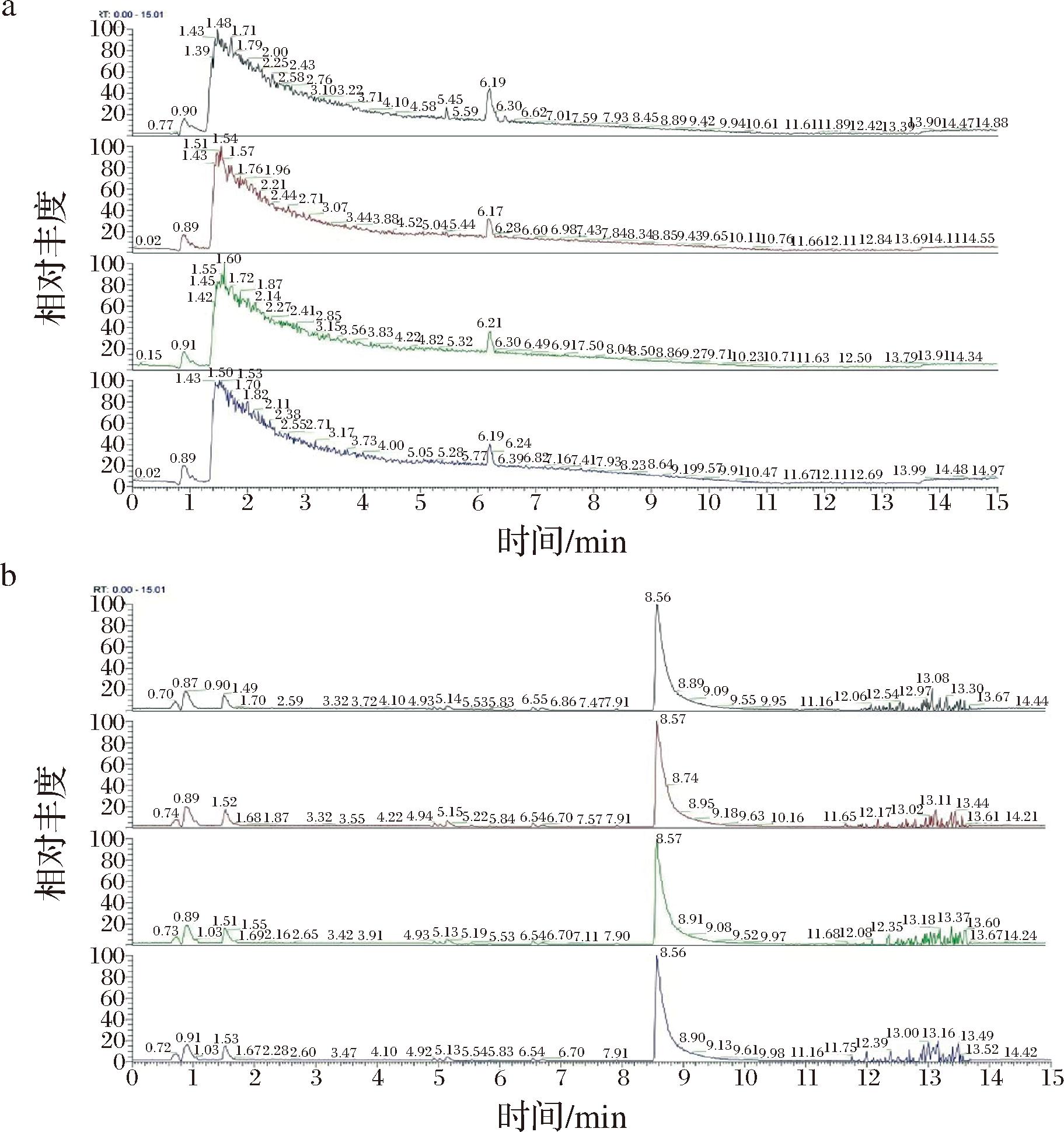
a-正离子模式图;b-负离子模式图
图1 QC样品离子模式Base Peak图
Fig.1 Base Peak diagram of ion mode of QC sample
REN Haijia,WU Haiyue,FU Shijun, et al.Analysis of metabolite differences in yak yogurt from different regions of Qinghai province based on non-targeted metabolomics[J].Food and Fermentation Industries,2025,51(14):35-47.
牦牛乳是青藏高原地区牧民的主要奶源[1],含有多种矿物质元素和人体必需氨基酸,同时含有较高的乳糖、蛋白质、脂肪和干物质[2],牦牛乳经发酵后,在保留牦牛乳原有的营养成分基础上,产生丰富的多种维生素,有更高的抗氧化能力[3],可进一步促进传统功能食品的利用发展。受地区地势海拔高、低温低压、强紫外等气候环境影响,青海地区传统牦牛酸奶制品含有丰富的微生物资源,保留着自然发酵产生的乳酸菌,该环境下的菌种多具备稳定的遗传基因和独特的生理机能,具有独特的风味及食疗功效[4-6],为人体提供了丰富的能量和营养。经研究发现,传统发酵牦牛酸奶不仅风味独特、营价值高,并且包含许多生物活性成分,能调节肠道微环境、降胆固醇、增强免疫力、抑制肿瘤活性等[7]。目前牦牛酸奶相关研究大多集中于乳酸菌菌株的分离、复合型酸奶工艺研究方面[8-10],对于牦牛酸奶成分组成以及代谢产物方面报道鲜少。
代谢组学对生物样本中所有代谢物在特定生理或病理状态下的代谢物同时进行定性和定量分析,以寻找出目标差异代谢物。其中非靶向代谢组学通过先进的分析技术和复杂的统计方法识别小分子代谢物,能够全面评估生物样本中的代谢物,并揭示相关代谢通路,而液相色谱-质谱联用技术(liquid chromatography-mass spectrometry,LC-MS)作为代谢组学研究中常用方法,通过高效液相色谱进行代谢物分离,然后使用高分辨率质谱进行代谢物检测,可适用于检测与分析样品中的难挥发或热稳定性差的代谢物,这对代谢生物学研究具有重要的意义[11-12]。
代谢组学在医学、药物开发、营养学、环境科学等领域有着广泛的应用,近年来也逐渐在现代食品领域应用,解决食品安全、质量和营养品质等问题。在食品发酵中,微生物通过代谢将底物转化为新产物,从而使发酵食品产生新的营养物质及独特的风味[13],同时产生的代谢物还可调节生物体的功能性质,抑制生物体内有害类物质产生。在发酵产物的应用中,LI等[14]利用非靶向代谢组学技术检测发酵干酪中特定代谢物和风味前体化合物,如有机酸、脂质、氨基酸等,郭永昊等[15]研究啤酒在发酵过程中代谢物成分变化,发现胆碱、甘油磷酸胆碱、三乙醇胺、磷脂酰乙醇胺影响啤酒风味;梁晓琳等[16]研究发现,传统发酵牦牛奶样品的微生物组成与代谢物之间有紧密联系。代谢组学是研究发酵食品中的有效工具,但目前对发酵牦牛乳制品中代谢产物与其品质方面研究报道鲜少,因此,利用代谢组学技术研究青海不同地区传统发酵酸奶制品的代谢差异机制,对提高传统发酵乳制品的品质和实现工业化生产提供理论依据。
乙腈、甲醇、甲酸,Millipore公司;氨水,Merck公司。
Q Exactive Plu质谱仪,Thermo Scientific公司;Nexera X2 2 LC-30AD超高压液相色谱仪,Shimadzu公司;ACQUITY UPLC® HSS T3色谱柱(2.1 mm×100 mm, 1.8 μm),Waters公司;Biorupt超声波系统,Diagenode公司;Concentrator plus真空离心浓缩仪、Centrifuge 5424离心机,Eppendorf公司。
1.3.1 代谢物提取
牦牛酸奶样品在4 ℃解冻,并取每份样品2 mL酸奶于15 mL EP管中,置于真空离心管中并用浓缩仪挥干。称取每份样品50 mg,加入2颗钢珠,并加400 μL预冷的甲醇-水(4∶1,体积比)溶液,使用组织破碎仪将样品和溶液混匀,再加入600 μL预冷的甲醇-水(4∶1,体积比)溶液,并继续混匀。然后在冰浴中超声20 min,并在-20 ℃下静置1 h。分离上清液和沉淀物。最后在4 ℃以16 000×g的离心力离心20 min,分离上清液和沉淀物,取上清液,使用高速真空浓缩离心机将其挥干。在质谱检测前,加入100 μL甲醇-水(1∶1,体积比)溶液复溶,在4 ℃以20 000×g的离心力离心15 min,取适量的上清液进行质谱分析。
1.3.2 LC-MS/MS分析
1.3.2.1 色谱分离
样品在4 ℃的自动进样器中进行,采用超高效液相的色谱系统(ultra-high performance liquid chromatography,UHPLC),样品进样量为4 μL,柱温为40 ℃,流速为0.3 mL/min;色谱流动相A:0.1%(体积分数)甲酸水溶液,B:乙腈。色谱梯度洗脱程序具体为:0~2 min:B相为0%,A维持在100%;2~6 min:B从0%线性增加至48%;6~10 min:B从48%线性增加至100%;10~12 min:B维持在100%;12~12.1 min:B从100%线性减少至0%;12.1~15 min:B维持在0%。
1.3.2.2 质谱采集
每份样品通过电喷雾电离(electrospray ionization,ESI)进行离子化,分别在正离子模式(+)和负离子模式(-)下进行检测。样品经过UPLC分离后,用QE Plus质谱仪进行质谱分析,其离子化条件为:Spray Voltage:3.8 kV(+)和 3.2 kV(-);Capillary Temperature:320(±);Sheath Gas:30(±);Aux Gas:5(±);Probe Heater Temp:350(±);S-Lens RF Level:50。
质谱采集设置如下:总的质谱采集时间为15 min。母离子扫描范围为75~1 050 m/z,一级质谱的分辨率为70 000(其为m/z 200处的分辨率),一级质谱的AGC target为3e6,一级质谱的Maximum IT为100 ms。二级质谱分析方法:每次全扫描后,触发采集10个最高强度母离子的二级质谱图谱(MS2 scan),二级质谱的分辨率为17 500(其为m/z 200处的分辨率),二级质谱的AGC target为1e5,二级质谱的Maximum IT为50 ms。使用HCD作为MS2的激活类型,Isolation window设置为2 m/z,normalized collision energy(Setpped) 使用20、30、40来激活。
采用MSDIAL软件对质谱数据进行峰对齐,对样品的保留时间进行校正,提取每个峰的面积,用于后续的定量分析;采用精确质量数匹配方式,代谢物结构鉴定采用精确质量数匹配方式(质量偏差<10 mg/L)和二级谱图匹配方式(质量偏差<0.01 Da),数据库检索采用HMDB、MassBank、GNPS等公共数据库及拜谱代谢物标准品库(byspectrum metabolite standard library,BP-DB)以辅助代谢物的鉴定。对提取到的数据,删除组内缺失值>50%的离子峰,不参与后续的统计分析;对正负离子数据分别进行总峰面积归一化,消除样品量和仪器响应差异;整合正负离子峰并应用Python软件进行模式识别分析,数据经UV预处理进行后续分析。利用主成分分析法(principal component analysis,PCA)、正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)、人类代谢数据库(human metabolome database,HMDB)化合物分类、火山图、聚类热图、Venn图等对代谢组数据进行差异分析,使用KEGG数据库(http://www.kegg.jp)对差异代谢物数据进行KEGG途径分析。
对QC样本正、负离子检测模式下的质谱总离子流图进行比较,如图1所示,果洛地区样品(G,红)、玉树地区样品(Y,绿)、海北地区样品(B,蓝)、海南地区样品(N,紫),通过MSDIAL软件提取代谢物的离子峰,在正、负离子模式下共采集到的离子峰数目为27 860。结果表明,各地区样品色谱峰的响应强度和保留时间基本一致,即整个试验过程中仪器误差引起的变异较小,所以本试验数据质量可靠。并对提取得到的峰经过UV预处理后,进行PCA,经过7次循环交互验证得样本的PCA得分图如图2所示,其QC样本较为紧密地聚集在一起,表明本试验的重复性良好,因此本试验较为可行。对QC样本进行Pearson相关性分析,当相关系数越接近于1,则试验数据质量越高,由图3可知,QC样品相关系数均大于0.96,表明样本间相关性较好,所以本试验整个方法稳定性好,数据质量较高。

a-正离子模式图;b-负离子模式图
图1 QC样品离子模式Base Peak图
Fig.1 Base Peak diagram of ion mode of QC sample
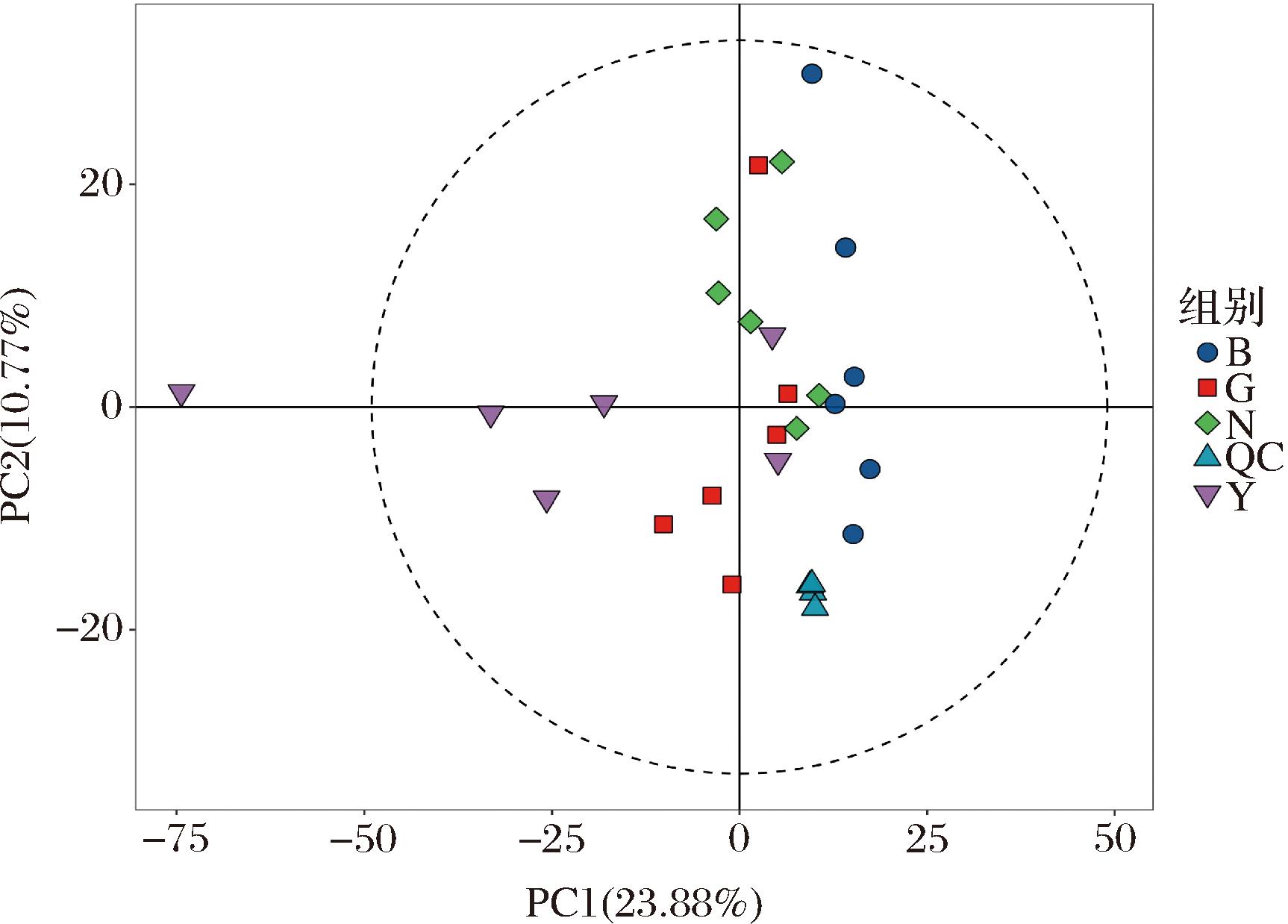
图2 QC样本的PCA得分图
Fig.2 PCA score chart of QC sample
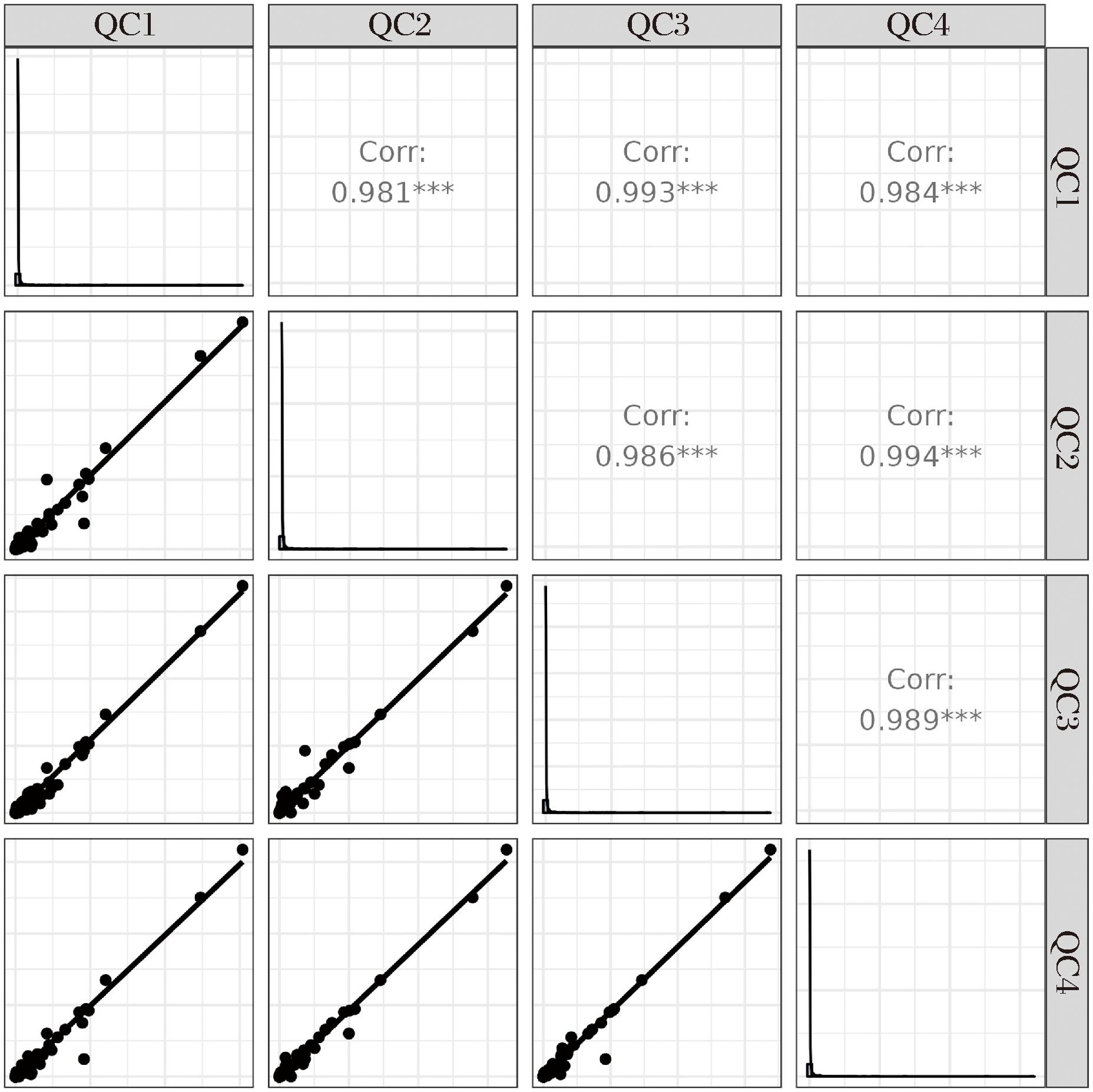
图3 不同地区牦牛酸奶合并正负离子模式QC样品相关性分析
Fig.3 Correlation analysis of QC samples combined with positive and negative ion modes of yak yogurt from different regions
PCA可判断不同地区牦牛酸奶的代谢物之间是否具有差异,对试验的系统稳定性进行评价与分析,由图4可知,横坐标为排名第一主成分得分,纵坐标为排名第二的主成分得分,发现4个地区酸奶存在明显交互现象,不同地区间样品代谢物分离程度不明显,因此需进一步采用OPLS-DA,寻找更有效的分析模型研究不同地区酸奶代谢物间的差异。
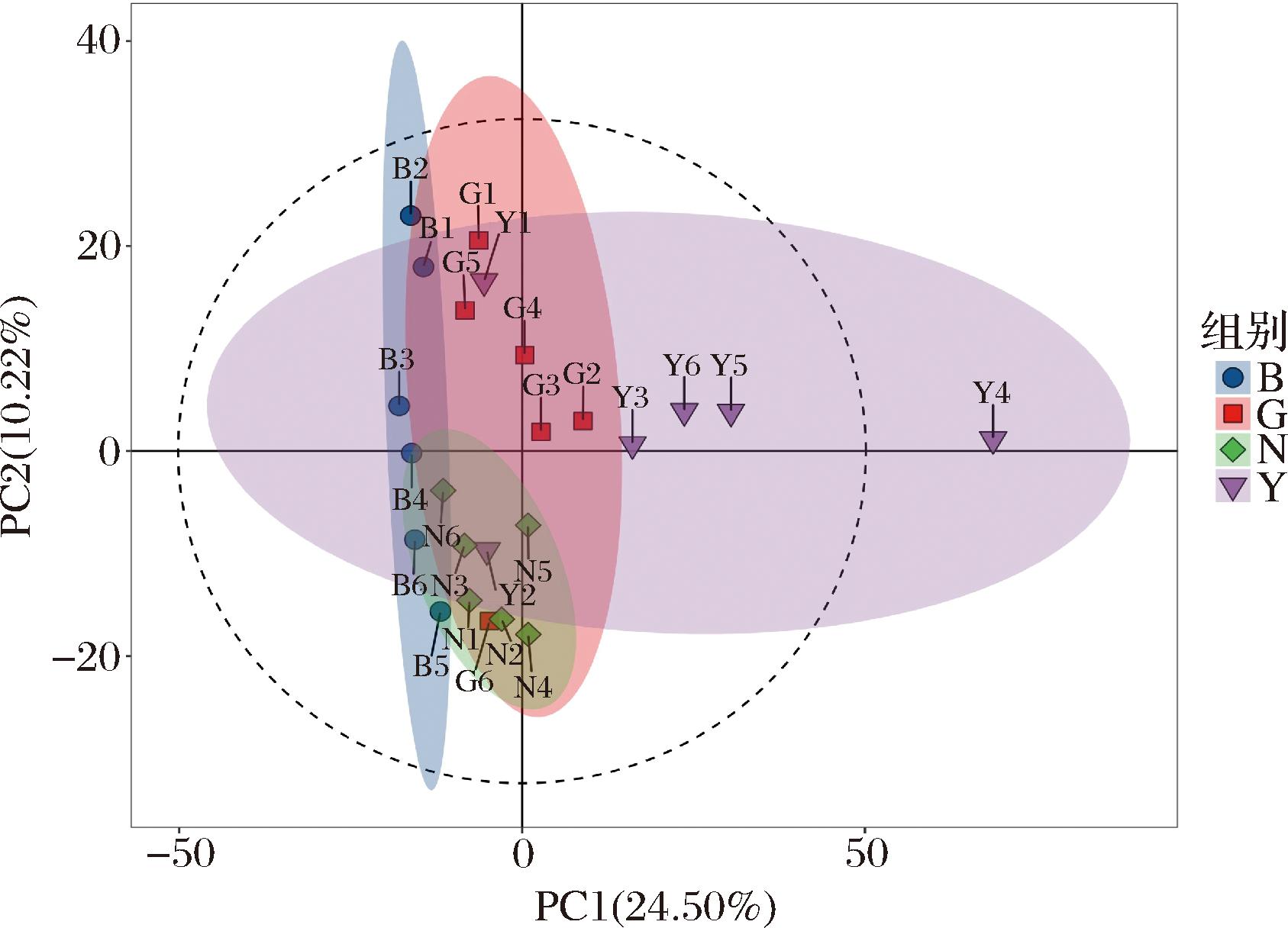
图4 Y、G、N和B地区的PCA第一、二主成分散点图
Fig.4 Scatterplot of first and second principal components of PCA in Y, G, N, and B regions
如图5-a所示,4个地区酸奶样品的横坐标相距较远,表明4个地区样本组间差距明显,无交互现象;纵坐标B/G/N地区牦牛酸奶样品,同组内样品相距较近,说明这3组牦牛酸奶样品的同组内差异小,Y地区牦牛酸奶样品的组内相距较远,说明组内差异较大;同时由图5-b可知,R2≥0.5,说明模型预测能力较好,Q2拟合线的截距斜率小于零,表明模型模不存在过拟合,试验可靠性较高。

a-OPLS-DA得分图;b-OPLS-DA置换检验图
图5 Y、G、N和B地区的OPLS-DA得分图和置换检验图
Fig.5 OPLS-DA score chart for Y, G, N, and B regions and permutation test diagram
综上所述,由分析仪器稳定性较好,试验数据重复性良好,试验方法稳定、数据质量较高,可判断4组牦牛酸奶样品存在代谢差异,在试验中获得的代谢质谱差异能反映样本间本身的生物学差异。
青海4个不同地区牦牛酸奶中的差异代谢物,采用单因素方差检验方法分析代谢物在多组中的显著性,以变量投影重要性(variable importance in projection, VIP)值>1为筛选标准,初步筛选出各组间的差异代谢物,进一步采用单变量统计分析,即FC(Fold Change)≥1.5或FC≤1/1.5,且P<0.05作为筛选标准,验证差异代谢物具有显著性。因此,通过OPLS-DA分析,以VIP>1且P<0.05为筛选标准,筛选显著性差异代谢物。从青海4个地区牦牛酸奶中共检测出1 500个差异代谢物,4个地区共有显著差异代谢物为325个。
火山图显示了不同地区牦牛酸奶代谢物差异水平,如图6所示,红色表示上调,蓝色表示下调。图6-a比较组中显著差异代谢物339个,上调82个,下调257个;图6-b比较组中显著差异代谢物210个,上调116个,下调94个;图6-c比较组中显著差异代谢物316个,上调77个,下调239个;图6-d比较组中显著差异代谢物426个,上调188个,下调238个;图6-e比较组中显著差异代谢物158个,上调89个,下调69个;图6-f比较组中显著差异代谢物237个,上调146个,下调91个。由此可见,Y/B地区的差异代谢物组间差异最大,共有426个差异代谢物,可能是因为玉树(Y)和海北(B)地区海拔等地理环境差异最大,导致所在地区牦牛酸奶菌种或者牦牛乳存在较大差异,存在生物差异性。
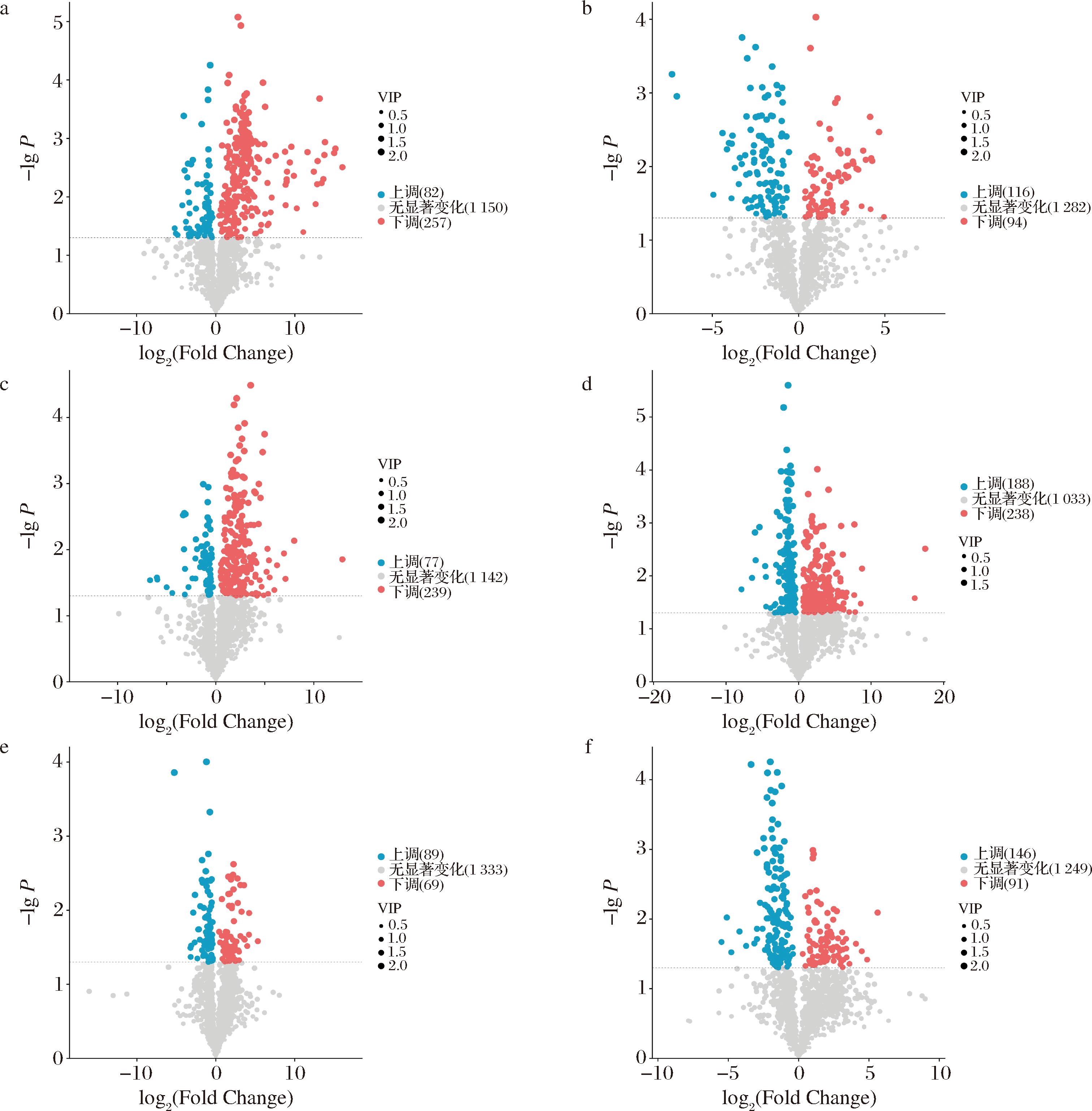
a-G/B火山图;b-G/N火山图;c-N/B火山图;d-Y/B火山图;e-Y/G火山图;f-Y/N火山图
图6 两组比较显著差异代谢物火山图
Fig.6 Volcano plots for metabolites with significant differences between the two groups
为研究不同地区牦牛酸奶差异代谢物的相对含量变化趋势,对其相对含量进行K-means分析。每个聚类群组横坐标为不同组别,纵坐标为相对表达量,黑色线条表示该聚类群组中所有蛋白的表达量平均值在不同组中的变化趋势。
如图7所示,聚类群组1组中,31个代谢物在Y地区中的含量最多,其次为N地区含量较高,B地区含量最低;聚类群组2组中,67个代谢物Y地区含量最多,其余由高到低为G、N、B地区;聚类群组3组20个代谢物,N地区含量最多,其次为Y地区含量较多,G和B地区含量较少;聚类群组4组22个代谢物含量由高到低依次为Y、G、N、B地区;聚类群组5组中,65个代谢物在Y地区含量最高,G、N和B地区含量较少;聚类群组6组中,120个代谢物在B地区含量最高,其余由高到低依次为N、G、Y地区。
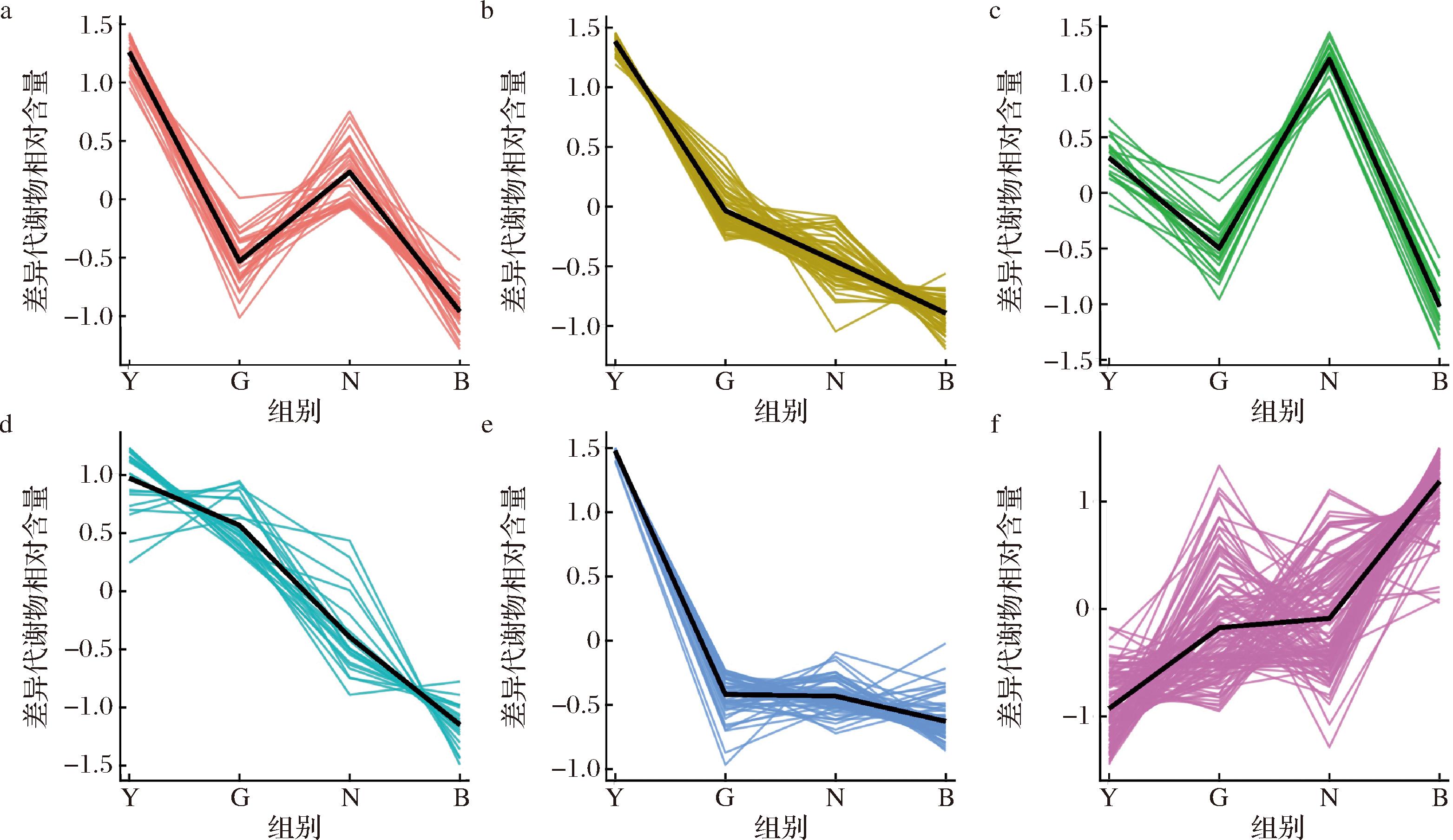
a-聚类群组1(n=31);b-聚类群组2(n=67);c-聚类群组3(n=20);d-聚类群组4(n=2);e-聚类群组5(n=65);f-聚类群组6(n=120)
图7 Y、G、N和B地区差异代谢物的K-means分析
Fig.7 K-means analysis of differential metabolites in Y, G, N, and B regions
从青海4个不同地区牦牛酸奶中共检测出的显著差异代谢物为325个,不同颜色表示一级分类,面积越大表示该分类的差异代谢物数量越多,这些代谢物的具体分类信息如图8-a所示,其代谢物质信息在HMDB顶级分类上占比前3的物质为:脂类和类脂分子(25.08%)、有机酸及其衍生物(22.26%)、有机杂环化合物(20.06%),这三者占总显著差异代谢物的67.40%;图8-b,在HMDB分类上占比前5的物质为:其他(27.67%)、羧酸及其衍生物(19.5%)、肾上腺素脂类(9.12%)、苯及取代衍生物(7.86%)、有机氧化合物(7.55%),占总显著差异代谢物的63.84%。图8-c中,Ontology代谢物分类信息中占比分别为:其他(68.21%)、肽类化合物(8.64%)、氨基酸及其衍生物(5.86%)、羧酸及其衍生物(2.78%),糖基化合物、有机氧化合物、脂肪酸、三萜苷类均为1.54%,酮类化合物、有机氮化合物、苯甲酰胺、倍半萜内酯、类固醇皂甙、三萜类化合物均为1.23%。
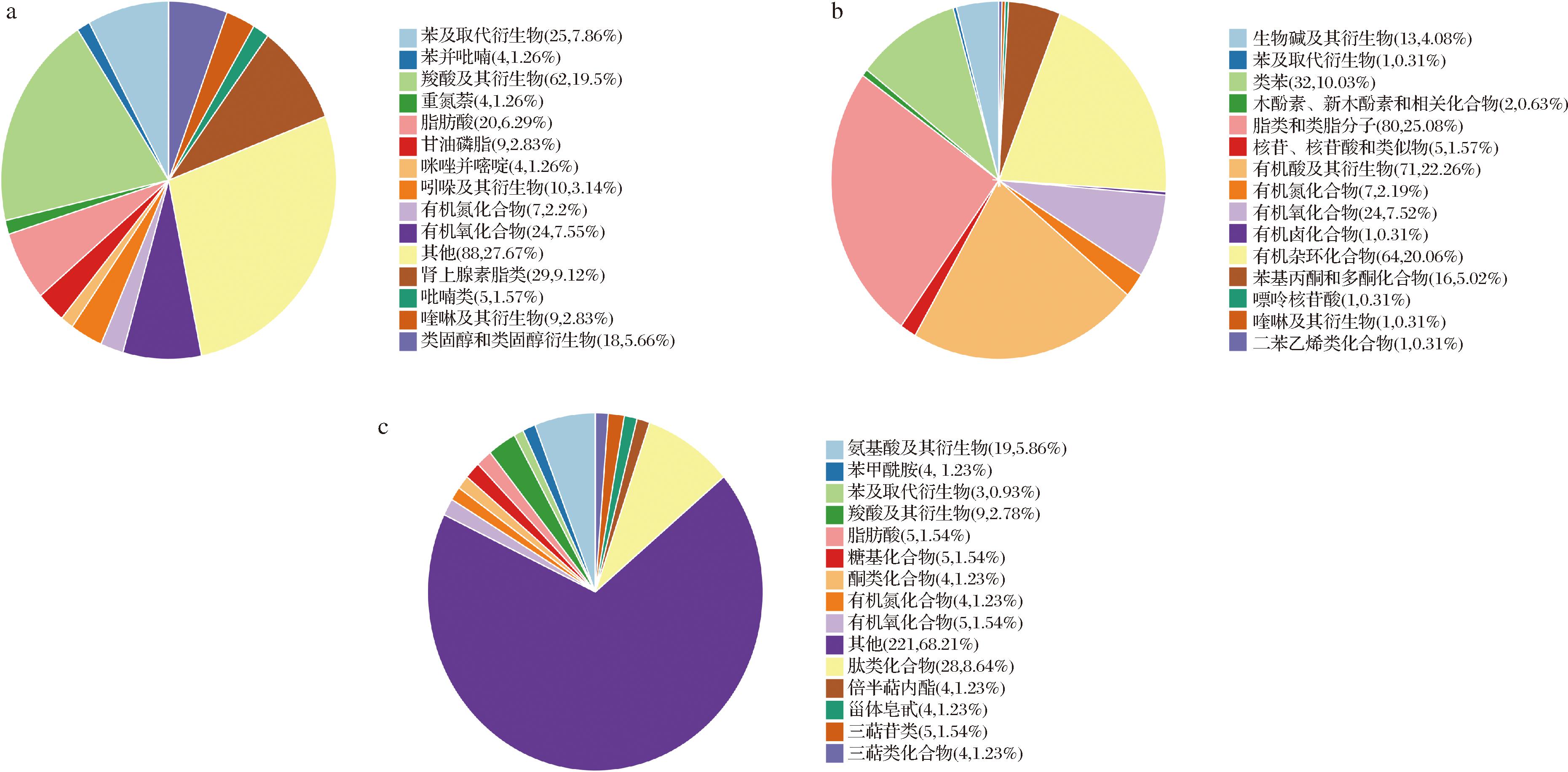
a-HMDB顶级分类;b-HMDB分类;c-Ontology分类
图8 Y、G、N和B地区差异代谢物分类
Fig.8 Classification for differential metabolites in Y, G, N, and B regions
聚类热图可直观反映多种代谢物在青海不同地区牦牛酸奶中相对表达量聚类关系的作用,如图9所示,根据VIP值,对4个地区牦牛酸奶的差异代谢物选取前50个进行层次聚类分析,颜色越红表示代谢物相对表达量越高,越蓝表示代谢物相对表达量越低。由图9和表1中显示的Ontology代谢物分类信息可知,G地区中甘油磷酸胆碱等脂类和类脂分子的代谢物相对含量较多,Y地区中,黄酮糖苷、LPI(19∶0)等脂类和类脂分子,缬氨酸等有机酸及其衍生物,N-(3-氯苯基)-2-[2-氧代-4-(吡咯烷基羰基)氢醌基]乙酰胺等有机杂环化合物的代谢物相对含量较多。B地区,谷氨酰胺、全氟烷基硫酸盐等的有机酸及其衍生物,呋喃酮A、3-羟基-2-喹喔啉羧酸等有机杂环化合物,5β-胆酸、SM(d18∶1/22∶1)、PI(17∶0/16∶1)、3-[(2-乙酰氨基-2-脱氧己吡喃糖基)氧基]-16-羟基油菜素-12-烯-28-酸等脂类和类脂分子的代谢物含量较多,以及阿洛酮糖等有机氧化合物,2-氨基-1-丁醇等有机氮化合物,(E)-3-(4-甲氧基苯基)-1-[2,4,6-三甲氧基-3-(3-甲基丁烷-2-烯烃)苯]丙-2-烯-1-酮(属3-丙烯酰化查尔酮)等苯基丙酮和多酮类化合物的代谢物也比较多。

图9 代谢差异物聚类热图
Fig.9 Clustering heat map of differential metabolites
注:差异显著性为:*P<0.05;**P<0.01;***P<0.001;sn-glycerol-3-phosphoethanolamine:甘油-3-磷酸乙醇胺;glycerophosphocholine:甘油磷酸胆碱; 2,2,6,6-tetramethylpiperidin-1-ol:2,2,6,6-四甲基-1-哌啶醇; 4-hydroxybenzoic acid:4-羟基苯甲酸;5beta-cholanic acid:5beta-胆酸;5,6-dibenzoyloxy-7-methyl-1-[3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-1,4a,5,6,7,7a-hexahydrocyclopenta[c]pyran-4-carboxylic acid:5,6-二苯甲酰氧基-7-甲基-1-[3,4,5-三羟基-6-(羟甲基)氧杂戊环-2-基]氧基-1,4a,5,6,7,7a-六氢环戊并[c]吡喃-4-羧酸; (2E,4E,14E)-13-hydroperoxy-1-piperidin-1-ylicosa-2,4,14-trien-1-one:(2E,4E,14E)-13-过氧化氢-1-哌啶酮-1-烯-2,4,14-铜-1-1; adipic acid:己二酸;4-hydroxybenzoylcholine:基苯甲酰基胆碱;kojic acid:羟曲酸;-N-(3-methoxybenzyl)octadeca-9,12-dienamide:-N-(3-甲氧基苄基)十八碳-9,12-二烯酰胺;ethyl 2-[(4-methoxy-3-nitrophenyl)carbonylamino]acetate:[1-(7-羟基-2,4b,8,8-四甲基l-4,4a,5,6,7,8a,9,10-八氢菲)-2-[3,4,5-三羟基-6-(羟甲基)氧杂环己烷-2-酰]氧乙基]乙酸酯; dioctyl phthalate:邻苯二甲酸二辛酯;furanone A:呋喃酮 A; 8,11,14-anacardic acid:8,11,14-二十二酸;OPFC-perfluoroalkyl_sulfate:OPFC-全氟烷基硫酸盐;chlorodifluoroacetic acid:二氟氯乙酸;3,3,3-trifluoro-1-propanol:3,3,3-三氟-1-丙醇;anisic acid:苯甲酸;(E)-3-(4-methoxyphenyl)-1-[2,4,6-trimethoxy-3-(3-methylbut-2-enyl)phenyl]prop-2-en-1-one:(E)-3-(4-甲氧基苯基)-1-[2,4,6-三甲氧基-3-(3-甲基丁烷-2-烯烃) 苯] 丙-2-烯-1-酮; 3-hydroxy-2-quinoxalinecarboxylic acid:3-羟基-2-喹喔啉羧酸;glutamine:谷氨酰胺;psicose:阿洛酮糖;3-[(2-acetamido-2-deoxyhexopyranosyl)oxy]-16-hydroxyolean-12-en-28-oic acid:3-[(2-乙酰氨基-2-脱氧己吡喃糖基)氧基]-16-羟基油菜素-12-烯-28-酸;2-aminobutan-1-ol:2-氨基-1-丁醇; carveol:香芹醇; rhodiooctanoside:红豆辛糖苷; dihydrosphingosine:二氢新肌苷; glutamyllysine:谷氨酰赖氨酸;methyl 3,5-hydroxybenzoate:3,5-羟基苯甲酸甲酯;(3S,5R,8R,10R,13R,14S,17R)-3-[5-[(2S,3R,4R,5S,6R)-3,4-dihydroxy-6-(hydroxymethyl)-5-[(2S,3R,4S,5S,6R)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-4-methoxy-6-methyloxan-2-yl]oxy-14-hydroxy-13-methyl-17-(5-oxo-2H-furan-3-yl)-1,2,3,4,5,6,7,8,9,11,12,15,16,17-tetradecahydrocyclopenta[a]phenanthrene-10-carbaldehyde:(3S,5R,8R,10R,13R,14S,17R)-3-[5-[(2S,3R,4R,5S,6R)-3,4-二羟基-6-(羟甲基)-5-[(2S,3R,4S,5S,6R)-3,4,5-三羟基-6-(羟甲基)氧杂蒽-2-基]氧杂蒽-2-基]氧-4-甲氧基-6-甲基环氧乙烷-2-基]氧基-14-羟基-13-甲基-17-(5-氧代-2H-呋喃-3-基)-1,2,3,4,5,6,7,8,9,11,12,15,16,17-十四氢环戊并[a]菲-10-甲醛;(3-chloro-4-methylphenyl)[2-(ethylpropyl)quinazolin-4-yl]amine:(3-氯-4-甲基苯基)[2-(乙基丙基)喹唑啉-4-基]胺; N-(3-chlorophenyl)-2-[2-oxo-4-(pyrrolidinylcarbonyl)hydroquinolyl]acetamide:N-(3-氯苯基)-2-[2-氧代-4-(吡咯烷基羰基)氢醌基]乙酰胺;beta-D-glucopyranoside,5-(4-hydroxyphenyl)-1-[2-(4-hydroxyphenyl)ethyl]pentyl 6-O-(6-deoxy-alpha-L-mannopyranosyl):beta-D-吡喃葡萄糖苷,5-(4-羟基苯基)-1-[2-(4-羟基苯基)乙基]戊基 6-O-(6-脱氧-alpha-L-吡喃甘露糖基); spermine:精胺; cyclopenta[c]pyran-4-carboxylic acid, 1-(beta-D-glucopyranosyloxy)-1,4a,5,7a-tetrahydro-7-[[[(2E)-1-oxo-3-phenyl-2-propen-1-yl]oxy]methyl]-, (1S,4aS,7aS):环戊并[c]吡喃-4-羧酸,1-(beta-D-吡喃葡萄糖氧基)-1,4a,5,7a-四氢-7-[[[(2E)-1-氧代-3-苯基-2-丙烯-1-基]氧基]甲基]-,(1S,4aS,7aS); 4-[(E)-3-[(2R,3R,4S,5S,6R)-3-[(2S,3R,4R)-3,4-dihydroxy-4-(hydroxymethyl)oxolan-2-yl]oxy-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxybut-1-enyl]-3,5,5-trimethylcyclohex-2-en-1-one:4-[(E)-3-[(2R,3R,4S,5S,6R)-3-[(2S,3R,4R)-3,4-二羟基-4-(羟甲基)氧杂环戊烷2-基]氧基-4,5-二羟基-6-(羟甲基)氧杂-2-基]氧杂丁-1-烯基]-3,5,5-三甲基环己-2-烯-1-酮: 1; (Z)-5-[(1S,2R,4aR,8aR)-5-(hydroxymethyl)-1,2,4a-trimethyl-2,3,4,7,8,8a-hexahydronaphthalen-1-yl]-3-(hydroxymethyl)pent-2-enoic acid:(Z)-5-[(1S,2R,4aR,8aR)-5-(羟甲基)-1,2,4a-三甲基-2,3,4,7,8,8a-六氢萘-1-基]-3-(羟甲基)戊-2-烯酸;(Z)-5-[(1S,2R,4aR,8aR)-5-(hydroxymethyl)-1,2,4a-trimethyl-2,3,4,7,8,8a-hexahydronaphthalen-1-yl]-3-(hydroxymethyl)pent-2-enoic acid:(Z)-5-[(1S,2R,4aR,8aR)-5-(羟甲基)-1,2,4a-三甲基-2,3,4,7,8,8a-六氢萘-1-基]-3-(羟甲基)戊-2-烯酸; [1-(7-hydroxy-2,4b,8,8-tetramethyl-4,4a,5,6,7,8a,9,10-octahydro-3H-phenanthren-2-Yl)-2-[3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-Yl]oxyethyl] acetate:[1-(7-羟基-2,4b,8,8-四甲基l-4,4a,5,6,7,8a,9,10-八氢菲)-2-[3,4,5-三羟基-6-(羟甲基)氧杂环己烷-2-酰] 氧乙基] 乙酸酯; valylarginine:缬氨酰精氨酸;mupirocin:莫匹罗星;ergocornine:麦角新碱;peloruside A:佩鲁西甙 A; acanthospermolide:刺桐内酯;prolylleucine:丙烯亮氨酸。
表1 青海4地区的显著差异代谢物
Table 1 Significantly different metabolites in four regions of Qinghai province
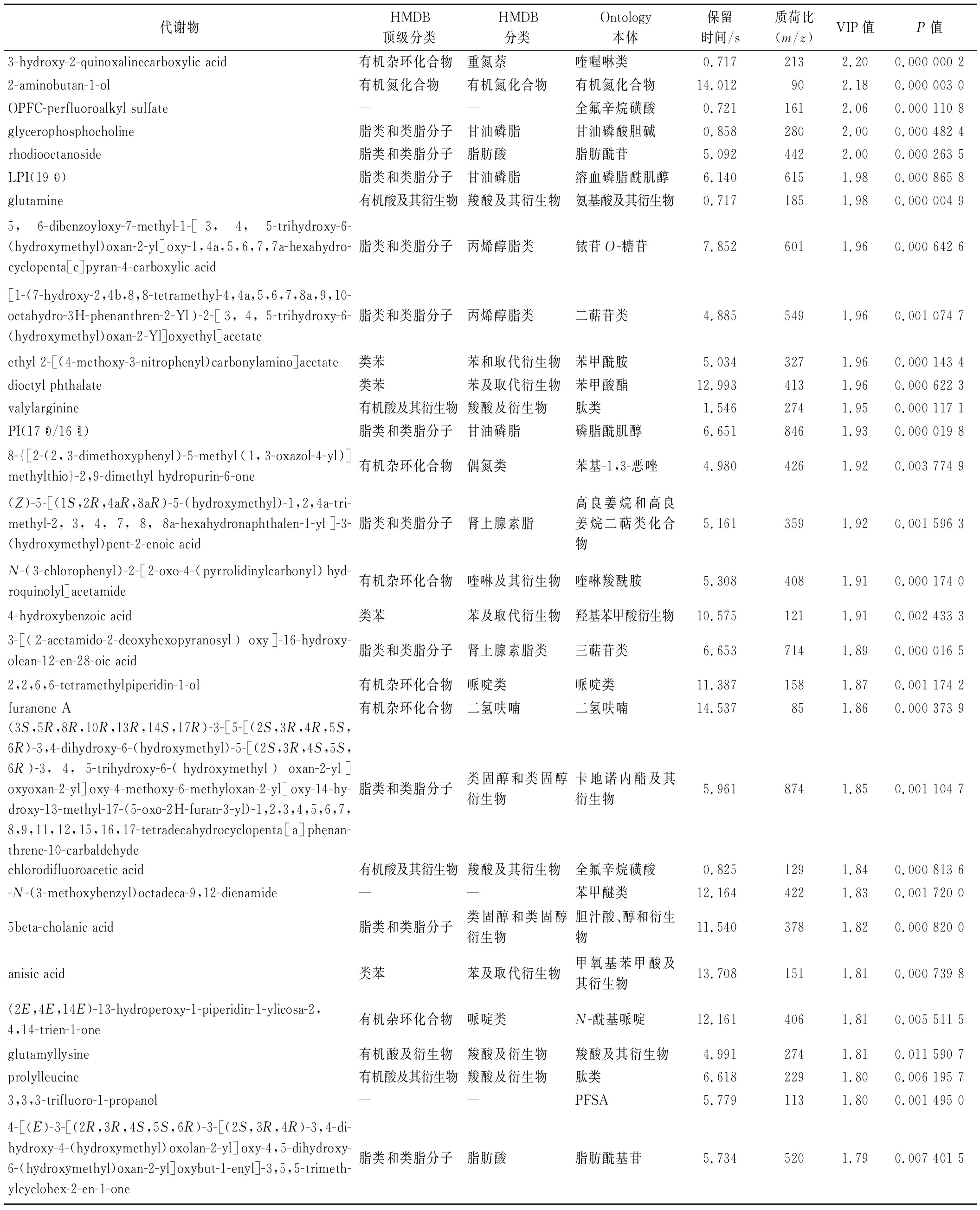
代谢物HMDB顶级分类HMDB分类Ontology本体保留时间/s质荷比(m/z)VIP值P值3-hydroxy-2-quinoxalinecarboxylic acid有机杂环化合物重氮萘喹喔啉类0.717 213 2.20 0.000 000 2 2-aminobutan-1-ol有机氮化合物有机氮化合物有机氮化合物14.012 90 2.18 0.000 003 0 OPFC-perfluoroalkyl sulfate——全氟辛烷磺酸0.721 161 2.06 0.000 110 8 glycerophosphocholine脂类和类脂分子甘油磷脂甘油磷酸胆碱0.858 280 2.00 0.000 482 4 rhodiooctanoside脂类和类脂分子脂肪酸脂肪酰苷5.092 442 2.00 0.000 263 5 LPI(19∶0)脂类和类脂分子甘油磷脂溶血磷脂酰肌醇6.140 615 1.98 0.000 865 8 glutamine有机酸及其衍生物羧酸及其衍生物氨基酸及其衍生物0.717 185 1.98 0.000 004 9 5,6-dibenzoyloxy-7-methyl-1-[3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-1,4a,5,6,7,7a-hexahydro-cyclopenta[c]pyran-4-carboxylic acid脂类和类脂分子丙烯醇脂类铱苷O-糖苷7.852 601 1.96 0.000 642 6 [1-(7-hydroxy-2,4b,8,8-tetramethyl-4,4a,5,6,7,8a,9,10-octahydro-3H-phenanthren-2-Yl)-2-[3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-Yl]oxyethyl]acetate脂类和类脂分子丙烯醇脂类二萜苷类4.885 549 1.96 0.001 074 7 ethyl 2-[(4-methoxy-3-nitrophenyl)carbonylamino]acetate类苯苯和取代衍生物苯甲酰胺5.034 327 1.96 0.000 143 4dioctyl phthalate类苯苯及取代衍生物苯甲酸酯12.993 413 1.96 0.000 622 3 valylarginine有机酸及其衍生物羧酸及衍生物肽类1.546 274 1.95 0.000 117 1 PI(17∶0/16∶1)脂类和类脂分子甘油磷脂磷脂酰肌醇6.651 846 1.93 0.000 019 8 8-{[2-(2,3-dimethoxyphenyl)-5-methyl(1,3-oxazol-4-yl)]methylthio}-2,9-dimethyl hydropurin-6-one有机杂环化合物偶氮类苯基-1,3-恶唑4.980 426 1.92 0.003 774 9 (Z)-5-[(1S,2R,4aR,8aR)-5-(hydroxymethyl)-1,2,4a-tri-methyl-2,3,4,7,8,8a-hexahydronaphthalen-1-yl]-3-(hydroxymethyl)pent-2-enoic acid脂类和类脂分子肾上腺素脂高良姜烷和高良姜烷二萜类化合物5.161 359 1.92 0.001 596 3 N-(3-chlorophenyl)-2-[2-oxo-4-(pyrrolidinylcarbonyl)hyd-roquinolyl]acetamide有机杂环化合物喹啉及其衍生物喹啉羧酰胺5.308 408 1.91 0.000 174 0 4-hydroxybenzoic acid类苯苯及取代衍生物羟基苯甲酸衍生物10.575 121 1.91 0.002 433 3 3-[(2-acetamido-2-deoxyhexopyranosyl)oxy]-16-hydroxy-olean-12-en-28-oic acid脂类和类脂分子肾上腺素脂类三萜苷类6.653 714 1.89 0.000 016 5 2,2,6,6-tetramethylpiperidin-1-ol有机杂环化合物哌啶类哌啶类11.387 158 1.87 0.001 174 2 furanone A有机杂环化合物二氢呋喃二氢呋喃14.537 85 1.86 0.000 373 9 (3S,5R,8R,10R,13R,14S,17R)-3-[5-[(2S,3R,4R,5S,6R)-3,4-dihydroxy-6-(hydroxymethyl)-5-[(2S,3R,4S,5S,6R)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-4-methoxy-6-methyloxan-2-yl]oxy-14-hy-droxy-13-methyl-17-(5-oxo-2H-furan-3-yl)-1,2,3,4,5,6,7,8,9,11,12,15,16,17-tetradecahydrocyclopenta[a]phenan-threne-10-carbaldehyde脂类和类脂分子类固醇和类固醇衍生物卡地诺内酯及其衍生物5.961 874 1.85 0.001 104 7 chlorodifluoroacetic acid有机酸及其衍生物羧酸及其衍生物全氟辛烷磺酸0.825 129 1.84 0.000 813 6 -N-(3-methoxybenzyl)octadeca-9,12-dienamide——苯甲醚类12.164 422 1.83 0.001 720 0 5beta-cholanic acid脂类和类脂分子类固醇和类固醇衍生物胆汁酸、醇和衍生物11.540 378 1.82 0.000 820 0 anisic acid类苯苯及取代衍生物甲氧基苯甲酸及其衍生物13.708 151 1.81 0.000 739 8 (2E,4E,14E)-13-hydroperoxy-1-piperidin-1-ylicosa-2,4,14-trien-1-one有机杂环化合物哌啶类N-酰基哌啶12.161 406 1.81 0.005 511 5 glutamyllysine有机酸及衍生物羧酸及衍生物羧酸及其衍生物4.991 274 1.81 0.011 590 7 prolylleucine有机酸及其衍生物羧酸及衍生物肽类6.618 229 1.80 0.006 195 7 3,3,3-trifluoro-1-propanol——PFSA5.779 113 1.80 0.001 495 0 4-[(E)-3-[(2R,3R,4S,5S,6R)-3-[(2S,3R,4R)-3,4-di-hydroxy-4-(hydroxymethyl)oxolan-2-yl]oxy-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxybut-1-enyl]-3,5,5-trimeth-ylcyclohex-2-en-1-one脂类和类脂分子脂肪酸脂肪酰基苷5.734 520 1.79 0.007 401 5
注:由于代谢物数量过多,仅选择VIP值排在前30个的代谢物进行展示;—表示无相关资料。
脂质又被称为脂类,是脂肪酸和醇作用生成的酯及其衍生物的总称[17],是各种代谢产物不可缺少的成分,在许多生物过程中起着关键作用。乳脂肪中含有磷脂、固醇类物质以及游离脂肪酸等[18-19],其中脂肪酸水解和微生物代谢产生的脂[20],对酸奶的风味具有一定影响。CHRISTIE等[21]发现在不同乳制品中磷脂的相对组成差异很小,但绝对含量明显不同,且磷脂在发酵过程中会自动氧化;YANG等[22]研究海拔对牦牛奶制品的影响,发现甘油磷脂代谢与海拔的相关性最为显著,高海拔地区甘油磷脂含量普遍偏高。而黄酮糖苷也属于脂类和类脂分子,在人体内生物利用度低,但乳酸菌发酵法可使黄酮类化合物结构和组分发生改变,由糖苷转变为苷元形式[23],且在肠道菌群的作用下,黄酮苷也能通过微生物转化生成黄酮苷元,被人体胃肠道直接吸收利用[24]。
有机酸是一类来源丰富且安全的天然物质,在谷物及药食同源食品中有机酸含量较高[25],有助于增加乳制品的风味和香味,在发酵乳制品中,乳酸菌产生的pH值和有机酸类可有效抑制不良微生物[26-28],避免发酵乳制品中病原微生物的生长,维持发酵食品的质量稳定和食品安全性。缬氨酸属于有机酸及其衍生物,是支链氨基酸的一种,其作用为保护肝脏,促进肌肉蛋白的合成,缬氨酸主要通过发酵产生[29],当乳制品发酵,乳酸积累到一定量时,会抑制糖类相关酶,同时激发氨基酸相关酶参与到乳酸菌能量的供应过程,导致天冬氨酸、精氨酸及缬氨酸的含量均降低[11],因此,缬氨酸的变化可调控酸奶发酵时pH值的变化,影响酸奶品质变化。同属于有机酸及其衍生物的谷氨酰胺转氨酶,它能催化谷氨酰胺上的γ-酰基与赖氨酸上的ε-氨基发生结合反应[30],从而实现蛋白质分子内、分子间的交联,能在不改变食品pH、感官和风味的前提下,形成稳定的网状结构,从而达到改善食品蛋白质的稳定性、乳化性和持水性能等效果[31-32],因此多应用于乳制品等蛋白制品的质构改良[30]。
呋喃类属于有机杂环化合物,其化合物的形成主要是牛乳中的糖和氨基酸发生美拉德反应[33],是酸奶重要的风味物质。呋喃酮,广泛分布在自然界生物中,是草莓特征芳香物质组分[34-35],类似果香和花香的味道,在食品中有助于增强食品的风味,提升酸奶食品的品质。而酸奶中酮类物质大多是由不饱和脂肪酸或氨基酸的氧化、降解或乳酸菌的代谢所产生的[36]。
采用Pearson相关性法,以VIP值选取前10的差异代谢物,分析显著差异代谢物之间的相关系数,如图10所示,差异代谢物之间的相关系数(R)为-1~1,R>0表示正相关,以红色来表示;R<0表示负相关,以蓝色来表示。其中,谷氨酰胺、5,6-二苯甲酰氧基-7-甲基-1-[3…](POS14223)与3-羟基-2-喹喔啉羧酸间呈正相关,甘油磷酸胆碱与全氟烷基硫酸盐呈正相关,且几者之间相关性较强;而代谢物[1-(7-羟基-2,4b,8,8…](POS13171))乙酸酯与LPI(19∶0)呈较强正相关,同时与甘油磷酸胆碱呈较强负相关性,说明两者存在竞争抑制关系,而LPI(19∶0)和甘油磷酸胆碱均属脂类和类脂分子。

图10 Y/G/N/B地区相关系数矩阵热图
Fig.10 Heat map of the matrix of correlation coefficients for Y, G, N, and B regions
2.9.1 显著通路气泡图
图11展示了显著性top30的通路,每类中的通路从上至下-lg P依次降低,因此,当P值依次升高,显著性依次降低,而圆圈大小表示富集到该通路中的差异代谢物数量,圆圈颜色对应校正后的P值,由蓝到红越显著。对4个地区酸奶差异代谢物进行KEGG通路富集分析,共有186条代谢途径,以校正后P值为参考,选取前30个代谢物进行富集通路分析,其共分布在五大类中,分别为生物体系统(organismal systems,O)、代谢(metabolism,M)、人类疾病(human diseases,H)、环境信息处理(environmental information processing,E)、细胞过程(cellular processes,C)。
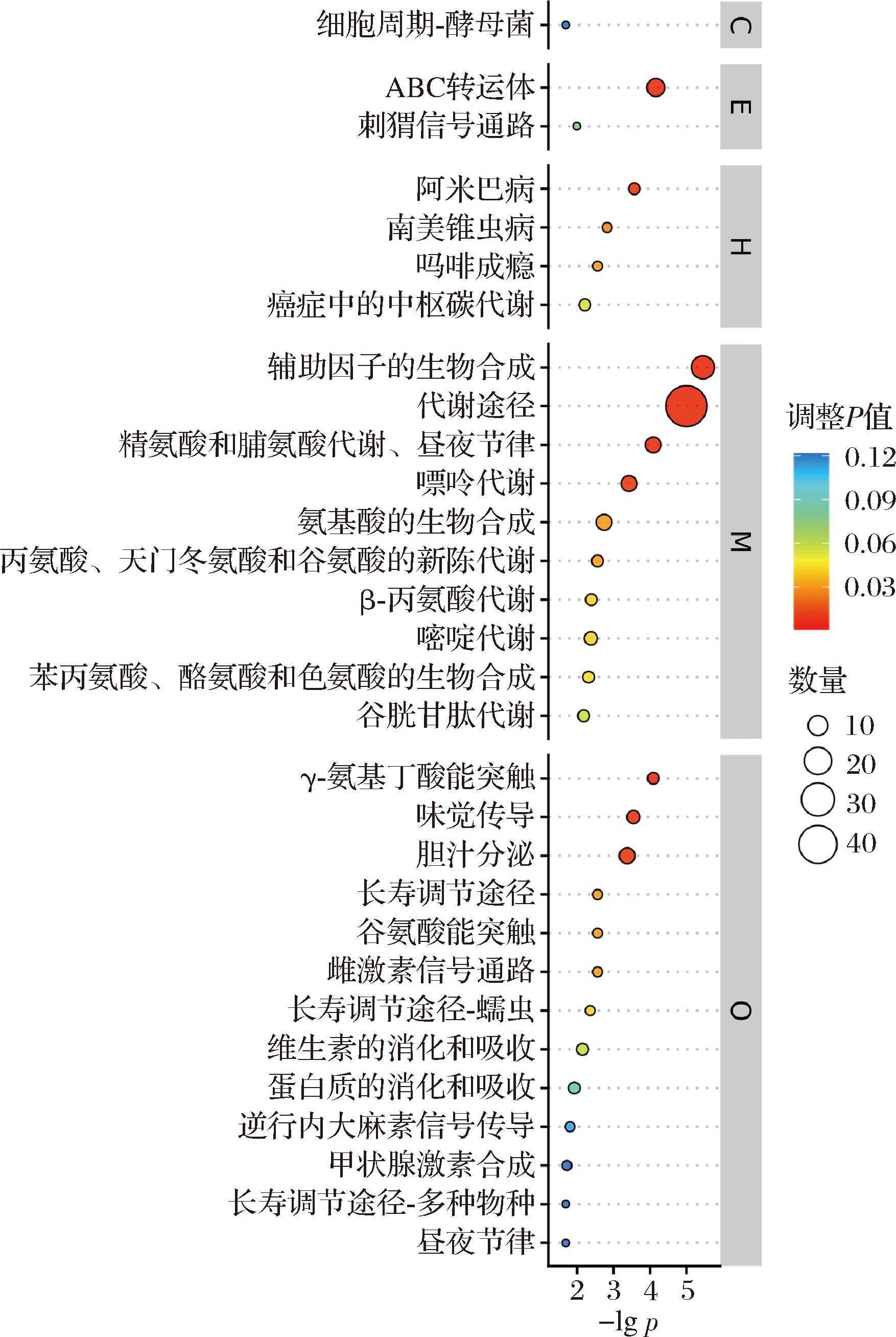
图11 Y/G/N/B地区的KEGG通路富集气泡图
Fig.11 Bubble map of KEGG pathway enrichment for Y, G, N, and B regions
在生物体系统中主要富集在13种代谢途径,分别为γ-氨基丁酸能突触、胆汁分泌、味觉传导、长寿调节途径、谷氨酸能突触、雌激素信号通路、长寿调节途径-蠕虫、维生素的消化和吸收、蛋白质的消化和吸收、逆行内大麻素信号传导、甲状腺激素合成、长寿调节途径-多种物种、昼夜节律;在代谢过程中富集于10种途径,主要在代谢途径,辅助因子的生物合成,精氨酸和脯氨酸代谢和昼夜节律,嘌呤代谢,氨基酸的生物合成,丙氨酸、天门冬氨酸和谷氨酸的新陈代谢,β-丙氨酸代谢,嘧啶代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成,谷胱甘肽代谢;在人类疾病中其通路富集于4条途径,分别为阿米巴病、南美锥虫病、吗啡成瘾、癌症中的中枢碳代谢;在环境信息处理中富集于2条通路途径:ABC转运体和刺猬信号通路;在细胞过程中富集于细胞周期-酵母菌1条途径。
2.9.2 富集通路的网络图分析
通路的功能相互作用网络图,每个点表示一条通路,颜色表示富集显著性(P值),越红的点表示该通路越显著富集;圆圈大小表示注释到该通路的代谢物数量(count),圆圈越大表示代谢物数量越多;通路间存在网络连线表示它们含有共同的差异代谢物,线越粗表示2个通路共有的代谢物越多。
由图12可知,4个地区牦牛酸奶中前30条代谢途径中含有共同的差异代谢物11种,分别为代谢途径、辅助因子的生物合成、精氨酸和脯氨酸代谢以及昼夜节律、γ-氨基丁酸能突触、ABC转运体、嘌呤代谢、氨基酸的生物合成、味觉传导、胆汁分泌、阿米巴病、南美锥虫病。其中前5种代谢物在通路之间相互作用的数量最多,且代谢途径与辅助因子的生物合成、精氨酸和脯氨酸代谢以及昼夜节律、ABC转运体、γ-氨基丁酸能突触、氨基酸的生物合成、嘌呤代谢、胆汁分泌、味觉传导之间相互作用的代谢物数量均较多。
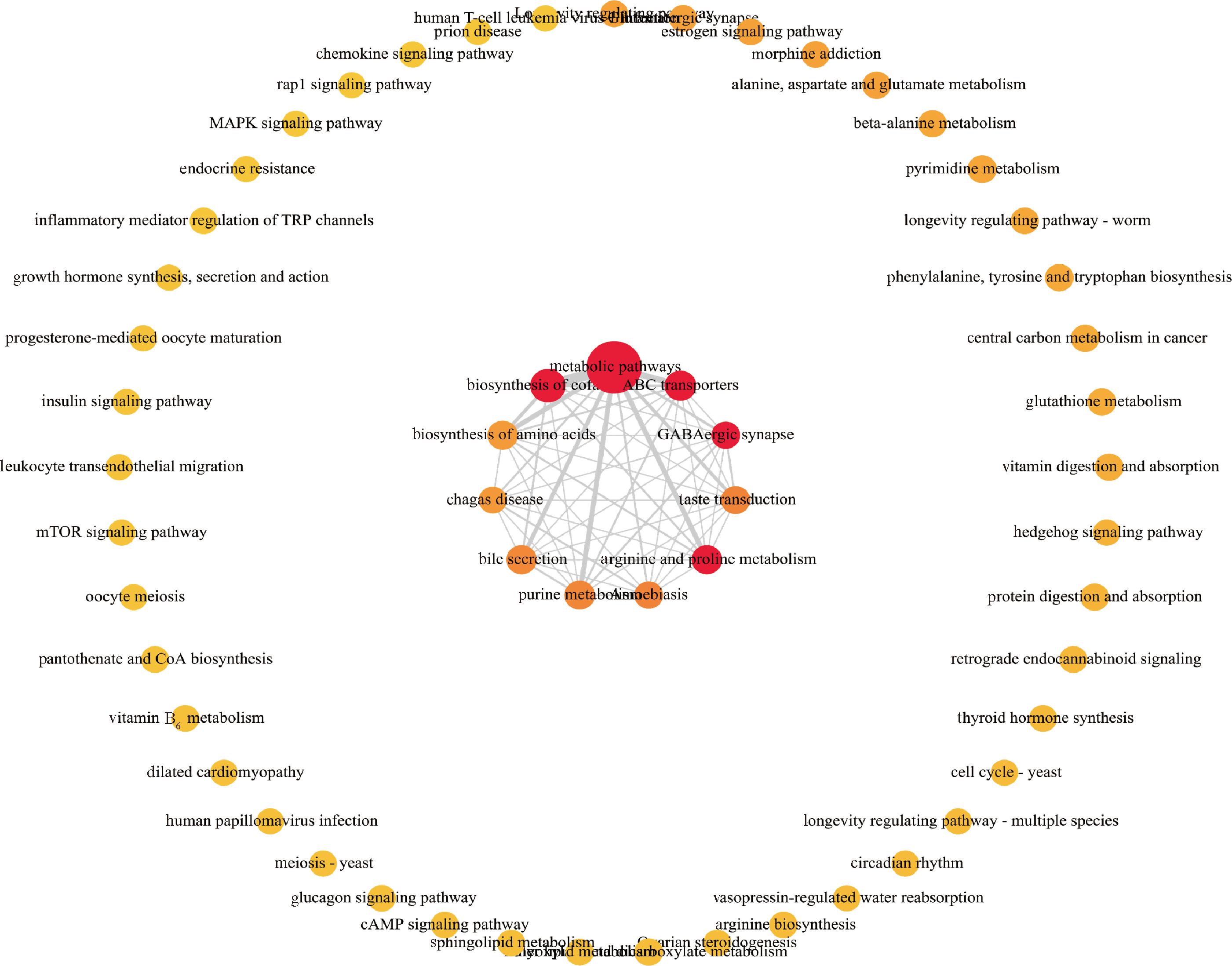
图12 富集通路的网络图
Fig.12 Network diagram of enriched pathways
注: metabolic pathways:代谢途径;biosynthesis of cofactors:辅助因子的生物合成;ABC transporters:ABC转运体;GABA ergic synapse:γ-氨基丁酸能突触;arginine and proline metabolism:精氨酸和脯氨酸代谢;taste transduction:味觉传导;amoebiasis:阿米巴病;purine metabolism:嘌呤代谢;bile secretion:胆汁分泌;chagas disease:南美锥虫病;biosynthesis of amino acids:氨基酸的生物合成;longevity regulating pathway:长寿调节途径;glutamatergic synapse:谷氨酸能突触;estrogen signaling pathway:雌激素信号传导途径;morphine addiction:吗啡成瘾;alanine, aspartate and glutamate metabolism:丙氨酸;天门冬氨酸和谷氨酸代谢;beta-alanine metabolism:β-丙氨酸代谢;pyrimidine metabolisn:嘧啶代谢;longevity regulating pathway-worm:长寿调节途径-蠕虫;phenylalanine, tyrosine and tryptophan biosynthesis:苯丙氨酸;酪氨酸和色氨酸的生物合成;central carbon metabolism in cancer:癌症中的中枢碳代谢;glutathione metabolism:谷胱甘肽代谢;vitamin digestion and absorption:维生素的消化和吸收;hedgehog signaling pathway:刺猬信号通路;protein digestion and absorption:蛋白质的消化和吸收;retrograde endocannabinoid signaling:逆行内大麻素信号传递;thyroid hormone synthesis:甲状腺激素合成;cell cycle-yeast:细胞周期-酵母菌;longevity regulating pathway-multiple species:长寿调节途径-多个物种;circadian rhythm:昼夜节律;vasopressin-regulated water reabsorption:血管加压素调节的水重吸收;arginine biosynthesis:精氨酸的生物合成;ovarian steroidogenesis:卵巢类固醇生成;glyoxylate and dicarboxylate metabolism:乙醛酸和二羧酸代谢;ether lipid metabolism:醚脂代谢;cAMP signaling pathway:CAMP信号通路;sphingolipid metabolism:鞘脂代谢;glucagon signaling pathway:胰高血糖素信号通路;meiosis-yeast:减数分裂-酵母菌;human papillomavirus infection:人类乳头瘤病毒感染;dilated cardiomyopathy:扩张型心肌病;vitamin B6 metabolism:维生素B6代谢;pantothenate and CoA biosynthesis:泛酸和CoA的生物合成;oocyte meiosis:卵母细胞减数分裂;mTOR signaling pathway:mTOR信号通路;leukocyte transendothelial migration:白细胞跨内皮迁移;insulin signaling pathway:胰岛素信号通路;progesterone-mediated oocyte maturation:黄体酮介导的卵母细胞成熟;growth hormone synthesis,secretion and action:生长激素的合成;分泌和作用;inflammatory mediator regulation of TRP channels:炎症介质对TRP通道的调控;endocrine resistance:内分泌抵抗;MAPK signaling pathway:MAPK 信号通路;Rapl signaling pathway:Rapl 信号通路;chemokine signaling pathway:趋化因子信号通路;Prion disease:普里恩病;human T-cell leukemia virus l infection:人类T细胞白血病病毒l感染。
采用Venn图分析4个不同地区2组互相比较组的共有差异代谢物和特有差异代谢物情况。如图13所示,Y/B组、Y/N组、Y/G组共有差异代谢物数量为47个,N/B组、G/B组、G/N组共有差异代谢物数量为21个。其中Y/B组差异代谢物数量最多,Y/G组差异代谢物数量最少,由此可得,Y地区与B地区牦牛酸奶代谢差异较大,与G地区牦牛酸奶差异较小。
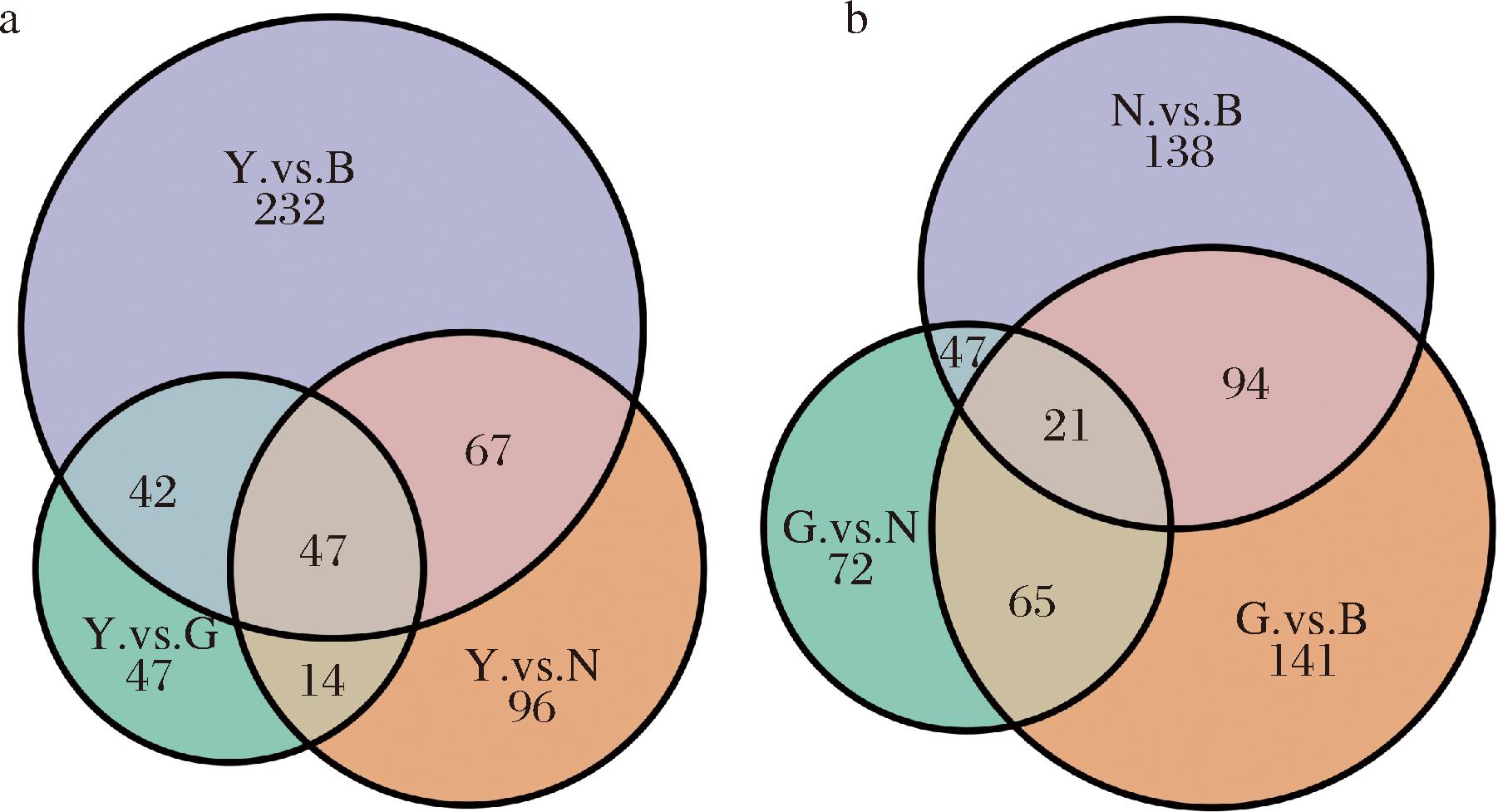
a-Y/G、Y/N、Y/B组;b-G/N、G/B、N/B组
图13 显著差异代谢物Venn图
Fig.13 Venn diagram of significantly differential metabolites
牦牛酸奶作为青海地区特色传统发酵乳制品,受不同地区海拔、温度气候、自然环境等影响,牦牛奶源、酸奶制作工艺、微生物环境不同,导致不同地区牦牛酸奶中代谢物质存在差异。本研究表明,青海4个地区牦牛酸奶中共有显著差异代谢物325个,而Y/B地区间的代谢物差异最大,可能是由于玉树(Y)和海北(B)地区的海拔等地理环境差异较大,4个地区中玉树海拔平均为4 400 m以上,海北平均为2 800 m,而果洛海拔为4 200 m以上,海南平均为3 800 m,由于高海拔地区传统发酵牦牛酸奶中的菌群经过长期严格的自然环境选择,与低海拔地区相比,乳酸菌种类差异明显,因此不同地区的海拔对牦牛酸奶中菌种有较大影响,导致代谢物差异较大,这与刘怡萱等[37]研究相一致。而在G地区发现甘油磷酸胆碱等脂类和类脂分子的代谢物相对含量较多,有研究表明,甘油磷脂代谢与海拔高度的相关性显著[22],通常高海拔地区甘油磷脂含量偏高。并且王一然[38]研究发现,不同温度对酸奶中发酵菌的氨基酸代谢具有显著影响,由于游离氨基酸的含量受发酵温度的影响,可通过酸奶中游离氨基酸含量调控参与蛋白质代谢,因此4个地区较大的温度气候差异,使得牦牛酸奶中氨基酸类等有机酸代谢物产生较大差异。本研究中4个地区显著差异代谢产物主要分布在脂类和类脂分子、有机酸及其衍生物、有机杂环化合物等三大类中,这与梁晓琳等[16]的研究结果相一致,且该研究表明,传统发酵乳制品微生物群和代谢产物之间存在密切关系,乳杆菌和链球菌与脯氨酸等正相关,酵母菌与有机酸类显著正相关,因此这些不同的菌种可能在一定程度上调控着不同地区牦牛酸奶代谢产物的变化。影响不同地区牦牛酸奶的代谢因素较复杂,高海拔低气压、温度气候、微生物环境等都能在一定程度上导致牦牛酸奶代谢产物的差异,进而影响酸奶品质。
采用非靶向代谢组学技术对青海不同地区牦牛酸奶的代谢物进行差异分析,通过PCA和OPLS-DA筛选显著差异代谢物,采用火山图、K-means分析、聚类图、Pearson相关性分析、HMDB化合物分类、KEGG通路富集和Venn图等对代谢组数据进行差异分析。从4个地区24份牦牛酸奶中共检测出1 500个差异代谢物,在Y/B组中显著差异代谢物426个,上调188个;G/B组中显著差异代谢物339个,上调82个;N/B组中显著差异代谢物316个,上调77个;Y/N组中显著差异代谢物237个,上调146个;G/N组中显著差异代谢物210个,上调116个;Y/G组中显著差异代谢物158个,上调89个。通过VIP值≥1和P<0.05筛选出4个地区共有325个显著差异代谢物,其主要分布在脂类和类脂分子、有机酸及其衍生物、有机杂环化合物等三大类中。采用VIP值聚类分析前50个差异代谢物,G地区中甘油磷酸胆碱、Y地区中的黄酮糖苷、缬氨酸、B地区的谷氨酰胺、呋喃酮A、5β-胆酸等差异代谢物相对含量较多,在一定程度上调控着酸奶中的代谢物质,影响酸奶的品质差异。通过代谢通路富集分析,发现青海不同地区牦牛酸奶的差异代谢物主要富集在代谢途径、辅助因子的生物合成、精氨酸和脯氨酸代谢和昼夜节律、嘌呤代谢、氨基酸的生物合成、ABC转运体等途径中。综上,G、Y、B、N地区牦牛酸奶间有较明显的分离趋势,脂类和类脂分子、有机酸及其衍生物、有机杂环化合物在青海不同地区牦牛酸奶中有不同程度的差异,研究结果可为鉴定不同地区酸奶品质提供参考方向,对青海省牦牛酸奶资源的开发利用具有重要的意义。
[1] SHENG Q H, LI J C, ALAM M S, et al.Gross composition and nutrient profiles of Chinese yak (Maiwa) milk[J].International Journal of Food Science &Technology, 2008, 43(3):568-572.
[2] 高利娥. 青藏高原传统发酵牦牛乳中乳酸菌的多样性及抗氧化特性研究[D].兰州:兰州大学, 2020.GAO L E.Biodiversity and antioxidant properties of lactic acid bacteria from spontaneously fermented yak milk in the Qinghai-Tibet Plateau[D].Lanzhou:Lanzhou University, 2020.
[3] 和秋红. 乳酸菌在食品工程中的应用探究[J].现代食品, 2023, 29(6):79-81.HE Q H.Research on application of lactic acid bacteria in food engineering[J].Modern Food, 2023, 29(6):79-81.
[4] 代牡兰, 锡林高娃, 吴金花, 等.内蒙古地区传统发酵乳中乳酸菌的分离与鉴定[J].中国乳品工业, 2023, 51(5):31-35.DAI M L, XI L G W, WU J H, et al.Isolation and identification of lactic acid bacteria from traditional fermented milk in Inner Mongolia[J].China Dairy Industry, 2023, 51(5):31-35.
[5] SINGH T P, ARORA S, SARKAR M.Yak milk and milk products:Functional, bioactive constituents and therapeutic potential[J].International Dairy Journal, 2023, 142:105637.
[6] 杨超. 酸马奶中乳酸菌的分离鉴定及生物学特性研究[D].呼和浩特:内蒙古农业大学, 2021.YANG C.Isolation, identification and biological characteristics of lactic acid bacteria in sour horse milk[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[7] 吕嘉伟, 卢灏泽, 刘振东, 等.西藏曲拉中优良乳酸菌的筛选与评价[J].酿酒科技, 2023(6):34-45.LYU J W, LU H Z, LIU Z D, et al.Screening and evaluation of lactic acid bacteria strains from Tibetan Qula[J].Liquor-Making Science &Technology, 2023(6):34-45.
[8] 刘雪, 吴莉蔚, 杨勇, 等.牦牛酸奶加工工艺参数优化及其品质分析[J].中国测试, 2023, 49(6):68-74.LIU X, WU L W, YANG Y, et al.The processing parameter optimization of yak yogurt and its quality analysis[J].China Measurement & Test, 2023, 49(6):68-74.
[9] CHI F M, TAN Z K, GU X D, et al.Bacterial community diversity of yak milk dreg collected from Nyingchi region of Tibet, China[J].LWT, 2021, 145:111308.
[10] YI R K, TAN F, LIAO W, et al.Isolation and identification of Lactobacillus plantarum HFY05 from natural fermented yak yogurt and its effect on alcoholic liver injury in mice[J].Microorganisms, 2019, 7(11):530.
[11] 李丽, 冯华峰, 周淳, 等.植物乳杆菌发酵黑果枸杞的代谢组学研究[J].化学试剂, 2022, 44(8):1088-1096.LI L, FENG H F, ZHOU C, et al.Metabolomics study of Lactobacillus plantarum fermented Lycium ruthenicum Murr[J].Chemical Reagents, 2022, 44(8):1088-1096.
[12] WISHART D S.Metabolomics for investigating physiological and pathophysiological processes[J].Physiological Reviews, 2019, 99(4):1819-1875.
[13] 胥鑫钰, 张梦梦, 王啸尘, 等.微生物代谢组学在发酵食品研究中的应用[J].食品研究与开发, 2024, 45(15):210-217.XU X Y, ZHANG M M, WANG X C, et al.Application of microbial metabolomics in the study of fermented foods[J].Food Research and Development, 2024, 45(15):210-217.
[14] LI Y D, WANG J H, WANG T, et al.Differences between Kazak cheeses fermented by single and mixed strains using untargeted metabolomics[J].Foods, 2022, 11(7):966.
[15] 郭永昊, 刘储睿, 孙珍.应用代谢组学技术预测啤酒发酵过程中的腐败菌[J].广西师范大学学报(自然科学版), 2023, 41(5):161-170.GUO Y H, LIU C R, SUN Z.Applying metabonomics to predict the spoilage bacteria in beer fermentation[J].Journal of Guangxi Normal University (Natural Science Edition), 2023, 41(5):161-170.
[16] 梁晓琳, 张哲川, 王宇豪, 等.传统发酵牦牛乳制品中微生物群落及其与代谢产物相关性[J].食品科学, 2024, 45(9):84-92.LIANG X L, ZHANG Z C, WANG Y H, et al.Microbial community structure and correlation with metabolites in traditional fermented yak milk products[J].Food Science, 2024, 45(9):84-92.
[17] 韩奕奕. 乳与乳制品中脂肪酸组成的分析体系研究及标准化应用[D].上海:复旦大学, 2010.HAN Y Y.Analytic system studies on composition of fatty acids in milk and milk products and standardizational application[D].Shanghai:Fudan University, 2010.
[18] KHAN I T, NADEEM M, IMRAN M, et al.Impact of post fermentation cooling patterns on fatty acid profile, lipid oxidation and antioxidant features of cow and buffalo milk set yoghurt[J].Lipids in Health and Disease, 2020, 19(1):74.
[19] 翁晨, 邓泽元, 李静.乳制品脂质组成的比较[J].食品科学, 2020, 41(4):149-156.WENG C, DENG Z Y, LI J.Comparison of lipid compositions of several dairy products[J].Food Science, 2020, 41(4):149-156.
[20] 施报平, 刘晓冰, 王怀旭, 等.包载C3G的新型纳米纤维脂质体在酸奶中的应用[J].深圳大学学报(理工版), 2024, 41(3):348-357.SHI B P, LIU X B, WANG H X, et al.Application of novel nanofiber liposomes coated with C3G in yogurt[J].Journal of Shenzhen University(Science and Engineering), 2024, 41(3):348-357.
[21] CHRISTIE W W, NOBLE R C, DAVIES G.Phospholipids in milk and dairy products[J].International Journal of Dairy Technology, 1987, 40(1):10-12.
[22] YANG F Y, WEN X, XIE S W, et al.Characterization of lipid composition and nutritional quality of yak ghee at different altitudes:A quantitative lipidomic analysis[J].Food Chemistry:X, 2024, 21:101166.
[23] 张嘉宾, 李苗苗, 靳思玉, 等.添加乳酸菌对苜蓿青贮过程中总黄酮提取率、β-葡萄糖苷酶活性及主要黄酮苷元含量的影响[J].动物营养学报, 2021, 33(3):1584-1593.ZHANG J B, LI M M, JIN S Y, et al.Effects of adding lactic acid bacteria on extraction rate of total flavones, β-glucosidase activity and main flavones aglycone contents in alfalfa silage[J].Chinese Journal of Animal Nutrition, 2021, 33(3):1 584-1 593.
[24] 毛新亮, 王憬, 周明, 等.发酵沙棘原果汁的乳酸菌筛选及工艺优化[J].现代食品科技, 2023, 39(9):106-112.MAO X L, WANG J, ZHOU M, et al.Screening and optimization of lactic acid bacteria for fermentation of seabuckthorn juice[J].Modern Food Science and Technology, 2023, 39(9):106-112.
[25] 宁亚维, 李明蕊, 陈艺, 等.食物来源有机酸及其衍生物抗血栓作用机制研究进展[J].食品科学, 2022, 43(13):292-301.NING Y W, LI M R, CHEN Y, et al.Progress in research on the antithrombotic mechanism of food-derived organic acids and their derivatives[J].Food Science, 2022, 43(13):292-301.
[26] MORTERA P, ZULJAN F A, MAGNI C, et al.Multivariate analysis of organic acids in fermented food from reversed-phase high-performance liquid chromatography data[J].Talanta, 2018, 178:15-23.
[27] SMID E J, KLEEREBEZEM M.Production of aroma compounds in lactic fermentations[J].Annual Review of Food Science and Technology, 2014, 5:313-326.
[28] PIARD J C, DESMAZEAUD M.Inhibiting factors produced by lactic acid bacteria.1.Oxygen metabolites and catabolism end-products[J].Le Lait, 1991, 71(5):525-541.
[29] 石拓, 刘晓倩, 范晓光, 等.缬氨酸生产菌株的定向改造及发酵优化[J].食品与发酵工业, 2019, 45(5):19-24.SHI T, LIU X Q, FAN X G, et al.Direct construction and fermentation optimization of valine producing strain[J].Food and Fermentation Industries, 2019, 45(5):19-24.
[30] 连艳鲜, 徐礼, 李静儒.谷氨酰胺转氨酶在酸奶制备中的应用研究[J].现代牧业, 2021, 5(3):40-43.LIAN Y X, XU L, LI J R.Study on the application of transglutaminase in yogurt preparation[J].Modern Animal Husbandry, 2021, 5(3):40-43.
[31] 李洪波, 张君颜, 李卿, 等.谷氨酰胺转氨酶在酸奶中的应用研究[J].安徽农业科学, 2017, 45(18):86-88.LI H B, ZHANG J Y, LI Q, et al.Application of transglutaminase in yoghurt[J].Journal of Anhui Agricultural Sciences, 2017, 45(18):86-88.
[32] 尹新雅, 李梦瑶, 李呵呵, 等.蛋白谷氨酰胺酶与发酵剂对核桃酸奶品质的影响[J].食品工业科技, 2024, 45(18):128-137.YIN X Y, LI M Y, LI H H, et al.Effects of protein-glutaminase and starter cultures on the quality of walnut-based yogurt[J].Science and Technology of Food Industry, 2024, 45(18):128-137.
[33] 贺红军, 邹慧, 孙宁, 等.紫薯酸奶和普通酸奶挥发性风味物质差异性研究[J].现代食品科技, 2014, 30(8):225-230.HE H J, ZOU H, SUN N, et al.Volatile flavor compounds in regular and purple sweet potato yogurt[J].Modern Food Science and Technology, 2014, 30(8):225-230.
[34] 潘百玲, 戴凌燕, 刘微, 等.微生物代谢合成呋喃酮的培养条件和酶学调控研究进展[J].黑龙江八一农垦大学学报, 2021, 33(5):67-73.PAN B L, DAI L Y, LIU W, et al.Research progress of culture condition and enzyme regulation about microbial metabolism and synthesis of furanone[J].Journal of Heilongjiang Bayi Agricultural University, 2021, 33(5):67-73.
[35] 李云端. 草莓果实特征芳香物质呋喃酮合成的DNA甲基化调控机制[D].杭州:浙江大学, 2023.LI Y D.DNA methylation regulation mechanism of furanone biosynthesis, a characteristic volatile compound in strawberry fruit[D].Hangzhou:Zhejiang University, 2023.
[36] GÜLER Z.Changes in salted yoghurt during storage[J].International Journal of Food Science &Technology, 2007, 42(2):235-245.
[37] 刘怡萱, 许国琪, 曹鹏熙, 等.基于16S rRNA高通量测序的西藏农、牧区牦牛酸奶菌群多样性分析[J].食品科学,2020,41(18):92-97.LIU Y X, XU G Q, CAO P X, et al.Microbial diversity of yak yogurt in agricultural and pastoral areas of Tibet analyzed based on high-throughput 16S rRNA gene sequencing[J].Food Science, 2020, 41(18):92-97.
[38] 王一然. 发酵条件对酸奶营养品质及代谢产物的影响[D].沈阳:沈阳农业大学, 2019.WANG Y R.Effects of fermentation technology on nutritional quality and metabolites of yogurt[D].Shenyang:Shenyang Agricultural University, 2019.