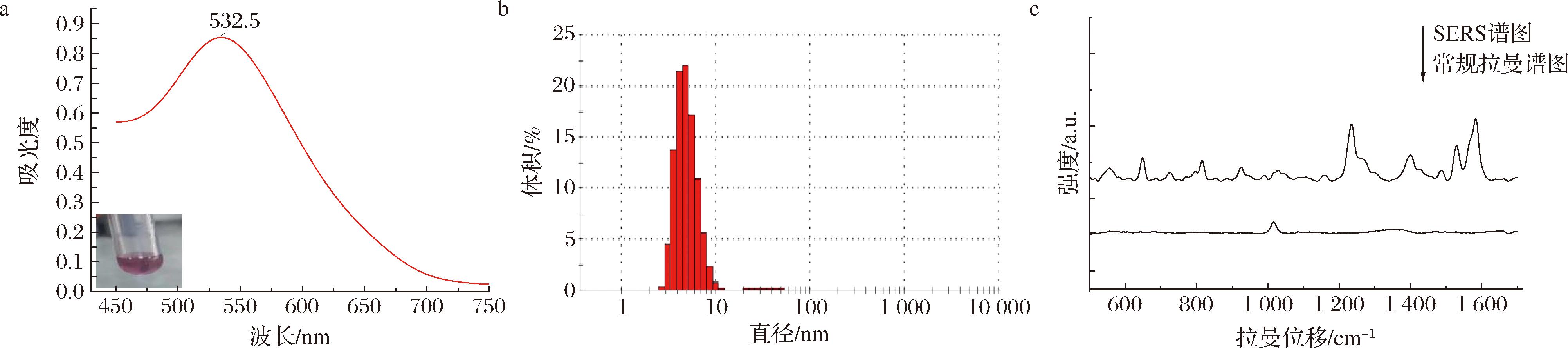
a-金溶胶的紫外可见吸收光谱图;b-金溶胶体积平均粒径分布图;c-西地那非的SERS谱图与常规拉曼谱图
图1 金溶胶的表征
Fig.1 Characterization of gold colloid
LI Yujing,HE Hongyuan,LUAN Yujing.Research on rapid screening of 90 kinds of illegally added phosphodiesterase type 5 inhibitors in liquid health foods using surface-enhanced Raman spectroscopy[J].Food and Fermentation Industries,2025,51(14):372-379.
随着人们生活水平提高和保健意识增强,保健食品市场迅速扩大。然而,一些不法商贩为了获取高额利润,非法向抗疲劳类、补肾壮阳类和调节免疫类保健食品中添加磷酸二酯酶5型抑制剂(phosphodiesterase type 5 inhibitors,PDE5is)[1-3],这些药物主要用于治疗勃起功能障碍和心血管疾病[4],但未经批准的添加和使用易导致消费者出现头痛、消化不良、血压下降、视觉异常等不良反应[5],过量摄入还可能引发心源性猝死[5-6]。近年来,我国在打击食药环犯罪的专项行动中,已查处多起保健食品中非法添加PDE5is的案件[7]。
目前,实验室检测PDE5is的方法主要包括高效液相色谱法(high performance liquid chromatography,HPLC)和液相色谱质谱联用法(liquid chromatography-mass spectrometry,LC-MS)[8-12],这些方法虽然灵敏度和选择性高,但检测过程复杂、耗时长,且对实验条件和操作人员要求较高。PDE5is的快速检测方法如薄层色谱法、免疫分析法、电化学分析法、常压电离质谱法、近红外光谱法等各有优缺点,薄层色谱法操作简便但准确度和灵敏度较低;免疫分析法和电化学分析法针对性强,目前仅能检测少数几种PDE5is;常压电离质谱设备昂贵,维护成本高;近红外光谱法对操作系统要求较高,需要建立特定的化学计量学模型。相比之下,表面增强拉曼光谱法(surface-enhanced Raman spectroscopy,SERS)具有检测速度快、荧光背景低、灵敏度高和指纹特征性强等优点,且90种PDE5is均具有拉曼活性和独特的光谱特征,可满足食药环部门的日常抽检和现场快速检测需要[13-16]。
本研究基于SERS技术,采用自制金溶胶作为增强试剂,通过优化匹配剂类型和样品前处理方法确定最佳检测条件,实现对液体保健食品中90种PDE5is的快速筛查。
18种抗疲劳、补肾壮阳、调节免疫类液体保健食品,某食药环部门查缴,其中7种为保健酒,11种为口服液;西地那非等90种PDE5is标准品(BJS 201805《食品中那非类物质的测定》),北京曼哈格生物科技有限公司;乙腈、乙酸乙酯、甲醇、二氯甲烷、异丙醇、硫酸、盐酸、氯化钠、氢氧化钠、氯金酸、柠檬酸三钠(均为分析纯),国药集团化学试剂有限公司。
ZPR1009便携式拉曼食品安全检测仪,江苏中朗宏泰科学仪器有限公司;MultiVortex-15 mL试管多样品涡旋混合器,广州得泰仪器科技有限公司;Milli-Q超纯水制备机,美国Merck Millipore公司;XS105型电子分析天平,瑞士Mettler Toledo公司;TGL-21台式高速多功能冷冻离心机,四川蜀科仪器有限公司;紫外可见分光光度计,日本SHIMADZU公司;RCT digital磁力加热搅拌器,德国IKA公司;Zetasizer Nano ZS zeta电位及纳米粒度分析仪,英国Malvern。
1.3.1 金溶胶制备
依据文献方法[17],采用柠檬酸三钠还原法制备金溶胶:取100 mL超纯水和2 mL质量分数为1%的氯金酸溶液混合于洁净的玻璃容器中,在120 ℃下加热并搅拌至溶液沸腾,逐滴加入1 mL质量分数为2%的柠檬酸三钠溶液,持续搅拌至容器内液体颜色变为酒红色且形成透明胶体时,立即终止反应并冷却至室温。将容器内胶体溶液转移至棕色瓶中低温避光贮存。
1.3.2 PDE5is标准溶液配制
准确称取罗地那非碳酸酯、西地那非二聚体杂质、伐地那非二聚体标准品各0.2 mg,用盐酸甲醇溶液[V(盐酸)∶V(甲醇)=1∶9]溶解,制成质量浓度为200 μg/mL标准溶液;准确称取N-乙基他达拉非1 mg,用乙酸乙酯溶解,制成质量浓度为1 000 μg/mL标准溶液;准确称取庆地那非、硫喹哌非各0.2 mg,用甲醇溶解,制成质量浓度为200 μg/mL标准溶液;准确称取其余84种标准品各1 mg,用甲醇溶解,制成质量浓度为1 000 μg/mL标准溶液。所有标准溶液均应置于-20 ℃下避光密封保存,备用。
1.3.3 样品前处理及光谱采集
将样品与乙腈按1∶2体积比混合置于离心管中,涡旋混合5 min后加入少量NaCl固体,随后以3 000 r/min离心5 min,取上清液备用。将上清液与0.3 mol/L硫酸溶液按1∶4体积比混合置于离心管中,涡旋混合5 min后,作为待测溶液备用。
依次取500 μL金溶胶、20 μL待测溶液、20 μL匹配剂[1 mol/L盐酸氯化钠溶液,配比为V(盐酸)∶V(氯化钠)=1∶9]置于拉曼检测瓶中混匀,迅速采集拉曼光谱。
1.3.4 SERS检测
使用便携式拉曼光谱仪收集拉曼光谱,激发波长为(785±0.5) nm,光谱扫描范围为200~3 200 cm-1,积分时间为2 000~3 000 ms,激光功率为500 mW。使用仪器自带软件对采集到的原始光谱数据进行预处理,以消除背景噪声并增强光谱信号特征。
使用超纯水对金溶胶适当稀释,以便于紫外可见分光光度计测定其吸收光谱,如图1-a所示。金溶胶的最大吸收峰位于532.5 nm,据此推测其颗粒尺寸小于50 nm[18]。532.5 nm处的吸光度值为0.884,较高的吸光度值意味着金溶胶中纳米颗粒的浓度较高或尺寸分布较为均匀。采用动态光散射法(particle size analysis-dynamic light scattering,DLS)测定样品粒径,其Z平均粒径为38.05 nm,其粒径分布直方图基本呈现正态分布,表明制备的金溶胶粒径均匀,如图1-b所示。选取西地那非作为探针分子以表征金溶胶的表面增强效果,通过对比加入金溶胶前后西地那非的拉曼谱图可知,金溶胶的加入显著增强了西地那非的特征峰,如图1-c所示,表明本研究制备的金溶胶对PDE5is具有显著的表面增强效果。

a-金溶胶的紫外可见吸收光谱图;b-金溶胶体积平均粒径分布图;c-西地那非的SERS谱图与常规拉曼谱图
图1 金溶胶的表征
Fig.1 Characterization of gold colloid
根据PDE5is的母体结构,可将PDE5is分为西地那非类、硫代西地那非类、他达拉非类和伐地那非类四类,从这四类PDE5is标准溶液的SERS谱图可以观察到,同一类别药物的光谱特征具有较高的一致性,如图2所示。西地那非类的特征峰主要分布在650、817、925、1 234、1 401、1 528、1 582 cm-1等处,根据化合物结构及相关文献,650 cm-1处特征峰主要源于苯环的伸缩振动,817 cm-1处特征峰来自于C—H弯曲振动,925 cm-1处特征峰主要由苯环及杂环的C—C伸缩振动所致,1 234 cm-1处的特征峰产生于芳香环的![]() C—H面内弯曲振动[19]和SO2伸缩振动的共同作用[20-21,13],1 401 cm-1处特征峰主要由C—N伸缩振动[21]和—CH2的剪切弯曲振动引起[13,20],1 528 cm-1和1 582 cm-1处特征峰归因于苯环和氮杂环上的
C—H面内弯曲振动[19]和SO2伸缩振动的共同作用[20-21,13],1 401 cm-1处特征峰主要由C—N伸缩振动[21]和—CH2的剪切弯曲振动引起[13,20],1 528 cm-1和1 582 cm-1处特征峰归因于苯环和氮杂环上的![]() 伸缩振动[13,19-20]。硫代西地那非类的特征峰位于424、580、817、869、993、1 193、1 258、1 394 cm-1等处,最高峰位于1 258 cm-1处,其中817 cm-1处特征峰与西地那非类相同。他达拉非类的特征峰分布在576、717、751、794、858、913、984、1 091、1 233、1 361、1 481、1 561、1 610 cm-1等处,在700~1 000 cm-1波数区内的拉曼特征峰分布密集,最高峰位于794 cm-1处。伐地那非类特征峰650、820、925、1 238、1 589 cm-1与西地那非类特征峰峰强和峰位相近,其他特征峰则出现在1 216、1 363、1 410、1 565、1 631 cm-1等位置。这些SERS特征峰为后续保健食品中PDE5is非法添加的检测提供了可靠的判别依据。
伸缩振动[13,19-20]。硫代西地那非类的特征峰位于424、580、817、869、993、1 193、1 258、1 394 cm-1等处,最高峰位于1 258 cm-1处,其中817 cm-1处特征峰与西地那非类相同。他达拉非类的特征峰分布在576、717、751、794、858、913、984、1 091、1 233、1 361、1 481、1 561、1 610 cm-1等处,在700~1 000 cm-1波数区内的拉曼特征峰分布密集,最高峰位于794 cm-1处。伐地那非类特征峰650、820、925、1 238、1 589 cm-1与西地那非类特征峰峰强和峰位相近,其他特征峰则出现在1 216、1 363、1 410、1 565、1 631 cm-1等位置。这些SERS特征峰为后续保健食品中PDE5is非法添加的检测提供了可靠的判别依据。
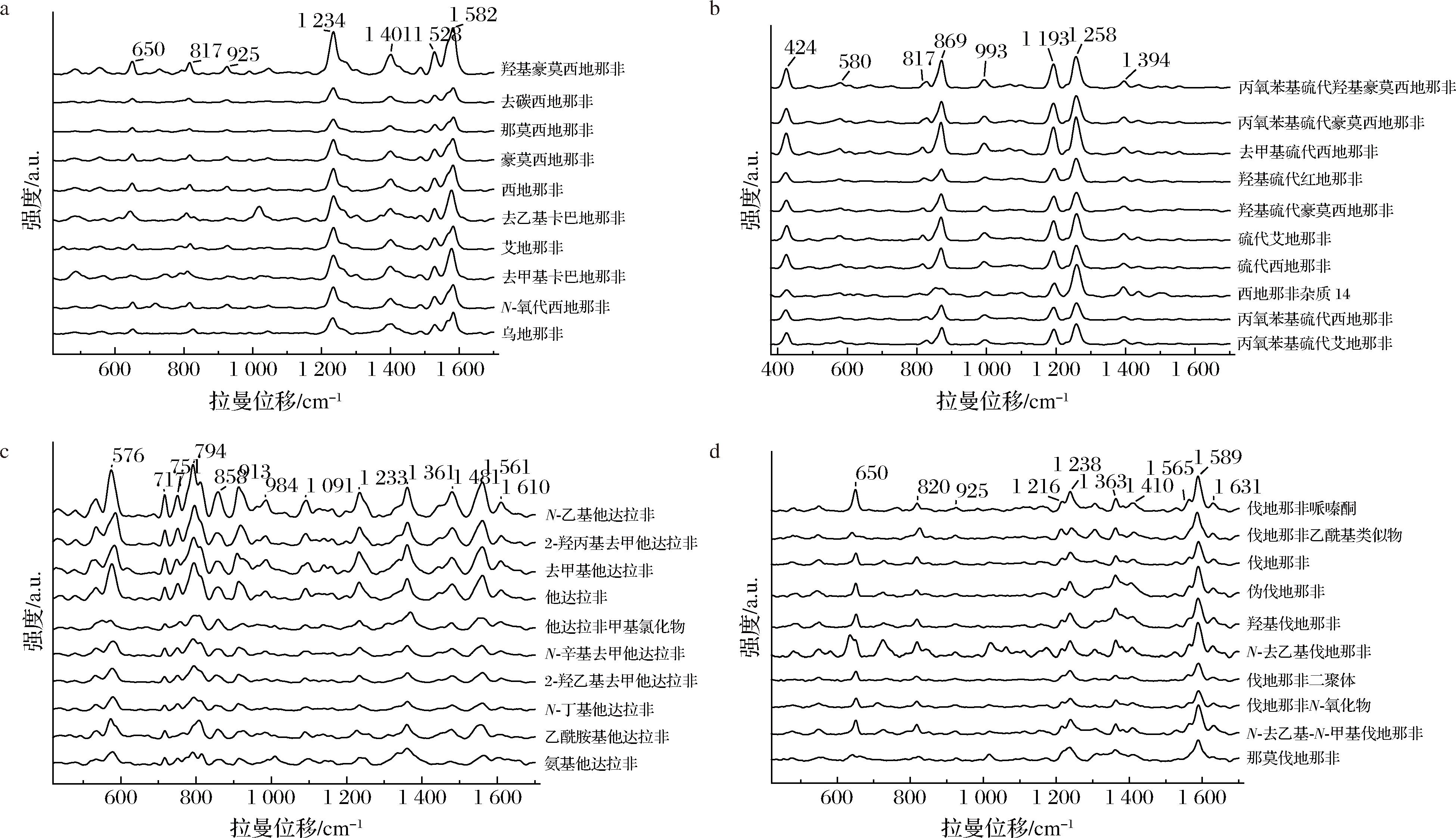
a-西地那非类;b-硫代西地那非类;c-他达拉非类;d-伐地那非类
图2 四类PDE5is标准溶液的SERS谱图
Fig.2 SERS spectra of 4 classes of PDE5is
由于金溶胶颗粒在水溶液中易受到范德华力和静电力的影响,可通过向金溶胶中加入适量浓度的电解质和酸碱溶液,进一步提高SERS增强效果[22-23]。本研究系统考察了5种不同匹配剂对西地那非SERS光谱强度的影响。如图3所示,加入匹配剂后,西地那非的SERS特征峰强度提高,当使用1 mol/L盐酸氯化钠溶液[V(盐酸)∶V(氯化钠)=1∶9]作为匹配剂时,对西地那非SERS特征峰的增强效果最为显著。
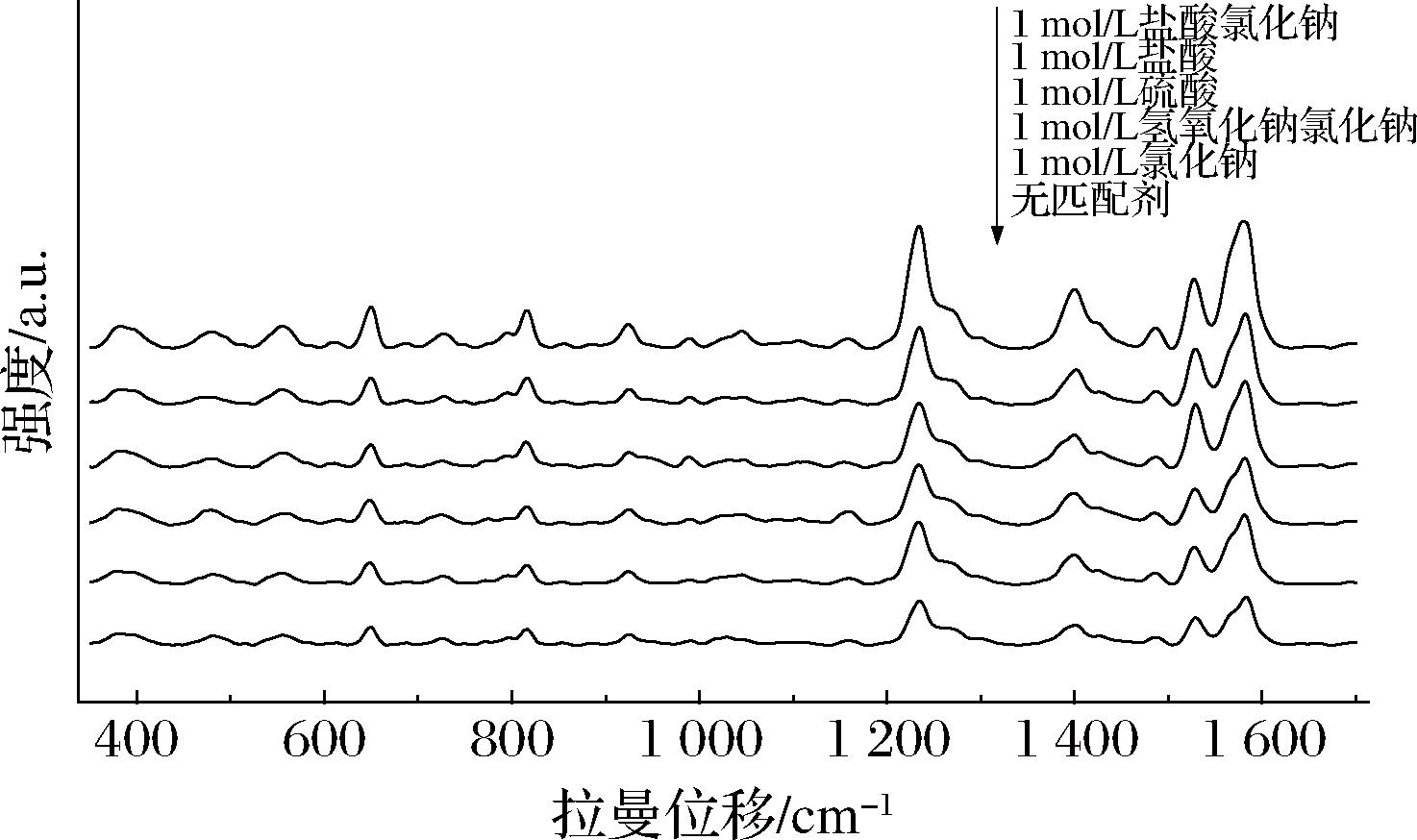
图3 五种匹配剂的西地那非SERS谱图
Fig.3 Sildenafil SERS spectra of 5 kinds of aggregating agents
2.4.1 提取溶剂的优化
鉴于90种PDE5is均易溶于有机溶剂,难溶或不溶于水,本研究选择西地那非蒸馏酒加标溶液作为检测对象,考察了乙酸乙酯、乙腈、二氯甲烷、异丙醇、甲醇5种溶剂对西地那非的提取效果。如图4所示,当乙酸乙酯和乙腈作为提取溶剂时,西地那非的SERS特征峰清晰且强度较高,同时溶剂峰的干扰相对较少。
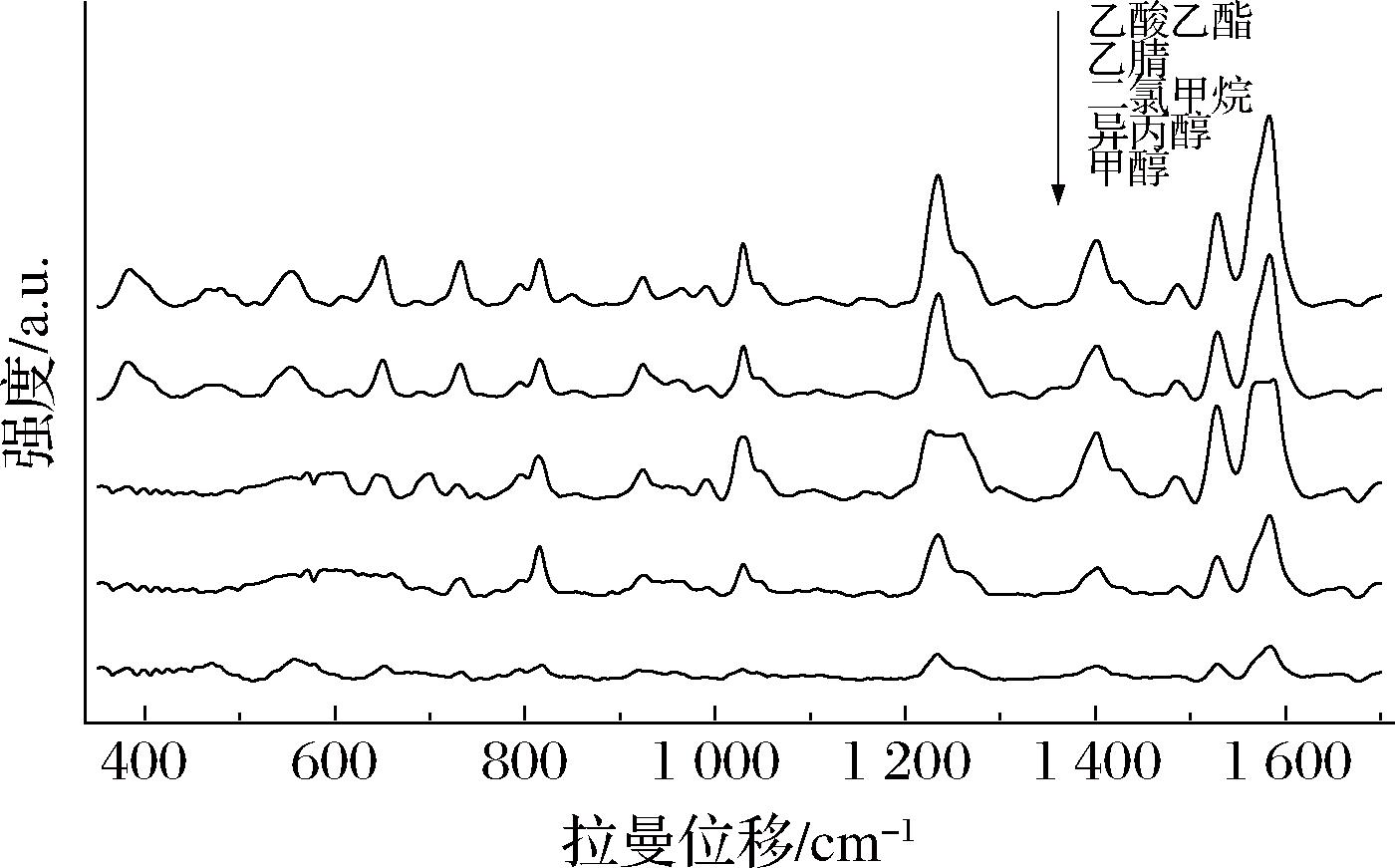
图4 五种提取溶剂的西地那非SERS谱图
Fig.4 Sildenafil SERS spectra of 5 kinds of extraction solvents
2.4.2 前处理方法的优化
由于保健酒和口服液的基质组成复杂,既含有乙醇、有机酸、色素、多糖等辅料成分,还含有西洋参、三七、淫羊藿等中药材成分,因此在检测液体保健食品之前,需要进行样品前处理以去除杂质,提高目标物质的提取效率。本研究将西地那非、硫代西地那非、他达拉非和乙酰伐地那非分别加入空白保健酒中制成保健酒加标溶液,比较了5种前处理方法的提取效果:第1种为乙腈提取后,硫酸酸化;第2种为乙腈提取后,进行QuEChERS;第3种为乙腈提取、硫酸酸化后,进行QuEChERS;第4种为乙酸乙酯提取后,硫酸酸化;第5种为乙酸乙酯提取、硫酸酸化后,进行QuEChERS。在QuEChERS方法中,使用无水MgSO4和NaCl作为萃取盐,PSA和C18作为吸附剂。此外,由于保健酒和口服液基质中含水量较高,本研究向样品的乙腈溶液和乙酸乙酯溶液中分别加入了少量NaCl固体,以提高前处理效果。
图5为5种前处理方法提取保健酒加标溶液的SERS谱图,结果显示,对于西地那非保健酒加标溶液,第4种前处理方法效果最好,第1种次之;对于硫代西地那非保健酒加标溶液,第2种效果最好,第1种次之;对于乙酰伐地那非或他达拉非的保健酒加标溶液,第1种方法均为最佳,故本研究最终选用第1种前处理方法。此外,前处理过程中加入的酸性试剂在SERS谱图的1 030 cm-1和1 528 cm-1位置产生了干扰峰,其中1 528 cm-1可能对西地那非类PDE5is的检测造成干扰,故检测该类物质时应优先以其他特征峰作为判定依据。
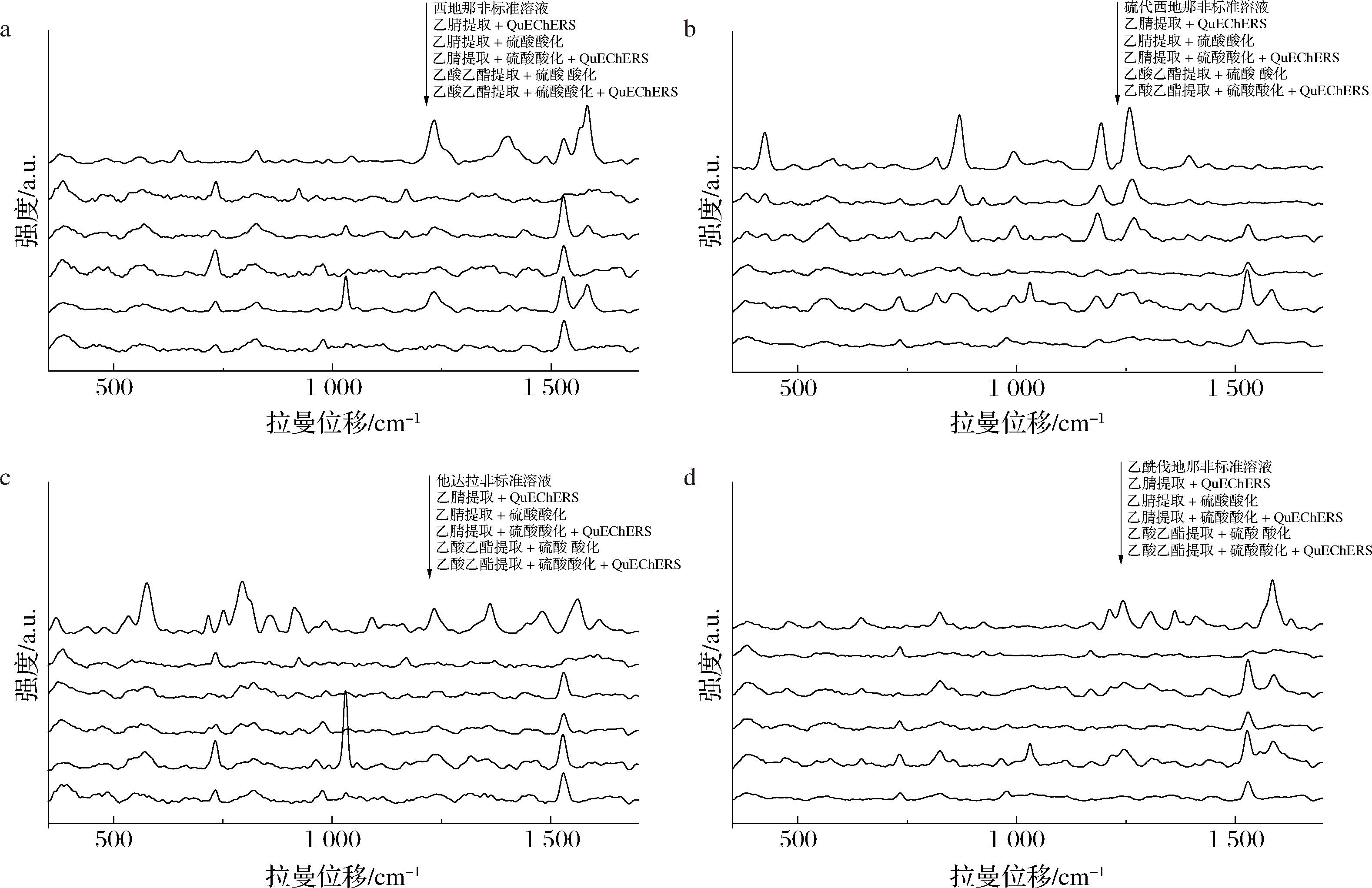
a-西地那非;b-硫代西地那非;c-他达拉非;d-乙酰伐地那非
图5 不同前处理方法的保健酒中PDE5is的SERS谱图
Fig.5 SERS spectra of PDE5is in health wine with different pretreatment methods
2.4.3 前处理溶剂体积的优化
为了提升前处理效果,本研究对前处理溶剂体积进行优化。以四类PDE5is代表性物质的SERS最高特征峰作为观察指标,通过正交实验法分别考察了样品与乙腈体积比,样品提取液与硫酸溶液体积比对SERS特征峰强度的影响。当样品与乙腈体积比为1∶2,样品提取液与硫酸溶液体积比为1∶4时,他达拉非和乙酰伐地那非的选定特征峰强度最高,西地那非和硫代西地那非的选定特征峰强度分别位列第二位和第三位,如表1所示。
表1 前处理溶剂体积对特征峰强度的影响
Table 1 Effect of pretreatment reagent volume on SERS spectral intensity

V(样品)∶V(乙腈)V(样品提取液)∶V(硫酸溶液)西地那非(1 582±5) cm-1硫代西地那非(1 258±5) cm-1他达拉非(794±5) cm-1乙酰伐地那非(1 585±5) cm-11∶11∶1600.832 380.361 841.651 368.831∶11∶2934.982 007.291 363.214 347.041∶11∶41 154.601 877.417 847.185 476.181∶21∶1897.675 573.432 312.443 757.281∶21∶22 238.633 311.295 145.634 428.781∶21∶46 165.195 638.938 183.2218 263.61∶41∶12 944.995 722.097 121.376 844.71∶41∶24 136.588 750.767 076.7312 917.51∶41∶47 892.663 487.585 193.4713 449.5
采用上述优化的前处理条件对PDE5is口服液加标样品进行前处理。
具体操作为:取1 mL口服液加标样品于离心管中,加入2 mL乙腈,充分混合后加入少量NaCl固体,涡旋并离心后取1 mL上清液与4 mL 0.3 mol/L硫酸溶液混合,涡旋后进行SERS检测。图6的检测结果表明,该最优前处理条件同样适用于口服液中PDE5is的SERS检测。

a-西地那非;b-硫代西地那非;c-他达拉非;d-乙酰伐地那非
图6 口服液中PDE5is的SERS谱图
Fig.6 SERS spectra of PDE5is in oral fluid
本研究通过测定检出限和评估重复性,对建立的SERS检测方法进行了方法学验证。在与保健食品中非法添加PDE5is的现有快速检测方法的比较中,本研究方法展现出对90种PDE5is的通用性优势和较好的操作简便性(表2)。以上均证实了本方法在实际检测中的应用价值。
表2 保健食品中非法添加PDE5is快速检测方法比较
Table 2 Comparison of rapid detection methods of illegally added PDE5 inhibitors in health foods

快检方法优点缺点基质类型目标物检出限参考文献电化学分析法(极谱法、伏安法、电位法等)操作简单、相应快速、灵敏度高电极制备过程复杂,可能存在背景信号干扰保健食品药物制剂西地那非和他达拉非西地那非—3.3×10-11 mol/L[25][26]免疫分析法(免疫层析、侧流免疫层析等)操作简单快速、灵敏度高、特异性强只能检测具有免疫活性的物质,对不同PDE5is需要制备不同抗体保健酒、口服液、固体类保健食品保健食品西地那非等13种PDE5is西地那非等6种PDE5is0.12 ng/mL0.32~6.52 ng/mL[27][28]常压电离质谱法(大气压固体分析探针、解析电喷雾电离-质谱成像等)检测速度快、分辨率高、准确度和灵敏度高设备昂贵、维护成本高,对操作人员要求高咖啡粉末、胶囊类保健食品咖啡粉末、胶囊、片剂类保健食品西地那非西地那非等9种PDE5is10~20 μg/mL5~50 μg/mL[29][30]显色反应简便、快速、设备最为小巧便携检测范围窄、灵敏度较低胶囊、片剂、液体等类别保健食品西地那非等12种PDE5is5~20 μg/mL[31]薄层色谱法操作简便、成本低廉灵敏度较低、重复性差,所需试剂种类较多,存在污染问题胶囊、片剂类保健食品西地那非、他达拉非—[32]红外光谱法(衰减全反射红外光谱、近红外光谱等)操作简单、样品用量少且无损对操作系统要求高,需要特定的化学计量学模型,易受其他组分干扰片剂类保健食品西地那非、他达拉非、伐地那非3%~6%[33]表面增强拉曼光谱法检测速度快、荧光背景低、指纹特征性强、通用性强需要特定增强试剂、定量能力弱保健酒、口服液等液体类保健食品西地那非等90种PDE5is1~10 μg/mL—
注:—表示“未检出”。
2.5.1 检出限
对90种PDE5is的SERS检出限进行了研究,确定其检出限为1~10 μg/mL,如附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.040698)所示。以他达拉非为例,其SERS特征峰强度随浓度降低而减弱,当质量浓度低至5 μg/mL时,特征峰仍可辨认,而当质量浓度降至1 μg/mL时,特征峰消失,无法辨认,如图7所示。据此确定他达拉非在液体保健食品中的检出限为5 μg/mL,其他PDE5is的检出限通过相同方法确定。
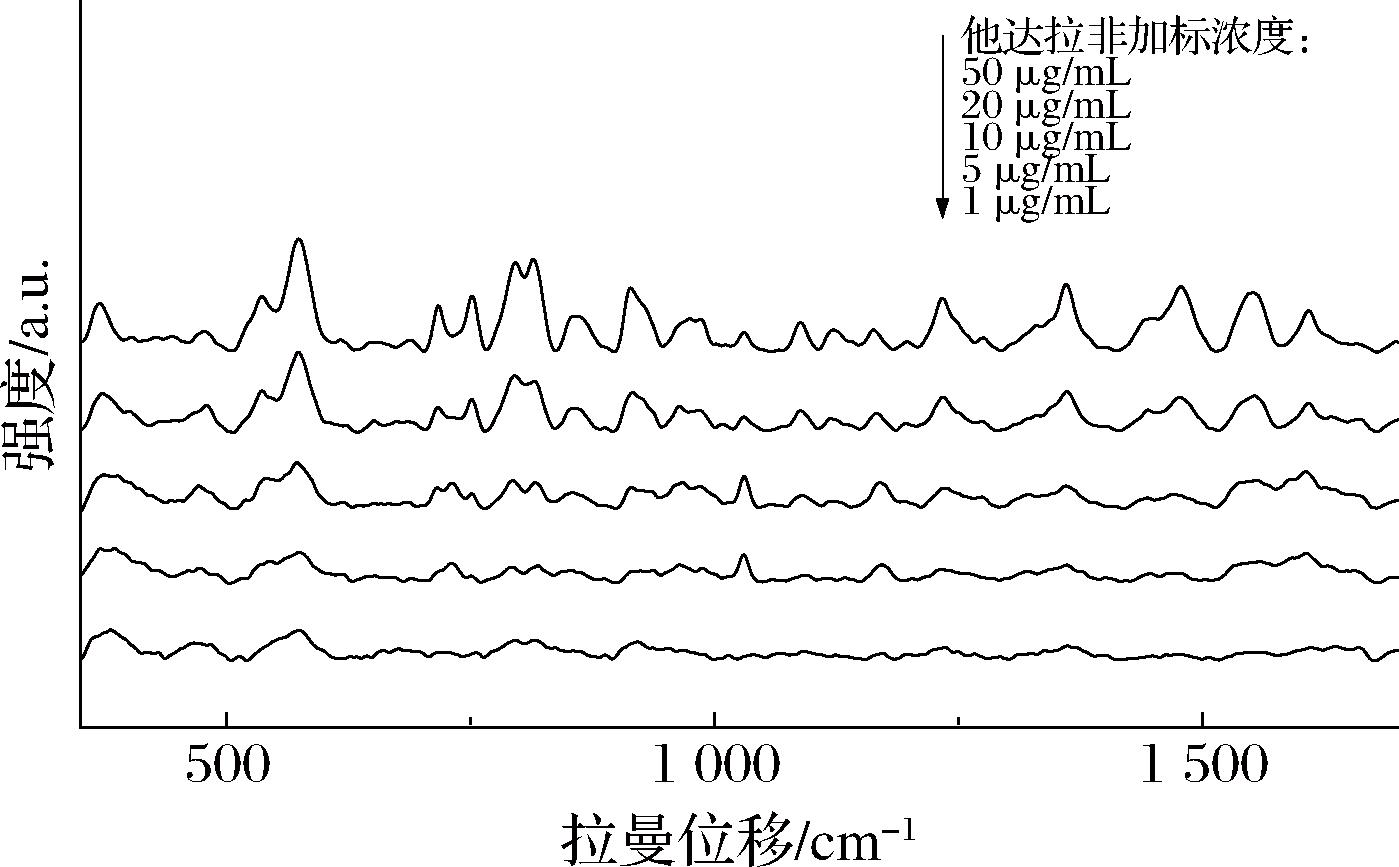
图7 液体保健食品中不同浓度他达拉非的SERS谱图
Fig.7 SERS spectra of tadalafil at different concentrations in liquid health foods
2.5.2 重复性
考虑到溶胶中纳米颗粒分布的均匀性对拉曼检测信号稳定性的影响[24],本研究对硫代西地那非保健酒加标溶液进行了10次SERS检测,如图8所示,10次检测的特征峰数量、强度和峰形基本一致,在1 258 cm-1处计算出的相对标准偏差(relative standard deviation,RSD)为5.06%,证明了该方法具有良好的重复性。

图8 SERS光谱的重复性
Fig.8 The repeatability of SERS spectra
使用本研究建立的实验方法对某食药环部门查缴的7种保健酒和11种口服液进行SERS检测。匹配度为仪器中样品谱图与PDE5is标准谱图自动比对的结果,匹配度>80%时,判定为PDE5is阳性,匹配度越高,阳性结果越可靠。
实际样品的SERS检测结果如表3所示,其中7号保健酒样品与硫代西地那非类的谱图匹配度达到95%,匹配度较高的5种药物分别为硫代艾地那非(90.57%)、硫代西地那非(86.76%)、硫代豪莫西地那非(85.91%)、羟基硫代豪莫西地那非(85.77%)和丙氧苯基硫代羟基豪莫西地那非(84.88%)。7号保健酒样品与硫代艾地那非标准溶液的SERS谱图如图9所示,可判定7号保健酒样品为硫代艾地那非阳性。随后采用液相色谱质谱联用法对上述SERS结论进行验证,检测结果一致。而1~6号保健酒样品和11种口服液样品的匹配度均小于80%,未检出非法添加PDE5is。
表3 实际样品的SERS检测结果
Table 3 SERS results of actual samples
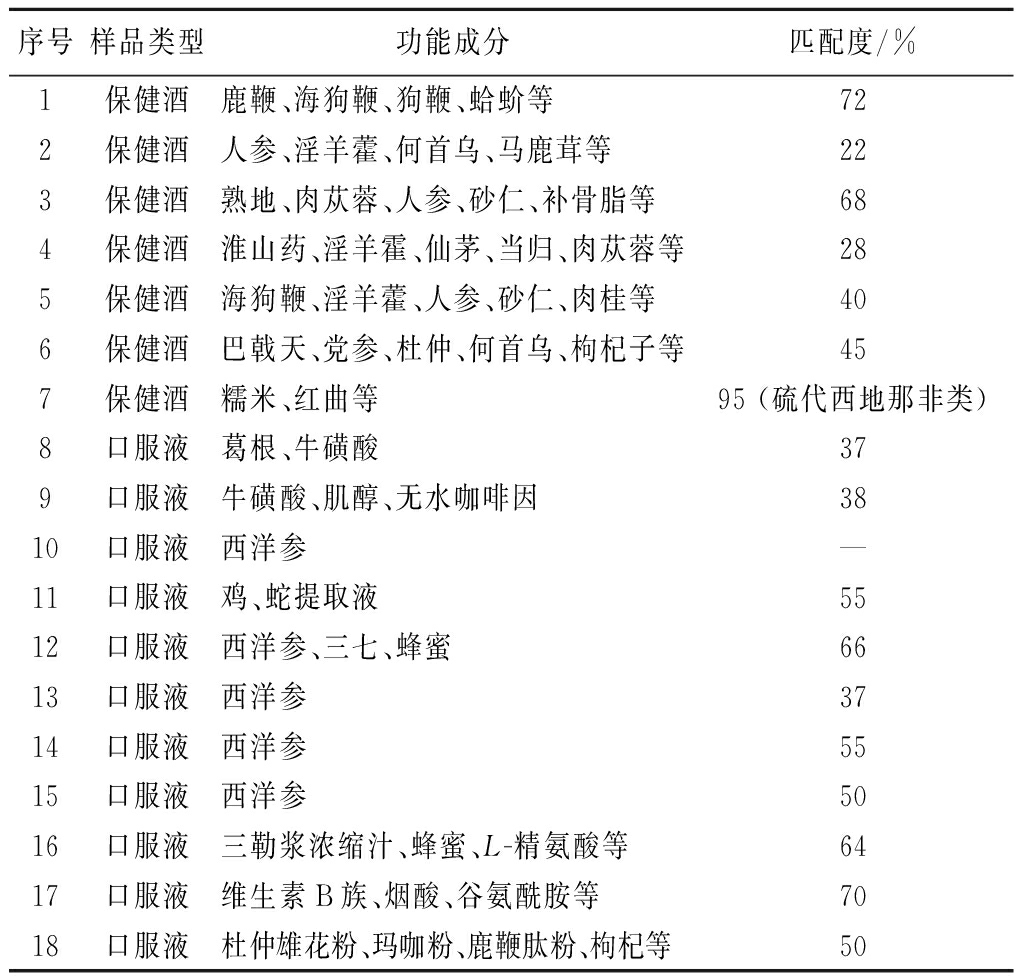
序号样品类型功能成分匹配度/%1保健酒鹿鞭、海狗鞭、狗鞭、蛤蚧等722保健酒人参、淫羊藿、何首乌、马鹿茸等223保健酒熟地、肉苁蓉、人参、砂仁、补骨脂等684保健酒淮山药、淫羊霍、仙茅、当归、肉苁蓉等285保健酒海狗鞭、淫羊藿、人参、砂仁、肉桂等406保健酒巴戟天、党参、杜仲、何首乌、枸杞子等457保健酒糯米、红曲等95 (硫代西地那非类)8口服液葛根、牛磺酸379口服液牛磺酸、肌醇、无水咖啡因3810口服液西洋参—11口服液鸡、蛇提取液5512口服液西洋参、三七、蜂蜜6613口服液西洋参3714口服液西洋参5515口服液西洋参5016口服液三勒浆浓缩汁、蜂蜜、L-精氨酸等6417口服液维生素B族、烟酸、谷氨酰胺等7018口服液杜仲雄花粉、玛咖粉、鹿鞭肽粉、枸杞等50
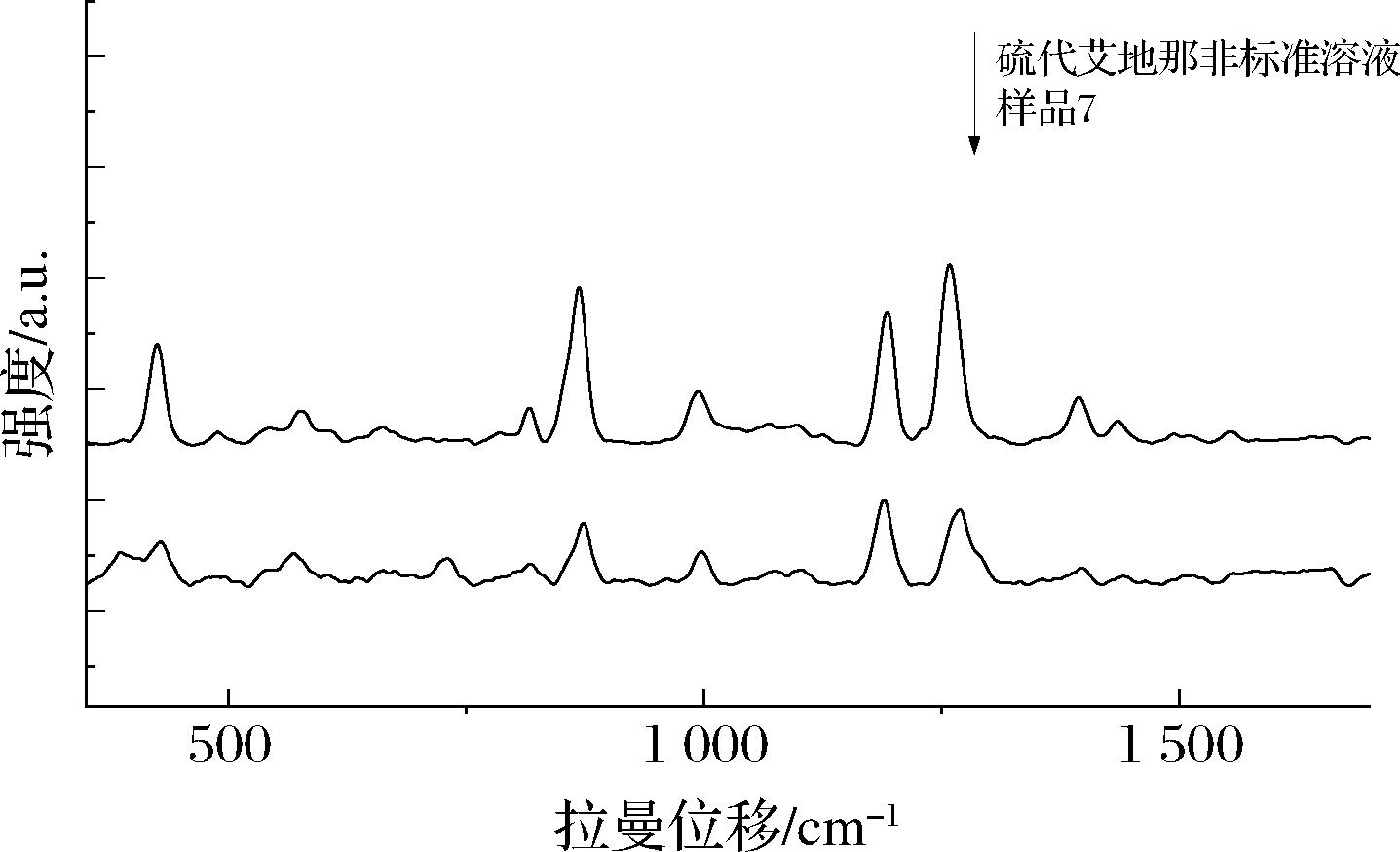
图9 7号保健酒样品与硫代艾地那非标准溶液的SERS谱图
Fig.9 The SERS spectra of health wine sample No.7 and thioaildenafil
本研究基于自制金溶胶增强试剂和表面增强拉曼光谱技术,建立了一种针对液体保健食品中90种非法添加PDE5is的快速筛查方法。通过匹配剂考察,提取溶剂和前处理方法的优化,实现了对西地那非类、硫代西地那非类、他达拉非类和伐地那非类PDE5is的灵敏检测,其检出限为1~10 μg/mL。实际案例的验证结果表明,该方法具有操作简单、灵敏度高、重现性好等优点,可准确区分并定性PDE5is类别,提供疑似药物的名称,满足了食药环部门对液体保健食品的日常抽检和现场快速检测需求,为相关工作提供了可行的技术支持。
尽管本研究方法在快速筛查非法添加的PDE5is方面表现出应用潜力,但仍存在一些局限性:首先,方法在定量分析方面的能力欠缺,未来研究中,需要进一步优化实验条件,提高方法的定量可行性,以满足更广泛的应用需求;其次,金溶胶纳米颗粒的均匀性和稳定性可能限制了方法在不同实验室间的重现性,未来将探索更稳定的增强试剂,以提高方法的通用性和可靠性;此外,本研究主要针对已知PDE5is,对于新出现的或未知的非法添加物质,方法的适用性可能需要进一步评估和调整。
[1] MUSCHIETTI L, REDKO F, ULLOA J. Adulterants in selected dietary supplements and their detection methods[J]. Drug Testing and Analysis, 2020, 12(7):861-886.
[2] 宁霄, 张伟清, 王钢力, 等. 保健食品中非法添加药物的检测现状及筛查策略研究[J]. 食品安全质量检测学报, 2015, 6(5):1876-1882.NING X, ZHANG W Q, WANG G L, et al. Detection status and screening strategy of illegally added drugs in healthy food[J]. Journal of Food Safety &Quality, 2015, 6(5):1876-1882.
[3] 田甜, 覃艳淑, 赵德恩, 等. 食品和保健食品中非法添加药物的筛查探究[J]. 食品安全质量检测学报, 2021, 12(3):1200-1208.TIAN T, QIN Y S, ZHAO D E, et al. Research of screening of illegal added drugs in food and health food[J]. Journal of Food Safety &Quality, 2021, 12(3):1200-1208.
[4] CORONA G, RASTRELLI G, BURRI A, et al. First-generation phosphodiesterase type 5 inhibitors dropout: A comprehensive review and meta-analysis[J]. Andrology, 2016, 4(6):1002-1009.
[5] NAGASAWA S, SAKA K J, YAMAGISHI Y, et al. Association between sexual activity-related death and non-prescription use of phosphodiesterase type 5 inhibitors[J]. Legal Medicine, 2021, 48:101815.
[6] EIDEN C, LAUREAU M, RICHEVAL C, et al. Acute cardiovascular disorders related to aphrodisiac honey (“Jaguar power”) consumption: Warning of unintentional exposure to Sildenafil[J]. La Revue de Medecine Interne, 2022, 43(1):68-69.
[7] 刘素丽. 食品中非法添加物质情况及其检测方法研究概述[J]. 中国食品药品监管, 2022(8):90-95.LIU S L. Research on illegally added substances and the relevant detection methods in food[J]. China Food &Drug Administration Magazine, 2022(8):90-95.
[8] 陈燕, 严丽娟, 徐敦明, 等. 高效液相色谱-串联质谱法同时检测蒸馏酒及其配制酒中90种那非类物质[J]. 分析测试学报, 2023, 42(5):519-530.CHEN Y, YAN L J, XU D M, et al. Simultaneous determination of 90 nafils in distilled liquor and its products by QuEChERS/high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2023, 42(5):519-530.
[9] LEE J H, PARK O R, YANG Y J, et al. Detection of 94 PDE-5is and their analogs including N-desmethylthiosildenafil in various formulations of dietary supplements and food samples using HPLC and LC-Q-TOF/MS[J]. Journal of Chromatographic Science, 2022, 60(10):953-962.
[10] KIM U, CHO H D, KANG M H, et al. Screening of phosphodiesterase-5 inhibitors and their analogs in dietary supplements by liquid chromatography-hybrid ion trap-time of flight mass spectrometry[J]. Molecules, 2020, 25(12):2734.
[11] NGUYEN T O, TRAN C S, DO T T H, et al. Rapid screening and quantitative determination of illegal phosphodiesterase type 5 inhibitors (PDE-5i) in herbal dietary supplements[J]. Journal of Analytical Methods in Chemistry, 2021, 2021(1):5579500.
[12] 孙婷婷, 徐彦红, 张雪梅, 等. HPLC法快速筛查保健酒中那非药物及质谱确证[J]. 食品研究与开发, 2018, 39(17):197-204.SUN T T, XU Y H, ZHANG X M, et al. Rapid determination of nafil drug in health wine by high performance liquid chromatography and their verification by mass spectrometry[J]. Food Research and Development, 2018, 39(17):197-204.
[13] 郑娟梅, 余婉松, 覃文霞, 等. 表面增强拉曼光谱法快速测定保健酒中西地那非[J]. 食品安全质量检测学报, 2018, 9(21):5659-5665.ZHENG J M, YU W S, QIN W X, et al. Rapid determination of Sildenafil in health wine by surface-enhanced Raman scattering[J]. Journal of Food Safety &Quality, 2018, 9(21):5659-5665.
[14] 吴国萍, 周亚红, 李静泉, 等. 表面增强拉曼光谱测定保健品中非法添加物西地那非[J]. 食品工业科技, 2019, 40(11):254-259; 264.WU G P, ZHOU Y H, LI J Q, et al. Surface enhanced Raman spectroscopy(SERS) for the detection of Sildenafil in health care products[J]. Science and Technology of Food Industry, 2019, 40(11):254-259; 264.
[15] 司星宇, 陈致, 周千渝, 等. 保健品中西地那非和他达拉非的拉曼光谱同时检测方法研究[J]. 光散射学报, 2022, 34(1):30-35.SI X Y, CHEN Z, ZHOU Q Y, et al. Simultaneous detection of Sildenafil and tadalafil in healthcare products by Raman spectroscopy[J]. The Journal of Light Scattering, 2022, 34(1):30-35.
[16] 胡家勇, 彭青枝, 张莉, 等. 表面增强拉曼光谱技术在快速检测保健食品中非法添加药物中的应用[J]. 食品安全质量检测学报, 2021, 12(1):7-15.HU J Y, PENG Q Z, ZHANG L, et al. Application of surface-enhanced Raman spectroscopy in the rapid detection of illegal additives in health food[J]. Journal of Food Safety &Quality, 2021, 12(1):7-15.
[17] FRENS G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J]. Nature Physical Science, 1973, 241(105):20-22.
[18] HAISS W, THANH N T K, AVEYARD J, et al. Determination of size and concentration of gold nanoparticles from UV-vis spectra[J]. Analytical Chemistry, 2007, 79(11):4215-4221.
[19] HU J Y, ZHOU T H, YAO X F, et al. Screening of PDE-5 inhibitors in health wine by surface-enhanced Raman spectroscopy[J]. Food and Machinery, 2022, 38(9):64-71.
[20] 李丹, 姬瑞瑞, 陈辉, 等. 手持式拉曼光谱快速检测功能饮料非法添加西地那非的研究[J]. 海军医学杂志, 2019, 40(5):436-439.LI D, JI R R, CHEN H, et al. Rapid detection of illegal addition of Sildenafil citrate in functional beverage by nano-surface enhanced Raman spectroscopy[J]. Journal of Navy Medicine, 2019, 40(5):436-439.
[21] WANG H M, LI L L, CHEN H B, et al. Simultaneous detection of sildenafil and tadalafil in healthcare products by Raman spectroscopy[J]. Chemical Journal Of Chinese Universities, 2017, 38(6): 1040-1045.
[22] 李秀明, 李金阳, 刘新兰. 纳米银溶胶稳定性的考察及其对表面增强拉曼光谱检测的影响[J]. 药物分析杂志, 2013, 33(6):1048-1053.LI X M, LI J Y, LIU X L. Stability of nano silver particles and the influence on surface-enhanced Raman spectroscopic detection[J]. Chinese Journal of Pharmaceutical Analysis, 2013, 33(6):1048-1053.
[23] YING Y, TANG Z Y, LIU Y L. Material design, development, and trend for surface-enhanced Raman scattering substrates[J]. Nanoscale, 2023, 15(26):10860-10881.
[24] 冯彦婷, 林沛纯, 谢慧风, 等. 基于纳米银颗粒团聚反应的表面增强拉曼光谱法测定牛奶中三聚氰胺的含量[J]. 食品与发酵工业, 2019, 45(15):256-261.FENG Y T, LIN P C, XIE H F, et al. Determination of melamine in milk based on silver nanoparticles aggregation by surface enhanced Raman spectroscopy[J]. Food and Fermentation Industries, 2019, 45(15):256-261.
[25] DA SILVEIRA G D, BRESSAN L P, SCHMIDT M E P, et al. Electrochemical behavior of 5-type phosphodiesterase inhibitory drugs in solid state by voltammetry of immobilized microparticles[J]. Journal of Solid State Electrochemistry, 2020, 24(8):1999-2010.
[26] ROUHANI M, SOLEYMANPOUR A. Molecularly imprinted Sol-gel electrochemical sensor for Sildenafil based on a pencil graphite electrode modified by Preyssler heteropolyacid/gold nanoparticles/MWCNT nanocomposite[J]. Mikrochimica Acta, 2020, 187(9):512.
[27] HE F, YANG J Y, ZOU T T, et al. A gold nanoparticle-based immunochromatographic assay for simultaneous detection of multiplex Sildenafil adulterants in health food by only one antibody[J]. Analytica Chimica Acta, 2021, 1141:1-12.
[28] SONG M S, WU Q, LIU B B, et al. Using a quantum dot bead-based lateral flow immunoassay to broadly detect the adulteration of PDE-5 inhibitors in functional foods[J]. Analytical Methods, 2022, 14(26):2586-2595.
[29] WANG X Y, HUANG M, LI X G, et al. Rapid screening of illegal additives in functional food using atmospheric pressure solids analysis probe coupled to a portable mass spectrometer[J]. Journal of Pharmaceutical and Biomedical Analysis, 2022, 214:114722.
[30] QI R R, WANG X Y, HUANG M, et al. Rapid screening of illegal additives in functional food using desorption electrospray ionization mass spectrometry imaging[J]. Journal of Pharmaceutical and Biomedical Analysis, 2023, 229:115351.
[31] ICHIKAWA-KAJI Y, ISHIZAWA F, NISHIYAMA R, et al. Development of a detector tube for screening tadalafil and its analogues in adulterated sexual enhancement products[J]. Drug Testing and Analysis, 2023, 15(3):345-360.
[32] GHEORGHIU O R C, CIOBANU A M, GUTU C M, et al. Determination of phosphodiesterase type-5 inhibitors (PDE-5) in dietary supplements[J]. Molecules, 2023, 28(10):4116.
[33] PIORUNSKA-SEDLAK K, STYPULKOWSKA K. Selectivity of identification of compounds from the group of phosphodiesterase-5 inhibitors (PDE-5i) in falsified products from the Polish market using attenuated total reflectance Fourier transform infrared spectroscopy and X-ray powder diffraction[J]. Science &Justice, 2021, 61(6):714-722.