肠膜明串珠菌胞外多糖的合成途径、生物活性及其在食品领域中的研究进展
杨绍华,李萌萌,张丽丽,刘远晓,贺昕,宋云飞,杨硕,关二旗,卞科*
(河南工业大学 粮油食品学院,河南 郑州,450001)
摘 要 肠膜明串珠菌胞外多糖(exopolysaccharide,EPS)是肠膜明串珠菌在生长代谢过程中分泌到细菌细胞壁外的一类次级代谢产物,具有良好的生物活性,可应用在食品领域中以改善产品品质及性能。该文概述了肠膜明串珠菌EPS的合成路径、影响因素及其生物活性,论述了其在食品领域中的功能特性和研究进展,旨在对肠膜明串珠菌EPS在食品行业中的进一步开发应用提供理论基础。
关键词 肠膜明串珠菌;胞外多糖;合成路径;生物活性;功能特性
DOI:10.13995/j.cnki.11-1802/ts.040498
引用格式:杨绍华,李萌萌,张丽丽,等.肠膜明串珠菌胞外多糖的合成途径、生物活性及其在食品领域中的研究进展[J].食品与发酵工业,2025,51(14):380-390.
YANG Shaohua,LI Mengmeng,ZHANG Lili, et al.Synthesis pathway, biological activity, and research advance in food industry of exopolysaccharide from Leuconostoc mesenteroides[J].Food and Fermentation Industries,2025,51(14):380-390.
第一作者:硕士研究生(卞科教授为通信作者,E-mail:kebian@163.com)
基金项目:十四五国家重点研发计划项目(2021YFD2100903);2024年度河南省青年骨干教师支持计划项目(2024GGJS057);河南小麦产业技术体系建设专项(HARS-22-01-G7)
收稿日期:2024-07-17,改回日期:2024-11-12
多糖是组成细胞结构的关键组分之一,其通式为Cn(H2O)n-1,是由单糖单元通过糖苷键连接形成的聚合物,这些聚合物可以是由同一单糖单元组成的均聚物,也可以是以不同单糖单元组成的杂聚物[1]。微生物是多糖的主要生产者之一,微生物多糖主要包括胞内多糖、结构多糖以及胞外多糖,其中胞外多糖作为微生物产出的防御性大分子物质,具有保护微生物在缺乏营养、高盐、高温等极端条件下生存的作用[2]。相关研究表明,微生物胞外多糖(exopolysaccharide,EPS)具有抗肿瘤、抗氧化、降低胆固醇、提高机体免疫力、调节消化道和肠道等多种生物活性,同时,EPS优良的益生元活性和流变特性使其可以作为食品中的增稠剂、稳定剂和胶凝剂[3]。经过不断的研究发展,EPS在食品行业中展现出优秀的潜在价值,从而成为当前最为活跃的研究话题之一。
肠膜明串珠菌属于乳酸菌中的明串珠菌属,而乳酸菌(lactic acid bacteria,LAB)作为“通认安全”(generally regarded as safe,GRAS)细菌,对宿主没有致病性,可以添加到食品中以改善产品品质[4]。肠膜明串珠菌一般存在于植物体表,是一种兼性厌氧的革兰氏阳性菌,由单独或成对的短链组成,以球菌的形式出现,常被应用于发酵乳制品、青贮、泡菜和果酒等食品行业中[5]。作为一种特异性异质发酵乳酸菌,肠膜明串珠菌可以在发酵过程中利用不同的底物和代谢途径产生不同类型的EPS。其中,肠膜明串珠菌可在人为控制的条件下,发酵蔗糖合成大量的α-葡聚糖,是目前产生EPS类型中应用最广泛、成分占比最高的。α-葡聚糖作为血浆代用品的主要组成成分,可在输血过程中代替一部分全血而应用在医药领域[6]。除此之外,在发酵产生EPS的同时,肠膜明串珠菌还会产生大量有机酸、醇类和各种氨基酸等代谢物质,具有抗菌、维持人体消化道健康等多种生理功效和保健功能[7]。本文首先总结了不同来源肠膜明串珠菌EPS的种类和生产条件,并对EPS的生物活性和功能特性进行了具体解析,最后概括了肠膜明串珠菌EPS在食品加工中的研究及应用,以期为肠膜明串珠菌EPS在食品领域中更为广泛的应用和更加深入的研究提供理论参考。
1 肠膜明串珠菌EPS组分及合成路径
肠膜明串珠菌可以利用环境中的不同碳源,在细胞内通过多种代谢途径产生不同组分的EPS。与其他产EPS菌种相比,肠膜明串珠菌产生的EPS中葡聚糖含量占比较高且其能够在较短的时间内发酵产生大量葡聚糖,在正常发酵条件下,当以蔗糖为碳源时,其产生的葡聚糖含量可以达到总糖含量的95%以上[8]。同时,肠膜明串珠菌产生的葡聚糖分子质量较大,具有高分支度结构,产生的葡聚糖链主要由α-(1,6)糖苷键连接,并带有由α-(1,3)糖苷键作为分支点连接的支链,这一特殊结构赋予了肠膜明串珠菌EPS优良的物理特性和化学特性,使其在工业应用中具有明显的优势[9-11]。除熟知的葡聚糖外,肠膜明串珠菌还会产生含有如果聚糖、半乳糖、甘露醇和低聚糖等含量和组分不同的EPS。不同来源肠膜明串珠菌EPS的组成成分及主要糖苷键类型如表1所示。
表1 不同肠膜明串珠菌合成的EPS类型
Table 1 The types of EPS synthesized by different Leuconostoc mesenteroides
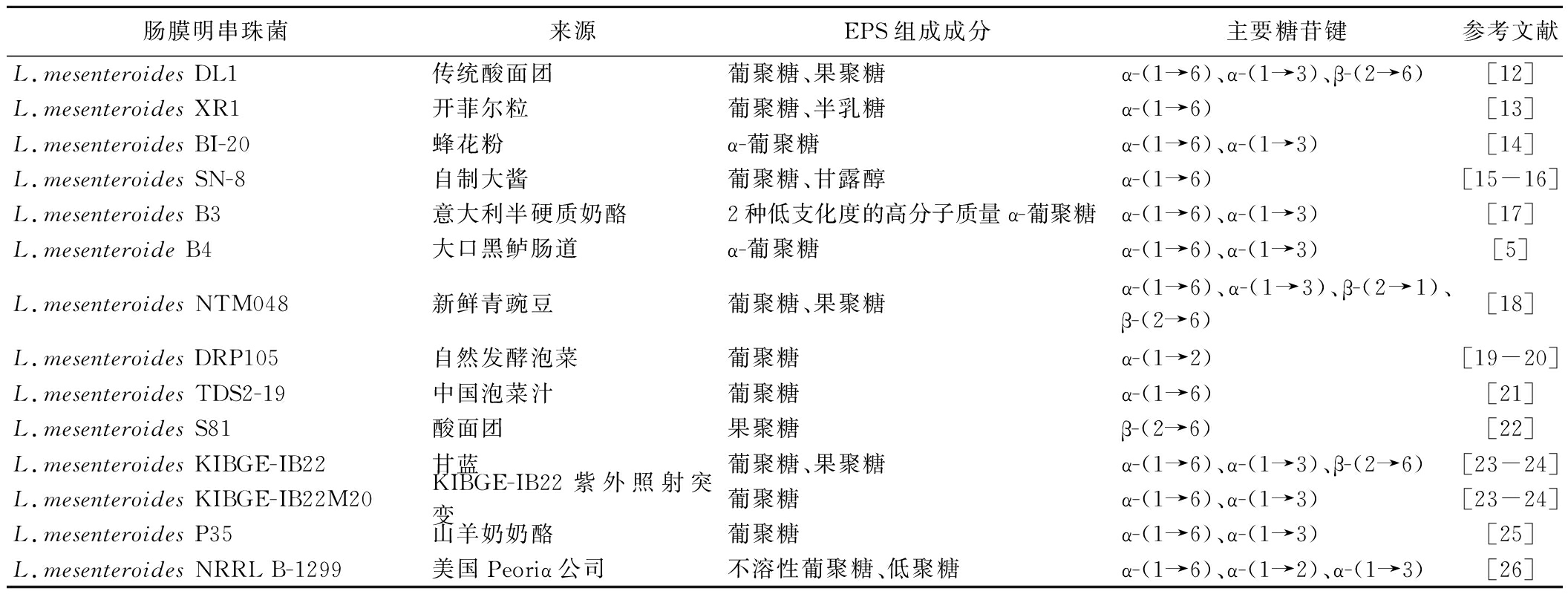
肠膜明串珠菌来源EPS组成成分主要糖苷键参考文献L.mesenteroides DL1传统酸面团葡聚糖、果聚糖α-(1→6)、α-(1→3)、β-(2→6)[12]L.mesenteroides XR1开菲尔粒葡聚糖、半乳糖α-(1→6)[13]L.mesenteroides BI-20蜂花粉α-葡聚糖α-(1→6)、α-(1→3)[14]L.mesenteroides SN-8自制大酱葡聚糖、甘露醇α-(1→6)[15-16]L.mesenteroides B3意大利半硬质奶酪2种低支化度的高分子质量α-葡聚糖α-(1→6)、α-(1→3)[17]L.mesenteroide B4大口黑鲈肠道α-葡聚糖α-(1→6)、α-(1→3)[5]L.mesenteroides NTM048新鲜青豌豆葡聚糖、果聚糖α-(1→6)、α-(1→3)、β-(2→1)、β-(2→6)[18]L.mesenteroides DRP105自然发酵泡菜葡聚糖α-(1→2)[19-20]L.mesenteroides TDS2-19中国泡菜汁葡聚糖α-(1→6)[21]L.mesenteroides S81酸面团果聚糖β-(2→6)[22]L.mesenteroides KIBGE-IB22甘蓝葡聚糖、果聚糖α-(1→6)、α-(1→3)、β-(2→6)[23-24]L.mesenteroides KIBGE-IB22M20KIBGE-IB22紫外照射突变葡聚糖α-(1→6)、α-(1→3)[23-24]L.mesenteroides P35山羊奶奶酪葡聚糖α-(1→6)、α-(1→3)[25]L.mesenteroides NRRL B-1299美国Peoriα公司不溶性葡聚糖、低聚糖α-(1→6)、α-(1→2)、α-(1→3)[26]
1.1 产葡聚糖
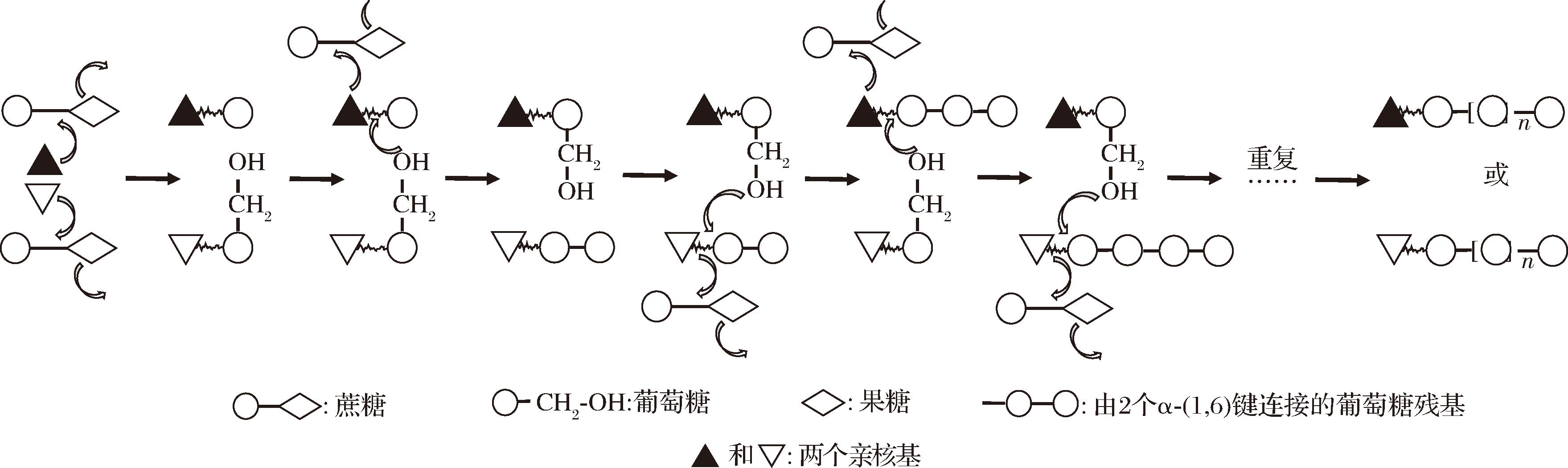
肠膜明串珠菌产葡聚糖的方式是以蔗糖为唯一底物,在葡聚糖蔗糖酶的催化作用下完成。葡聚糖蔗糖酶是一种胞外糖基转移酶, 其催化D-葡萄糖吡喃残基从蔗糖转移到葡聚糖,同时释放出果糖,并将葡萄糖基转移到与酶活性位点共价连接的葡聚糖基链的还原端[27-29]。肠膜明串珠菌由葡萄糖基合成α-(1,6)键连接的葡聚糖机制涉及2个亲核基,亲核基可以与活性位点相结合,攻击蔗糖并取代果糖后得到2个葡萄糖基中间体,形成的葡萄糖基被添加至葡聚糖链的还原端以延伸葡聚糖链,最终合成葡聚糖[30]。葡聚糖链的具体延伸机制为:一个葡萄糖基的C-6羟基基团攻击另一个葡萄糖基的C-1,形成α-(1,6)键,亲核基被释放,释放出的亲核基继续攻击另一个蔗糖分子,形成新的葡萄糖基中间体。新葡萄糖基的C-6 羟基基团继续攻击异麦芽糖基单元(正在生长的葡聚糖链)的C-1,随着葡聚糖链在还原端被拉长,葡萄糖基和葡聚糖基单元在2个亲核基之间交替转移直至延长终止,并通过受体反应释放出葡聚糖,其反应过程如图1所示[31-32]。反应发生的另一个条件是需要氢离子转移到从蔗糖中置换出的果糖基上,葡聚糖蔗糖酶的化学修饰表明,组氨酸的2个咪唑基参与葡聚糖的合成过程,这2个咪唑基将它们的氢离子供给到置换出的果糖单元上。在葡萄糖基C-6羟基基团攻击另一个葡萄糖基的C-1时,咪唑基从羟基上抽离一个质子而被重新复原,促进亲核攻击和α-(1,6)键的形成[30,33]。
1.2 产低聚糖
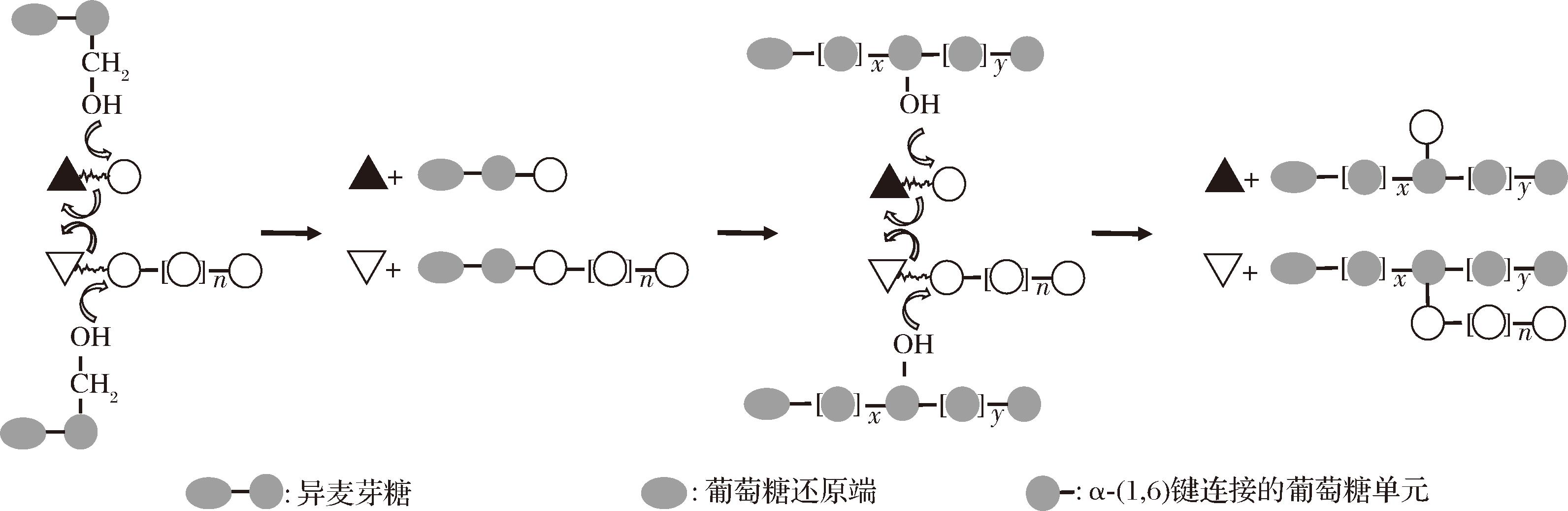
肠膜明串珠菌生成低聚糖的过程同样需要葡聚糖蔗糖酶的参与。当在葡聚糖蔗糖酶酶解过程中引入蔗糖以外的其他受体糖(如麦芽糖)时,会致使蔗糖中的葡萄糖残基从葡聚糖的合成中转移到受体糖的游离羟基上,高分子质量的葡聚糖被转化合成为低聚糖,产生的低聚糖链包含由D-吡喃葡萄糖单位构成的支链,这些支链通过α-(1,2)糖苷键与主链相连接[34-36]。具体合成机制为:受体糖可以与酶-葡萄糖基或酶-葡聚糖基中间体相互作用,从酶活性位点释放葡萄糖或葡聚糖链,葡萄糖或葡聚糖链被转移到受体葡萄糖基的非还原端,并在葡萄糖或葡聚糖与受体之间形成共价键。当受体从活性位点取代葡聚糖时,葡聚糖链的聚合被终止,之后反应体系再利用形成的高分子质量葡聚糖为受体糖,受体葡聚糖链上的C-3羟基会攻击葡萄糖基或葡聚糖基单元的C-1,释放葡萄糖或葡聚糖亲核基复合物,并在受体葡聚糖和来自亲核基复合物中的葡萄糖或葡聚糖链间形成分支键,进而形成同源的α-(1,4)和α-(1,6)低聚糖,其反应过程如图2所示[29,35, 37-38]。
1.3 产甘露醇
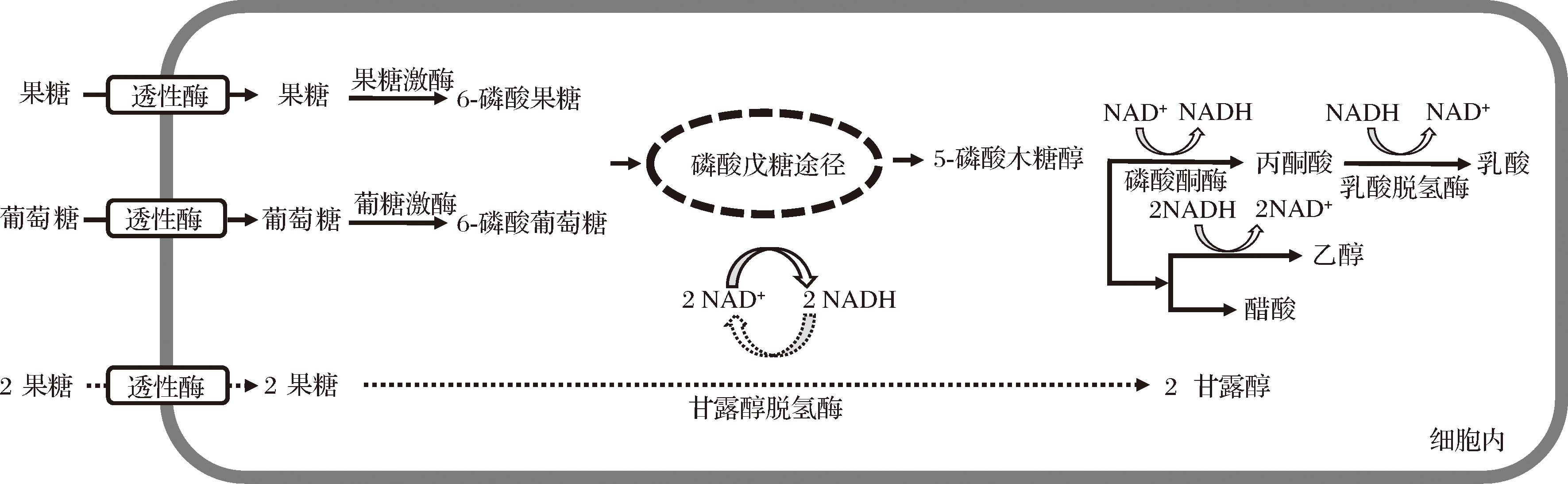
甘露醇的合成能力在不同类型乳酸菌中存在明显差异。研究发现,产甘露醇能力强的大多数为异型发酵乳酸菌[39],肠膜明串珠菌作为异型发酵乳酸菌的典型代表之一,由于其基因组内缺少醛缩酶基因,因此,不能进行糖酵解途径进行代谢,只能通过磷酸戊糖途径产生甘露醇。肠膜明串珠菌可以以葡萄糖和果糖的混合物或只以果糖为底物合成甘露醇。当葡萄糖和果糖进入膜内后,其在果糖激酶和葡糖激酶的催化作用下转变为6-磷酸葡萄糖,然后进入磷酸戊糖途径,最终生成CO2、乙醇、乙酸盐和乳酸盐的混合物以及NADH,并为细胞的生长提供能量。同时,果糖在甘露醇脱氢酶的作用下,利用生成的NADH直接转变为甘露醇,NADH在此过程中重新转变为NAD+参与到新一轮的磷酸戊糖途径。反应过程如图3所示[40-41]。
2 肠膜明串珠菌EPS产量的影响因素
肠膜明串珠菌EPS的生产受到多种因素的影响,在接种量一致的情况下,培养条件(温度、时间、初始pH等)和培养基成分(碳源、氮源、金属离子等)的细微变化便可能引起EPS产量的较大改变[42]。
2.1 培养条件对肠膜明串珠菌EPS产量的影响
2.1.1 温度和pH值对肠膜明串珠菌EPS产量的影响
微生物在一定温度和pH范围内才可以正常生长并执行不同的代谢功能,而EPS作为微生物代谢途径产物,培养温度、培养基起始pH值以及在培养过程中pH值的变化都可以显著影响其合成进程。在肠膜明串珠菌发酵产EPS的过程中,参与代谢途径的各种酶对温度、pH的变化较为敏感,微弱的温度、pH变化便可引起酶活力的较大浮动。GOYA等[43]和DU等[44]分别通过控制培养温度和培养基pH探究肠膜明串珠菌葡聚糖蔗糖酶的酶活力变化,当温度保持在23 ℃、pH值在7.0左右时,肠膜明串珠菌葡聚糖蔗糖酶的酶活性最高。但当温度过高,超过一定阈值时,肠膜明串珠菌EPS链可能会发生断裂和分解,造成EPS大量损失,LI等[15]和WANG等[45]的研究发现,当温度超过220 ℃时,肠膜明串珠菌EPS开始解聚。与极端温度条件下EPS的转化不同,在过高或过低的pH环境内,虽然葡聚糖蔗糖酶难以存活,致使肠膜明串珠菌无法利用蔗糖合成葡聚糖,但这一极端pH环境似乎会促进其他类型EPS合成反应的进行。DU等[44]和VANDAMME等[46]的研究证明在pH较低时(pH 4.9),蔗糖完全磷酸化之前就进一步转化为甘露醇,这证明较低的pH值似乎有利于提升肠膜明串珠菌甘露醇脱氢酶的活性,促进生成EPS中甘露醇的占比。
EPS的最佳产糖温度一般与菌株的最适生长温度不一致,菌株的最适生长温度一般高于微生物EPS的最适合成温度,EPS结构最为稳定时的温度也不一定是EPS产量最高时的温度。同样,适宜肠膜明串珠菌生长的pH环境与EPS产量最高时的pH环境也存在一定差异[44, 47]。虽然不同来源的肠膜明串株菌最适产糖温度和pH可能有所不同,但最适温度多聚集在25~30 ℃,最适pH多聚集在7.0左右,此时葡聚糖蔗糖酶活性良好,产生的EPS结构稳定、含量高。
2.1.2 时间对肠膜明串珠菌EPS产量的影响
微生物的生长阶段主要包括4个时期:迟缓期、对数期、稳定期以及衰亡期。不同时期EPS的产量具有较大差异。肠膜明串珠菌EPS的产生从迟缓期开始,产量最大值位于对数增长期与衰亡期之间,向发酵液内接种后,在迟缓期至稳定期期间,随着时间的延长,培养基内与EPS合成有关的酶含量明显增加,肠膜明串珠菌利用蔗糖产生EPS的效率显著提高[48]。同时由于在稳定期附近的活菌数目最多,此时整个系统利用底物产EPS的能力最强[19, 49]。因此,时间对肠膜明串株菌EPS产量的影响可归因于不同时期内总菌数以及产生酶的种类和数目不同,导致其利用底物的能力在不同阶段存在差异,进而对EPS的合成产生影响。
通过对培养条件的优化,可以显著提升肠膜明串珠菌EPS的合成能力,经过条件优化后的部分肠膜明串珠菌,其EPS产量可以比优化前的产量高出1倍以上,如表2所示。
表2 肠膜明串珠菌最适产EPS培养条件
Table 2 The optimal fermentation conditions for EPS production by Leuconostoc mesenteroides
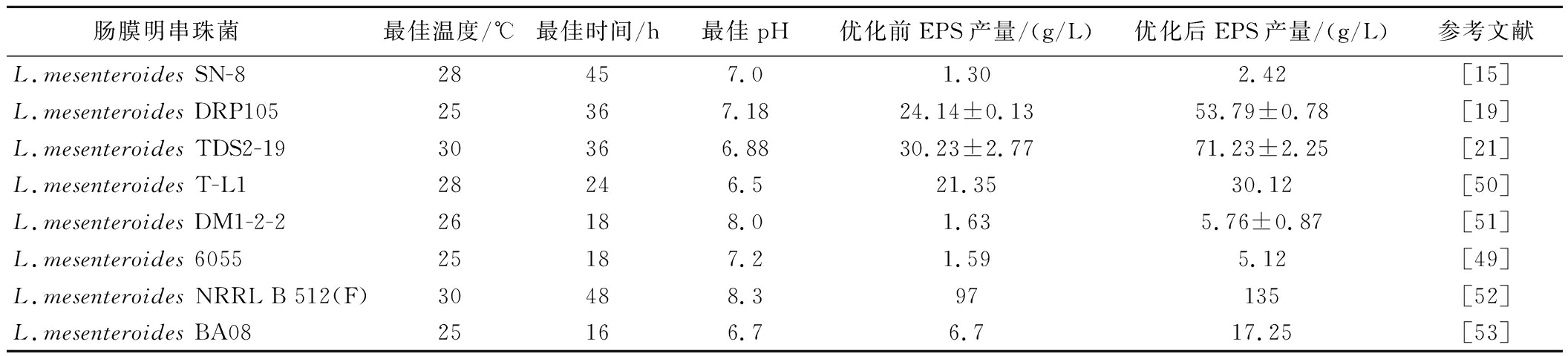
肠膜明串珠菌 最佳温度/℃最佳时间/h最佳pH优化前EPS产量/(g/L)优化后EPS产量/(g/L)参考文献L.mesenteroides SN-828457.01.302.42[15]L.mesenteroides DRP10525367.1824.14±0.1353.79±0.78[19]L.mesenteroides TDS2-1930366.8830.23±2.7771.23±2.25[21]L.mesenteroides T-L128246.521.3530.12[50]L.mesenteroides DM1-2-226188.01.635.76±0.87[51]L.mesenteroides 605525187.21.595.12[49]L.mesenteroides NRRL B 512(F)30488.397135[52]L.mesenteroides BA0825166.76.717.25[53]
2.2 培养基成分对肠膜明串珠菌EPS产量的影响
2.2.1 碳源、氮源对肠膜明串珠菌EPS产量的影响
微生物可通过碳代谢在发酵液内积累糖类物质, 碳代谢与氮代谢相互依存和限制,通过α-酮戊二酸与NH4+在谷氨酰胺合成酶和谷氨酸合成酶的联合催化来实现2种途径对微生物积累糖类过程的调节作用[54-55]。与其他碳源相比,当以蔗糖为碳源时,肠膜明串珠菌葡聚糖蔗糖酶更容易催化底物产生EPS[44]。邢瀚文[20]研究发现,当以蔗糖和以“蔗糖+葡萄糖”为碳源时,肠膜明串珠菌EPS产量并无明显变化,即葡萄糖对肠膜明串珠菌EPS产量无显著的诱导作用和抑制作用。除单独的碳源、氮源会对EPS的产量造成影响外,培养基内碳氮比也会影响EPS的合成进程。在保持其他条件一致的情况下,随着碳氮比的降低,肠膜明串珠菌生长过程中葡聚糖蔗糖酶的合成速率会逐渐减缓。同时,LOPRETTI等[56]研究显示,当在培养基中添加活性酵母提取物(氨基酸氮源)改善培养基内碳氮比时,可以稳定肠膜明串珠菌葡聚糖蔗糖酶的生产速率并缩短发酵时间,提升EPS产量,即碳氮比可能通过影响酶的合成致使肠膜明串珠菌EPS产量上的较大差异。
2.2.2 金属离子对肠膜明串珠菌EPS产量的影响
金属离子的存在会极大地影响酶的结构和功能,当金属离子同与EPS合成有关的酶结合时,它们可以对酶的催化功能产生直接影响[57]。在寻找肠膜明串珠菌最适培养基的研究中,FOUCAUD 等[58]证明金属离子是肠膜明串株菌生长的必要条件,在没有金属离子存在的情况下,其不会在培养基内生长。金属离子通过影响发酵液内的酶活而对EPS的产生造成影响。DAS等[59]和MAJUMDER等[60]研究中显示Hg2+和Mn2+等金属离子会对葡聚糖蔗糖酶产生强烈抑制作用,Ca2+、Co2+和Mg2+等金属离子则可以通过稳定蛋白质的三级结构而对葡聚糖蔗糖酶活性有显著激活作用。同时,葡聚糖蔗糖酶可被乙二胺四乙酸灭活,但可被Ca2+重新激活。这可能是因为Ca2+的加入改变了细胞膜的通透性,而且Ca2+作为某些关键酶的辅酶因子,它能与酶的结合位点相结合,增强其催化活性,从而促进EPS的合成与分泌[61]。
3 肠膜明串珠菌EPS的生物活性
肠膜明串珠菌作为公认的安全益生乳酸菌,因具有众多对人体有益的生物活性而被应用于食品领域中,这些生物活性主要依靠自身发酵产生的EPS提供,而EPS表现出的广泛活性是由单糖单元的连接方式、分子质量大小以及单糖单元上存在的取代基(氨基、羧基等)等化学结构上的差异而形成的[62]。目前研究发现肠膜明串珠菌EPS具有的生物活性主要有抗氧化、抗肿瘤、免疫调节以及益生元等[15,17,63]。
3.1 抗氧化活性
EPS作为体外抗氧化剂的分子机理可归因于其在酸性环境中发生水解的特性,这一过程将会产生大量的活性半缩醛羟基,同时在反应体系中将电子输送到自由基,促使自由基向稳定物质的转化,最终导致自由基浓度降低[64]。EPS在体内的抗氧化性能通过2种途径实现:酶途径和非酶途径。在酶途径中,EPS能够提高生物机体内多种抗氧化酶(超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶等)的产量,提升机体对氧化应激的应对能力,从而实现抗氧化的目的;在非酶途径中,EPS可以参与激活巨噬细胞吞噬活性氧簇等生化反应来达到抗氧化的目的[65]。这2种途径共同作用,使EPS表现出优异的抗氧化活性。YILMAZ等[14]和WANG等[66]通过对肠膜明串珠菌进行多种抗氧化能力的测定表征肠膜明串珠菌EPS的抗氧化性能,发现肠膜明串珠菌EPS的抗氧化能力取决于产生EPS的剂量。通常情况下,肠膜明串珠菌的抗氧化活性随着EPS浓度的增加而增加。此外,大量研究证明,肠膜明串珠菌EPS具有明显的DPPH自由基和羟自由基清除能力,这可能是因为其含有如羟基、羧基等氢供体物质,可以与自由基结合从而达到清除的目的。不同肠膜明串珠菌EPS的抗氧化能力测定如表3所示。
表3 不同肠膜明串珠菌EPS抗氧化活性
Table 3 The antioxidant activity of EPS from different Leuconostoc mesenteroides

肠膜明串珠菌 抗氧化活性测定结果及最高清除率参考文献L.mesenteroides LM187清除DPPH自由基(50.2%)、清除羟自由基(71.0%)、清除超氧阴离子自由基(33.1%)[67]L.mesenteroides WiKim32清除DPPH自由基(71.6%)、抑制脂质过氧化(抑制率为28.2%)、还原Fe3+-TPTZ(FRAP值为0.04)[68]L.mesenteroides SN-8清除DPPH自由基(40.0%)、清除羟自由基(17.76%)、清除ABTS阳离子自由基(65.0%)[15]L.mesenteroides S81清除羟自由基(近乎100%)[22]L.mesenteroides HDE1清除DPPH自由基(50.00%)、清除ABTS阳离子自由基(40.00%)、清除羟自由基(49.96%)[69]L.mesenteroides BI-20清除ABTS阳离子自由基(36.1%)、还原Cu2+(45%左右)[14]L.mesenteroides DRP105清除DPPH自由基(25.58%)、清除羟自由基(15.38%)、清除超氧阴离子自由基(17.63%)[19]
3.2 抗癌活性
近几年来,随着癌症患者的逐渐增加,抗肿瘤活性物质的研究得到了广泛关注,肠膜明串珠菌作为一种产含有羟基和羰基的高分子质量EPS菌种,其产生的EPS抗肿瘤活性要强于不含羟基和羰基的低分子质量多糖,具有明显的天然抗癌活性[70]。其抗癌作用机理主要表现在3个方面:a)增强机体自身免疫调节;b)抑制肿瘤细胞增殖;c)诱导肿瘤细胞凋亡[71]。癌细胞的增殖、生长、代谢和凋亡是由磷脂酰肌醇激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/磷酸酶的失调和十号染色体上缺失张力蛋白同源物(phosphatase and tensinhomology deleted on chromosome ten,PTEN)所控制的,肠膜明串珠菌EPS可以作为核因子-κB(nuclear factor kappa-B,NF-κB)、AKT、PTEN和促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路的分子调节因子,调节下游细胞的凋亡反应,从而有效抑制癌细胞的存活和炎症反应[72]。已有研究证明,肠膜明串珠菌EPS在肝癌细胞的形成和聚集中具有明显的抑制作用。WU等[8]对肠膜明串珠菌SN-8 EPS的抗癌活性研究发现,肠膜明串珠菌EPS的添加可以使人体肝癌细胞间隙变得更加明显,大量的肝癌细胞呈现出膨胀或收缩的状态,凋亡癌细胞数目增加,人肝癌细胞数量逐渐减少;而且随着EPS浓度的增加,肝癌细胞的生长抑制率呈明显的上升趋势。同时,肠膜明串珠菌产生的EPS对哺乳动物的癌细胞具有选择性的抑制作用,不会对宿主产生有害副作用,为其应用在抗癌领域提供了安全前提[73]。
3.3 免疫调节活性
EPS可以在机体内作为免疫调节剂,其既可以影响特异性免疫系统,激活T淋巴细胞产生淋巴因子并刺激B淋巴细胞产生抗体,又能通过酸性异型多糖的磷酸基团激活非特异性免疫细胞(巨噬细胞、NK细胞等),增强机体分泌免疫分子的能力,提高机体免疫细胞活性[74]。MATSUZAKI等[75]研究证明,肠膜明串珠菌NTM048-EPS可以提升机体肠道免疫球蛋白水平,诱导机体产生抗原与相应抗体之间发生特异性结合,提升小鼠的免疫调节力。同时,肠膜明串珠菌EPS可以对CD4细胞产生的细胞因子造成影响。MA’UNATIN等[76]通过动物实验发现,EPS的添加促进了促炎细胞因子IL-2、IFN-γ和TNF-α的产生,降低了抗炎因子IL-10的含量,从而促进激活动物机体自身的T细胞免疫系统活性。
3.4 益生元活性
肠膜明串珠菌EPS能够在机体内选择性地促进有益微生物菌群的增殖,抑制有害微生物群落的生长以及某些有害物质的产生,表现出明显的益生元活性[77]。双歧杆菌、拟杆菌和梭状芽胞杆菌等肠道微生物可以利用多糖产生短链脂肪酸(short-chain fatty acids,SCFAs),SCFAs可以通过受体(如G蛋白偶联受体GPR41和GPR43)充当宿主能量来源和信号分子,之后通过影响内分泌系统(GPR41通过提升交感神经活性和促进肠道激素分泌来影响宿主代谢功能;GPR43通过抑制刺激脂肪和促进肠道激素分泌来影响宿主代谢功能)来改善宿主体内平衡[78]。MIYAMOTO等[79]对摄入肠膜明串珠菌EPS的小鼠肠道微生物种类和数目进行检测,发现其可以有效增殖产SCFAs菌种,并显著提升SCFAs水平,相较于摄入其他多糖,摄入肠膜明串珠菌EPS产生的SCFAs可以更好地通过受体调节肠促胰岛素等的分泌,改善宿主体内葡萄糖稳态,抑制体内血糖水平的提升。此外,低聚糖作为具有典型益生元效应的营养物质,其显示出的双歧活性因子可以促进肠道内益生菌的繁殖。KOTHARI等[73]和RYCROFT等[80]发现肠膜明串株菌产生的低聚糖的水解抗性显著高于标准益生元-菊粉,证明其能够承受胃酸和消化酶的影响,完整地到达结肠发挥益生元活性,从而达到调节人体肠道微生物菌落、改善宿主肠道健康的作用。
4 肠膜明串珠菌EPS在食品领域中的研究进展
肠膜明串珠菌EPS具有的众多优异生物活性为其在食品领域中的应用提供了基础保障。EPS的添加可以改善食品品质、提高食品风味、延长食品保质期以及改良食品加工特性等,这些优异性能使人们开始聚焦于其在乳制品、面制品以及保健品等食品领域中的研究及应用。
4.1 在面制品中的研究进展
酸面团发酵过程中产生的EPS会对面团中的蛋白质和淀粉特性产生重大影响,其可以大大改善面团及面制品的品质[81]。肠膜明串珠菌混合发酵过程中产生的葡聚糖是在α-(1,6)糖苷键连接的主链上支出以α-(1,3)、α-(1,2)、α-(1,4)、α-(1,6)糖苷键连接的支链而组成的长线型结构,这一结构促使其与面筋蛋白中的氢原子相互作用,从而提高面团的稳定性和对面制品的持气性,最终改善面制品的品质[82]。同时,高分子质量的肠膜明串珠菌EPS可以与水大量结合,抑制小麦淀粉颗粒的膨胀和凝胶化,起到减缓面团贮存变质进程、延长面制品保质期的作用[83]。此外,肠膜明串珠菌EPS还会对面团中的谷蛋白结构产生影响。在单一发酵条件下,面筋网络中游离巯基含量较低,由葡聚糖引起的大分子谷蛋白聚合物的解聚反应较弱,但在混合发酵环境中,产生的大分子葡聚糖提高了面筋网络结构的延展性;同时,反向平行β片层结构含量降低,促进了谷蛋白的膨胀和溶解,谷蛋白分子间的共价作用减弱,进而加强了谷蛋白聚合物的解聚反应,使面团品质质量和面制品的体积及质地得以改善[84]。
4.2 在乳制品中的研究进展
肠膜明串珠菌能够在乳制品的发酵过程中以细胞外碳水聚合物的形式产生EPS,并且不会改变发酵产品的整体性能,更加符合消费者对营养健康的需求。肠膜明串珠菌EPS可以改善乳制品的结构和质地,在不影响香气和味道的情况下作为增稠剂增加产品黏度以改善产品口感[85]。此外,肠膜明串珠菌EPS可以与水以及牛奶内的其他成分(蛋白质、胶束等)相互结合以避免产品在发酵或贮存过程中发生乳清分离,是乳制品中的强稳定剂[53]。WANG等[13]研究表明,肠膜明串珠菌EPS的添加可以使发酵乳制品具有更高的黏度和弹性;同时,在一定剪切时间范围内,经肠膜明串珠菌发酵的酸奶可以表现出恒定的牛顿流体行为,证明肠膜明串珠菌EPS在发酵乳制品的应用中具有稳定的乳化活性和优异的絮凝活性以及保水能力。
4.3 在保健食品中的研究进展
肠膜明串珠菌EPS由于其良好的抗氧化活性、免疫调节活性和抗菌活性而被添加进保健食品中,为食用宿主提供降血糖、改善肠道菌群以及促进消化等保健作用。α-淀粉酶和α-葡萄糖苷酶抑制剂可以有效抑制酶活性,减缓糖的分解,从而控制人体血糖含量。作为天然益生产物,JIANG等[86]研究发现,肠膜明串珠菌EPS与α-淀粉酶和α-葡萄糖苷酶存在着竞争性抑制关系,其可以通过与底物竞争酶的催化位点,以可逆的方式降低酶对底物的亲和力,间接达到控制血糖水平的作用。此外,肠膜明串珠菌产生的甘露醇可以取代一些诸如葡萄糖等的高热量糖类应用到食品中。由于甘露醇在人体内的代谢不涉及胰岛素的介导, 不提高血糖值,也不会导致龋齿,故可以用于保健食品中甜味剂的替代品[87]。同时,在保健食品中添加肠膜明串珠菌EPS可以对动物胃肠道健康起到显著的有益影响。肠膜明串珠菌EPS可被肠道菌群用作能量来源以支持有益菌的生长,用于对抗肠道内的致病菌,而且肠膜明串珠菌EPS可以黏附在肠上皮细胞上,以恢复受损的肠道屏障功能并抑制细菌病原体形成生物膜来改善肠道健康[88]。
肠膜明串珠菌EPS在食品领域中的应用主要通过肠膜明串珠菌单一发酵或和其他菌种混合发酵的方式实现,利用发酵过程中产生的EPS优化产品性能。这一过程虽然能够有效改善产品品质、减少生产成本,但在发酵过程中不同菌种之间的相互作用会影响发酵动力学,从而增加工艺复杂性,使产品的稳定生产难以实现[89]。同时,不同菌株产生EPS的生物活性具有一定差异,菌株间的竞争可能引起EPS生物活性降低,最终致使产品质地和风味具有差异,对产品产生负面影响,具有一定弊端[90]。然而分离纯化后的EPS纯度较高,其在食品中的精确添加可以供给产品已有研究显示的具体改良功效、确保产品品质稳定。而且与混合发酵利用EPS相比,EPS可在分离纯化过程中去除杂质和可能抑制生物活性的组分,维持EPS正常生物活性水平[91]。目前关于肠膜明串株菌EPS的分离纯化并没有合适的优化方法,其分离提取通常遵循微生物EPS分离提取的常规步骤,即灭菌、粗提、清除蛋白质和小分子杂质、分级分离等[92]。尽管这一过程成本较高且较为繁琐,在操作过程中还会造成质量损失,但优化分离纯化方法仍是提升EPS产品竞争力和市场价值的重要策略[93]。因此,寻求合适的提取方法以提高肠膜明串珠菌EPS的提取率并减少提取成本使其直接大规模应用在食品领域中是目前需要解决的一个重要问题。
5 结论与展望
肠膜明串珠菌EPS在食品领域中具有广阔的应用前景和巨大的潜力。作为乳酸菌中具有优异益生元活性的菌种,肠膜明串珠菌通过不同发酵途径,利用不同的底物在短时间内产生大量不同类型的EPS,而不同类型EPS在结构上的差异造成了其生物活性的多样性,这些生物活性使其可以应用在食品领域中,以达到改善食品的结构特征、提高食品品质以及延长食品保质期限等作用。同时,肠膜明串珠菌EPS的添加,可以为食品附加一些调控机体健康的性能,机体食用之后可以利用肠膜明串珠菌EPS的抗菌、抗氧化和免疫调节等活性,调节机体肠道微生物菌群、改善肠道功能以及预防高血糖等疾病。肠膜明串珠菌EPS在食品行业中的研究应用已受到广泛关注,但由于其分离纯化过程较为复杂、成本较高,大规模生产技术尚不成熟,限制了其在食品行业中的应用。未来可以通过改善工艺集成过程、筛选优势产糖菌种、改良培养条件以及优化分离纯化技术等手段,开发适用于大规模生产的发酵和分离纯化设备,提升生产效率,并通过工艺集成和自动化技术,完成高效的连续生产,降低生产成本,最终实现其在食品领域中的大规模开发应用[94]。
参考文献
[1] DEDHIA N, MARATHE S J, SINGHAL R S.Food polysaccharides:A review on emerging microbial sources, bioactivities, nanoformulations and safety considerations[J].Carbohydrate Polymers, 2022, 287:119355.
[2] PRASAD S, PUROHIT S R.Microbial exopolysaccharide:Sources, stress conditions, properties and application in food and environment:A comprehensive review[J].International Journal of Biological Macromolecules, 2023, 242:124925.
[3] DONOT F, FONTANA A, BACCOU J C, et al.Microbial exopolysaccharides:Main examples of synthesis, excretion, genetics and extraction[J].Carbohydrate Polymers, 2012, 87(2):951-962.
[4] BINTSIS T.Lactic acid bacteria as starter cultures:An update in their metabolism and genetics[J].AIMS Microbiology, 2018, 4(4):665-684.
[5] HUANG M Y, LO C Y, LAI C Y, et al.Dietary supplementation of synbiotic Leuconostoc mesenteroide B4 and dextran improves immune regulation and disease resistance of Penaeus vannamei against Vibrio parahaemolyticus[J].Fish &Shellfish Immunology, 2023, 132:108498.
[6] 李文斌, 宋敏丽, 高荣琨.肠膜明串珠菌的研究和应用进展[J].食品工程, 2006(4):3-4;11.LI W B, SONG M L, GAO R K.Research and application process of Leuconostoc mesenteroides[J].Food Engineering, 2006(4):3-4;11.
[7] ZHANG P, ZHANG P F, WU J R, et al.Effects of Leuconostoc mesenteroides on physicochemical and microbial succession characterization of soybean paste, Da-jiang[J].LWT, 2019, 115:108028.
[8] WU J R, YAN D L, LIU Y M, et al.Purification, structural characteristics, and biological activities of exopolysaccharide isolated from Leuconostoc mesenteroides SN-8[J].Frontiers in Microbiology, 2021, 12:644226.
[9] D AZ-MONTES E.Dextran:Sources, structures, and properties[J].Polysaccharides, 2021, 2(3):554-565.
AZ-MONTES E.Dextran:Sources, structures, and properties[J].Polysaccharides, 2021, 2(3):554-565.
[10] PRECHTL R M, JANßEN D, BEHR J, et al.Sucrose-induced proteomic response and carbohydrate utilization of Lactobacillus sakei TMW 1.411 during dextran formation[J].Frontiers in Microbiology, 2018, 9:2796.
[11] BESROUR-AOUAM N, FHOULA I, HERN NDEZ-ALC
NDEZ-ALC NTARA A M, et al.The role of dextran production in the metabolic context of Leuconostoc and Weissella Tunisian strains[J].Carbohydrate Polymers, 2021, 253:117254.
NTARA A M, et al.The role of dextran production in the metabolic context of Leuconostoc and Weissella Tunisian strains[J].Carbohydrate Polymers, 2021, 253:117254.
[12] KABLI M, YILMAZ M T, TAYLAN O, et al.An integrated neural-fuzzy methodology for characterisation and modelling of exopolysaccharide (EPS) production levels of Leuconostoc mesenteroides DL1[J].Computers &Industrial Engineering, 2020, 148:106619.
[13] WANG L, GU Y C, ZHENG X Y, et al.Analysis of physicochemical properties of exopolysaccharide from Leuconostoc mesenteroides strain XR1 and its application in fermented milk[J].LWT, 2021, 146:111449.
[14] YILMAZ M T,  H, TAYLAN O, et al.Characterisation and functional roles of a highly branched dextran produced by a bee pollen isolate Leuconostoc mesenteroides BI-20[J].Food Bioscience, 2022, 45:101330.
H, TAYLAN O, et al.Characterisation and functional roles of a highly branched dextran produced by a bee pollen isolate Leuconostoc mesenteroides BI-20[J].Food Bioscience, 2022, 45:101330.
[15] LI Y, LIU Y M, CAO C X, et al.Extraction and biological activity of exopolysaccharide produced by Leuconostoc mesenteroides SN-8[J].International Journal of Biological Macromolecules, 2020, 157:36-44.
[16] 李洋. 肠膜明串珠菌SN-8胞外多糖分离纯化,结构鉴定及功能特性研究[D].沈阳:沈阳农业大学, 2020.LI Y.Isolation, purification, structural identification and functional properties of extracellular polysaccharide from Leuconostoc mesenteroides SN-8[D].Shenyang:Shenyang Agricultural University, 2020.
[17] BISSON G, COMUZZI C, GIORDANI E, et al.An exopolysaccharide from Leuconostoc mesenteroides showing interesting bioactivities versus foodborne microbial targets[J].Carbohydrate Polymers, 2023, 301:120363.
[18] MATSUZAKI C, TAKAGAKI C, TOMABECHI Y, et al.Structural characterization of the immunostimulatory exopolysaccharide produced by Leuconostoc mesenteroides strain NTM048[J].Carbohydrate Research, 2017, 448:95-102.
[19] XING H W, DU R P, ZHAO F K, et al.Optimization, chain conformation and characterization of exopolysaccharide isolated from Leuconostoc mesenteroides DRP105[J].International Journal of Biological Macromolecules, 2018, 112:1 208-1 216.
[20] 邢瀚文. 肠膜明串珠菌DRP105胞外多糖发酵条件优化及其性质研究[D].天津:天津大学, 2019.XING H W.Fermentation optimization and characterization of exopolysaccharide isolated from Leuconosto mesenteroides DRP105[D].Tianjin:Tianjin University, 2019.
[21] DU R P, XING H W, YANG Y P, et al.Optimization, purification and structural characterization of a dextran produced by L.mesenteroides isolated from Chinese sauerkraut[J].Carbohydrate Polymers, 2017, 174:409-416.
[22] TAYLAN O, YILMAZ M T, DERTLI E.Partial characterization of a levan type exopolysaccharide (EPS) produced by Leuconostoc mesenteroides showing immunostimulatory and antioxidant activities[J].International Journal of Biological Macromolecules, 2019, 136:436-444.
[23] SIDDIQUI N N, AMAN A, SILIPO A, et al.Structural analysis and characterization of dextran produced by wild and mutant strains of Leuconostoc mesenteroides[J].Carbohydrate Polymers, 2014, 99:331-338.
[24] SIDDIQUI N N, AMAN A, ALI UL QADER S.Mutational analysis and characterization of dextran synthesizing enzyme from wild and mutant strain of Leuconostoc mesenteroides[J].Carbohydrate Polymers, 2013, 91(1):209-216.
[25] AZARI-ANPAR M, JAHANBIN K, DEGRAEVE P, et al.Structural characterization of exopolysaccharide from Leuconostoc mesenteroides P35 and its binding interaction with bovine serum albumin using surface plasmon resonance biosensor[J].International Journal of Biological Macromolecules, 2023, 246:125599.
[26] DOLS M, REMAUD-SIMEON M, WILLEMOT R-M, et al.Characterization of dextransucrases from Leuconostoc mesenteroides NRRL B-1299[J].Applied Biochemistry and Biotechnology, 1997, 62(1):47-59.
[27] VANDAMME E J, DE BAETS S, STEINBUCHEL A.Biopolymers, Polysaccharides I:Polysaccharides from Prokaryotes[M].Weinheim:Wiley-VCH, 2002, 5:351-377.
[28] LAURA M, NOTARARIGO S, NCHER M, et al.Biosynthesis, purification and biotechnological use of exopolysaccharides produced by lactic acid bacteria[J].Food Additive, 2012:83-114.
[29] ROBYT J F, EKLUND S H.Stereochemistry involved in the mechanism of action of dextransucrase in the synthesis of dextran and the formation of acceptor products[J].Bioorganic Chemistry, 1982, 11(2):115-132.
[30] ROBYT J F.Mechanism and Action of Glucansucrases[M].Amsterdam:Elsevier, 1996:1-22.
[31] 宗明, 金中淦, 徐兰, 等.乳酸细菌葡聚糖蔗糖酶的研究应用与进展[J].检验医学教育, 2005, 12(2):30-32.ZONG M, JIN Z G, XU L, et al.Research, application and progress of lactic acid bacteria dextran sucrase from lactic acid bacteria[J].Chinese Journal of Laboratory Medicine Education, 2005, 12(2):30-32.
[32] HARUTOSHI T.Exopolysaccharides of Lactic Acid Bacteria for Food and Colon Health Applications[M].Rijeka:Lactic Acid Bacteria - R &D for Food, Health and Livestock Purposes, 2013.
[33] NAESSENS M, CERDOBBEL A, SOETAERT W, et al.Leuconostoc dextransucrase and dextran:Production, properties and applications[J].Journal of Chemical Technology &Biotechnology, 2005, 80(8):845-860.
[34] EBERT K H, SCHENK G.Mechanisms of biopolymer growth:The formation of dextran and levan[J].Advances in Enzymology and Related Areas of Molecular Biology, 1968, 30:179-221.
[35] ROBYT J F, WALSETH T F.The mechanism of acceptor reactions of Leuconostoc mesenteroides B-512F dextransucrase[J].Carbohydrate Research, 1978, 61(1):433-445.
[36] 李婧. 利用肠膜明串珠菌代谢生产低聚葡萄糖的研究[D].北京:北京林业大学, 2010.LI J.Application of Leuconostoc mesemteroide to produce glucooligosaccharides to be used as prebiotics[D].Beijing:Beijing Forestry University, 2010.
[37] KOEPSELL H J, TSUCHIYA H M, HELLMAN N N, et al.Enzymatic synthesis of dextran:Acceptor specificity and chain initiation[J].The Journal of Biological Chemistry, 1953, 200(2):793-801.
[38] FABRE E, BOZONNET S, ARCACHE A, et al.Role of the two catalytic domains of DSR-E dextransucrase and their involvement in the formation of highly α-1, 2 branched dextran[J].Journal of Bacteriology, 2005, 187(1):296-303.
[39] 于冬梅, 杜煜光.生物合成法生产D-甘露醇的研究进展[J].农产品加工(学刊), 2008(1):36-39;50.YU D M, DU Y G.The progress on D-mannitol production by microorganism[J].Academic Periodical of Farm Products Processing, 2008(1):36-39;50.
[40] DOLS M, CHRAIBI W, REMAUD-SIMEON M, et al.Growth and energetics of Leuconostoc mesenteroides NRRL B-1299 during metabolism of various sugars and their consequences for dextransucrase production[J].Applied and Environmental Microbiology, 1997, 63(6):2159-2165.
[41] SONG S H, VIEILLE C.Recent advances in the biological production of mannitol[J].Applied Microbiology and Biotechnology, 2009, 84(1):55-62.
[42] KANIMOZHI J, MOORTHY I G, SIVASHANKAR R, et al.Optimization of dextran production by Weissella cibaria NITCSK4 using Response Surface Methodology-Genetic Algorithm based technology[J].Carbohydrate Polymers, 2017, 174:103-110.
[43] GOYA L A, NIGAM M, KATIYAR S S.Optimal conditions for production of dextransucrase from Leuconostoc mesenteroides NRLL B-512F and its properties[J].Journal of Basic Microbiology, 1995, 35(6):375-384.
[44] DU R P, ZHAO F K, PAN L, et al.Optimization and purification of glucansucrase produced by Leuconostoc mesenteroides DRP2-19 isolated from Chinese Sauerkraut[J].Preparative Biochemistry &Biotechnology, 2018, 48(6):465-473.
[45] WANG B B, SONG Q Z, ZHAO F K, et al.Purification and characterization of dextran produced by Leuconostoc pseudomesenteroides PC as a potential exopolysaccharide suitable for food applications[J].Process Biochemistry, 2019, 87:187-195.
[46] VANDAMME E J, VAN LOO J, SIMKENS E, et al.Optimization of sucrose phosphorylase production by Leuconostoc mesenteroides[J].Journal of Chemical Technology &Biotechnology, 1987, 39(4):251-262.
[47] LIU J, LUO J G, YE H, et al.Medium optimization and structural characterization of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J].Carbohydrate Polymers, 2010, 79(1):206-213.
[48] VEDIASHKINA T A, REVIN V V, GOGOTOV I N. Optimizing the conditions of dextran synthesis by the bacterium Leuconostoc mesenteroides grown in a molasses-containing medium[J]. Prikladnaia Biokhimiia i Mikrobiologiia, 2005, 41(4):409-413.
[49] 李婧, 张柏林.肠膜明串珠菌6055合成低聚葡萄糖培养条件的优化[J].宁夏农林科技, 2019, 60(11):60-62.LI J, ZHANG B L.Optimization of culture conditions for synthesis of oligosaccharide with Leuconostoc mesenteroides 6055[J].Journal of Ningxia Agriculture and Forestry Science and Technology,2019, 60(11):60-62.
[50] 王英, 黄开红, 李思睿, 等.产葡聚糖明串珠菌的分离鉴定及发酵条件研究[J].食品与生物技术学报, 2012, 31(7):727-732.WANG Y, HUANG K H, LI S R, et al.Isolation and identification of dextran-producting strain and study of fermentation conditions[J].Journal of Food Science and Biotechnology, 2012, 31(7):727-732.
[51] 魏小雁. 产葡聚糖明串珠菌的特性及其葡聚糖合成条件研究[D].呼和浩特:内蒙古农业大学, 2008.WEI X Y.Studies on biological properties of Leuconostoc and fermentation condition of dextran[D].Hohhot:Inner Mongolia Agricultural University, 2008.
[52] KARTHIKEYAN R S, RAKSHIT S K, BARADARAJAN A.Optimization of batch fermentation conditions for dextran production[J].Bioprocess Engineering, 1996, 15(5):247-251.
[53] DE VUYST L, DE VIN F, VANINGELGEM F, et al.Recent developments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria[J].International Dairy Journal, 2001, 11(9):687-707.
[54] 卢培利, 杨涵, 丁阿强, 等.碳源与氮源限制下细菌代谢调节研究进展[J].微生物学报, 2023, 63(3):946-962.LU P L, YANG H, DING A Q, et al.Metabolic regulation of bacteria with limited carbon and nitrogen sources[J].Acta Microbiologica Sinica, 2023, 63(3):946-962.
[55] 邓超, 杜秀娟, 黄涛, 等.碳氮比对固氮菌株WN-F合成胞外多糖的影响[J].生物技术通报, 2018, 34(3):194-199.DENG C, DU X J, HUANG T, et al.The promotion of proper carbon nitrogen ratio in the synthesis of extracellular polysaccharide by nitrogen-fixing strains WN-F[J].Biotechnology Bulletin, 2018, 34(3):194-199.
[56] LOPRETTI M, MARTINEZ E, TORRES L, et al.Influence of nitrogen/carbon ratio and complementary sugars on dextransucrase production by Leuconostoc mesenteroides NRRL B512(f)[J].Process Biochemistry, 1999, 34(9):879-884.
[57] EKO SUKOHIDAYAT N H, ZAREI M, BAHARIN B S, et al.Purification and characterization of lipase produced by Leuconostoc mesenteroides subsp.mesenteroides ATCC 8293 using an aqueous two-phase system (ATPS) composed of Triton X-100 and maltitol[J].Molecules, 2018, 23(7):1800.
[58] FOUCAUD C, FRANCOIS A, RICHARD J.Development of a chemically defined medium for the growth of Leuconostoc mesenteroides[J].Applied and Environmental Microbiology, 1997, 63(1):301-304.
[59] DAS D, GOYAL A.Isolation, purification and functional characterization of glucansucrase from probiotic Lactobacillus plantarum DM5[J].Annals of Microbiology, 2014, 64(4):1 715-1 724.
[60] MAJUMDER A, MANGTANI A, GOYAL A.Purification, identification and functional characterization of glucansucrase from Leuconostoc dextranicum NRRL B-1146[J].Current Trends in Biotechnology and Pharmacy, 2008, 2(4):493-505.
[61] 王烁, 姜静, 杜仁鹏, 等.乳酸菌胞外多糖的生物合成、特性和应用[J].生物技术, 2022, 32(3):394-401.WANG S, JIANG J, DU R P, et al.Biosynthesis, characterization and application of exopolysaccharides from lactic acid bacteria[J].Biotechnology, 2022, 32(3):394-401.
[62] CUI S W.Food Carbohydrates:Chemistry, Physical Properties, and Applications[M].1th ed.Boca Raton:CRC Press, 2005:293-299.
[63] BISSON G, GIORDANI E, POLETTI D, et al.Characterization and bioactivities of a novel exopolysaccharide from Leuconostoc mesenteroides[C].Proceedings of the 9th Biennial Meeting on Microbial Carbohydrates.Amsterdam:Elsevier, 2022.
[64] ZHOU Y, CUI Y H, QU X J.Exopolysaccharides of lactic acid bacteria:Structure, bioactivity and associations:A review[J].Carbohydrate Polymers, 2019, 207:317-332.
[65] 索超, 曲晓军, 崔艳华.乳酸菌胞外多糖研究进展[J].中国乳品工业, 2017, 45(11):32-36.SUO C, QU X J, CUI Y H.Research advances in extracellular polysaccharide produced by lactic acid bacteria[J].China Dairy Industry, 2017, 45(11):32-36.
[66] WANG Y, DU R P, QIAO X X, et al.Optimization and characterization of exopolysaccharides with a highly branched structure extracted from Leuconostoc citreum B-2[J].International Journal of Biological Macromolecules, 2020, 142:73-84.
[67] ZHANG Q, WANG J, SUN Q, et al.Characterization and antioxidant activity of released exopolysaccharide from potential probiotic Leuconostoc mesenteroides LM187[J].Journal of Microbiology and Biotechnology, 2021, 31(8):1144-1153.
[68] CHOI I S, KO S H, LEE M E, et al.Production, characterization, and antioxidant activities of an exopolysaccharide extracted from spent media wastewater after Leuconostoc mesenteroides WiKim32 fermentation[J].ACS Omega, 2021, 6(12):8171-8178.
[69] 臧文晶, 刘丽娜, 赵丹.肠膜明串珠菌HDE1的分离鉴定及其胞外多糖抗氧化和牛奶凝结特性研究[J].食品工业科技, 2023, 44(4):155-162.ZANG W J, LIU L N, ZHAO D.Isolation, identification of Leuconostoc mesenteroides HDE1 and antioxidation and milk coagulability of its extracellular polysaccharide[J].Science and Technology of Food Industry, 2023, 44(4):155-162.
[70]  D B,
D B,  M M, et al.Natural and modified (1→3)-β-D-glucans in health promotion and disease alleviation[J].Critical Reviews in Biotechnology, 2005, 25(4):205-230.
M M, et al.Natural and modified (1→3)-β-D-glucans in health promotion and disease alleviation[J].Critical Reviews in Biotechnology, 2005, 25(4):205-230.
[71] 汪清美, 赵丽平.乳酸菌胞外多糖的结构及益生功能研究进展[J].天津农业科学, 2015, 21(5):19-22.WANG Q M, ZHAO L P.Research progress on structure and function of exopolysaccharides from lactic acid bacteria[J].Tianjin Agricultural Sciences, 2015, 21(5):19-22.
[72] ZUNUNI VAHED S, BARZEGARI A, RAHBAR SAADAT Y, et al.Leuconostoc mesenteroides-derived anticancer pharmaceuticals hinder inflammation and cell survival in colon cancer cells by modulating NF-κB/AKT/PTEN/MAPK pathways[J].Biomedicine &Pharmacotherapy, 2017, 94:1094-1100.
[73] KOTHARI D, GOYAL A.Gentio-oligosaccharides from Leuconostoc mesenteroides NRRL B-1426 dextransucrase as prebiotics and as a supplement for functional foods with anti-cancer properties[J].Food &Function, 2015, 6(2):604-611.
[74] 孟凡岭, 万姝含, 胡风庆.乳酸菌胞外多糖生物活性研究进展[J].辽宁大学学报(自然科学版), 2018, 45(4):379-384.MENG F L, WAN S H, HU F Q.Progress in biological activity of exopolysaccharide of lactic acid bacteria[J].Journal of Liaoning University(Natural Sciences Edition), 2018, 45(4):379-384.
[75] MATSUZAKI C, NAKASHIMA Y, ENDO I, et al.Enzymatically synthesized exopolysaccharide of a probiotic strain Leuconostoc mesenteroides NTM048 shows adjuvant activity to promote IgA antibody responses[J].Gut Microbes, 2021, 13(1):1949097.
[76] MA’UNATIN A, HARIJONO, ZUBAIDAH E, et al. Immunomodulatory activity of exopolysaccharides produced by Leuconostoc mesenteroides strains isolated from palm (Borassus flabellifer L.) sap[J]. IOP Conference Series: Earth and Environmental Science, 2020, 456(1):012058.
[77] HELANDER I M, VON WRIGHT A, MATTILA-SANDHOLM T M.Potential of lactic acid bacteria and novel antimicrobials against Gram-negative bacteria[J].Trends in Food Science &Technology, 1997, 8(5):146-150.
[78] KIMURA I, ICHIMURA A, OHUE-KITANO R, et al.Free fatty acid receptors in health and disease[J].Physiological Reviews, 2020, 100(1):171-210.
[79] MIYAMOTO J, SHIMIZU H, HISA K, et al.Host metabolic benefits of prebiotic exopolysaccharides produced by Leuconostoc mesenteroides[J].Gut Microbes, 2023, 15(1):2161271.
[80] RYCROFT C E, JONES M R, GIBSON G R, et al.Fermentation properties of gentio-oligosaccharides[J].Letters in Applied Microbiology, 2001, 32(3):156-161.
[81] ARENDT E K, RYAN L A M, DAL BELLO F.Impact of sourdough on the texture of bread[J].Food Microbiology, 2007, 24(2):165-174.
[82] TINZL-MALANG S K, GRATTEPANCHE F, RAST P, et al.Purified exopolysaccharides from Weissella confusa 11GU-1 and Propionibacterium freudenreichii JS15 act synergistically on bread structure to prevent staling[J].LWT, 2020, 127:109375.
[83] ZHANG Y, GUO L N, XU D, et al.Effects of dextran with different molecular weights on the quality of wheat sourdough breads[J].Food Chemistry, 2018, 256:373-379.
[84] ZHANG Y, HONG T T, YU W J, et al.Structural, thermal and rheological properties of gluten dough:Comparative changes by dextran, weak acidification and their combination[J].Food Chemistry, 2020, 330:127154.
[85] YOO S K, HUR S S, SONG S, et al.Optimization of mannitol fermentation by Leuconostoc mesenteroides sp.strain JFY[J].Journal of Life Science, 2005, 15(3):374-381.
[86] JIANG B, CHEN P F, GUO J X, et al.Structural characteristics and biological activity of lactic acid bacteria exopolysaccharides separated by ethanol/(NH4)2SO4 ATPS[J].International Journal of Biological Macromolecules, 2023, 244:125451.
[87] 李晶, 姜丽丽, 李沐轩, 等.黄芪多糖对黄嘌呤氧化酶活性的抑制作用[J].食品与生物技术学报, 2021, 40(10):16-20.LI J, JIANG L L, LI M X, et al.Inhibitory effects of Astragalus polysaccharide on activity of xanthine oxidase[J].Journal of Food Science and Biotechnology, 2021, 40(10):16-20.
[88] CASTRO-BRAVO N, WELLS J M, MARGOLLES A, et al.Interactions of surface exopolysaccharides from Bifidobacterium and Lactobacillus within the intestinal environment[J].Frontiers in Microbiology, 2018, 9:2426.
[89] OLEKSY M, KLEWICKA E.Exopolysaccharides produced by Lactobacillus sp.:Biosynthesis and applications[J].Critical Reviews in Food Science and Nutrition, 2018, 58(3):450-462.
[90] G NZLE M G.Lactic metabolism revisited:Metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2:106-117.
NZLE M G.Lactic metabolism revisited:Metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2:106-117.
[91] SØRENSEN H M, ROCHFORT K D, MAYE S S, et al.Exopolysaccharides of lactic acid bacteria:Production, purification and health benefits towards functional food[J].Nutrients, 2022, 14(14):2938.
[92] HUANG Y Z, CHEN H, ZHANG K F, et al.Extraction, purification, structural characterization, and gut microbiota relationship of polysaccharides:A review[J].International Journal of Biological Macromolecules, 2022, 213:967-986.
[93] YANG S T, SILVA E M.Novel products and new technologies for use of a familiar carbohydrate, milk lactose[J].Journal of Dairy Science, 1995, 78(11):2541-2562.
[94] FREITAS F, TORRES C A V, REIS M A M.Engineering aspects of microbial exopolysaccharide production[J].Bioresource Technology, 2017, 245:1674-1683.
Synthesis pathway, biological activity, and research advance in food industry of exopolysaccharide from Leuconostoc mesenteroides
YANG Shaohua, LI Mengmeng, ZHANG Lili, LIU Yuanxiao, HE Xin, SONG Yunfei, YANG Shuo, GUAN Erqi, BIAN Ke*
(College of Food Science and Engineering, Henan University of Technology, Zhengzhou 450001, China)
ABSTRACT Exopolysaccharide (EPS) is a secondary metabolite secreted by Leuconostoc mesenteroides into the bacterial cell wall during the growth and metabolism, which has favorable biological activity and can be used in the food industry to improve product quality and performance.This article outlines the synthesis pathway, influencing factors, and biological activities of EPS from Leuconostoc mesenteroides, and discusses its functional characteristics and research advance in the food industry, aiming to provide a theoretical basis for the further development and application of EPS from Leuconostoc mesenteroides in the food industry.
Key words Leuconostoc mesenteroides; exopolysaccharide; synthetic pathway; biological activities; functional characteristics



 AZ-MONTES E.Dextran:Sources, structures, and properties[J].Polysaccharides, 2021, 2(3):554-565.
AZ-MONTES E.Dextran:Sources, structures, and properties[J].Polysaccharides, 2021, 2(3):554-565. NDEZ-ALC
NDEZ-ALC NZLE M G.Lactic metabolism revisited:Metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2:106-117.
NZLE M G.Lactic metabolism revisited:Metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2:106-117.