植物生长调节剂对水果品质的影响及机理研究进展
李瑞1,黎振源1,洪先龙1,赵希娟1,2*
1(西南大学 园艺园林学院,重庆,400715)2(农业农村部柑橘类果品质量安全控制重点实验室,重庆, 400715)
摘 要 植物生长调节剂(plant growth regulators,PGR)在调控植株生长发育和果实品质中具有重要作用。该文简述了PGR的种类及其对水果外观品质、内在理化品质和营养品质、次生代谢产物以及安全品质的影响,同时介绍了不同类型PGR影响果实品质的作用机理,指出了同一种PGR对水果品质的影响因水果的种类、施用时间和浓度的差异而不同;不同PGR对不同水果各种品质的调控机理存在差异;合理使用PGR会提升果实各项品质,但不规范使用将影响果实的品质甚至造成安全隐患。该文为水果生产过程中PGR的合理使用和绿色高效PGR的开发与应用提供参考。
关键词 植物生长调节剂;水果;果实品质;作用机理
DOI:10.13995/j.cnki.11-1802/ts.042394
引用格式:李瑞,黎振源,洪先龙,等.植物生长调节剂对水果品质的影响及机理研究进展[J].食品与发酵工业,2025,51(14):399-411.
LI Rui,LI Zhenyuan,HONG Xianlong, et al.Research progress on effects and mechanisms of plant growth regulators on fruit quality[J].Food and Fermentation Industries,2025,51(14):399-411.
第一作者:硕士研究生(赵希娟副教授为通信作者,E-mail:xijuanzh@swu.edu.cn)
基金项目:广西重点研发计划项目(桂农科AB241484036);中国绿色食品发展中心项目(GF-SGPZ-2024021)
收稿日期:2025-02-17,改回日期:2025-03-21
植物生长调节剂(plant growth regulator,PGR)是一类人工合成或天然存在[1],具有内源植物激素相似的生理活性或能影响内源激素合成、运输、代谢或生理作用的外源活性物质。在植株生长的不同阶段使用不同的PGR可有效调控植株的生长发育,即使在低浓度,也会发挥一定的作用[2]。
我国是果品生产和消费大国,截至2023年,全国果园面积达到了约1.27千万hm2,园林水果产量约2.4亿t。作为全球最大的水果生产国,中国的水果产量大约占世界的三分之一。随着育种和栽培技术的快速发展,水果的品质和产量均在不断提高,而PGR在其中发挥了不可忽视的作用。据中国农药信息网统计,到目前为止,我国有效登记状态的植物生长调节剂产品有1 828个,涉及54种有效成分,其中2024年获得新批准植物生长调节剂产品共217个,主要应用在柑橘、芒果、荔枝和猕猴桃等水果中。PGR能增强果树的抗逆性,减少恶劣环境和病虫害带来的经济损失;也可以调控果实成熟时间、延长货架期、提高水果产量和改善水果品质,从而提高水果的经济价值。但PGR在改善水果某项品质时,可能会对其他的品质产生不利影响,如氯吡脲(forchlorfenuron,CPPU)常用于甜瓜坐果,但是CPPU的不当使用也会对果实品质带来一些负面影响,比如花青素、维生素C和糖含量降低、苦味增加等[3]。本文就PGR的种类及其对水果各项品质的影响与作用机理进行综述。
1 常见植物生长调节剂
根据与植物激素作用的类似性,植物生长调节剂主要分为六大类:生长素类、赤霉素类、细胞分裂素类、乙烯类、脱落酸类和油菜素内酯类及其抑制剂。近几年,人们将水杨酸、茉莉酸和独角金内酯归于植物生长调节剂。下面简要介绍常见的各类植物生长调节剂。
1.1 生长素
生长素一词来源于希腊语“auxein”,意为“生长或扩张”。吲哚-3-乙酸(3-indoleacetic acid,IAA)是植物中天然存在的生长素[4]。生长素刺激细胞伸张,引起向光性和向地性反应,但是高浓度的生长素会抑制这些反应,并且可能造成相反的效果。生长素能促进吸引同化物,比如能促进谷类种子积累淀粉[1]。IAA以及其他生长素常在组织培养中发挥作用。近几年,发现内源性生长素合成(主要是IAA)局部升高是体细胞胚胎发生的关键[5]。生长素在花原基的形成、花器官发育方面发挥着重要的调节作用。
1.2 细胞分裂素
细胞分裂素是一种N6位被替代的一系列腺嘌呤衍生物[6],分为异戊二烯类细胞分裂素和芳香族细胞分裂素两类。常见的异戊二烯类细胞分裂素有异戊烯基腺嘌呤(isopentenyl adenine,iP)、二氢玉米素、反式玉米素(trans-zeatin,tZ)和顺式玉米素。经典的芳香族细胞分裂素是6-苄基腺嘌呤(6-benzylaminopurine,6-BA)及其衍生物。MILLER等[7]从老鲱鱼精子DNA中分离出了激动素(kinetin,6-糠基氨基嘌呤)。玉米是已知的首个腺嘌呤类细胞分裂素(玉米素)的来源。细胞分裂素可促进细胞分裂,以达到消除由生长素带来的顶端优势作用,延缓叶片衰老,以及刺激愈伤组织的形成。
1.3 脱落酸
脱落酸(abscisic acid,ABA)在保护高等植物免受或者减少胁迫带来的伤害方面起重要作用。在干旱条件下,ABA会促使植物气孔开度降低甚至关闭。ABA还有抑制种子萌发的功能。在自然界中,ABA以右旋、具有顺反异构的形式存在(S-ABA)。大多数人认为ABA引起的叶片衰老、脱落是促进乙烯水平的提高导致的,但有研究发现ABA以乙烯非依赖型促进叶片衰老[8]。在衰老的叶片中ABA含量并不会增加,而是在叶片完全死亡才会上升[8],可能是因为衰老的叶片对ABA更加敏感。
1.4 赤霉素
赤霉素(gibberellin,GA)由植物病原真菌藤仓赤霉命名,它感染了水稻后会引起水稻疯长并且会大大降低水稻的结实率。虽然赤霉酸(gibberellic acid,GA3)是第一个被发现的赤霉素,但植物体内赤霉素A1(gibberellin A1,GA1)和赤霉素A4(gibberellin A4,GA4)才是主要具有生物活性的赤霉素形式[9]。目前常用的赤霉素类植物生长调节剂有GA3、GA4和赤霉素A7(gibberellin A7,GA7),因为GA4和GA7的化学性质相似,难以将二者完全分离,所以有关它们的植物生长调节剂一般是二者的混合形式(GA4+7)。
GA在高等植物中的主要激素功能是促进纵向生长,诱导长日照植物的抽薹,以及促进坐果和发育,诱导萌发种子中的水解酶,能够打破由ABA引起的种子休眠。而赤霉素合成抑制剂如矮壮素(chlormequat chloride,CCC)、多效唑(paclobutrazol,PBZ)和烯效唑,它们可以降低植株的株高,增强植物的抗倒伏能力以及调节植物的营养生长和生殖生长。
1.5 乙烯
乙烯是结构最简单的植物生长调节剂,在高等植物中有刺激或抑制细胞生长、诱导花芽分化和促进花、果、叶的脱落等功能。乙烯促进果实成熟,对呼吸跃变型水果更明显,可能导致果实过成熟,从而缩短果实货架期。乙烯是气态的植物生长调节剂,使用起来并不方便,因此主要使用乙烯利这种能促进乙烯合成的水溶性植物生长调节剂[10]。使用最多的乙烯抑制剂是1-甲基环丙烯(1-methylcyclopropene,1-MCP),是一种与乙烯结构相似的气体,它与乙烯受体有着非常高的亲和力,因此可以抑制乙烯与受体结合。
1.6 油菜素内酯
油菜素内酯由4个环以及一条侧链构成。油菜素内酯最初是从油菜花粉中提取出来促进细胞伸长的一种化学物质[11]。油菜素内酯被认为是第6种植物激素,直至今日,已经分离出了70多种油菜素内酯类物质。芸苔素内酯(brassinolide,BR)是油菜素内酯类中生物活性最高的物质,而24-表芸苔素内酯(epibrassinolide,EBR)是实验研究中最常用的油菜素内酯。油菜素内酯能够促进细胞伸长、分裂和节间伸长、增强植株的抗逆性、促进叶绿素合成和延缓衰老的功能,并且油菜素内酯在调节籽粒大小、形态和果实形状等决定产量和品质的重要性状方面发挥着重要[12]。
1.7 茉莉酸
茉莉酸(jasmonic acid,JA)参与植物的胁迫反应,影响植物的抗逆性,对花药育性、根生长等产生影响。外源施加JA抑制生长并诱导衰老。JA最初是从真菌Lasiodiplodia theobromae的培养液中分离出来的一种植物生长抑制剂。这表明病原菌可能会释放植物激素或结构相似的物质来调控植物的免疫。JA的酯类物质茉莉酸甲酯(methyl jasmonate,MeJA)常被作为外源的JA用于实验研究之中。
1.8 水杨酸
水杨酸(salicylic acid,SA),即邻羟基苯甲酸,植物体内存在的一种简单酚类物质。SA在医学领域有重要的作用,例如抗氧化、抗菌等。SA有诱导细胞分化、促进根系发育、增强植物抗逆性等功能,在水果保鲜方面也有一定的作用。
1.9 独角金内酯
独角金内酯(strigolactone,SL)是一类由类胡萝卜素衍生的激素。独角金醇是第一个被发现的SL类化合物,它是从棉花根分泌物中分离得到的[13]。SL有抑制细胞分裂与伸长、增加气孔导度从而促进光合作用、参与渗透调节和调节活性氧来提高抗逆性的功能[14]。GR24是活性最高、应用最广泛的人工合成的SL[14]。
表1列举了几种常见植物生长调节剂所属类型、应用物种及其主要作用。通过分析发现,不同类型的PGR在改善水果品质方面可能发挥不同的作用,也可能达到相同的效果。比如,S-诱抗素属于ABA,应用于鲜食葡萄时,可改善其着色[20];MeJA属于茉莉酸系列,应用于草莓、树莓、桃时也可以改善果实着色[25];细胞分裂素类型中的CPPU和噻苯隆(thidiazuron,TDZ)以及赤霉素类型中的GA3均有提高果实单果重的作用。同一种PGR对水果品质的影响因水果的种类、施用时间和浓度的差异而产生不同的影响[16,18,28]。
表1 植物生长调节剂的分类、应用物种及其主要作用
Table 1 Classification, application species, and main effects of plant growth regulators

名称类别主要应用物种主要作用参考文献萘乙酸生长素苹果、荔枝影响坐果[15]氯吡脲细胞分裂素猕猴桃、鲜食葡萄、甜瓜提高果实的单果重和体积[3,16-17] 噻苯隆细胞分裂素芒果、金桔提高水果果实的单果重[15,18] 6-苄基腺嘌呤细胞分裂素柑橘、枣促进果实膨大,提高坐果率[19]S-诱抗素脱落酸鲜食葡萄改善水果着色[20]赤霉酸赤霉素葡萄提高水果单果重[21]GA4+7赤霉素柑橘改善水果果实品质[19]多效唑赤霉素抑制剂芒果改善水果果实品质[22]乙烯利乙烯广泛应用于水果催熟,诱导菠萝开花[10]1-甲基环丙烯乙烯抑制剂苹果提高水果的耐贮性[23]氨基乙氧基乙烯基甘氨酸乙烯抑制剂苹果、梨延迟收获期[24]芸苔素内酯油菜素内酯苹果、荔枝、柑橘提高产量[19]24-表油菜素内酯油菜素内酯葡萄、桃改善水果果实品质[20]茉莉酸丙酯茉莉酸梨改善水果着色[25]茉莉酸甲酯茉莉酸草莓、树莓、桃改善水果着色[25]水杨酸水杨酸蓝莓、柑橘提高水果的耐贮性[26]GR24独角金内酯草莓、柑橘、葡萄提高坐果率,改善水果果实品质[27]
2 植物生长调节剂对水果外观品质的影响
2.1 果形指数
果形指数是指果实纵径与横径的比值。在果树种植和果品销售中,果形指数是评估果实品质的重要指标之一。研究发现,植物生长调节剂能对果形指数造成影响。陈黎明等[28]在芒果小果期用3.2×10-2 g/L的TDZ处理芒果,可以极显著增大芒果的果形指数。陈鹏飞等[21]研究发现在开花期10 d和20 d分别用不同浓度GA3和6-BA处理“户太八号”,各处理组果实的果形指数均有增加,且用GA3处理的各处理组的果形指数均显著大于对照组。朱学慧等[16]20 d用7×10-2 g/L的GA3和1×10-3 g/L的CPPU处理无核白鸡心葡萄后,与对照组相比,果实果形指数增加了19.02%。郑直[29]发现,在盛花期只使用GA3处理“阳光玫瑰”葡萄果穗,成熟后果实果形指数显著增大,但GA3、CPPU和TDZ 3种植物生长调节剂混合施用后,却显著降低了果形指数。
2.2 单果重
CPPU、GA3和TDZ等植物生长调节剂可以作为膨大剂显著增大果实的单果重(图1)。陈利娜等[30]研究发现经过不同浓度GA3溶液处理石榴,果实成熟后相较于对照组单果重没有明显差异。解鑫[17]花后20 d用不同浓度CPPU(5×10-3 g/L、1×10-2 g/L、2×10-2 g/L)浸蘸‘徐香’、‘金桃’和‘中华50’3种猕猴桃的幼果,发现3个品种猕猴桃果实单果重均有大幅增加,且单果重增幅随CPPU浓度的增加而增大。NESMITH等[31]利用不同浓度CPPU处理兔眼越橘,结果发现在果实膨大期处理可以增加果实单果质量32%。相较于GA3和CPPU单独处理越橘水果,二者组合使用对单果重的促进效果更好[32]。李钊阳等[18]研究发现喷施2、3、4、6 mg/kg的质量分数为0.2%的TDZ可溶液剂后能够使‘脆皮’金桔的单果重提升10.2%~12.2%。
3 植物生长调节剂对水果理化品质和营养品质的影响
3.1 对果实糖、酸含量的影响
糖是水果甜味的主要来源。水果中的糖分主要包括蔗糖、果糖和葡萄糖等,糖含量越高,果实的甜度就越大。同时,糖分的种类和比例也会影响果实的口感和风味。有机酸则给水果带来了酸味。有机酸主要有柠檬酸、苹果酸和酒石酸等,这些有机酸的含量和种类不同,使得水果的酸味有所差异。适度的酸味可以增加果实的清爽口感,提升整体风味。研究发现,同一种植物生长调节剂在不同水果上作用不同。使用质量分数为0.2%的TDZ处理金桔能够增加果肉中的含糖量以及降低果肉中的可滴定酸[18],而在对芒果施用TDZ会抑制可溶性糖的积累并且促进可滴定酸的积累[28]。而朱学慧等[16]花后20 d用多个浓度的GA3和多个浓度的CPPU组合处理无核白鸡心葡萄后,处理组的可溶性糖含量均高于对照组,但高浓度(>1×10-2 g/L)的CPPU可能会抑制可溶性糖的积累。LI等[33]研究发现用“Pro-Gibb”(主要成分为GA3)处理降低了可滴定酸含量。郑直[29]研究发现在盛花期无论是混合使用GA3、CPPU和TDZ还是单独使用都可以降低果实中的可滴定酸含量。用CPPU处理甜瓜会抑制甜瓜总糖的积累[3]。PBZ可以有效增加芒果中总糖、还原糖、糖酸比并降低可滴定酸含量,但是对葡萄、草莓和桃子果实品质没有明显改善[22]。由此可见,植物生长调节剂能促进或抑制总糖和可滴定酸的积累,以及促进还原糖的积累(图1)。
3.2 对果实中可溶性固形物的影响
TDZ对水果中可溶性固形物的影响会根据水果种类发生改变。TDZ可以促进金桔[18]和芒果[28]果实中可溶性固形物的积累;在盛花期25 d用TDZ和CPPU处理‘徐香猕猴桃’,无论是单独处理还是组合使用,均会降低果实中可溶性固形物的含量[34]。陈鹏飞等[21]研究发现在开花期10 d和20 d用6-BA和GA3单独处理‘户太八号’葡萄,均增加了可溶性固形物的积累。用GA3与CPPU组合使用处理越橘,可溶性固形物相较于对照组增长了14.4%,同样也高于CPPU单独处理[32]。王铤等[35]研究表明在果实进入第2次膨大期后使用胺鲜酯(diethyl aminoethyl hexanoate,DA-6)可以促进果实中可溶性固形物的积累,并且可溶性固形物含量随DA-6处理浓度的增加呈先增加后减少的趋势。马文尧[36]研究发现在草莓苗期喷施BR和硝钠·胺鲜酯,处理组的可溶性固形物含量均大于对照组。关于CPPU对猕猴桃果实中可溶性固形物的影响,部分研究表明CPPU促进猕猴桃果实可溶性固形物的积累[17],也有研究表明CPPU会抑制猕猴桃可溶性固形物的积累[34],这可能跟CPPU的浓度有关,当处理浓度高于1×10-2 g/L 时,可溶性固形物含量与施用浓度呈负相关;CPPU浓度越高,可溶性固形物含量越低,且均低于CK[17]。TORRES等[37]研究发现在盛花期和落花期后用1-氨基环丙烷羧酸(1-aminocyclopropane-1-carboxylic acid,ACC)处理‘Flatbeauti’梨对果实中可溶性固形物含量没有显著影响。PARK等[24]在收获前1~2周分别用1-MCP和氨基乙氧基乙烯基甘氨酸(2-aminoethxyvinlglycine,AVG)处理‘富士’苹果,处理组中均没有检出对可溶性固形物的影响。大多数植物生长调节剂对可溶性固形物的积累具有积极作用,但也有植物生长调节剂,如CPPU和DA-6,对可溶性固形物促进效果随着自身浓度的增加而减弱,甚至出现抑制可溶性固形物积累的现象(图1)。
3.3 对水果中维生素C含量的影响
植物生长调节剂还可以促进或者抑制维生素C的积累。杨琴等[38]在幼果期、膨大期和转色期3个时期均使用3种植物生长调节剂处理百香果。实验发现,用1×10-2 g/L的2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)、5×10-2 g/L的质量分数为5%的氨基寡糖素处理组维生素C含量都显著低于对照组,分别降低了30.75%、5.27%;5×10-5 g/L的质量分数为0.01%的EBR处理后维生素C含量较对照组升高了24.57%。王欢欢等[39]在灰枣幼果期组合使用0.25 mmol/L SA与3×10-2 g/L DA-6,发现处理组果实的维生素C含量显著高于对照组,但在此植物生长调节剂组合基础上,无论是再施加1×10-2 g/L的油菜素内酯还是1.5×10-2 g/L的烯效唑,果实中维生素C含量反而都显著低于对照组。
3.4 对水果中矿质元素含量的影响
植物生长调节剂也可以对果实中的矿质元素造成一定的影响(图1)。在花后2周用1.25×10-2 g/L的CPPU处理可以显著提高猕猴桃果实中的Ca、P和Mg含量,显著降低B的含量;6-BA则可以显著提高猕猴桃果实中的Ca和Mg含量,显著降低K的含量[40]。GA3处理温州蜜柑早熟品种‘Miyagawa Wase’,果实中的N、P、Mg的含量均高于未处理的果实[41]。
3.5 对水果中氨基酸和蛋白质含量的影响
CHEN等[3]在盛花期用CPPU处理甜瓜发现,相较于蜜蜂授粉的甜瓜,CPPU处理果实中可代谢为香气物质的氨基酸含量显著高于蜜蜂授粉果实,但脯氨酸含量却低于蜜蜂授粉的果实。高浓度(>1 g/L)PBZ、CCC和缩节胺可以增加无花果果实蛋白质含量,其中1.5 g/L的CCC处理组果实中蛋白质含量与对照组差异显著[42]。
4 植物生长调节剂对水果次生代谢产物的影响
4.1 对果实中类黄酮含量的影响
类黄酮化合物是一类广泛存在于植物中的次生代谢产物,以C6-C3-C6为骨架,可分为黄酮、异黄酮、黄酮醇、黄烷酮等,类黄酮化合物具有抗病毒、降血压、抗氧化和免疫调节等多种生物活性。王颖[43]在盛花期末期用外源赤霉素处理早熟葡萄品种‘夏黑’发现外源赤霉素处理会降低果实中总类黄酮含量,在果实发育过程中,这种抑制效果会越来越明显,但并没有改变果实中总类黄酮的积累模式。马文尧[36]在草莓苗期时分别施加油菜素内酯和硝钠·胺鲜酯,结果发现二者的施用对果实中类黄酮含量影响都不大。韩春红[25]分别用MeJA和二氢茉莉酸丙酯处理‘红香酥’、‘红玛瑙’和‘红酥宝’3种梨发现,无论是MeJA还是二氢茉莉酸丙酯都显著增加了果实中总类黄酮的含量。总黄酮含量在猕猴桃成熟过程中呈现下降趋势,解鑫[17]发现在花后20 d用不同浓度CPPU浸蘸幼果处理,对‘徐香’、‘金桃’、‘中华50’3种不同类型猕猴桃果实总黄酮含量的降低有一定程度的抑制作用,可以有效地维持果实中总黄酮含量,有利于猕猴桃抗氧化能力的保持。
4.2 对果实中芳香物质的影响
香气是水果最重要的感官品质之一,由成百上千种化合物组成,主要包括酯类、醇类、醛类、萜烯等,不同种类和不同含量的香气物质共同组成了水果的独特香气。植物生长调节剂既影响芳香物质的种类,又影响芳香物质的含量(图1)。郑欣欣等[44]在黄冠梨生长期施用GA4+7,发现在GA4+7处理组中的酯类数量持续下降,从33 种减少到了23种;烯类化合物数量减少了2 种,说明GA4+7处理过的梨果在贮藏过程中挥发性物质易分解或者挥发。崔媛媛[23]在香蕉七分熟后用3种植物生长调节剂处理香蕉,发现在香蕉转色期时,MeJA有促进醛类物质生成的作用;乙烯利则可以促进与乙烯相关性更强的反式-2-辛烯醛、反式-2,4-壬二烯醛等C8~C10醛的形成,而1-MCP不但降低了与乙烯相关(E,E)-2,4-壬二烯醛、反式-2,4-癸二烯醛,还显著增强了正己醛和2-己烯醛含量,说明了正己醛和 2-己烯醛的生物合成并不完全受乙烯调控。
5 植物生长调节剂对水果安全品质的影响
虽然植物生长调节剂对果实品质能起到重要的调控作用,但目前市场上传统的植物生长调节剂种类繁多,大多为化学合成,长期使用易造成环境污染;且植物生长调节剂能够影响人类和其他动物的生殖、发育,若食用残留过量植物生长调节剂的果实,会对人体健康产生潜在危害。比如,暴露在2,4-D下的男性可能会增加不育的风险,因2,4-D会抑制精子活性。孕早期接触植物生长调节剂,所生下的儿童体重较低且体脂百分比较高。GA和IAA处理小鼠,发现小鼠表现为生精过程紊乱和睾丸退行性改变[45]。王丽荣等[46]用HPLC测定了芒果中5 种植物生长调节剂的含量,其中芒果果皮中检测出了0.50 μg/g 6-BA、0.15 μg/g PBZ和0.092 μg/g TDZ,果肉中只检测出了0.11 μg/g TDZ。果皮中PBZ残留量高于目前规定的最大残留量(0.05 mg/kg),目前没有关于芒果中TDZ和6-BA的最大残留量规定。何欣等[47]通过液相色谱串联质谱检测出桃果实中PBZ、CCC、DA-6、复硝酸钠、GA、TDZ、CPPU和烯效唑8种PGRs。我国还未制定桃果实中这8种植物生长调节剂最大残留限量标准,但在桃中检测出的PBZ残留量最大值(1.324 μg/g)超过了日本(0.2 μg/g)和欧盟(0.15 μg/g)PBZ在桃果实中的最大残留量限制,而检测出的CPPU残留量(0.002 μg/g)在日本(0.1 μg/g)和欧盟(0.01 μg/g)规定范围内,除了GA在桃中无残留量限制,剩下5种PGRs在日本和欧盟未制定在桃果实中最大残留限量标准。GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》规定了包括CCC、DA-6在内的多种植物生长调节剂的最大残留量,但关于植物生长调节剂最大残留量并不全面,如桃树上仅登记了多效唑·甲哌鎓这一种植物生长调节剂。不同的植物生长调节剂在不同水果中的限量不完全相同,比如CCC在番茄中最大残留量为1 mg/kg,DA-6在番茄中最大残留量只有0.1 mg/kg。同时我国大部分还在使用PBZ等残留期长的产品,对调环酸钙和抗倒酯等新一代高效低残留产品研究较少。因此应严格遵守国家对植物生长调节剂限量的要求,防止过量使用而引起食品安全问题,危害人体健康。
6 植物生长调节剂的作用机理
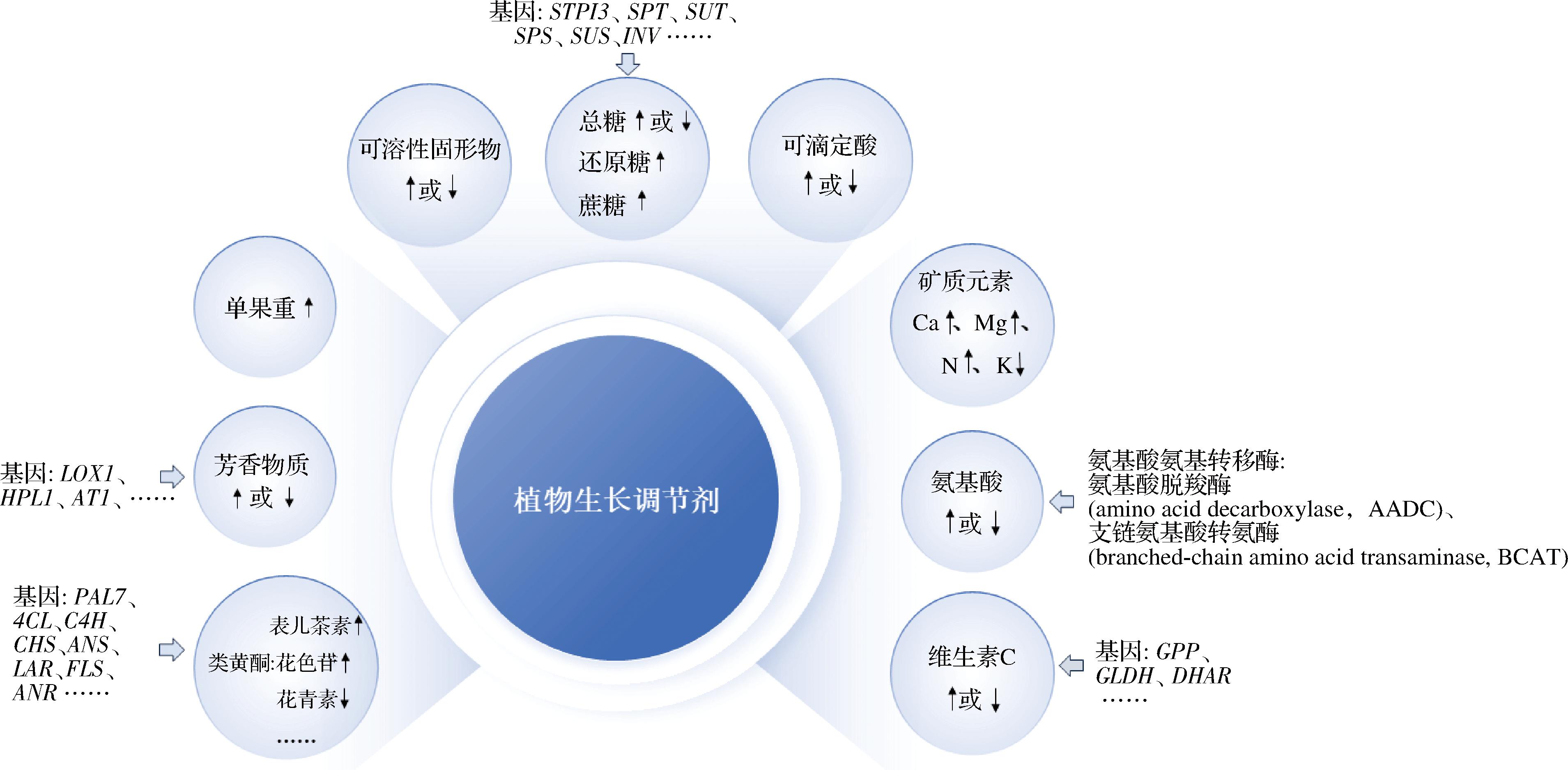
不同的植物生长调节剂可上调或下调果实的品质指标,通过调控基因表达而对水果的理化品质、营养品质和次生代谢产物产生不同程度的影响,如图1所示,植物生长调节剂通过调节糖代谢相关基因、脂氧合酶(lipoxygenase,LOX)途径基因、与类黄酮相关苯丙烷代谢途径基因、抗坏血酸代谢基因以及氨基酸氨基转移酶等调控糖、芳香物质、类黄酮、维生素C和氨基酸含量,关于植物生长调节剂对单果重、可滴定酸和矿质元素等品质性状的调节机制还不清楚。本节系统总结了生长素、细胞分裂素、脱落酸、赤霉素、乙烯、油菜素内酯、茉莉酸、水杨酸和独角金内酯等9种常见的植物生长调节剂对果实品质调控的机理。
6.1 生长素
生长素的运输方式有极性运输和非极性运输2种方式。大多数生长素从花、幼叶等生产部位以自由扩散的方式运输到生长旺盛部位,称为非极性运输。虽然植物许多部位都能合成生长素,但是生长素的运输是必不可少的。生长素主要在茎尖产生,曾经认为生长素在茎尖分生组织产生,但使用生长素运输抑制剂处理会抑制IAA在茎尖的积累,说明可能叶原基中IAA运输至茎尖。
梨石细胞团含量和大小会影响梨果肉的硬度和咀嚼性,进而影响梨果实的口感。石细胞是果实发育早期通过增厚次生壁形成,生长素通过PbrARF13-PbrNSC-PbrMYB132模块抑制次生壁发育,进而抑制石细胞的形成。使用200 μmol/L的萘乙酸(1-naphthaleneacetic acid,NAA)可以抑制石细胞的含量并且抑制PbrNSC的表达。PbrNSC是次生壁发育的关键基因,也是PbrMYB132的正调控因子,PbrMYB132通过与PbrCESA4b/7a/8a和PbrLAC5等细胞壁合成酶基因启动子结合并且激活它们转录。而PbrARF13与PbrNSC启动子结合,抑制PbrNSC的转录,从而抑制梨果实次生壁的形成[48]。如图1所示,植物生长调节剂能影响GPP、GLDH、DHAR基因表达,最终调节维生素C含量。外源施加IAA能对植物合成维生素C造成影响,IAA通过诱导ARF家族中的SlARF4的表达,随后SlARF4与SlMYB11启动子结合并抑制其转录,并且SlMYB 11能够与GPP、GLDH、DHAR基因的启动子结合并促进它们的转录从而促进维生素C的合成,因此IAA通过SlARF4-SlMYB11模块抑制维生素C的合成。ABA可以诱导SlMAPK8,SlMAPK8磷酸化SlARF4并抑制其转录活性,而SlMAPK8磷酸化SlMYB11并激活其转录活性。因此IAA与ABA起拮抗作用[49]。
6.2 细胞分裂素
细胞分裂素长距离运输机制已经得到充分确立,人们发现iP型细胞分裂素在茎中占主导地位,而tZ型细胞分裂素则在根中大量积累,茎尖产生的细胞分裂素通过韧皮部从茎尖向根部运输,而根部产生的细胞分裂素则通过木质部从根部向茎尖运输。tZ型和iP型细胞分裂素的双向运输有利于将根、茎接收到的环境信号传达到彼此。
CPPU的使用会甜瓜苦味增加,葫芦素B(cucurbitacin B,CuB)是甜瓜主要的苦味三萜化合物,在甜瓜中Bhlh转录因子负责CuB的生物合成,CPPU诱导MYB相关转录因子CmRSM1,它会直接与CmBr启动子上的MYB基序结合,激活并且调节CuB的合成[50]。CPPU或TDZ通过促进ANR基因的表达,从而促进表儿茶素的积累(图1)。对葡萄施加CPPU或者TDZ,MYB86和ANR基因的表达水平增加,MYB86在草莓中证实通过调控参与类黄酮生物合成途径基因,ANR基因与表儿茶素合成基因相关,导致了CPPU或TDZ处理的果实中类黄酮含量增加以及CPPU处理果实细胞中的单宁含量高于其他处理。GST是类黄酮运载体,施加CPPU或TDZ后,GST23基因表达水平增加,并且与成熟果实中类黄酮含量一致[51]。
6.3 脱落酸
ABA是一种含有15个碳原子的倍半萜类化合物,主要从维管组织中产生[52],植物通过ABA在细胞、组织和器官的运输以及活性的激活丧失来适应环境[53]。IKEGAMI等[54]发现,在根部缺水条件下,叶片合成的ABA会运输至根部,但如果根部和叶片都缺水,ABA只会在叶片部位积累。植物体中的ABA以阴离子(ABA-)和质子化形式(ABAH)存在,后者是ABA在植物体内的主要存在形式。ABA在质子化的形式下可以自由穿过生物膜扩散[53]。ABA的主动运输需要转运蛋白介导,目前已知的转运蛋白有ABCG转运蛋白、NRT1/PTR(NPF)、DTX/MATE型转运蛋白以及AWPM-19家族蛋白(OsPM1)[52]。
外源ABA处理能够诱导果实中类胡萝卜素积累,ABA可以促进转录因子CsbZIP44与4个类胡萝卜素代谢相关基因(CsDXR、CsGGPPs、CsBCH1和CsNCED2)的启动子结合并激活它们的表达。CsHB5是CsbZIP44的调控因子并且可以会通过ABA诱导的方式激活其表达,CsbZIP44与CsHB5互作形成蛋白复合物并且这种互作会被ABA放大,并且CsbZIP44-CsHB5蛋白复合体能够增强各自对靶基因的激活作用(CsHB5的靶基因也有CsBCH1和CsNCED2)[55]。后续研究又发现,转录调控模块CsERF110-CsERF53对ABA信号传导有反应,诱导类胡萝卜素的积累,进而协调柑橘果实着色[56]。研究发现,CsERF110作为必需激活剂参与ABA诱导的类胡萝卜素积累,而且还可能有核定位转录激活因子的作用。CsERF110直接与靶胡萝卜素基因CsGGPPS、CsPDS、CsCRTISO、CsLCYB2、CsLCYE、CsHYD和CsNCED2的启动子结合并激活表达。此外,CsERF110能与CsERF53结合并且促进CsERF53的转录,ABA处理会放大这种促进效果。像CsERF110,CsERF53也作为一种必需的核定位转录激活因子参与ABA诱导的类胡萝卜素积累,并且CsERF53直接结合CsPSY、CsGGPPS、CsHYD、CsZEP和CsNCED2的启动子并激活其表达,ABA信号进一步放大了增强激活作用[56]。ABA通过影响SPT等糖代谢基因最终促进糖含量的积累(图1)。在草莓中转录因子FaTCP7能够直接与糖转运蛋白基因FaSTP13和FaSPT启动子结合并抑制糖转运蛋白基因的转录,降低果实中糖含量。ABA处理可以增强蛋白激酶FaRIPK1与FaTCP7相互作用,并且FaRIPK1能够将FaTCP7关键位点磷酸化。磷酸化后的FaTCP7与FaSTP13和FaSPT启动子结合能力受到抑制,从而促进FaSTP13和FaSPT的转录,增加果实中糖含量[57]。
6.4 赤霉素
目前为止有大概140种GA,但具有生物活性的只有GA1、GA3、GA4和GA7,植物体中有GA1、GA3和GA4[1,9]。GA的生物合成在3个细胞区室,分别在质体、内质网和细胞质[9]。GA抑制剂能通过抑制GA生物合成发挥生理功能,如PBZ通过灭活CYP450,阻止内根-贝壳杉烯氧化为内根-贝壳杉烯酸的过程[22]。ABA与GA有相同生物合成前体。外源PBZ能够提升植物体内的ABA含量,但这种提升是短暂的,ABA含量最终会回到正常水平或者低于正常水平[22]。
早期的研究发现GA在植物体中具有移动性,并且是非极性的[9]。有研究证明GA20是豌豆植株中主要的可移动形式,GA12是GA通过维管束进行远距离运输的主要形式[9]。但是对GA的转运蛋白和转运机制并不了解,近年来关于GA的转运蛋白有了一定进展。目前已鉴定的GA转运蛋白有糖转运体(SWEET)和对硝基苯酚转运体(NPF)。NPF是第一个被鉴定的GA转运蛋白,利用改良的酵母双杂交系统和在非洲爪蟾卵母细胞鉴定了几种NPF蛋白家族,包括NPF2.3、NPF2.4、NPF2.5、NPF2.7、NPF2.10和NPF3.1[52]。NPF2.12和NPF2.13(作为ABA和GA的转运体)和NPF2.14共同调节木质部的形成[58]。SWEET作为糖转运体也可以参与GA的转运,在酵母细胞和卵母细胞中发现能够介导GA输入细胞,在拟南芥中sweet13 sweet14双突变体的具有开药开裂的缺陷,这一表型可以通过外源GA处理而逆转[52]。
GA的信号转导通路与其他植物生长调节剂类似,都涉及活性信号分子(即为GA)被受体识别并结合,最后引起转录调控因子的降解。GA信号通路包括3个核心部分,赤霉素受体(GID1)及其直接的下游阻遏物(DELLA蛋白)和激活物(F-box蛋白GID2/SLEEPY1[SLY1])。
如图1所示,当对葡萄施加外源GA3时,发现与类黄酮合成相关基因显著上升,如PAL7、4CL、C4H、CHS、CHI、F3′H、F3H和LDOX,它们在类黄酮合成途径中发挥着重要作用,因此GA3处理能促进葡萄果实中类黄酮含量的积累,但是具体的调控机制还不清楚[59]。外源赤霉素处理能提高赤霉素刺激转录因子1(GAST1)的表达,抑制包括成熟抑制子(RIN)、不成熟(NOR)和无色不成熟(CNR)在内的果实成熟调控因子的表达对果实成熟进行调控。除此之外,还影响乙烯合成和信号转导,如减少ACS2、ACS4、ACO1和ETR4等基因的表达[60]。除了调控乙烯,GA还可以通过介导IAA、ABA和BR调控果实成熟和软化[61]。
6.5 乙烯
AVG是有效的乙烯生物合成抑制剂,通过抑制1-氨基环丙烷羧酸合酶(1-aminocyclopropane-1-carboxylate synthase,ACS)的活性来抑制乙烯的合成,常用于苹果、梨、桃等水果中。一些物理方法处理也可以抑制乙烯的合成,如热水处理、紫外线C等。用热水处理抑制了早期内源性乙烯的产生,可能是因为ACC积累的减少或者是消除了ACS和ACC氧化酶(1-aminocyclopropane-1-carboxylate oxidase,ACO)的刺激[62]。
乙烯作为气体分子没有直接的转运蛋白,但是乙烯的前体ACC能够在植物体内进行远距离传递乙烯信号[52]。由于ACC不是气体,因此不会快速扩散。ACC主要通过木质部进行长距离运输[52],但在韧皮部中也发现能完成ACC运输。
近年来揭示了乙烯通过MdMAPK3-MdNAC72模块调控苹果软化的分子机制。乙烯通过增强MdMAPK3激酶的活性,促进其对MdNAC72磷酸化,磷酸化后的MdNAC72被E3连接酶MdPUB24泛素化,进入26S蛋白酶体途径降解。MdNAC72是细胞壁降解相关基因MdPG1的转录抑制因子[63]。同样在苹果中,乙烯通过诱导MYB转录因子的表达来促进花色苷的生成。MYB1在调控花色苷的生成起到重要作用,MdEIL1直接激活MYB1的表达从而促进花色苷的生成[64]。如图1所示,乙烯处理会上调苹果果实中参与挥发性物质合成基因的表达,如芳香氨基酸转氨酶(aromatic amino acid aminotransferase,ArAT)、BCAT、AADC等,使用1-MCP处理会抑制这些基因的表达,这说明它们的表达受乙烯的调控[65]。
6.6 油菜素内酯
植物中发现了3条生成油菜素内酯的合成路径,分别生成C27、C28和C29类型的BR。BR的合成在细胞内部完成,但是BR却在细胞表面被感知,这就意味着BR通过某种方式从细胞内转运至细胞外。但是具有生物活性的BR是一种极性分子,具有亲水性,不能轻易通过扩散作用跨越细胞屏障,因此BR应该需要借助转运蛋白来完成跨越细胞膜的过程。近期,鉴定出了ABCB19是BR转运蛋白[66]。BR与ABCB19结合并刺激其ATP酶的活性,二者的结合亲和力在微摩尔范围[66]。ABCB1和ABCB19正调控BR信号而BR信号反过来又控制转运蛋白的周转[66]。BR在细胞外能够通过胞间连丝这种方式完成短距离运输[67]。目前还没有实验能够表明BR能够完成长距离的运输。
BR可以促进果实成熟,当进行外源BR处理,番茄果实成熟提前。在成熟期间SlBZR1高度表达,如果敲除SlBZR1,番茄成熟受到抑制,并且发现SlBZR1和SlBES1冗余调控果实成熟与软化。此外,SlBZR1还能够直接调控类胡萝卜素和乙烯合成相关基因,促进类胡萝卜素和乙烯的积累,以确保果实成熟和品质的形成[68]。如图1所示,BR通过影响类黄酮合成基因和糖代谢基因,从而调控类黄酮和糖含量积累。当施用外源BL处理苹果愈伤组织和叶片时,发现MdFLS、MdLAR、MdANR、MdUFGT和MdANS这几个类黄酮生物合成基因的表达受到抑制,愈伤组织和叶片中的类黄酮、花青素和原花青素含量较低,如果使用芸苔素唑(BRZ,一种BR生物合成抑制剂)处理,效果截然相反[69]。使用外源EBR处理葡萄可以促进葡萄中原花青素的积累并诱导相关基因的表达,这说明BR对类黄酮化合物的影响效果在不同植物物种中存在差异[70]。使用一定浓度的EBR处理葡萄果实可以促进与糖代谢相关基因VvSS、VvcwINV、VvHT1和VvSUC12的表达,促进了在葡萄转色期时VvSPS的表达。此外,还促进了蔗糖合酶和蔗糖磷酸合酶的活性[71]。
6.7 茉莉酸
JA及其衍生物的合成涉及叶绿体、过氧化物酶体和细胞质3个合成部位。正常情况下,植物体内的JA含量很少且没有生物活性,此时茉莉酸ZIM域蛋白(jasmonate-ZIMdomain,JAZ)抑制下游转录因子,抑制JA应答基因启动子,从而导致JA应答基因的激活受到抑制。当受到环境或者发育刺激时,植物积累具有生物活性的JA,例如JA-异亮氨酸复合体(JA-Ile)。
JA能影响相关基因表达从而影响类黄酮、糖和芳香物质含量(图1)。MdJAZ 5/10和MdERF1B相互作用抑制了MdMYC2和MdMYB1/9/11启动子的激活,导致MdMYC2和MdMYB1/9/11表达水平较低,花青素产生相关基因水平下调,从而抑制花青素积累。当施加外源JA时,JA水平升高,MdJAZ 5和MdJAZ 10被降解。由此产生的游离MdERF1B诱导MdMYC2和MdMYB1/9/11启动子活性,导致MdMYC2和MdMYB1/9/11表达水平较高,以及花青素生物合成和积累相关基因的上调[72]。MeJA可以与光共同调控花青素合成,在黑暗条件下SmCOP1通过26S蛋白酶体途径介导SmMYB5蛋白的降解,无法通过SmMYB5调节花青素合成基因的表达,弱光条件下,光抑制SmCOP1的泛素化功能,使SmMYB5得以释放。但是在缺乏JA时,SmJAZ5/10蛋白通过干扰SmMYB5-SmTT8复合物的稳定性和转录激活活性抑制SmF3H和SmANS的基因表达,当施加MeJA时,SmJAZ5/10被降解,释放的SmMYB5与SmTT8相互作用,协同激活SmF3H和SmANS的表达,从而促进茄子果皮中花青素的合成[73]。MeJA处理会促进草莓糖代谢相关基因的表达,如蔗糖合成酶基因FaSPS1和FaSPS2以及蔗糖转运蛋白家族(包括FaSUT1、FaSUT2、FaSUT3、FaSUT4、FaSUT5、FaSUT6和FaSUT7),从而促进蔗糖的积累[74]。关于梨,MeJA处理可以影响参与挥发性物质合成的酶的表达水平,如12-氧代-1,2-二烯酸还原酶(12-oxo-phytodienoate reductase,OPR)、LOX、醇脱氢酶(alcohol dehydrogenase,ADH)、醇乙酰转移酶(alcohol acetyltransferase,AAT)和羧基酯酶(carboxylesterase,CXE),从而导致酯类成分发生改变[75]。
6.8 水杨酸
植物合成SA有异分支酸合成酶(isochorismate synthase,ICS)途径和苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)途径,其中ICS途径是SA合成主要途径。ICS途径第一步发生在叶绿体中,分支酸首先在ICS的催化下转化为异构体,也就是异分支酸。随后转移至细胞质中,在PBS3的作用下异分支酸和谷氨酸生成异分支酸-谷氨酸加合物(ISC-9-Glu),ISC-9-Glu极其不稳定,很容易分解为SA。PBS3的生物活性会被SA所抑制,这种负反馈机制有利于植物调节SA的生物合成并控制SA在植物体中的水平。
SA在延缓果实成熟衰老方面有一定的作用,外源SA处理上调了乙烯生物合成负调控因子ETR,说明SA通过抑制乙烯的合成从而延缓果实成熟衰老,同时在一定程度上抑制了果实中与细胞壁降解相关的酶如多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectin methylesterase,PME)的活性[26]。SA可以促进酯类化合物的合成,通过上调PpLOX1、氢过氧化物裂解酶基因PpHPL1和PpAAT1的转录水平,影响LOX途径酶活性和酯形成[76]。SA处理苹果果实后,内源SA水平增加,此外还抑制了糖代谢相关基因MdSPS、MdSUSY、MdAINV、MdNINV、MdAMY、MdBam5和MdBam8的转录水平,从而抑制了淀粉转化为其他糖的过程,最终延长了货架期[77]。
6.9 独角金内酯
SL在根部有较高水平,通过嫁接实验发现SL可以从根部运输至地上部,并且己内酯、己内酯酸和/或其代谢产物甲基独脚金内酯和羟基甲基独脚金内酯可能作为信号分子,但是是否通过木质部或者细胞间运输还需要更多的实验研究[78]。
如图1所示,SL影响糖代谢相关基因和类黄酮合成基因,从而影响糖和类黄酮含量。对处于在淹水胁迫下葡萄施加SL类化合物GR24,发现参与淀粉合成的基因(如SUS和HK)表达下降,但是参与淀粉裂解的基因AM和TPS表达水平则上升,且发现β-D-果糖-6P的水平下降[79]。GR24处理28 d后,草莓中蔗糖含量显著提升,可能是GR24处理促进了蔗糖磷酸化酶(sucrose phosphorylase,SPP)、己糖激酶(hexokinase,HXK)、尿苷二磷酸葡萄糖焦磷酸化酶2(uridine diphosphate glucose pyrophosphorylase 2,UGP2)、糖基水解酶I(GPI),促进了蔗糖的积累,抑制了蔗糖合酶和转化酶的表达,减少了蔗糖的分解导致的。此外,GR24处理还促进了花青素合成基因,如C4H、CHS、CHI、F3H、FNS和ANS的表达,从而促进花青素的积累[27]。关于苹果, SL类似物GR245DS处理可以诱导MdHY5的表达,从而促进花色素的合成和积累,这一诱导效果受到MdPRT1-MdSMXL8-MdAGL9模块调节[80]。
7 总结与展望
植物生长调节剂能够调控植物的生长发育过程,对水果的外观品质如果形指数和单果重、内在理化和营养品质如可溶性固形物、糖、酸、维生素C、矿质元素、氨基酸和蛋白质以及次生代谢产物如类黄酮和芳香物质等有积极的调节作用,但施用不当也能对果实的品质产生一定的负面影响,如抑制可溶性固形物的积累,降低果实中维生素C的含量。同一种植物生长调节剂对不同水果的影响不同,甚至对同一种水果也会有不同的影响,并且对水果品质的具体影响会因植物生长调节剂的浓度和施用时间发生改变。
但目前植物生长调节剂的应用与研究仍存在一定的问题:大多为化学合成,存在环境污染和膳食风险,高效、低毒、低残留的植物生长调节剂产品偏少;使用标准与规范不完善,与国际标准存在差距,部分产品缺乏明确的限量标准;对果实品质调控的作用机制研究不深入,部分品质性状的调控机制不清。未来迫切需要开发高效、低残留和低毒害的新型植物生长调节剂代替部分传统产品,在使用过程中必须严格把控使用剂量和使用方法;对缺乏残留限量标准的植物生长调节剂产品,加快评估其对生态环境和农产品的影响以及膳食风险,制定科学合理的残留限量标准与使用规范;植物生长调节剂对品质影响的作用机制复杂,建议开展持续的田间试验及其对果实品质的影响评价,加强生理学、基因表达调控和代谢组学等多学科交叉研究,同时可进一步研究不同激素之间的互作机制,以阐明植物生长调节剂对果实品质形状的调控机理。
参考文献
[1] RADEMACHER W.Plant growth regulators:Backgrounds and uses in plant production[J].Journal of Plant Growth Regulation, 2015, 34(4):845-872.
[2] LIU C X, ZHANG M M, LI L, et al.Development and application of the novel plant growth regulator guvermectin:A perspective[J].Journal of Agricultural and Food Chemistry, 2024, 72(15):8365-8371.
[3] CHEN H W, CHENG J T, HUANG Y, et al.Comparative analysis of sugar, acid, and volatile compounds in CPPU-treated and honeybee-pollinated melon fruits during different developmental stages[J].Food Chemistry, 2023, 401:134072.
[4] 崔筱,孔维丽.生长素IAA对食用菌生长发育影响的研究进展[J].中国瓜菜, 2024,37(8):8-14.CUI X, KONG W L.Research progress of auxin IAA on the growth and development of edible fungi[J].China Cucurbits and Vegetables, 2024, 37(8):8-14.
[5] CHEN Z L, DEBERNARDI J M, DUBCOVSKY J, et al.Recent advances in crop transformation technologies[J].Nature Plants, 2022, 8(12):1343-1351.
[6] HAJAM A H, ALI M S, SINGH S K, et al.Understanding cytokinin:Biosynthesis, signal transduction, growth regulation, and phytohormonal crosstalk under heavy metal stress[J].Environmental and Experimental Botany, 2024, 228:106025.
[7] MILLER C O, SKOOG F, VON SALTZA M H, et al.Kinetin, a cell division factor from deoxyribonucleic acid[J].Journal of the American Chemical Society, 1955, 77(5):1392.
[8] ZHAO Y, CHAN Z L, GAO J H, et al.ABA receptor PYL9 promotes drought resistance and leaf senescence[J].Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(7):1949-1954.
[9] SHANI E, HEDDEN P, SUN T P.Highlights in gibberellin research:A tale of the dwarf and the slender[J].Plant Physiology, 2024, 195(1):111-134.
[10] 郭丽英, 莫洁欣, 李冰虹, 等.乙烯利在果蔬上的应用研究进展[J].南方农业, 2024,18(17):81-85.GUO L Y, MO J X, LI B H, et al.Research progress on the application of ethephon in fruits and vegetables[J].South China Agriculture, 2024, 18(17):81-85.
[11] ZEBOSI B, VOLLBRECHT E, BEST N B.Brassinosteroid biosynthesis and signaling:Conserved and diversified functions of core genes across multiple plant species[J].Plant Communications, 2024, 5(9):100 982-100982.
[12] YANG Y Z, CHU C C, QIAN Q, et al.Leveraging brassinosteroids towards the next green revolution[J].Trends in Plant Science, 2024, 29(1):86-98.
[13] COOK C E, WHICHARD L P, TURNER B, et al.Germination of witchweed (Striga lutea Lour.):Isolation and properties of a potent stimulant[J].Science, 1966, 154(3753):1189-1190.
[14] 张志霞, 包小琴, 牛敏, 等.独角金内酯的研究进展及其在果树中的应用展望[J].农村经济与科技, 2024,35(5):18-21.ZHANG Z X, BAO X Q, NIU M, et al.Research progress of unicornolide and its application prospect in fruit trees[J].Rural Economy and Science-Technology, 2024, 35(5):18-21.
[15] 严婷婷, 李二莉, 王满青, 等.生长素抑制剂对荔枝开花坐果的调控效应研究[J].果树学报, 2025,42(1):162-169.YAN T T, LI E L, WANG M Q, et al.Regulatory effect of auxin inhibitors on flowering and fruit setting in litchi[J].Journal of Fruit Science, 2025, 42(1):162-169.
[16] 朱学慧, 谢辉, 韩守安, 等.两种植物生长调节剂对无核白鸡心葡萄果实品质的影响[J].浙江农业学报, 2024,36(6):1309-1319.ZHU X H, XIE H, HAN S A, et al.Effect of two plant growth regulators on the fruit quality of ‘Centennial Seedless’ grapes[J].Acta Agriculturae Zhejiangensis, 2024, 36(6):1309-1319.
[17] 解鑫. 氯吡脲对猕猴桃果实发育期及贮藏期营养物质变化的影响[D].北京:中国农业科学院,2023.XIE X.The impact of forchlorfenuron on nutrient changes during the development and storage of kiwifruit[D].Beijing:Chinese Academy of Agricultural Sciences, 2023.
[18] 李钊阳, SHAUKAT ALI, 唐良德, 等.0.2%噻苯隆可溶液剂对金桔产量和品质的影响[J].中国农学通报, 2021,37(16):33-36.LI Z Y, ALI S, TANG L D, et al.Effects of thidiazuron 0.2% soluble liquid on yield and quality of kumquat tree[J].Chinese Agricultural Science Bulletin, 2021, 37(16):33-36.
[19] 金龙飞, 尹欣幸, 刘烽,等.植物生长调节剂在柑橘生产中的应用研究进展[J].浙江柑橘, 2023,40(4):5-10.JIN L F, YIN X X, LIU F, et al.Research progress on application of plant growth regulators in citrus production[J].Zhejiang Canju, 2023, 40(4):5-10.
[20] 罗俊霞, 赵建波, 申战宾,等.植物生长调节剂和除草剂在葡萄上的登记应用现状分析[J].生物灾害科学, 2024,47(2):274-283.LUO J X, ZHAO J B, SHEN Z B, et al.An analysis of the registration and application status of plant growth regulators and herbicides on grapes[J].Biological of Disaster Science, 2024, 47(2):274-283.
[21] 陈鹏飞, 刘春燕, 张卓尔, 等.6-苄氨基嘌呤和赤霉素对‘户太八号’葡萄果实品质的影响[J].新疆农业大学学报, 2023,46(4):289-294.CHEN P F, LIU C Y, ZHANG Z E, et al.Effects of 6-benzylaminopurine and gibberellin acid on fruit quality of ‘hutai No.8’ grapevine[J].Journal of Xinjiang Agricultural University, 2023, 46(4):289-294.
[22] DESTA B, AMARE G.Paclobutrazol as a plant growth regulator[J].Chemical and Biological Technologies in Agriculture, 2021, 8(1):1.
[23] 崔媛媛. 植物生长调节剂对香蕉后熟过程中挥发性物质的影响[D].武汉:华中农业大学,2022.CUI Y Y.Effects of Plant growth regulators on volatile compounds during the ripening process of banana[D].Wuhan:Huazhong Agricultural University, 2022.
[24] PARK D S, AL SHOFFE Y, ALGUL B E, et al.Preharvest application of 1-methylcyclopropene and 1-aminoethoxyvinylglycine affects watercore severity and volatile profiles of ‘Fuji’ apples stored in air and controlled atmospheres[J].Postharvest Biology and Technology, 2024, 211:112840.
[25] 韩春红. 套袋和喷施外源物(MeJA、PDJ)对红皮梨果实品质的影响[D].洛阳:河南科技大学,2022.HAN C H.Effects of bagging and spraying exogenous substances (meja, pdj) on fruit quality of red-skinned pears[D].Luoyang:Henan University of Science and Technology, 2022.
[26] CHENG A, ZHAO P F, WANG X, et al.Relationships between melatonin and salicylic acid treatments in delaying the senescence of postharvest pear fruit[J].Postharvest Biology and Technology, 2025, 219:113288.
[27] LI M Y, YANG M, LIU X Y, et al.Pre-harvest application of strigolactone (GR24) accelerates strawberry ripening and improves fruit quality[J].Agronomy, 2023, 13(11):2699
[28] 陈黎明, 李少卡, 白蓓蓓, 等.不同浓度噻苯隆对芒果果实品质和有机酸组分的影响[J].中国果树, 2024(5):82-88.CHEN L M, LI S K, BAI B B, et al.Effects of different concentrations of thidiazuron on the quality and organic acid composition of mango fruit[J].China Fruit, 2024(5):82-88.
[29] 郑直. CPPU、TDZ及不同套袋方式处理对‘阳光玫瑰’葡萄果实生长发育的影响[D].南京:南京农业大学,2021.ZHENG Z.Effects of CPPU, TDZ, and different bagging methods on the fruit growth and development of ‘shine muscat’ grapes [D].Nanjing:Nanjing Agricultural University, 2021.
[30] 陈利娜, 牛娟, 刘贝贝, 等.不同花期喷施植物生长调节剂对石榴坐果及果实品质的影响[J].果树学报, 2020,37(2):244-253.CHEN L N, NIU J, LIU B B, et al.Effects of foliar application of plant growth regulators at different flowering stages on fruit setting and fruit quality in pomegranate[J].Journal of Fruit Science, 2020, 37(2):244-253.
[31] NESMITH D S, ADAIR H M.Rabbiteye blueberry field trials with the growth regulator CPPU[J].Small Fruits Review, 2004, 3(1-2):183-191.
[32] 王宇航, 雷蕾, 孙海悦, 等.赤霉素与氯吡苯脲对越橘果实品质影响的分析及评价[J].北方园艺, 2019(13):44-52.WANG Y H, LEI L, SUN H Y, et al.Analysis and evaluation of the effect of GA3 and CPPU on the fruit quality of bluebeny[J].Northern Horticulture, 2019(13):44-52.
[33] LI L, YAN W J, YAO H D, et al.Influences of two plant growth regulators on the fruit quality of the ‘crimson seedless’ grapes[J].Journal of Plant Growth Regulation, 2023, 42(2):771-779.
[34] 李为福, 黄兰淇, 宋韵琼, 等.不同植物生长调节剂及其组合对‘徐香’猕猴桃果实品质的影响[J].南方园艺, 2021,32(5):14-17.LI W F, HUANG L Q, SONG Y Q, et al.Effects of different plant growth regulators and their combinations on fruit quality of ‘Xuxiang’ kiwifruit[J].Southern Horticulture, 2021, 32(5):14-17.
[35] 王铤, 黄科文, 陈胜雯, 等.胺鲜酯对桃果实品质的影响[J].北方园艺, 2023(18):35-42.WANG T, HUANG K W, CHEN S W, et al.Effects of diethyl aminoethyl hexanoate (DA-6) on fruit quality of peach[J].Northern Horticulture, 2023(18):35-42.
[36] 马文尧. 叶面喷施油菜素内酯及硝钠.胺鲜酯对草莓生长发育的影响[D].南京:南京农业大学,2022.MA W Y.The influence of foliar spraying with brassinolide and sodium nitrate-daminozide on the growth and development of strawberry[D].Nanjing:Nanjing Agricultural University, 2022
[37] TORRES E, CAIMEL D, AS N L.Responses of ethylene emission, abscission, and fruit quality to the application of ACC as a chemical thinner in ‘flatbeauti’ peach[J].Journal of Plant Growth Regulation, 2024, 43(11):4171-4184.
N L.Responses of ethylene emission, abscission, and fruit quality to the application of ACC as a chemical thinner in ‘flatbeauti’ peach[J].Journal of Plant Growth Regulation, 2024, 43(11):4171-4184.
[38] 杨琴, 俞露, 赵芷, 等.植物生长调节剂对百香果的影响[J].中国农学通报, 2021,37(19):58-64.YANG Q, YU L, ZHAO Z, et al.Effects of plant growth regulators on Passiflora edulia[J].Chinese Agricultural Science Bulletin, 2021, 37(19):58-64.
[39] 王欢欢, 王晶晶, 陈奇凌.植物生长调节剂对灰枣产量及果实品质的影响[J].中国果树, 2024(8):63-68.WANG H H, WANG J J, CHEN Q L.Effects of plant growth regulators on yield and fruit quality of ‘Huizao’ jujube[J].China Fruits, 2024(8):63-68.
[40] 张慧, 刘世彪, 唐元桂, 等.不同植物生长调节剂对猕猴桃单果重及营养成分的影响[J].湖南农业大学学报(自然科学版), 2015,41(4):385-390.ZHANG H, LIU S B, TANG Y G, et al.Effects of different plant growth regulators on fruit weights and nutritional components of kiwifruit[J].Journal of Hunan Agricultural University (Natural Sciences Edition), 2015, 41(4):385-390.
[41] YAMAGA I, TONOOKA C, EMOTO Y.A comprehensive analysis of gibberellic acid and prohydrojasmon treatments for mitigating rind puffing and rind disorder of early-maturing cultivar of Satsuma mandarin[J].Horticulture, Environment, and Biotechnology, 2024, 65(4):627-636.
[42] 苏宇霞, 余丽萍, 刘厚基, 等.植物生长调节剂对设施无花果生长及果实品质的影响[J].经济林研究, 2024,42(1):284-293.SU Y X, YU L P, LIU H J, et al.Effects of plant growth regulators on growth and fruit quality of facility figs[J].Non-wood Forest Research, 2024, 42(1):284-293.
[43] 王颖. 外源赤霉素对葡萄果实品质及果皮花色苷代谢的影响[D].晋中:山西农业大学,2023.WANG Y.Effects of exogenous gibberellic acid on grape fruit quality and anthocyanin metabolism in fruit skin[D].Jinzhong:Shanxi Agricultural University, 2023.
[44] 郑欣欣, 颜朦朦, 陈子雷, 等.生长期施用GA4+7对黄冠梨贮藏过程中挥发性有机化合物的变化影响[J].齐鲁工业大学学报, 2024,38(1):19-29.ZHENG X X, YAN M M, CHEN Z L, et al.Effects of GA4+7 applied during the growth period on the changes of volatile organic compounds in Huangguan pear during storage[J].Journal of Qilu University of Technology, 2024, 38(1):19-29.
[45] WANG X X, HAO W D.Reproductive and developmental toxicity of plant growth regulators in humans and animals[J].Pesticide Biochemistry and Physiology, 2023, 196:105640.
[46] 王丽荣,贾文君,陈明敏,等.高效液相色谱法(HPLC)测定芒果多种植物生长调节剂含量[J].植物生理学报, 2022,58(5):981-988.WANG L R, JIA W J, CHEN M M, et al.Determination of contents of several plant growth regulators in mango by high-performance liquid chromatography (HPLC)[J].Plant Physiology Journal, 2022, 58(5):981-988.
[47] 何欣,陈健,李勇,等.八种植物生长调节剂在桃果实上的残留及膳食摄入风险评估[J].江苏农业学报, 2024,40(10):1962-1969.HE X, CHEN J, LI Y, et al.Residues and dietary intake risk assessment of eight plant growth regulators in peach fruits[J].Jiangsu Journal of Agricultural Sciences, 2024, 40(10):1962-1969.
[48] XU S Z, SUN M Y, YAO J L, et al.Auxin inhibits lignin and cellulose biosynthesis in stone cells of pear fruit via the PbrARF13-PbrNSC-PbrMYB132 transcriptional regulatory cascade[J].Plant Biotechnology Journal, 2023, 21(7):1408-1425.
[49] XU X, ZHANG QD, GAO X L, et al.Auxin and abscisic acid antagonistically regulate ascorbic acid production via the SlMAPK8-SlARF4-SlMYB11 module in tomato[J].The Plant Cell, 2022, 34(11):4409-4427.
[50] WANG M Y, JIANG N Y, XU Y C, et al.CmBr confers fruit bitterness under CPPU treatment in melon[J].Plant Biotechnology Journal, 2024, 22(10):2724-2737.
[51] ZHENG T, ZHAO P C, XIANG J, et al.Integrated transcriptomic and metabolomic analysis reveals the effects of forchlorfenuron and thidiazuron on flavonoid biosynthesis in table grape skins[J].Current Plant Biology, 2024, 40:100417.
[52] ZHANG Y Q, BERMAN A, SHANI E.Plant hormone transport and localization:Signaling molecules on the move[J].Annual Review of Plant Biology, 2023, 74:453-479.
[53] CHEN K, LI G J, BRESSAN R A, et al.Abscisic acid dynamics, signaling, and functions in plants[J].Journal of Integrative Plant Biology, 2020, 62(1):25-54.
[54] IKEGAMI K, OKAMOTO M, SEO M, et al.Activation of abscisic acid biosynthesis in the leaves of Arabidopsis thaliana in response to water deficit[J].Journal of Plant Research, 2009, 122(2):235-243.
[55] SUN Q, HE Z C, WEI R R, et al.The transcriptional regulatory module CsHB5-CsbZIP44 positively regulates abscisic acid-mediated carotenoid biosynthesis in citrus (Citrus spp.)[J].Plant Biotechnology Journal, 2024, 22(3):722-737.
[56] SUN Q, HE Z C, FENG D, et al.The abscisic acid-responsive transcriptional regulatory module CsERF110-CsERF53 orchestrates citrus fruit coloration[J].Plant Communications, 2024, 5(11):101065.
[57] CHEN X X, GAO J H, SHEN Y Y.Abscisic acid controls sugar accumulation essential to strawberry fruit ripening via the FaRIPK1-FaTCP7-FaSTP13/FaSPT module[J].The Plant Journal, 2024, 119(3):1400-1417.
[58] BINENBAUM J, WULFF N, CAMUT L, et al.Gibberellin and abscisic acid transporters facilitate endodermal suberin formation in Arabidopsis[J].Nature Plants, 2023, 9(5):785-802.
[59] DONG Y J, WU Y X, ZHANG Z X, et al.Transcriptomic analysis reveals GA3 is involved in regulating flavonoid metabolism in grape development for facility cultivation[J].Molecular Genetics and Genomics, 2023,298(4):845-855.
[60] LI H, WU H, QI Q, et al.Gibberellins play a role in regulating tomato fruit ripening[J].Plant and Cell Physiology, 2019, 60(7):1619-1629.
[61] WU M B, LIU K D, LI H H, et al.Gibberellins involved in fruit ripening and softening by mediating multiple hormonal signals in tomato[J].Horticulture Research, 2023, 11(2):uhad275.
[62] OPIO P, JITAREERAT P, PONGPRASERT N, et al.Efficacy of hot water immersion on lime (Citrus auranifolia, Swingle cv.Paan) fruit packed with ethanol vapor in delaying chlorophyll catabolism[J].Scientia Horticulturae, 2017, 224:258-264.
[63] WEI Y, LIU Z, LYU T X, et al.Ethylene enhances MdMAPK3-mediated phosphorylation of MdNAC72 to promote apple fruit softening[J].The Plant Cell, 2023, 35(8):2887-2909.
[64] AN J P, WANG X F, LI Y Y, et al.EIN3-LIKE1, MYB1, and ETHYLENE RESPONSE FACTOR3 act in a regulatory loop that synergistically modulates ethylene biosynthesis and anthocyanin accumulation[J].Plant Physiology, 2018, 178(2):808-823.
[65] YANG X T, SONG J, DU L N, et al.Ethylene and 1-MCP regulate major volatile biosynthetic pathways in apple fruit[J].Food Chemistry, 2016, 194:325-336.
[66] YING W, WANG Y W, WEI H, et al.Structure and function of the Arabidopsis ABC transporter ABCB19 in brassinosteroid export[J].Science, 2024, 383(6689):eadj4591.
[67] WANG Y W, PEREZ-SANCHO J, PLATRE M P, et al.Plasmodesmata mediate cell-to-cell transport of brassinosteroid hormones[J].Nature Chemical Biology, 2023, 19(11):1331-1341.
[68] MENG F L,LIU H R, HU S S, et al.The brassinosteroid signaling component SlBZR1 promotes tomato fruit ripening and carotenoid accumulation[J].Journal of Integrative Plant Biology, 2023, 65(7):1 794-1 813.
[69] WANG Y C, MAO Z L, JIANG H Y, et al.Brassinolide inhibits flavonoid biosynthesis and red-flesh coloration via the MdBEH2.2-MdMYB60 complex in apple[J].Journal of Experimental Botany, 2021, 72(18):6382-6399.
[70] XU F, GAO X, XI Z M, et al.Application of exogenous 24-epibrassinolide enhances proanthocyanidin biosynthesis in Vitis vinifera ‘Cabernet Sauvignon’ berry skin[J].Plant Growth Regulation, 2015, 75(3):741-750.
[71] 贺琰, 孙艳丽, 赵芳芳, 等.外源油菜素内酯处理对‘美乐’葡萄果实糖代谢的影响[J].园艺学报, 2022,49(1):117-128.HE Y, SUN Y L, ZHAO F F, et al.Effect of exogenous brassinolides treatment on sugar metabolism of merlot grape berries[J].Acta Horticulturae Sinica, 2022, 49(1):117-128.
[72] WANG S, LI L X, FANG Y, et al.MdERF1B-MdMYC2 module integrates ethylene and jasmonic acid to regulate the biosynthesis of anthocyanin in apple[J].Horticulture Research, 2022, 9:uhac142.
[73] LI S H, DONG Y X, LI D L, et al.Eggplant transcription factor SmMYB5 integrates jasmonate and light signaling during anthocyanin biosynthesis[J].Plant Physiology, 2024, 194(2):1139-1165.
[74] HAN Y L, CHEN C, YAN Z M, et al.The methyl jasmonate accelerates the strawberry fruits ripening process[J].Scientia Horticulturae, 2019, 249:250-256.
[75] WU X, CHEN Y Y, WANG X H, et al.New insights into aroma regulation in pear peel and flesh under methyl jasmonate treatment obtained by metabolite and whole-transcriptome RNA sequencing analyses[J].Postharvest Biology and Technology, 2023, 201:112347.
[76] YANG C, DUAN W Y, XIE K L, et al.Effect of salicylic acid treatment on sensory quality, flavor-related chemicals and gene expression in peach fruit after cold storage[J].Postharvest Biology and Technology, 2020, 16(1):1111089.
[77] YUAN R M, MAO L L, MIN T, et al.Salicylic acid treatment inhibits ethylene synthesis and starch-sugar conversion to maintain apple fruit quality during shelf life[J].Scientia Horticulturae, 2023, 308:111586.
[78] MASHIGUCHI K, SETO Y, YAMAGUCHI S.Strigolactone biosynthesis, transport and perception[J].The Plant Journal, 2021, 105(2):335-350.
[79] GE Q, ZHANG Y, WU J R, et al.Exogenous strigolactone alleviates post-waterlogging stress in grapevine[J].Plant Physiology and Biochemistry, 2024, 216:109124.
[80] AN J P, ZHAO L, CAO Y P, et al.The SMXL8-AGL9 module mediates crosstalk between strigolactone and gibberellin to regulate strigolactone-induced anthocyanin biosynthesis in apple[J].The Plant Cell, 2024, 36(10):4404-4425.
Research progress on effects and mechanisms of plant growth regulators on fruit quality
LI Rui1, LI Zhenyuan1, HONG Xianlong1, ZHAO Xijuan1,2*
1(College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400715, China)2(Key Laboratory of Quality and Safety Control for Citrus Fruits, Ministry of Agriculture and Rural Affairs, Chongqing 400715, China)
ABSTRACT Plant growth regulators (PGR) play a crucial role in the improvement of fruit appearance, the regulation of intrinsic quality, and the accumulation and metabolism of nutrients.In recent years, the impact of PGR on fruit quality has received increasing attention.This review summarizes the types of PGR and their effects on the appearance quality, intrinsic physicochemical and nutritional quality, secondary metabolites, and safety quality of fruits.The fruits quality includes the following indices such as shape index, fruit weight, the contents of sugar, acidity, total soluble solid, vitamin C, mineral elements, amino acids and proteins, as well as the safety quality.Secondary metabolites include flavonoids and aroma components.Meanwhile, the mechanisms by which different types of PGR affect fruit quality are also discussed.It is found that the effects of the same PGR on fruit quality vary depending on the type of fruits, application time, and concentrations.There are differences in the regulatory mechanisms of different PGRs on various qualities of fruits.Reasonable use of PGR can improve fruit quality, but improper use probably affects the quality of fruits and even cause potential risks to environment and humans.This article will provide some references for the use of PGR reasonably in the process of fruit production as well as the development and application of green and efficient PGR.
Key words plant growth regulators; fruit; fruit quality; mechanism of action

 N L.Responses of ethylene emission, abscission, and fruit quality to the application of ACC as a chemical thinner in ‘flatbeauti’ peach[J].Journal of Plant Growth Regulation, 2024, 43(11):4171-4184.
N L.Responses of ethylene emission, abscission, and fruit quality to the application of ACC as a chemical thinner in ‘flatbeauti’ peach[J].Journal of Plant Growth Regulation, 2024, 43(11):4171-4184.