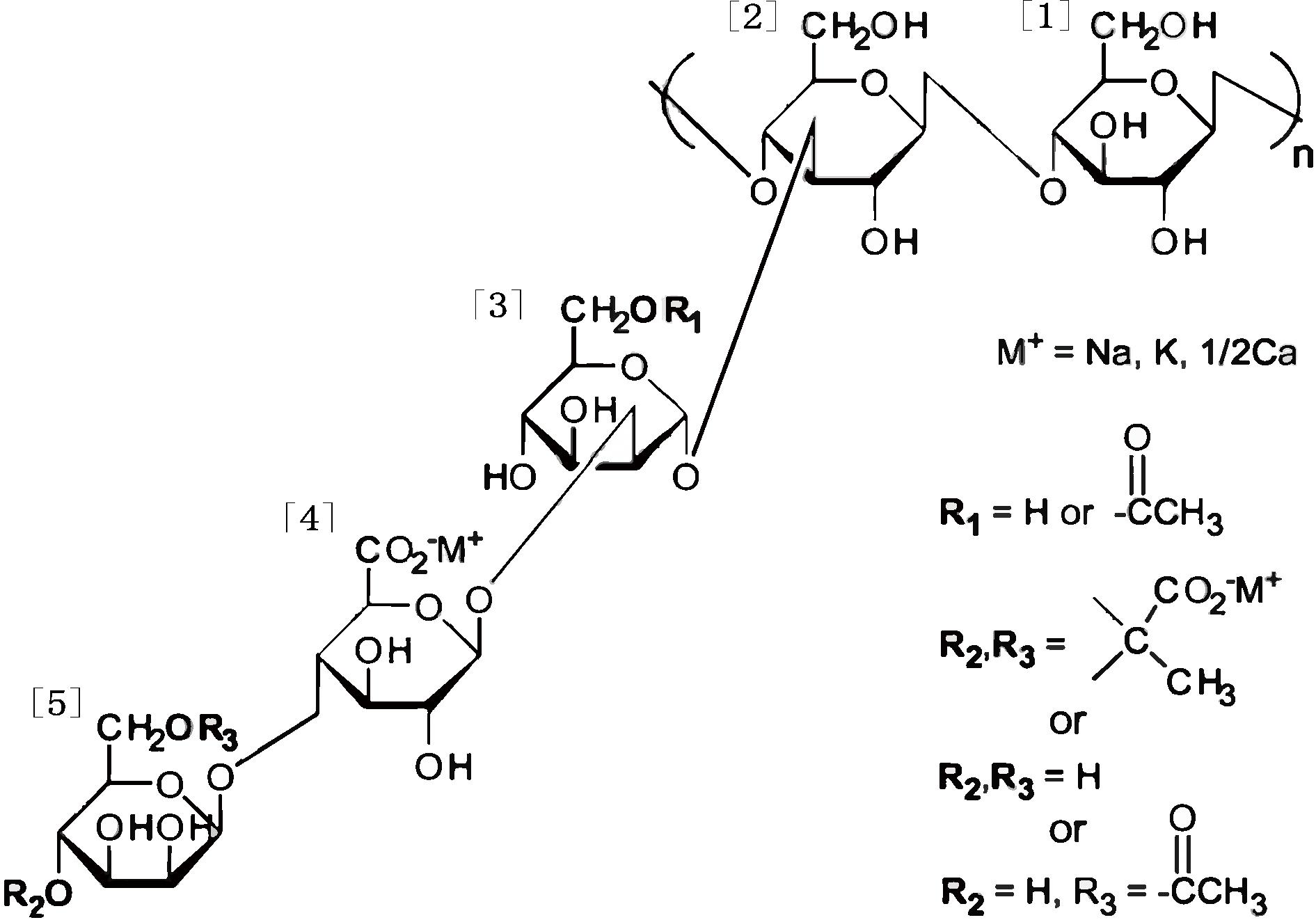
图1 黄原胶分子结构图
Fig.1 Chemical structure of xanthan gum
注:[1]、[2]为葡萄糖;[3]、[5]为甘露糖;[4]为葡萄糖醛酸。
YIN Li,WANG Yanyong,QI Xifang.Production and application of xanthan gum in dairy and plant-based dairy product[J].Food and Fermentation Industries,2025,51(14):433-440.
从海藻、植物和微生物等可再生资源中分离出来的多糖,具有生物安全性、生物相容性、可生物降解和生物黏附等特性,可广泛应用于食品、医药、石油等行业。胞外多糖(extracellular polysaccharide,EPS)是由微生物合成的一种功能多样的聚糖化合物。不同来源的胞外多糖在生物相容性、生物降解性、吸附性等理化性质上存在差异[1]。与市场主导产品海藻和植物多糖相比,微生物多糖具有发酵生产周期短、不受季节和气候影响、可利用廉价的可再生资源作为碳源制备等优势[2]。目前已有葡聚糖、可得然胶、结冷胶和黄原胶等少数微生物多糖实现商业化生产。黄原胶是由黄单胞菌在好氧发酵过程中产生的微生物胞外多糖,具有优异的流变性能,可作为增稠剂、乳化剂、悬浮剂、稳定剂等广泛应用于食品行业[3],是世界上生产规模最大、用途最广泛的微生物多糖。
最近因黄原胶可用于乳制品和植物基代乳的生产而备受关注。脂肪含量低的牛奶和乳制品以及植物基代乳等产品胶体稳定性差,贮存过程中易发生沉淀、分离,导致产品质量异常。黄原胶作为一种有效的增稠剂、乳化剂和稳定剂,可以防止成分分离,提高产品质量,延长保质期,在以牛奶和植物基代乳为基础的食品生产中应用前景广阔[4-6]。
随着黄原胶应用拓展,其市场需求逐渐增加,需提升黄原胶产量以满足市场需求。利用合成生物学等现代生物技术改造菌种以及优化发酵工艺可进一步提高胞外多糖产量和改善其理化性质,从而扩大其应用范围[7-8]。本文系统综述了黄原胶生产研究进展,包括基因工程改造菌种提高产量,以及利用更廉价的碳源和生产工艺优化等研究结果。同时,总结了黄原胶在食品中的应用进展,尤其是在乳制品和植物基代乳中的最新应用进展,并对未来研究方向进行了展望,为进一步开发和利用黄原胶提供参考。
黄原胶分子由D-葡萄糖、D-甘露糖、D-葡萄糖醛酸、乙酸以及丙酮酸组成的“五糖重复单元”聚合而成,平均分子质量为2×106~2×107 Da。黄原胶的“五糖重复单元”主链是由2个D-葡萄糖以β-1,4-糖苷键连接组成,其主链结构与纤维素基本一致。每2个葡萄糖残基含有1个由甘露糖、葡萄糖醛酸、甘露糖构成的侧链,通过β-1,3-糖苷键连接到主链上。与主链相连的甘露糖通常含乙酰基修饰,侧链末端的甘露糖通常含丙酮酸或乙酰基修饰[9],如图1所示[10]。这些修饰可显著影响黄原胶的构象和物理化学性质,其中乙酰基稳定有序构象,而丙酮酸基破坏有序构象,因此高丙酮酸黄原胶比低丙酮酸黄原胶黏度高[11]。黄原胶的分子质量、丙酮酸和乙酰基含量等分子结构主要取决于生产菌种、培养基和发酵条件。

图1 黄原胶分子结构图
Fig.1 Chemical structure of xanthan gum
注:[1]、[2]为葡萄糖;[3]、[5]为甘露糖;[4]为葡萄糖醛酸。
与淀粉、瓜尔豆胶、刺槐豆胶、羧甲基纤维素等其他可作为增稠剂的食品胶体相比,特殊的分子结构使得黄原胶具有许多优良特性:黄原胶亲水性好,在热水和冷水中都有很好的溶解性;有良好的增黏性、分散性和乳化性,可与多种物质互配,能有效防止成分分离,并有助于延长产品的保质期[12];有很高的稳定性,耐酸碱(pH 2~12)、抗低温冷冻和高温(-18~120 ℃),不受酶的影响,因此适用于各种食品[13]。
全球黄原胶年产量约为300 000 t,年增长率为5%~10%[14]。在过去的几年里,黄原胶的市场规模稳步上升。2021年和2022年,其市场规模分别约7.5亿美元和15亿美元。预计2023年至2032年黄原胶市场规模年复合增长率将达到3.2%。市场规模的不断扩大,需提高黄原胶产量以满足市场需求。
特定性能的黄原胶由特定的微生物菌株在生物反应器中扩增和规模生产。生长和生产受到培养基组成、温度、pH和溶解氧等因素的影响。发酵后将黄原胶从发酵液中沉淀和分离出来,然后进行产物干燥、研磨、分装等。与其他增稠剂和稳定剂相比,黄原胶的主要缺点之一是成本高。通过基因工程改造菌种、利用廉价的工业/农业废物作为原料、优化发酵工艺等可改变黄原胶结构,提高黄原胶产量和性能,降低生产成本。
黄原胶是由植物病原菌Xanthomonas spp.合成的一种在工业上用途广泛的微生物胞外多糖[8]。可用于黄原胶工业生产菌种包括X.arboxicola、X.axonopodis、X.vaculo-rium、X.citri、X.malvacearum、X.carotae、X.gummisudans、X.jugladis、X.fragaria和X.phaseoli。如表1所示,生产菌株和碳源对黄原胶的产量和性能有显著影响。工业上最常用的生产菌种是X.campestris。
表1 生产菌株和碳源对黄原胶产量的影响
Table 1 Influence of bacteria strain and carbon source on xanthan yield
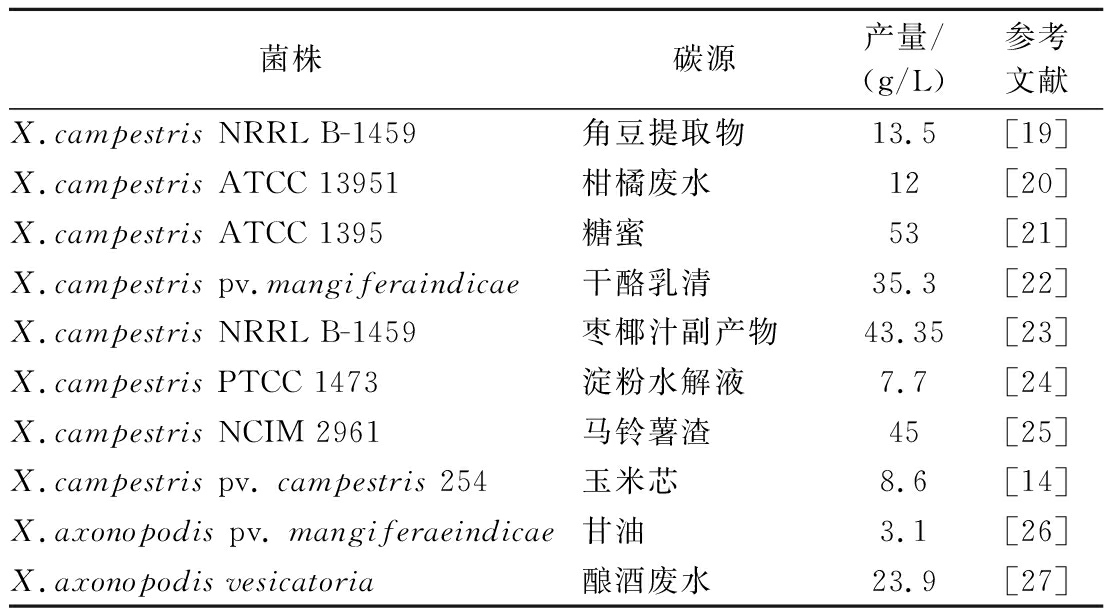
菌株碳源产量/(g/L)参考文献X.campestris NRRL B-1459角豆提取物13.5[19]X.campestris ATCC 13951柑橘废水12[20]X.campestris ATCC 1395糖蜜53[21]X.campestris pv.mangiferaindicae干酪乳清35.3[22]X.campestris NRRL B-1459枣椰汁副产物43.35[23]X.campestris PTCC 1473淀粉水解液7.7[24]X.campestris NCIM 2961马铃薯渣45[25]X.campestris pv. campestris 254玉米芯8.6[14]X.axonopodis pv. mangiferaeindicae甘油3.1[26]X.axonopodis vesicatoria酿酒废水23.9[27]
基于基因组数据分析和生理生化实验,已基本解析黄原胶合成途径。黄原胶合成过程可分为3步:a)核苷酸单糖的合成;b)五糖重复单元的组装;c)黄原胶的合成及释放。该过程相关蛋白由一个约12 kb的 gum基因簇编码,包括gumBCDEFGHIJKLM 12个基因[15]。
随着对黄原胶合成机制的研究深入,通过基因工程改造菌种,可提升黄原胶的产量或改变黄原胶的分子结构,降低生产成本或改良黄原胶的性能,扩大其应用范围。STEFFENS等[8]通过插入失活鞭毛基因fliC和fliM,显著提高了黄原胶的产量和流变性。DAI等[16]通过敲除菌色素合成基因pigA,构建了无色黄原胶合成菌株,可提高黄原胶的白度,使纯化过程中乙醇用量减少133.3%,降低了黄原胶后处理成本。GANSBILLER等[17]通过在X.campestris LMG 8031中分别敲除gumL、gumF、gumG构建了7种不同乙酰化和丙酮酸化修饰度的黄原胶,改善了其在无盐环境以及在一价和二价阳离子存在下的流变性能。WU等[18]通过基因工程改造Xanthomonas campestris CGMCC 15155获得8种具有不同分子结构的黄原胶,证明了含有丙酮酸的末端甘露糖和含有乙酰基的内部甘露糖决定了黄原胶的二级结构和流变性能。乙酰基为黄原胶的螺旋结构提供了稳定性,而丙酮酸基提供了相反的稳定性。
黄原胶生产的主要成本是原材料,利用工业废物和农业废物作为原料可降低生产成本[28]。目前正探索将农业和工业有机副产品作为可持续的替代原料,食品工业废水作为发酵过程的水源[29]。然而,由于供应安全和原材料质量的原因,将这些方法转移到工业化生产规模仍有限。
2.2.1 碳源
不同碳源种类和浓度影响黄原胶的产率。黄原胶生产最常用的碳源是葡萄糖、蔗糖和淀粉,最适浓度为2%~4%,培养基中碳浓度过高(>5%)可能会抑制生长[30-31]。研究发现当碳源为葡萄糖、蔗糖、麦芽糖、阿拉伯糖、可溶性淀粉和马铃薯淀粉时,X.campestris的黄原胶产率较高,达9.75~14.74 g/L。当碳源为果糖、木糖和半乳糖时,黄原胶产率为5.23~7.13 g/L。当碳源为乳糖、肌醇和山梨醇时,产率要低得多,仅为1.01~1.5 g/L[32]。此外,研究人员还探索了廉价碳源应用于黄原胶生产,包括干酪乳清(35.3 g/L)[22]、马铃薯渣(45 g/L)[25]、糖蜜(53 g/L)[21]、玉米芯(8.6 g/L)[14]和酿酒废水(23.9 g/L)[27]等。
2.2.2 氮源
氮是一种必需的营养物质,以有机或无机分子的形式提供。与铵盐或硝酸盐等无机氮源相比,蛋白胨、酵母提取物、玉米浸泡液和豆粕等有机氮源成本更高。其中,酵母提取物和蛋白胨最适合黄原胶生产[33-34],铵盐则适合生物量积累[35],发酵阶段的最佳碳氮比为20∶1[36]。较高氮源(>0.25 g/L)有利于细胞生长和酶合成,但与黄原胶生产过程并不相关[31,37]。因此,在发酵过程中控制氮的水平对经济效率和产品质量都很重要。在初始阶段,细胞快速生长需要更高水平的氮,但后期必须减少氮,以获得更纯净的产品并节省原材料成本。
2.3.1 温度
温度也是黄原胶生产的一个重要因素。X.campestris生长最适温度为25~27 ℃,而黄原胶生产最适温度为28~30 ℃。当温度超过35 ℃可导致黄原胶产量和生物量降低。温度还影响黄原胶的结构和黏度,当生产温度超过34 ℃时,乙酰基和丙酮酸的含量以及平均分子质量降低,导致水溶液黏度降低。当温度低于25 ℃时,乙酰基含量和分子质量升高,导致水溶液黏度增加[34,38-39]。
2.3.2 pH
黄原胶发酵生产过程中,pH控制非常重要,因为pH会影响黄原胶的电荷密度,从而改变了黄原胶分子之间相互作用,导致黄原胶黏度变化。X.campestris最适生长pH值为 6.0~7.5,黄原胶生产最适pH值为7.0~8.0。通过控制pH可调控菌株生长,从而显著影响黄原胶产量和黏度。研究发现在pH=6.0~8.0时,黄原胶的黏度不受影响。当pH>9.0时,黄原胶的乙酰基含量减少,而在pH<3时,黄原胶的丙酮酸含量减少。在黄原胶生产过程中,碱胁迫可增加黄原胶产量。由于黄原胶结构具有酸性基团,发酵过程中pH值会降低到5.0左右,从而导致合成速率下降。因此,发酵过程中用KOH或NaOH控制pH值保持在6.0~8.0,有利于黄原胶的高效生产[40]。
2.3.3 搅拌和通气速率
Xanthomonas spp.为好氧菌,在黄原胶的生产过程中搅拌和通气速率非常重要。研究表明,黄原胶产量与溶解氧浓度成正相关[41]。在生产过程中,随着黄原胶的胞外积累,发酵液黏度增加,氧气和营养物质传质效率降低。通过提高搅拌和通气速率有助于改善氧溶解速率,提高黄原胶产量。然而,搅拌和通气速率过高会产生高剪切力或流体动力学应力损伤细胞,从而减少黄原胶产量。相反,搅拌和通气速率太低可能影响氧溶解速率,从而导致黄原胶产量降低。为了防止这些问题,需要优化搅拌和通气速率,实现黄原胶高产[38]。
黄原胶的安全性已得到深入研究。在动物模型中,口服高达20 g黄原胶/kg体重未观察到的毒性,1%黄原胶对皮肤没有刺激作用[42]。人类在23 d内每天摄入10.4~12.9 g黄原胶不会导致血浆生物化学、尿液分析参数、葡萄糖和胰岛素测试、甘油三酯等发生显著变化,但血清胆固醇水平降低了10%,粪便胆汁酸浓度显著增加[43]。在小于16周的婴儿食用的特殊医疗用途食品中黄原胶添加量为每天312 mg/kg时,不会引起任何副作用[44]。黄原胶的消化率和热量有效性测试表明黄原胶在人体内是不可消化的,这是由于人体内缺乏黄原胶水解酶,因此黄原胶不会影响每日热量或营养摄入。
黄原胶生物安全性好,被广泛用作食品添加剂。1969年,美国食品药品监督管理局(Food and Drug Administration,FDA)批准黄原胶作为食品添加剂。1980年,欧盟批准黄原胶进入食品添加剂目录,1988年我国批准了黄原胶作为食品添加剂。各国食品安全机构制定黄原胶添加量标准。欧盟标准为最大添加量为2 000 mg/kg,而美国FDA标准为最高添加率为0.5%,并且要标注和声明添加了黄原胶,以帮助那些对黄原胶过敏或敏感的人。
天然材料具有来源丰富、成本有效性、环境友好性和可持续性等优势,在人类生活的各个领域发挥着重要作用。黄原胶具有特殊的流变性、在冷水和热水中的溶解性、在低浓度下的高黏度等特性,可作为增稠剂、稳定剂和悬浮剂等,提高产品的流动性、口感和附着力等性能,广泛应用于肉汁和酱汁、乳制品、烘焙食品、调味品、糖浆和浇头、饮料等食品行业。此外黄原胶还可作为麸质、脂肪等替代品以及食品包装材料,用于开发新产品。
在果汁饮料中添加黄原胶,可使饮料中果肉等不溶成分形成悬浮液,改善口感,赋予饮料爽口特性。黄原胶在低pH下也能快速溶解,使其适用于几乎所有的饮料。椰子蛋白是商业椰子油生产的副产品,但其低分散性使其无法用于食品中。研究发现,通过添加0.4%的黄原胶增加表面颗粒的黏度和负电荷,可保持椰子蛋白溶液流体状行为而不沉淀,使其可用于食品行业,如蛋白质饮料[45]。
在烘焙和贮存期间,黄原胶可提高烘焙食品和冷藏面团的持水能力,保持良好的面筋和淀粉网络,提高产品质量[46]。黄原胶与蛋清粉混合,有助于在制备蛋糕面糊的过程中增加表面张力、粒径、黏度和界面吸附,并降低表面疏水性[47]。在无麸质烘焙食品中,黄原胶作为麸质替代品可以改善产品质地和体积[48]。黄原胶还可作为脂肪替代物,使面包获得更好的质地、更大的体积和更低的密度等优良品质,同时大幅降低面包中脂肪添加量,为低热量面包的开发打开了大门[49]。
由于特殊的假塑性和物理化学性质有助于薄膜形成,黄原胶可作为食品包装材料[50-51]。黄原胶在冷水或温水中的高稳定性,在不同pH和温度下的黏度一致性(耐热性),使其更适合于包装薄膜的制造。黄原胶还可作为交联剂用于制造纳米纤维,从而降低水蒸气渗透性、水溶性和水分含量[52]。在实际应用中,黄原胶作为香蕉保鲜膜,可延长香蕉的保质期,减少贮藏过程中风味释放[53]。黄原胶的食品安全性使其适合用于生产食用薄膜,可代替脂肪用于挤压零食的涂层和调味,提高质量和消费者接受度[54]。以黄原胶、结冷胶和氧化锌创制的纳米复合材料具有较高的紫外线屏蔽、热稳定性和防水性能,使其可作为食品和药物包装材料[51]。以黄原胶和聚乙烯醇制备的复合膜的水分含量、水溶性和水蒸气透过率降低,具有优越的食品包装能力,并可在12 h内在土壤和水中完全分解,使其成为可再生、可持续和环保的潜在替代包装材料[55]。
在低热量沙拉酱中,黄原胶可作为淀粉的完美替代品,提供和改善清爽的口感,保持冻融稳定性,改善外观和感官特性。在酸性和中性酱汁和肉汁中,低浓度黄原胶能提供高黏度。即使在温度波动的情况下,黏度也可长期保持稳定。在温热的食物上添加含有黄原胶的酱汁和肉汁,有助于释放香味和改善色泽。在调味品中添加黄原胶,有助于维持调味品稳定性,使调味品在灌装过程中均匀分布,同时也可防止飞溅[56]。在冰淇淋、熟肉和煎饼等中添加黄原胶,使产品显得粘稠,令人垂涎欲滴。此外添加黄原胶可使冷冻无乳制品搅打配料浓缩物具有非常好的冻融稳定性、质地坚硬和高溢出率[56]。
乳制品营养含量高,是人类饮食中重要的组成部分。黄原胶可作为稳定剂、乳化剂等,广泛用于奶酪、冰淇淋、冰糕、酸奶等乳制品。黄原胶与瓜尔豆胶、槐豆胶等半乳甘露聚糖配伍后有很强的协同增效作用。在奶酪中添加黄原胶与瓜尔豆胶、槐豆胶混合物,可使产品结构坚实,易于切片和香味释放,保持长期稳定。在冰淇淋中添加黄原胶可提高膨胀率、黏度和抗融性,降低产品硬度。黄原胶、卡拉胶和半乳甘露聚糖混合物是很好的冷冻乳制品稳定剂,其价格合理,可提供最适黏度、长期稳定性、增强加工过程中的热传递和免受热冲击的保护[57]。
酸奶是一种发酵乳制品,其微观结构由酪蛋白胶束、水偶极子、脂肪球和细菌细胞组成的3D蛋白质网络组成。酪蛋白网络相对较弱,黄原胶等稳定剂可用于改善酸奶的质地和稳定性,提高酸奶的黏度、保水能力、品质和感官特性[4, 58]。添加其他食品成分易导致酸奶不稳定,亲水胶体具有稳定这些产品的能力,从而提高消费者的可接受性。低浓度黄原胶与瓜尔胶混合物可以协同稳定酸奶中含有β-胡萝卜素的脂质分散体,提高产品的稳定性。黄原胶和麦芽糊精可作为包封剂应用于酸奶生产,使酸奶在40 d的贮存过程中保持pH、湿度和稳定性等物理化学性质[59]。黄原胶和乳清粉可以用于稳定奶昔中的泡沫,使泡沫持续约25 min,产生吸引顾客的质地[5]。
牛奶、羊奶等不同奶源营养成分存在差异,其制备的乳制品可能具有不同的物理化学性质。PARK等[60]评估了不同胶体对羊奶酸奶质地和微生物活力的影响。结果表明,与其他胶体相比,在四周冷藏期间黄原胶提高了产品的黏度、硬度、稠度和内聚性,并且保持了酸奶培养物和所用益生菌的活力。用骆驼奶制作含黄原胶的酸奶时也得到了类似的结果[61]。
随着生活水平提高,消费者对健康越来越重视,对低脂产品的需求越来越多。乳制品通常含有高达12%的脂肪,以亲水胶体作为脂肪替代品开发低脂乳制品已成为研发热点[62]。在低脂搅拌酸奶中用黄原胶改性的鱼明胶替代哺乳动物明胶,可使产品具有最佳的流变学特性[63]。在奶酪中使用黄原胶作为脂肪替代品,可以增加产品的黏性和弹性,并对风味释放有积极影响。与淀粉等多糖相比,添加黄原胶可改善低脂奶酪的纤维形成和拉丝分离,从而提高产品产量,并解决产品质地和功能相关问题。此外黄原胶还可以改善奶酪的其他品质,包括涂抹能力和温度稳定性等[64]。
黄原胶不仅可用作奶酪产品配料,还可以作为可食用涂层,改善奶酪存储期间的游离脂肪酸组成、pH、酸度以及干物质脂肪、水分和蛋白质含量[36]。黄原胶作为亲水胶体还可改善乳制品饮料感官特性,对产品的乳脂度和脂肪感有积极的影响[65]。此外,在乳制品甜点等食品中,黄原胶可以提高产品的硬度和黏性。黄原胶(0.325%)的高黏度有助于改善酸性奶油酸度对感官感知的影响,显著提高稳定性和可接受性。
黄原胶可替代明胶,保持无明胶甜点的物理化学性质不变,使产品在咀嚼过程中保持令人愉快的奶油般的醇厚丝滑口感,提高产品的感官可接受性。在益生元奶油冻中添加黄原胶作为脂肪替代品,可减少产品中脂肪含量,同时防止产品中的菊粉聚集。此外亲水胶体黄原胶可作为稳定剂与乳蛋白(食品乳化剂)作为低脂乳化剂,改善产品流变性、黏稠度和稳定性。
因此,黄原胶已广泛应用于酸奶、奶酪、乳制品饮料和甜点等乳制品,提高了产品质量,使其更受消费者的喜爱,从而为乳制品行业带来了美好的未来。
近年来,受牛奶过敏、乳糖不耐受、高胆固醇血症、素食主义、环境友好等因素影响,对人类和自然环境相对友好的植物基乳制品作为动物乳制品替代品受到越来越多消费者的关注,成为全球未来食品发展的重要板块和新的行业增长点[66-67]。黄原胶作为增稠剂、稳定剂、悬浮剂等,在提高植物基乳制品稳定性,改善产品质地和口感等方面发挥重要作用。
豆浆是世界上消费量最大、最受欢迎的植物基代乳之一,其营养成分丰富,不含胆固醇、麸质和乳糖,是素食者和乳糖不耐受人群的最佳饮食来源。豆浆是典型的水包油乳液,呈现出由脂肪、蛋白质和多糖组成的多组分体系。这些多组分可能导致相的聚集和分离。因此,需要相应的稳定剂来提高稳定性。黄原胶与大豆蛋白的相容性更好,黏度更高,因此在豆浆中的稳定性更好,即使在0.01%较低浓度下也是如此[68]。
发酵豆浆具有减少豆腥味,改善消化道环境,抗衰老等作用,但易发生液相分离,影响了其质地和外观。在大豆酸奶中添加0.005%黄原胶可显著影响产品微观结构,提高产品稳定性和感官评分。
黄原胶还可用于其他与豆浆相关产品的生产。例如,在大豆-玉米浆混合制作的酸奶类似物中添加黄原胶作为稳定剂,极大地提高了产品质量。在以大豆蛋白水解物为原料制作的低脂冰淇淋中添加黄原胶,可以提高产品的抗融稳定性和感官性能。此外,在以含有3%豆渣的豆浆制作益生菌奶油酱时,添加黄原胶和瓜尔胶混合物可以提高益生菌含量和产品质量[69-70]。
植物基代乳和乳制品作为新兴产业发展快速,同时面临不少挑战,特别是产品存在黏度低、稳定性差、口感和风味不佳等问题。因此,添加黄原胶等亲水胶体作为稳定剂提高最终产品质量和消费者的可接受性是必要的。在坚果奶中添加酪蛋白和黄原胶,可维持产品在高温生产条件下黏度稳定,提高其物理稳定性、感官品质、营养价值以及消费者的可接受性[71]。由花生、燕麦和椰奶以及黄原胶制成的植物基代乳具有优异的感官品质、营养成分和物理化学特性,可作为牛奶替代品满足乳糖不耐症患者的饮食需求。
大多数植物基代乳和乳制品中缺乏天然蛋白质网络,使它难以用于生产酸奶等传统发酵乳制品。黄原胶可在产品中提供这种网络,从而提高产品质量。例如,在植物基酸奶中添加果胶、黄原胶和玉米淀粉作为稳定剂,可使产品保持最佳黏度和流变性,增强口感,提高产品品质。在植物发酵甜点中添加黄原胶可用于抵抗机械应力,提高产品稳定性[6,72]。
黄原胶可作为稳定剂应用于以植物基代乳替代牛奶生产乳制品类似物凝乳和冰淇淋,满足不想要动物乳制品的消费者需求。在以杏仁乳制作纯素冰淇淋的过程中,添加使用黄原胶和刺槐豆胶混合物对冰淇淋的物理性能没有显著影响,但可以防止重结晶和改善感官特性。在研究糙米乳素食冰淇淋配方的过程中发现,含黄原胶、瓜尔胶和卡拉胶的糙米乳冰淇淋的理化特性和感官评价最好。添加0.15%黄原胶即可改善产品的乳化性和黏稠度[73]。
芳香族化合物通常具有使植物基代乳散发香味的作用。黄原胶可以降低植物基代乳中芳香族化合物的使用量。例如,在松子乳饮料中添加黄原胶降低了α-蒎烯、β-月桂烯和D-柠檬烯等芳香族化合物的使用量[74]。
总的来说,黄原胶能够改善植物基代乳和乳制品的质地、稳定性、物理化学和感官特性,使其更接近牛奶的味道和体验,在植物基代乳和乳制品中具有广阔的应用前景。因此,应进一步深入研究黄原胶在不同植物基代乳和乳制品中的最佳应用,以满足产品的生产成本和质量需求。
目前,黄原胶在食品行业中应用广泛,发展前景非常广阔。黄原胶具有多种功能,不仅可以改善食品的流变特性,还可改变产品成分,产生新的产品,如不含动物蛋白、低脂、无乳糖、无麸质等。
黄原胶在乳制品和植物基乳制品生产中的应用,使其受到广泛关注。黄原胶作为乳化剂、稳定剂和增稠剂,可提高低脂牛奶和乳制品以及以植物基乳制品稳定性,有效防止成分分离,在生产以牛奶和植物基代乳为基础的食品方面具有广阔的前景。此外,黄原胶还具有兼容性强的优势,可与蛋白质、糖和香料等乳制品和植物基乳制品中常用的各种成分相兼容,适用于各种组合物。随着无乳制品需求的增加和植物基乳制品的日益普及,黄原胶在提高这些产品的质量和感官特性方面发挥关键作用,使其更能吸引消费者。
然而,值得注意的是,有些人可能对黄原胶敏感或过敏。制造商应考虑这一方面,并为有特殊饮食要求或偏好的消费者提供替代品。此外,必须遵守法规和标签要求,以确保黄原胶在乳制品和植物基乳制品中的正确使用。
黄原胶的市场规模持续增长,需要增加产量以满足需求。黄原胶的生产成本与原材料来源密切相关。选择更便宜的原材料来源有助于降低生产成本。需要加强对黄原胶生产菌种的基因工程改造研究,提高菌种的生产性能和黄原胶回收率。需要广泛研究黄原胶在食品工业中的应用,特别是在乳制品和植物基乳制品中的应用,以便制定更经济可行的黄原胶应用策略,如改良、食品中的最佳添加量等。还需评估黄原胶对生理和心理反应的影响,如在植物基代乳和乳制品中使用黄原胶的愉悦感、饥饿感和饱腹感。随着对植物基乳制品的需求不断增长,黄原胶为开发新型高品质的非乳制品提供了巨大的潜力,为寻求更健康、更可持续的生活方式的消费者提供了更多的选择。
[1] MAHMOUD Y A G, EL-NAGGAR M E, ABDEL-MEGEED A, et al.Recent advancements in microbial polysaccharides:Synthesis and applications[J].Polymers, 2021, 13(23):4136.
[2] REVIN V V, LIYASKINA E V, PARCHAYKINA M V, et al.Production of bacterial exopolysaccharides:Xanthan and bacterial cellulose[J].International Journal of Molecular Sciences, 2023, 24(19):14608.
[3] PATEL J, MAJI B, HARI NARAYANA MOORTHY N S, et al.Xanthan gum derivatives:Review of synthesis, properties and diverse applications[J].RSC Advances, 2020, 10(45):27103-27136.
[4] KHALID N, RAMZAN R, ZAHOOR T, et al.Exploring the prebiotic potential of xanthan gum and its modified forms for the production of synbiotic yogurt[J].Journal of Food Processing and Preservation, 2022, 46(11):e17053.
[5] MIANO T F.Foaming stability of yougurt smoothie with whey powder and xanthan gum[J].Pakistan Journal of Science, 2021, 73(2):391-396.
[6] MADSEN S K, THULESEN E T, MOHAMMADIFAR M A, et al.Chufa drink:Potential in developing a new plant-based fermented dessert[J].Foods, 2021, 10(12):3010.
[7] BHAT I M, WANI S M, AHMAD MIR S, et al.Advances in xanthan gum production, modifications and its applications[J].Biocatalysis and Agricultural Biotechnology, 2022, 42:102328.
[8] STEFFENS T, VORHÖLTER F J, TECKENTRUP J, et al.Two flagellar mutants of Xanthomonas campestris are characterized by enhanced xanthan production and higher xanthan viscosity[J].Journal of Biotechnology, 2022, 347:9-17.
[9] KOOL M M, GRUPPEN H, SWORN G, et al.The influence of the six constituent xanthan repeating units on the order-disorder transition of xanthan[J].Carbohydrate Polymers, 2014, 104:94-100.
[10] NSENGIYUMVA E M, ALEXANDRIDIS P.Xanthan gum in aqueous solutions:Fundamentals and applications[J].International Journal of Biological Macromolecules, 2022, 216:583-604.
[11] YUAN S, LIANG J Y, ZHANG Y M, et al.Evidence from thermal aging indicating that the synergistic effect of glyoxal and sodium sulfite improved the thermal stability of conformational modified xanthan gum[J].Polymers, 2022, 14(2):243.
[12] RASHIDI A R, AZELEE N I W, ZAIDEL D N A, et al.Unleashing the potential of xanthan:A comprehensive exploration of biosynthesis, production, and diverse applications[J].Bioprocess and Biosystems Engineering, 2023, 46(6):771-787.
[13] BAK J H, YOO B.Intrinsic viscosity of binary gum mixtures with xanthan gum and guar gum:Effect of NaCl, sucrose, and pH[J].International Journal of Biological Macromolecules, 2018, 111:77-81.
[14] JESUS M, MATA F, BATISTA R A, et al.Corncob as carbon source in the production of xanthan gum in different strains Xanthomonas sp.[J].Sustainability, 2023, 15(3):2287.
[15] ALKHATEEB R S, VORHÖLTER F J, RÜCKERT C, et al.Genome wide transcription start sites analysis of Xanthomonas campestris pv.campestris B100 with insights into the gum gene cluster directing the biosynthesis of the exopolysaccharide xanthan[J].Journal of Biotechnology, 2016, 225:18-28.
[16] DAI X H, GAO G, WU M M, et al.Construction and application of a Xanthomonas campestris CGMCC15155 strain that produces white xanthan gum[J].Microbiology Open, 2019, 8(2):e00631.
[17] GANSBILLER M, SCHMID J, SIEBER V.In-depth rheological characterization of genetically modified xanthan-variants[J].Carbohydrate Polymers, 2019, 213:236-246.
[18] WU M M, QU J M, TIAN X F, et al.Tailor-made polysaccharides containing uniformly distributed repeating units based on the xanthan gum skeleton[J].International Journal of Biological Macromolecules, 2019, 131:646-653.
[19] ROSEIRO J C, COSTA D C, COLLACO M T A.Batch and fed-batch cultivation of Xanthomonas-campestris in carob extracts[J].Lebensmittel-Wissenschaft Und-Technologie-Food Science and Technology, 1992, 25(3):289-293.
[20] MOHSIN A, HUSSAIN M H, ZAMAN W Q, et al.Advances in sustainable approaches utilizing orange peel waste to produce highly value-added bioproducts[J].Critical Reviews in Biotechnology, 2022, 42(8):1284-1303.
[21] KALOGIANNIS S, IAKOVIDOU G, LIAKOPOULOU-KYRIAKIDES M, et al.Optimization of xanthan gum production by Xanthomonas campestris grown in molasses[J].Process Biochemistry, 2003, 39(2):249-256.
[22] MESOMO M, SILVA M F, BONI G, et al.Xanthan gum produced by Xanthomonas campestris from cheese whey:Production optimisation and rheological characterisation[J].Journal of the Science of Food and Agriculture, 2009, 89(14):2440-2445.
[23] BEN SALAH R, CHAARI K, BESBES S, et al.Production of xanthan gum from Xanthomonas campestris NRRL B-1459 by fermentation of date juice palm by-products (Phoenix dactylifera L.)[J].Journal of Food Process Engineering, 2011, 34(2):457-474.
[24] NIKNEZHAD, ASADOLLAHI, ZAMANI, et al.Production of xanthan gum by Xanthomonas species using starch as carbon source[J].Minerva Biotecnologica, 2014, 26(3):191-197.
[25] SIROHI S, KUMAR A.Batch production kinetics of xanthan gum from potato waste[J].Think India Journal, 2019, 22:104-110.
[26] SANTOS GONDIM T, PEREIRA R G, FIAUX S B.Xanthan gum production by Xanthomonas axonopodis pv.mangiferaeindicae from glycerin of biodiesel in different media and addition of glucose[J].Acta Scientiarum Biological Sciences, 2019, 41(1):43661.
[27] ![]() Z, GRAHOVAC J,
Z, GRAHOVAC J, ![]() S, et al.Utilisation of winery wastewater for xanthan production in stirred tank bioreactor:Bioprocess modelling and optimisation[J].Food and Bioproducts Processing, 2019, 117:113-125.
S, et al.Utilisation of winery wastewater for xanthan production in stirred tank bioreactor:Bioprocess modelling and optimisation[J].Food and Bioproducts Processing, 2019, 117:113-125.
[28] GUNASEKAR V, RESHMA K R, TREESA G, et al.Xanthan from sulphuric acid treated tapioca pulp:Influence of acid concentration on xanthan fermentation[J].Carbohydrate Polymers, 2014, 102:669-673.
[29] DEY R, CHATTERJI B P.Sources and methods of manufacturing xanthan by fermentation of various carbon sources[J].Biotechnology Progress, 2023, 39(6):e3379.
[30] PALANIRAJ A, JAYARAMAN V.Production, recovery and applications of xanthan gum by Xanthomonas campestris[J].Journal of Food Engineering, 2011, 106(1):1-12.
[31] KHOSRAVI-DARANI K.Bench scale production of xanthan from date extract by Xanthomonas campestris in submerged fermentation using central composite design[J].African Journal of Biotechnology, 2011, 10(62):13520-13527.
[32] KRISHNA LEELA J, SHARMA G.Studies on xanthan production from Xanthomonas campestris[J].Bioprocess Engineering, 2000, 23(6):687-689.
[33] BHATIA S K, KUMAR N, BHATIA R K.Stepwise bioprocess for exopolysaccharide production using potato starch as carbon source[J].3 Biotech, 2015, 5(5):735-739.
[34] CHAVAN S, BAIG M.Relationship of biomass and xanthan gum production by Xanthomonas campestris:Optimization of parameters[J].British Biotechnology Journal, 2016, 11(1):1-8.
[35] LETISSE F, CHEVALLEREAU P, SIMON J L, et al.Kinetic analysis of growth and xanthan gum production with Xanthomonas campestris on sucrose, using sequentially consumed nitrogen sources[J].Applied Microbiology and Biotechnology, 2001, 55(4):417-422.
[36] SOLEYMANPOUR Z, NIKZAD M, TALEBNIA F, et al.Xanthan gum production from acid hydrolyzed broomcorn stem as a sole carbon source by Xanthomonas campestris[J].3 Biotech, 2018, 8(7):296.
[37] MOSHAF S, HAMIDI-ESFAHANI Z, AZIZI M.Statistical optimization of xanthan gum production and influence of airflow rates in lab-scale fermentor[J].Applied Food Biotechnology, 2014, 1(1):17-24.
[38] SHERLEY K I, PRIYADHARSHINI R D.Review on production of xanthan gum in batch and continuous reactors[J].International Journal of ChemTech Research, 2015, 8(2):711-717.
[39] LOPES B D, LESSA V L, SILVA B M, et al.Xanthan gum:Properties, production conditions, quality and economic perspective[J].Journal of Food and Nutrition Research, 2015, 54(3):185-194.
[40] DE MELLO LUVIELMO M, BORGES C D, DE OLIVEIRA TOYAMA D, et al.Structure of xanthan gum and cell ultrastructure at different times of alkali stress[J].Brazilian Journal of Microbiology, 2016, 47(1):102-109.
[41] GARC A-OCHOA F, CASTRO E G, SANTOS V E.Oxygen transfer and uptake rates during xanthan gum production[J].Enzyme and Microbial Technology, 2000, 27(9):680-690.
A-OCHOA F, CASTRO E G, SANTOS V E.Oxygen transfer and uptake rates during xanthan gum production[J].Enzyme and Microbial Technology, 2000, 27(9):680-690.
[42] FIUME M M, HELDRETH B, BERGFELD W F, et al.Safety assessment of microbial polysaccharide gums as used in cosmetics[J].International Journal of Toxicology, 2016, 35(1 Suppl):5S-49S.
[43] EASTWOOD M A, BRYDON W G, ANDERSON D M W.The dietary effects of xanthan gum in man[J].Food Additives &Contaminants, 1987, 4(1):17-26.
[44] YOUNES M, AQUILINA G, CASTLE L, et al.Re-evaluation of xanthan gum (E 415) as a food additive in foods for infants below 16 weeks of age and follow-up of its re-evaluation as a food additive for uses in foods for all population groups[J].EFSA Journal, 2023, 21(5):e07951.
[45] KAEWMUNGKUN K, LIMPISOPHON K.Characteristics of coconut protein-enriched lipid and the effects of pH, NaCl, and xanthan gum on its dispersibility[J].Journal of the Saudi Society of Agricultural Sciences, 2023, 22(6):351-360.
[46] AHMED J, THOMAS L, AL-HAZZA A.Effects of frozen storage on texture, microstructure, water mobility and baking quality of brown wheat flour/β-glucan concentrate arabic bread dough[J].Journal of Food Measurement and Characterization, 2021, 15(2):1258-1269.
[47] LI J H, SUN J J, CHANG C H, et al.Influence of selected gums on the foaming properties of egg white powders:Kinetics of foam formation and baking performance[J].Food Hydrocolloids, 2023, 139:108529.
[48] CHAKRABORTY S K, KOTWALIWALE N, NAVALE S A.Selection and incorporation of hydrocolloid for gluten-free leavened millet breads and optimization of the baking process thereof[J].LWT, 2020, 119:108878.
[49] KATSUDA M S R C S.Development of cheese bread with the addition of guar gum and xanthan gum as a substitute for partial fat[J].International Medical Journal:IMJ, 2015, 22(5):2 050-2 056.
[50] RASCHIP I E, FIFERE N, VARGANICI C D, et al.Development of antioxidant and antimicrobial xanthan-based cryogels with tuned porous morphology and controlled swelling features[J].International Journal of Biological Macromolecules, 2020, 156:608-620.
[51] RUKMANIKRISHNAN B, ISMAIL F R M, MANOHARAN R K, et al.Blends of gellan gum/xanthan gum/zinc oxide based nanocomposites for packaging application:Rheological and antimicrobial properties[J].International Journal of Biological Macromolecules, 2020, 148:1182-1189.
[52] YAVARI MAROUFI L, NOROUZI R, RAMEZANI S, et al.Novel electrospun nanofibers based on gelatin/oxidized xanthan gum containing Propolis reinforced by Schiff base cross-linking for food packaging[J].Food Chemistry, 2023, 416:135806.
[53] ZHENG M X, CHEN J F, TAN K B, et al.Development of hydroxypropyl methylcellulose film with xanthan gum and its application as an excellent food packaging bio-material in enhancing the shelf life of banana[J].Food Chemistry, 2022, 374:131794.
[54] GRAÇA C, MARQUES D, SOUSA I, et al.Xanthan gum as an alternative to replace the fat for coating and flavoring the extruded snacks[J].Journal of Food Science and Technology, 2020, 57(8):3151-3156.
[55] CHEN J F, ZHENG M X, TAN K B, et al.Polyvinyl alcohol/xanthan gum composite film with excellent food packaging, storage and biodegradation capability as potential environmentally-friendly alternative to commercial plastic bag[J].International Journal of Biological Macromolecules, 2022, 212:402-411.
[56] SURYAWANSHI N, NAIK S, JUJJAWARAPU S E.Exopolysaccharides and their applications in food processing industries[J].Food Science and Applied Biotechnology, 2022, 5(1):22.
[57] GHEBREMEDHIN M, SCHREIBER C, ZIELBAUER B, et al.Interaction of xanthan gums with galacto- and glucomannans.part II:Heat induced synergistic gelation mechanism and their interaction with salt[J].Journal of Physics Materials, 2021, 3(3):034014.
[58] MEHANNA N, SWELAM S, ALMQBIL N, et al.Improvement of the dairy products by wheat germ powder[J].Fresenius Environmental Bulletin, 2020, 29:10954-10959.
[59] ANTIGO J L D, DA SILVA J M, DE C SSIA BERGAMASCO R, et al.Microencapsulation of beet dye (Beta vulgaris L.) using maltodextrin and xanthan gum as encapsulant agents and application in yogurt[J].Research, Society and Development, 2020, 9(12):e14091210896.
SSIA BERGAMASCO R, et al.Microencapsulation of beet dye (Beta vulgaris L.) using maltodextrin and xanthan gum as encapsulant agents and application in yogurt[J].Research, Society and Development, 2020, 9(12):e14091210896.
[60] PARK Y W, OGLESBY J, HAYEK S A, et al.Impact of different gums on textural and microbial properties of goat milk yogurts during refrigerated storage[J].Foods, 2019, 8(5):169.
[61] LADJVARDI Z S, YARMAND M S, EMAM-DJOMEH Z, et al.Synergistic effect of locust bean and xanthan gum on viability of probiotic bacteria and water holding capacity of synbiotic yogurt from camel milk[J].Iranian Food Science and Technology Research Journal, 2020, 16(1):131-143.
[62] AKBARI M, ESKANDARI M H, DAVOUDI Z.Application and functions of fat replacers in low-fat ice cream:A review[J].Trends in Food Science &Technology, 2019, 86:34-40.
[63] YIN M D, YANG D Y, LAI S J, et al.Rheological properties of xanthan-modified fish gelatin and its potential to replace mammalian gelatin in low-fat stirred yogurt[J].LWT, 2021, 147:111643.
[64] BRIGHENTI M, GOVINDASAMY-LUCEY S, JAEGGI J J, et al.Behavior of stabilizers in acidified solutions and their effect on the textural, rheological, and sensory properties of cream cheese[J].Journal of Dairy Science, 2020, 103(3):2065-2076.
[65] JI L, DEN OTTER D, CORNACCHIA L, et al.Role of polysaccharides in tribological and sensory properties of model dairy beverages[J].Food Hydrocolloids, 2023, 134:108065.
[66] MATTISON C P, ARYANA K J, CLERMONT K, et al.Microbiological, physicochemical, and immunological analysis of a commercial cashew nut-based yogurt[J].International Journal of Molecular Sciences, 2020, 21(21):8267.
[67] ZHENG Y, FEI Y T, YANG Y, et al.A potential flavor culture:Lactobacillus harbinensis M1 improves the organoleptic quality of fermented soymilk by high production of 2,3-butanedione and acetoin[J].Food Microbiology, 2020, 91:103540.
[68] PANG Z H, LUO Y W, LI B R, et al.Effect of different hydrocolloids on tribological and rheological behaviors of soymilk gels[J].Food Hydrocolloids, 2020, 101:105558.
[69] YAN L, YU D J, LIU R, et al.Microstructure and meltdown properties of low-fat ice cream:Effects of microparticulated soy protein hydrolysate/xanthan gum (MSPH/XG) ratio and freezing time[J].Journal of Food Engineering, 2021, 291:110291.
[70] DE MORAES FILHO M L, BUSANELLO M, PRUDENCIO S H, et al.Soymilk with okara flour fermented by Lactobacillus acidophilus:Simplex-centroid mixture design applied in the elaboration of probiotic creamy sauce and storage stability[J].LWT, 2018, 93:339-345.
[71] KIZZIE-HAYFORD N, AMPOFO-ASIAMA J, ZAHN S, et al.Enriching tiger nut milk with sodium caseinate and xanthan gum improves the physical stability and consumer acceptability[J].Journal of Food Technology Research, 2021, 8(2):40-49.
[72] MAURO C S I, FERNANDES M T C, FARINAZZO F S, et al.Characterization of a fermented coconut milk product with and without strawberry pulp[J].Journal of Food Science and Technology, 2022, 59(7):2804-2812.
[73] MYGDALIA A, SFETSAS T, DIMITROPOULOU G, et al.Recipe for brown rice milk-based vegan ice cream[J].Asian Food Science Journal, 2023, 22(4):33-39.
[74] ABBOU A, KADRI N, SERVENT A, et al.Setting up a diagram process for the elaboration of a new plant-based beverage from Pinus halepensis seeds:Selection of unit operations and their conditions[J].Journal of Food Process Engineering, 2022, 45(2):e13943.