FAN Yifei,ZHANG Lina,ZHANG Lingyan, et al.Difference of digestibility of lactoferrin from different milk sources in infant in vitro digestion model[J].Food and Fermentation Industries,2025,51(14):48-57.
乳铁蛋白(lactoferrin, LF),也称作乳转铁蛋白,是一种球状糖蛋白,其分子质量约为80 kDa,由约700个氨基酸组成。乳铁蛋白在乳中的浓度因物种而异,且与泌乳时期相关。根据目前研究,初乳中的乳铁蛋白含量相对比常乳高,人初乳中高达5.8 g/L,常乳中则减少到2~3 g/L[1];牛初乳中为0.8 g/L,常乳中仅为0.03~0.49 g/L[2],而骆驼初乳中可达2.26 g/L,成熟乳中浓度约1.74 g/L[3],介于人乳与牛乳之间。人乳中乳铁蛋白的含量明显高于其他物种,预示着乳铁蛋白对婴儿发育起到重要作用。不同物种间乳铁蛋白的序列相似性从65%到接近100%不等[4],其中牛乳铁蛋白与人乳铁蛋白在核酸序列上具有77%的同源性[5],骆驼乳铁蛋白与牛乳铁蛋白的序列一致性也达到了74.9%[6]。作为一种对铁有着高亲和力的蛋白,乳铁蛋白以3种不同的铁饱和度形式存在:缺铁形式(apo-LF)、铁饱和形式(holo-LF)以及部分铁饱和形式(mono-LF)[7]。铁离子和![]() 一起结合在乳铁蛋白的两叶(N叶和C叶)上,铁离子的结合与释放会改变乳铁蛋白的构象,从而影响乳铁蛋白的热稳定性、抑菌性以及消化性等功能。
一起结合在乳铁蛋白的两叶(N叶和C叶)上,铁离子的结合与释放会改变乳铁蛋白的构象,从而影响乳铁蛋白的热稳定性、抑菌性以及消化性等功能。
随着社会的进步和健康意识的提升,婴儿配方奶粉母乳化的市场需求也日渐增强。由于乳铁蛋白具有的抗菌、抗病毒、抗炎活性以及在新生儿期起到的免疫保护作用,已作为一种免疫活性蛋白添加到婴儿配方奶粉中。乳铁蛋白对热处理较为敏感,且加工过程中的pH值和发酵条件也可能会改变乳铁蛋白的活性和稳定性[8],因此对加工工艺的要求较高。尽管已有研究表明喷雾干燥工艺(入口为180 ℃、出口为95 ℃)和冷冻干燥工艺(-30 ℃24 h、0 ℃12 h、20 ℃6 h)生产出的半乳铁结构无明显差异[9],但其对消化性的影响还鲜有报道。
市售婴儿配方奶粉中的乳铁蛋白主要来源于牛乳,尽管不同乳源的乳铁蛋白具有同源性,但物种间的差异可能导致其生理功能和消化性存在一定差异性。已有研究表明,在婴儿胃肠道消化条件下,驼奶蛋白与牛乳蛋白和人乳蛋白具有相同的可消化性,可能是婴儿配方奶粉基础的理想替代品[10],另外吴秋菊等[11]也采用了婴儿体外消化模型对骆驼初乳和常乳进行了蛋白质比较分析,结果发现驼乳蛋白质在胃中消化速率缓慢,进入肠道后会被充分水解,为婴儿提供充足的游离氨基酸。目前的大部分消化研究集中在全乳的基础上展开,对于乳铁蛋白这一单蛋白的体外消化研究较少,因此本研究采用婴儿静态体外消化模型对市售牛乳铁(commercial bovine lactoferrin,CBLF)、提取牛乳铁(bovine lactoferrin,BLF)、提取人乳铁(human lactoferrin,HLF)和提取驼乳铁(camel lactoferrin,CLF)进行分析和对比,通过深入分析不同乳源乳铁蛋白在婴儿体外消化模型中的稳定性及其消化效率,为婴儿营养产品配方优化、乳铁蛋白的提取和应用提供了科学参考,以期推动幼儿营养科学的进一步发展。
牛乳LF冻干粉,荷兰菲仕兰公司;新鲜荷斯坦牛乳,江苏无锡天资乳业有限公司;骆驼乳从新疆乌鲁木齐采集。无水乙醇、磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸、氯化钠、β-巯基乙醇、甘油、硼酸、甘氨酸、四硼酸钠、邻苯二甲醛(O-phthaldialdehyde,OPA)、三氯乙酸(trichloroacetic acid,TCA)、牛血红蛋白,国药集团化学试剂有限公司;氨基酸标准品、胃蛋白酶(P6887)、胰蛋白酶(P7545)、胆盐(48305)、三氟乙酸、二硫苏糖醇(dithiothreitol,DTT)、苯甲磺酰氟(phenylmethylsulfonyl fluoride, PMSF),美国Sigma公司;乙腈、二喹啉甲酸蛋白质定量试剂盒,美国赛默飞世尔科技(中国)有限公司;SDS-PAGE 凝胶配制试剂盒,翌圣生物科技(上海)股份有限公司;CM-Separose FF阳离子交换树脂(500 mL),美国Cytiva公司;丝氨酸,上海生工有限公司。
EL204型和PL2002型电子天平、Seven Compact pH计,上海梅特勒-托利多仪器有限公司;INLK5004MHDB型中压玻璃层析柱,北京英莱克科技发展有限公司;RO10型高效多点磁力搅拌器、VORTEX3 S25型漩涡混匀器,德国IKA公司;SK 7200H超声波清洗器,上海科岛超声仪器有限公司;Waters e2695 Separations Module 高效液相色谱分析仪、NW15VF水净化系统,上海康雷分析仪器有限公司;Nano Drop 微量分光光度计、X1R 台式高速冷冻离心机,赛默飞世尔科技(中国)有限公司;BT101LY 恒流泵,保定融柏恒流泵制造有限公司;UV-2700 紫外-可见分光光度计,日本岛津公司;Mini-PROTEIN Tetra 电泳仪、Chemi Doc XRS+化学发光凝胶成像系统,美国 Bio-rad 公司;Chirascan V100 圆二色光谱(circular dichroism,CD)仪,英国应用光物理公司。
1.3.1 乳铁蛋白的纯化
鲜乳4 ℃离心去除脂肪,然后将脱脂乳的pH值调节至4.6(人乳和驼乳调节至4.3)于37 ℃保温60 min后在室温下以10 000×g离心15 min沉淀酪蛋白。随后,将乳清的pH值调至6.8,并用0.8 μm微孔滤膜过滤。采用CM Sepharose FF作为填料,使用阳离子交换色谱法(cation exchange chromatography,CEX)对乳铁蛋白进行纯化。首先用20 mmol/L PBS过2个柱体积进行平衡,随后乳清在4 ℃下上样,液体均由恒流泵上柱,流速为10 mL/min。上样结束后,用20 mmol/L PBS去除未结合的蛋白质,清洗完成后分别用 0.3 mol/L NaCl和1.0 mol/L NaCl(含有20 mmol/L PBS)洗脱杂蛋白和乳铁蛋白。收集乳铁蛋白洗脱液,在4 ℃透析24 h除盐(每隔4 h换一次水),最后用冷冻干燥贮存备用。
1.3.2 铁饱和度测定
根据王彩云等[12]报道的方法并稍作修改,通过465 nm和280 nm的光吸收比来评估乳铁蛋白样品的铁饱和度。全饱和的乳铁蛋白溶液(10 mg/mL)在465 nm处的吸光度值为0.48,据此可预估所制备乳铁蛋白样品的铁饱和度。首先,需制备0.15 mol/L NaCl溶液,并用这一溶液配制10 mg/mL的乳铁蛋白溶液。把上述1 mL(10 mg/mL)的混合溶液加入容量瓶中,再加入0.15 mol/L NaCl稀释至10 mL,盖上瓶塞并倒转摇晃,使其充分混合均匀,使其浓度为1 mg/mL。稀释溶液使其在280 nm处时的测量值为1.00~1.50。测定前0.15 mol/L NaCl和10 mg/mL的乳铁蛋白溶液需通过0.45 μm微孔滤膜过滤。打开紫外分光光度计预热20 min,将紫外分光光度计的波长调节至465 nm,并用0.15 mol/L NaCl溶液作为基准进行调零。在465 nm处测量10 mg/mL乳铁蛋白溶液的吸光度值,并将其记录为A1。随后,重新设置波长为280 nm,再次调零后在280 nm记录1 mg/mL,乳铁蛋白溶液的吸光度为A2。质量浓度1 mg/mL乳铁蛋白溶液在280 nm处达到饱和时的吸光度为1.3,乳铁蛋白溶液的铁饱和度计算如公式(1)所示:
铁饱和度![]()
(1)
1.3.3 SDS-PAGE
用二喹啉甲酸蛋白定量试剂盒检测蛋白浓度并将浓度稀释至2 mg/mL,取样品各100 μL,还原样品与等体积的buffer缓冲液(含5%的β-巯基乙醇)混匀后沸水浴3 min,非还原样品与等体积buffer缓冲液(不含β-巯基乙醇)混匀,不加热。冷却后各取10 μL上样。样品条带在浓缩胶时电压为60 V,待条带移动至分离胶时调整电压为120 V。跑胶结束后采用考马斯亮蓝(R-250)染色30 min,随后用脱色液振荡脱色直至背景透明无色,使用Chemi Doc XRS+化学发光凝胶成像系统进行拍照。
1.3.4 乳铁蛋白的体外消化
采用婴幼儿体外模型进行消化。称取一定质量的乳铁蛋白制备成蛋白浓度为10 mg/mL的样品,用1 mol/L HCl调节pH值至5.3。空白对照为未消化的样品溶液,记为G0。将模拟胃液和样品溶液置于37 ℃ 水浴锅中预热10 min,然后将模拟胃液和样品以63∶37的体积比加入酶反应器,此时各组分终浓度如下:94 mmol/L NaCl、13 mmol/L KCl、268 U/mL胃蛋白酶。消化120 min后将pH值调至6.6。将预热后的模拟肠液加入酶反应器,模拟肠液和胃肠消化液的体积比为38∶62,此时各组分终浓度如下:16 U/mL胰酶素、3.1 mmol/L胆盐、164 mmol/L NaCl、10 mmol/L KCl、85 mmol/L NaHCO3、85 mmol/L CaCl2。消化过程中在肠1 min、肠5 min、肠30 min和肠消化120 min取样(分别记为I1、I5、I30、I120)。以1∶40(体积比)添加PMSF溶液(1 mmol/L)终止反应,消化液于-80 ℃冷冻保存。
1.3.5 多肽分子质量分布测定
使用Waters e2695高效液相色谱系统检测胃肠消化过程中肽段释放情况。取消化样品10 000 r/min离心 30 min 取上清液,过膜后进样到TSK-GEL G2000SWxl柱(300 mm×7.8 mm,5 μm)。流动相为乙腈-水-三氟乙酸(400∶600∶1,体积比),流速0.5 mL/min。柱温和检测波长分别设置为30℃、220 nm。
1.3.6 圆二色光谱测定
利用圆二色光谱仪监测了乳铁蛋白在消化过程中的结构变化。在室温下,以超纯水为背景,在1 mm石英试管中采集光谱,带宽为1 nm,扫描速度为60 nm/min。室温下搅拌平衡30 min后,进行测量。二级结构在190~260 nm测定,乳铁蛋白溶液浓度为0.2 mg/mL。每个样品做3个平行,用CDPro软件分析样品。
1.3.7 水解度测定
采用OPA法对不同时间点的消化液进行测定。
消化液样品制备:将不同消化时间点的样液与6.2%(体积分数)TCA等体积混合(0.2 mL+0.2 mL),混合振荡均匀后静置约30 min,在4 ℃,10 000×g条件下离心30 min,将上清液过0.45 μm滤膜后备用。
OPA溶液制备:称取19.05 g四硼酸钠和500 mg SDS,加入375 mL去离子水溶解至完全透明(a);将400 mg OPA溶于10 mL无水乙醇中,用去离子水将(a)定量转移至上述溶液中(b);完全溶解后再将440 mg DTT加入(b)中,用去离子水将溶液定容至500 mL(c)。
标准溶液制备:准确称取50 mg丝氨酸标准品,用去离子水定容至500 mL。
测定过程:取3 mL OPA溶液及400 μL样品溶液,混匀5 s后精确静置2 min后于分光光度计340 nm处测量OD值。空白组、标准组、样品组的样品溶液分别是去离子水、丝氨酸标准液及消化液滤液。
蛋白水解度的计算如公式(5)、公式(6)、公式(7)所示:
(5)
(6)
丝氨酸![]()
(7)
式中:h,每克蛋白裂解的肽键数,mmol/g;htot,蛋白质总肽键数,mmol/g,计为8.8;丝氨酸-NH2,每克蛋白中所含的丝氨酸的NH2量,mmol/g;α、β,常数,根据NIELSEN等[13]所述,分别选取1.00和0.40;X ,样液中的蛋白含量,g。
1.3.8 游离氨基酸测定
上机前样品的前处理如下:将100 g/L的TCA 溶液以1∶1(体积比)的比例加入到样品溶液中,混匀后超声30 min,静置过夜,然后将样品在4 ℃,10 000×g条件下离心30 min,将上清液过0.45 μm滤膜后备用。
采用Agilent1100高效液相色谱系统进行检测,色谱条件如下:Hypersil ODS C18色谱柱(4.6 mm×150 mm,5 μm);柱温40 ℃;检测波长338 nm(脯氨酸为262 nm);流动相A为27.6 mmol/L乙酸钠-三乙胺-四氢呋喃溶液(pH=7.2,体积比为500∶0.11∶2.5),流动相B为80.9 mmol/L乙酸钠-甲醇-乙腈(pH=7.2,体积比为1∶2∶2);流速1.0 mL/min;采用外标法对氨基酸含量进行定量。
所有统计分析均使用SPSS 22.0版和GraphPad Prism 8进行。采用单因素方差(ANOVA)分析实验所得数据,统计显著性水平设定为P<0.05。
图1显示了4种乳铁蛋白分别在还原以及非还原状态下的SDS-PAGE结果。还原样品中显示绝大部分样品的分子质量集中在80 kDa左右,还存在一些分子质量较小的肽段;而在非还原样品中,样品几乎全部集中在80 kDa,下面的条带较为干净。这是由于加入还原剂后会打开蛋白质分子内的二硫键,使蛋白质解聚成多肽链,这种方法多用于测定蛋白质亚基的分子质量;而非还原的样品中二硫键不会被打开,蛋白质仍保持多聚体结构,这种方法多用于测定目标蛋白的纯度及分子质量[14]。从非还原的条带可知,提取的乳铁蛋白纯度略高于市售乳铁蛋白。
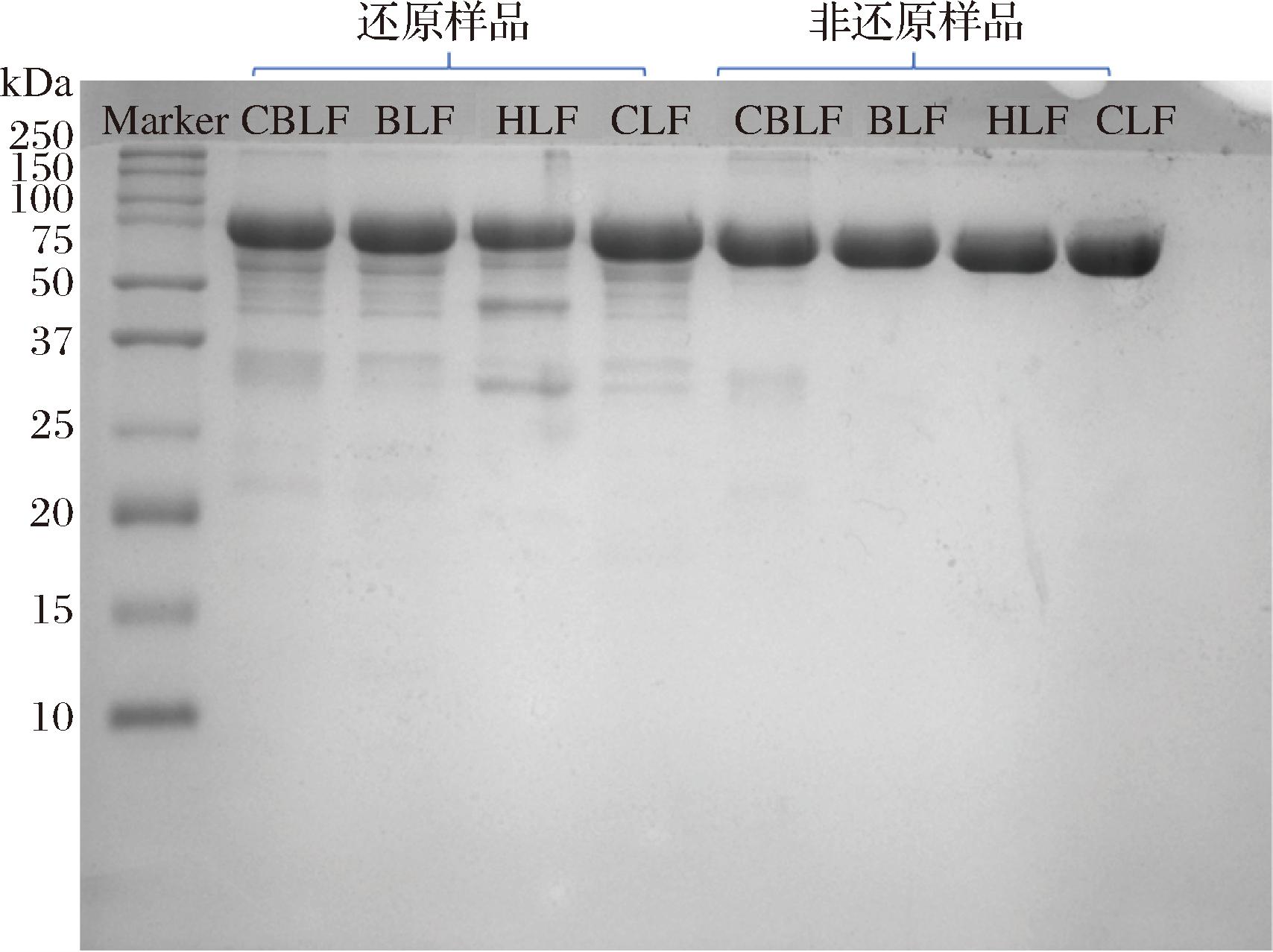
图1 不同乳铁蛋白的SDS-PAGE
Fig.1 SDS-PAGE of different lactoferrins
乳铁蛋白的铁饱和度是指乳铁蛋白中的铁与乳铁蛋白总铁结合能力的百分比,对其功能特性有着显著的影响,采用紫外-可见分光光度法测定不同乳铁蛋白的铁饱和度,结果如图2所示。其中CBLF的铁饱和度为16.02%,BLF的铁饱和度为13.39%,二者较为接近,而HLF的铁饱和度最低,为7.49%,CLF的铁饱和度最高,为20.19%。不同物种和品种以及饲养方式都会导致铁饱和度的变化[15],已有研究显示,BLF的铁饱和度在15%左右[16],而HLF的铁饱和度在4%左右[17],实验结果与前人趋势基本一致,CLF的天然铁饱和度尚缺乏报道,因此无法对比。
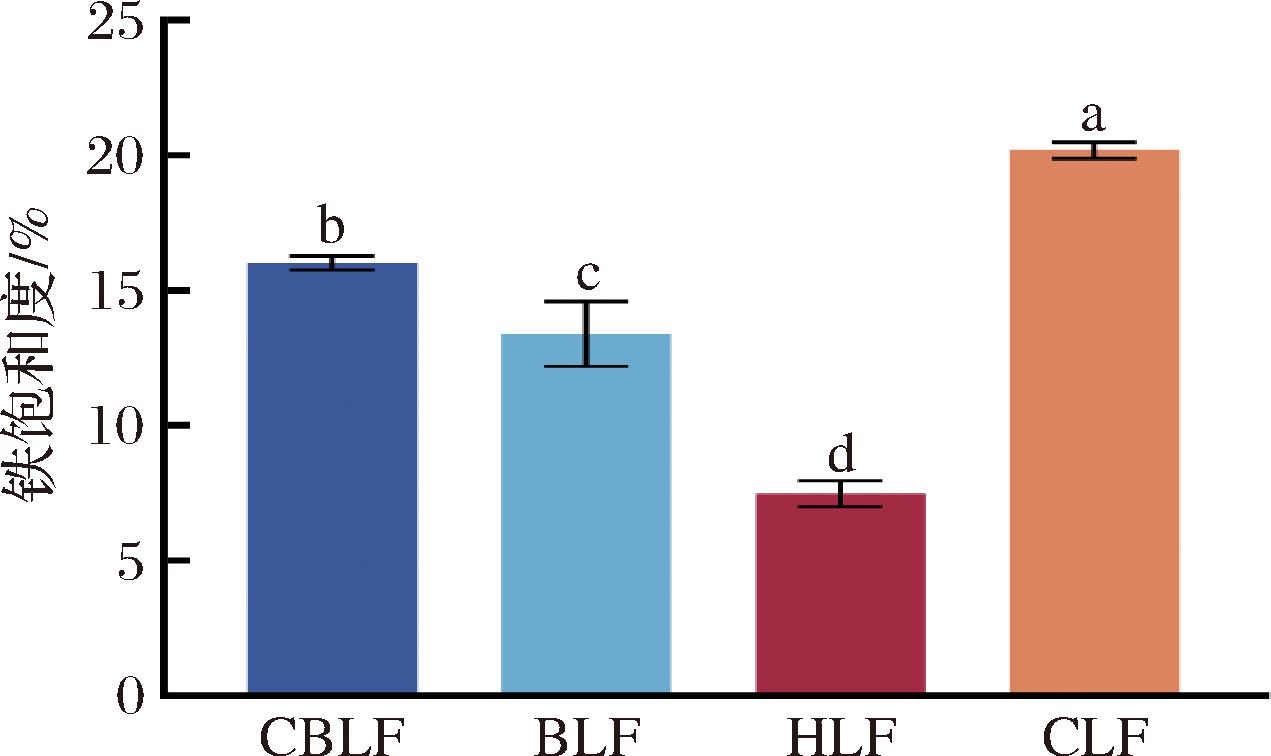
图2 不同乳源乳铁蛋白的铁饱和度
Fig.2 Iron saturation of LF from different species
注:不同字母表示不同实验组间具有显著性差异(P<0.05)(下同)。
蛋白在蛋白酶和胰蛋白酶的作用下会被分解为分子质量较小的肽段,因此可以通过在不同消化节点取样进行SDS-PAGE观测其变化,不同乳铁蛋白经过体外模拟消化过程中的胃消化液和肠消化液的蛋白组成变化如图3所示,乳铁蛋白在胃消化阶段保留了大部分结构,进入肠消化阶段后才被分解。乳铁蛋白在婴幼儿胃部的消化抗性与前人研究一致,DE FIGUEIREDO FURTADO等[18]在对含有乳铁蛋白的婴儿配方奶粉进行体外模拟婴儿动态消化时发现,乳铁蛋白对胃蛋白酶具有一定抗性;另外前人在母乳喂养的婴幼儿粪便中检测到了乳铁蛋白,这也说明乳铁蛋白在胃部并未完全消化并能在进入肠道后被完整吸收[2,19]。乳铁蛋白在婴儿模型下具有的胃消化抗性可能与其铁离子释放机制有关,乳铁蛋白在pH<5时开始失去铁,pH<4后铁离子快速释放,在低pH环境中碳酸盐离子首先发生质子化,其次是His配体的质子化,这些配体解离后削弱了铁的结合,并在铁离子释放后打开结构域从而使乳铁蛋白更易被消化[20-21];成年人的胃内pH值为0.9~1.5,乳铁蛋白在这种低pH环境下铁释放量达到90%以上,同时pH 1.5~2.0是胃蛋白酶的最适pH值,因此乳铁蛋白在成人胃内会很大程度被降解,而婴儿较高的胃pH和较低的酶活性使得乳铁蛋白更易以完整结构到达肠道[22]。对比4种乳铁蛋白,CBLF、BLF(图3-A、图3-B)和CLF(图3-D)在胃消化阶段已经有部分的肽段产生,而人乳铁(图3-C)几乎没有发生降解。KIM等[23]的研究结果同样显示HLF在胃液中具有最高的保留率,推测是由于HLF有着最高的铁饱和度。然而在本研究中HLF具有最低的铁饱和度,其仍然在胃消化阶段展示出了最佳的抗性,这说明除了铁饱和度之外,物种间还存在其他造成消化性差异的因素。ZOU等[10]在采用体外婴儿消化模型比较牛乳、母乳和驼乳的蛋白质消化率时同样发现在母乳中乳铁蛋白的条带在胃中残留最多,目前针对物种间消化机制的研究较少,其中一种可能是不同乳铁蛋白的糖基化差异。乳铁蛋白是一种高度糖基化的蛋白质,在HLF中存在5个N-糖基位点 (Asn624、Asn138、Asn503、Asn516 和 Asn479)[24];BLF的位于Asn233、Asn368、Asn476和Asn545,而Asn281在成熟乳中仅有15%被糖基化[25];CLF的糖基化位点有3个位于N叶(Asn233、Asn366、Asn575),1个位于C叶的Asn518,且该位点是CLF特有的[26]。这些位点的不同导致了每种乳铁蛋白独特的糖基化模式,N-糖基化可以为乳铁蛋白提供面对蛋白酶解的保护作用[27]。
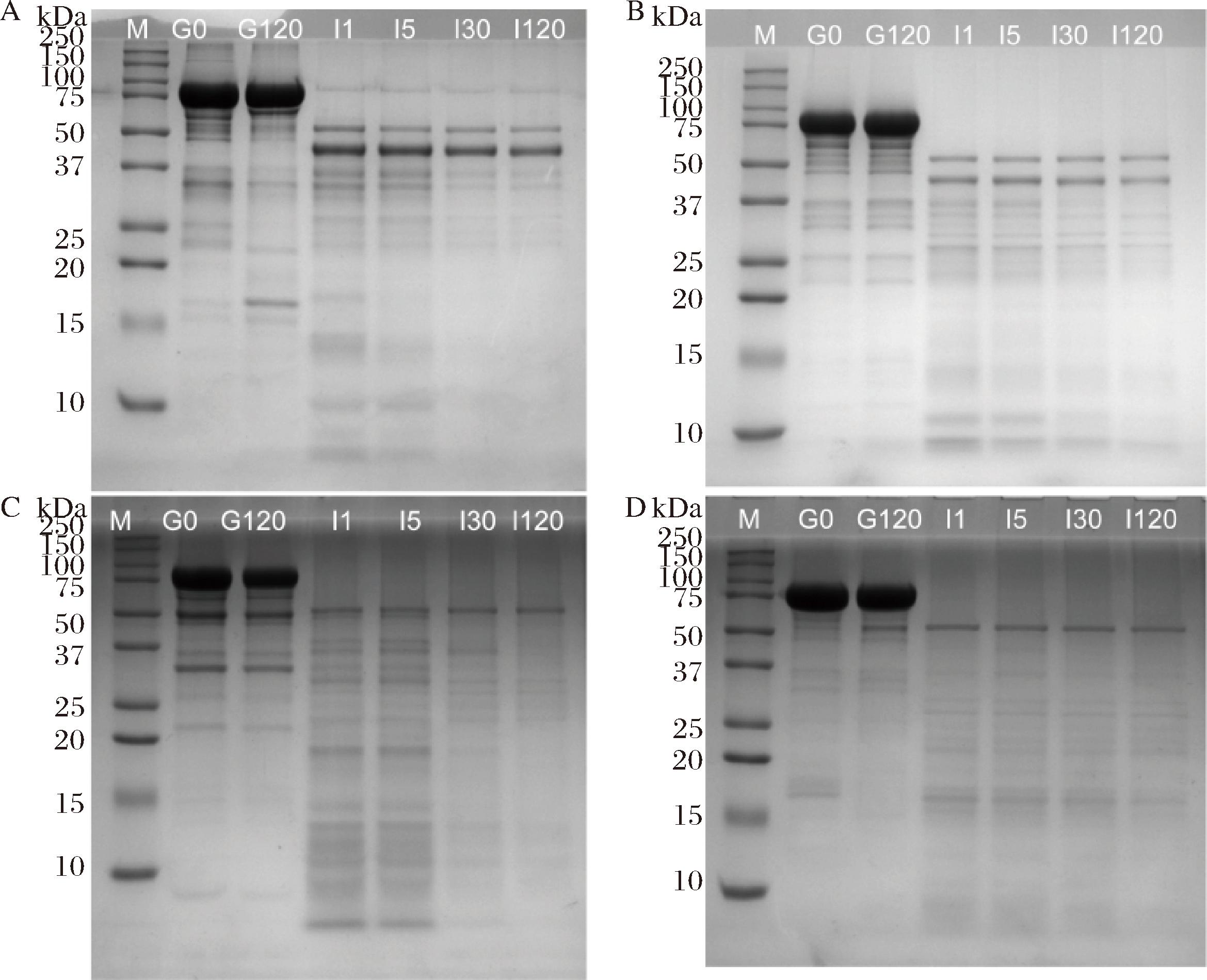
M-Marker;G0-胃消化0 min;G120-胃消化120 min;I1-肠消化1 min;I5-肠消化5 min;I30-肠消化30 min;I120-肠消化120 min(下同)。A-CBLF;B-BLF;C-HLF;D-CLF
图3 CBLF、BLF、HLF和CLF的胃肠消化阶段的SDS-PAGE
Fig.3 SDS-PAGE analysis of CBLF, BLF, HLF, and CLF during gastrointestinal digestion stage
进入肠消化后,所有乳铁蛋白在1 min内都被降解为肽段,在肠消化初期,与其他乳铁蛋白相比,人乳铁蛋白倾向于被水解为较大的肽段,消化速率较慢,这是由于HLF对胰蛋白酶的抵抗性远高于BLF,VAN VEEN等[28]的研究结果显示,N-糖基化会增加HLF对胰酶的敏感性,但去除糖基化后HLF仍然对胰酶具有较高的抗性。在肠消化末期,CBLF和BLF都保留了一条40 kDa左右的肽段,前人的研究结果中BLF婴儿体外消化模型中也保留了此条肽段,而成年体外消化模型则没有[29-30],但具体保留的原因尚不明确。
SDS-PAGE结果仅在宏观角度体现了蛋白消化过程中的变化趋势,无法定量分析,因此采用高效液相色谱测定了其多肽分子质量的分布情况,乳铁蛋白在不同消化节点的多肽分子质量结果如图4所示。整体来看在胃消化阶段乳铁蛋白集中分布在大于10 kDa范围内,进入肠消化阶段后大于10 kDa的肽段显著减少而小于200 kDa的肽段逐渐增加,到了消化终点4种样品均保留了10%左右的大分子片段,且有约40%的肽段其分子质量大于200 Da,这也说明乳铁蛋白消化后不完全分解为氨基酸,还有很大一部分以肽段的形式存在。在G0阶段,CBLF、BLF、HLF和CLF大于10 kDa的肽段分别占总肽段的94.8%、98.2%、95.4%和94.5%,胃消化结束后,4种样品大于10 kDa的肽段占比分别减少了9.02%、6.93%、2.81%和7.41%,可知HLF在胃阶段被分解得最少,BLF和CLF相差不大,而CBLF分解程度最高,这说明HLF在胃消化的抗消化性最好。I1(图4-C)中,CBLF、BLF、HLF和CLF小于200 Da的肽段分别占总肽段的45.8%、50.77%、41.63%和40.29%,其中BLF占比最高,CLF占比最小,该趋势一直保持到肠消化结束,可见BLF在消化过程中更倾向于被水解为小分子,而CLF的水解程度较小;HLF在肠消化初期(图4-C和图4-D)小于200 Da的肽段较少,到了I30和I120有了显著增加,这也与电泳结果一致。
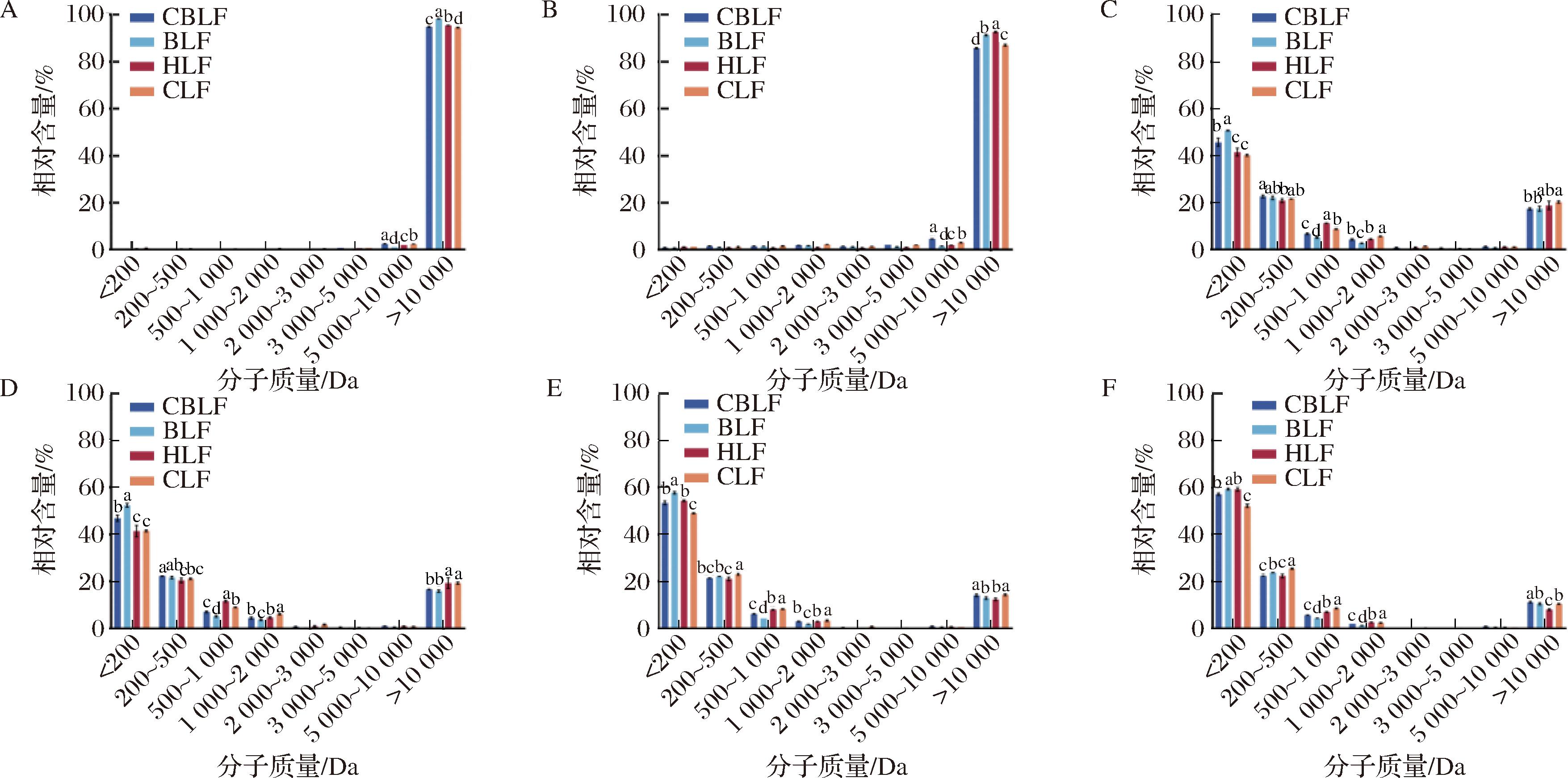
A-G0;B-G120;C-I1;D-I5;E-I30;F-I120
图4 乳铁蛋白在消化过程中的多肽分子质量的分布情况
Fig.4 Distribution of the peptide molecular weight of LF during digestion
蛋白质的二级结构对其稳定性有着重要意义,同时也能影响消化酶的作用位点[31]。圆二色光谱是一种广泛用于研究蛋白质二级结构的光谱技术,远紫外(190~260 nm)圆二色光谱反映了蛋白质结构构象的二级结构变化,包括α-螺旋、β-折叠、β-转角和无规则卷曲等,乳铁蛋白在G0阶段和G120阶段的二级结构对比以及在消化过程中在190~260 nm波长范围内的圆二色光谱如图5所示。由图5-A可看出,CBLF和BLF的二级结构含量无明显差异,α-螺旋占比19%左右,β-折叠为31.8%,可知铁饱和度和制备工艺对乳铁蛋白的二级结构影响不显著,这一点和前人的研究一致[9,32]。HLF的α-螺旋占比相较牛乳铁略高为23.5%,β-折叠则为29%;CLF的α-螺旋占比在4种样品中最高,为31.7%,其β-折叠占比最低为21.3%。经过胃消化后,乳铁蛋白都保留了较完整的结构,由图5-B可知,α-螺旋有不同程度的下降,而β-折叠有小幅度上升。α-螺旋是由多个氢键相互作用而形成的螺旋状结构,其稳定性主要依赖于氢键,其含量的下降通常意味着蛋白二级结构展开[33]。

A-G0阶段的二级结构对比;B-G120阶段的二级结构对比;C-CBLF;D-BLF;E-HLF;F-CLF
图5 不同乳铁蛋白的二级结构对比以及在消化过程中的CD光谱及二级结构变化
Fig.5 Comparison of secondary structure of different LF and changes in CD spectrum and secondary structure during digestion
在肠消化1 min时,只有HLF还保留了一部分的结构,其余乳铁蛋白基本失去了完整结构(图5-C~图5-F),可以看到α-螺旋的含量随着消化时间显著下降,无规卷曲的含量显著上升,β-折叠含量呈现较缓慢的上升趋势。无规则卷曲的增加通常伴随着有序二级结构含量的减少,导致蛋白质从有序的刚性结构转变为更为松散的柔性结构[34]。
水解度定义为蛋白质水解物中肽键断裂的比例,OPA法是通过量化体系中游离氨基的相对量来对蛋白水解程度进行表征的常用方法。较高的水解度意味着样品在消化过程中被酶作用得更快,不同的乳铁蛋白在消化过程的蛋白水解度变化如图6所示。在胃消化阶段,各组样品的水解度上升有限,仅为1%左右。到了肠消化阶段,水解度发生了急剧增加,在肠消化1 min,BLF的水解度最高,达到了48.76%,其次是CLF和CBLF,分别为47.27%和46.75%,而H组的水解度较低,为30.72%;在肠消化中期(I30),所有样品的水解度无显著性差异;而到了肠消化末期(I120),HLF成为了水解度最高的组别,为61.84%,其次是BLF和CLF,分别为59.14%和58.4%,CBLF的水解度最低,为56%,这与多肽分子质量结果一致。
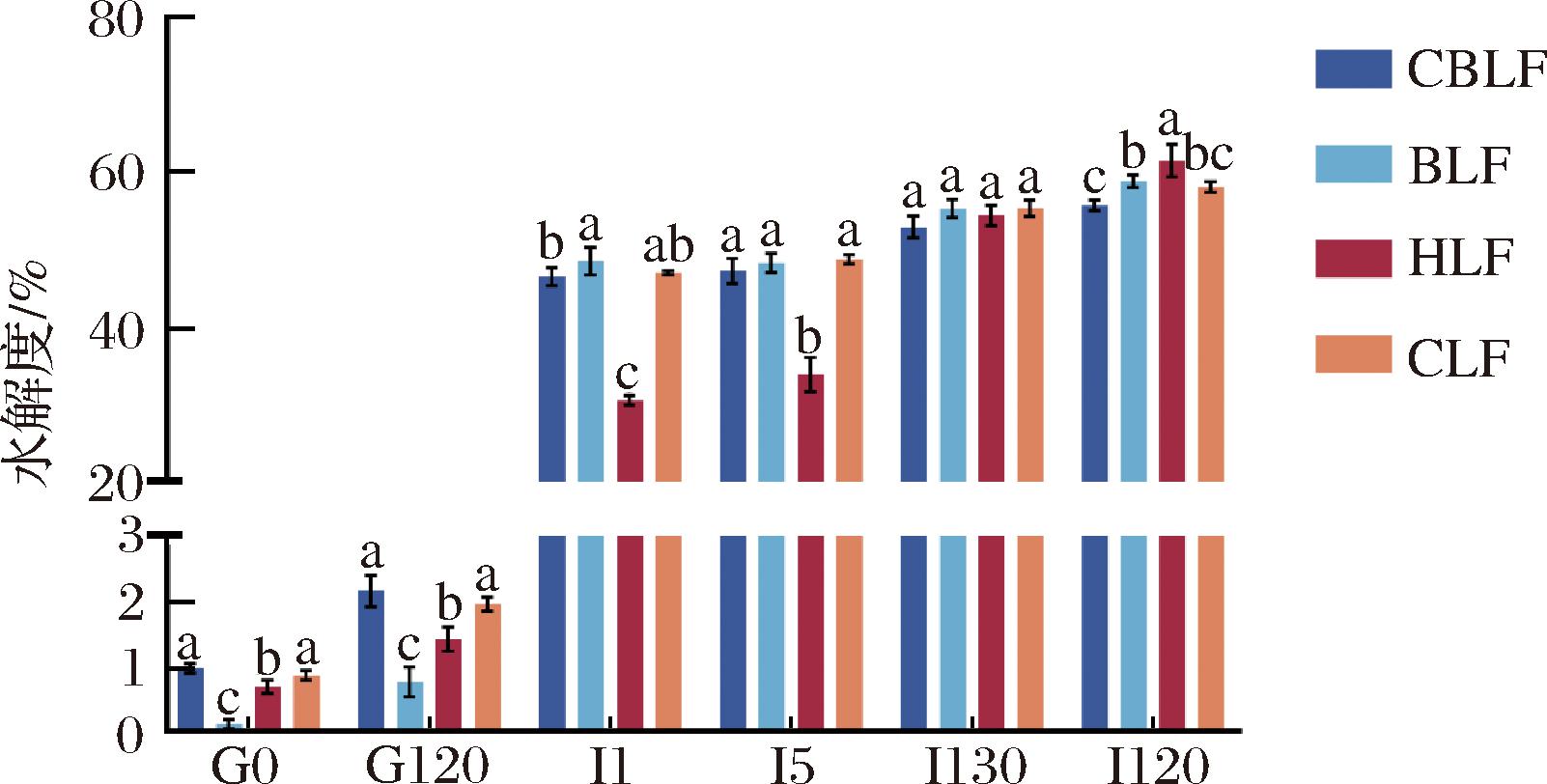
图6 乳铁蛋白在不同消化时间点水解度的变化
Fig.6 Changes of hydrolysis degree of LF at different digestion time points
在消化过程中BLF的水解度一直高于CBLF,这可能是由于二者的铁饱和度差异导致。CBLF的铁饱和度为16.02%,BLF的铁饱和度为13.39%,已有研究表明apo-LF的结构远不如holo-LF紧密[35],高铁饱和度的乳铁蛋白相较低铁饱和度的LF在肠道内更不易降解[23,36],理由如2.3节所述。尽管CBLF和BLF存在提取工艺上的差异,在初期设想中CBLF经过了喷雾干燥的热处理后构象可能会更松散从而更易消化,但从结果看铁饱和度对消化性的影响可能比加工工艺更大。从水解度的角度看,CLF的消化程度是4个样品中最低的,这也与图4多肽分子质量的结果一致,且CLF具有最高的铁饱和度,这也说明铁饱和度确实和抗消化性存在一定的关系。
水解度仅反映了肽键断裂的数量,不能准确反映婴儿发育所需的游离氨基酸(free amino acids,FAA)释放量。不同乳铁蛋白消化后的必需氨基酸(essential amino acid,EAA)及非必需氨基酸(non-essential amino acid,NEAA)含量如图7所示,胃消化阶段几乎无FAA释放,而肠阶段后FAA迅速上升,不同乳铁蛋白展现出了不同的消化规律。其中BLF在消化全程保持了最高的FAA释放量,这与图6水解度结果一致;值得注意的是,CLF有着较低的水解度,却释放了较多的FAA,前人一些研究表明即使水解度较低,游离氨基酸的含量也可能增加[26],这可能是由于酶水解过程中,蛋白降解的更彻底,降解产生的肽段进一步水解为游离氨基酸,从而增加了游离氨基酸的含量[37];HLF在肠消化初期释放量较少,在后期有了明显提升,这也与前期结果一致。
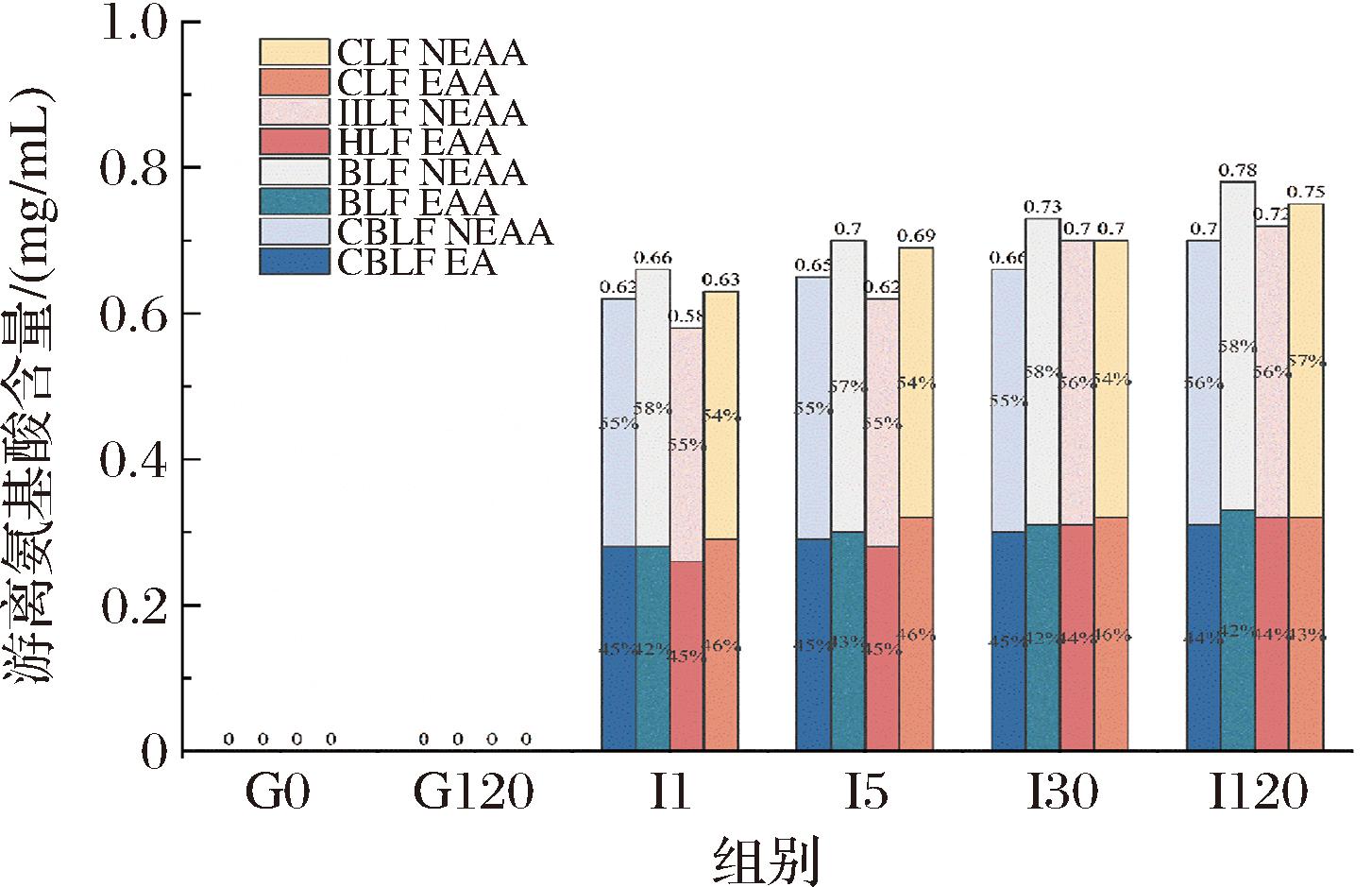
图7 乳铁蛋白在不同消化时间点必需氨基酸及非必需氨基酸含量
Fig.7 Content of essential amino acids and non-essential amino acids in LF at different digestion time points
除了氨基酸释放总量,不同种类氨基酸的具体分布热图以及显著性差异氨基酸含量如图8所示。乳铁蛋白被消化后主要释放丙氨酸(Ala)、精氨酸(Arg)、谷氨酸(Glu)、赖氨酸(Lys)、甘氨酸(Gly)、亮氨酸(Leu)、苏氨酸(Thr)、丝氨酸(Ser)、酪氨酸(Tyr)和缬氨酸(Val)等,其中赖氨酸(Lys)、亮氨酸(Leu)、苏氨酸(Thr)和缬氨酸(Val)为必需氨基酸。由图8可知,CBLF的酪氨酸(Tyr)略低于其他样品,而HLF的Tyr含量最高,酪氨酸是合成肾上腺激素、甲状腺激素和黑色素的必需氨基酸。它在体内通过酪氨酸羟化酶的作用转化为多巴,进而合成多巴胺、去甲肾上腺素和肾上腺素等神经递质[38]。另外BLF的谷氨酸(Glu)、丝氨酸(Ser)和苏氨酸(Thr)稍高于其他组别,谷氨酸是肠道细胞的主要能量来源,促进肠道发育和功能[39],丝氨酸是合成磷脂酰丝氨酸的重要部分,其作为神经调节剂可以用于改善记忆力和增强认知功能[40];苏氨酸作为甘氨酸和丝氨酸的前体,有助于身体合成胶原蛋白、弹性蛋白和肌肉组织,保持整个身体结缔组织和肌肉健康[41]。而BLF和CLF的丙氨酸(Ala)高于另外2组,丙氨酸是糖异生的重要前体,参与葡萄糖的生成,能在空腹或能量需求增加时为婴儿提供能量[42]。
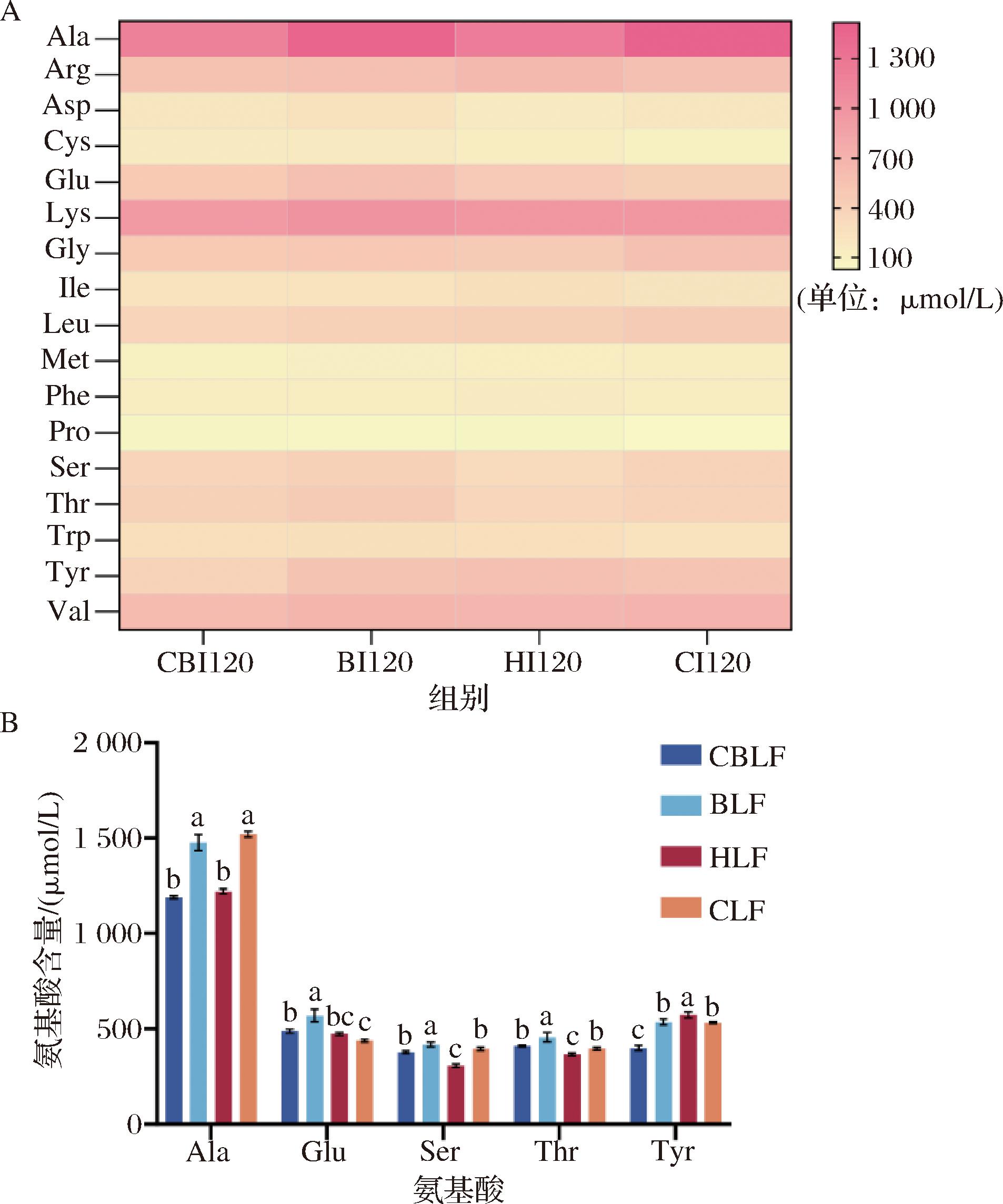
A-氨基酸热图对比;B-显著性差异氨基酸对比
图8 不同乳铁蛋白在I120氨基酸含量差异
Fig.8 The amino acid contents of LF at I120
本研究通过婴儿静态体外消化模型探究了不同乳源乳铁蛋白的消化行为,结果发现4种乳铁蛋白对胃部消化都具有抗性,其中人乳铁的抗消化性最高,而到了肠部消化后被充分水解。CBLF和BLF具有相似的二级结构,但铁饱和度的差异可能导致了二者三级结构不同,BLF的铁饱和度较低,相较于CBLF更易消化,因此推测铁饱和度对消化性的影响可能比加工工艺更大。CLF有着4种乳铁蛋白中最高的铁饱和度,其在水解度和多肽分子质量中呈现了较低的消化程度,也说明了铁饱和度对消化性的关系,值得注意的是CLF仍能产生较多的FAA。然而HLF尽管有着最低的铁饱和度,其仍展示出了较强的消化抗性,且在肠消化初期有着明显缓于其他乳铁蛋白消化的趋势,这更利于乳铁蛋白在真实的消化环境中被完整吸收进肠道从而发挥功能,具体的机制尚不得知。本研究为婴儿营养产品配方优化、乳铁蛋白添加的提取和应用提供了可参考性,未来研究可用重组蛋白技术控制铁饱和度在相同水平从而研究不同乳铁蛋白消化的具体机制,定向开发功能制品。
[1] MONTAGNE P, CUILLIERE M, MOLE C, et al. Bioactive Components of Human Milk[M]. Springer, 2001: 241-247.
[2] LI W S, LIU B, LIN Y Y, et al. The application of lactoferrin in infant formula: The past, present and future[J]. Critical Reviews in Food Science and Nutrition, 2024, 64(17):5748-5767.
[3] OMAR A, HARBOURNE N, ORUNA-CONCHA M J. Quantification of major camel milk proteins by capillary electrophoresis[J]. International Dairy Journal, 2016, 58:31-35.
[4] BAKER E N, BAKER H M. Molecular structure, binding properties and dynamics of lactoferrin[J]. Cellular and Molecular Life Sciences, 2005, 62(22):2531-2539.
[5] LEGRAND D, PIERCE A, ELASS E, et al. Lactoferrin Structure and Functions[M].Bioactive Components of Milk. New York, NY: Springer New York, 2008:163-194.
[6] KAPPELER S R, ACKERMANN M, FARAH Z, et al. Sequence analysis of camel (Camelus dromedarius) lactoferrin[J]. International Dairy Journal, 1999, 9(7):481-486.
[7] WANG B, TIMILSENA Y P, BLANCH E, et al. Lactoferrin: Structure, function, denaturation and digestion[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(4):580-596.
[8] 纪颖, 艾连中, 邢明霞, 等. 基于牛乳铁蛋白的生产技术创新及应用研究进展[J]. 食品与发酵工业, 2022, 48(15):332-340.JI Y, AI L Z, XING M X, et al. Advances on bovine lactoferrin-based technical innovation and application[J]. Food and Fermentation Industries, 2022, 48(15):332-340.
[9] WANG B, TIMILSENA Y P, BLANCH E, et al. Characteristics of bovine lactoferrin powders produced through spray and freeze drying processes[J]. International Journal of Biological Macromolecules, 2017, 95:985-994.
[10] ZOU Z Z, DULEY J A, COWLEY D M, et al. Digestibility of proteins in camel milk in comparison to bovine and human milk using an in vitro infant gastrointestinal digestion system[J]. Food Chemistry, 2022, 374:131704.
[11] 吴秋菊, 何静, 明亮,等 基于模拟婴儿胃肠消化的骆驼初乳和常乳中蛋白质和脂肪消化特性的比较分析 [J]. 食品与发酵工业,2025,51(4):154-161.WU Q J,HE J,MING L, et al. Comparative analysis of protein and lipid digestion properties in camel colostrum and mature milk based on simulated in vitro infant gastrointestinal digestion[J]. Food and Fermentation Industries,2025,51(4) :154-161.
[12] 王彩云, 罗述博, 闫序东, 等. 乳铁蛋白铁饱和度检测方法的对比[J]. 中国乳品工业, 2015, 43(2):54-56; 64.WANG C Y, LUO S B, YAN X D, et al. Evaluation of different methods for determination of the iron saturation of lactoferrin[J]. China Dairy Industry, 2015, 43(2):54-56;64.
[13] NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science, 2001, 66(5):642-646.
[14] KIRLEY T L, NORMAN A B. Unfolding of IgG domains detected by non-reducing SDS-PAGE[J]. Biochemical and Biophysical Research Communications, 2018, 503(2):944-949.
[15] 齐英杰, 郑楠, 王加启, 等. 乳中乳铁蛋白不同铁饱和度的构效作用、检测方法及其影响因素[J]. 动物营养学报, 2024, 36(6):3482-3490.QI Y J, ZHENG N, WANG J Q, et al. Structure-activity, detection methods and influencing factors of lactoferrin with different iron saturation in milk[J]. Chinese Journal of Animal Nutrition, 2024, 36(6):3482-3490.
[16] INDYK H E, FILONZI E L. Determination of lactoferrin in bovine milk, colostrum and infant formulas by optical biosensor analysis[J]. International Dairy Journal, 2005, 15(5):429-438.
[17] FRANSSON G B, LÖNNERDAL B. Iron in human milk[J]. The Journal of Pediatrics, 1980, 96(3):380-384.
[18] DE FIGUEIREDO FURTADO G, MÉNARD O, YU X X, et al. In vitro dynamic digestion of model infant formulae containing lactoferrin and medium chain triacylglycerols[J]. Food Hydrocolloids, 2021, 118:106787.
[19] MA Y, HOU Y M, XIE K, et al. Digestive differences in immunoglobulin G and lactoferrin among human, bovine, and caprine milk following in vitro digestion[J]. International Dairy Journal, 2021, 120:105081.
[20] BAKER H M, BAKER E N. Lactoferrin and iron: Structural and dynamic aspects of binding and release[J]. Biometals, 2004, 17(3):209-216.
[21] WEI Y S, FENG K, LI S F, et al. Oral fate and stabilization technologies of lactoferrin: A systematic review[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(23):6341-6358.
[22] RASTOGI N, SINGH A, SINGH P K, et al. Structure of iron saturated C-lobe of bovine lactoferrin at pH 6.8 indicates a weakening of iron coordination[J]. Proteins, 2016, 84(5):591-599.
[23] KIM B J, KUHFELD R F, HAAS J L, et al. Digestive profiles of human milk, recombinant human and bovine lactoferrin: Comparing the retained intact protein and peptide release[J]. Nutrients, 2024, 16(14):2360.
[24] ZHANG Y Q, ZHANG L N, XIA S Q, et al. Site-specific glycoproteomic analysis of purified lactoferrin from human and animal milk[J]. International Journal of Biological Macromolecules, 2024, 254:127766.
[25] PIERCE A, COLAVIZZA D, BENAISSA M, et al. Molecular cloning and sequence analysis of bovine lactotransferrin[J]. European Journal of Biochemistry, 1991, 196(1):177-184.
[26] KAPPELER S, FARAH Z, PUHAN Z. Alternative splicing of lactophorin mRNA from lactating mammary gland of the camel (Camelus dromedarius)[J]. Journal of Dairy Science, 1999, 82(10):2084-2093.
[27] KARAV S, GERMAN J B, ROUQUIÉ C, et al. Studying lactoferrin N-glycosylation[J]. International Journal of Molecular Sciences, 2017, 18(4):870.
[28] VAN VEEN H A, GEERTS M E J, VAN BERKEL P H C, et al. The role of N-linked glycosylation in the protection of human and bovine lactoferrin against tryptic proteolysis[J]. European Journal of Biochemistry, 2004, 271(4):678-684.
[29] DE HAAN P, NATSUHARA D, TRIANTIS V, et al. A microfluidic model for infantile in vitro digestions: Characterization of lactoferrin digestion[J]. SLAS Technology, 2024, 29(5):100175.
[30] 姜晗韵. 多糖对乳铁蛋白热稳定性和婴儿体外消化特性的影响研究[D]. 杭州: 浙江工商大学, 2023.JIANG H Y. Effect of polysaccharide on thermal stability of lactoferrin and in vitro digestion characteristics of infants[D]. Hangzhou: Zhejiang Gongshang University, 2023.
[31] H![]()
![]() M. Protein-lipid interactions in different meat systems in the presence of natural antioxidants—A review[J]. Polish Journal of Food and Nutrition Sciences, 2017, 67(1):5-17.
M. Protein-lipid interactions in different meat systems in the presence of natural antioxidants—A review[J]. Polish Journal of Food and Nutrition Sciences, 2017, 67(1):5-17.
[32] XIA S Q, ZHANG L N, ZHANG Y Q, et al. Structural characteristics and thermal stabilities of bovine, caprine and ovine lactoferrins with different iron saturation levels[J]. Food Bioscience, 2023, 56:103275.
[33] 张芷芸. 热处理方式对鮰鱼食用品质和蛋白消化特性的影响研究[D]. 无锡: 江南大学, 2023.ZHANG Z Y. Study on the effect of heat treatment methods on the edible quality and protein digestibility of catfish[D]. Wuxi: Jiangnan University, 2023.
[34] 张麒, 吴海波, 颜文文, 等. 大豆7S与11S球蛋白理化特性及其改性修饰的研究进展[J]. 食品与发酵工业, 2022, 48(9):324-335.ZHANG Q, WU H B, YAN W W, et al. Research progress on physicochemical properties and modification of soybean 7S and 11S globulins[J]. Food and Fermentation Industries, 2022, 48(9):324-335.
[35] GROSSMANN J G, NEU M, PANTOS E, et al. X-ray solution scattering reveals conformational changes upon iron uptake in lactoferrin, serum and ovo-transferrins[J]. Journal of Molecular Biology, 1992, 225(3):811-819.
[36] 刘栓, 李宜坤, 万丹, 等. 乳铁蛋白生物学功能研究进展[J]. 动物营养学报, 2020, 32(4):1508-1515.LIU S, LI Y K, WAN D, et al. Research progress on biological function of lactoferrin[J]. Chinese Journal of Animal Nutrition, 2020, 32(4):1508-1515.
[37] ISLAM M S, WANG H X, ADMASSU H, et al. Degree of hydrolysis, functional and antioxidant properties of protein hydrolysates from Grass Turtle (Chinemys reevesii) as influenced by enzymatic hydrolysis conditions[J]. Food Science &Nutrition, 2021, 9(8):4031-4047.
[38] LAI X L, WICHERS P H J, SOLER-LOPEZ D M, et al. Frontispiece: Structure and function of human tyrosinase and tyrosinase-related proteins[J]. Chemistry-A European Journal, 2018, 24(1):47-55.
[39] NEWSHOLME P, PROCOPIO J, LIMA M M R, et al. Glutamine and glutamate: Their central role in cell metabolism and function[J]. Cell Biochemistry and Function, 2003, 21(1):1-9.
[40] JIANG J W, LI B W, HE W F, et al. Dietary serine supplementation: Friend or foe?[J]. Current Opinion in Pharmacology, 2021, 61:12-20.
[41] LIU H, LI X C. Serine/threonine ligation: Origin, mechanistic aspects, and applications[J]. Accounts of Chemical Research, 2018, 51(7):1643-1655.
[42] WU G Y. Amino acids: Metabolism, functions, and nutrition[J]. Amino Acids, 2009, 37(1):1-17.