CHEN Juanbo,LIU Xinyi,SHI Meiling, et al.Research on the capsule system loaded with Pickering emulsion for improving the stability of water-soluble active substances[J].Food and Fermentation Industries,2025,51(14):58-64.
在当代人类的生活中,生物活性物质如营养保健品、药物、酶等能带来健康益处,被广泛应用于食品、医药、化妆品等多个领域,且其需求量和消费量依旧持续增长[1-3]。然而,轻微的环境变化,如贮存条件、光、氧气等都会影响生物活性物质的稳定性和生物利用度[4]。而包载技术的进步促进了活性物质的多剂型应用,活性成分可被携带用于精确给药、提高其稳定性以及生物利用度[5-6]。更重要的是与亲脂性生物活性物质递送系统取得的重大进展相比,负载亲水性活性物的有效系统较少,这主要是由于亲水性物质有严重向外部水相泄漏的趋势,提高其稳定性更为困难[7]。因此,开发能够通过包封提高水溶性活性物稳定性的有效系统显得极为重要。
迄今为止,已经探索了不同的策略来封装亲水性活性物。a)传统的多重乳液。活性物被包在内部分散的水滴中,但是这种多重乳液在热力学上不稳定,且表面活性剂的添加对活性物有毒性[8-9]。b)直接混合或使用牺牲模板生成的胶囊[10-11]。然而这种体系依靠聚合物壳层来封装,空气中的水分子会穿透壳层的孔隙,引起内部活性物的失活,无法长期贮存亲水性活性物[12]。c)由固体颗粒乳化剂制备而成的Pickering乳液(Pickering emulsion,PE)[13-14]。其中油包水(water in oil, W/O)以及水包油包水(water in oil in water, W/O/W)型的乳液被应用到水溶性活性物的包封中[15],例如JIANG等[16]用二氧化硅纳米颗粒包裹玉米蛋白形成疏水微球,用于稳定W/O型Pickering乳液,该体系能有效地包封水溶性活性物,并具有良好的贮存稳定性。但是Pickering乳液的应用受到热力学不稳定和液滴团聚等方面的限制,且通常为液体形式,在实际应用中仍然存在挑战,例如使食品加工复杂化,与食品领域中的应用兼容性有限[17]。
克服这些限制的策略之一是将Pickering乳液封装在水凝胶中,水凝胶具有三维网络结构,限制了Pickering乳液的布朗运动,从而提高体系的稳定性。例如WU等[18]将Pickering乳液装进海藻酸钙/果胶形成的凝胶微球中,改善了白藜芦醇在胃肠道中的消化行为,促进了其在功能食品中的应用。虽然可以提高活性物的稳定性,但是仅能保护脂溶性活性物,无法保护亲水性的活性物质。
基于此,本研究探索了一种提高水溶性活性物稳定性的封装策略,即建立一个基于Pickering乳液和海藻酸钙水凝胶的载体体系,将W/O型Pickering乳液封装在海藻酸钙胶囊中,为所负载的水溶性活性物维生素C设计了一种通用的载体。海藻酸钙凝胶层、W/O型Pickering乳液的固体颗粒界面膜以及外油相,保护维生素C免受外界环境的损害,提升其稳定性,推动了生物活性物包裹技术在食品、医药等领域的前进。
维生素C、二氧化硅纳米颗粒,上海麦克林生化科技有限公司;辛酸/癸酸甘油三酯,丰益油脂科技有限公司;无水乙醇,成都金山化学试剂有限公司;海藻酸钠,成都市科隆化学品有限公司;DPPH,东京化成工业株式会社;磷酸二氢钠,天津奥普升化工有限公司;磷酸氢二钠,广东光华科技股份有限公司;用水均为实验室自制去离子水。
UV-1600PC紫外分光光度计,上海美谱达仪器公司;FA2204 N电子天平,上海菁海仪器有限公司;KQ-500DE数控超声波清洗器,昆山市超声仪器有限公司;XSP-24生物显微镜,凤凰光学控股有限公司;LabRAM HR Evolution激光共聚焦显微镜,德国徕卡微系统有限公司;Nicolet iS50傅里叶红外光谱测试仪,赛默飞世尔科技有限公司;DF-101S集热式恒温加热磁力搅拌器、H1650高速台式离心机,湘仪离心机仪器有限公司;UPT-I-10T超纯水机,四川优普超纯科技有限公司。
1.3.1 包封维生素C水溶液的Pickering乳液的制备与表征
以维生素C水溶液为水相,将疏水纳米二氧化硅溶于辛酸/癸酸甘油三酯中,形成油相。然后将油水两相混合,手摇乳化3 min,得到包封维生素C水溶液的Pickering乳液,并用照相机和光学显微镜对其进行宏观和微观观察,拍照记录。
1.3.2 载维生素C的Pickering乳液型海藻酸钙胶囊的制备与表征
以海藻酸钠水溶液为外相液,Pickering乳液为内相液,氯化钙水溶液为接收液,然后将内相液和外相液置于滴注泵上的注射器中,控制流量分别以18 mL/h和60 mL/h通入自制的滴注装置,两相在装置锥口处接触并同时滴入接收液中进行交联反应。30 min后取出球形胶囊,水洗去除表面多余的钙离子,即得到载维生素C的Pickering乳液型海藻酸钙胶囊(PE in alginate capsules, PE@gel)。然后使用扫描电镜和共聚焦显微镜(confocal laser scanning microscope, CLSM)对PE@gel的形貌和结构进行观察。
1.3.3 傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)
为了探究维生素C水溶液和Pickering乳液包封进海藻酸钙胶囊中的化学成分差异,使用FTIR进行衰减全反射分析,分别对维生素C,Pickering乳液,海藻酸钠(alginate,Alg)和PE@gel进行扫描,光谱范围为650~4 000 cm-1。
1.3.4 PE@gel包封率和载药量测定
采用超滤离心法测定包封率和载药量[19],取适量PE@gel用滤纸将表面水分吸干,用天平称量微胶囊的质量,然后用pH值为4.7的柠檬酸-柠檬酸钠缓冲液解离后冷水浴超声并稀释一定倍数,用针头过滤器过滤后,通过紫外分光光度计在256 nm处测定其吸光度,根据标准曲线方程计算维生素C含量。包封率的计算如公式(1)所示:
包封率![]()
(1)
式中:W1为包入PE@gel中维生素C的含量,W2为加入维生素C的初始含量。
载药率的计算如公式(2)所示:
载药率![]()
(2)
式中:W0为PE@gel的质量,g;W1为包入PE@gel中维生素C的含量,g。
1.3.5 PE@gel对维生素C稳定性探究
参考ZHANG等[19]的方法,将维生素C水溶液,按照方法1.3.1节中将二氧化硅颗粒乳化剂替换为司盘80形成乳液包封的维生素C(Span 80-stabilized emulsions, Span 80),Pickering乳液和PE@gel样品分别静置在避光25 ℃恒温箱和365 nm紫外灯照射的条件下,定期使用紫外分光光度计测定维生素C的吸光度和对DPPH自由基的清除率,以维生素C在不同包封体系中的保留率和抗氧化率反映其稳定性。维生素C相对保留率的计算如公式(3)所示:
相对保留率![]()
(3)
式中:R1为第1天时维生素C的吸光度,Rn为第n天时维生素C的吸光度。
维生素C DPPH抗氧化值的计算如公式(4)所示:
DPPH抗氧化值![]()
(4)
式中:A0为DPPH的乙醇溶液的吸光值,A1为样品液DPPH 的吸光值,A2为样品的乙醇溶液DPPH的吸光值。
相对抗氧化率的计算如公式(5)所示:
相对抗氧化率![]()
(5)
采用Origin 8.1作图,利用SPSS 19进行差异显著性分析,结果以“平均值±标准差”表示。所有实验重复3次。
包封维生素C的Pickering乳液粒度分布和显微镜照片如图1所示,乳液平均粒径为43 μm,粒径分布呈单峰型。使用尼罗红和接枝牛血清蛋白的异硫氰酸荧光素(fluorescein isothiocyanate-bovine serum albumin, FITC-BSA)对乳液的油相和水相进行染色,通过CLSM观察乳液形貌特征,由尼罗红染色的乳液外部呈红色荧光,被FITC-BSA染色的水相显示绿色荧光,将油水两相染色的图片叠加,可以清晰看到乳液的外部发出红色荧光,内部发出绿色荧光。以上现象证明制备的Pickering乳液为W/O型。
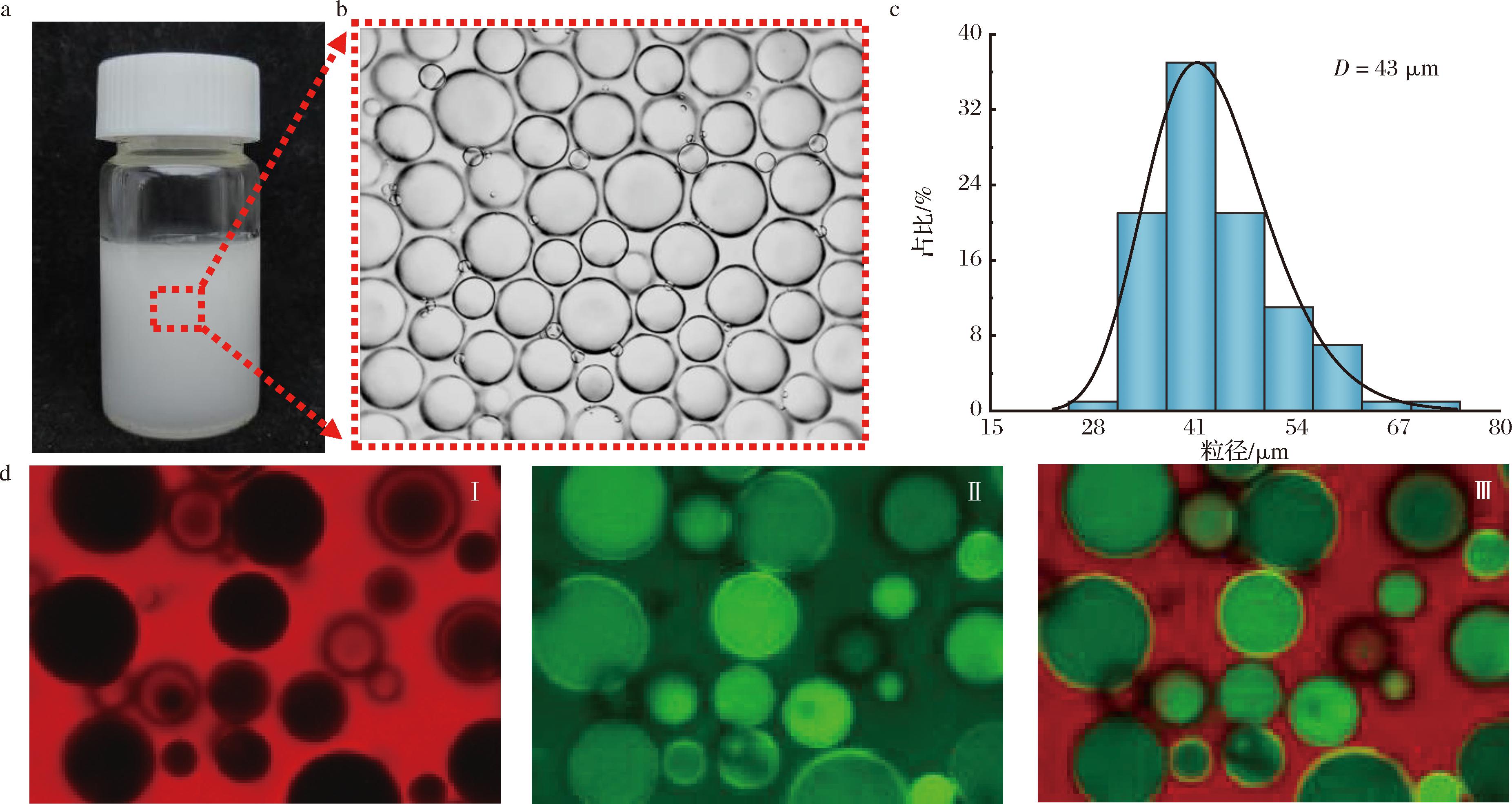
a-乳液表观图片;b-微观图片;c-粒径分布;d-新鲜乳液的CLSM图像
图1 负载维生素C的Pickering乳液的表观图片、微观图片、粒径分布和乳液的CLSM图像
Fig.1 Apparent images, microscopic images, particle size of vitamin C-loaded Pickering emulsions and CLSM images of emulsions
图2-a是制备PE@gel的装置示意图,通过调节外相海藻酸钠溶液、内相Pickering乳液的流量和接收相CaCl2的浓度来控制胶囊尺寸,如图2-b所示,在Ca2+浓度不变的情况下,随着乳液流量的增加,乳液核心和胶囊尺寸都增大,海藻酸钙壳层厚度减小;在内外相流量比不变的情况下,随着Ca2+浓度的增加,海藻酸钙壳层厚度和胶囊尺寸都增大(图2-c),且壳层厚度与Ca2+的浓度成正比。不论何种条件,胶囊直径的标准差均低于5%,表明制备的单分散胶囊球形度良好。
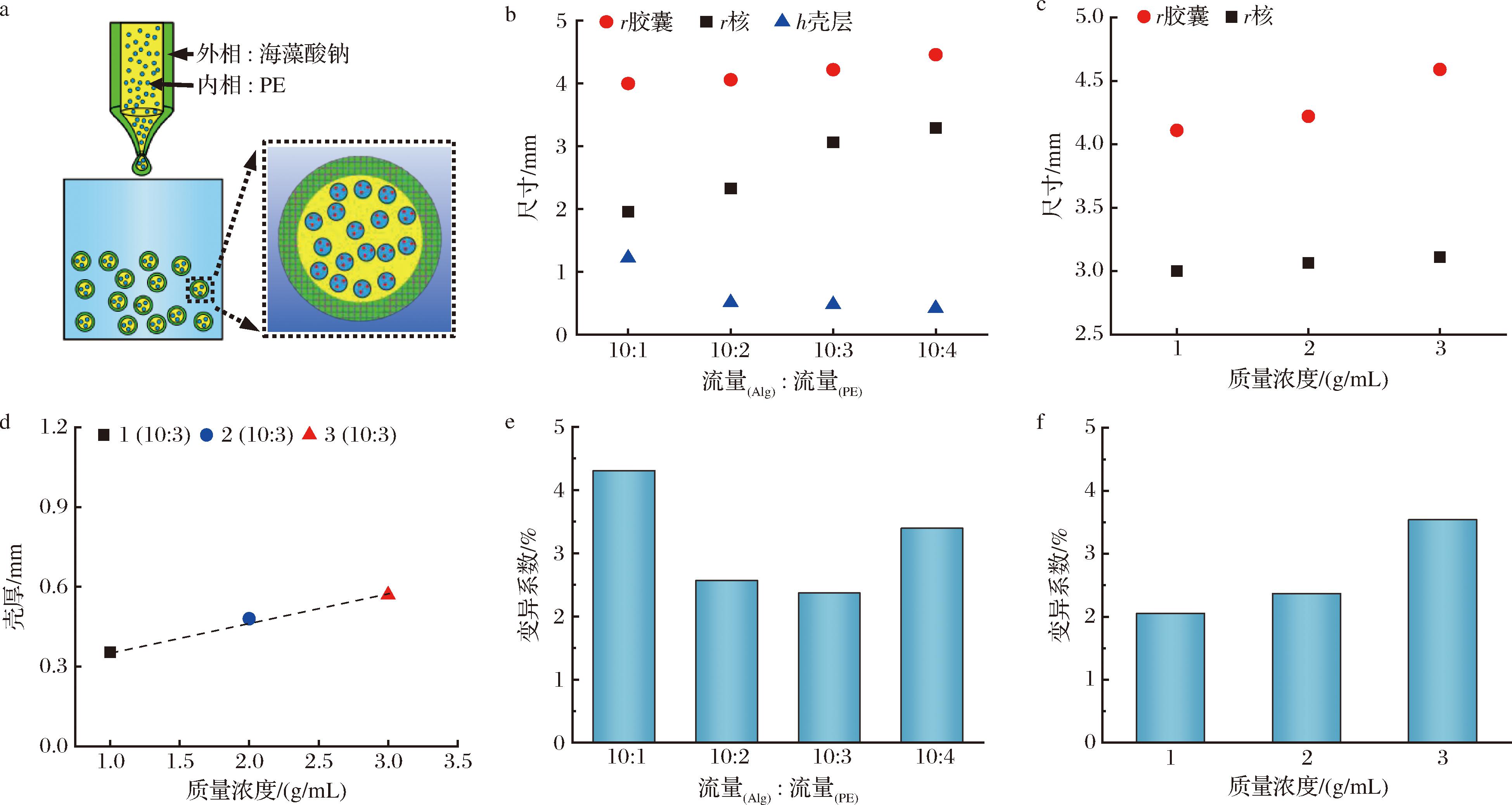
a-载维生素C的Pickering乳液型海藻酸钙胶囊制备示意图;b-不同流量比下胶囊尺寸;c-不同质量浓度下胶囊尺寸;d-壳厚与Ca2+质量浓度呈线性关系;e-胶囊在不同流量比下的变异系数;f-胶囊在不同质量浓度下的变异系数
图2 Pickering型海藻酸钙胶囊尺寸概述
Fig.2 Overview of the Pickering emulsion-laden capsule dimensions
PE@gel的表面和内部形貌如图3所示,制备的PE@gel整体呈现圆球状,内部有空腔结构,可包封载维生素C的乳液。对胶囊的内部(图3-c)进行元素扫描分析,如图3-d所示,Pickering乳液的乳化剂为二氧化硅,而胶囊内部除了海藻酸盐的碳氧元素外,还有硅元素的存在,证明了乳液被成功包封进海藻酸钙胶囊中。
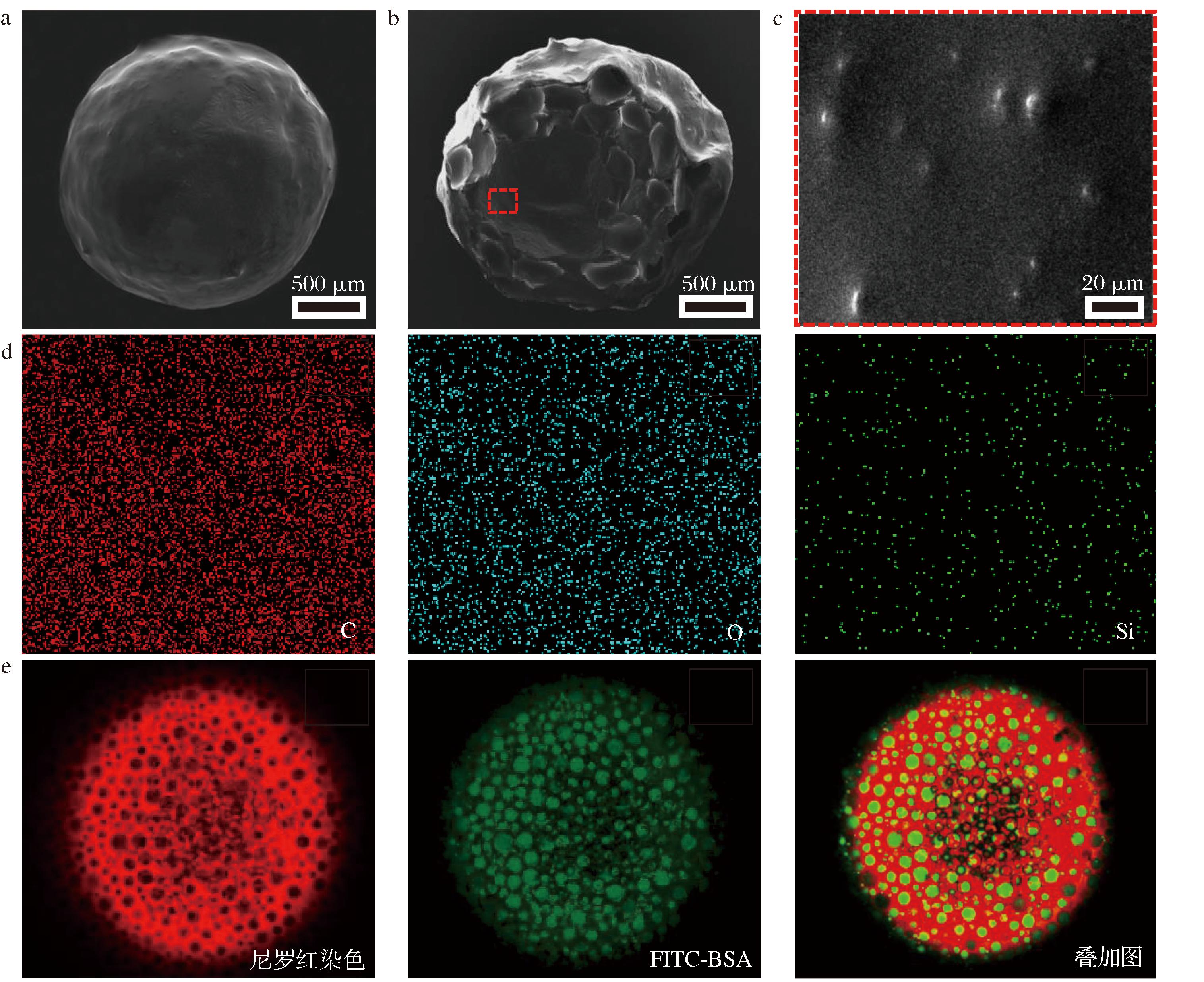
a-包封Pickering乳液的海藻酸钙胶囊;b-横截面;c-胶囊内壁放大图;d-胶囊内壁EDS元素分析;e-胶囊的CLSM平面图像
图3 包封载维生素C的Pickering乳液的海藻酸钙胶囊的形貌特征
Fig.3 Morphological characteristics of vitamin C-loaded Pickering emulsions in calcium alginate capsules
使用CLSM观察PE@gel的内部结构,由尼罗红染色的油相和FITC-BSA染色的水相分别显示红色荧光和绿色荧光,表明载维生素C的W/O型Pickering乳液被成功封装在胶囊内部,且乳液的形貌结构未发生改变。
用FTIR分析维生素C、PE和Alg,PE@gel之间的相互作用。如图4所示,维生素C的光谱在1 753 cm-1和1 111 cm-1处可见到C![]() O和C—O—C的拉伸峰。在Pickering乳液和PE@gel的FTIR光谱中也发现了维生素C的特征峰,表明维生素C被成功封装在Pickering乳液中。结合Alg在1 753 cm-1处无特征峰,证明PE被包裹在PE@gel中,且这些制备过程都是物理包封,无新的化学键产生,对维生素C的化学性质没有影响,这一结果与CLSM图中的结果一致。
O和C—O—C的拉伸峰。在Pickering乳液和PE@gel的FTIR光谱中也发现了维生素C的特征峰,表明维生素C被成功封装在Pickering乳液中。结合Alg在1 753 cm-1处无特征峰,证明PE被包裹在PE@gel中,且这些制备过程都是物理包封,无新的化学键产生,对维生素C的化学性质没有影响,这一结果与CLSM图中的结果一致。
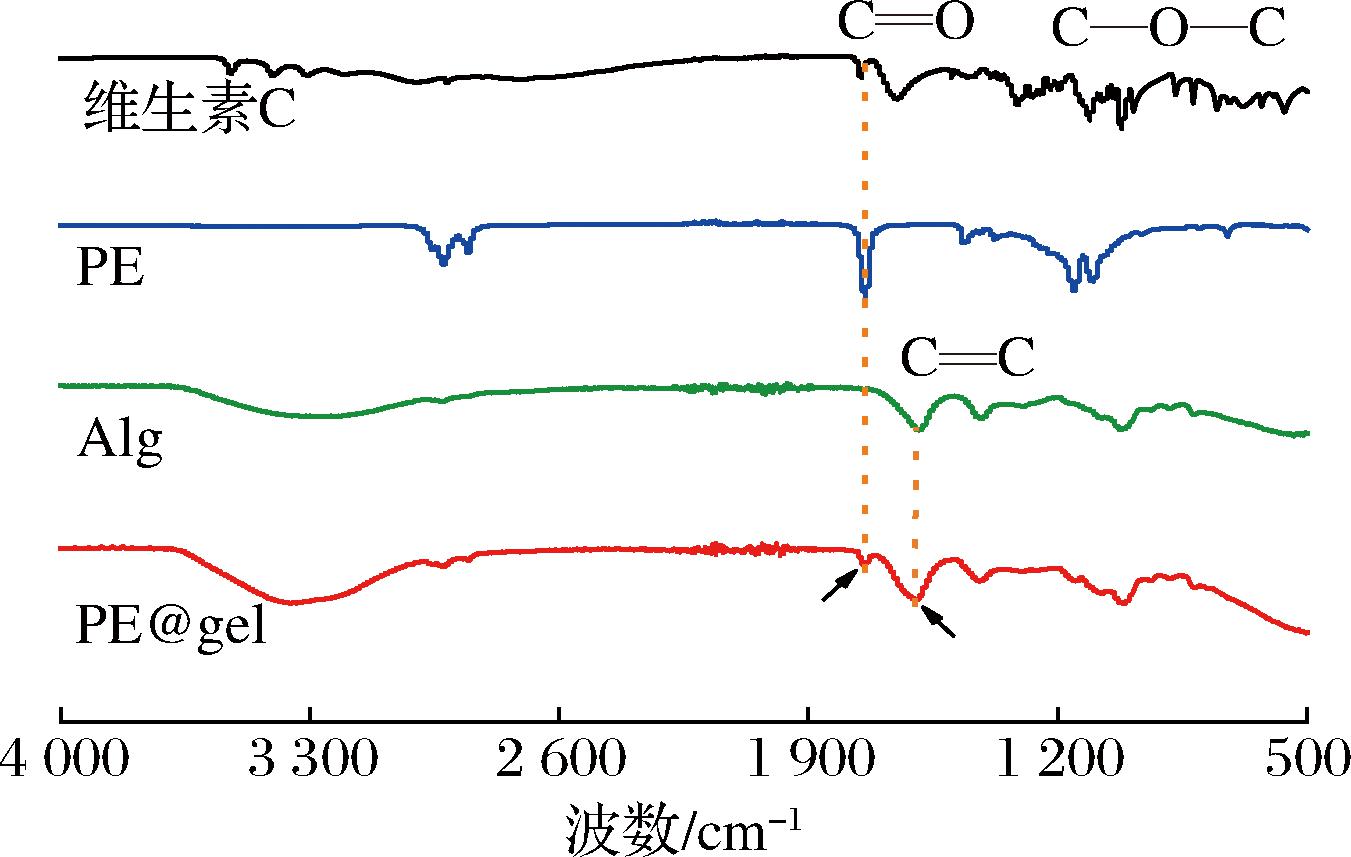
图4 维生素C、PE、Alg和PE@gel的FTIR光谱
Fig.4 The FTIR spectra of vitamin C, PE, Alg, and PE@gel
海藻酸钙胶囊的厚度和交联程度与接收相中CaCl2的浓度有关,其浓度过低胶囊成型较差,浓度过高则胶囊硬度大,不适合包封乳液。因此本实验将CaCl2质量浓度定于1~3 g/mL来探究对包封率和载药率的影响。如图5所示,随着Ca2+浓度的增大,维生素C的包封率呈现上升趋势,这主要是由于具有三维网状结构的海藻酸钙胶囊减少了Pickering乳液的泄漏,当CaCl2的质量浓度为2.5 g/mL时,达到最高包封率81.81%,载药率为13.16%,而继续提高CaCl2浓度时维生素C的包封率降低,载药率不变。这主要是由于Ca2+浓度增加,胶囊的壁层增厚,不利于胶囊对乳液的包封。综合考虑维生素C的包封率和载药率以及所形成胶囊的软硬程度,选择2.5 g/mL的CaCl2浓度作为后续接收液实验条件。
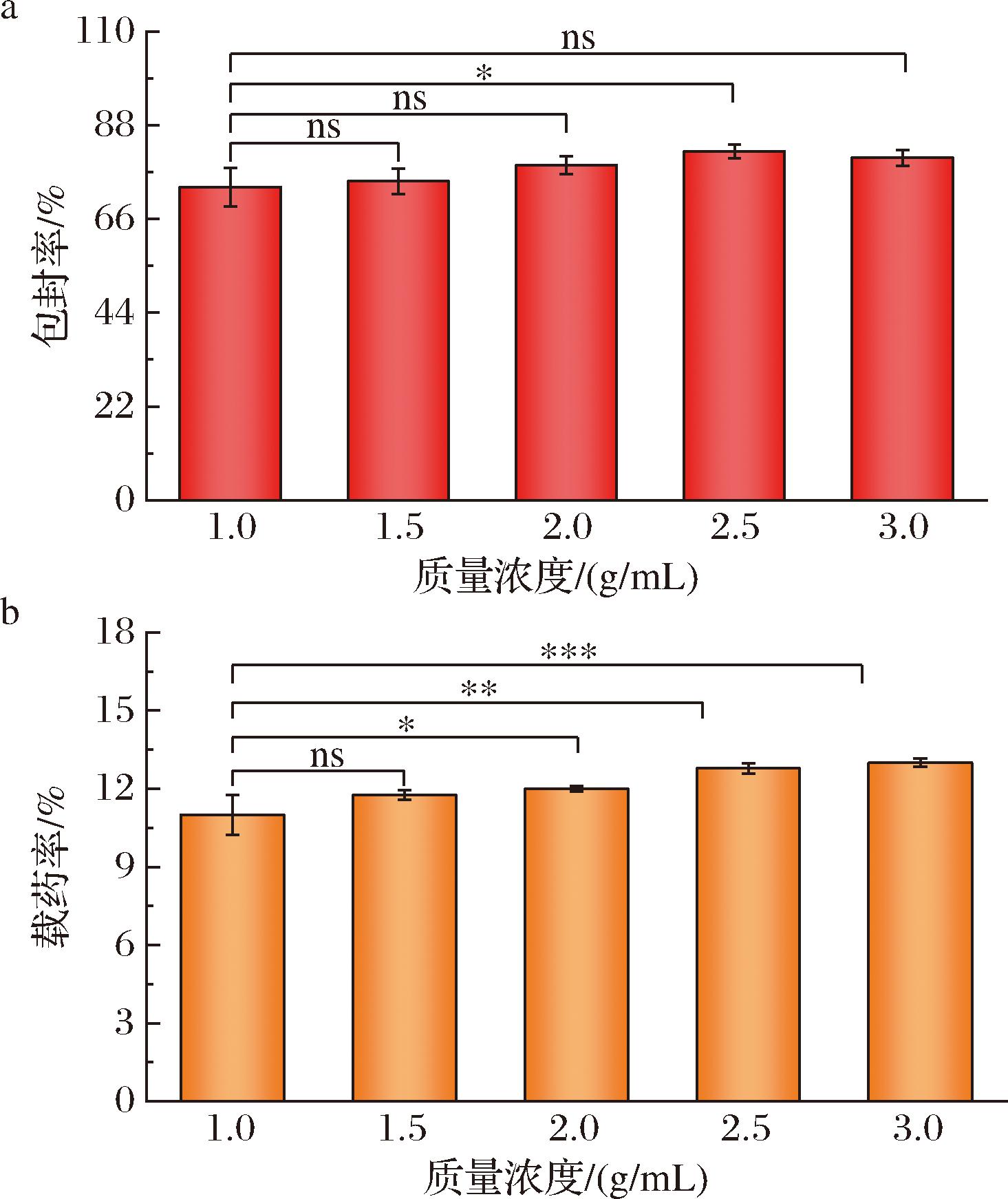
a-包封率;b-载药率
图5 不同CaCl2浓度对包封率和载药率的影响
Fig.5 The effect of different concentrations of CaCl2on encapsulation efficiency and drug loading efficiency
注:统计学分析采用Student’s T检验,*P<0.05,**P<0.01,***P<0.001,ns代表不显著。
在常温避光条件下,对比不同体系中维生素C的保留率和相对抗氧化活性。图6-a显示了各体系中维生素C的保留率,随着时间的延长,维生素C水溶液快速失活,12 d后保留率为0%。而Span 80,PE和PE@gel包封的维生素C在经过27 d后保留率分别为30.4%、55.4%和71.29%。Span 80因油水分离稳定性下降,后期其包封的维生素C保留率迅速下降,Pickering乳液的保护效果较高,主要原因是二氧化硅胶体颗粒形成物理屏障隔绝氧气,从而延缓了维生素C的失活[18,20]。维生素C水溶液,Pickering乳液和PE@gel在上述条件下的相对抗氧化活性如图6-b所示,随贮存时间的延长,各体系对DPPH自由基的清除能力均出现下降的趋势,但PE@gel对DPPH自由基的清除率最高为81.3%左右。主要原因是维生素C在乳液内水相减少了与氧气的接触,降低了氧化反应的程度,海藻酸钙水凝胶层的二次包封进一步减少乳液的聚并,提高其稳定性,因此能保持对DPPH自由基较高的清除率,发挥抗氧化作用。
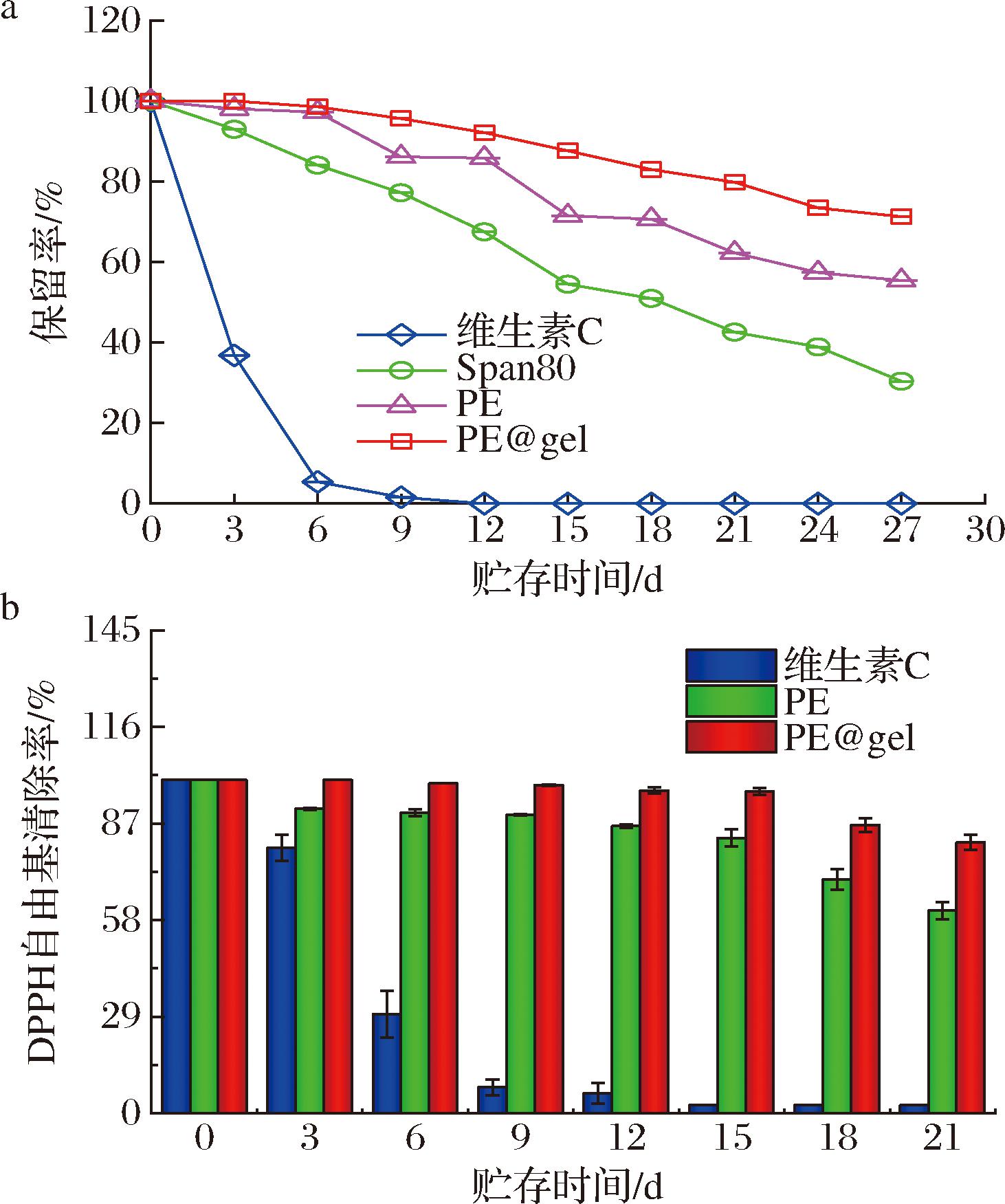
a-维生素C的保留率;b-维生素C对DPPH自由基清除率
图6 常温避光条件下不同包封体系对维生素C的贮存稳定性
Fig.6 Storage stability of vitamin C under ambient temperature and light avoidance conditions using different encapsulation systems
在365 nm紫外灯照射下,对比不同体系中维生素C的保留率和相对抗氧化活性的变化。如图7-a所示,所有体系中维生素C的保留率随照射时间的延长而降低,而维生素C水溶液一周后保留率为0%,说明光照是导致维生素C失活的重要因素。相比之下,PE@gel包裹的维生素C具有优异的光稳定性,7 d后保留率为75%以上。同样的,在紫外光照条件下的相对抗氧化活性如图7-b所示,21 d后维生素C水溶液,Pickering乳液和PE@gel的相对抗氧化活性分别是2.4%、60.84%、81.3%,PE@gel较维生素C水溶液高出27.41倍。这一结果可能归因于水凝胶的紫外线散射效应,它减弱了紫外线的强度。此外,海藻酸钙凝胶上的不饱和官能团可以吸收紫外线,保护被封装的维生素C免受紫外线辐射。另一方面二氧化硅自身具有紫外吸收能力,能够减少紫外光照对维生素C的影响[17,21]。
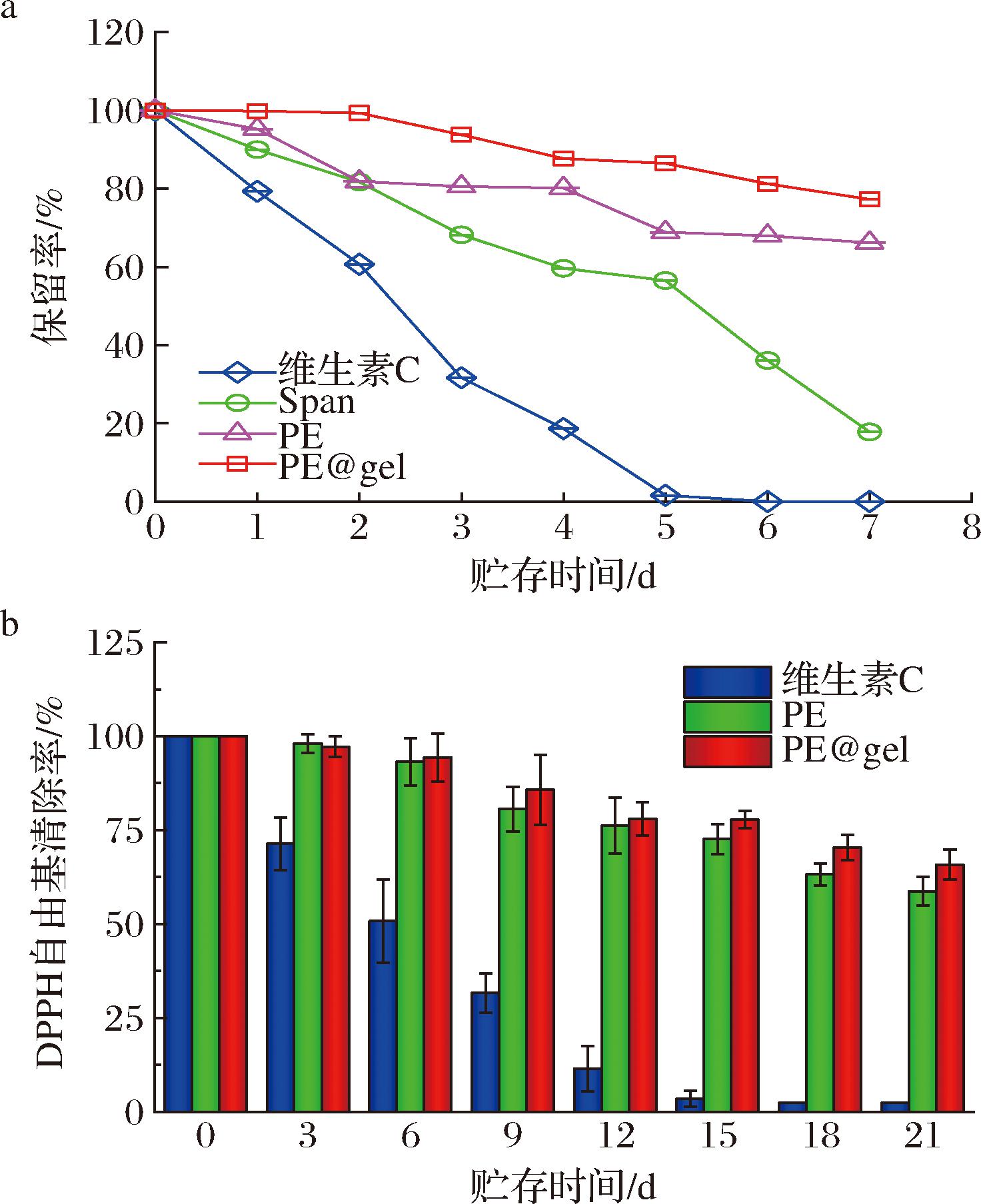
a-维生素C的保留率;b-维生素C对DPPH自由基清除率
图7 紫外灯照射下不同包封体系对维生素C的光稳定性
Fig.7 Photostability of vitamin C under UV lamp irradiation using different encapsulation systems
本研究通过滴注法将载维生素C的W/O型Pickering乳液包封进海藻酸钙微胶囊中,从而实现了对亲水性活性物的包封及活性保留,凭借Pickering乳液的颗粒界面膜和海藻酸钙水凝胶壁层的联合保护,可提高维生素C的贮存稳定性、光稳定性并保留其较高的抗氧化活性。通过改变流量和CaCl2浓度就能够调控微胶囊的微观结构。CLSM和FTIR结果表明,负载维生素C的Pickering乳液成功制备,并包封在海藻酸钙微胶囊中,且Pickering乳液的性质没有发生化学变化,对维生素C的生物活性也没有影响。此外,在25 ℃避光贮存和紫外光照条件下,PE@gel保护的维生素C表现出良好的稳定性和抗氧化能力。综上所述,PE@gel胶囊包封体系作为水溶性活性物的包封和保护系统具有良好的潜力,未来可用于开发功能性食品。
[1] LI Z H, BEHRENS A M, GINAT N, et al.Biofilm-inspired encapsulation of probiotics for the treatment of complex infections[J].Advanced Materials, 2018, 30(51):1803925.
[2] KHAN M A, CHEN L Y, LIANG L. Improvement in storage stability and resveratrol retention by fabrication of hollow zein-chitosan composite particles[J].Food Hydrocolloids, 2021, 113:106477.
[3] ADITYA N P, KO S.Solid lipid nanoparticles (SLNs):Delivery vehicles for food bioactives[J].RSC Advances, 2015, 5(39):30902-30911.
[4] KIM S H, KIM K R, AHN D R, et al.Reversible regulation of enzyme activity by pH-responsive encapsulation in DNA nanocages[J].ACS Nano, 2017, 11(9):9352-9359.
[5] MCCLEMENTS D J.Encapsulation, protection, and release of hydrophilic active components:Potential and limitations of colloidal delivery systems[J].Advances in Colloid and Interface Science, 2015, 219:27-53.
[6] 刘博文, 孙洋, 康宇, 等.食品凝胶递送体系的应用及研究进展[J].食品与发酵工业, 2024, 50(13):377-387.LIU B W, SUN Y, KANG Y, et al.Application of food gel used as a nutrient delivery system and its research progress[J].Food and Fermentation Industries, 2024, 50(13):377-387.
[7] ADITYA N P, ESPINOSA Y G, NORTON I T.Encapsulation systems for the delivery of hydrophilic nutraceuticals:Food application[J].Biotechnology Advances, 2017, 35(4):450-457.
[8] CHEN X, MCCLEMENTS D J, WANG J, et al.Coencapsulation of (-)-epigallocatechin-3-gallate and quercetin in particle-stabilized W/O/W emulsion gels:Controlled release and bioaccessibility[J].Journal of Agricultural and Food Chemistry, 2018, 66(14):3691-3699.
[9] XUAN M J, ZHAO J, SHAO J X, et al.Recent progresses in layer-by-layer assembled biogenic capsules and their applications[J].Journal of Colloid and Interface Science, 2017, 487:107-117.
[10] ZHU Z L, YUAN Y, GUO J K, et al.Encapsulation of SOD in chitosan-coated gel particles of alginate or mixture of alginate and shellac for targeted intestinal delivery[J].Food Hydrocolloids, 2023, 142:108778.
[11] DEVI N, SARMAH M, KHATUN B, et al.Encapsulation of active ingredients in polysaccharide—protein complex coacervates[J].Advances in Colloid and Interface Science, 2017, 239:136-145.
[12] TAN C, CELLI G B, LEE M, et al.Polyelectrolyte complex inclusive biohybrid microgels for tailoring delivery of copigmented anthocyanins[J].Biomacromolecules, 2018, 19(5):1517-1527.
[13] 吴子涵, 陈泽平, 刘震宇, 等.大豆蛋白纤维聚集体Pickering乳液提高β-胡萝卜素的包埋稳定性[J].食品与发酵工业, 2022, 48(21):152-159.WU Z H, CHEN Z P, LIU Z Y, et al.Soy protein fibril Pickering emulsions improve stability of β-carotene[J].Food and Fermentation Industries, 2022, 48(21):152-159.
[14] 魏晓晶, 陈红, 张迈, 等.荷载姜黄素的Pickering乳液流变学特性和稳定性研究:姜黄素溶解在乙醇和油中的比较[J].食品与发酵工业, 2024, 50(13):98-107.WEI X J, CHEN H, ZHANG M, et al.Rheological properties and stability of curcumin-loaded Pickering emulsions:A comparison of curcumin in aqueous and oil phases[J].Food and Fermentation Industries, 2024, 50(13):98-107.
[15] WU B, LI Y, LI Y Y, et al.Pickering emulsions-chitosan hydrogel beads carrier system for loading of resveratrol:Formulation approach and characterization studies[J].Reactive and Functional Polymers, 2021, 169:105074.
[16] JIANG H, HU X F, JIANG W J, et al.Water-in-oil Pickering emulsions stabilized by hydrophobized protein microspheres[J].Langmuir, 2022, 38(40):12273-12280.
[17] LIM H P, HO K W, SURJIT SINGH C K, et al.Pickering emulsion hydrogel as a promising food delivery system:Synergistic effects of chitosan Pickering emulsifier and alginate matrix on hydrogel stability and emulsion delivery[J].Food Hydrocolloids, 2020, 103:105659.
[18] WU B, LI Y, LI Y Y, et al.Encapsulation of resveratrol-loaded Pickering emulsions in alginate/pectin hydrogel beads:Improved stability and modification of digestive behavior in the gastrointestinal tract[J].International Journal of Biological Macromolecules, 2022, 222:337-347.
[19] ZHANG M, SUN R, XIA Q.An ascorbic acid delivery system based on (W1/O/W2) double emulsions encapsulated by Ca-alginate hydrogel beads[J].Journal of Drug Delivery Science and Technology, 2020, 60:101929.
[20] SOTO E R, SPECHT C A, RUS F, et al.An efficient (nano) silica-In glucan particles protein encapsulation approach for improved thermal stability[J].Journal of Controlled Release, 2023, 357:175-184.
[21] WU B, LI Y, LI Y Y, et al.The influence of Ca2+/K+ weight ratio on the physicochemical properties and in vitro digestion behavior of resveratrol-loaded Pickering emulsions encapsulated in alginate/κ-carrageenan hydrogel beads[J].Reactive and Functional Polymers, 2022, 181:105414.