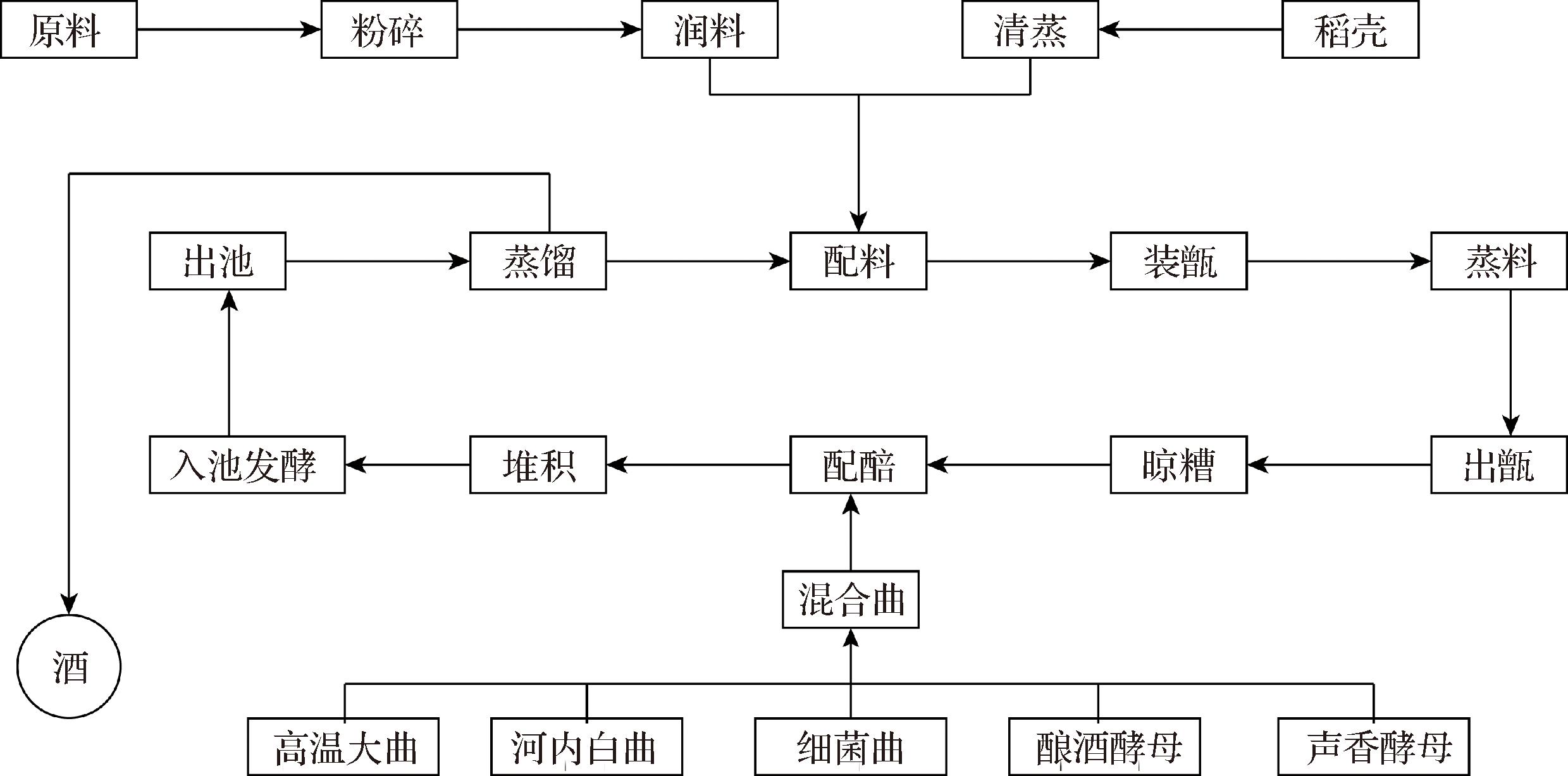
图1 馥香型白酒工艺流程图
Fig.1 Process flow chart of Fu-flavor Baijiu
XIE Sankuan,SUN Shouying,ZHANG Jiaojiao, et al.Microbial succession and core microbiome analysis in fermentation process of Fu-flavor Baijiu[J].Food and Fermentation Industries,2025,51(14):74-82.
馥香型白酒是以高粱、大米、糯米、小麦为酿酒原料,高温大曲、麸曲、细菌曲、酿酒酵母和生香酵母为糖化发酵剂,经润料、蒸粮、配醅、堆积、入池发酵和蒸酒等工序酿制而成的创新型白酒,具有酱香、窖香和芝麻香的香气特征,以及口感醇厚、绵甜和细腻特征[1]。馥香型白酒的感官品质与其独特的发酵工艺有关,其工艺融合了酱香、浓香和芝麻香白酒的生产工艺。例如,在酿造过程中,堆积作为酱香型白酒的典型工艺特征,引入馥香型白酒酿造,为酒体带来较丰富复杂的风味构成,使酒体呈现幽雅、细腻等感官品质。在堆积过程中,除了用高温大曲,馥香型白酒堆积还保留了芝麻香型白酒的大麸结合的用曲工艺,即采用麸曲、细菌曲以及酵母曲等,使得酒体具有芝麻香的感官风格特征。此外,馥香型白酒窖池采用泥窖发酵,为酒体带来窖香绵甜等感官风格。
馥香型白酒发酵过程包括堆积和窖池发酵2个阶段,不同香型白酒在堆积和入池发酵过程微生物群落结构均不同。张春林等[2]研究了酱香型白酒堆积过程微生物的多样性,发现优势细菌以芽孢杆菌属(Bacillus)、海洋芽孢杆菌属(Oceanobacillus)等为主,真菌以曲霉属(Aspergillus)、假丝酵母属(Candida)为主,并研究了微生物与风味物质间的关系。进一步对比王云胜等[3]对酱香白酒第7轮次堆积发酵过程微生物的研究发现,不同轮次微生物的群落结构也存在差异。贾一清等[4]研究了芝麻香型发酵过程中微生物的群落演替规律,与酱香型白酒存在明显差异,在芝麻香型堆积过程优势细菌的相对丰度由堆积开始的乳杆菌属(Lactobacillus,75.7%)、芽孢杆菌属(14.9%)变化为堆积后的90.6%与3.8%。窖泥微生物中细菌生物量约为真菌生物量的10 000倍,即以细菌为主,其优势细菌主要是梭菌属(Clostridium)、己酸菌属(Caproiciproducens)[5]。
白酒的发酵具有多菌种参与的特征,群落结构复杂。在分析复杂群落结构中,核心微生物组通常被定义为来自相似生境的微生物群落之间共享的一组成员,其概念随着生态学的发展逐渐由分类学向群落功能扩展[6-7]。核心微生物组是调控微生物群落和工艺优化的重要策略基础,其在酒类上也已有应用。朱莹[8]对黄酒酒药中的核心微生物组进行了分析,确定了以小孢根霉(Rhizopus microsporus)等为主的核心微生物组组成。叶书建等[9]也对黄酒的核心微生物组开展研究,并基于此和结合生产需求,通过核心微生物群落组装创建了抑制生物胺形成的循环浸米工艺。核心微生物组在白酒中也有应用实践,如刘兰兰[10]对酱香型白酒糟醅中核心微生物组进行解析,明晰了第5轮次窖池发酵核心细菌与风味物质的关系。姚伟科等[11]对浓香型白酒不同季节大曲核心微生物组进行分析,并鉴定出了与糖化能力有关的核心微生物。王鹏等[12-13]采用高通量测序从风味贡献和主导发酵等功能角度揭示了窖池发酵过程中的核心微生物组。因此,核心微生物组对于理解复杂群落组成及功能,以及群落组装及优化工艺具有重要意义。然而,馥香型白酒作为酱香、浓香和芝麻香的创新香型,其独特的微生物群落结构和核心微生物组尚缺乏系统深入研究。
本研究采用高通量测序和顶空固相微萃取(headspace solid phase microextraction,HS-SPME)气相色谱-嗅闻-质谱联用(gas chromatography-olfactory-mass spectrometry,GC-O-MS)等技术,对馥香型白酒发酵过程微生物群落结构及演替规律进行分析,并进一步采用统计学分析方法明晰微生物与风味物质间的相关性以及核心微生物组,这对理解馥香型白酒复杂群落结构,保障白酒稳定生产具有重要意义。
馥香型白酒的酒醅和窖泥均取自山东某酒厂,其酿造工艺流程图如图1所示。堆积过程中堆子呈四棱台状,采用五点取样法,选取四棱台上表面的4个角以及中心位置,从距离上表面约30 cm深处分别取样,混合均匀,取约500 g装入样品袋,冷藏备用,取样时间为堆积前和堆积后。出窖酒醅为窖池发酵结束时上层、中层和下层酒醅的混合物,其中上层、中层和下层酒醅均采用五点取样法,从窖池的4个角和中心位置取样,所有样品混合均匀后,留取约500 g备用。窖泥为分别从窖池四壁的中心位置和窖底的中心位置分别取样,混合均匀后备用。叔戊醇等化合物(均为色谱纯),美国Sigma-Aldrich公司。

图1 馥香型白酒工艺流程图
Fig.1 Process flow chart of Fu-flavor Baijiu
BSA224S电子分析天平,德国Sartorius公司;Gen Pure UV/UF超纯水系统,美国Thermo Fisher Scientific公司;8860 GC System-5977B GC/MSD GC-O-MS,美国安捷伦科技有限公司;萃取头:50/30 μm DVB/CAR/PDMS Stableflex,美国 Supelco 公司。
1.3.1 风味物质检测方法
称取1.0 g酒醅,加入2.8 g氯化钠,加入9.0 mL去离子水,加入5 μL质量浓度为4.80 mg/mL的叔戊醇作为内标,密封和振荡混匀。采用顶空固相微萃取前处理,在70 ℃条件下振摇15 min,萃取45 min,进行GC-MS检测。
GC-MS条件:色谱柱为Elite WAX ETR(30 m×0.25 mm×0.5 μm);升温程序:35 ℃保留2 min,以3 ℃/min升温至120 ℃,保留2 min,以5 ℃/min升温至200 ℃,以10 ℃/min升温至230 ℃,保留5 min,载气为高纯氦气(He)(纯度99.999%);载气流量1.0 mL/min;不分流进样;溶剂延迟时间1 min。电子电离(electron ionization,EI)源;离子源温度230 ℃;传输线温度230 ℃。得到的风味化合物通过NIST数据库检索对比,相似度大于80%的鉴定结果确定该风味化合物的种类,挥发性风味物质质量浓度以挥发性风味物质峰面积与内标峰面积的比值乘以内标质量浓度计。
1.3.2 基因组提取及高通量测序
酒醅微生物基因组的提取依照说明书,采用试剂盒(E.Z.N.A.Soil DNA Kit)的方法进行提取[14]。天津诺和致源生物信息科技有限公司采用高通量测序(Illumina Miseq PE250)平台对样品进行测序,细菌使用SILVA138数据库进行物种注释,真菌使用Unit(v8.2)数据库进行物种注释,以上均使用NovaSeq 6000进行上机测序,测序策略PE250。
采用SPSS 24.0软件进行相关性分析,Originpro 9.1软件做柱形图,MeV_4_9_0软件做热图和聚类分析,Gephi 0.9.1软件做网络图。
馥香型白酒的发酵过程包括堆积和窖池发酵2个 阶段,以该过程为研究对象,研究其微生物演替规律。
2.1.1 微生物多样性分析
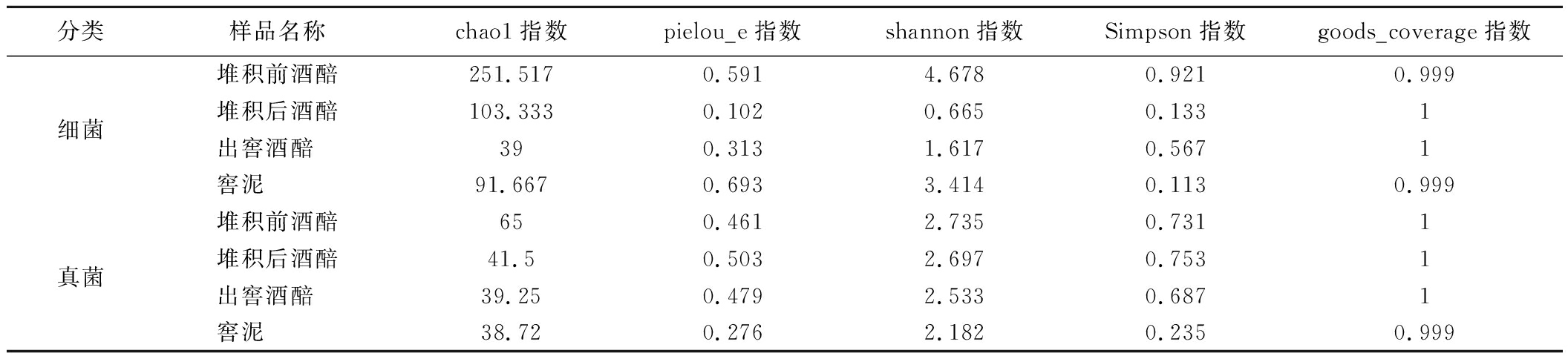
对堆积和入池发酵过程中的微生物多样性进行分析,结果如表1所示。
表1 馥香型白酒堆积、窖池发酵过程多样性指数
Table 1 Diversity index of accumulation and pit fermentation process of Fu-flavor Baijiu
分类样品名称chao1指数pielou_e指数shannon指数Simpson指数goods_coverage指数细菌堆积前酒醅251.5170.5914.6780.9210.999堆积后酒醅103.3330.1020.6650.1331出窖酒醅 390.3131.6170.5671窖泥 91.6670.6933.4140.1130.999真菌堆积前酒醅650.4612.7350.7311堆积后酒醅41.50.5032.6970.7531出窖酒醅 39.250.4792.5330.6871窖泥 38.720.2762.1820.2350.999
如表1所示,α指数多样性分析显示,所有样本的goods_coverage指数均在99.9%以上,测序结果较好代表样本中细菌、真菌的真实情况。chao1指数显示随着堆积和入池发酵过程的进行,在细菌、真菌数量上呈现逐渐降低的趋势,窖泥中细菌数量相对出窖酒醅较高,而真菌与出窖酒醅相差不明显。pielou_e指数显示堆积前酒醅和窖泥细菌均匀度较高,发酵过程中细菌呈现均匀度先降低后升高的变化,结合shannon指数和simpson指数,细菌经堆积发酵在堆积后多样性降低,在入池发酵过程多样性有所上升。pielou_e指数、shannon指数和simpson指数显示,堆积和入池发酵过程中真菌的均匀度和多样性均相差不大,但窖泥的真菌均匀度和多样性均小于发酵过程中的酒醅。
2.1.2 微生物演替规律分析
对堆积、入池发酵和窖泥微生物群落结构进行分析,结果如图2所示。如图2-A所示,采用高通量测序(16S rDNA)技术对馥香型白酒堆积、入池发酵酒醅和窖泥中的细菌在属水平上的物种组成进行分析。堆积前酒醅中芽孢杆菌属的相对丰度最高(61.33%),是堆积前酒醅中的主导菌群,其次是葡萄球菌属(Staphylococcus)和魏斯氏菌属(Weissella),两者的相对丰度分别为12.42%和10.26%,也是堆积前酒醅中细菌优势菌群。堆积后酒醅和出窖酒醅中均以乳杆菌属为主导菌群,该属在堆积后酒醅中的相对丰度为93.84%,在出窖酒醅中已知种属的微生物中占比84.90%,由此,通过比较堆积前、堆积后酒醅和出窖酒醅可以看出,馥香型白酒在堆积前期以孢杆菌属为主的优势菌群快速演替为堆积后期和入池发酵过程以乳杆菌属为主的优势菌群。在窖泥中,乳杆菌属相对丰度占比10.38%,也是窖泥中细菌优势菌群之一,此外,在窖泥中,相对丰度最高的是己酸菌属,为16.09%。窖泥中优势菌群还有Blvii28_wastewater-sludge_group、无胆甾原体属(Acholeplasma)、甲烷短杆菌属(Methanobrevibacter)、拟杆菌属(Bacteroides),它们的相对丰度分别为9.68%、8.34%、8.11%和6.67%,相对丰度较为接近,这与窖泥中细菌pielou_e指数的分析结果一致。
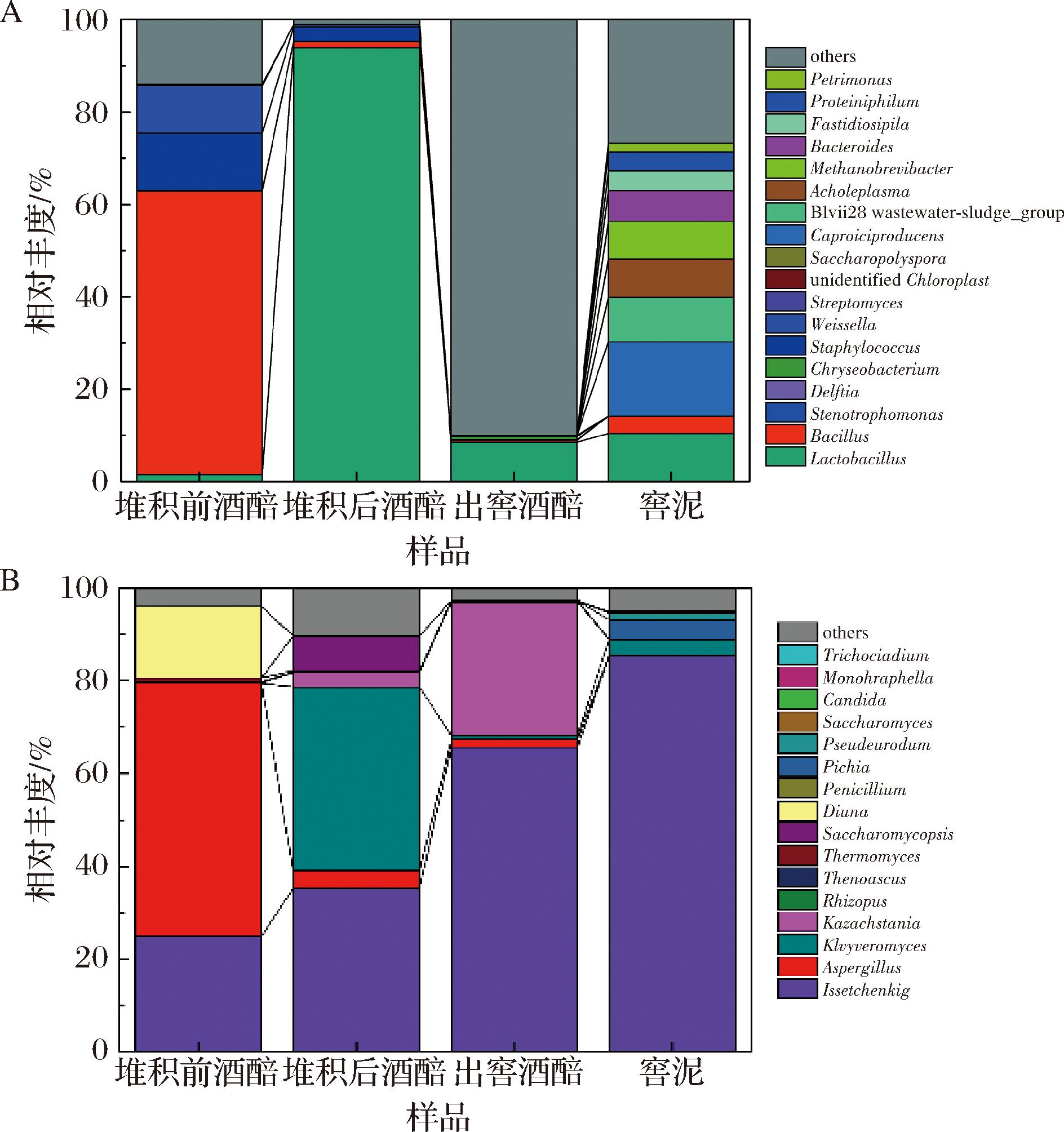
A-细菌;B-真菌
图2 馥香型白酒发酵过程微生物群落结构
Fig.2 Microbial community structure during the fermentation of Fu-flavor Baijiu
采用高通量测序(internal transcribed spacer sequencing,ITS)技术对馥香型白酒堆积、入池发酵酒醅和窖泥中的真菌在属水平上的物种组成进行分析,结果如图2-B所示。在堆积、入池发酵过程和窖泥样品中,相对丰度较高的真菌有6种,其中,伊萨酵母属(Issatchenkia)在所有样品中均是优势菌群之一,且在堆积、入池发酵和窖泥中呈现相对丰度逐渐增加的趋势,发生演替变化较大的是曲霉属、克鲁维酵母属(Kluyveromyces)和Kazachstania。
在堆积前酒醅中,相对丰度最高的是曲霉属,相对丰度为54.61%,其次是伊萨酵母属和Diutina,相对丰度分别为24.88%和15.36%。堆积后酒醅中,优势菌群除了伊萨酵母属,还有克鲁维酵母属和覆膜孢酵母属(Saccharomycopsis),三者的相对丰度分别为35.26%、39.62%和7.52%。出窖酒醅中优势真菌主要是伊萨酵母属和Kazachstania,相对丰度分别为65.65%和28.81%。窖泥中伊萨酵母属的相对丰度为85.38%,是窖泥真菌中的主导真菌。
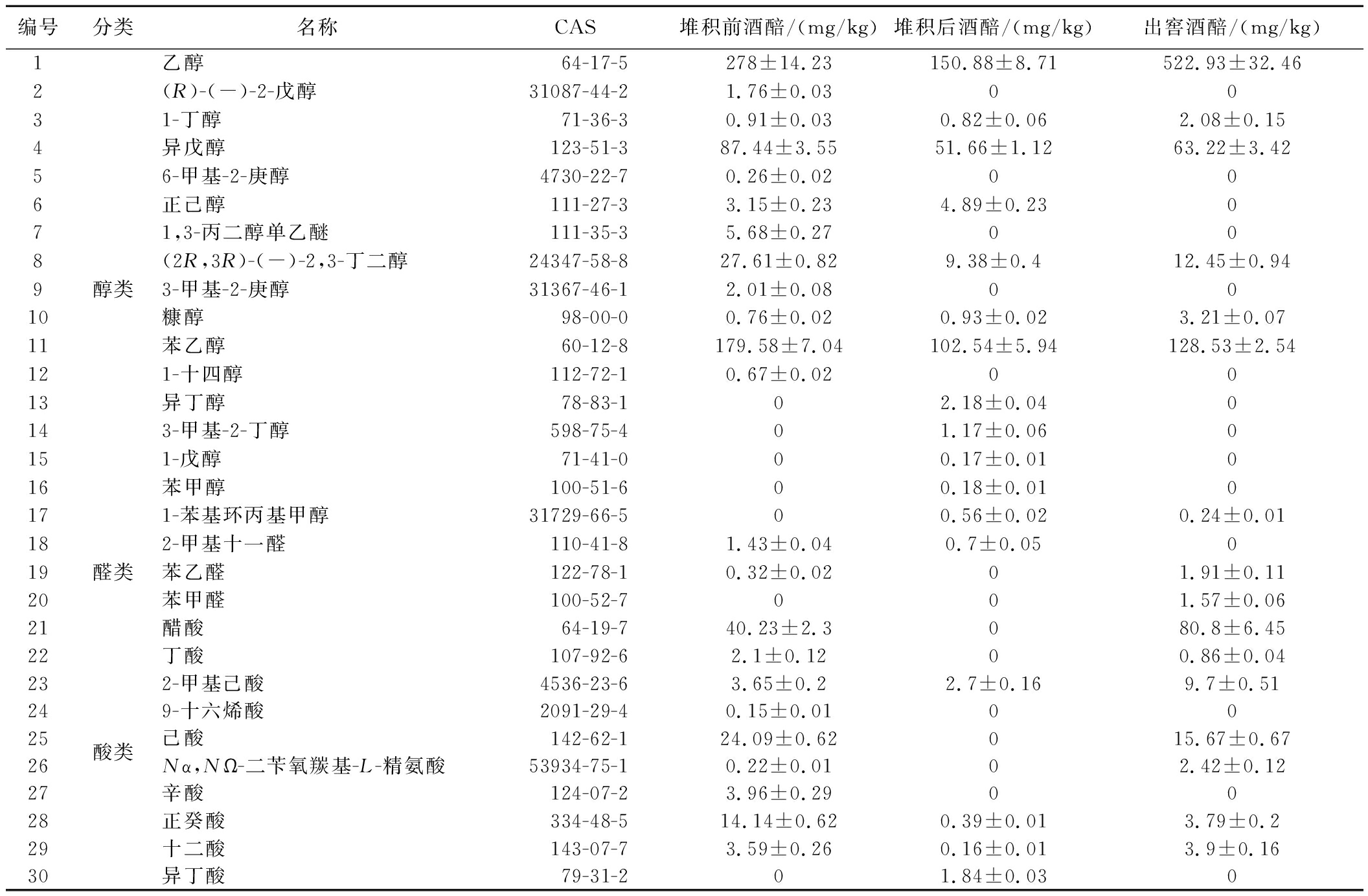
采用GC-O-MS对堆积和入池发酵过程风味物质进行分析,结果如表2所示。
表2 馥香型白酒堆积和入池发酵过程风味物质组成及含量
Table 2 Composition and content of flavor substances during accumulation and pit fermentation of Fu-flavor Baijiu
编号分类名称CAS堆积前酒醅/(mg/kg)堆积后酒醅/(mg/kg)出窖酒醅/(mg/kg)1234567891011121314151617醇类乙醇64-17-5278±14.23150.88±8.71522.93±32.46(R)-(-)-2-戊醇31087-44-21.76±0.03001-丁醇71-36-30.91±0.030.82±0.062.08±0.15异戊醇123-51-387.44±3.5551.66±1.1263.22±3.426-甲基-2-庚醇4730-22-70.26±0.0200正己醇111-27-33.15±0.234.89±0.2301,3-丙二醇单乙醚111-35-35.68±0.2700(2R,3R)-(-)-2,3-丁二醇24347-58-827.61±0.829.38±0.412.45±0.943-甲基-2-庚醇31367-46-12.01±0.0800糠醇98-00-00.76±0.020.93±0.023.21±0.07苯乙醇60-12-8179.58±7.04102.54±5.94128.53±2.541-十四醇112-72-10.67±0.0200异丁醇78-83-102.18±0.0403-甲基-2-丁醇598-75-401.17±0.0601-戊醇71-41-000.17±0.010苯甲醇100-51-600.18±0.0101-苯基环丙基甲醇31729-66-500.56±0.020.24±0.01182-甲基十一醛110-41-81.43±0.040.7±0.05019醛类苯乙醛122-78-10.32±0.0201.91±0.1120苯甲醛100-52-7001.57±0.0621222324252627282930酸类醋酸64-19-740.23±2.3080.8±6.45丁酸107-92-62.1±0.1200.86±0.042-甲基己酸4536-23-63.65±0.22.7±0.169.7±0.519-十六烯酸2091-29-40.15±0.0100己酸142-62-124.09±0.62015.67±0.67Nα,NΩ-二苄氧羰基-L-精氨酸53934-75-10.22±0.0102.42±0.12辛酸124-07-23.96±0.2900正癸酸334-48-514.14±0.620.39±0.013.79±0.2十二酸143-07-73.59±0.260.16±0.013.9±0.16异丁酸79-31-201.84±0.030
续表2

编号分类名称CAS堆积前酒醅/(mg/kg)堆积后酒醅/(mg/kg)出窖酒醅/(mg/kg)313233343536373839404142434445464748495051525354555657585960616263酯类乙酸乙酯141-78-685.41±6.64058.74±4.59乙酸戊酯628-63-78.66±0.552.62±0.051.91±0.04戊酸乙酯539-82-20.9±0.0700.74±0.05己酸乙酯123-66-026.94±1.912.89±0.1158.17±8.36乳酸乙酯687-47-82.68±0.23.14±0.22287.47±22.73辛酸乙酯106-32-117.57±0.933.06±0.217.15±0.188-甲基壬酸乙酯1000452-00-85.04±0.1200丁二酸二乙酯123-25-12.09±0.1107.94±0.3610-甲基-E-11-三萜-1-醇丙酸酯1000130-97-40.12±0.0100癸酸乙酯110-38-33.86±0.2904.68±0.27辛酸戊酯638-25-50.83±0.0100苯乙酸乙酯101-97-31.25±0.10.36±0.023.75±0.19乙酸苯乙酯103-45-73.91±0.062.95±0.213.88±0.53乙二醇二甲基丙烯酸酯97-90-50.79±0.0100月桂酸乙酯106-33-20.62±0.051.41±0.043.12±0.2十四酸乙酯124-06-13.48±0.050.81±0.036.92±0.542-羟基-3-苯丙酸乙酯15399-05-00.1±00.07±08.55±0.47十六酸乙酯628-97-715.53±1.189.26±0.450.71±3.21辛酸-2-苯乙酯5457-70-50.15±000油酸乙酯111-62-62.41±0.121.43±0.096.89±0.49亚油酸乙酯544-35-43.98±0.132.66±0.1813.28±0.48十二酸-2-苯乙酯6309-54-20.36±0.0100对苯二甲酸二丁酯1962-75-01.52±0.020.45±0.021.05±0.07乳酸异戊酯19329-89-600.08±09.34±0.25苯甲酸乙酯93-89-000.16±00甲酸异戊酯110-45-2000.88±0.03乙酸己酯142-92-7000.28±0.01庚酸乙酯106-30-9002.51±0.12-羟基丙酸异丁酯585-24-0001.83±0.072-羟基-4-甲基戊酸乙酯10348-47-70041.24±1.68十五酸乙酯41114-00-5001.16±0.04壬二酸二乙酯624-17-9000.24±0.024-羟基-3-甲氧基-苯丙酸乙酯61292-90-8000.65±0.0364656667686970717273酚类愈创木酚329942.93±0.1902.89±0.122-甲氧基-4-甲基苯酚93-51-60.28±0.0203.43±0.07苯酚108-95-20.38±0.020.25±0.010.44±0.024-乙基-2-甲氧基苯酚2785-89-91.46±0.09019.94±1.39对甲基苯酚106-44-50.59±0.040.29±0.0104-乙基苯酚123-07-90.48±0.03004-乙烯基-2-甲氧基苯酚7786-61-0128.28±6.87004-乙烯基苯酚2628-17-312.83±0.930.86±0.040.31±0.022,6-二叔丁基对苯二酚2444-28-20.21±00.12±00.16±0.015-乙烯基-2-甲氧基-苯酚621-58-904.13±0.331.54±0.057475吡嗪类四甲基吡嗪1124-11-42.5±0.0600三甲基吡嗪14667-55-1016.29±1.010767778798081828384其他十一烷1120-21-40.52±0.010.51±0.011.72±0.032-庚酮110-43-00.47±0.030.55±0.022.68±0.15十三烷629-50-56.18±0.41001,1-双(十二烷氧基)-十六烷56554-64-40.44±0.020.33±0.0203,4-二甲氧基苯乙烯6380-23-01.31±0.0310.71±0.320二叔十二烷基二硫化物27458-90-800.87±0.0704-甲氧基苯乙烯637-69-400.78±0.050邻苯二甲醚91-16-704.83±0.280.19±0.01十二烷112-40-3001.95±0.02
如表2所示,在堆积、入池发酵过程中,共检测到风味物质84种,其中,酯类33种,醇类17种,酸类10种,酚类10种,醛类3种,吡嗪类2种,酮类、烷烃类等9种。其中,酯类风味物质中含量较高的有己酸乙酯、乙酸乙酯、辛酸乙酯、乳酸乙酯和十六酸乙酯。除乙醇外,醇类风味物质中含量较高的有苯乙醇、异戊醇和2,3-丁二醇。
酸类风味物质含量较高的是乙酸和己酸,醛类风味物质相对含量均较低。除此之外,还检测到多种酚类和吡嗪类物质,其中酚类物质含量较高的是4-乙烯基-2-甲氧基苯酚、4-乙基-2-甲氧基苯酚,吡嗪类物质检测到了三甲基吡嗪和四甲基吡嗪,酚类和吡嗪类物质除了具有香气属性,还是白酒中具有生物活性的健康因子。进一步地,根据风味物质的含量,采用聚类分析对风味物质在发酵过程中的变化规律进行分析,结果如图3所示。
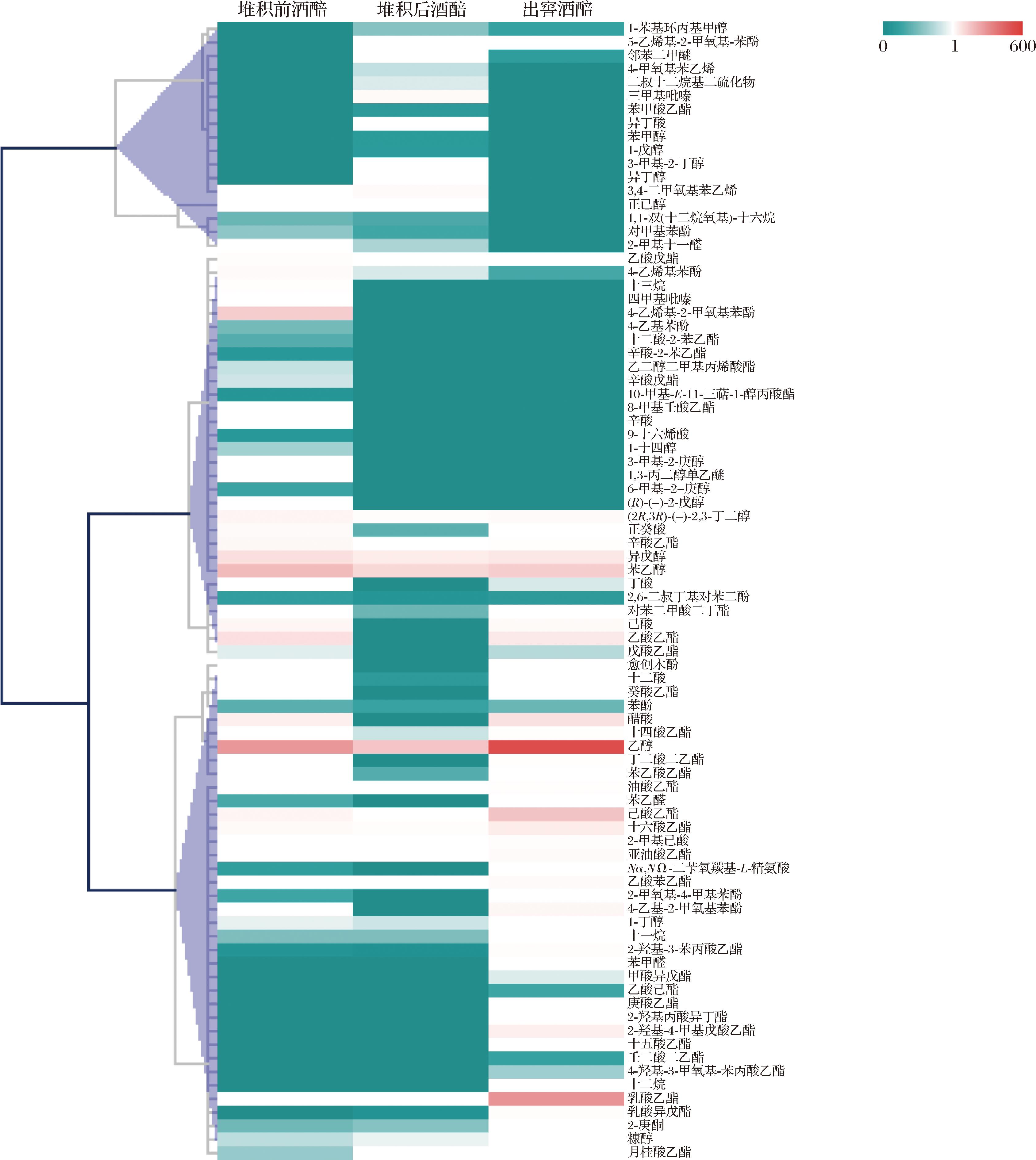
图3 馥香型白酒堆积和窖池发酵过程风味物质聚类分析
Fig.3 Cluster analysis of flavor substances in the process of accumulation and pit fermentation of Fu-flavor Baijiu
如图3所示,聚类分析将堆积和入池发酵过程中84种风味物质归为三类,第一类风味物质包含17种,整体上风味物质呈现先升高,在窖池发酵后降低的变化趋势,这些风味物质可能主要在堆积过程中产生,经堆积发酵,含量较高的风味物质有3,4-二甲氧基苯乙烯、三甲基吡嗪、正己醇、异丁醇、3-甲基-2-丁醇等。第二类风味物质包含30种,含量整体上呈现下降或先下降后上升的变化趋势。风味物质在堆积前具有较高的含量可能与酿造用曲、蒸粮和用于配醅的蒸酒后酒醅残存的香气物质有关,含量较高的有4-乙烯基-2-2甲氧基苯酚、乙酸戊酯、四甲基吡嗪等。也有一些风味物质经入池发酵含量略有上升,但仍小于堆积前,含量较高的有苯乙醇、异戊醇、乙酸乙酯、戊酸乙酯等,其原因可能是这些风味物质主要在堆积前期产生,在入池发酵阶段也能够产生一部分。第三类风味物质共包含37种,也是种类最多的一类,整体上含量呈现上升的变化趋势,这些风味物质主要在入池发酵过程中产生,含量较高的有乙醇、乙酸、己酸乙酯、乳酸乙酯等,也有部分风味物质在堆积过程中也产生一部分,含量较高的有乳酸异戊酯、糠醇、月桂酸乙酯等。
随着核心微生物组的定义由分类学向群落功能拓展,馥香型白酒的核心微生物组将从风味贡献、相对丰度和微生物间相互作用维度进行挖掘。
2.3.1 馥香型白酒发酵过程微生物风味贡献分析
采用相关性分析和调控网络分析发酵过程中微生物与风味物质之间的关系,以揭示微生物的风味贡献,结果如图4所示。
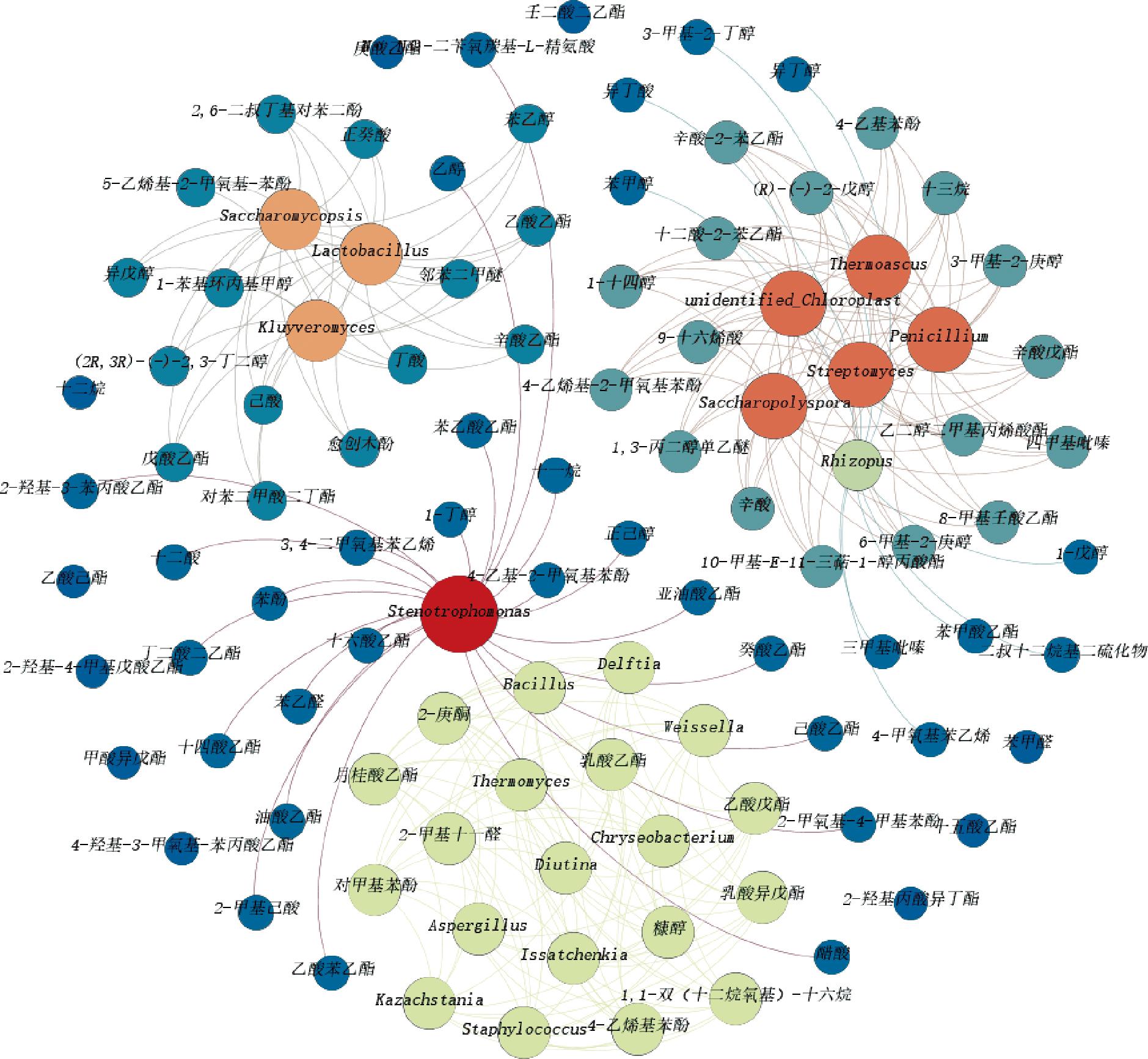
图4 馥香型白酒发酵过程微生物与风味物质调控网络
Fig.4 Control network of microorganisms and flavor substances in the fermentation process of Fu-flavor Baijiu
注:节点表示微生物或风味物质,边表示微生物与风味物质相关性显著(P<0.05),节点由小到大、颜色由蓝黄红渐变均表示节点的度由小到大。
如图4所示,根据微生物与风味物质之间的相关性,可以将微生物大致分为四类,其中,第一类仅包含一种微生物,即寡养单胞菌属(Stenotrophomonas),其与23种风味物质相关性显著,主要是酯类和酚类风味物质,如呈正相关的己酸乙酯、苯乙酸乙酯、乙酸苯乙酯、癸酸乙酯、4-乙基-2-甲氧基苯酚和少数呈负相关的正己醇等,可能是风味贡献最大的微生物种类。第二类包含5种微生物,主要是真菌,分别是糖多孢菌属(Saccharopolyspora)、链霉菌属(Streptomyces)、青霉菌属(Penicillium)、嗜热真菌属(Thermomyces)和unidentified_Chloroplast,它们与17种风味物质相关性显著,主要是酯类和醇类风味物质,如辛酸乙酯、十二酸-2-苯乙酯、十四醇等。第三类包含3种微生物,分别是覆膜孢酵母属、乳杆菌属和克鲁维酵母属,它们与15种风味物质均呈现显著正相关,主要是酯类、酸类和醇类风味物质,如乙酸乙酯、戊酸乙酯、辛酸乙酯、己酸、丁酸、异戊醇等。第四类包含10种微生物,它们与10种风味物质相关性显著,主要是酯类和酚类风味物质,如呈现负相关的、月癸酸乙酯、乳酸乙酯等,呈正相关的乙酸戊酯、对甲基苯酚等。因此,根据与微生物相关性显著的风味物质数目,从风味物质种类上,贡献大小为第一类>第二类>第三类>第四类。
进一步地,结合微生物的相对丰度,在上述四类中贡献风味物质且相对丰度大于5%的微生物有10种,分别是芽孢杆菌属、乳杆菌属、魏斯氏菌属、葡萄球菌属、Diutina、曲霉属、伊萨酵母属、Kazachstania、覆膜孢酵母属、克鲁维酵母属,该10种微生物是发酵过程中对风味物质贡献较大的微生物。
2.3.2 馥香型白酒发酵过程微生物相互作用关系分析
采用相关性分析和调控网络分析发酵过程中微生物之间的相互作用关系,结果如图5所示。
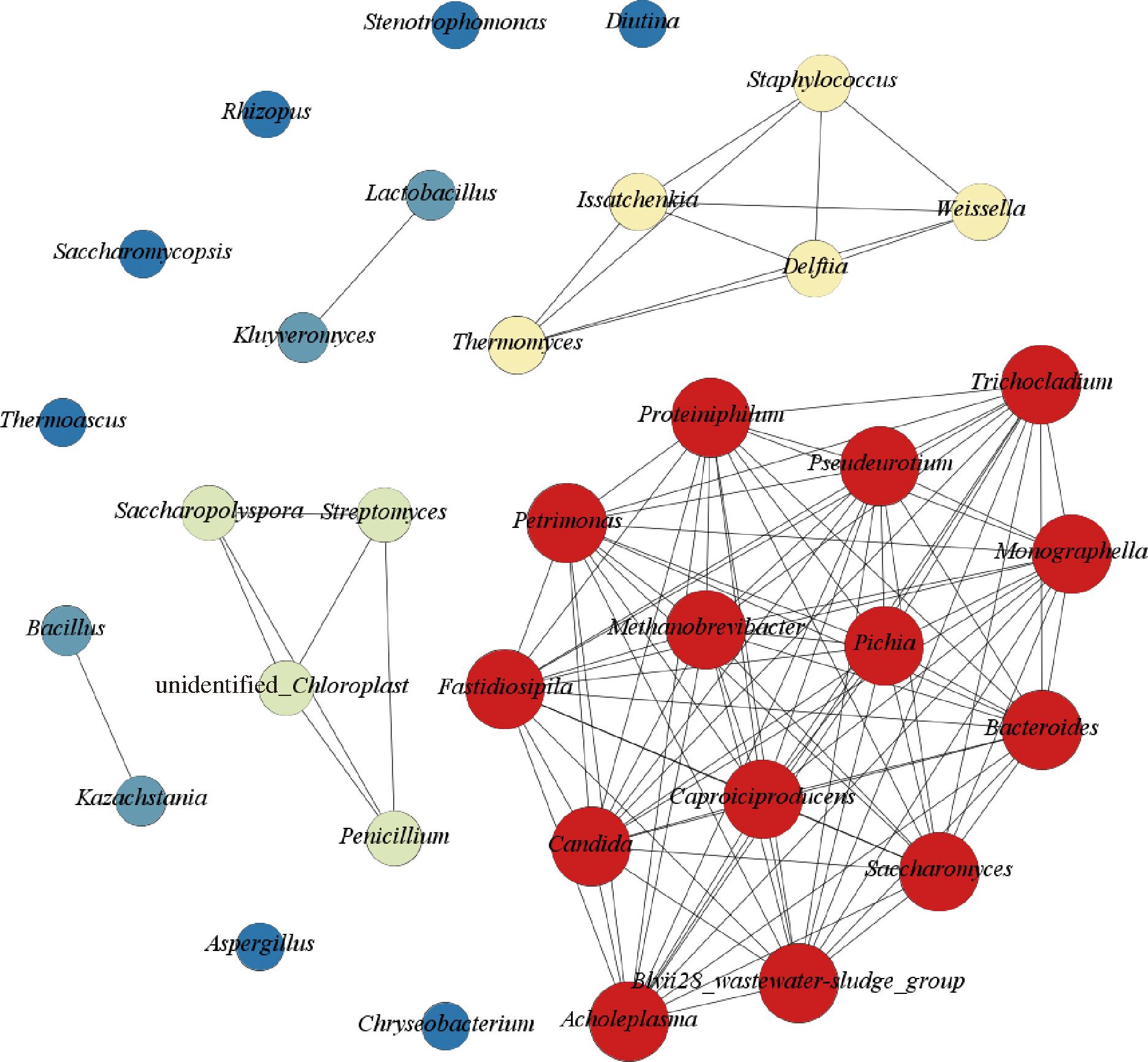
图5 馥香型白酒发酵过程微生物间调控网络分析
Fig.5 Analysis of microbial regulation network in the fermentation process of Fu-flavor Baijiu
注:节点表示微生物,边表示两端微生物相关性显著(P<0.05),节点由小到大、颜色由蓝黄红渐变均表示节点的度由小到大。
由图5可知,调控网络分析共得到34个节点和109个边。网络的平均聚类系数为1,根据调控网络,发酵过程中的微生物分为五类,第一类~第五类分别包含14种、5种、4种、4种和7种微生物,其中前四类内部微生物间相关性显著,可能存在较强的相互作用。第一类(红色)均为窖泥微生物,每个节点有超过12条边的连接,这与窖泥微生物与酒醅微生物种类和数量差异较大,在发酵过程中呈现独特演替规律性有关。在该类微生物中,相对丰度大于1%的微生物有10种,分别是己酸菌属、Blvii28_wastewater-sludge_group、无胆甾原体属、甲烷短杆菌属、拟杆菌属、Fastidiosipila、嗜蛋白菌属(Proteiniphilum)、Petrimonas、毕赤酵母属(Pichia)、假单胞菌属(Pseudeurotium),其中己酸菌属的相对丰度16.09%,是相对丰度最大的优势菌群。第二类中5个微生物节点有3~6条边的连接,微生物包含代尔夫特菌属(Delftia)、葡萄球菌属、魏斯氏菌属、伊萨酵母属、热子囊菌属(Thermoascus),相互之间可能存在相互作用关系,其中,葡萄球菌属、魏斯氏菌属、伊萨酵母属在堆积前的相对丰度在10%以上,伊萨酵母属的相对丰度在整个发酵过程中真菌占比均在24%以上,是重要的优势真菌之一。第三类4个微生物节点有3条边的连接,包括微生物有链霉菌属、unidentified_Chloroplast、糖多孢菌属、青霉菌属,但其相对丰度均在1%以下,这些微生物对发酵过程群落演替的影响较弱。第四类中4个微生物节点有1条边的连接,可能仅存在两者之间相互作用,包括微生物有乳杆菌属、芽孢杆菌属、克鲁维酵母属、Kazachstania,4种微生物均是不同发酵时间的优势菌群,作为优势菌群时相对丰度均在10%以上。第五类包含7种微生物,节点间没有边的连接,可能不存在相互作用关系。综上,根据微生物间的相互作用关系,且相对丰度大于5%的微生物有12种,分别是己酸菌属、Blvii28_wastewater-sludge_group、无胆甾原体属、甲烷短杆菌属、拟杆菌属、葡萄球菌属、魏斯氏菌属、伊萨酵母属、乳杆菌属、芽孢杆菌属、克鲁维酵母属、Kazachstania。
根据风味贡献程度、相互作用关系和相对丰度,得到发酵过程中的核心微生物组共包含15种,其中细菌8种,分别是己酸菌属、Blvii28_wastewater-sludge_group、甲烷短杆菌属、拟杆菌属、葡萄球菌属、魏斯氏菌属、乳杆菌属、芽孢杆菌属。真菌6种,分别是伊萨酵母属、克鲁维酵母属、Kazachstania、Diutina、曲霉属、覆膜孢酵母属。支原体1种,即无胆甾原体属。
采用高通量测序和HS-SPME、GC-O-MS等技术,以及统计学分析方法对馥香型白酒发酵过程中微生物和风味物质进行分析,揭示馥香型白酒发酵过程中微生物群落演替规律及核心微生物组。在堆积和入池发酵过程中,细菌优势菌群由堆积前期以芽孢杆菌属为主快速演替为堆积后期和入池发酵过程以乳杆菌属为主。窖泥中细菌群落结构与酒醅差异较大,以己酸菌属为优势菌群,与酒醅共有细菌较少。伊萨酵母属是发酵过程和窖泥中最主要的优势真菌,主导发酵过程和窖泥中的真菌群落结构,相对丰度较高的真菌还有曲霉属、克鲁维酵母属和Kazachstania,发酵过程中发生演替较快。发酵过程中检测到风味物质84种,主要是酯类(33种)、醇类(17种)、酸类(10种)、酚类(10种)、醛类(3种)、吡嗪类(2种)等。结合风味贡献程度、微生物间相互作用和相对丰度,确定馥香型白酒核心微生物组包含15种,其中细菌8种:己酸菌属、Blvii28_wastewater-sludge_group、甲烷短杆菌属、拟杆菌属、葡萄球菌属、魏斯氏菌属、乳杆菌属、芽孢杆菌属。真菌6种:伊萨酵母属、克鲁维酵母属、Kazachstania、Diutina、曲霉属、覆膜孢酵母属,以及支原体1种,为无胆甾原体属,这些微生物在风味形成和发酵过程驱动中起主要作用。下一步,我们将验证微生物间相互作用,通过优化大曲配比、核心功能菌株强化等微生物组装发酵策略进一步优化发酵工艺,提升白酒品质。
[1] 薛新新,孙守营,张娇娇,等.馥郁香型白酒感官风格及特征风味构成的剖析[J].中国酿造,2022,41(2):76-79.XUE X X, SUN S Y, ZHANG J J, et al.Analysis of sensory style and characteristic flavor composition of Fuyu-flavor Baijiu[J].China Brewing, 2022, 41(2):76-79.
[2] 张春林,杨亮,李喆,等.酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J].食品科技,2022,47(4):111-118.ZHANG C L, YANG L, LI Z, et al.Microbial community and its relationship with volatile compounds in Moutai-flavor Baijiu stacking fermentation process[J].Food Science and Technology, 2022, 47(4):111-118.
[3] 王云胜,辛健康,陈银翠,等.酱香白酒第七轮次堆积发酵过程中细菌群落的动态变化[J].基因组学与应用生物学,2022,41(6):1244-1253.WANG Y S, XIN J K, CHEN Y C, et al.Dynamic change of bacterial community during seventh round stacking fermentation of Maotai-flavor Baijiu[J].Genomics and Applied Biology, 2022,41(6):1244-1253.
[4] 贾一清,孙昭,廖博曦,等.不同堆积醅对芝麻香型白酒发酵过程中主要微生物演替及代谢的影响[J].中国酿造,2023,42(11):34-39.JIA Y Q, SUN Z, LIAO B X, et al.Effects of different stacking fermented grains on main microbial succession and metabolism during sesame-flavor Baijiu fermentation[J].China Brewing, 2023,42(11):34-39.
[5] 晋湘宜,胡咏梅,彭楠,等.浓香型白酒窖泥己酸菌的研究进展[J].华中农业大学学报,2024,43(4):121-132.JIN X Y, HU Y M, PENG N, et al.Progress in studying caproic acid-producing bacteria in pit mud of strong-flavor Baijiu[J].Journal of Huazhong Agricultural University, 2024, 43(4):121-132.
[6] SHADE A, HANDELSMAN J.Beyond the Venn diagram:The hunt for a core microbiome[J].Environmental Microbiology, 2012, 14(1):4-12.
[7] 孙翔,SHARON O, SHARON A.确定核心微生物群系的新方法及群落内部的分层[C].中国菌物学会2023年学术年会论文摘要,2023:1.SUN X, SHARON O, SHARON A.A new method for determining the core microbial community and the stratification within the community[C].Abstract of the 2023 Annual Meeting of Mycological Society of China, 2023:1.
[8] 朱莹.酒药核心微生物解析及可控固态发酵的研究[D].无锡:江南大学,2023.ZHU Y.Study on core microbiota analysis and controlled solid fermentation of jiuyao [D].Wuxi:Jiangnan University, 2023.
[9] 叶书建,刘甜甜,毛健,等.黄酒循环浸米中核心微生物群落组装[J].食品与发酵工业,2025,51(8):77-84.YE S J, LIU T T, MAO J, et al.Assembly of core microbial community in cyclic rice soaking of Huangjiu[J].Food and Fermentation Industries, 2025,51(8):77-84.
[10] 刘兰兰.酱香型白酒糟醅核心微生物菌群的解析及分离筛选研究[D].贵阳:贵州大学,2023.LIU L L.Study on the analysis and isolation of the core microflora in the fermented grains of Jiang-flavor Baijiu[J].Guiyang:Guizhou University, 2023.
[11] 姚伟科,郭辉祥,邹永芳,等.浓香曲春夏培菌过程中核心微生物对糖化能力的影响[J].酿酒,2024,51(4):58-63.YAO W K, GUO H X, ZOU Y F, et al.Influence of core microorganisms on saccharification ability during spring and summer cultivation of nongxiangxing Daqu[J].Liquor Making, 2024, 51(4):58-63.
[12] 王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.WANG P, WU Q, XU Y.Core microbiota in Chinese liquor fermentation and associations with environmental factors[J].Acta Microbiologica Sinica, 2018, 58(1):142-153.
[13] 王鹏.地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D].无锡:江南大学,2017.WANG P.Effects of Bacillus licheniformis inoculation on the microbial community structure and metabolism during strong flavored liquor brewing process[D].Wuxi:Jiangnan University, 2017.
[14] 郭松波,谢三款,张娇娇,等.茅台地区酱香大回酒轮次发酵机理分析[J].中国酿造,2022,41(7):38-44.GUO S B, XIE S K, ZHANG J J, et al.Analysis on the fermentation mechanism of sauce-flavor Dahui-jiu in Maotai region[J].China Brewing, 2022,41(7):38-44.