表1 实验动物分组及剂量
Table 1 Experimental animal grouping and dose

组别受试物灌胃剂量乙醇造模剂量低剂量组(5倍)0.3 g/kg体重12 mL/kg体重中剂量组(10倍)0.6 g/kg体重12 mL/kg体重高剂量组(20倍)1.2 g/kg体重12 mL/kg体重模型组等体积玉米油12 mL/kg体重空白对照组等体积玉米油等体积蒸馏水
WEI Qijie,WANG Liang,WANG Xiaoya, et al.Study on auxiliary protective effect of seabuckthorn oil on alcoholic liver injury in rats[J].Food and Fermentation Industries,2025,51(14):89-96.
肝损伤的疾病分类主要包括酒精性肝病、非酒精性脂肪性肝病、药物性肝损伤、病毒性肝炎等。在中国,肝脏疾病负担尤为沉重,据估计有1/5的人口受到肝脏疾病的影响[1]。随着民众的生活方式改变,我国酒精性肝病的发病率呈逐年上升的态势,如今已成为重要的公共卫生问题[2],研究天然食物对肝损伤的辅助保护作用具有重要的应用意义[3]。
沙棘(Hippophae rhamnoides L.)是胡颓子科沙棘属植物,我国是沙棘资源最丰富,同时也是最早利用沙棘的国家[4]。沙棘油提取自沙棘籽、果肉或全果,含有丰富的生物活力物质,包括多种不饱和脂肪酸、类胡萝卜素及其衍生物、甾醇以及天然维生素E等。沙棘籽油和沙棘果油的生物活性物质组成各有其特性,沙棘籽油富含多不饱和脂肪酸(亚油酸和亚麻酸),沙棘果油不饱和脂肪酸含量较高,但多不饱和脂肪酸含量较沙棘籽油低;类胡萝卜素主要存在于沙棘果油中,而沙棘籽油的生育酚含量和甾醇种类则多于果油[5]。故沙棘籽油和沙棘果油各有其营养优势。
已有研究提示沙棘籽油和沙棘果油均能分别通过其抗氧化作用、抗炎作用等发挥对肝脏的保护作用。沙棘籽油对CCl4和酒精造成的大鼠肝损伤具有明显保护作用,有效剂量分别为0.500、0.333 g/kg体重[6-7]。此外,沙棘籽油能增强肝损伤小鼠的免疫功能[8],并且对CCl4所致大鼠肝纤维化有一定保护作用[9]。一项研究将沙棘籽油和沙棘果油分别单独作用于小鼠,结果显示两者均有抵抗CCl4致肝损伤的作用,存在剂量效应,且沙棘籽油的作用略优[10]。沙棘籽油和沙棘果油的组成成分不同,且均对肝脏具有保护作用,沙棘籽油和沙棘果油的脂质成分及抗氧化功能成分组成等有较大差异,结合两者营养优势成分有望更好地发挥肝脏保护作用。本实验中沙棘油由40%沙棘籽油和60%沙棘果油组成,其n-6和n-3多不饱和脂肪酸的比例约为2∶1。研究表明n-6和n-3多不饱和脂肪酸的摄入比例接近1∶1至2∶1,可降低肥胖和代谢综合征风险[11],不同文献建议的比例略有差异,但普遍认为降低n-6/n-3比例对健康有益。因此该沙棘油可能更好地通过抗氧化和抗炎效应发挥对肝脏的保护作用。
本研究基于《保健食品功能检验与评价方法(2023年版)》“对化学性肝损伤有辅助保护作用 方案二:酒精肝损伤模型”的功能学检验方法,以50%无水乙醇诱导建立急性肝损伤大鼠模型,分析比较不同剂量沙棘油对大鼠肝脏代谢酶、脂质累积和血清脂质水平的影响,以期明确沙棘油(沙棘果油60%,沙棘籽油40%)对大鼠急性酒精性肝损伤的辅助保护作用。
1.1.1 实验动物
SPF级雄性SD大鼠100只,体重(200±20) g,广东维通利华实验动物技术有限公司提供,实验动物生产许可证号 SCXK(粤)2022—0063。大鼠饲养于四川大学华西公共卫生学院动物实验中心,实验动物使用许可证号 SYXK(川)2023—0011。本研究经四川大学华西第四医院/华西公共卫生学院伦理委员会审查批准(批件号Gwll2024169)。
1.1.2 受试物
沙棘油样品由阿勒泰太阳石健康产业发展有限公司提供,其中含有沙棘果油60%(质量分数),沙棘籽油40%,生产日期为2024年3月28日。样品的人体推荐摄入量为3.6 g/d。
1.1.3 试剂
病理试剂,湖北百奥斯生物科技有限公司。
SpectraMAX Plus384酶标仪,美谷分子仪器有限公司;UV752 N型分光光度计,上海佑科仪器仪表有限公司;KZ-III-F高速低温组织研磨仪,武汉赛维尔生物科技有限公司;HM525 NX U冰冻切片机,赛默飞世尔科技有限公司;BS-240VET兽用生化分析仪,深圳迈瑞生物医疗电子股份有限公司;生化检测试剂盒,南京建成生物工程研究所。
1.3.1 实验分组及剂量
大鼠在屏障系统内适应性喂养7 d后,随机分为5组,每组20只,包括低、中、高3个剂量组、1个空白对照组和1个模型组。以体重60 kg计,则该样品的人体每日推荐剂量为0.06 g/kg体重,以此可计算出大鼠低、中、高剂量分别为0.3、0.6、1.2 g/kg体重(人体推荐剂量的5、10、20倍)。实验动物分组及相应剂量见表1。
表1 实验动物分组及剂量
Table 1 Experimental animal grouping and dose

组别受试物灌胃剂量乙醇造模剂量低剂量组(5倍)0.3 g/kg体重12 mL/kg体重中剂量组(10倍)0.6 g/kg体重12 mL/kg体重高剂量组(20倍)1.2 g/kg体重12 mL/kg体重模型组等体积玉米油12 mL/kg体重空白对照组等体积玉米油等体积蒸馏水
1.3.2 受试物给予方式
沙棘油样品以食用玉米油稀释至所需浓度,灌胃给予大鼠,空白对照组和模型组给予等体积玉米油,大鼠灌胃量为0.5 mL/100 g,每日1次,每5 d称重调整灌胃量。给予样品结束时,模型组和各剂量组一次性灌胃给予50%无水乙醇12 mL/kg体重,空白对照组给等体积蒸馏水,造模结束立即禁食16 h处死大鼠并检测。
1.3.3 大鼠一般情况观察及指标测定
连续灌胃30 d,每组8只大鼠进行如1.3.3.1节~1.3.3.3节检测;剩余大鼠灌胃50 d后进行如1.3.3.1节、1.3.3.2节、1.3.3.4节检测。
1.3.3.1 一般情况观察、体重及肝脏指数的测定
试验期间,各组大鼠自由进食和饮水,每天观察大鼠的活动状态、食欲、毛发光泽、眼睛和鼻子清洁程度等一般情况。每5 d称量1次体重并记录。
给予受试样品结束并进行造模处理后,戊巴比妥钠麻醉大鼠后进行腹主动脉取血,无抗凝剂采血管收集全部血液。取完整大鼠肝脏,电子天平称量,肝脏指数按公式(1)计算:
肝脏指数![]()
(1)
式中:末重为大鼠禁食16 h后的体重(g),下同。
1.3.3.2 功能评价指标
肝脏生化指标测定:取一定量的肝脏,生理盐水冲洗、擦干、称量、粉碎,置匀浆器中制成50 g/L组织匀浆,离心后取上清液检测丙二醛(malondialdehyde, MDA)、还原型谷胱甘肽(glutathione, GSH)和甘油三酯(triglyceride, TG)的含量。
肝脏病理组织学检查:将剩余肝脏用组织固定液固定24 h以上,石蜡包埋、切片、油红O染色,40倍物镜从一端视野开始连续观察整个切片。主要观察肝细胞脂肪变性的程度即脂滴在肝脏的分布、范围和面积,并进行组织病理学评分。组织病理评分标准见表2。
表2 组织病理评分标准
Table 2 Histopathological scoring criteria

脂肪变性程度评分/分肝细胞内脂滴散在,稀少0含脂滴的肝细胞不超过25%1含脂滴的肝细胞不超过50%2含脂滴的肝细胞不超过75%3肝组织几乎被脂滴代替4
1.3.3.3 血清生化指标
大鼠腹主动脉取血,室温放置后3 500 r/min离心15 min,取上清液用兽用生化分析仪测定血清的丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、总胆固醇(total cholesterol, TC)、TG、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)水平。
1.3.3.4 肝脏酒精代谢酶检测
采用免疫组化法测定灌胃50 d大鼠肝脏中乙醛脱氢酶ALDH2及乙醇脱氢酶ADH1B的表达,将每张切片内的阳性细胞数量及其染色强度转化为组织化学评分(histochemistry score,H-SCORE)即H评分来反映酶活力强度,计算如公式(2)所示:
H评分=(1×染色评分为1的细胞比例+2×染色评分为2的细胞比例+3×染色评分为3的细胞比例)×100
(2)
结果用“平均值±标准差”表示,采用SPSS 26.0进行分析。
对于功能评价指标,先对模型组和空白对照组进行t检验判定模型是否成立。在模型成立的前提下,采用单因素方差分析和Dunnett-t检验检验各剂量组与模型组间的差异性。
其余指标采用单因素方差分析和Dunnett-t检验比较各剂量组与空白对照组及模型组的差异性。以α=0.05作为显著性检验水平,P<0.05表示具有显著性差异。对方差不齐的数据用Kruskal-Wallis秩和检验进行统计。
实验期内有8只大鼠意外死亡,实际用于检测的大鼠为92只。灌胃30 d后,每组取8只大鼠共40只进行检测;剩余52只大鼠灌胃至50 d后进行检测,其中模型组、低剂量组和中剂量组各11只,高剂量组10只,空白对照组9只。
大鼠在实验期间表现和行为正常,未发生不良反应、中毒,生长发育良好。如图1所示,给予受试物30 d后,各组大鼠体重及增重、肝脏质量、肝脏指数均无显著性差异(P>0.05),肝脏质量(11.97~12.75 g)和肝体比值(2.91~3.10)在正常范围内,与文献基本一致[12]。
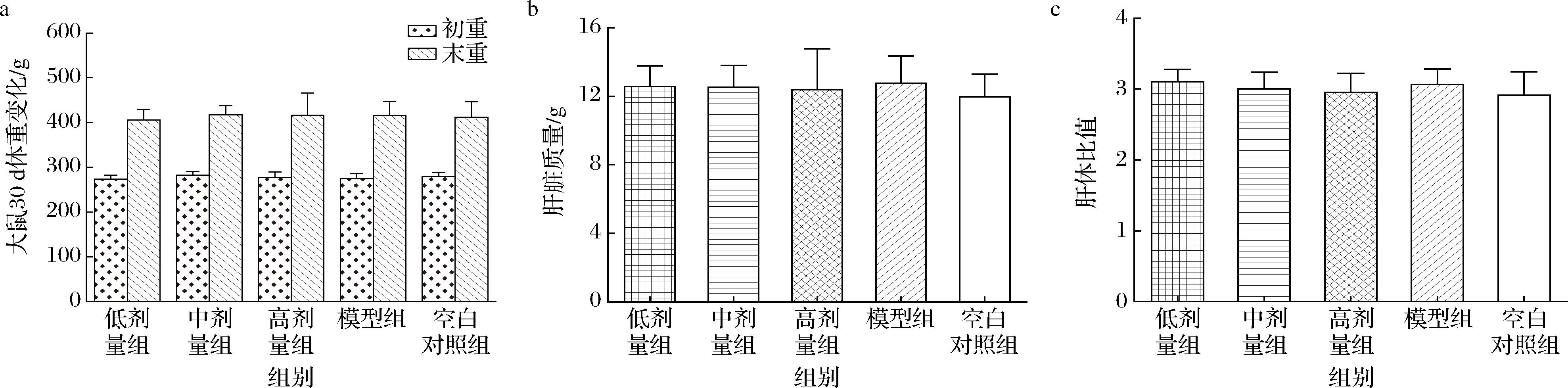
a-大鼠30 d体重变化;b-肝脏质量;c-肝体比值
图1 给予受试物30 d对各组大鼠体重及肝脏指数的影响
Fig.1 Effects of 30-day test substance administration on body weight and liver index in rats of each group
如图2所示,灌胃50 d后,各组大鼠体重及增重均无显著性差异(P>0.05)。与空白对照组相比,模型组的肝脏质量及肝脏指数显著上升(P<0.05)。高剂量组的肝脏质量(P<0.05)和各剂量组的肝脏指数(P<0.01)较空白对照组明显升高,与模型组无显著差异。结果表明长时间摄入油脂并大剂量摄入乙醇,肝脏可能发生脂肪蓄积,这种变化可能随着时间延长而逐渐显现。

a-大鼠50 d体重变化;b-肝脏质量;c-肝体比值
图2 给予受试物50 d对各组大鼠体重及肝脏指数的影响
Fig.2 Effects of 50-day test substance administration on body weight and liver index in rats of each group
注:模型组和空白对照组通过t检验比较:*表示P<0.05,**表示P<0.01;各剂量组和空白对照组通过单因素方差分析比较:a表示P<0.05,b表示P<0.01。
如表3所示,灌胃30 d后一次性给予无水乙醇造模,与空白对照组相比,模型组的MDA、TG水平和病理评分均显著增高(P<0.05),GSH水平显著降低(P<0.01),依据《保健食品功能检验与评价方法(2023年版)》的评价标准,可判定SD大鼠急性酒精肝损伤模型成功建立。
表3 沙棘油灌胃30 d对大鼠肝脏生化指标和脂滴分布的影响![]()
Table 3 Effects of 30-day oral gavage of sea buckthorn oil on hepatic biochemical indexes and lipid droplet distribution in rats ![]()
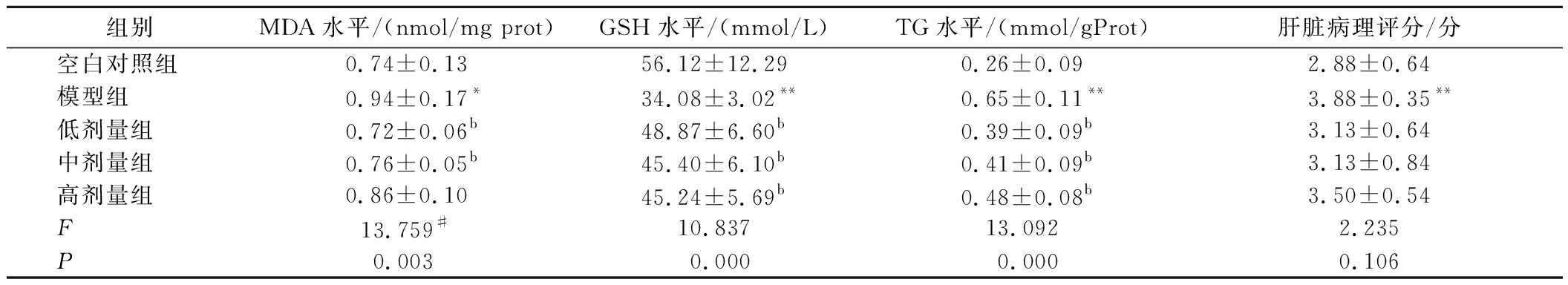
组别MDA水平/(nmol/mg prot)GSH水平/(mmol/L)TG水平/(mmol/gProt)肝脏病理评分/分空白对照组0.74±0.1356.12±12.290.26±0.092.88±0.64模型组0.94±0.17*34.08±3.02**0.65±0.11**3.88±0.35**低剂量组0.72±0.06b48.87±6.60b0.39±0.09b3.13±0.64中剂量组0.76±0.05b45.40±6.10b0.41±0.09b3.13±0.84高剂量组0.86±0.1045.24±5.69b0.48±0.08b3.50±0.54F13.759#10.83713.0922.235P0.0030.0000.0000.106
注:模型组和空白对照组通过t检验比较:*表示P<0.05,**表示P<0.01;各剂量组和模型组通过单因素方差分析比较:a表示P<0.05,b表示P<0.01(下同);#:MDA的F值为Kruskal-Wallis秩和检验卡方值。
给予受试物30 d后,与模型组相比,低剂量组和中剂量组的MDA、GSH和TG水平有显著差异(P<0.01),高剂量组的改善趋势与低剂量组和中剂量组一致,仅在MDA水平上未表现出与模型组的明显差异。大量摄入乙醇后,乙醇在乙醇脱氢酶的催化下大量脱氢氧化,会阻碍三羧酸循环、减弱脂肪酸氧化代谢,导致脂肪蓄积于肝细胞内[13-14]。同时乙醇激活氧分子,产生氧自由基导致肝细胞膜的脂质过氧化及体内GSH的耗竭[13-14]。作为脂质过氧化的终产物之一,MDA是评估脂质过氧化水平和氧化应激程度的重要指标,MDA的生成量与细胞氧化损伤程度密切相关。受试物组大鼠肝脏的MDA、TG较模型组降低,GSH较模型组升高,结果表明沙棘油受试物可改善肝脏脂质过氧化及脂肪沉积状况,同时增强急性酒精性肝损伤大鼠的抗氧化能力,减轻其肝损伤。肝脏病理评分结果显示,所有剂量组评分与模型组相比均降低,但无统计学差异。
综合MDA、GSH和TG的阳性结果,依据《保健食品功能检验与评价方法(2023年版)》的评价标准,可以判定样品对酒精性肝损伤具有辅助保护作用。
给予受试物50 d后同样可以判定对酒精性肝损伤具有辅助保护作用。如表4所示,与空白对照组相比,模型组的MDA、TG水平和病理评分均显著增高(P<0.01),GSH水平显著降低(P<0.01),依据《保健食品功能检验与评价方法(2023年版)》的评价标准,可判定SD大鼠急性酒精肝损伤模型成功建立。低剂量组在MDA、GSH水平(P<0.01)和病理评分(P<0.05)上与模型组相比有显著改善。中剂量组和高剂量组MDA水平明显下降(P<0.05或P<0.01)。综合MDA、GSH和病理组织学检查的阳性结果,依据《保健食品功能检验与评价方法(2023年版)》的评价标准,可判定受试样品对酒精性肝损伤具有辅助保护作用。
表4 沙棘油灌胃50 d对大鼠肝脏生化指标和脂滴分布的影响![]()
Table 4 Effects of 50-day oral gavage of sea buckthorn oil on hepatic biochemical indexes and lipid droplet distribution in rats ![]()
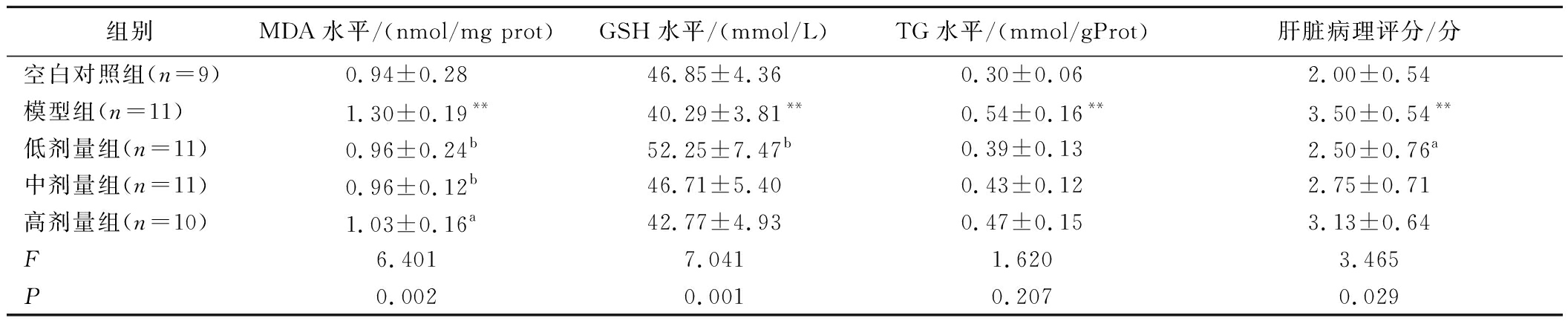
组别MDA水平/(nmol/mg prot)GSH水平/(mmol/L)TG水平/(mmol/gProt)肝脏病理评分/分空白对照组(n=9)0.94±0.2846.85±4.360.30±0.062.00±0.54模型组(n=11)1.30±0.19**40.29±3.81**0.54±0.16**3.50±0.54**低剂量组(n=11)0.96±0.24b52.25±7.47b0.39±0.132.50±0.76a中剂量组(n=11)0.96±0.12b46.71±5.400.43±0.122.75±0.71高剂量组(n=10)1.03±0.16a42.77±4.930.47±0.153.13±0.64F6.4017.0411.6203.465P0.0020.0010.2070.029
以上结果表明,沙棘油可能通过减少氧化应激和改善肝脏脂肪变性来发挥保护作用。两阶段实验都得到阳性结论,说明受试物对大鼠酒精性肝损伤的辅助保护作用较可靠,沙棘油对酒精性肝损伤的保护作用可能与减少自由基产生有关。
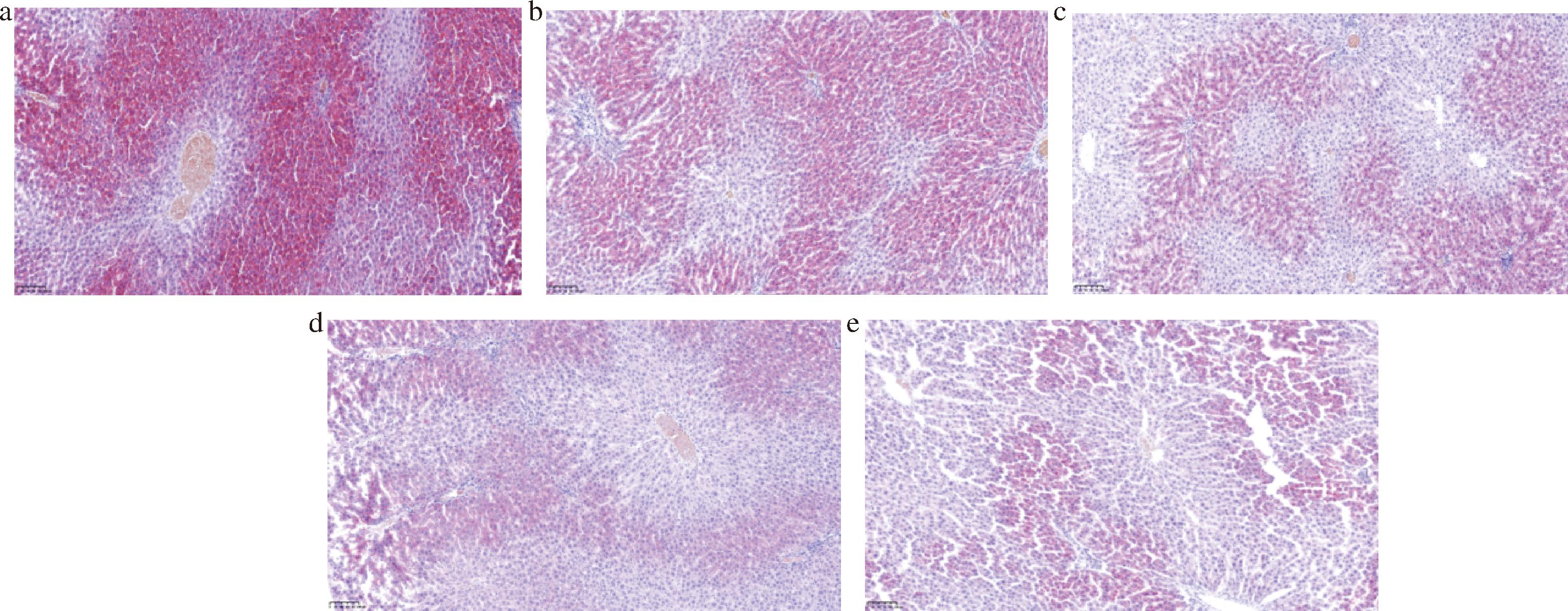
如图3、图4所示,给予受试物30或50 d后,模型组(图3-a、图4-a)的肝脏脂滴含量显著高于空白对照组(图3-e、图4-e)(P<0.01)。模型组的大部分个体镜下可见含脂滴的肝细胞超过75%,病变肝细胞的细胞浆内含有大量大小不等的橘红色圆形脂滴;中剂量组(图3-c、图4-c)、高剂量组(图3-d、图4-d)的多数个体镜下可见含脂滴的肝细胞为50%~75%;而低剂量组(图3-b、图4-b)、空白对照组的个体镜下可见含脂滴的肝细胞为50%左右,仅含有少量脂滴。但仅有50 d低剂量组(图4-b)的肝脏脂滴含量下降较模型组(图4-a)具有显著性(P<0.05)。结果提示给予受试物可减少肝脏因急性暴露于酒精造成的脂肪沉积,从而减轻大鼠的肝损伤程度,且给予受试物的时间越长,改善程度越显著,但沙棘油的含量不宜过高,结果显示改善效果最好的为低剂量组(0.3 g/kg体重),与另一研究结果一致[15],且该剂量也更接近人的正常摄入水平。
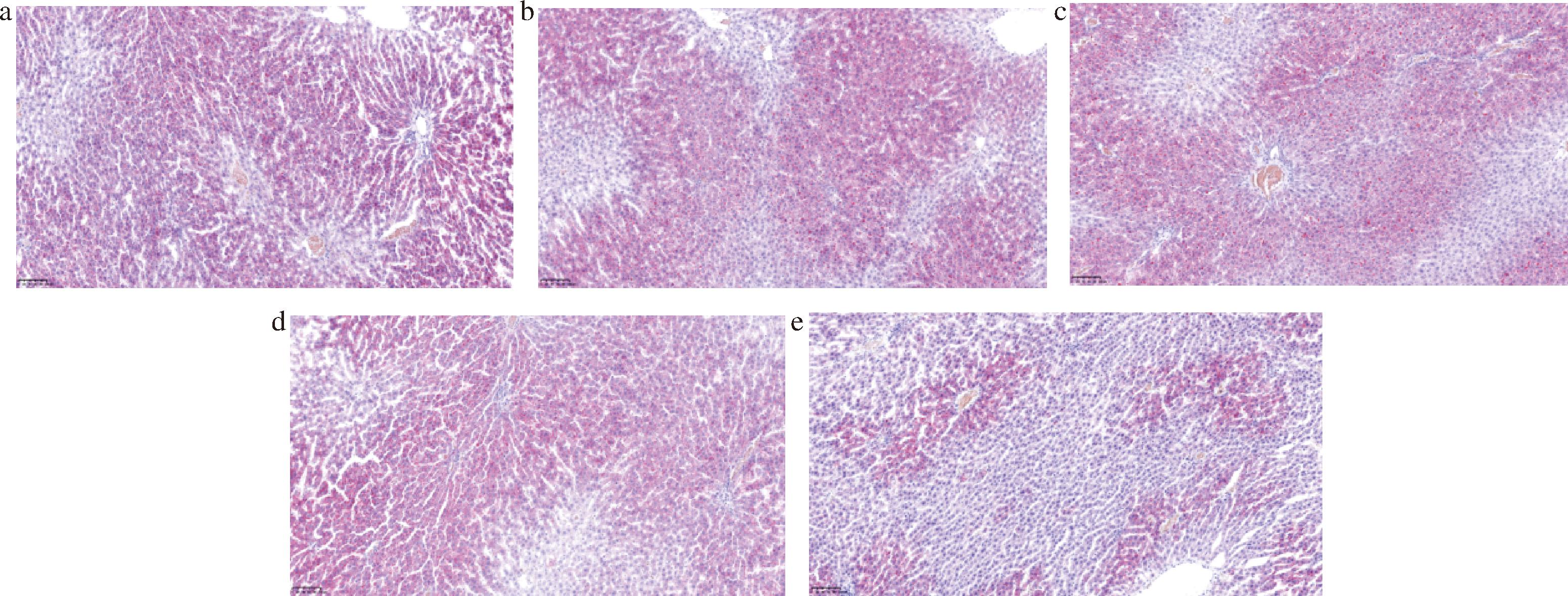
a-模型组;b-低剂量组;c-中剂量组;d-高剂量组;e-空白对照组
图3 给予受试物30 d后大鼠肝脏油红O染色典型示意图(×40)
Fig.3 Typical schematic diagram of oil red O staining in rat liver after 30 days of administration of the test substance(×40)
a-模型组;b-低剂量组;c-中剂量组;d-高剂量组;e-空白对照组
图4 给予受试物50 d后大鼠肝脏油红O染色典型示意图(×40)
Fig.4 Typical schematic diagram of oil red O staining in rat liver after 50 days of administration of the test substance(×40)
如表5所示,给予受试物30 d后,模型组的ALT水平显著高于空白对照组(P<0.01),而各剂量组的ALT水平与模型组相比显著降低(P<0.05或P<0.01),与空白对照组无明显差别。模型组的AST水平较空白对照组升高(P<0.01),而高剂量组则较模型组降低(P<0.05)。ALT 和 AST 是临床常用的肝细胞损伤指标,前者主要分布在肝细胞胞浆,后者主要存在于肝细胞线粒体;肝细胞受损时,膜通透性增加,ALT、AST进入血液,致使血清的ALT、AST活力升高[16]。实验结果表明,受试物可降低大鼠血清ALT和AST水平,提示沙棘油受试物能减少肝细胞损伤,对酒精性肝损伤有保护作用。
表5 沙棘油灌胃30 d对大鼠血清生化指标的影响![]()
Table 5 The effect of 30-day oral gavage of sea buckthorn oil on serum biochemical indexes in ![]()
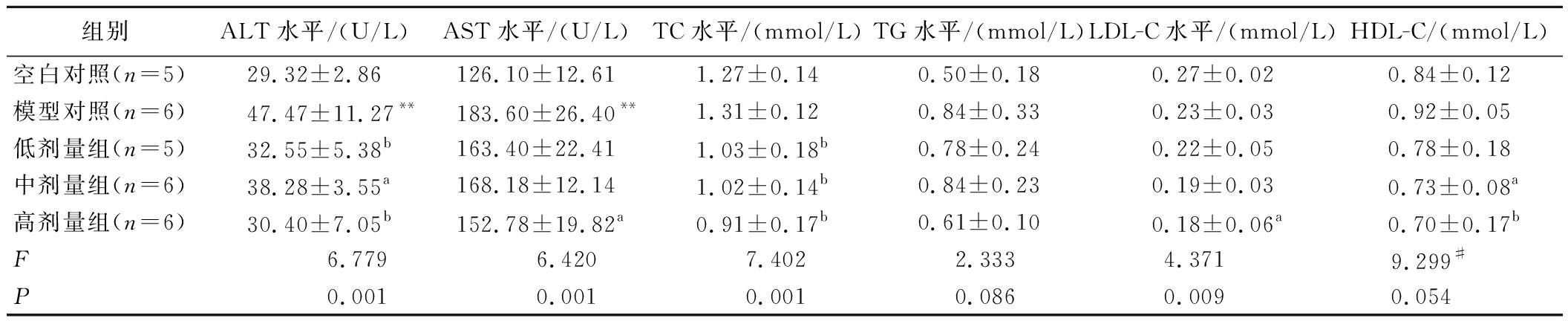
组别ALT水平/(U/L)AST水平/(U/L)TC水平/(mmol/L)TG水平/(mmol/L)LDL-C水平/(mmol/L)HDL-C/(mmol/L)空白对照(n=5)29.32±2.86126.10±12.611.27±0.140.50±0.180.27±0.020.84±0.12模型对照(n=6)47.47±11.27**183.60±26.40**1.31±0.120.84±0.330.23±0.030.92±0.05低剂量组(n=5)32.55±5.38b163.40±22.411.03±0.18b0.78±0.240.22±0.050.78±0.18中剂量组(n=6)38.28±3.55a168.18±12.141.02±0.14b0.84±0.230.19±0.030.73±0.08a高剂量组(n=6)30.40±7.05b152.78±19.82a0.91±0.17b0.61±0.100.18±0.06a0.70±0.17bF6.7796.4207.4022.3334.3719.299#P0.0010.0010.0010.0860.0090.054
注:表中剔除了采样失败和发生溶血的样本;#:HDL-C的F值为Kruskal-Wallis秩和检验卡方值。
模型组的TC和空白对照组无明显区别,而所有剂量组的TC含量都较模型组显著降低(P<0.01),提示沙棘油可降低血清中的TC。模型组的LDL-C水平与空白对照组相比没有显著差异,高剂量组的LDL-C水平与模型组相比显著降低(P<0.05),表明沙棘油能降低血清中的LDL-C水平。TC是血液中各脂蛋白所含胆固醇的总和,LDL-C是动脉粥样硬化性心血管疾病的致病性危险因素[17]。本研究结果提示,沙棘油受试物有助于降低血脂水平,调节酒精性肝损伤造成的脂质代谢紊乱。这种保护作用可能与沙棘油含有的脂肪酸有关,有研究发现由沙棘油富集得到的油酸能够改善因饮食不当引发的血脂升高和肥胖问题,对高脂血症和动脉硬化有良好的预防效果[18];富含棕榈油酸的沙棘油能改善脂质代谢、减轻肝脂肪变性、降低氧化应激并调节炎症反应,在预防和治疗代谢紊乱及心血管疾病方面极具前景[19-20]。
如图5、图6所示,给药50 d后,一次性大剂量给予乙醇,模型组的乙醇脱氢酶ADH1B的阳性面积和H评分比空白对照组高,低、中剂量组比空白对照组高但低于模型组,高剂量组高于模型组,各组差异无统计学意义。各组的乙醛脱氢酶ALDH2的阳性面积和H评分比空白对照组低,低、中剂量组低于模型组,高剂量组高于模型组,各组差异无统计学意义。结果表明ALDH2和ADH1B的活力虽然在一次性大剂量给予乙醇后有轻微改变,但差异无显著性,受试样品可能未通过酒精代谢酶相关的途径发挥酒精性肝损伤的辅助保护作用,但不排除作用时间较短的可能。
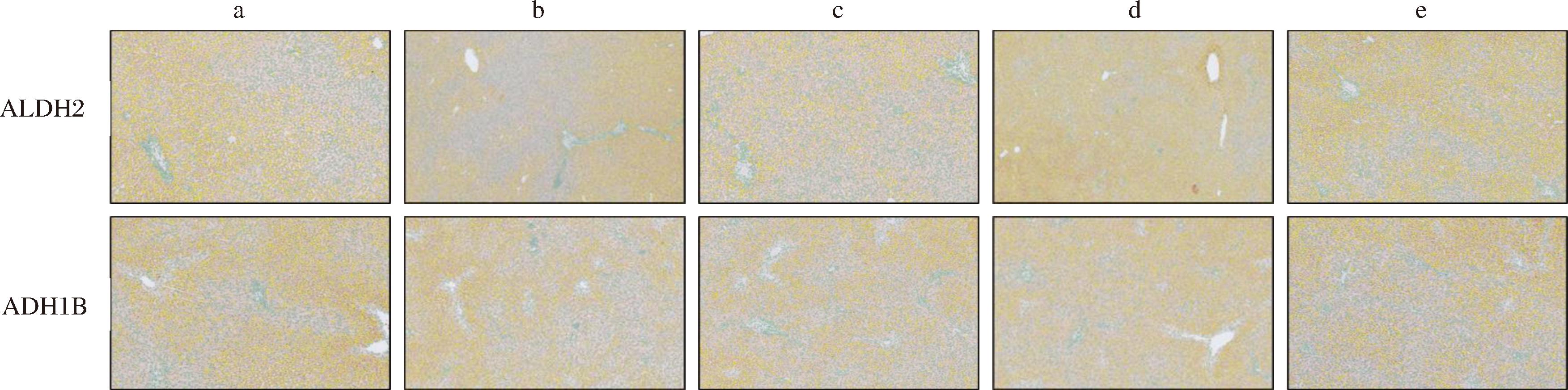
a-模型组;b-低剂量组;c-中剂量组;d-高剂量组;e-空白对照组
图5 给予受试物50 d后大鼠肝脏免疫组化典型示意图(×40)
Fig.5 Typical schematic diagram of rat liver immunohistochemistry after 50 days of administration of the test substance(×40)
注:图中黄色部分为阳性细胞。
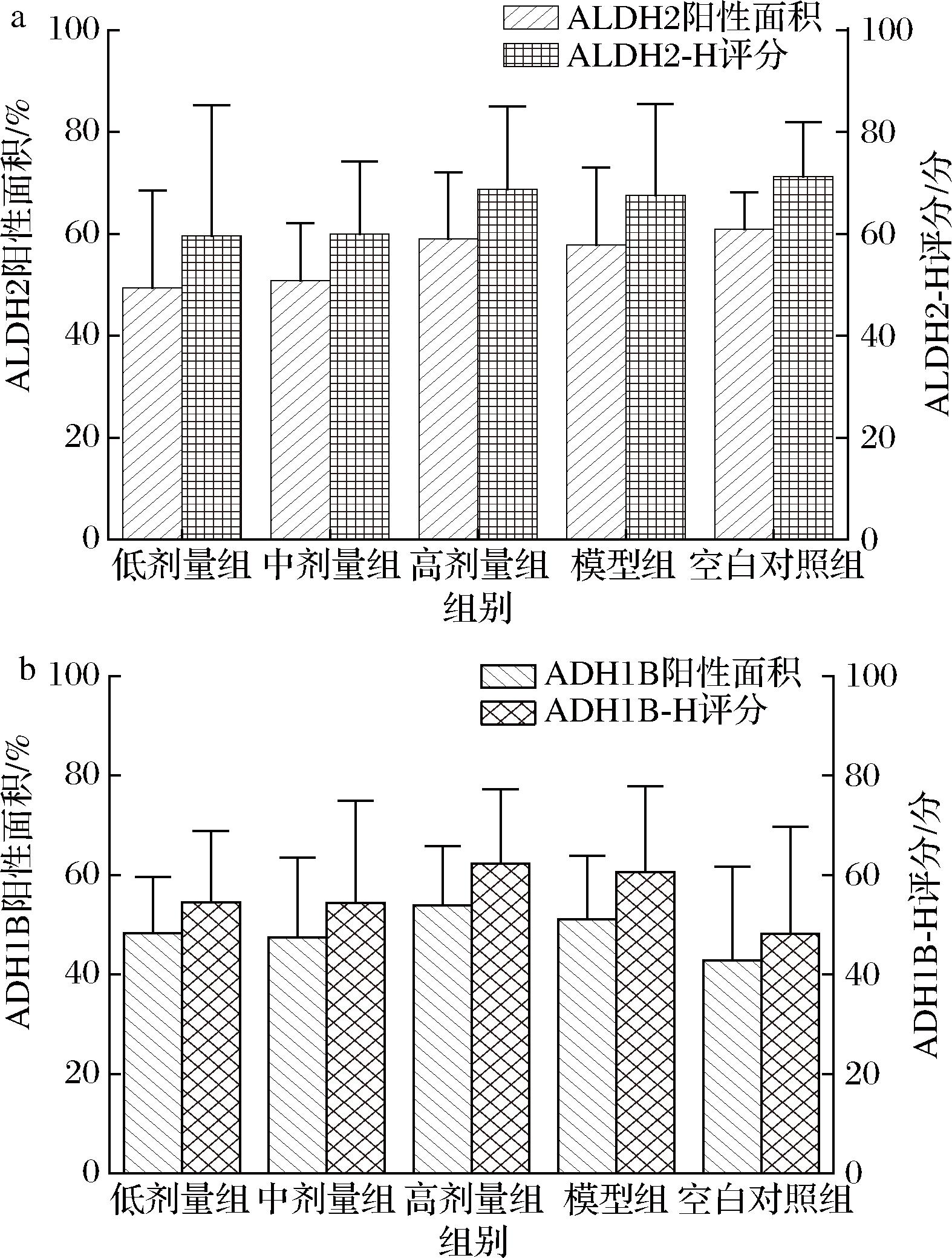
a-乙醛脱氢酶ALDH2阳性面积和H评分;b-乙醇脱氢酶ADH1B阳性面积和H评分
图6 给予受试物50 d后对大鼠肝脏酒精代谢酶活力的影响
Fig.6 Effect of 50-day test substance administration on the activity of alcohol metabolic enzymes in rat liver
本实验成功构建了大鼠酒精性肝损伤模型。依据《保健食品功能检验与评价方法(2023年版)》,本受试物给药30 d剂量组大鼠的肝脏MDA、还原型GSH和TG三项检测指标结果阳性,给药50 d剂量组大鼠的肝脏MDA、还原型GSH和肝脏病理评分结果阳性,2项实验均可判定受试样品对酒精性肝损伤具有辅助保护作用。
本研究给予大鼠沙棘油受试物后,结果显示其能够显著降低急性酒精性肝损伤大鼠肝脏中的过氧化脂质降解产物MDA水平,降低TG水平减少脂肪蓄积,提高GSH含量,表明沙棘油具有抗氧化作用,能够减轻肝脏由于急性暴露于酒精造成的氧化应激。本研究受试物(沙棘籽油与沙棘果油复配)与其他研究中的单纯饲喂沙棘籽油或沙棘果油相比,3种沙棘油均显示可减轻酒精性肝损伤大鼠肝脏的TG水平和脂肪变性,提高GSH活力,但单独的沙棘籽油或沙棘果油并未显著降低大鼠肝脏MDA水平[7,15],提示沙棘籽油与沙棘果油复配后在一定程度上提升了沙棘油抵抗酒精性肝损伤的效果。此外,沙棘油能降低ALT和AST水平,减轻肝损伤,同时显著降低血清中的TC和LDL-C含量,提示其有助于降低血脂。然而,本研究发现,当沙棘油剂量逐渐升高,其对肝脏生化指标(MDA、GSH和TG)的改善程度并未持续提升,反而出现下降现象;而对血清生化指标(ALT、AST、TC和TG),高剂量组的改善效果更为显著。血清生化指标(如ALT、AST)通常对肝脏损伤更为敏感,因此在高剂量沙棘油的作用下,这些指标的改善可能更为显著。以上结果表明,沙棘油对肝脏生化指标和血清生化指标的影响呈现复杂的剂量依赖性关系,在实际应用中,应根据具体情况选择合适的沙棘油剂量,避免盲目追求高剂量而导致不良反应。各组大鼠肝脏酒精代谢酶活力无显著差异,表明受试样品可能未通过酒精代谢酶相关的途径发挥酒精性肝损伤的辅助保护作用。然而,造模后时间过短,可能无法充分反映酒精性肝损伤对酶活力的影响,也是本研究中肝脏酒精代谢酶活力无显著差异的原因之一。在另一慢性酒精性肝损伤模型中,研究观察到了肝脏酒精代谢酶活力的组间差异[21],提示应在急性酒精性肝损伤造模后的不同时间点进行检测,以观察酶活力的动态变化,更可靠地阐明酒精代谢酶的作用。综上,实验结果表明,沙棘油可能通过抗氧化作用和调节脂质代谢减少肝细胞损伤,从而表现出对酒精性肝损伤有辅助保护作用,但具体机制需进一步研究。基于本研究结果,沙棘油在预防和辅助治疗酒精性肝损伤方面展现出一定的潜力,具有良好的转化前景,有望成为一种辅助治疗酒精性肝损伤的天然产品。
[1] XIAO J, WANG F, WONG N K, et al. Global liver disease burdens and research trends: Analysis from a Chinese perspective[J]. Journal of Hepatology, 2019, 71(1):212-221.
[2] 黄俊,江晶晶,邵慧娟,等.1990—2019年我国酒精性肝病的疾病负担分析[J].现代预防医学,2023,50(20):3800-3805;3811.HUANG J, JIANG J J, SHAO H J, et al. Disease burden analysis of alcoholic liver disease in China, 1990—2019[J]. Modern Preventive Medicine,2023,50(20):3800-3805;3811.
[3] 曲航,高鑫,伊娟娟,等.食源性天然产物对酒精性肝损伤的防护作用研究进展[J].食品科学,2020,41(17):283-290.QU H, GAO X, YI J J, et al. Review on the protective effects of food-derived natural compounds on alcohol-induced liver injury[J]. Food Science,2020,41(17):283-290.
[4] 周浩楠, 胡娜, 董琦, 等. 沙棘化学成分及药理作用的研究进展[J]. 华西药学杂志, 2020, 35(2):211-217.ZHOU H N, HU N, DONG Q, et al. Research progress on the chemical composition and pharmacological action of Hippophae rhamnoides[J]. West China Journal of Pharmaceutical Sciences, 2020, 35(2):211-217.
[5] 臧茜茜, 邓乾春, 从仁怀, 等. 沙棘油功效成分及药理功能研究进展[J]. 中国油脂, 2015, 40(5):76-81.ZANG X X, DENG Q C, CONG R H, et al. Review on functional components and pharmacological property of sea buckthorn (Hippophae rhamnoides L.) oil[J]. China Oils and Fats, 2015, 40(5):76-81.
[6] 徐美虹, 王娜, 张亮, 等. 沙棘籽油对四氯化碳肝损伤的保护作用研究[J]. 中国预防医学杂志, 2010, 11(5):513-516.XU M H, WANG N, ZHANG L, et al. Hepatoprotective effect of Hippophae rhamnoides seed oil on the CCl4-reduced injuries[J]. Chinese Preventive Medicine, 2010, 11(5):513-516.
[7] 徐美虹, 王娜, 张葳芮, 等. 沙棘籽油对急性酒精性肝损伤的保护作用研究[J]. 中国民族民间医药, 2009, 18(20):18-19.XU M H, WANG N, ZHANG W R, et al. Protective effect of seabuckthorn seed oil on acute alcoholic liver injury[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2009, 18(20):18-19.
[8] 覃红, 程体娟, 佟婉红, 等. 沙棘籽油对肝损伤小鼠免疫功能的影响[J]. 中药药理与临床, 2003, 19(1):14-15.QIN H, CHENG T J, TONG W H, et al. Influence of seed oil of Hippophae rhamnoides L. (SOHR) on immune effect in mice of hepatocirrhosis[J]. Pharmacology and Clinics of Chinese Materia Medica, 2003, 19(1):14-15.
[9] 程体娟, 李文惠, 陈卫, 等. 沙棘籽油对大鼠实验性肝纤维化的保护作用[J]. 中药药理与临床, 2002, 18(6):15-16.CHENG T J, LI W H, CHEN W, et al. The protection of seed oil of Hippophae rhamnoides L. on experimental hepatic fibrosis in rats[J]. Pharmacology and Clinics of Chinese Materia Medica, 2002, 18(6):15-16.
[10] 刘超, 徐婧, 叶存奇, 等. 沙棘籽油和果油对小鼠实验性肝损伤的保护作用及对比研究[J]. 中国中药杂志, 2006, 31(13):1100-1102.LIU C, XU J, YE C Q, et al. Effects and comparison of seed oil and sarcocarp oil of Hippophae rhamnoides on rats with experimental hepatocirrhosis[J]. China Journal of Chinese Materia Medica, 2006, 31(13):1100-1102.
[11] SIMOPOULOS A P. An increase in the omega-6/omega-3 fatty acid ratio increases the risk for obesity[J].Nutrients, 2016, 8(3):128.
[12] 曾丽海, 郑杰蔚, 谢植伟, 等. SD大鼠28 d重复剂量经口毒性试验生物学指标实验室历史对照值研究[J]. 中国职业医学, 2021, 48(3):247-252.ZENG L H, ZHENG J W, XIE Z W, et al. Study on the laboratory historical control values of biological indicators in SD rats with 28-day repeated dose oral toxicity tests[J]. China Occupational Medicine, 2021, 48(3):247-252.
[13] 卓鑫鑫, 邓丽萍, 何冰浩, 等. 解酒机制及解酒产品研究进展[J]. 中国酿造, 2024, 43(2):22-28.ZHUO X X, DENG L P, HE B H, et al. Research progress of anti-alcoholic mechanism and anti-alcoholic products[J]. China Brewing, 2024, 43(2):22-28.
[14] PARK S H, LEE Y S, SIM J, et al. Alcoholic liver disease: A new insight into the pathogenesis of liver disease[J]. Archives of Pharmacal Research, 2022, 45(7):447-459.
[15] XU M H, WANG N, ZHANG W R, et al. Protective effects of seabuckthorn seed oil against acute alcoholic-induced liver injury in rats[J]. Journal of Food and Nutrition Research, 2014, 2(12):1037-1041.
[16] 李飞, 陆伦根. 肝功能异常的评估及临床意义[J]. 临床肝胆病杂志, 2015, 31(9):1543-1546.LI F, LU L G. Evaluation of abnormal liver function and its clinical significance[J]. Journal of Clinical Hepatology, 2015, 31(9):1543-1546.
[17] 王增武,刘静,李建军,等.中国血脂管理指南(2023年)[J].中国循环杂志,2023,38(3):237-271.WANG Z W, LIU J, LI J J, et al. Chinese guidelines for lipid management(2023)[J]. Chinese Circulation Journal,2023,38(3):237-271.
[18] 王子豪,孟鑫.沙棘果油中油酸的富集及对高脂小鼠的代谢影响[J].食品科技,2021,46(9):161-168.WANG Z H, MENG X. Accumulation of oleic acid in seabuckthorn fruit oil and its effect on metabolism in hyperlipidemic mice[J]. Food Science and Technology,2021,46(9):161-168.
[19] LI J, GUO J H, YUEN M, et al. The comparative effects of ω-7 fatty acid-rich sea buckthorn oil and ω-3 fatty acid-rich DHA algal oil on improving high-fat diet-induced hyperlipidemia[J]. Food &Function, 2025, 16(4):1241-1253.
[20] GAO S, HU G S, LI D, et al. Anti-hyperlipidemia effect of sea buckthorn fruit oil extract through the AMPK and Akt signaling pathway in hamsters[J]. Journal of Functional Foods, 2020, 66:103837.
[21] 刘明,陈绍红,钟赣生,等.葛花枳椇子配伍对酒精性肝损伤大鼠血中乙醇浓度和肝中乙醇脱氢酶活性的量—时—效影响[J].环球中医药,2015,8(3):299-303.LIU M, CHEN S H, ZHONG G S, et al.Volume-when-effect influence of hovenia dulcis thunb and flower of kudzuvine compatibility to ethanol concentration and liver alcohol dehydrogenase activity of experimental alcoholic liver disease of rats[J]. Global Traditional Chinese Medicine,2015,8(3):299-303.