水开菲尔是一种非乳制品发酵饮料,通常由水开菲尔粒发酵红糖等非分蜜糖水溶液,或与果蔬等基底相结合制备而成。水开菲尔粒含有多种共生的有益菌种,包括乳酸菌、醋酸菌和酵母菌等,外观形状多表现为不规则的透明小颗粒[1-2],研究发现,水开菲尔发酵过程会产生大量有机酸、氨基酸和维生素等微量营养素[3],因此,水开菲尔具有多种健康益处,包括维持肠道微生物群平衡、增强肠道屏障功能以及调节免疫系统等[4-5]。目前,随着消费者对健康饮食需求的不断增长,水开菲尔在我国市场的发展潜力巨大,但也面临着一系列挑战,包括其发酵过程以及代谢产物还不明晰等问题,需要进一步的研究。
水开菲尔的独特风味和功能特性主要源于其乳酸菌、醋酸菌和酵母菌的共同发酵作用[6],目前对水开菲尔动态发酵过程中菌群结构演替规律的了解仍较为有限。水开菲尔发酵过程中菌群的代谢产物是其风味形成以及维持微生物群落平衡的关键因素,不同微生物通过各自的代谢路径和酶的活性,生成多种有机酸、醇类、酯类、酚类及其他风味活性化合物[7],这些化合物共同决定了水开菲尔最终的质量特性。例如,乳酸菌的活动会增加乳酸的产量,影响饮品的酸度,而酿酒酵母所主导的酒精发酵则会增添水开菲尔的芳香味道[8]。对水开菲尔发酵过程中微生物群落变化及其代谢产物的进一步研究,不仅能够帮助我们理解微生物群落在水开菲尔发酵过程中的互作机制,同时也是优化其生产工艺和满足消费者口味需求的关键[9]。
本研究通过宏基因组和非靶向代谢组学联用,旨在揭示水开菲尔微生物群落的发展演变和其代谢谱的变化特征,并分析在水开菲尔发酵过程中与标志性代谢产物相关联的核心微生物群落,从而为我国水开菲尔发酵工业的发展提供理论支持。
1 材料与方法
1.1 材料与试剂
甲醇(HPLC级),德国CNW Technologies GmbH公司;氯仿(HPLC级)、吡啶(HPLC级),上海阿达玛斯试剂有限公司;甲氧胺盐酸盐(分析纯),东京化成工业株式会社;核糖醇(≥99%),sigma公司;双(三甲基硅烷基)三氟乙酰胺(含1% 三甲基氯硅烷),Regis Technologies公司;十六烷基三甲基溴化铵(≥99%)、三(羟甲基)氨基甲烷盐酸盐(≥99.5%),北京索莱宝科技有限公司;饱和脂肪酸甲酯,德国Dr. Ehrenstorfer公司;纯水,屈臣氏。
1.2 仪器与设备
SW-CJ-2F洁净工作台,苏州安泰空气技术有限公司;JC-100-SE恒温培养箱,青岛精诚仪器仪表有限公司;7890A气相色谱仪、DB-5MS色谱柱(30 m × 250 μm × 0.25 μm),美国Agilent公司、PEGASUS HT质谱仪,美国LECO公司;Heraeus Fresco17离心机、Forma 900 series超低温冰箱,美国Thermo Fisher 公司;BSA124S-CW分析天平,德国赛多利斯公司;JXFSTPRP-24研磨仪,上海净信科技有限公司;YM-080S超声仪,深圳市方奥微电子有限公司;DHG-9023A烘箱,上海一恒科学仪器有限公司;LNG-T98真空干燥仪,太仓市华美生化仪器厂。
1.3 水开菲尔制备
水开菲尔粒(30 g)来自中国轻工业健康食品开发与营养调控重点实验室。参考文献[10]的发酵条件,将水开菲尔粒置于配备水封阀的Schott瓶中进行培养。每10 g水开菲尔粒加入25 g红糖和100 mL蒸馏水,温度保持26 ℃。每隔3 d,分离水开菲尔粒和发酵液,并将分离后的水开菲尔粒置于新红糖溶液中培养,条件与前相同。这个过程反复进行,直至水开菲尔粒的湿重超过500 g,采集3份各2 g的水开菲尔粒样本进行宏基因组检测。
水开菲尔样本制备分为3个不同时间点:24、48、72 h(分别编号为D1、D2、D3)。每个时间点准备3个平行样本,每个样本包含10 g水开菲尔粒、25 g红糖和100 mL蒸馏水,放入250 mL的Schott瓶(配有水封阀)中进行发酵。实验结束后,过滤分离水开菲尔粒,然后在25 ℃、4 000×g离心10 min处理水开菲尔发酵液样本。离心所得的菌体储存于-80 ℃的冰箱中,以备后续宏基因组检测。
1.4 基础指标检测
分别在0、24、48、72 h取水开菲尔样品检测pH值以及糖度,使用pH计测定不同发酵时间水开菲尔的pH值,使用折光仪检测水开菲尔的糖度(Brix)。
1.5 水开菲尔粒及发酵液微生物宏基因组检测
采用CTAB法从水开菲尔粒以及水开菲尔发酵液(24、48、72 h样品)中提取DNA(样本数=3)。通过测量260 nm/280 nm的吸光光度比值评估提取出的DNA的质量。高质量的DNA样本(具有1.8至2.0的吸光光度比值且DNA含量超过1 μg)存放于-20 ℃。使用NEBNext® UltraTM DNA Kit制备测序库。每个样本使用1 μg的高质量DNA,测序过程产生的原始数据作为后续信息分析的基础。为确保数据分析的准确性和可靠性,采取了严格的质量控制和宿主过滤流程。对微生物物种注释使用了GTDB数据库(https://gtdb.ecogenomic.org/),以95%的相似性和30%的覆盖率为阈值,本研究共注释到8个物种(相对丰度>0.01%)。
1.6 水开菲尔非靶向代谢组检测
水开菲尔发酵液使用气相色谱联用飞行时间质谱仪进行分析。系统采用DB-5MS毛细管柱。1 μL样品等分注入到无分流模式中,He被用作载气气体,前进口净化流量为3 mL/min,气体通过柱子的流速为1 mL/min。初始温度在50 ℃保持1 min,然后以10 ℃/min的速率升至310 ℃,然后在310 ℃保持8 min。注射口、传递线和离子源的温度分别设定为280、280、250 ℃,电子碰撞模式下的能量为-70 V。在溶剂延迟6.4 min后,以每秒12.5个谱图的速率在质荷比m/z范围为50~500的全扫描模式下获取质谱数据。原始数据分析,包括峰提取、基线校正、解卷积、对齐和积分,均通过Chroma TOF (V 4.3x,LECO)软件进行。代谢物的鉴定是通过质谱匹配和保留指数,使用LECO-Fiehn Rtx5数据库完成。最后,排除在少于一半的质控样品中检测到的峰以及在质控样品中相对标准偏差>30%的峰。
1.7 数据处理及分析
检测到的代谢物通过偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA)进行可视化处理,通过变量重要性投影值(variable importance in projection, VIP>1,P<0.05)筛选出组间存在显著性差异的标志物。使用FooDB(https://foodb.ca/)及KEGG(www.genome.jp/kegg/ligand.html)数据库进行代谢物的信息提取、注释。使用Graphpad软件生成柱形图并进行统计分析。相关性分析通过OmicStudio工具(https://www.omicstudio.cn/tool/62)完成。
2 结果与分析
2.1 水开菲尔发酵过程中pH及糖度变化
如图1-a所示,水开菲尔的pH值在0~24 h和24~48 h的时间段内均显著降低,而在48 h与72 h之间,pH值无统计学差异。值得注意的是,在最初的24 h期间,pH值呈现最显著的变化。如图1-b所示,与pH值的观测结果相似,糖度在最初48 h内显著下降,随后在48 h后趋于稳定。这一趋势可能与发酵初期的乳酸菌活动密切相关。在0~24 h阶段,乳酸菌可能迅速繁殖并开始发酵,消耗糖分并产生酸性物质,导致糖度和pH值下降。在24~48 h的时间段内,这些变化仍然显著,但程度有所减弱,发酵过程开始趋于稳定,并且有文献显示水开菲尔pH值迅速降低时,酿酒酵母的活动会得到加强[11],此时其与乳酸菌对基础碳源会形成“竞争”关系,减弱有机酸的生成。到了48~72 h之间,pH值和糖度均进入平台期,变化不再显著,这表明该体系乳酸菌-酵母菌发酵活动已达到相对稳定的状态,微生物的代谢活动和产物生成趋于平衡。
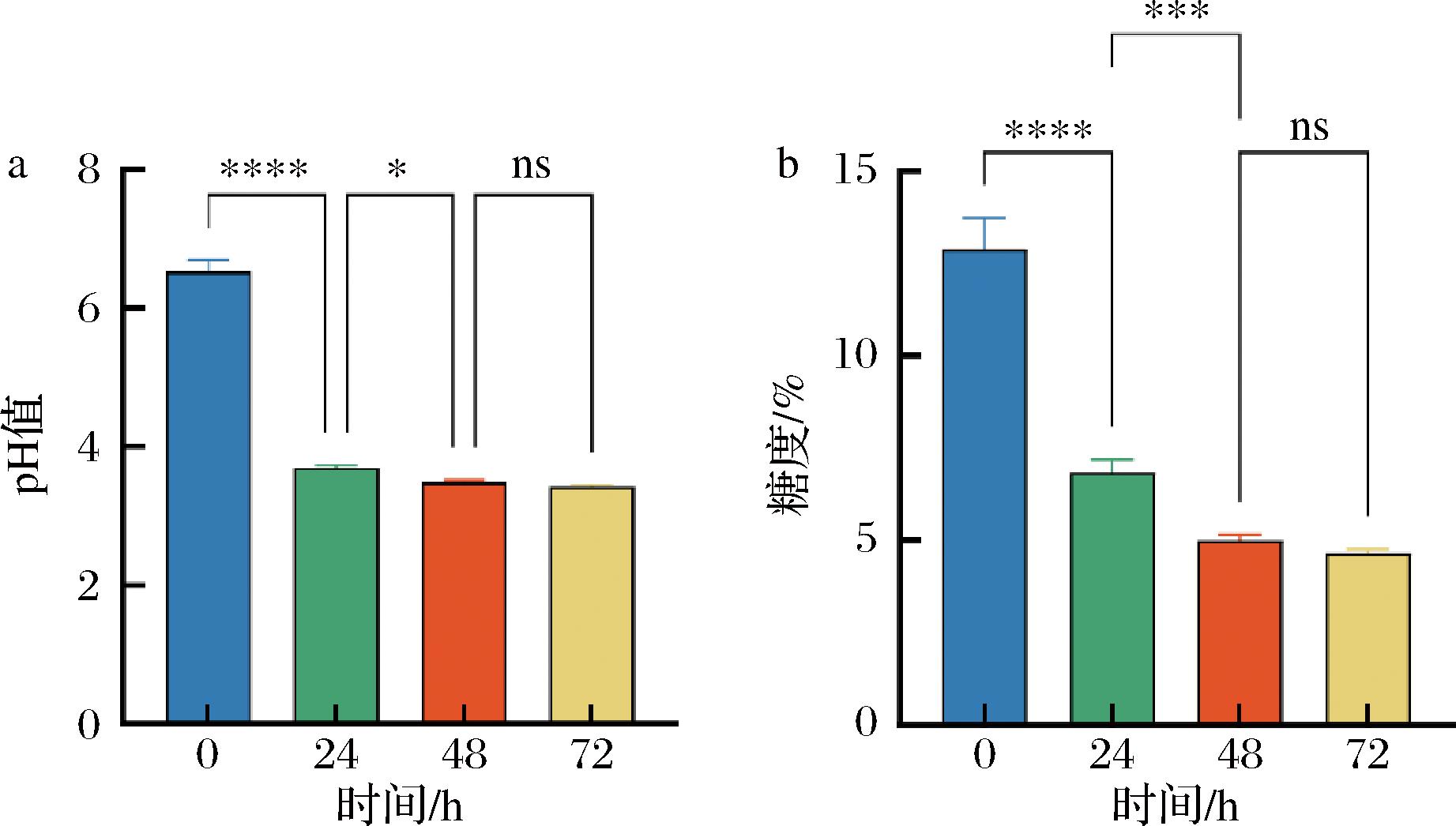
a-pH值;b-糖度
图1 水开菲尔发酵过程中pH、糖度变化
Fig.1 Variations in pH and Brix during the water kefir fermentation process
注:*表示差异显著(P<0.05),**表示差异显著(P<0.01),***表示差异显著(P<0.001),****表示差异显著(P<0.000 1),ns表示差异不显著(下同)。
2.2 水开菲尔粒菌群结构
如图2所示,在菌群种水平上,恶味施莱弗乳杆菌(Schleiferilactobacillus perolens)在所有注释到的微生物中展现出了最高的相对丰度(52.89±1.05)%。此外,乳杆菌科的其他成员包括酒液体乳杆菌[Liquorilactobacillus vini,(14.81±2.02)%]、食二酸迟缓乳杆菌[Lentilactobacillus diolivorans,(9.05±1.70)%]、哈尔滨施莱弗乳杆菌[Schleiferilactobacillus harbinensis,(8.77±1.24)%]、希氏迟缓乳杆菌[Lentilactobacillus hilgardii,(7.65±0.67)%]、副干酪乳酪杆菌[Lacticaseibacillus paracasei,(1.72±0.06)%]、加纳液体乳杆菌[Liquorilactobacillus ghanensis,(0.81±0.21)%]。此研究中唯一鉴定到的酵母菌种是酿酒酵母(Saccharomyces cerevisiae),丰度为(0.86±0.25)%。水开菲尔作为乳酸菌及酵母菌的混合发酵体系,其菌种是影响其发酵特征的关键,且不同的基础发酵菌株会带来不同的水开菲尔风味特点[12]。本实验中所检测到的哈尔滨施莱弗乳杆菌,研究发现其仅在我国及比利时地区的样品检出[6]。此外,本研究所获得的水开菲尔菌群结构相对简单,所鉴定到的菌种主要集中于乳酸菌及酿酒酵母,这与其他相关研究不同[10,13-14],可能是本实验中用于培养水开菲尔粒的基质单一(仅使用红糖,并未加入其他干果或果汁基底),低营养浓度的发酵环境对水开菲尔粒菌群多样性存在负面影响[7],并且经历长期厌氧培养导致此开菲尔粒中缺乏醋酸菌。
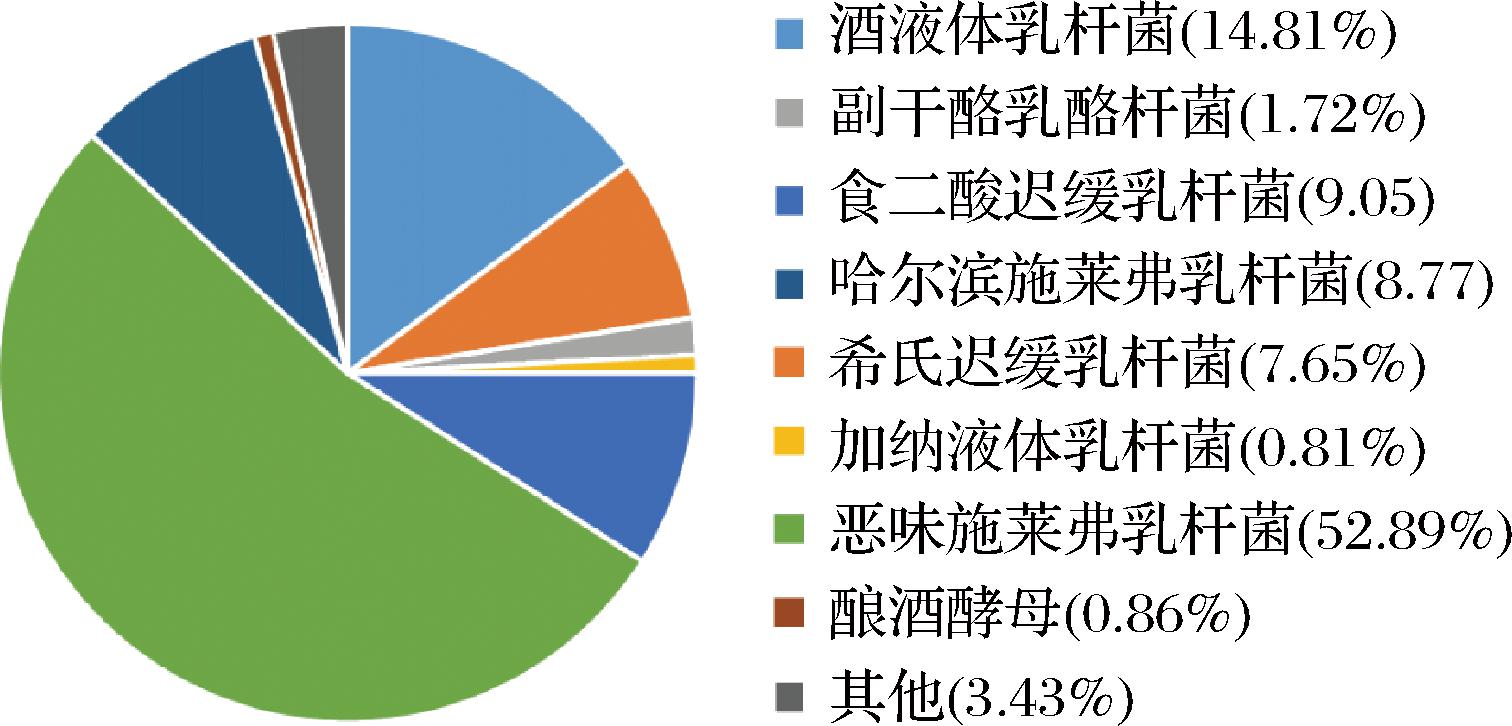
图2 水开菲尔粒菌群结构(种水平)
Fig.2 Microbial community structure of water kefir grains (species level)
2.3 水开菲尔发酵过程中菌群结构变化
2.3.1 水开菲尔发酵过程中菌群结构变化(属水平)
如图3所示,在水开菲尔发酵的24~72 h内,液体乳杆菌属(Liquorilactobacillus)与施莱弗乳杆菌属(Schleiferilactobacillus)为主要菌属。其中液体乳杆菌属随发酵时间其相对丰度逐渐上升,而施莱弗乳杆菌属随发酵时间延长,其相对丰度逐渐下降,发酵后期施莱弗乳杆菌属的相对丰度显著下降。这一变化反映了施莱弗乳杆菌属随时间环境适应能力的下降,导致其生态位被其他菌属所挤压,相比而言液体乳杆菌属在pH值逐渐降低、营养源(碳源)逐渐匮乏的体系中更具适应性[15]。此外,在复杂微生物体系中低丰度菌与主要菌群之间可能存在复杂的互作和共生关系,比如竞争、拮抗等[16]。本研究水开菲尔发酵过程中低丰度菌属包括乳酪杆菌属(Lacticaseibacillus),迟缓乳杆菌属(Lentilactobacillus),酵母菌属(Saccharomyces),其中乳酪杆菌属丰度在24~48 h的发酵过程中无显著性变化,而在72 h其相对丰度显著上升。酵母菌属是鉴定到的唯一真菌菌属,在发酵过程中其相对丰度逐渐降低。迟缓乳杆菌属相对丰度在整个发酵过程中无显著变化。为了更细致研究菌群的演替规律,本研究从种水平对水开菲尔菌群结构进行了分析(图4)。
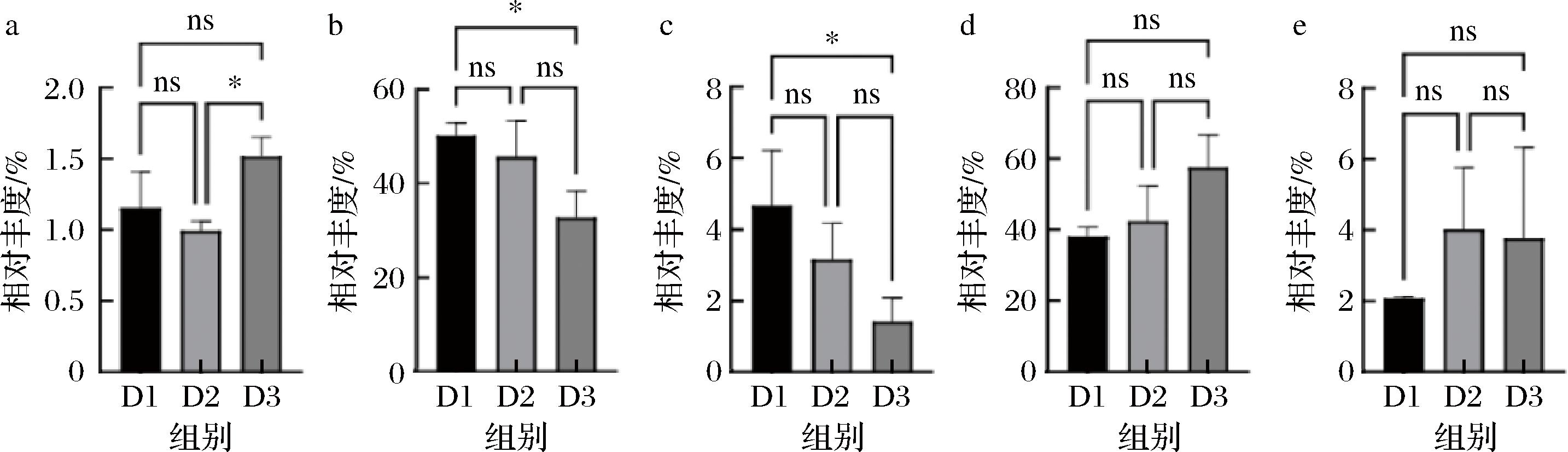
a-乳酪杆菌属相对丰度;b-施莱弗乳杆菌属相对丰度;c-酵母菌属相对丰度;d-液体乳杆菌属相对丰度;e-迟缓乳杆菌属相对丰度
图3 水开菲尔的菌群结构(属水平)
Fig.3 Microbial community structure of water kefir fermentation (genus level)
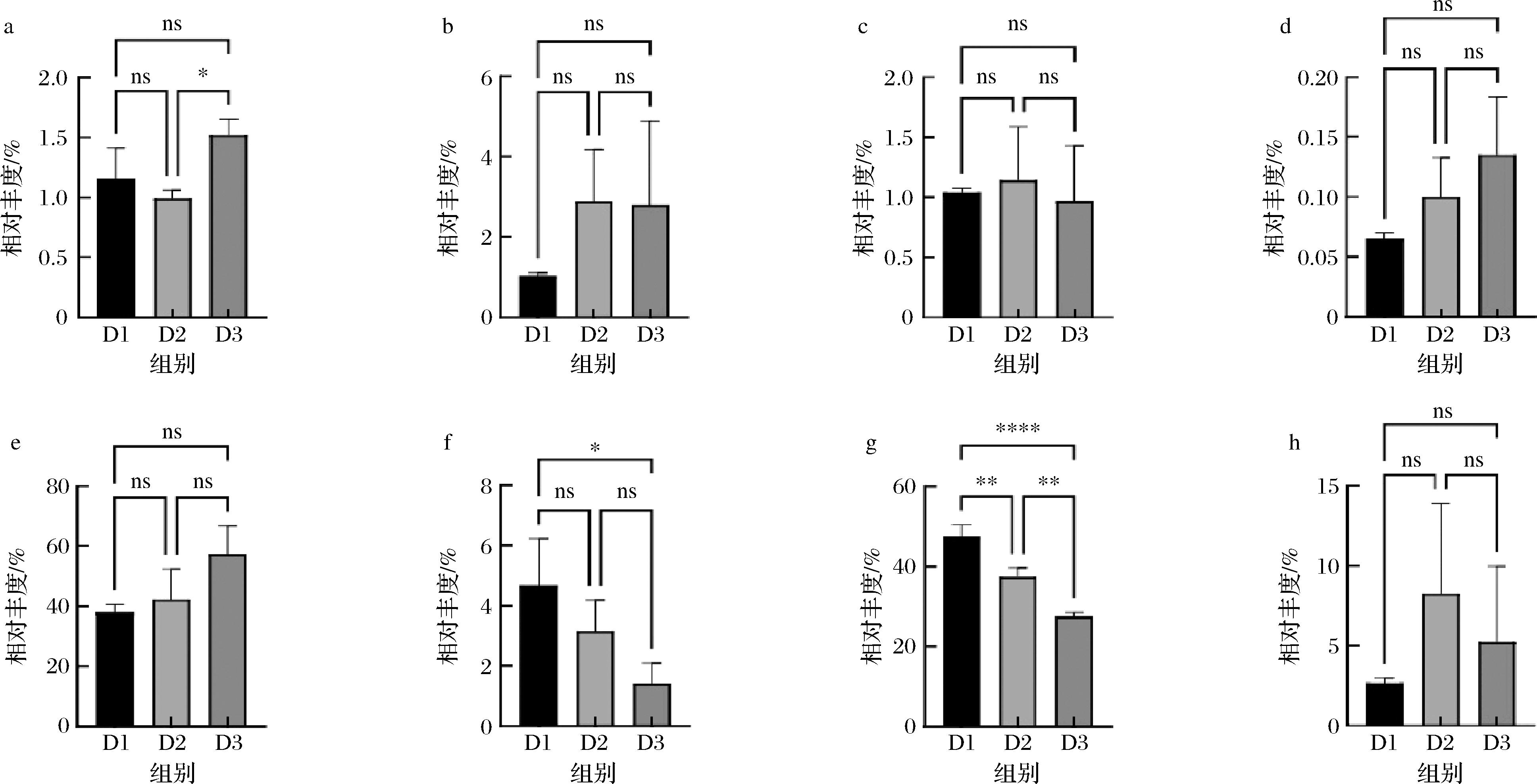
a-副干酪乳酪杆菌;b-食二酸迟缓乳杆菌;c-希氏迟缓乳杆菌;d-加纳液体乳杆菌;e-酒液体乳杆菌;f-酿酒酵母;g-哈尔滨施莱弗乳杆菌;h-恶味施莱弗乳杆菌
图4 水开菲尔的菌群结构(种水平)
Fig.4 Microbial community structure of water kefir fermentation (species level)
2.3.2 水开菲尔发酵过程中菌群结构变化(种水平)
本研究发现酒液体乳杆菌以及哈尔滨施莱弗乳杆菌是水开菲尔发酵过程中的优势菌种。副干酪乳酪杆菌作为乳酪杆菌属下被注释到的唯一菌种,在24~48 h的发酵过程中其相对丰度无显著性变化,而72 h其相对丰度显著上升(图4-a)。副干酪乳酪杆菌在已发表的关于水开菲尔菌群的研究中几乎都有报道,是常驻乳酸菌[10]。
食二酸迟缓乳杆菌以及希氏迟缓乳杆菌的相对丰度在水开菲尔发酵过程中无显著性变化(图4-b、图4-c)。加纳液体乳杆菌以及酒液体乳杆菌丰度随时间增加呈逐渐上升趋势,并无显著性差异(图4-d、图4-e)。恶味施莱弗乳杆菌在水开菲尔发酵过程中无显著性变化(图4-h),但施莱弗乳杆菌属下另一种被鉴定出的菌种—哈尔滨施莱弗乳杆菌的相对丰度在整个发酵过程中呈显著下降趋势(图4-g)。
作为酵母菌属中鉴定出的唯一种,酿酒酵母在发酵过程中其相对丰度逐渐减少,特别是在水开菲尔发酵的48~72 h显著下降(图4-f)。有研究表明在水开菲尔的发酵环境中,营养物质的浓度会改变发酵体系中菌群的多样性和优势物种,特别是高营养物质浓度有利于酵母菌的生长,相反,低营养环境会使酵母菌的丰度降低[17]。此外,酿酒酵母是全球水开菲尔中普遍存在的重要微生物,其能与水开菲尔中优势的乳酸菌种建立互惠关系,酿酒酵母能够为乳酸菌提供所需的氨基酸和维生素等营养物质,有助于维持水开菲尔发酵过程的稳定[11]。此外,酿酒酵母与乳酸菌共生的发酵体系中还能够产生甘露醇、各类挥发性酯和高级醇等化合物,这些代谢产物可能会对水开菲尔的感官特性产生调节作用[18]。
2.4 水开菲尔发酵过程中代谢物的时间特征
为了筛选水开菲尔不同时间点之间的标志性代谢物,研究中采用了PLS-DA模型,如图5-a、图5-b所示,将24、48 h(D1、D2)及48、72 h(D2、D3)的样品分为明显可区分的组别(D2 vs D1:R2=0.999 1,Q2=0.974 7;D3 vs D2:R2=0.997 9,Q2=0.862 9)。将鉴定出的标志性代谢物(VIP>1 &P<0.05)绘制热图,如图5-c所示,水开菲尔发酵24~48 h筛选出15种标志性代谢物,其中糖类及其衍生物10种、芳香羧酸及其衍生物2种、氨基醇类1种,醇脂类1种以及甾体类化合物1种。48~72 h筛选出标志性代谢物26个,如图5-d所示。其中糖类及其衍生物7种、氨基酸及其衍生物5种、有机酸及其衍生物4种、芳香羧酸及苯环结构化合物3种、糖醇类3种、苯环衍生物及生物碱2种、核苷酸及其衍生物1种,甾体类化合物1种。

a-24、48 h样品PLS-DA得分图;b-48、72 h样品PLS-DA得分图;c-24~48 h之间标志性代谢物;d-48~72 h之间标志性代谢物
图5 不同发酵时间水开菲尔标志性代谢物
Fig.5 Characteristic metabolites of water kefir at different fermentation times
水开菲尔的标志性代谢物主要集中于糖类及其衍生物、氨基酸、有机酸及其衍生物。在水开菲尔发酵过程中,糖类作为主要的碳源被微生物代谢利用,生成能量及其他代谢产物。在72 h内,水开菲尔微生物群落的变化会影响糖类的消耗和转化,主要原因在于水开菲尔体系中微生物对糖类的代谢路径不同。有研究表明在水开菲尔发酵过程中,乳酸菌和酵母菌会通过代谢活动影响糖类的消耗和转化,其中乳酸菌在水开菲尔发酵初期迅速增长,消耗糖类产生乳酸,从而降低pH值,抑制其他微生物的生长[14],而酵母菌如酿酒酵母则通过发酵糖类产生乙醇和CO2,进一步影响发酵环境[19]。48~72 h之间,水开菲尔代谢标志物集中于氨基酸、有机酸及其衍生物,在发酵过程中呈现出显著的变化。有文献指出,在水开菲尔发酵后期体系中氨基酸相关的代谢通路会发生显著变化[19],这可能是由于水开菲尔发酵体系中微生物在不同生长阶段对氨基酸需求的变化所导致[20]。此外,有机酸及其衍生物在水开菲尔发酵过程中存在显著变化,乳酸菌在水开菲尔发酵过程中会产生大量的有机酸,这些有机酸代谢产物不仅影响发酵液的酸度,还会对水开菲尔整体发酵体系的稳定和代谢活性产生重要影响[21]。
2.5 水开菲尔发酵过程中标志性代谢物与微生物相关性网络
同时,本研究对检测出的菌种以及标志性代谢物进行了相关性计算,依据斯皮尔曼相关系数(|r|>0.7 &P<0.05)绘制共现网络。如图6所示,网络中存在27个标志性代谢物节点以及6个微生物节点,其中包括5种乳酸菌以及酿酒酵母。副干酪乳酪杆菌拥有最多的与标志性代谢物的相关关系(Edge=14),并且值得注意的是,其所有共现关系均为显著正相关。除副干酪乳酪杆菌外,哈尔滨施莱弗乳杆菌是网络中相关关系占比最多的乳酸菌,其与标志性代谢物存在3个显著正相关以及9个显著负相关。与之相反的是酿酒酵母,其与标志性代谢物共现关系均为显著负相关(Edge=8)。同样加纳液体乳杆菌显著正相关关系占比较大(显著正相关8,显著负相关2),与副干酪乳酪杆菌在整个微生物-标志性代谢物网络中呈现的模式相似。

图6 相关性分析结果
Fig.6 Correlation analysis results
酿酒酵母的代谢活动与标志性代谢物呈显著负相关,以负相关关系为主的乳酸菌还有食二酸迟缓乳杆菌(显著正相关1,显著负相关4)、恶味施莱弗乳杆菌(显著正相关0,显著负相关2)。这可能是由于随着水开菲尔pH逐渐降低,酿酒酵母代谢活跃快速消耗糖分,产生大量乙醇,这种环境变化不利于乳酸菌的生长[20],从而导致部分代谢产物减少。研究结果显示,尽管副干酪乳酪杆菌和酿酒酵母在水开菲尔发酵过程中并非优势菌种,但它们与大多数标志性代谢物之间存在显著相关性。这表明它们可能通过代谢产物影响主要菌群的生长和活动,在维持水开菲尔发酵体系的微生态平衡中发挥重要作用。
3 结论
本研究通过宏基因组与非靶向代谢组联用,对以恶味施莱弗乳杆菌、酒液体乳杆菌、食二酸迟缓乳杆菌、哈尔滨施莱弗乳杆菌为主要菌种的水开菲尔粒发酵的不同时间的水开菲尔菌群结构及代谢谱进行了时间动态分析,研究结果表明本实验中的水开菲尔在发酵过程中酒液体乳杆菌、哈尔滨施莱弗乳杆菌为优势菌种,标志性代谢物在发酵前期集中于糖类及其衍生物,而在发酵后期氨基酸、有机酸及其衍生物占据了更高的比例。此外,相关性分析揭示了在水开菲尔微生物—代谢物网络中以副干酪乳酪杆菌为代表的菌种与多个标志性代谢物之间呈现显著正相关关系,而以酿酒酵母为代表的菌种与多个标志性代谢物呈显著负相关关系。值得注意的是副干酪乳酪杆菌与酿酒酵母对维持水开菲尔发酵体系的代谢平衡发挥了重要作用。
[1] 尹琳琳, 陈志娜, 孙瑞雪, 等.水开菲尔粒发酵草莓汁在冷藏期间品质稳定性分析[J].食品工业科技, 2025, 46(2):301-307.
YIN L L, CHEN Z N, SUN R X, et al.Quality stability analysis of strawberry juice fermented by kefir granules during cold storage[J].Science and Technology of Food Industry, 2025, 46(2):301-307.
[2] 欧阳信, 伍蓉莉, 殷景淳, 等.水开菲尔粒发酵大豆粉转化大豆异黄酮糖苷的研究[J].食品科技, 2019, 44(3):62-69.
OUYANG X, WU R L, YIN J C, et al.Conversion of soybean isoflavone glycosides in soybean powder by fermentation with water kefir grain[J].Food Science and Technology, 2019, 44(3):62-69.
[3] PEND N M D, BENGOA A A, IRAPORDA C, et al.Water kefir:Factors affecting grain growth and health-promoting properties of the fermented beverage[J].Journal of Applied Microbiology, 2022, 133(1):162-180.
N M D, BENGOA A A, IRAPORDA C, et al.Water kefir:Factors affecting grain growth and health-promoting properties of the fermented beverage[J].Journal of Applied Microbiology, 2022, 133(1):162-180.
[4] EGEA M B, DOS SANTOS D C, DE OLIVEIRA FILHO J G, et al.A review of nondairy kefir products:Their characteristics and potential human health benefits[J].Critical Reviews in Food Science and Nutrition, 2022, 62(6):1536-1552.
[5] YE Z M, YANG X M, DENG B X, et al.Prevention of DSS-induced colitis in mice with water kefir microbiota via anti-inflammatory and microbiota-balancing activity[J].Food &Function, 2023, 14(15):6813-6827.
[6] 高芫超, 肖爱波, 王成, 等.水开菲尔和水开菲尔粒细菌多样性分析及乳酸菌分离鉴定[J].粮油食品科技, 2022, 30(1):182-189.
GAO Y C, XIAO A B, WANG C, et al.Bacterial diversity analysis of water kefir and water kefir granules and isolation and identification of lactic acid bacteria[J].Science and Technology of Cereals, Oils and Foods, 2022, 30(1):182-189.
[7] GUZEL-SEYDIM Z B, GÖK RMAKL
RMAKL Ç, GREENE A K.A comparison of milk kefir and water kefir:Physical, chemical, microbiological and functional properties[J].Trends in Food Science &Technology, 2021, 113:42-53.
Ç, GREENE A K.A comparison of milk kefir and water kefir:Physical, chemical, microbiological and functional properties[J].Trends in Food Science &Technology, 2021, 113:42-53.
[8] PATEL S H, TAN J P, BÖRNER R A, et al.A temporal view of the water kefir microbiota and flavour attributes[J].Innovative Food Science &Emerging Technologies, 2022, 80:103084.
[9] PAREDES J L, ESCUDERO-GILETE M L, VICARIO I M.A new functional kefir fermented beverage obtained from fruit and vegetable juice:Development and characterization[J].LWT, 2022, 154:112728.
[10] LYNCH K M, WILKINSON S, DAENEN L, et al.An update on water kefir:Microbiology, composition and production[J].International Journal of Food Microbiology, 2021, 345:109128.
[11] STADIE J, GULITZ A, EHRMANN M A, et al.Metabolic activity and symbiotic interactions of lactic acid bacteria and yeasts isolated from water kefir[J].Food Microbiology, 2013, 35(2):92-98.
[12] LIMA PARENTE FERNANDES M, CRISTINA DE SOUZA A, SÉRGIO PEDROSO COSTA P Jr, et al.Sugary kefir grains as the inoculum for developing a low sodium isotonic beverage[J].Food Research International, 2022, 157:111257.
[13] VERCE M, DE VUYST L, WECKX S.The metagenome-assembled genome of Candidatus Oenococcus aquikefiri from water kefir represents the species Oenococcus sicerae[J].Food Microbiology, 2020, 88:103402.
[14] LAUREYS D, DE VUYST L.Microbial species diversity, community dynamics, and metabolite kinetics of water kefir fermentation[J].Applied and Environmental Microbiology, 2014, 80(8):2564-2572.
[15] 钟凯, 何庆华, 吴永宁.乳杆菌属30a菌株(ATCC33222)的生长特性及代谢组学采样策略[J].卫生研究, 2009, 38(3):368-371.
ZHONG K, HE Q H, WU Y N.Growth characteristics and metabolomic sampling strategy of Lactobacillus sp.30a(ATCC33222)[J].Journal of Hygiene Research, 2009, 38(3):368-371.
[16] HAN G, VAISHNAVA S.Microbial underdogs:Exploring the significance of low-abundance commensals in host-microbe interactions[J].Experimental &Molecular Medicine, 2023, 55(12):2498-2507.
[17] LAUREYS D, AERTS M, VANDAMME P, et al.The buffer capacity and calcium concentration of water influence the microbial species diversity, grain growth, and metabolite production during water kefir fermentation[J].Frontiers in Microbiology, 2019, 10:2876.
[18] GHAMRY M, ZHAO W, LI L.Impact of Lactobacillus apis on the antioxidant activity, phytic acid degradation, nutraceutical value and flavor properties of fermented wheat bran, compared to Saccharomyces cerevisiae and Lactobacillus plantarum[J].Food Research International, 2023, 163:112142.
[19] ARRIETA-ECHEVERRI M C, FERNANDEZ G J, DUARTE-RIVEROS A, et al.Multi-omics characterization of the microbial populations and chemical space composition of a water kefir fermentation[J].Frontiers in Molecular Biosciences, 2023, 10:1223863.
[20] MA D, WANG B, XIAO S, et al.Non-targeted metabolomics unveils metabolic spectrum characteristics and core metabolite interaction networks in water kefir fermentation[J].LWT, 2024, 195:115840.
[21] LAUREYS D, LEROY F, HAUFFMAN T, et al.The type and concentration of inoculum and substrate as well as the presence of oxygen impact the water kefir fermentation process[J].Frontiers in Microbiology, 2021, 12:628599.