冬虫夏草(Ophiocordyceps sinensis)是产于青藏高原地区的传统名贵中药材,是冬虫夏草发酵菌丝侵染蝙蝠蛾幼虫形成的虫菌复合体。该药材主要产于中国青海、西藏、四川、云南、甘肃等省及自治区的高寒地带和高山草原[1-2]。研究发现冬虫夏草具有免疫调节、抗氧化、抗肿瘤、降血糖等药理作用[3-7]。冬虫夏草发酵菌丝由冬虫夏草无性型菌株扩大培养而得,具有与野生冬虫夏草相似的化学成分和药理功效[8-9]。由于苛刻的生长条件、漫长的生活史及过度采挖,冬虫夏草野生资源十分稀缺且价格昂贵,因此以其无性型菌株发酵所得的冬虫夏草菌丝体日益受重视,具有广阔的市场开发前景。
核苷类物质是冬虫夏草及其发酵菌丝的主要活性成分,具备舒张血管、降低血压、减慢心率、保护肾脏和抗氧化等药理功效,其中腺苷是《中国药典》(2020版)评价冬虫夏草质量的化学标志物[10]。不同冬虫夏草菌株间具有不同生长特性和代谢物合成特点,因此通过发酵所得的冬虫夏草菌丝质量也不同。近年来,冬虫夏草发酵菌丝的研究主要集中于发酵条件对核苷类成分含量的影响,以及冬虫夏草发酵菌丝与天然冬虫夏草在营养成分和功效作用方面的差异,而基于不同菌株的冬虫夏草发酵菌丝间的质量变化情况尚不明确。此外,目前对冬虫夏草发酵菌丝质量评价方式较单一,通常采用其腺苷含量作为判定标准,难以体现冬虫夏草发酵菌丝综合品质。
HPLC操作简便、分析速度快,是目前中药指纹图谱分析及质量评价最常使用的方法。通过指纹图谱结合分层聚类分析(hierarchical cluster analysis, HCA)、主成分分析(principal component analysis, PCA)以及正交偏最小二乘法-判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)等化学模式识别法和层次分析(analytic hierarchy process, AHP)-熵权法(entropy weight method, EWM)综合分析,食用及药用资源质量[11-12]。生物体内的氧化应激反应通常与多种人类疾病发生密切相关,如衰老、癌症、神经退行性疾病等[13]。冬虫夏草发酵菌丝水提取物含有多种天然抗氧化成分,表现出较好的抗氧化活性[14]。抗氧化活性的发挥能够减轻氧化应激反应,避免由于活性氧引发的细胞损伤,能够综合体现食品和中药材中多重药理功效间的协同效应[15]。本研究以8种不同来源的冬虫夏草菌株发酵所得菌丝体为对象,采用HPLC指纹图谱分析结合化学模式识别评价和主要核苷类定量分析,以及抗氧化活性比较,以此综合考察不同来源的冬虫夏草发酵菌丝质量特性与差异,研究结果可为冬虫夏草发酵菌丝资源的开发利用提供数据支撑。
1 材料与方法
1.1 材料与仪器
供试菌株为分离自不同来源冬虫夏草的冬虫夏草菌,见表1。
表1 供试菌株信息
Table 1 Information of tested strains
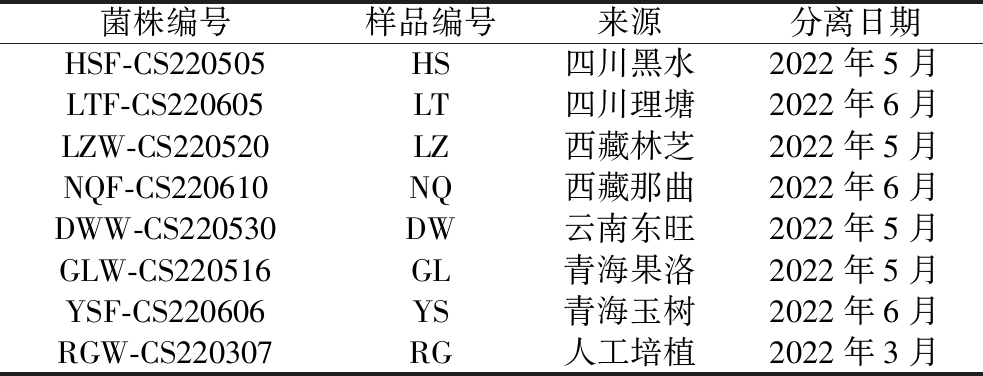
菌株编号样品编号来源分离日期HSF-CS220505HS四川黑水2022年5月LTF-CS220605LT四川理塘2022年6月LZW-CS220520LZ西藏林芝2022年5月NQF-CS220610NQ西藏那曲2022年6月DWW-CS220530DW云南东旺2022年5月GLW-CS220516GL青海果洛2022年5月YSF-CS220606YS青海玉树2022年6月RGW-CS220307RG人工培植2022年3月
V1100DB紫外分光光度计,上海美普达仪器有限公司;H1650-W微量台式高速离心机,湖南湘仪实验室仪器开发有限公司。
DPPH、ABTS(分析纯),上海源叶生物科技有限公司;尿苷、鸟苷、肌苷、胞苷、腺苷(纯度≥98%),上海阿拉丁生化科技股份有限公司,其余试剂均为分析纯。
1.2 实验方法
1.2.1 菌株培养
固体优化培养基(g/L):土豆300,牛肉膏4,葡萄糖40,MgSO4 0.15,维生素B1 0.05,酵母浸粉1,KH2PO4 1,氯霉素0.1。
冬虫夏草菌于18 ℃培养45 d后真空冷冻干燥,研磨后保存于-20 ℃。
1.2.2 核苷类物质分析
1.2.2.1 核苷类物质提取
取适量样品,料液比为1∶40(g∶mL),300 W、50 ℃超声波提取40 min,10 000 r/min离心10 min,上清液过0.45 μm滤膜后备用。
1.2.2.2 核苷类标准曲线绘制
配制含腺苷、鸟苷、胞苷、尿苷标准品的100 μg/mL标准品溶液,依次稀释后过0.45 μm滤膜备用。
1.2.2.3 色谱条件
色谱柱Hypersil BDS C18(4.6 mm×250 mm,5 μm);流动相为甲醇(A)- 0.3%乙酸水(B);洗脱梯度:0~10 min:100% B;10~20 min:100%~92% B;20~30 min:92%~80% B;30~40 min:80% B,流速1 mL/min;检测波长260 nm;柱温室温;进样量20 μL。
1.2.2.4 方法学验证
通过《中药色谱指纹图谱相似度(2012)评价系统》比较HPLC指纹图谱的相似度,判断技术是否符合要求。精密度实验:取同一个样品,连续进样5次,记录HPLC指纹图谱,以13号峰为参照峰,考察实验方法的精密度。重复性实验:取同一批样品5份,按照水溶性样品制备方法提取样品分别进样,以13号峰为参照峰,考察实验方法的可重复性。稳定性实验:取同一个样品,分别在提取后0、2、6、12、24、48 h进样,以13号峰为参照峰,考察实验方法的稳定性。
1.2.3 抗氧化活性测定
1.2.3.1 样品溶液制备
称取适量样品,料液比1∶40(g∶mL),300 W、50 ℃超声波提取40 min,12 000 r/min离心10 min,取上清液浓缩为50 mg/mL原液,4 ℃保存。
1.2.3.2 DPPH自由基清除活性
参考王振宇等[16]的方法并略作修改。DPPH自由基清除率计算如公式(1)所示:
清除率![]()
(1)
式中:Ai,实验组的吸光值;Aj,实验对照组的吸光值;A0,空白对照组的吸光值。
1.2.3.3 ABTS阳离子自由基清除活性
参考王振宇等[16]的方法并略作修改。ABTS阳离子自由基清除率计算如公式(2)所示:
清除率![]()
(2)
式中:As,实验组吸光值;Am,实验对照组吸光值;A0,空白对照吸光值。
1.2.3.4 总还原力
参考吴捷等[17]的方法测定样品总还原力,并略作修改。
1.2.4 数据统计分析
所有实验均开展3个重复组,结果采用“平均值±标准差”表示。通过SPSS Statistics 25统计分析软件对数据进行方差分析(analysis of variance,ANOVA)和样品清除自由基半抑制浓度(half inhibitory concentration,IC50)值计算,使用Origin 2022进行PCA和聚类分析,采用SIMCA-P 14.1进行OPLS-DA分析。
1.2.5 AHP-EWM综合质量评价
选择4种核苷含量和3种体外抗氧化活性共7个指标进行分析,本研究采用极值法消除量纲,使数据具有可比性。利用SPSSPRO平台构建判断优先级矩阵并进行分析,计算AHP权重系数。参考张远帆等[18]的方法,对标准化后的数据进行分析,计算EWM权重系数。将上述2个权重系数按公式(3)计算综合权重系数F综合,进一步根据公式(4)计算综合评分W综合。
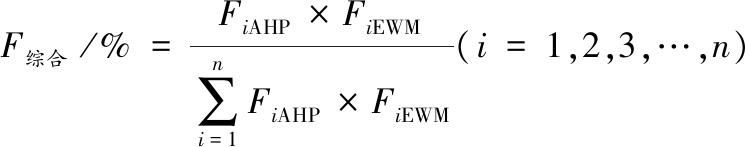
(3)
(4)
式中:FiAHP,第i个指标AHP权重系数;FiEWM,第i个指标EWM权重系数;ci,第i个指标标准化后的值。
2 结果与分析
2.1 方法学考察
精密度实验:取同一冬虫夏草菌样品,按1.2.2.4节方法连续进样5次,其共有色谱峰相对保留时间相对标准偏差(relative standard deviation,RSD)均<3%,相对峰面积RSD<3%(表2),表明仪器精密度良好,能满足实验要求。
表2 方法精密度、重复性与稳定性考察结果
Table 2 Results of precision,repeatability,and stability test
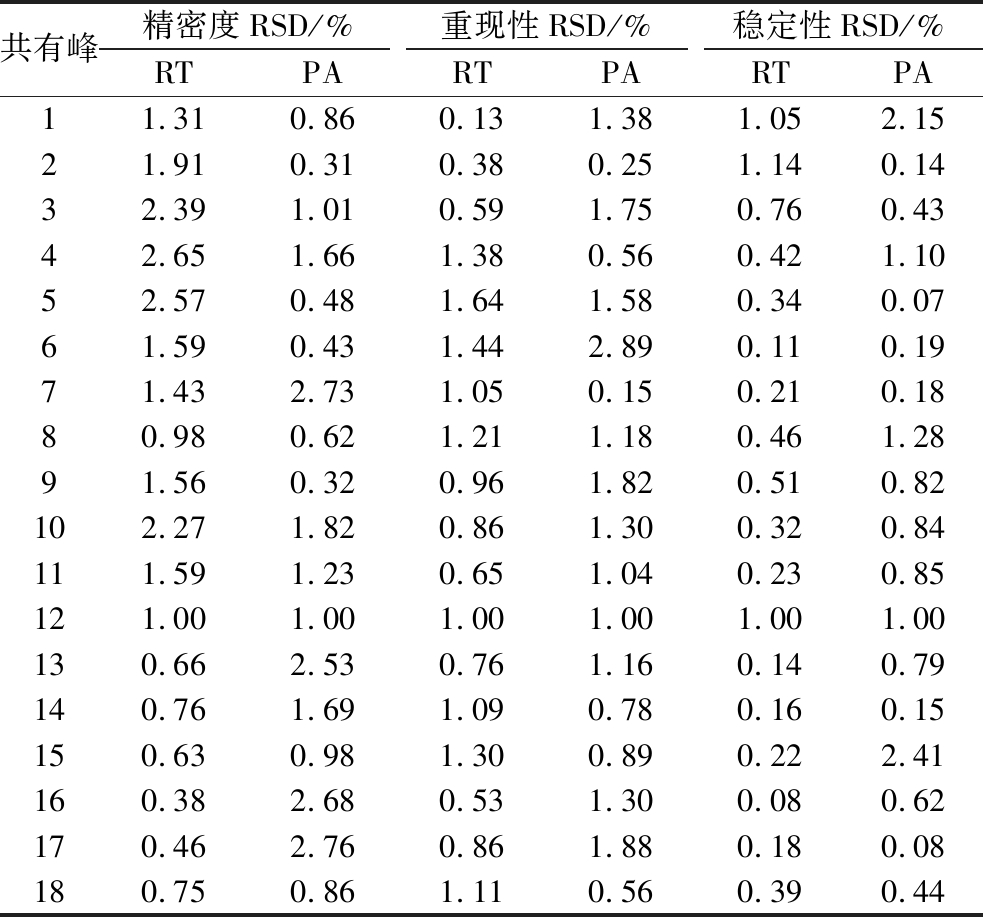
共有峰精密度RSD/%重现性RSD/%稳定性RSD/%RTPARTPARTPA11.31 0.86 0.131.38 1.05 2.15 21.91 0.31 0.38 0.25 1.14 0.14 32.39 1.01 0.59 1.75 0.76 0.43 42.65 1.66 1.38 0.56 0.42 1.10 52.57 0.48 1.64 1.58 0.34 0.07 61.59 0.43 1.44 2.89 0.11 0.19 71.43 2.73 1.050.15 0.21 0.18 80.980.62 1.21 1.18 0.46 1.28 91.560.32 0.961.82 0.51 0.82 102.271.82 0.86 1.30 0.320.84 111.591.23 0.651.04 0.23 0.85 121.00 1.00 1.00 1.00 1.00 1.00 130.66 2.53 0.76 1.16 0.14 0.79 140.76 1.69 1.09 0.78 0.160.15 150.63 0.98 1.300.89 0.22 2.41 160.38 2.68 0.531.30 0.08 0.62 170.46 2.76 0.861.88 0.18 0.08 180.75 0.86 1.110.56 0.39 0.44
注:RT-相对保留时间;PA-相对峰面积。
重现性实验:取同一冬虫夏草菌样品,按1.2.2.4节样品制备方法平行5次实验,按上述色谱条件依次检测,其共有色谱峰相对保留时间RSD均<3%,相对峰面积RSD<3%(表2),表明该方法可重现性良好,能满足实验要求。
稳定性实验:取同一冬虫夏草菌样品,按1.2.2.4节方法分别在0、2、6、12、24、48 h进行检测,其共有色谱峰相对保留时间RSD均<3%,相对峰面积RSD<3%(表2),表明样品提取液在48 h内保持稳定,能满足实验要求。
2.2 冬虫夏草菌HPLC指纹图谱的建立及相似度评价
不同来源冬虫夏草发酵菌丝按照1.2.2.3节、1.2.2.4节方法进行检测,记录其色谱图,导入《中药色谱指纹图谱相似度(2012)评价系统》,24批样品匹配色谱图见图1,共获得15个共有峰。以S1样品为参照图谱,采用中位数法生成冬虫夏草发酵菌丝对照指纹图谱,以标准品溶液的HPLC图谱作为参照,指认出不同来源冬虫夏草发酵菌丝匹配色谱图中5个共有峰,分别是尿苷(7号峰)、胞苷(8号峰)、肌苷(10号峰)、鸟苷(11号峰)、腺苷(13号峰)(图2)。冬虫夏草发酵菌丝中均包含3个峰高较高且峰面积较大的色谱峰,分别是尿苷、鸟苷和腺苷,而肌苷含量较低。不同来源冬虫夏草发酵菌丝匹配色谱图中共有峰面积占总色谱峰面积在60.60%~87.40%。采用中药色谱指纹图谱相似度评价系统计算不同样品的相似度,结果见表3,冬虫夏草发酵菌丝色谱图与对照指纹图谱的相似度在0.921~0.984,其中LT与对照图谱的相似度最高。结果表明8种来源冬虫夏草发酵菌丝水溶性成分组成相似,但各成分含量存在差异。
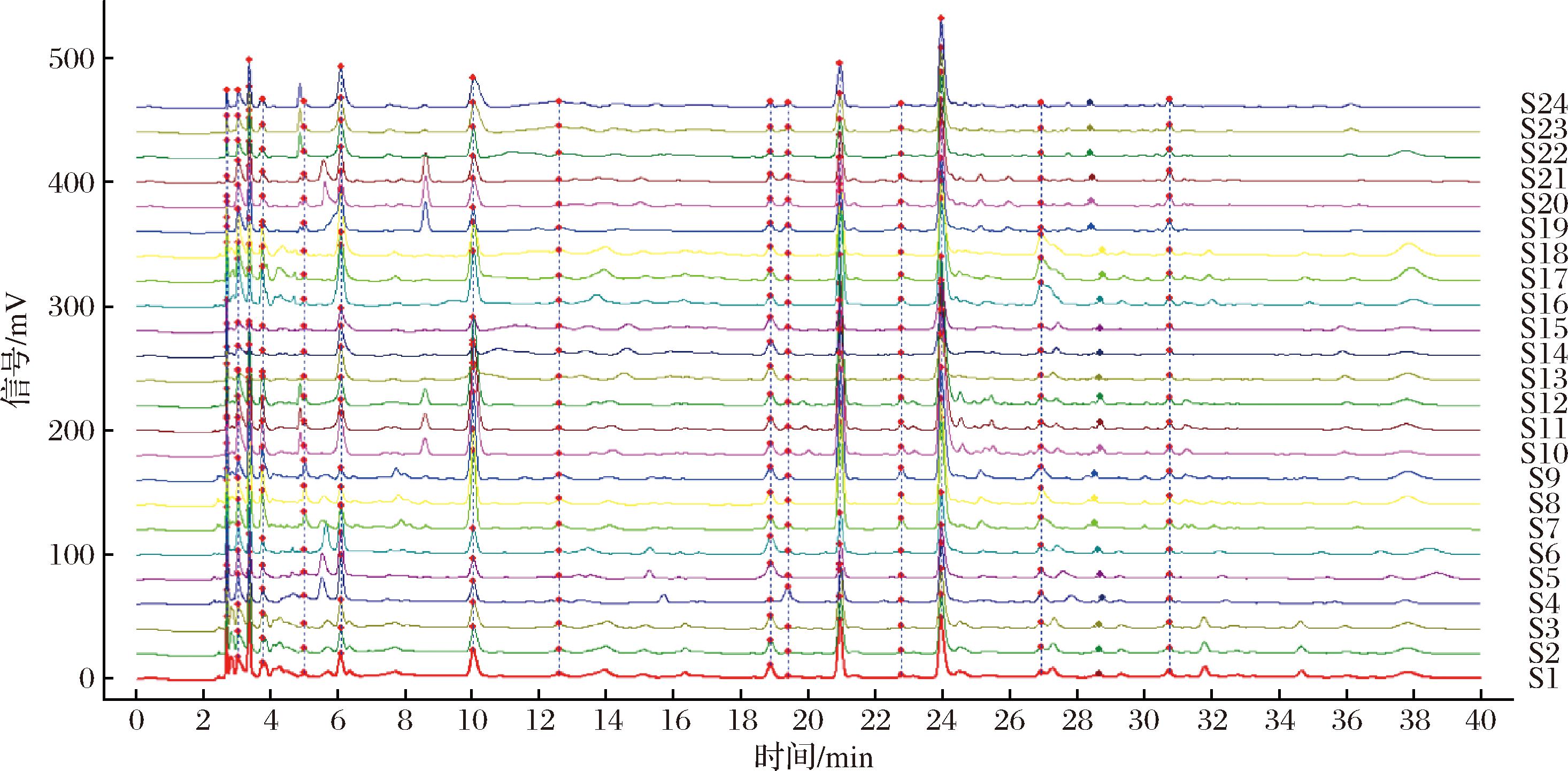
S1~S3-DW;S4~S6-GL;S7~S9-HS;S10~S12-LT;S13~S15-LZ;S16~S18-NQ;S19~S21-YS;S22~S24-RG。
图1 冬虫夏草菌色谱图叠加比较
Fig.1 Chromatographic superposition and comparison of O.sinensis
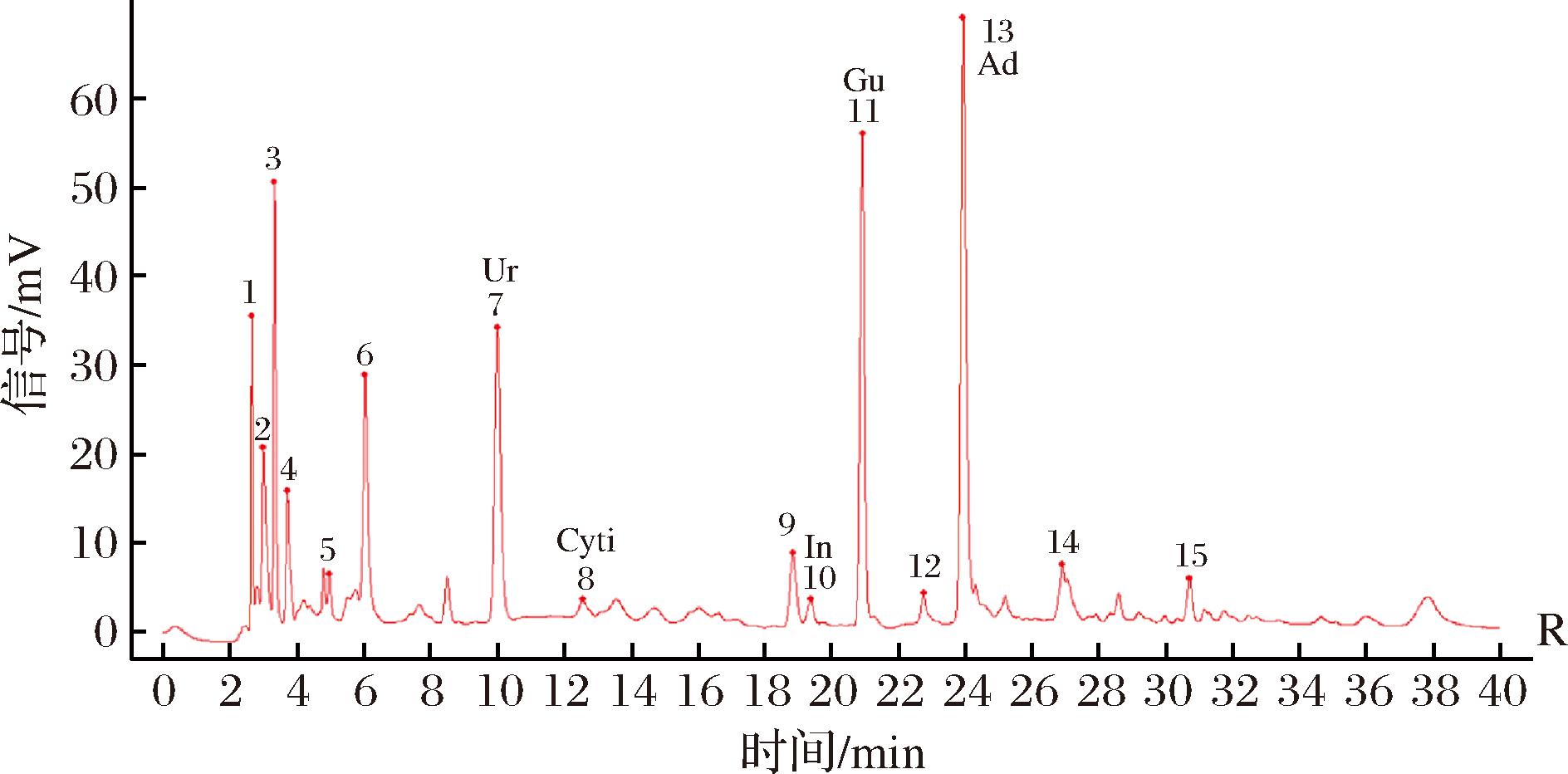
Ur-尿苷;Cyti-胞苷;In-肌苷;Gu-鸟苷;Ad-腺苷。
图2 冬虫夏草菌HPLC对照指纹谱
Fig.2 HPLC fingerprint of O.sinensis
表3 冬虫夏草菌相似度评价结果
Table 3 Similarity evaluation of O.sinensis
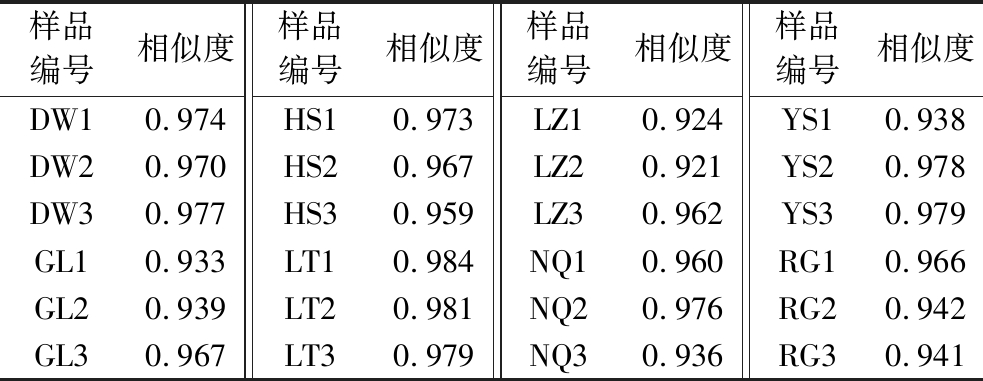
样品编号相似度样品编号相似度样品编号相似度样品编号相似度DW10.974HS10.973LZ10.924YS10.938DW20.970HS20.967LZ20.921YS20.978DW30.977HS30.959LZ30.962YS30.979GL10.933LT10.984NQ10.960RG10.966GL20.939LT20.981NQ20.976RG20.942GL30.967LT30.979NQ30.936RG30.941
2.3 化学模式识别
基于共有峰面积对冬虫夏草发酵菌丝进行聚类分析,结果显示不同菌株来源样品各自聚为一类。当距离值为6时,所有样品被聚为两大类,其中DW、GL、LZ、YS和RG归为一类,LT、HS和NQ归类为一类(图3)。通过聚类分析能够实现不同来源的冬虫夏草发酵菌丝的辨别,该发现与对野生冬虫夏草的研究相符合[19]。
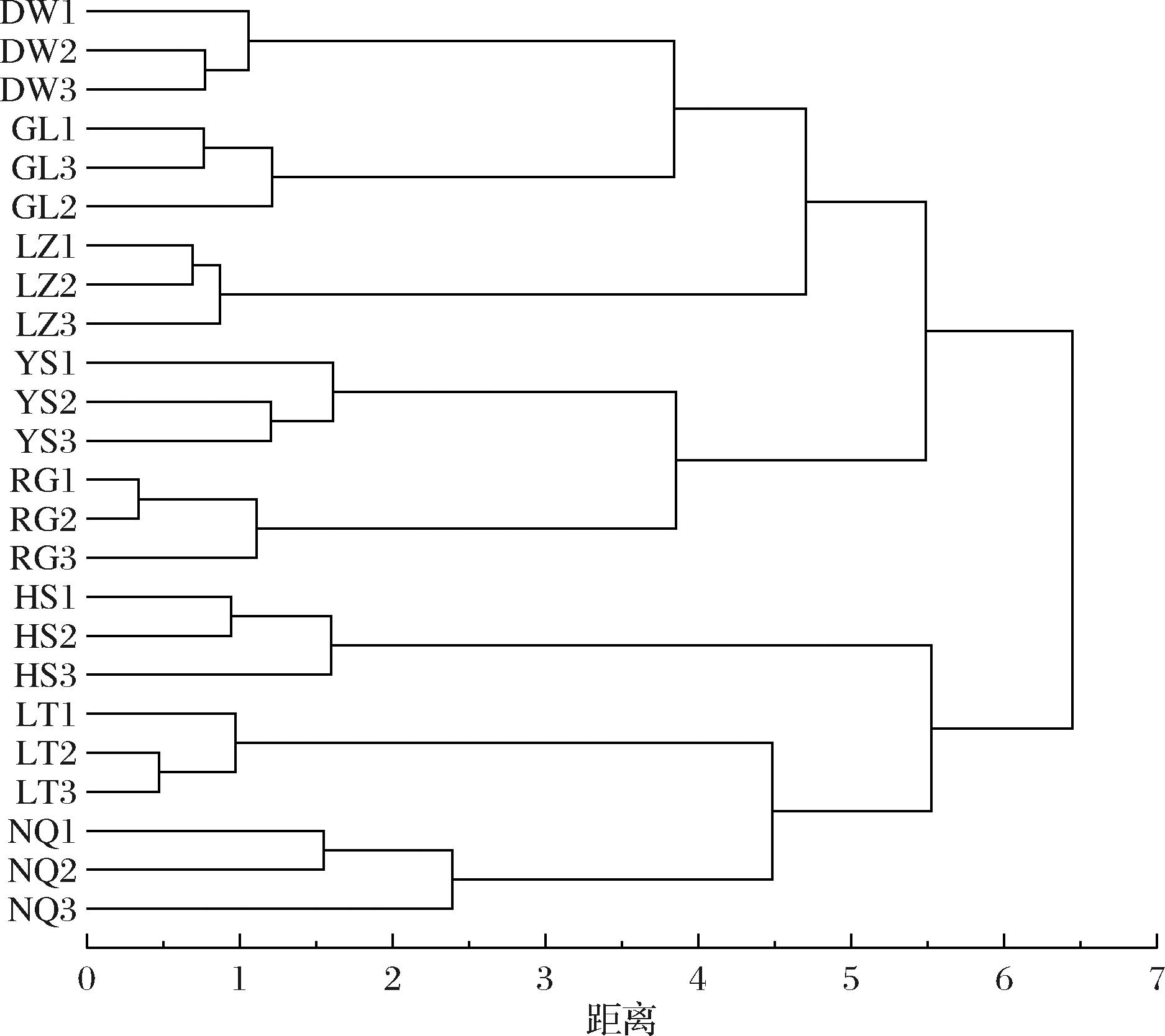
图3 基于共有峰面积的冬虫夏草发酵菌丝聚类图
Fig.3 Dendrogram of O.sinensis based on common peaks
以24批冬虫夏草发酵菌丝共有峰面积为变量进行PCA,PCA得分图结果与聚类分析结果相一致(图4),表明不同来源冬虫夏草发酵菌丝化学组成具有一定差异。前5个主成分累积方差贡献率为93.65%,PCA表征了冬虫夏草发酵菌丝指纹的大部分信息。进一步利用OPLS-DA筛选导致差异区分的标志化合物,模型R2X为0.998,R2Y为0.976,Q2为0.908,表明模型稳定可靠,未过度拟合,具有较好的预测性。根据变量投影重要性值(variable importance for projection,VIP)>1.0共筛选出5种成分,分别为腺苷、鸟苷和尿苷,以及未能指定的3号和6号色谱峰(图5),表明这些成分对冬虫夏草发酵菌丝的区分有重要贡献,是导致其质量差异的潜在标志物。
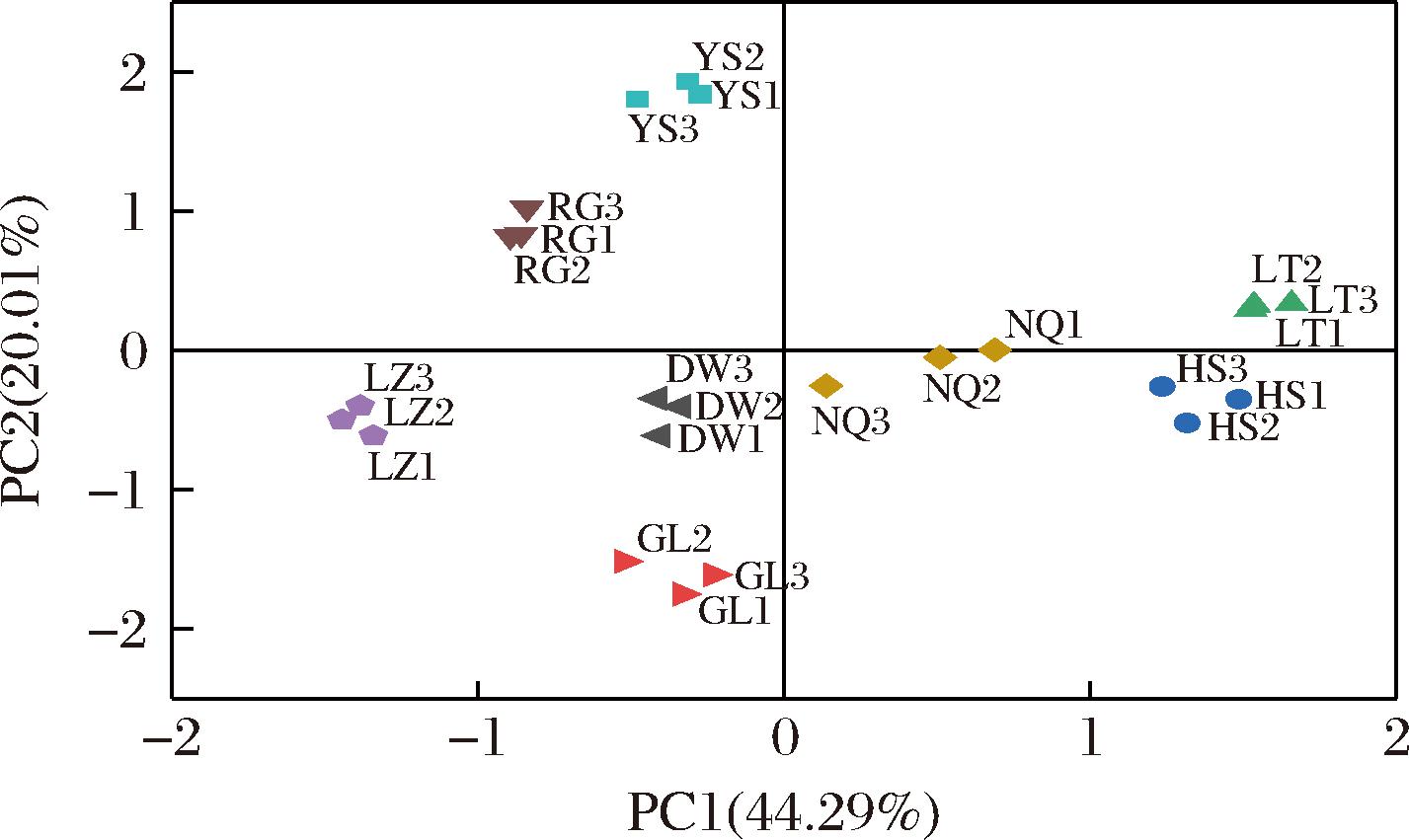
图4 基于共有峰面积的冬虫夏草发酵菌丝PCA得分图
Fig.4 PCA score plot of O.sinensis based on the common peaks
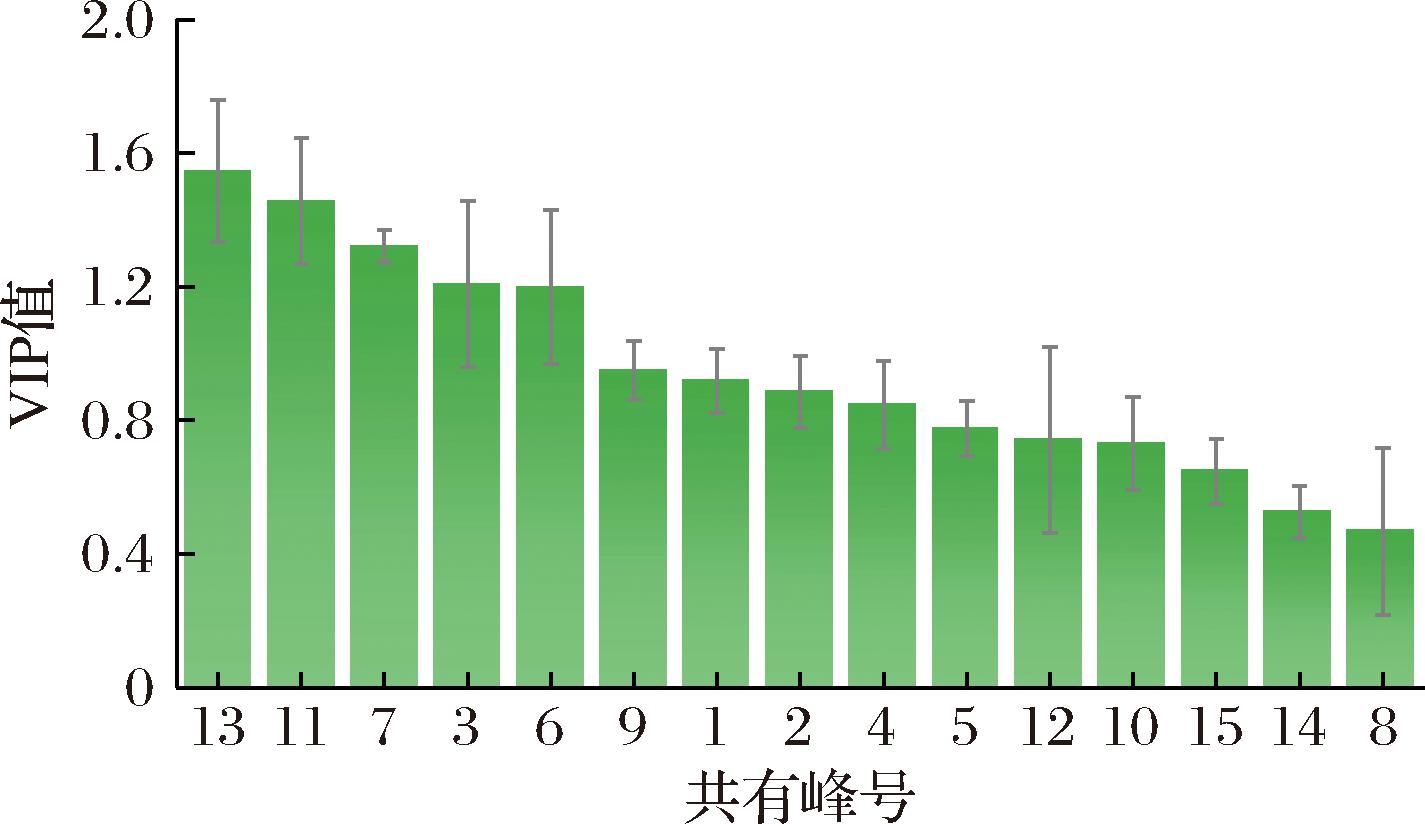
图5 冬虫夏草发酵菌丝OPLS-DA模型共有峰VIP得分值
Fig.5 VIP scores of the common peaks of O.sinensis mycelium in OPLS-DA model
2.4 核苷类成分含量分析
2.4.1 核苷标准曲线
根据不同浓度核苷标准品与其对应峰面积拟合得到线性回归方程,如表4所示。各化合物RSD<2%,线性相关系数均>0.999,结果表明各核苷标准品在质量浓度为0.5~100 μg/mL曲线线性关系良好,能够用于后续冬虫夏草菌样品中核苷类成分的定量分析。
表4 核苷成分标准品回归方程
Table 4 Linear regression for four nucleosides

标准品回归方程R2尿苷Y=47.925X-0.437 90.999 9胞苷Y=28.322X-7.566 60.999 9腺苷Y=57.140X-11.7270.999 9鸟苷Y=45.531X-3.851 70.999 9
2.4.2 核苷类成分含量测定
基于标准曲线计算结果可知,8种来源冬虫夏草发酵菌丝中主要核苷类为腺苷(0.801 6~2.706 2 mg/g)、鸟苷(0.465 8~2.515 5 mg/g)和尿苷(0.458 1~1.739 7 mg/g),而胞苷含量较低(0.094 3~0.232 8 mg/g)。4种核苷类成分总含量为1.888 6~7.086 0 mg/g,含量从高到低依次为LT>HS>NQ>RG>YS>DW>GL>LZ。方差分析结果显示,LT、HS和NQ中核苷类成分含量显著高于其他样品(P<0.05),三者之间也存在显著差异(P<0.05);RG、YS、DW和GL之间核苷类成分总含量差异不显著(P>0.05)(图6)。单独比较不同核苷类含量发现,冬虫夏草菌丝中腺苷、鸟苷和尿苷的含量分布特征相一致,在LT和HS中含量显著高于其他样本(P<0.05);YS和RG中胞苷含量最高,其次为NQ、DW和GL,HS和LT中显著低于其他样本(P<0.05)(图7)。
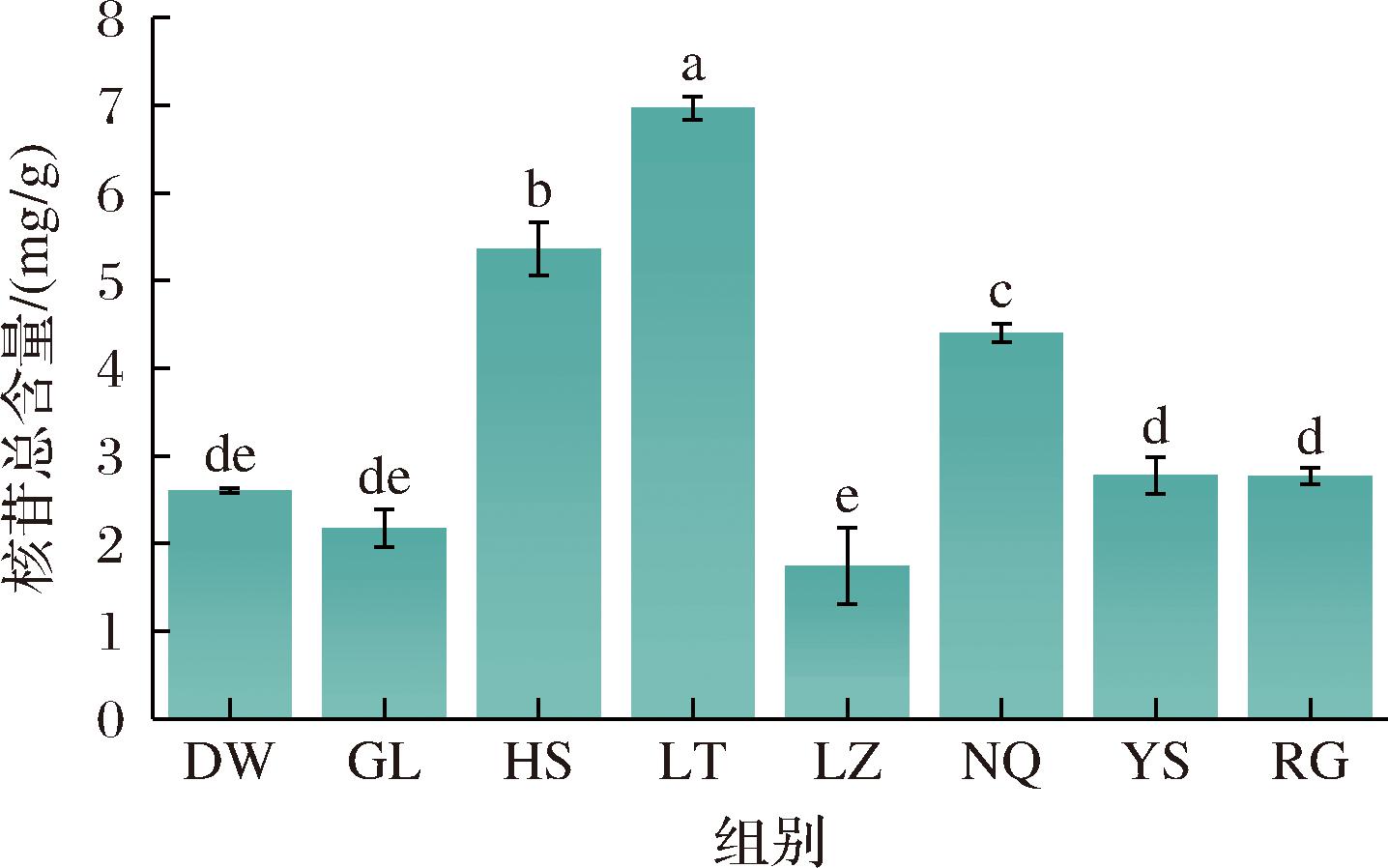
图6 冬虫夏草菌核苷类成分含量
Fig.6 Content of nucleosides of O.sinensis
注:图中不同小写字母代表差异显著(P<0.05)(下同)。
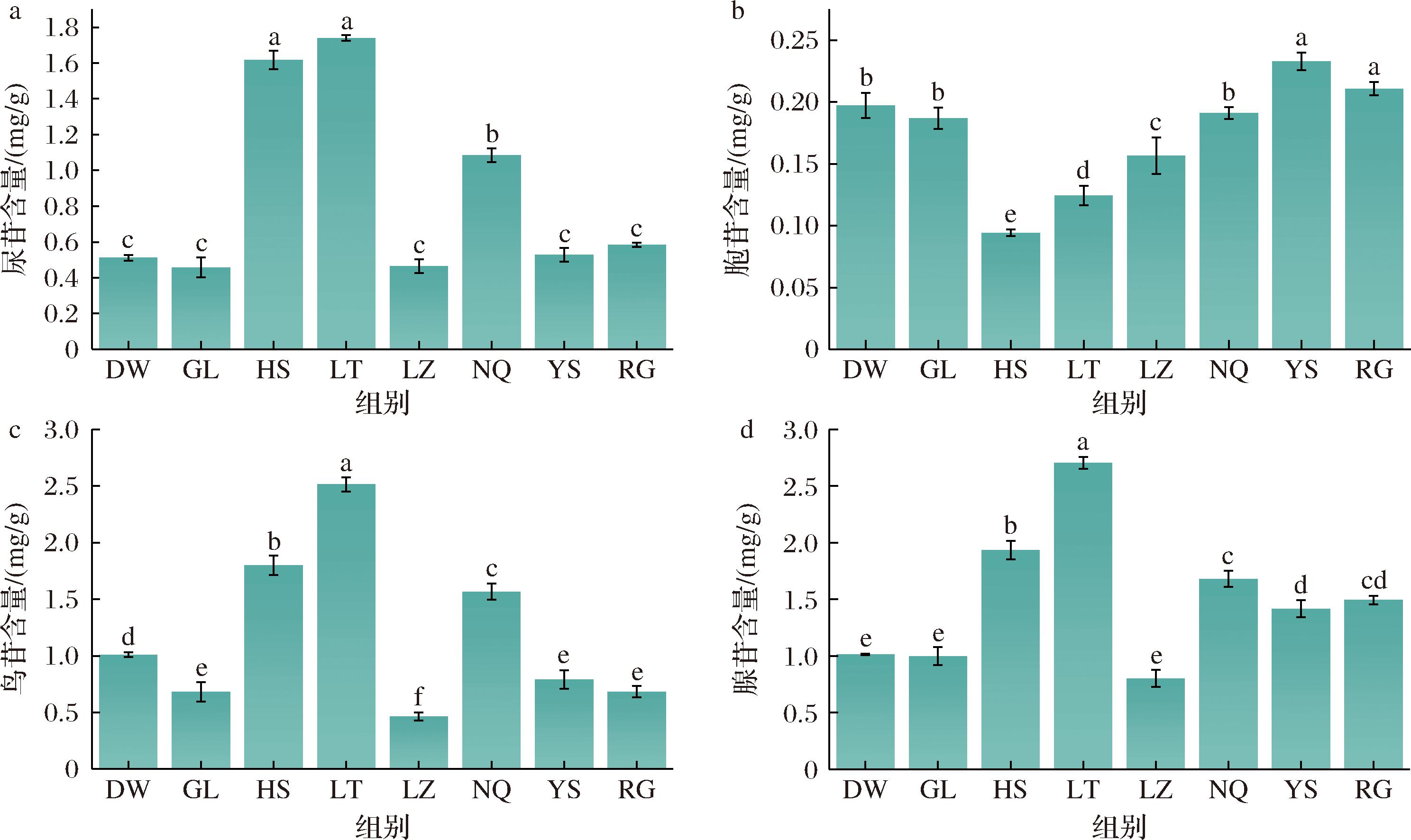
a-尿苷含量;b-胞苷含量;c-鸟苷含量;d-腺苷含量
图7 冬虫夏草菌核苷类成分分布
Fig.7 Distribution of nucleosides of O.sinensis
腺苷、鸟苷和尿苷是冬虫夏草以及冬虫夏草发酵菌丝中的主要核苷类成分,广泛分布在虫草属真菌中[20-22]。现已有许多研究证实核苷类成分具有生物活性,如腺苷、鸟苷、尿苷等均具有免疫调节作用,并且腺苷对肿瘤细胞生长增殖有一定的抑制作用[23]。不同来源冬虫夏草发酵菌丝中总核苷含量呈显著差异,提示其药理功效也可能发生变化。
2.5 抗氧化活性
抗氧化活性结果表明,所有样品均有较好的还原力和自由基清除活性,与前人研究结果一致[24]。总还原力活性随样品浓度的升高而升高,各样品的总还原力由高到低依次为:HS>LT>GL>NQ>DW>RG>YS>LZ(图8)。
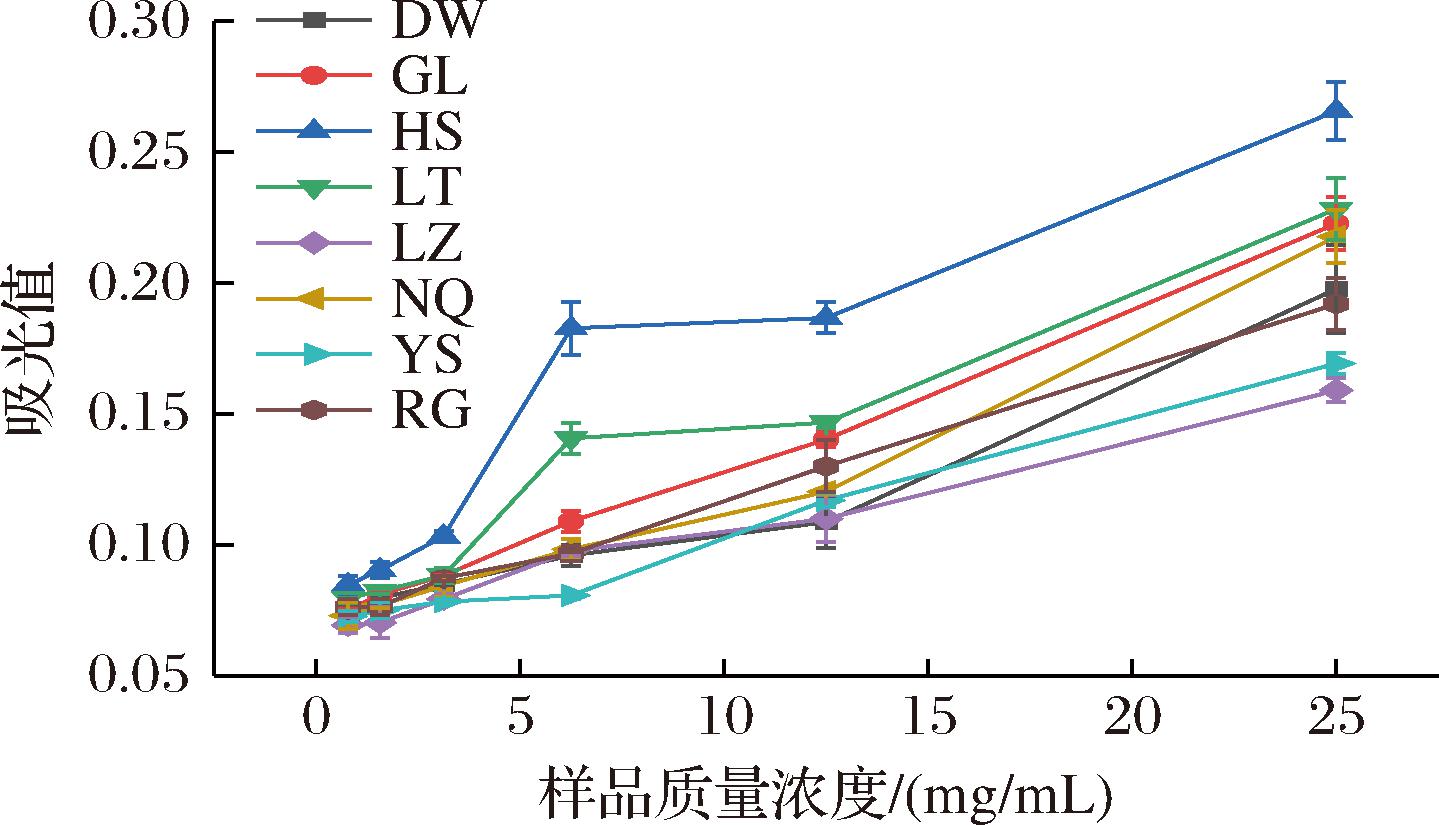
图8 冬虫夏草菌总还原力
Fig.8 Total reducing power of O.sinensis
DPPH自由基和ABTS阳离子自由基清除率结果见图9、图10,所有冬虫夏草发酵菌丝DPPH自由基的IC50值在11.505~67.132 mg/mL,ABTS阳离子自由基的IC50值在9.129~50.126 mg/mL,其中LT的DPPH自由基和ABTS阳离子自由基清除力最强,IC50分别为11.505 mg/mL和9.129 mg/mL;其次为NQ和HS样品,LZ、GL和DW对2种自由基的清除能力远低于其他样品(表5)。综上可知,不同来源冬虫夏草发酵菌丝间抗氧化活性存在一定差异,表明菌株类型对冬虫夏草发酵菌丝中抗氧化活性物质的积累有重要影响[15]。
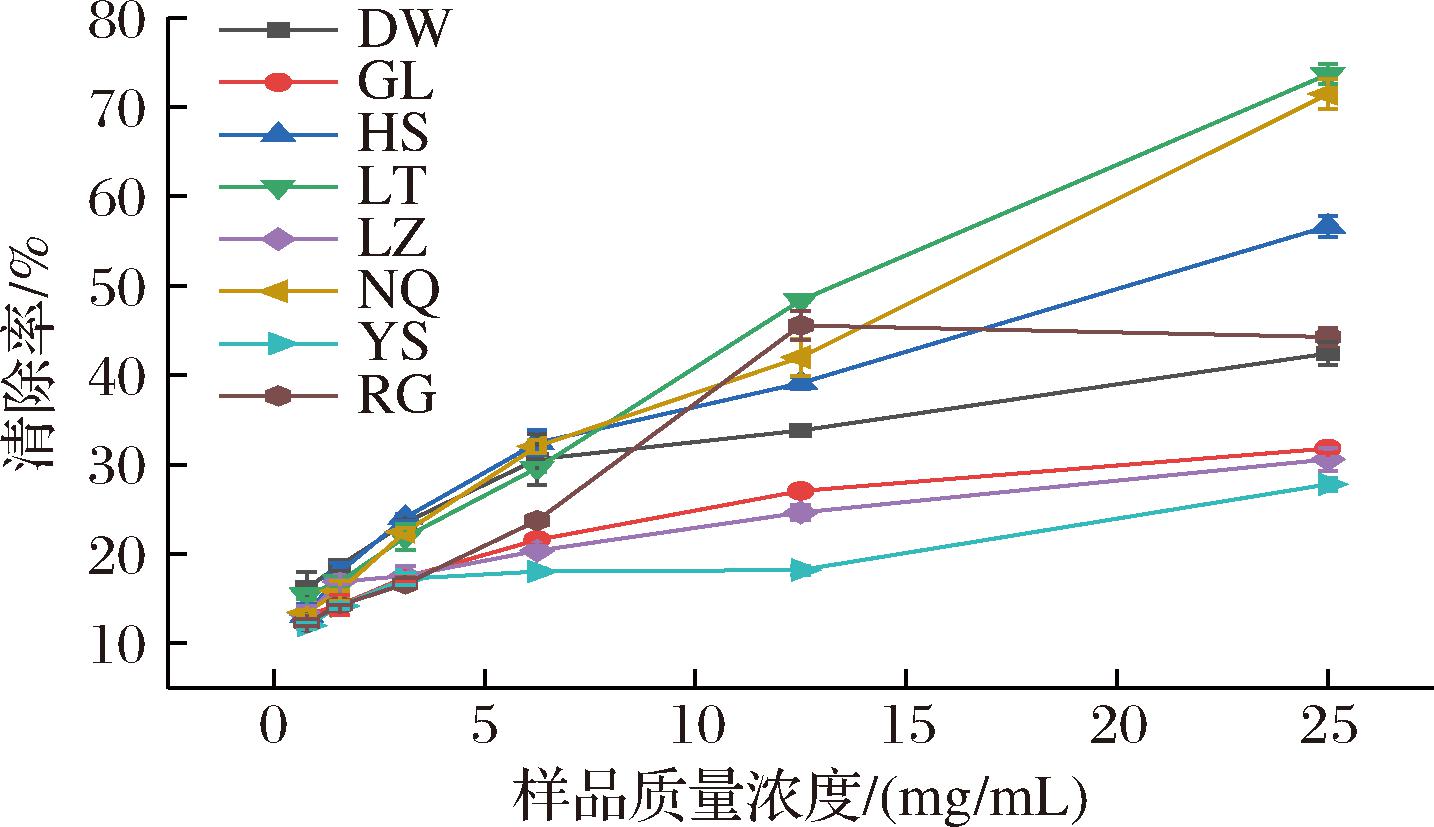
图9 冬虫夏草菌DPPH自由基清除率
Fig.9 DPPH free radical clearance rate of O.sinensis
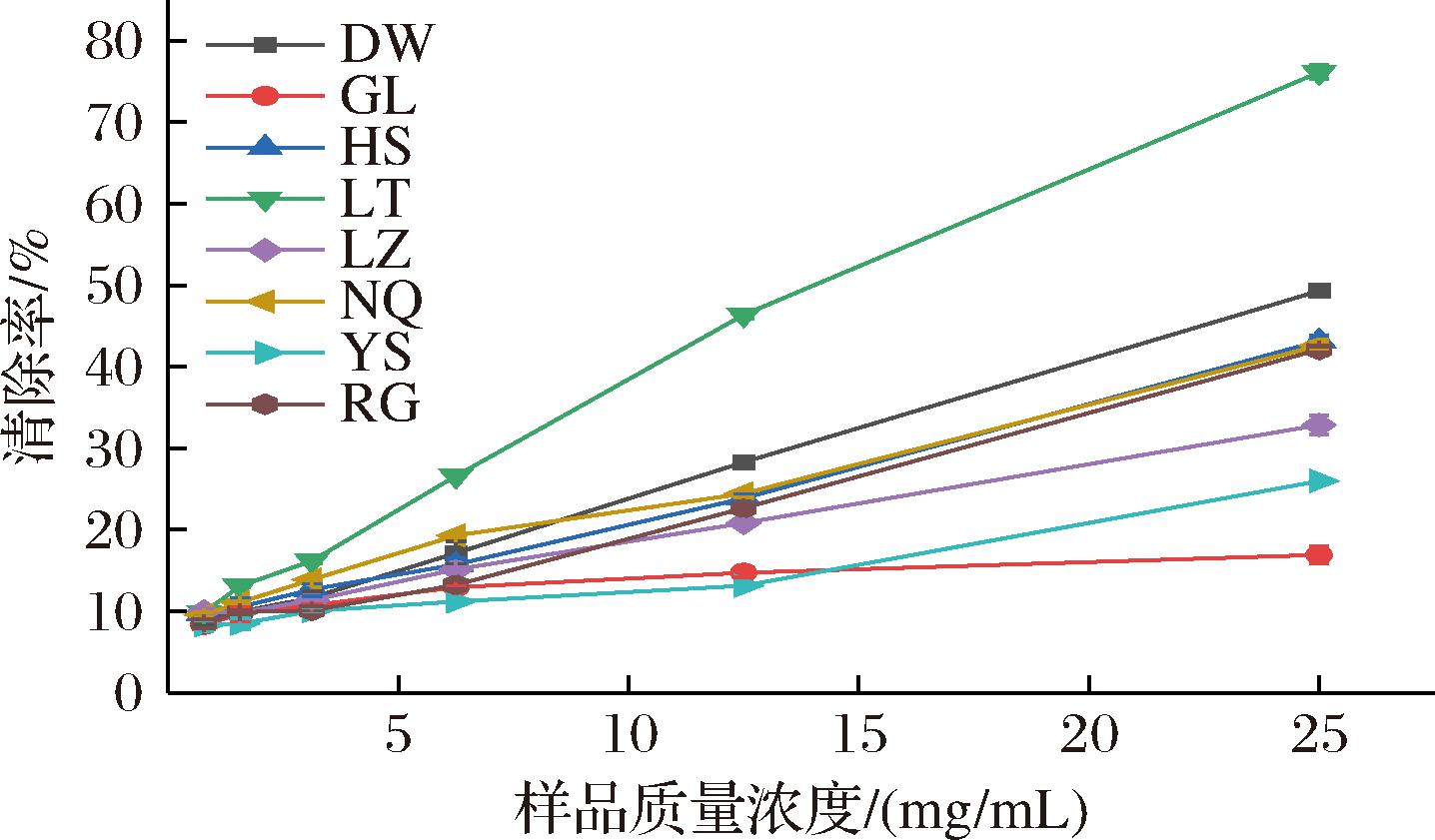
图10 冬虫夏草菌ABTS阳离子自由基清除率
Fig.10 ABTS cationic radical clearance rate of O.sinensis
表5 冬虫夏草菌自由基半抑制浓度
Table 5 Free radical half-inhibitory concentration of O.sinensis
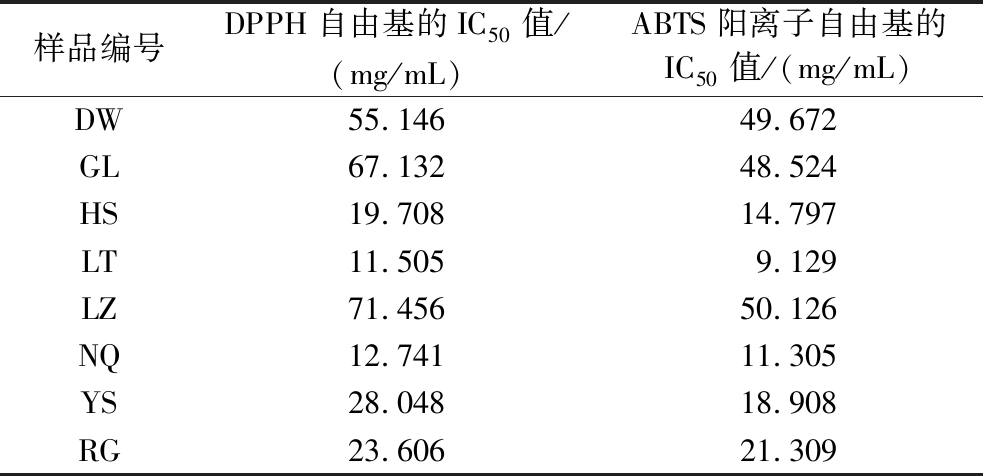
样品编号DPPH自由基的IC50值/(mg/mL)ABTS阳离子自由基的IC50值/(mg/mL)DW55.14649.672GL67.13248.524HS19.70814.797LT11.5059.129LZ71.45650.126NQ12.74111.305YS28.04818.908RG23.60621.309
2.6 AHP-EWM综合评价
构建4种核苷成分和3个抗氧化活性共7个指标的层次分析判断矩阵(表6),计算权重系数。对结果进行一致性检验,CI=0.039,CR=0.029。其中,CI≠0,CR<0.1,表明优先级判断矩阵一致性良好,权重系数有效。
表6 层次分析矩阵
Table 6 Analytic hierarchy matrix
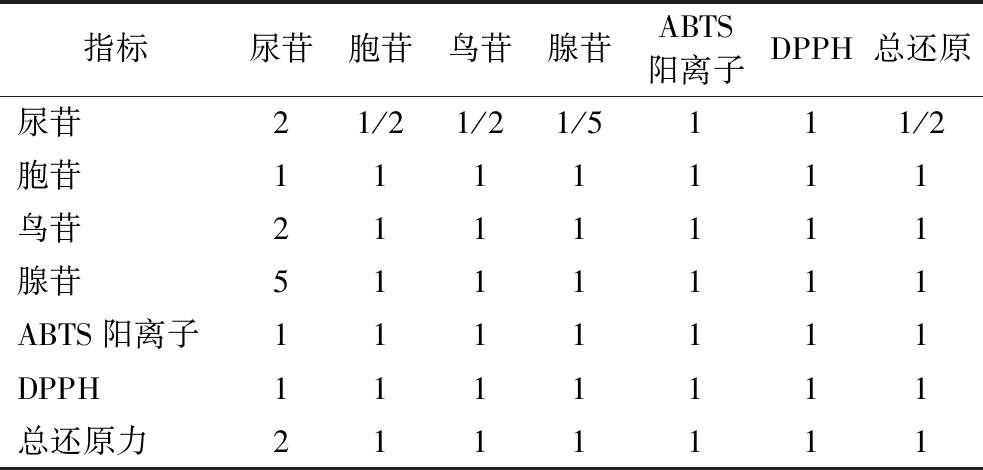
指标尿苷胞苷鸟苷腺苷ABTS阳离子DPPH总还原尿苷21/21/21/5111/2胞苷1111111鸟苷2111111腺苷5111111ABTS阳离子1111111DPPH1111111总还原力2111111
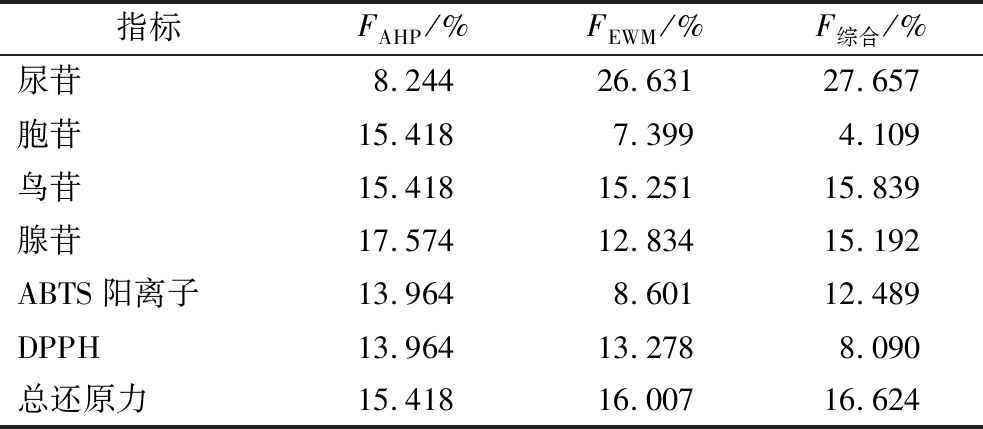
确定EWM权重系数,结合AHP权重系数计算综合权重系数(表7),结果显示尿苷、总还原力、鸟苷和腺苷综合权重较高,这4个指标在质量评价体系中起重要作用。
表7 AHP-EWM评价指标权重
Table 7 Evaluation index weights of AHP-EWM
指标FAHP/%FEWM/%F综合/%尿苷8.24426.63127.657胞苷15.4187.3994.109鸟苷15.41815.25115.839腺苷17.57412.83415.192ABTS阳离子13.9648.60112.489DPPH13.96413.2788.090总还原力15.41816.00716.624
根据综合权重系数计算综合评分并进行排序,结果如表8所示,LT、HS和NQ排名靠前,质量较优,与核苷类、体外抗氧化活性结果相符。
表8 AHP-EWM综合评价
Table 8 Comprehensive evaluation of AHP-EWM
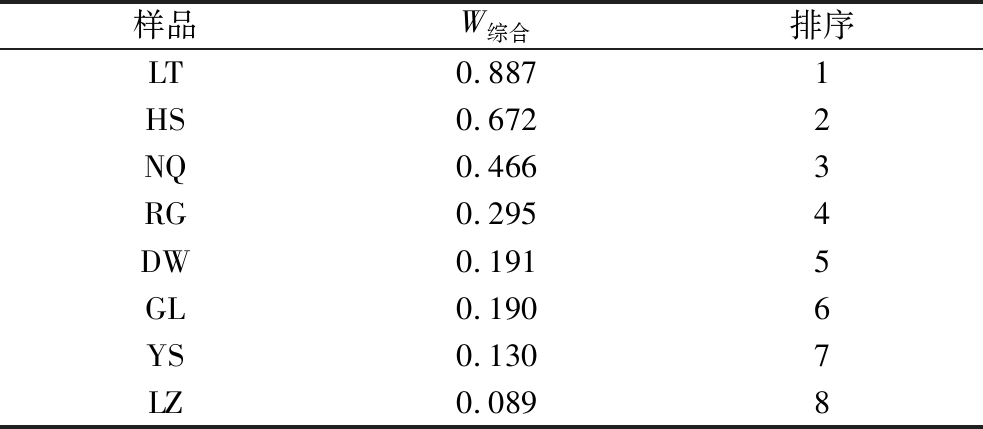
样品W综合排序LT0.8871HS0.6722NQ0.4663RG0.2954DW0.1915GL0.1906YS0.1307LZ0.0898
3 结论
本研究通过HPLC指纹图谱、结合化学模式识别、多成分含量测定及体外抗氧化活性,分析菌株来源对冬虫夏草发酵菌丝质量的影响。指纹图谱分析结果显示,冬虫夏草发酵菌指纹图谱相似度为0.921~0.984,表明不同来源样本化学组成相似。HCA和PCA结果表明,基于共有成分含量可实现不同来源发酵菌丝的区分辨认,DW、GL、LZ、YS和RG之间,以及LT、HS和NQ之间化学组成更接近。借助OPLS-DA筛选出腺苷、鸟苷和尿苷,以及3号和6号未知色谱峰是不同来源冬虫夏草发酵菌丝的差异标志物。HS、LT和NQ中3种差异核苷类含量显著高于其他来源样本。此外,所有冬虫夏草菌丝均表现出一定的抗氧化活性,HS和LT具有更强的总还原力、DPPH自由基和ABTS阳离子自由基清除能力。AHP-EWM综合质量评价显示,LT、HS和NQ排名更靠前,质量较优。综上可知,建立的指纹图谱方便可靠、结合化学模式分析和综合质量评价可为冬虫夏草发酵菌丝的质量控制与评价提供参考。
[1] LI Y, WANG X L, JIAO L, et al.A survey of the geographic distribution of Ophiocordyceps sinensis[J].Journal of Microbiology, 2011, 49(6):913-919.
[2] 李耀磊, 徐健, 金红宇, 等.冬虫夏草及产区土壤中5种重金属及有害元素污染评价[J].药物分析杂志, 2019, 39(4):677-684.
LI Y L, XU J, JIN H Y, et al.Pollution assessment of five heavy metals and harmful element in Cordyceps and its habitat’s soil[J].Chinese Journal of Pharmaceutical Analysis, 2019, 39(4):677-684.
[3] CHEN S P, WANG J Q, FANG Q Y, et al.Polysaccharide from natural Cordyceps sinensis ameliorated intestinal injury and enhanced antioxidant activity in immunosuppressed mice[J].Food Hydrocolloids, 2019, 89:661-667.
[4] YUAN Q H, XIE F, TAN J, et al.Extraction, structure and pharmacological effects of the polysaccharides from Cordyceps sinensis:A review[J].Journal of Functional Foods, 2022, 89:104909.
[5] ZHANG Q, XIAO X H, LI M, et al.Bailing capsule (Cordyceps sinensis) ameliorates renal triglyceride accumulation through the PPARα pathway in diabetic rats[J].Frontiers in Pharmacology, 2022, 13:915592.
[6] XIANG F X, LIN L M, HU M, et al.Therapeutic efficacy of a polysaccharide isolated from Cordyceps sinensis on hypertensive rats[J].International Journal of Biological Macromolecules, 2016, 82:308-314.
[7] CAI H W, LI J, GU B H, et al.Extracts of Cordyceps sinensis inhibit breast cancer cell metastasis via down-regulation of metastasis-related cytokines expression[J].Journal of Ethnopharmacology, 2018, 214:106-112.
[8] ZHANG J S, YU H, LI S S, et al.Comparative metabolic profiling of Ophiocordyceps sinensis and its cultured mycelia using GC-MS[J].Food Research International, 2020, 134:109241.
[9] 邢康康, 贺元川, 刘艳, 等.冬虫夏草人工繁育的研究进展[J].绿色科技, 2020, 22(20):171-173.
XING K K, HE Y C, LIU Y, et al.Research progress of cultivation technology in Cordyceps sinensis[J].Journal of Green Science and Technology, 2020, 22(20):171-173.
[10] 国家药典委员会. 中华人民共和国药典(一部)[M].北京:中国医药科技出版社, 2020:119.
COMMISSION C P.Pharmacopoeia of the People’s Republic of China 2020[M].Beijing:China Medical Science Press, 2020:119.
[11] 张心一, 黄振阳, 何嘉伟, 等.基于指纹图谱和多指标成分定量结合化学模式识别法评价不同产地地榆质量[J].中草药, 2024, 55(16):5649-5655.
ZHANG X Y, HUANG Z Y, HE J W, et al.Quality evaluation of Sanguisorba officinalis from different origins by fingerprint combined with multi-component quantification and chemical pattern recognition[J].Chinese Traditional and Herbal Drugs, 2024, 55(16):5649-5655.
[12] 付艳, 周涛, 许清清, 等.基于熵权法和层次分析法优选天麻趁鲜切制方法[J].中草药, 2024, 55(5):1493-1501.
FU Y, ZHOU T, XU Q Q, et al.Optimization of Gastrodiae Rhizoma fresh-cut processing method based on entropy method and analytic hierarchy process[J].Chinese Traditional and Herbal Drugs, 2024, 55(5):1493-1501.
[13] 赵聃聃, 黄罗冬, 索菲娅, 等.冬虫夏草菌培养物抗氧化活性研究[J].中国食用菌, 2015, 34(1):65-69.
ZHAO D D, HUANG L D, SUO F Y, et al.Study on antioxidant activities of cultured Ophiocordyceps sinensis[J].Edible Fungi of China, 2015, 34(1):65-69.
[14] 李忠红, 胡浩彬, 杜冠华.天然虫草和人工虫草菌丝体的抗氧化活性比较研究[J].中国医药导报, 2008, 5(16):13-16.
LI Z H, HU H B, DU G H.Comparison of the antioxidant activities of natural and cultured Cordyceps[J].China Medical Herald, 2008, 5(16):13-16.
[15] WANG J Q, NIE S P, KAN L J, et al.Comparison of structural features and antioxidant activity of polysaccharides from natural and cultured Cordyceps sinensis[J].Food Science and Biotechnology, 2017, 26(1):55-62.
[16] 王振宇, 胡润红, 赵爱萍, 等.小柴胡汤丸中黄芩苷含量及体外抗氧化活性测定[J].沈阳药科大学学报, 2023, 40(6):725-730; 752.
WANG Z Y, HU R H, ZHAO A P, et al.Determination of baicalin and antioxidant activity in vitro from Xiaochaihutang pill[J].Journal of Shenyang Pharmaceutical University, 2023, 40(6):725-730; 752.
[17] 吴捷, 吴传超, 顾秋亚, 等.红景天有效成分微生物发酵高值化转化[J].食品与发酵工业, 2019, 45(9):29-34.
WU J, WU C C, GU Q Y, et al.High value conversion of effective components in Rhodiola by microbial fermentation[J].Food and Fermentation Industries, 2019, 45(9):29-34.
[18] 张远帆, 朱成豪, 江媛, 等.基于AHP-熵权法的天麻共生蜜环菌质量评价研究[J].中国中医药信息杂志, 2024, 31(7):113-121.
ZHANG Y F, ZHU C H, JIANG Y, et al.Study on quality evaluation of symbiotic Armillaria in Gastrodia elata Bl.based on AHP-entropy weight method[J].Chinese Journal of Information on Traditional Chinese Medicine, 2024, 31(7):113-121.
[19] WEI Y Q, ZHANG L, WANG J N, et al.Chinese caterpillar fungus (Ophiocordyceps sinensis) in China:Current distribution, trading, and futures under climate change and overexploitation[J].Science of the Total Environment, 2021, 755:142548.
[20] 陈亚丽, 洪妍, 李继平, 等.HPLC法测定冬虫夏草中核苷类成分的含量[J].西北药学杂志, 2017, 32(4):403-406.
CHEN Y L, HONG Y, LI J P, et al.Determination of nucleosides in Cordyceps sinensis by HPLC[J].Northwest Pharmaceutical Journal, 2017, 32(4):403-406.
[21] 冯旭, 汪家春, 邹赢锌, 等.不同产地冬虫夏草及其伪品中核苷类成分的含量测定[J].药学服务与研究, 2018, 18(4):304-307.
FENG X, WANG J C, ZOU Y X, et al.Determination of nucleosides contents in Cordyceps sinensis from different origins and its counterfeit products[J].Pharmaceutical Care and Research, 2018, 18(4):304-307.
[22] FAN H, LI S P, XIANG J J, et al.Qualitative and quantitative determination of nucleosides, bases and their analogues in natural and cultured Cordyceps by pressurized liquid extraction and high performance liquid chromatography-electrospray ionization tandem mass spectrometry (HPLC-ESI-MS/MS)[J].Analytica Chimica Acta, 2006, 567(2):218-228.
[23] 周刚, 谢放, 陈照禾, 等.冬虫夏草化合物的研究进展[J].广州化工, 2023, 51(5):5-8.
ZHOU G, XIE F, CHEN Z H, et al.Research progress on Ophiocordyceps sinensis compounds[J].Guangzhou Chemical Industry, 2023, 51(5):5-8.
[24] LIU W, GAO Y W, ZHOU Y, et al.Mechanism of Cordyceps sinensis and its extracts in the treatment of diabetic kidney disease:A review[J].Frontiers in Pharmacology, 2022, 13:881835.