灵芝具有调节人体免疫功能,延长寿命,发挥抗肿瘤和神经保护作用。目前,《中国药典》(2015年版)将灵芝、白芷列为法定生药,在临床上具有预防癌症、神经退行性疾病和心血管疾病的作用。在美国,灵芝作为一种膳食补充剂出现在美国市场,并被列入美国药典的膳食补充剂和草药[1]。据报道,三萜类化合物、多糖类化合物是灵芝的主要药用成分,并已证明其具有良好的治疗效果[2]。目前有关灵芝液态发酵合成次级代谢产物灵芝三萜、灵芝多糖的研究较多[3-5],而有关固态发酵生产次级代谢产物的报道较少。与液态发酵相比,固态发酵具有原料来源广泛、操作简便、能耗低、二次污染小等优势,特别是固态发酵可以使用很多废弃的生物质原料,可以极大地降低生产成本。
我国是中药生产和使用大国,每年产生的中药渣有上千万吨。对中药渣进行处理的传统方法是填埋、焚烧和长期堆存,这已经对环境造成了极大的危害。目前相关学者针对中药渣的资源化利用开展了大量研究工作,其主要利用途径包括:生产生物乙醇、沼气,热解气化燃气、复合材料,作为造纸原料,提取多糖、黄酮,用于废水处理和土壤修复等。中药渣含有大量的营养物质、生物活性物质和一些未知的促生长物质,特别是对于以根茎入药的药用植物经提取药用成分后产生的药渣,其淀粉含量较高,适合作为发酵基质使用,选择适宜的微生物对其进行发酵,可将其转化为高附加值的产品,实现变废为宝。鉴于此,采用药用真菌发酵中药渣的“双向发酵”技术可以提高中药渣的利用价值,对衍生中药资源的经济产业链和实现我国中药产业的可持续发展具有重要理论和现实意义,考虑到三七渣中含有丰富的淀粉、纤维素和微量元素[6],谭显东等[7-8]采用灵芝固态发酵三七渣开发了灵芝菌质、灵芝三萜等产品。但现有的研究工作主要是针对灵芝固态发酵三七渣的培养基制备条件和发酵工艺条件进行优化,有关灵芝固态发酵三七渣动力学的研究报道很少。
固态发酵过程与化学反应过程有很大的不同,因为它不但涉及菌体细胞的生长繁殖等生命活动过程,而且还涉及菌体细胞分泌的多种酶所催化的各种生物化学反应,这些生化反应是受多种因素影响的多酶反应过程。因此,固态发酵过程非常复杂,涉及微生物学、化学和工程学等多种学科理论和技术的综合应用。固态发酵动力学的主要研究内容是固态发酵过程反应速率和环境因素对发酵过程的影响。通过发酵动力学的研究,可进一步了解微生物的生理特征,菌体生长和产物形成的合适条件,以及各种发酵参数之间的关系,为发酵过程的工艺控制、发酵罐的设计放大和利用计算机对发酵过程进行控制创造条件。
三七渣,取自四川省成都市某中成药厂,药渣经晾晒、80 ℃干燥3 d后粉碎、过筛后置于干燥器中备用,其主要成分为:粗淀粉33.13%、粗蛋白12.28%、真蛋白9.97%、还原糖1.37%[9];川芝6号(国品认菌2007045,川审菌2004007),四川省农业科学院土壤肥料研究所微生物室;三氯乙酸、KH2PO4、酵母浸出粉、琼脂粉、蛋白胨、MgSO4、葡萄糖,均为分析纯,成都市科隆化工试剂厂;土豆,市售。
UV-2550紫外可见分光光度计,日本SHIMADZU公司;LDZX-50KB高压灭菌锅,上海申安医疗器械厂;PYX-280H-C恒温恒湿生化培养箱,广东韶关科力实验仪器有限公司;SF-130中药分析研磨机,长沙中南制药机械厂;VT1300L-U超净工作台,苏州安泰空气技术有限公司;BSA224S电子天平,赛多利斯科学仪器(北京)有限公司。
种子液培养基(g/100 mL):土豆20,葡萄糖2.0,酵母粉0.3,蛋白胨0.2,KH2PO4 0.1,MgSO4 0.06,灭菌处理(121 ℃,30 min)后用于灵芝种子液的制备。
综合培养基(g/100 mL):土豆20,葡萄糖2.0,酵母粉0.3,蛋白胨0.2,KH2PO4 0.1,MgSO4 0.06,琼脂粉2.0,灭菌处理(121 ℃,30 min)后用于灵芝菌种扩大与保藏。
三七渣固体培养基:过60目筛的三七渣10.00 g,酵母粉0.247 g,KH2PO4 0.014 5 g,培养基初始含水量65.47%,pH自然,灭菌处理(121 ℃,30 min)后再加入1 mg纤维素酶,用于固态发酵动力学的研究实验。
1.3.1 菌种扩大培养
采用1.2节中的综合培养基进行灵芝菌种扩大培养,具体方法参考文献[6]。
1.3.2 种子液的制备
采用1.2节中的种子液培养基制备种子液,具体方法参考文献[6]。
1.3.3 发酵动力学的研究
将1.2节所描述的三七渣固体培养基置于28 ℃恒温恒湿生化培养箱中培养2 d后再次进行灭菌处理(121 ℃,30 min),然后按照每10 g三七渣固体培养基接入1 mL种子液的比例接入灵芝种子液,置于恒温恒湿生化培养箱中于28 ℃下恒温发酵培养19 d。从第0天(接入灵芝种子液当天)开始,每天取样,将发酵培养物置于热风循环烘箱中,于60 ℃烘干48 h至恒重,再用中药渣分析研磨机粉碎,过60目筛,取适量样品测定灵芝生物量、灵芝三萜、灵芝多糖、总糖含量。每个实验结果均为3个平行实验的均值。
1.4.1 灵芝生物量的测定
参照文献[6]的方法,准确称取0.250 g发酵培养物样品加入到25 mL 5%(质量分数)的三氯乙酸溶液中,于80 ℃提取25 min后,8 000 r/min、4 ℃离心15 min,于波长260 nm处测定其上清液的吸光度值(OD260),对未经发酵的固体培养基采用同样的方法处理作为空白对照,再按照标准曲线查出其对应的生物量。灵芝生物量(%)表示灵芝菌丝体在整个发酵培养物样品(干基)中所占的质量百分比。
1.4.2 灵芝三萜的测定
参照文献[7]的方法,准确称取0.50 g发酵培养物,置于50 mL比色管中,加入12.5 mL 75%(体积分数)的乙醇溶液进行超声波处理,然后加入相同浓度的乙醇溶液定容至50 mL,摇匀,离心后取上清液保存备用。吸取0.1 mL上清液置于比色管中,用沸水浴加热煮干其中的溶剂,再依次加入50 g/L的香草醛一冰乙酸溶液0.2 mL,高氯酸0.8 mL,并迅速混匀。然后将试管置于60 ℃水浴中加热20 min,再取出用冰水冷却至室温,加5 mL冰乙酸,迅速混匀,在550 nm处测定吸光值,再按照标准曲线查出其对应的灵芝三萜质量。灵芝三萜含量(%)表示灵芝三萜在整个发酵培养物样品(干基)中所占的质量百分比。
1.4.3 灵芝多糖的测定
1.4.3.1 去除样品中的淀粉、单糖和低聚糖
参照文献[10]的方法,准确称量0.500 0 g烘干后的发酵培养物,加入4 mL 3 mol/L CaCl2溶液,摇匀,再加入6×10-3 mol/L的碘-二甲基亚砜溶液15 mL,65 ℃下超声波处理10 min,离心,去其上清液,再加入5 mL同浓度的碘-二甲基亚砜溶液洗涤2次,离心去其上清液,之后加入50%(体积分数)的乙醇溶液洗涤2次,离心,去其上清液,然后再加入15 mL 75%(体积分数)乙醇溶液,在60 ℃下恒温水浴醇提30 min,离心,去其上清液,留下残渣备用,经过上述步骤,可以去除样品中的淀粉、单糖、低聚糖等物质。
1.4.3.2 样品中灵芝多糖的测定
参照文献[11]的方法,将1.4.3.1节获得的残渣用30 mL蒸馏水在80 ℃下继续提取2 h,用蒸馏水定容至100 mL,过滤。取2 mL经稀释后的提取液,加入6 mL硫酸-蒽酮溶液,然后水浴加热准确反应15 min,再冰水冷却15 min,在波长625 nm处测定吸光度,根据标准曲线计算得到灵芝多糖的含量。灵芝多糖含量(%)表示灵芝多糖在整个发酵培养物样品(干基)中所占的质量百分比。
1.4.4 总糖的测定
参照文献[12]的方法,准确称取发酵培养物样品1.0 g,放入150 mL的锥形瓶中,加入10 mL 6 mol/L HCl溶液和15 mL水,沸水浴加热30 min(可用碘-碘化钾溶液检查水解是否完全),冷却后用10%(质量分数)NaOH溶液调至中性(以酚酞作指示剂),用水定容到100 mL,过滤后取滤液再稀释10倍,即为总糖水解液,备用。
取总糖水解液1.0 mL加0.5 mL 3,5-二硝基水杨酸试剂于试管中,混匀,置沸水浴加热5 min后用流水冷却,再加4.0 mL水,摇匀后以空白管为对照,于540 nm波长处比色并读取吸光度。根据标准曲线计算得到总糖含量。总糖含量(%)表示总糖在整个发酵培养物样品(干基)中所占的质量百分比。
1.5.1 灵芝菌体生长模型
由于对数模型只需要用一个方程就能够近乎完整地表示包括适应期、对数生长期和稳定期在内的菌体生长曲线,因此在固态发酵动力学研究中得到了广泛的应用[13]。相应的数学表达式如公式(1)所示:
(1)
积分后可得公式(2):
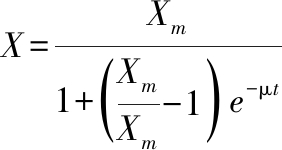
(2)
式中:X,t时刻灵芝生物量,%,即灵芝菌丝体在发酵培养物(干基,下同)中的含量;Xm,最大灵芝生物量,%;X0,0时刻灵芝生物量,%;μ,灵芝比生长速率常数,d-1;t,对应于灵芝生物量X的发酵时间,d。
1.5.2 次级代谢产物合成模型
由于次级代谢产物动态变化曲线与灵芝菌丝体动态变化曲线高度相似,采用形式上与公式(1)类似的方程来表达,如公式(3)所示:
(3)
积分后可得公式(4):
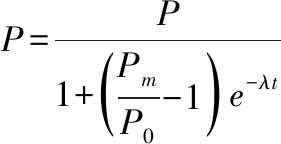
(4)
式中:P,t时刻次级代谢产物含量,%,即次级代谢产物在发酵培养物(干基,下同)中的含量;Pm,次级代谢产物含量最大值,%;P0,0时刻次级代谢产物含量,%;λ,次级代谢产物比合成速率,d-1;t,对应于次级代谢产物含量P的发酵时间,d。
1.5.3 基质降解动力学模型
采用Origin 18.0软件中自带的四参数对数模型对图2中的相关实验数据进行非线性拟合,其具体形式如公式(5)所示:
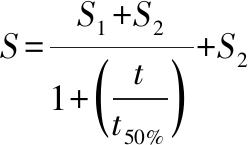
(5)
式中:t,发酵时间,d;S,t时刻发酵培养物(干基,下同)中的总糖含量,%;S1,发酵期初基质中的总糖含量,%;S2,发酵期末发酵培养物中残留的总糖含量,%;t50%,以S2为基准的总糖降解半衰期,d。
由图1可知,发酵过程中灵芝生物量的变化过程大致可以分为3个阶段:适应期,即发酵第0~3天,灵芝菌在逐渐适应新环境,生物量缓慢增长;快速增长期,即发酵第3~16天,环境中养分充足,灵芝菌生长迅速,生长量远大于死亡量,因此灵芝生物量快速增长;稳定期,即发酵第16~19天,灵芝生长速率与死亡速率持平,灵芝生物量保持稳定,维持在45%左右。作为灵芝代谢产物的灵芝三萜和灵芝多糖,其含量动态变化趋势总体上与灵芝生物量保持一致,在发酵过程中它们的峰值分别达到了0.42%和4.0%。总糖含量的动态变化可以划分为以下3个阶段:第一阶段,即发酵第0~6天,基质中总糖的含量基本保持在40%左右;第二阶段,即发酵第6~15天,基质中总糖的含量快速下降至19%左右;第三阶段,即发酵第15~19天,基质中总糖的含量基本趋于稳定,保持在19%左右。在固态发酵过程中,一部分总糖被用于灵芝菌体自身细胞的生长,另一部分则用于次级代谢产物的合成。发酵初期灵芝菌体还处于适应阶段,在发酵第0~6天时,虽然灵芝生物量有少许增加,但总糖的消耗速率与生成速率持平,因此,总糖含量基本保持平稳;到了第二阶段,也就是灵芝的对数生长期,由于灵芝快速生长繁殖和次级代谢产物的大量合成,必然导致总糖的大量消耗,此时总糖的消耗速率远大于生成速率,因此其浓度快速下降;到了第三阶段,由于次级代谢产物的反馈抑制作用,灵芝菌体的生长速率和次级代谢产物的生成速率受到抑制,灵芝生物量和代谢产物含量不再发生变化,表明灵芝新陈代谢活动减弱,所以总糖的消耗速率与生成速率基本保持平衡,其含量也不再变化。总体而言,总糖的动态变化趋势与灵芝生物量及次级代谢产物的变化趋势是基本吻合的。按照Gaden分类方法[14],可以将发酵动力学模型分为产物形成与菌体生长相耦联、产物形成与菌体生长部分偶联、产物形成与菌体的生长没有关系3类,结合图1中各参数的变化趋势,可以认为本次发酵属于产物形成与菌体生长相耦联的类型。
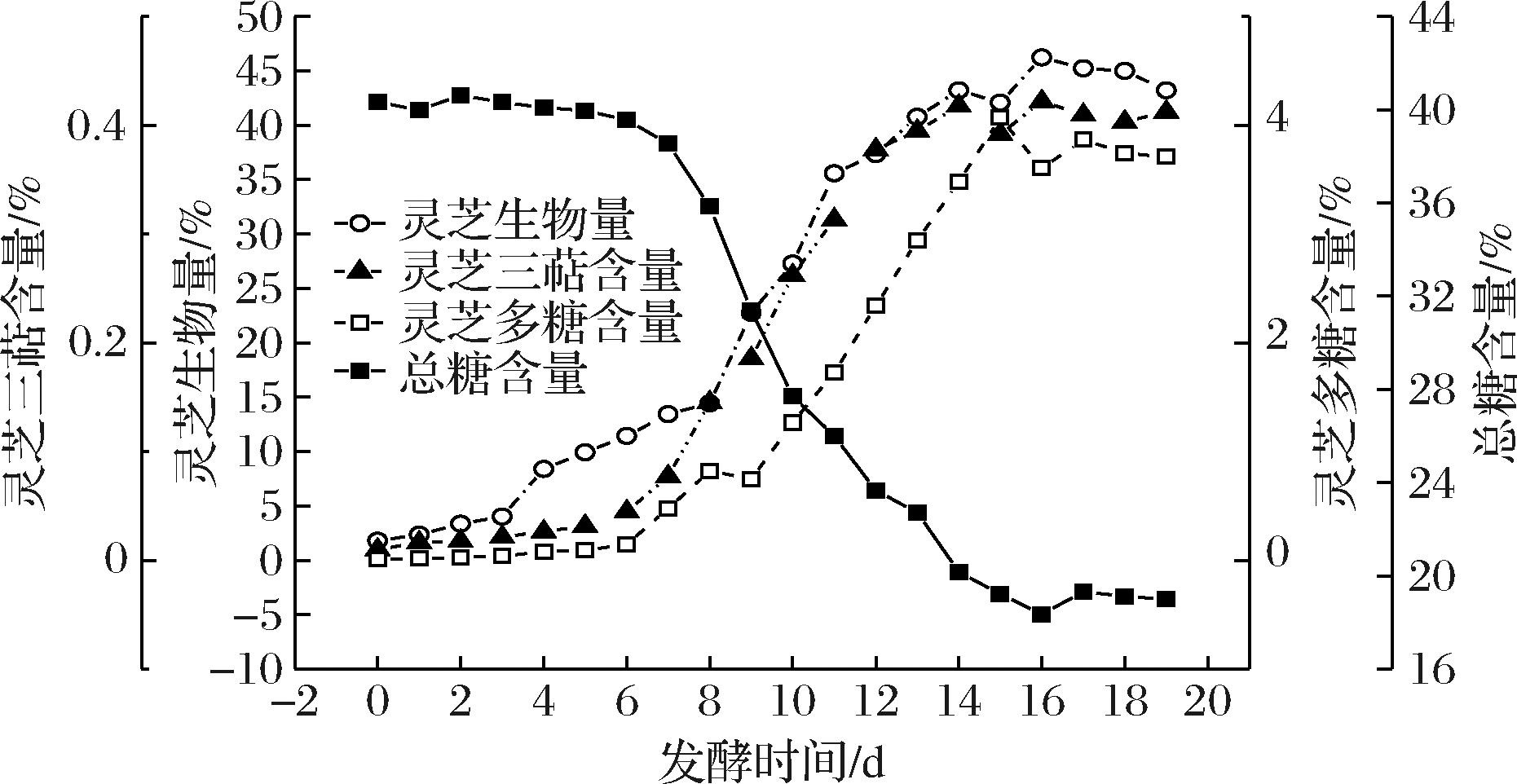
图1 固态发酵过程中工艺参数的动态变化
Fig.1 Time course of technological parameters during the solid state fermentation
在灵芝液体发酵中也观察到了类似现象[4,15-18],即代谢产物的合成与灵芝细胞的生长相关,都呈现“S型曲线”,且对应于灵芝菌体的对数生长期,基质浓度也会急速下降。例如,采用甘蔗汁进行灵芝液体发酵时发现,灵芝生物量在发酵到第8天时达到最大值,到第10天时胞外多糖到达峰值,蔗糖浓度在发酵前7 d消耗较缓,平均每天只消耗了0.78 g/L,然而在发酵7~13 d,蔗糖浓度快速下降11.61 g/L,胞外多糖在发酵前4 d没有变化,从第5天开始浓度迅速上升,到第10天时达到稳定的平台期(1.17~1.20 g/L)[8]。在30 L的液体发酵罐中(以葡萄糖为碳源),灵芝发酵5 d后,灵芝生物量、残糖、胞外多糖分别可达13.01、6.3、7.6 g/L[19]。在200 L规模的灵芝液体发酵研究中(以葡萄糖为碳源),发酵到第5天时,糖质量浓度从初始的14.5 g/L下降到了3.7 g/L;在发酵第6天时灵芝三萜含量达到最大值,为295.3 mg/L[20]。但在采用灵芝固体发酵豆渣的研究中却发现,到发酵20 d时,多糖含量才达到最大值(43.96 mg/g)[21]。与液体深层发酵相比,灵芝固态发酵三七渣无论是灵芝生物量增长速率还是次级代谢产物的合成速率都要慢很多,相应的这些参数到达峰值的时间也要延后一些,可能的原因在于:其一,基质成分差异较大,大多数有关灵芝液态发酵的研究中使用的碳源主要是葡萄糖、蔗糖等简单糖类物质,而固态发酵中使用的基质(三七渣或豆渣)中,葡萄糖等易于灵芝利用的简单糖类物质含量较少,难于利用的纤维素等组分含量较多;其二,与液态发酵相比,固态发酵供氧、散热更加困难;其三,本次研究中采用的灵芝菌种与文献中采用的菌种不相同,其所产酶系、代谢能力有差异。
2.2.1 菌体生长动力学模型
将图1中灵芝生物量的实验数据带入公式(2)中,采用Origin 18.0软件进行非线性拟合,拟合曲线图和模型参数分别见图2及表1。
表1 菌体生长动力学模型参数表
Table 1 Model parametes of microbial growth kinetics
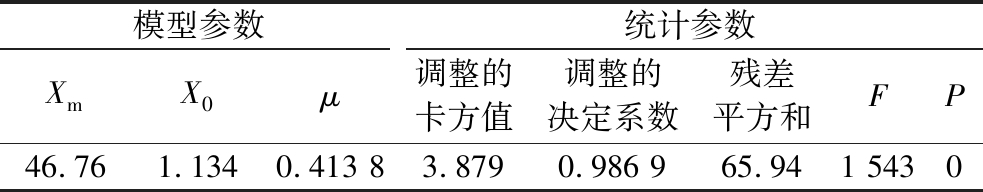
模型参数统计参数XmX0μ调整的卡方值调整的决定系数残差平方和FP46.761.1340.413 83.8790.986 965.941 5430
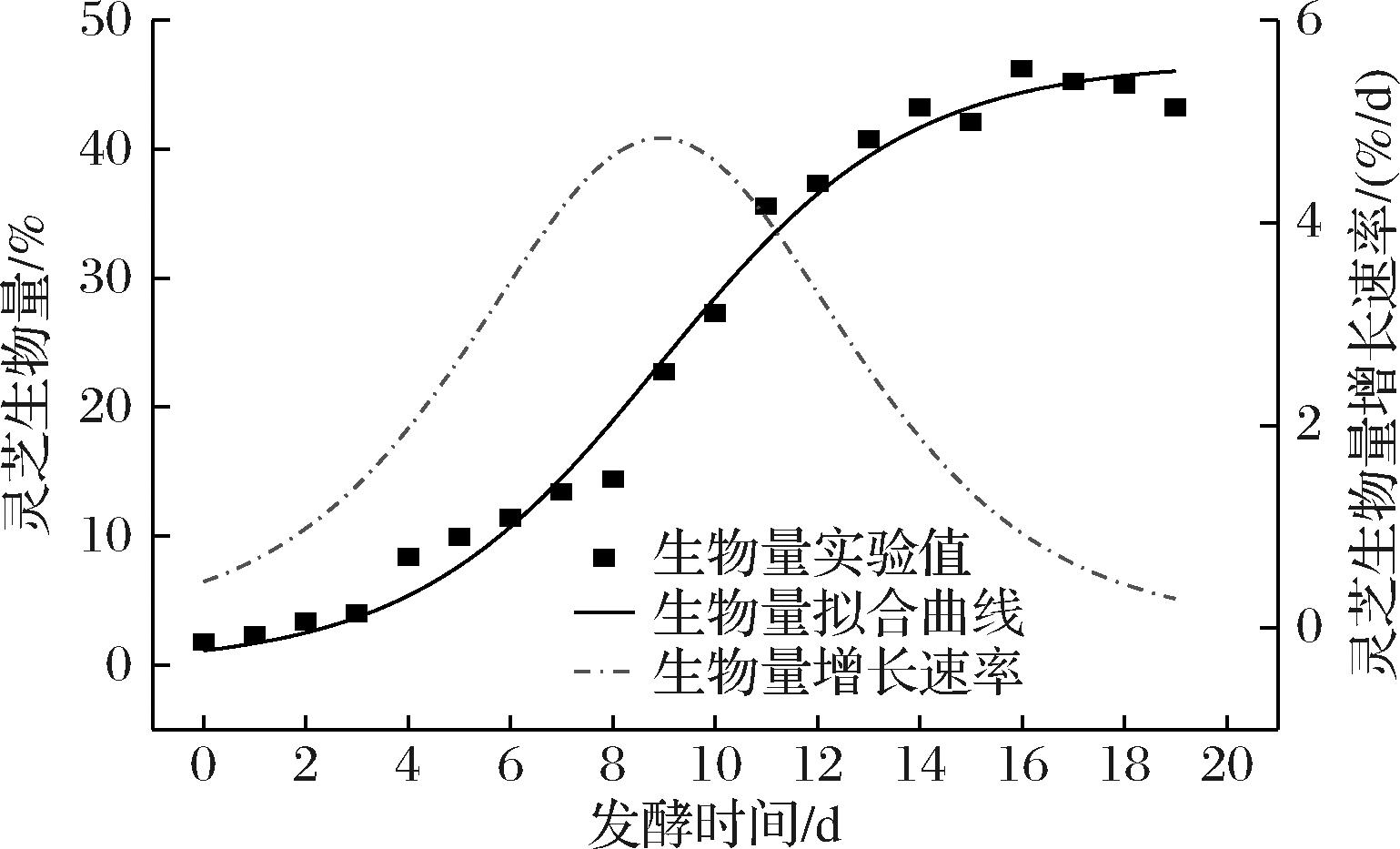
图2 灵芝生物量及灵芝生长速率变化曲线
Fig.2 Time course of G. lucidum biomass and its growth rate
由图2和表1可知,拟合曲线的相关性很好,符合统计检验的要求。根据上述结果,可以得到灵芝固态发酵三七渣的菌体生长动力学方程如公式(6)或公式(7)所示:
(6)
(7)
将公式(7)代入公式(6)中,可得灵芝菌体生长速率VM的表达式(8)
(8)
由公式(8)中VM对发酵时间作图可得灵芝生长速率曲线,见图2。
由图2可知,灵芝生长速率先逐渐增大,到发酵第9.000天时生物量增长速率达到最大,为4.834%/d,然后又逐渐减小,最终趋于零。采用甘蔗汁进行灵芝液态发酵的研究发现,灵芝菌体的生长曲线也能很好地采用对数模型进行拟合,其最大生物量为5.42 g/L,生长速率为0.78/d[5]。在以葡萄糖和大豆粉为主要基质的液体发酵研究中发现,优化发酵工艺后灵芝的生物量增长速率为0.091 g/(L·h)[15]。而单独采用葡萄糖为基质,灵芝液体发酵的比生长速率则为0.037 5/h,发酵140 h后最大细胞质量浓度为3.14 g/L[17],这说明灵芝的生长速率受到发酵类型、微生物种类、培养基组成、发酵工艺条件、发酵方式等多种因素的影响。
2.2.2 次级代谢产物合成动力学模型
将图1中灵芝次级代谢产物的实验数据带入公式(4)中,采用Origin 18.0软件进行非线性拟合,拟合曲线图及的模型参数分别见图3及表2。
表2 灵芝次级代谢产物合成动力学模型参数表
Table 2 Model parametes of G. lucidum secondary metabolite synthesis kinetics

产物种类模型参数统计参数PmP0λ调整的卡方值调整的决定系数残差平方和FP灵芝三萜0.417 21.073×10-30.651 71.456×10-40.995 22.470×10-33 5160灵芝多糖3.9354.508×10-30.607 02.987×10-20.988 50.507 71 1610
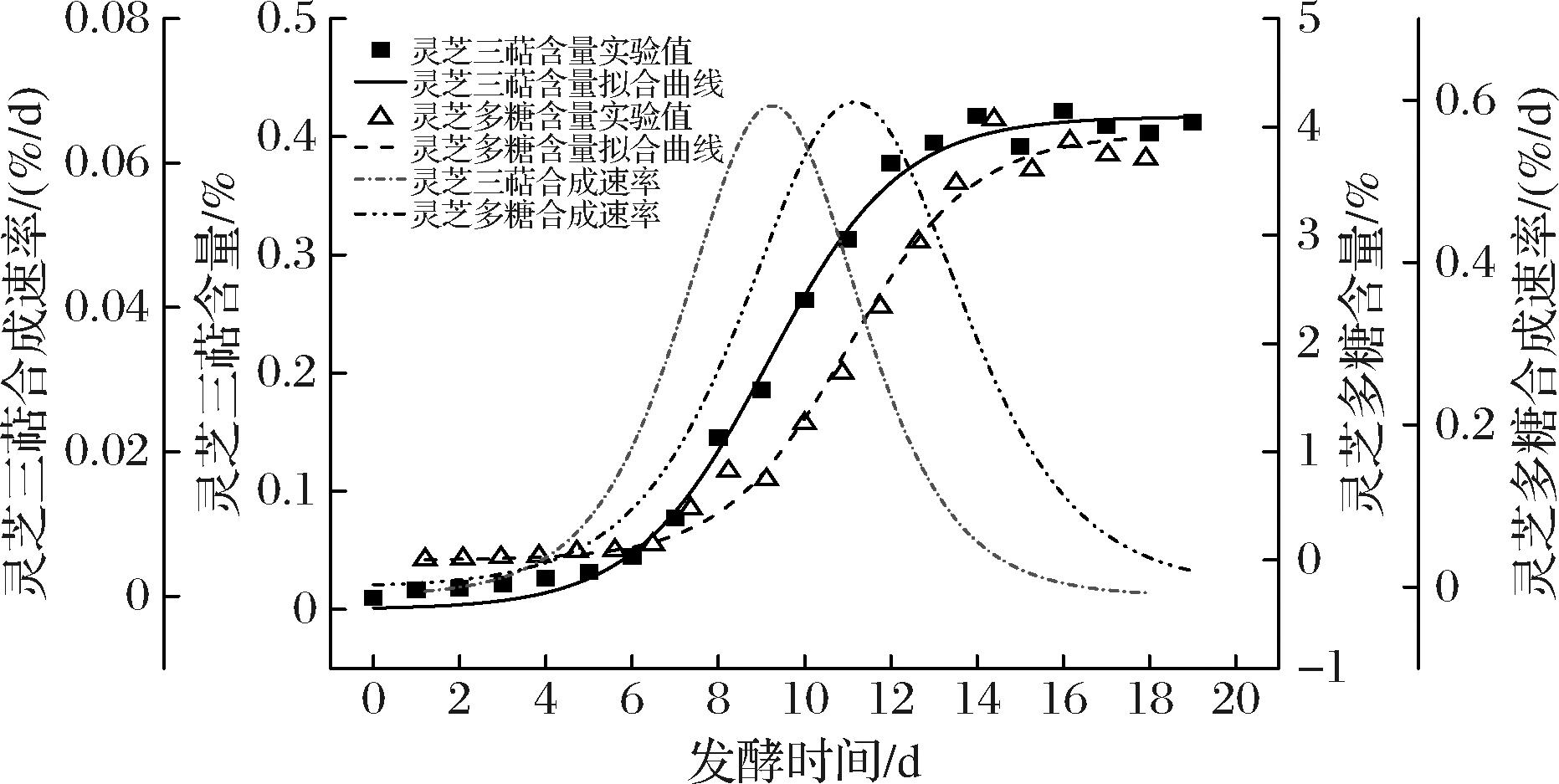
图3 灵芝次级代谢产物及次级代谢产物合成速率变化曲线
Fig.3 Time course of G. lucidum secondary metabolite and its synthesis rate
由图3和表2可知,次级代谢产物动态变化拟合曲线与实验值的相关性很好,符合统计检验的要求。根据上述结果,灵芝三萜合成动力学方程如公式(9)、公式(10)所示:
(9)
(10)
灵芝多糖合成动力学方程如公式(11)、公式(12)所示:
(11)
(12)
式中:P1、P2分别表示t时刻发酵培养物中灵芝三萜、灵芝多糖的含量。
将公式(10)代入公式(9)中,可得灵芝三萜合成速率V1的表达式(13):
(13)
同理,将公式(12)带入公式(11)中,可得灵芝多糖合成速率V2的表达式(14):
(14)
分别由公式(12)、公式(13)中V1、V2对发酵时间t作图,可得灵芝次级代谢产物合成速率随发酵时间的变化曲线,见图3。
由图3可知,灵芝三萜、灵芝多糖分别在发酵第9.11、11.18天时合成速率达到最大,其最大合成速率分别为0.067 96%/d、0.597 2%/d,然后又逐渐减小,最终趋于零。在以葡萄糖和大豆粉[15]为主要基质的液体发酵研究中发现,在优化的工艺条件下,发酵80 h后,灵芝三萜合成速率达到最高,为6.532×10-4 g/(L·h)。此外,张建国等[22]采用Luedeking-Piret方程拟合分批发酵过程中灵芝胞外多糖生成动力学实验数据,结果表明,该动力学模型能很好地描述灵芝胞外多糖合成随时间变化的行为,但是在发酵132 h后,多糖的浓度比预测值低。
2.2.3 基质降解动力学模型
采用Origin 18.0软件将图1中总糖的实验数据带入公式(5)中进行非线性拟合,拟合曲线及模型参数分别见图4和表3。
表3 总糖降解动力学模型参数表
Table 3 Kinetic model parameters of total sugar degradation

模型参数统计参数S1S2t50%m调整的卡方值调整的决定系数残差平方和Fp40.3918.389.7646.1810.352 50.995 95.6401.401×1040
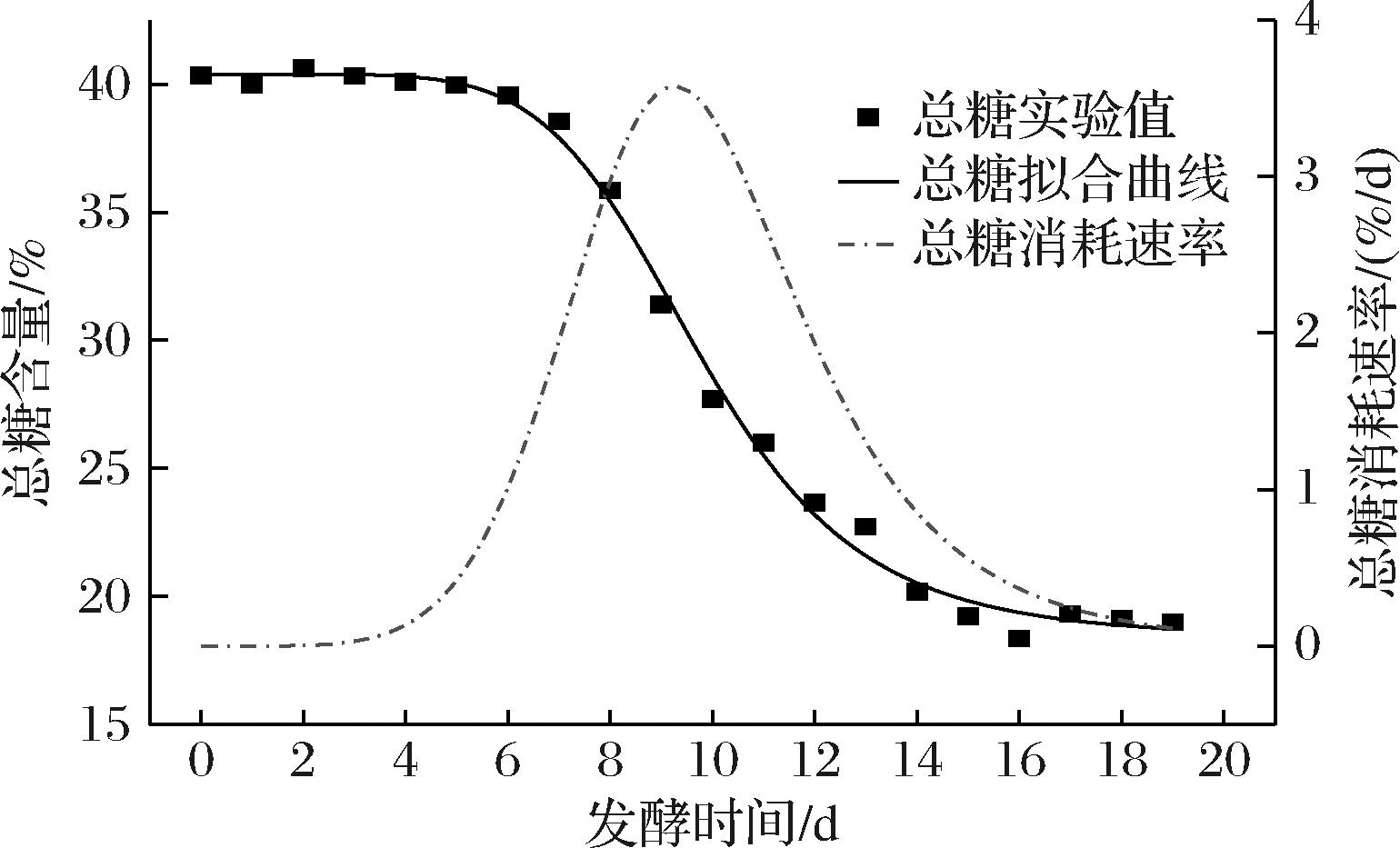
图4 总糖及总糖降解速率变化曲线
Fig.4 Time course of total sugar and its degradation rate
由图4和表3可知,拟合曲线的相关性很好,符合统计检验的要求。根据上述结果,可以得到总糖降解动力学方程如公式(15)所示:
(15)
由公式(15)进行求导,可得总糖的降解速率Vs的表达式(16)
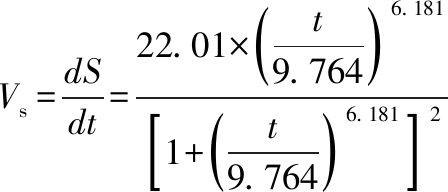
(16)
相应的,由公式(16)中的总糖降解速率Vs对发酵时间t作图,结果如图4所示。
由图4可知,总糖降解速率在发酵第9.243天时达到峰值,为3.576%/d,随后又逐渐下降。谭显东等[23]采用四参数对数模型研究黑曲霉发酵三七渣过程中总糖的降解动力学时,发现该过程中总糖降解的半衰期为123.1 h,发酵46.1 h后总糖降解速率达到峰值。说明该研究中采用的黑曲霉对三七渣的糖化降解能力比本次研究使用的灵芝更强一些。
由上述讨论可以看出,由于发酵类型、发酵基质、菌种、工艺条件的差异,灵芝发酵过程的动力学参数变化较大,为了通过定向调控在较短周期内获得优质的发酵产品,有必要针对具体的发酵体系进行专门的动力学过程研究。灵芝三萜和灵芝多糖的生物合成代谢是非常复杂又高度协调的系统,目前,灵芝三萜类物质合成的上游步骤已被基本阐明,多个关键酶已经被克隆表征并研究了其特性。合成三萜环碳环系统后,碳环骨架还需经过复杂的修饰,即从羊毛甾醇之后,各种灵芝三萜还需经过一系列氧化还原和酰化等反应,但目前具体的合成步骤仍不清楚[24]。同样的,灵芝多糖的核苷酸糖前体合成途径已明晰,但单糖重复单元的组装和聚合过程尚不清晰,使得发酵过程中目标产物多糖的糖苷键、支化程度、分子质量等较难进行定向调控[25]。今后的研究工作需要聚焦于应用基因工程的手段阐明灵芝三萜、灵芝多糖生物合成下游的具体途径,解析其合成代谢途径,在此基础上可以考虑通过基因工程改良菌种、优化培养基组成(氮源、含水率、无机盐及生长因子)、优化发酵工艺参数(pH、温度、供氧、散热、光照条件)、引入超声波处理、添加外源物质(细胞色素P450诱导剂和抑制剂、植物激素、油脂物质等)、进行混菌发酵等方式对发酵过程进行调控,促进基质降解、菌丝体生长和次级代谢产物合成,实现短周期、高产物品质的发酵过程,为实现灵芝固态发酵三七渣的工业规模生产打下基础。
在本次实验条件下,可以得到如下结论:
a)灵芝固态发酵三七渣过程中产物形成与菌体生长相耦联,微生物生长动力学、次级代谢产物合成动力学适合采用对数模型进行描述,基质降解动力学适合采用四参数对数模型进行描述。发酵过程中灵芝最大生物量为46.76%,比生长速率常数为0.413 8/d,灵芝生长速率最大值为4.834%/d;灵芝三萜与灵芝多糖含量的最大值分别为0.417 2%、3.935%,比合成速率常数分别为0.651 7/d、0.607 0/d,灵芝三萜和灵芝多糖的最大合成速率分别为0.067 96%/d、0.597 1%/d;总糖半衰期为9.243 d,降解速率最大值为3.576%/d。
b)本次研究获得的动力学参数可用于发酵过程的工艺控制和发酵反应器的设计、放大。
[1] WANG L, LI J Q, ZHANG J, et al.Traditional uses, chemical components and pharmacological activities of the genus Ganoderma P.Karst.A review[J].RSC Advances, 2020, 10(69):42084-42097.
[2] CADAR E, NEGREANU-PIRJOL T, PASCALE C, et al.Natural bio-compounds from Ganoderma lucidum and their beneficial biological actions for anticancer application:A review[J].Antioxidants, 2023, 12(11):1907.
[3] 冯杰, 刘艳芳, 苏晓薇, 等.灵芝三萜类物质液态发酵研究进展[J].上海农业学报, 2023, 39(4):163-172.
FENG J, LIU Y F, SU X W, et al.Research progress on liquid fermentation of Ganoderma triterpenes[J].Acta Agriculturae Shanghai, 2023, 39(4):163-172.
[4] WANG Q F, HUANG Q H, LIANG L, et al.Research on sugarcane juice fermentation by Ganoderma lucidum and assay of antioxidant activity of exopolysaccharide[J].Journal of Food Processing and Preservation, 2018, 42(9):e13761.
[5] YANG X B, YANG Y Y, ZHANG Y F, et al.Enhanced exopolysaccharide production in submerged fermentation of Ganoderma lucidum by Tween 80 supplementation[J].Bioprocess and Biosystems Engineering, 2021, 44(1):47-56.
[6] 盘道兴, 李凡, 王献, 等.三七渣对文山牛生长性能、血清生化指标及肌肉品质的影响[J].动物营养学报, 2023, 35(5):3069-3080.
PAN D X, LI F, WANG X, et al.Effects of panaxnotoginseng residue on growth performance, serum biochemical indexes and muscle quality of Wenshan cattle[J].Chinese Journal of Animal Nutrition, 2023, 35(5):3069-3080.
[7] 谭显东, 卢上飞, 胡伟, 等.三七渣固态发酵生产灵芝菌质的工艺优化[J].食品工业科技, 2020, 41(18):130-134.
TAN X D, LU S F, HU W, et al.Optimization of technological conditions for producing Ganoderma lucidum fungal substance by solid state fermentation of Panax notoginseng residues[J].Science and Technology of Food Industry, 2020, 41(18):130-134.
[8] 谭显东, 陈楠, 王浪, 等.响应面法优化灵芝发酵三七渣产灵芝三萜工艺[J].中国酿造, 2021, 40(6):147-151.
TAN X D, CHEN N, WANG L, et al.Optimization of fermentation conditions for Ganoderma lucidum triterpenoids production with notoginseng residues by Ganoderma lucidum using response surface methodology[J].China Brewing, 2021, 40(6):147-151.
[9] 谭显东, 黄凡, 林巧玉, 等.培养基特性对三七渣发酵产红曲色素的影响[J].环境工程学报, 2017, 11(7):4293-4297.
TAN X D, HUANG F, LIN Q Y, et al.Effect of culture medium characteristics on production of Monascus pigments from notoginseng residues by fermentation[J].Chinese Journal of Environmental Engineering, 2017, 11(7):4293-4297.
[10] 杨宗渠, 李长看, 雷志华, 等.菌株和培养基质对虫草菌质主要营养成分和活性成分的影响[J].食品研究与开发, 2020, 41(2):7-11.
YANG Z Q, LI C K, LEI Z H, et al.Effects of strains and substrates on main nutritional components and active ingredients of Cordyceps fungal substance[J].Food Research and Development, 2020, 41(2):7-11.
[11] 国家药典委员会. 中华人民共和国药典-一部:2020年版[M].北京:中国医药科技出版社, 2020.
The National Pharmacopoeia Editorial Board.The Pharmacopoeia of the People’s Republic of China (2020)[M].Beijing:Chemical Industrial Press, 2020.
[12] 俞建瑛,蒋宇,王善利.生物化学实验技术[M].北京:化学工业出版社, 2005:138-139.
YU J Y, JIANG Y, WANG S L.Experimental Technology of Biochemistry[M].Beijing:Chemical Industry Press, 2005:138-139.
[13] MITCHELL D A, VON MEIEN O F, KRIEGER N, et al.A review of recent developments in modeling of microbial growth kinetics and intraparticle phenomena in solid-state fermentation[J].Biochemical Engineering Journal, 2004, 17(1):15-26.
[14] 邱立友,戚元成,高玉千,等.固态发酵工程原理及应用[M].北京:中国轻工业出版社.2008:44-45.
QIU L Y, QI Y C, GAO Y Q, et al.Principles and Application of Solid-State Fermentation[M].Beijing:China light Industry Press, 2008:44-45.
[15] FENG J, FENG N, YANG Y, et al.Simple and reproducible two-stage agitation speed control strategy for enhanced triterpene production by Lingzhi or reishi medicinal mushrooms, Ganoderma lucidum ACCC G0119 (higher basidiomycetes) based on submerged liquid fermentation[J].International Journal of Medicinal Mushrooms, 2015, 17(12):1151-1159.
[16] FENG J, FENG N, ZHANG J S, et al.A new temperature control shifting strategy for enhanced triterpene production by Ganoderma lucidum G0119 based on submerged liquid fermentation[J].Applied Biochemistry and Biotechnology, 2016, 180(4):740-752.
[17] FENG J, ZHANG J S, JIA W, et al.An unstructured kinetic model for the improvement of triterpenes production by Ganoderma lucidum G0119 based on nitrogen source effect[J].Biotechnology and Bioprocess Engineering, 2014, 19(4):727-732.
[18] ZHOU H B, BI P Y, WU X T, et al.Improved polysaccharide production in submerged culture of Ganoderma lucidum by the addition of coixenolide[J].Applied Biochemistry and Biotechnology, 2014, 172(3):1497-1505.
[19] LIU G Q, LIN Q L, REN G P, et al.Use of response surface methodology to optimize critical medium components for biomass and extracellular polysaccharide production by Ganoderma sinense[J].African Journal of Microbiology Research, 2010, 4(24):2735-2741.
[20] WANG X L, DING Z Y, LIU G Q, et al.Improved production and antitumor properties of triterpene acids from submerged culture of Ganoderma Lingzhi[J].Molecules, 2016, 21(10):1395.
[21] SHI M, YANG Y N, GUAN D, et al.Evaluation of solid-state fermentation by Ganoderma lucidum using soybean curd residue[J].Food and Bioprocess Technology, 2013, 6(7):1856-1867.
[22] 张建国, 陈晓明, 贺新生.灵芝胞外多糖分批发酵动力学模型[J].生物工程学报, 2007, 23(6):1065-1070.
ZHANG J G, CHEN X M, HE X S.Kinetic model for exopolysaccharides (EPS) of Ganoderma lucidum in batch fermentation[J].Chinese Journal of Biotechnology, 2007, 23(6):1065-1070.
[23] 谭显东, 王君君, 段娅宁, 等.三七渣发酵生产蛋白饲料的总糖和淀粉降解动力学"[J].农业机械学报, 2013, 44(1):157-161;156.
TAN X D, WANG J J, DUAN Y N, et al.Dynamics of total sugar and starch degradation in protein feed fermentation production using Panax notoginseng residues[J].Transactions of the Chinese Society for Agricultural Machinery, 2013, 44(1):157-161;156.
[24] 姜幸怡, 韩伟, 刘艳芳, 等.影响灵芝三萜类物质液态发酵合成的关键因素研究进展[J].微生物学通报, 2023, 50(5):2155-2172.
JIANG X Y, HAN W, LIU Y F, et al.Identification of key factors affecting liquid fermentation of Ganoderma lucidum for triterpenes:A review[J].Microbiology China, 2023, 50(5):2155-2172.
[25] 郭嘉, 冯杰, 谭贻, 等.灵芝液态发酵胞内外多糖的研究进展[J].微生物学通报, 2022, 49(10):4337-4356.
GUO J, FENG J, TAN Y, et al.Liquid fermentation of Ganoderma Lingzhi for intracellular and extracellular polysaccharides:A review[J].Microbiology China, 2022, 49(10):4337-4356.