镇远道菜作为贵州省黔东南苗族侗族自治州镇远县的传统发酵食品,其以笋子芥(Brassica juncea var.crassicaulis)[1]为原料,经发酵、蒸煮、干燥等14道工艺后密封贮藏而成,具有500余年历史[2]。道菜作为发酵蔬菜中的一类,发酵过程不仅赋予道菜独特的地域风味,提高其营养价值和消化率,还去除相应的抗营养因子[3]。然而,传统开放式生产模式导致微生物群落结构更为复杂,且微生物群落的变化受到环境(温度、湿度、盐度)等因素影响较显著[4],部分菌株通过分泌氨基酸脱羧酶催化原料中游离氨基酸生成生物胺(biogenic amines, BAs)[5]。研究表明,BAs广泛存在于各种含有蛋白质和游离氨基酸的食物中,过量摄入可能引发头痛、高血压甚至中毒反应,对食品安全构成潜在威胁[5]。
目前BAs控制技术主要依赖化学添加剂或物理辐射处理,但这类方法易破坏食品风味特性与功能成分[6]。近年来,利用降胺微生物(借助诸如精氨酸脱羧酶、胍基丁胺酶等关键酶通过代谢途径降解生物胺的功能菌株,简称降胺菌)实现BAs的绿色消减成为研究热点[7]。目前已证实解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、植物乳植杆菌(Lactiplantibacillus plantarum)、戊糖片球菌(Pediococcus pentosaceus)等菌株具有生物胺降解功能[8]。其中,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)作为公认安全认证的益生菌[9],在食品发酵领域应用广泛。该菌具有显著的环境适应性,能在广泛的pH范围(pH 5.0~9.0)和温度条件(20~50 ℃)下保持活性,同时能形成耐热芽孢,在不利环境下维持长期稳定性,有利于工业化生产及应用[10]。与其他降胺菌株相比,该菌对多种生物胺(组胺、腐胺和尸胺)表现出较强的降解能力,降解效率分别达59.9%、7.5%和26.4%[11]。在食品工业应用方面,解淀粉芽孢杆菌已被广泛用于豆豉、纳豆(日本)和清国酱(韩国)等传统发酵食品的生产中[12],其不仅能改善产品风味,还能通过产生多种酶类提高食品的营养价值和生物可利用性,甚至有研究证实该菌能产生多种抗菌物质有效抑制食品中的腐败菌和病原菌,在生产应用中具有双重控制效果[13]。
本研究从镇远道菜发酵体系中分离获得一株具有较高生物胺降解能力的解淀粉芽孢杆菌LS1-002-014。通过分析菌株生长特性与环境耐受性,结合HPLC定量评估其生物胺降解效率;进一步利用PacBio三代测序技术解析该菌株的全基因组功能图谱,挖掘与生物胺代谢关键基因及调控网络,以阐明其生物胺降解的分子机制。该研究不仅为传统发酵食品中的胺类安全控制提供理论依据支撑,亦为功能性发酵剂开发奠定菌种资源基础。
1 材料与方法
1.1 目标菌株及其种子液的制备
菌株LS1-002-014分离自贵州省黔东南苗族侗族自治州镇远县某道菜生产企业,经16S rRNA基因序列技术鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),保藏于贵州大学发酵工程与生物制药重点实验室。实验前,将-80 ℃甘油管保藏的菌株划线接种于LB琼脂培养基中,置于37 ℃培养24 h后挑取单菌落,继而再将单菌落接种于LB液体培养基中,置于37 ℃、120 r/min条件下振荡培养12 h,连续传代三次后获得活化菌液,调节菌悬液浓度为1 × 108 CFU/mL的种子液备用。
1.2 菌株LS1-002-014的培养
LB琼脂培养基(g/L):蛋白胨10.0、酵母粉5.0、NaCl 10.0、琼脂15.0,pH 6.8~7.2;121 ℃灭菌15 min。上述培养基去掉琼脂,其他成分不变即为LB液体培养基。
生物胺降解培养基(microbial medium for biogenic-amine degradation,MLB):蛋白胨10.0、NaCl 10.0、生物胺各0.1(尸胺、酪胺、组胺、亚精胺、β-苯乙胺、色胺、丁二胺),pH 6.8~7.2;121 ℃灭菌 15 min。单一生物胺培养基指在保持MLB基础成分不变的条件下,将混合生物胺组分替换为某一种特定生物胺。
1.3 试剂
精氨酸、赖氨酸、组氨酸、酪氨酸、色氨酸、苯丙氨酸、亚精胺均为国产分析纯,北京索莱宝科技有限公司;尸胺、酪胺、组胺、亚精胺、β-苯乙胺、色胺、腐胺均为国产分析纯,上海阿拉丁生化科技股份有限公司;NaCl、NaHCO3、NaOH等均为国产分析纯,成都金山化学试剂有限公司;丙酮、乙腈为色谱纯,美国天地试剂公司。
1.4 仪器和设备
101-1AB电热恒温干燥箱,天津泰斯特仪器有限公司;YXQ-LS-75G立式压力蒸汽灭菌锅、BMJ-250C培养箱,上海博讯实业有限公司医疗设备;JJ-CJ-IFD型超净工作台,苏州市金净净化设备科技有限公司;Heraeus Multifuge X3R冷冻离心机、Varioskan Flash超微量全波长读数酶标仪,美国Thermo Fisher公司;721可见分光光度计,上海菁华科技仪器有限公司;1260 Infinity高效液相色谱仪,美国安捷伦有限公司;ZQPL-200立式振荡培养箱全温摇床,天津市莱玻特瑞仪器设备有限公司。
1.5 菌株LS1-002-014生长特性研究
1.5.1 生长曲线测定
将菌株LS1-002-014种子液按1% (体积分数)接种量分别接种入LB培养基和含7种混合生物胺的MLB培养基中,同时以接种1%无菌水的相应培养基为空白对照。所有培养基置于37 ℃、120 r/min下培养,每间隔2 h无菌采集1 mL培养液,测定600 nm波长处吸光度,持续监测至OD600nm值稳定。以培养时间为横坐标,OD600nm值为纵坐标,分别绘制常规条件和混合生物胺胁迫下的菌株生长曲线。
1.5.2 生物胺种类及浓度对菌株LS1-002-014生长的影响
将菌株种子液按1%(体积分数)接种量分别接入含0、50、100、200、400、600、800 mg/L单种生物胺培养基中,置于37 ℃、120 r/min下培养24 h。同时,将无菌水按相同比例接入不添加任何生物胺的MLB培养基作为对照。测定OD600nm值,分析不同种类及浓度生物胺对菌株生长的影响。
1.6 生物胺降解能力测定
1.6.1 生物胺混合标准曲线的制作
准确称取10 mg组胺、腐胺、亚精胺、色胺、β-苯乙胺、酪胺、尸胺,分别用0.1 mol/L HCl溶液定容至10 mL,配制1 g/L标准储备液置于-20 ℃下保存。取各储备液1 mL混合,用相同浓度HCl溶液稀释制备50、25、15、10、5、2.5 mg/L系列浓度标准使用液,于4 ℃下保存。采用HPLC法测定柱前衍生后的标准使用液,以峰面积(y)对浓度(x)绘制7种生物胺的标准曲线。
1.6.2 柱前衍生处理
取1 mL标准使用液或待测样品于5 mL棕色容量瓶中,依次加入200 μL浓度为2 mol/L NaOH溶液调节pH至碱性,300 μL的A液(饱和NaHCO3缓冲液)、2 mL的B液(含3,5-二硝基水杨酸10 mg/mL、酒石酸钾钠及NaOH的DNS显色剂),混匀后置于40 ℃避光水浴45 min后加入100 μL氨水终止反应,乙腈定容至5 mL后过0.22 μm滤膜待用。
1.6.3 HPLC分析条件
生物胺含量采用HPLC方法测定。色谱条件:使用SHIMADZU C18-AQ色谱柱(5 μm, 250 mm×4.6 mm),流动相A为水,流动相B为乙腈,进样量20 μL,柱温35 ℃,紫外检测波长254 nm。梯度洗脱程序从0 min的30%A/70%B(流速0.80 mL/min)开始,15 min时调整为25%A/75%B并增加流速至1.00 mL/min,22 min时改为15%A/85%B,25~28 min维持10%A/90%B,最后35 min时调整为40%A/60%B,15 min后流速均保持在1.00 mL/min。
1.6.4 生物胺降解能力的测定
将菌株LS1-002-014种子液按1%(体积分数)接入30 mL的LB液体培养基中,置于37 ℃、120 r/min下培养7 d。每日固定时间点取4 mL菌悬液,其中2 mL用于OD600nm值测定,另2 mL按上述HPLC条件进行7种生物胺含量分析。以培养时间为横坐标,生物量和生物胺降解率为纵坐标绘制曲线,所有实验设空白对照,3次重复。生物胺降解率按公式(1)计算:
(1)
式中:X,生物胺降解率,%;ρ,对照组生物胺质量浓度,mg/L;ρ1,实验组生物胺质量浓度,mg/L。
1.7 菌株LS1-002-014降胺特性的研究
考察温度(25、30、37、45、50 ℃)、NaCl质量分数(0、2.5、5、7.5、10%)和亚硝酸盐质量浓度(50、100、150、200、300 mg/L)对菌株降胺特性的影响。将菌株LS1-002-014种子液按1%(体积分数)接入不同条件的MLB培养基中,置于120 r/min下培养6 d,按公式(1)计算其生物胺降解率。
1.8 菌株LS1-002-014的基因组测序与分析
1.8.1 样品制备
将菌株从-80 ℃冰箱取出,经LB液体培养基连续传代活化3次后,划线接种于LB固体培养基中进行单菌落分离。继而,挑取单一菌落接种于LB固体培养基进行扩增培养,18 h后使用无菌双蒸水冲洗菌苔制备菌悬液。所得菌悬液经4 ℃,12 000 r/min离心10 min后,去除上清液,将菌体保存于-80 ℃的冰箱中待用。
1.8.2 DNA提取与基因组测序
采用细菌基因组提取试剂盒提取菌体DNA,以1 μg DNA为起始量在PacBio平台建库测序。使用Hifiasm软件组装原始数据,Circlator v1.5.5进行环化和起始位点调整,Pilon v1.22利用二代数据纠错,获得高质量基因组序列。
1.8.3 功能注释与基因分析
利用KEGG、GO和进化基因组注释(EggNOG)数据库进行功能注释,圆形基因组查看器(CGView)生成基因组环形图。通过KEGG Mapper数据库探究降胺相关基因并构建代谢途径,采用抗生素与次级代谢产物基因簇自动化分析(antiSMASH 4.0)进行基因簇预测和共线分析。
1.9 数据分析与处理
实验结果使用SPSS 22.0和Excel 2010进行相关统计和分析,利用Origin 9.0 Pro进行数据可视化处理,实验结果均为3次实验数据的平均值。
2 结果与讨论
2.1 生物胺降解菌生长特性分析
2.1.1 生长曲线的绘制
如图1所示,菌株LS1-002-014在常规条件与混合生物胺胁迫的后期生长动力学(60~90 h)中呈现显著差异(P<0.001)。在常规培养基中,菌株在培养0~60 h处于对数生长期,60 h后进入稳定期,最大OD600nm值为0.64±0.11。然而,在混合生物胺胁迫条件下,菌株的生长显著受到抑制,于44 h后便进入稳定期,最大OD600nm值为0.45±0.11,仅为常规条件的70.3%。此外,混合生物胺胁迫培养的菌株生物量在60 h后表现出持续下降的趋势,到84 h其OD600nm值降至0.58±0.03。
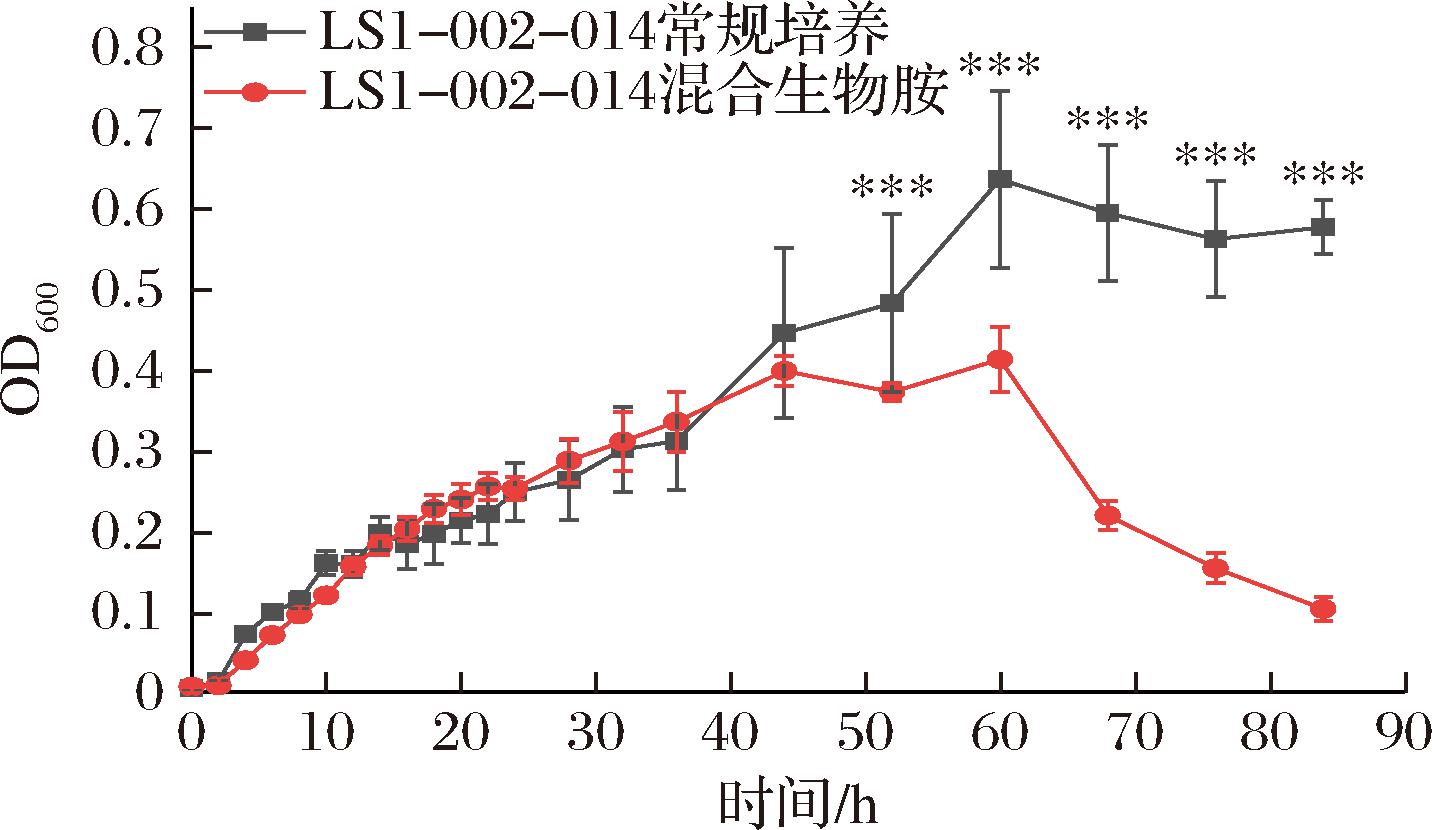
图1 LS1-002-014降胺菌的生长曲线
Fig.1 Growth curve of LS1-002-014 amine-degrading strain
注:以常规培养组为对照,混合生物胺组与之比较显著性(***代表P<0.001)。
研究发现,生物胺(如组胺、酪胺)可通过干扰细胞膜通透性、抑制关键酶活性或诱导DNA损伤等途径直接抑制微生物的生长[14]。在本研究中,混合生物胺可能通过竞争性抑制氨基酸转运系统,阻碍了菌株对碳氮源的高效利用,导致对数生长期的缩短和生物量积累的减少。这些结果表明,混合生物胺不仅抑制菌株的初期增殖,还对后期的代谢过程产生持续性抑制效应。
2.1.2 不同生物胺种类及质量浓度对降胺菌生长的影响
如图2所示,除组胺和腐胺外,其余生物胺质量浓度对菌株LS1-002-014的生长表现出剂量依赖性效应。酪胺、亚精胺和色胺在低质量浓度(<100 mg/L)时即表现出明显的抑制作用(降幅分别达到37.28%、27.22%和42.53%),而苯乙胺、尸胺在同等质量浓度下表现出较弱的抑制作用(降幅分别为10.23%、9.07%)。当亚精胺或色胺的单一生物胺质量浓度达到600 mg/L以上时,菌株生长几乎完全被抑制,OD600nm值趋近于0,而同等质量浓度下菌株在含其他生物胺的培养基中仍能继续生长。此类抑制作用的差异可能与多胺类物质的分子结构特征相关,以含3个—NH2的亚精胺和含有2个—NH2的尸胺为例,具有较多氨基官能团的物质更容易与细菌细胞膜的磷酸基团形成静电相互作用,从而破坏细胞膜的完整性[15]。
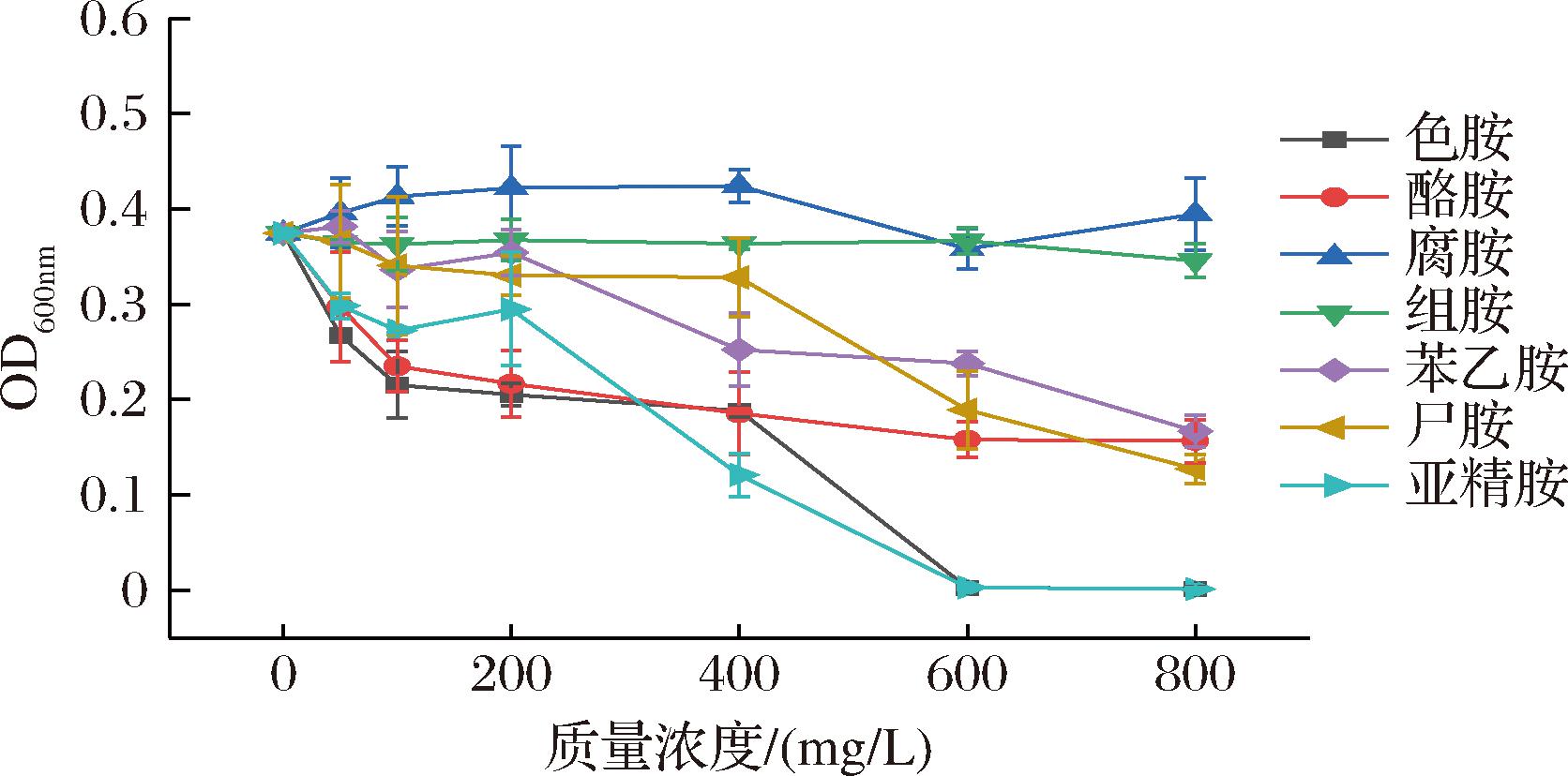
图2 不同生物胺种类及质量浓度对LS1-002-014降胺菌生长的影响
Fig.2 Effects of different types and concentrations of biogenic amines on the growth of LS1-002-014 amine-degrading strain
2.2 菌株LS1-002-014降解生物胺能力测定
2.2.1 生物胺的标准曲线
表1展示了7种生物胺的回归方程及相关系数。结果显示,所有生物胺的线性关系良好,相关系数均大于0.996,表明标准曲线具有较高的可靠性。
表1 7种生物胺的回归方程和相关系数
Table 1 Regression equations and correlation coefficients of 7 kinds of biogenic amines

生物胺回归方程相关系数(R2)色胺y=25.42x+24.940.997尸胺y=40.98x+32.140.999苯胺y=27.39x+40.740.999腐胺y=45.76x+10.570.998亚精胺y=66.47x+129.640.999组胺y=34.62x+17.870.999酪胺y=39.70x+59.130.999
2.2.2 降解生物胺能力测定
如图3所示,菌株LS1-002-014对亚精胺的降解率显著高于其他生物胺(P<0.01),并在第4天达到峰值(29.19±0.61)%,约为第1天的5.47倍,随后逐渐降低。菌株生物量呈先减后增趋势,在第4天降至最低值(OD600nm=0.23±0.005),与降解率呈现负相关关系。这可能是由于菌株在氮源快速消耗阶段优先通过降解BAs实现氮源同化,继而进入生物量恢复的二次生长阶段并最终达稳态,揭示该菌株采取“降解优先”的资源分配策略[16]。
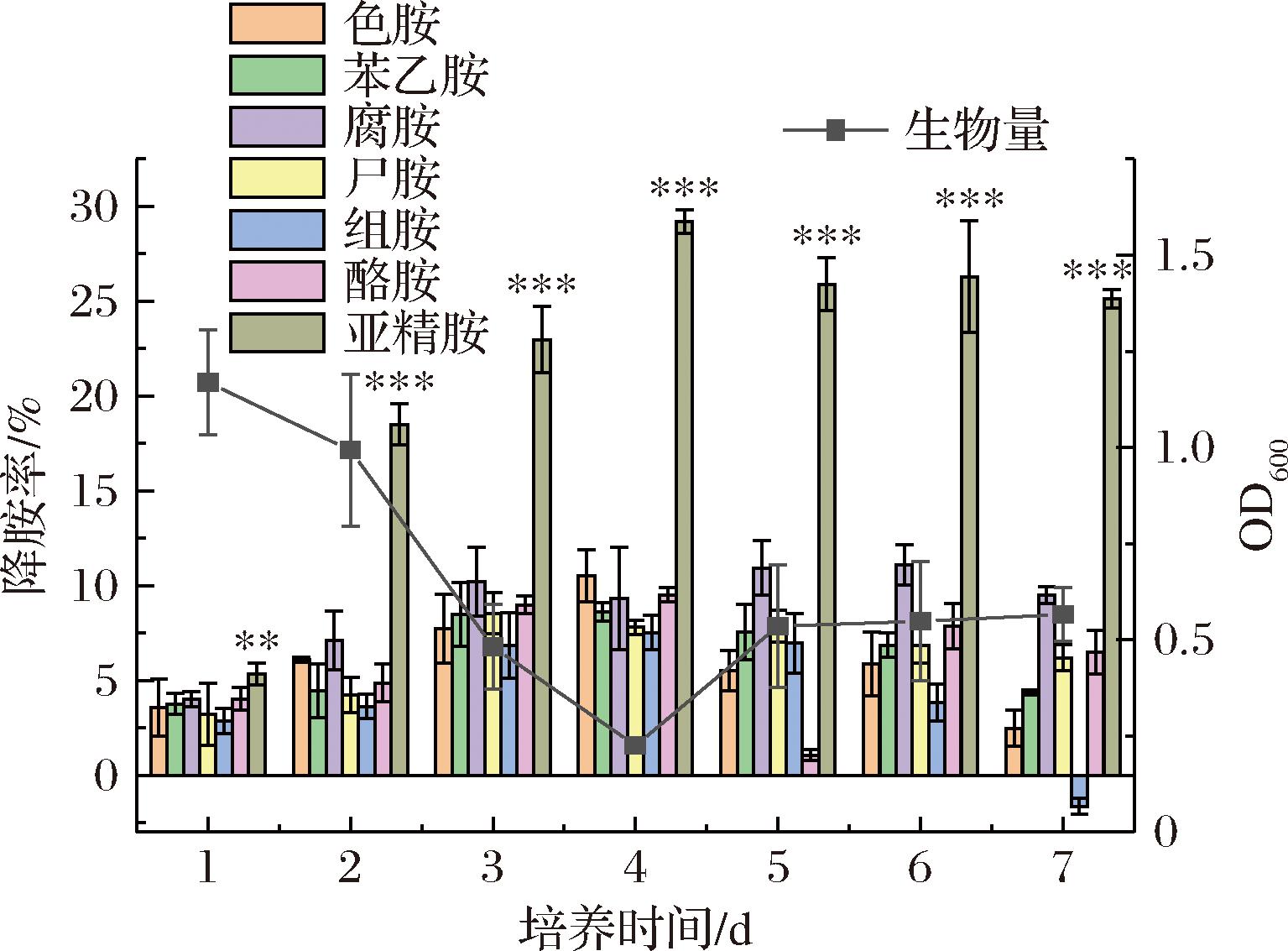
图3 菌株LS1-002-014在不同BAs浓度下的降胺率与生物量(OD600nm值)变化
Fig.3 Changes in amine degradation rate and biomass (OD600nm values) of strain LS1-002-014 at different BAs concentrations
注:显著性分析基于同1天内亚精胺与其他几种生物胺(酪胺、腐胺、组胺、苯乙胺、尸胺)直接进行比较而得(**P<0.01,***P<0.001)。
2.3 菌株LS1-002-014的降胺特性
2.3.1 温度对生物胺降解率的影响
由图4-a所示,37 ℃时菌株LS1-002-014对各类BAs的降解率均达到最高,其中对亚精胺的降解率(35.91±2.09)%显著高于其他BAs(P<0.001)。此后,随温度上升,菌株对各类BAs的降解率均出现下降,当温度升至50 ℃时,对BAs的降解活性几乎完全丧失。这表明37 ℃是该菌株降解多种BAs的最适温度,这一结果与亚精胺降解酶(如亚精胺脱氨酶、单加氧酶等)达到最佳活性条件相吻合[17]。此外,高温胁迫下酶蛋白的变性和细胞膜结构的破坏可能是导致菌株生物胺降解能力丧失的主要原因[18-19]。
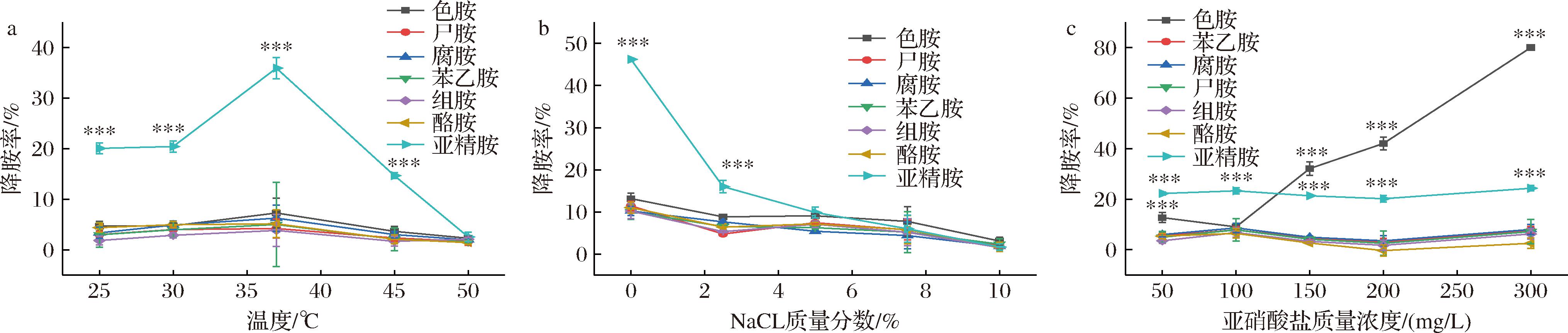
a-温度;b-NaCl质量分数;c-亚硝酸盐质量浓度
图4 不同条件对菌株LS1-002-014降胺率的影响
Fig.4 Effect of different conditions on the amine degradation rate of strain LS1-002-014
注:图a、b的显著性分析基于亚精胺降解率在相同条件下与其他生物胺的降解率进行比较而得,图c的显著性分析则是在亚精胺、色胺降解率在相同条件与其他生物胺降解率之间进行比较而得(***P<0.001)。
经研究显示,该菌株在亚精胺代谢过程中可能通过群体感应(quorum sensing,QS)系统介导降解酶的生物合成。PRESCOTT等[20]研究指出,当环境温度维持在37 ℃时,适宜的群体密度以及较高的QS信号分子浓度可以有效促进降解酶的合成,从而进一步提高亚精胺降解率。值得注意的是,当温度过高时,QS信号分子稳定性和浓度可能会降低,这种热敏效应可能对降解酶的生物合成产生抑制作用,最终导致生物胺降解率整体下降。
2.3.2 NaCl质量分数对生物胺降解率的影响
如图4-b所示,随着NaCl质量分数的递增,菌株LS1-002-014对生物胺的降解能力逐渐下降,尤其是亚精胺,其降解率在NaCl质量分数从0增加到2.5%时急剧下降,降胺率从(39.79±0.88)%骤降至(10.20±0.84)%,降幅达到74.38%。表明菌株对该胺类代谢对盐胁迫具有超敏特性。相比之下,其他生物胺的降解率变化相对较缓,在相同NaCl质量分数条件下,色胺降解率从(13.16±1.27)%降至(8.85±0.19)%,降幅为32.75%,酪胺降解率从(11.46±1.07)%降至(4.78±0.15)%,降幅为58.29%。这些结果表明,低盐环境(NaCl质量分数0%~2.5%)下菌株的降解酶系统对渗透压波动极为敏感。
值得注意的是,当NaCl质量分数升至2.5%~7.5%时,所有BAs降解率均进入稳态平台期[(4.41±3.36)%~(9.89±1.29)%]。当NaCl质量分数突破7.5%临界值后,生物胺降解率呈现二次下降趋势,但在10%(质量分数)高盐条件下菌株仍保留部分生物胺降解能力。这种在不同NaCl质量分数下表现出的降解特性体现了其盐胁迫下的适应性机制。这可能与芽孢杆菌属的多重盐响应机制相关,有研究表明,芽孢杆菌属普遍采用多种策略应对盐胁迫:在细胞结构层面,通过调节膜脂肪酸饱和度和磷脂组成,增强膜流动性和选择通透性[19];在细胞生理层面,通过积累脯氨酸等相容性溶质,维持渗透压平衡并保护蛋白质结构的同时,激活K+吸收系统和Na+/H+反向转运体以维持离子平衡[21];在分子调控层面,高盐条件激活σB转录因子诱导相关操纵子表达,合成分子伴侣蛋白,保护关键酶活性[22]。
2.3.3 亚硝酸盐质量浓度对生物胺降解率的影响
如图4-c所示,菌株LS1-002-014对色胺的降解率随亚硝酸盐质量浓度的增加呈直线升高,当亚硝酸盐质量浓度达到300 mg/L时,色胺降解率达到(79.94±0.44)%,较50 mg/L时提高了约6.3倍。这表明,亚硝酸盐质量浓度对菌株就色胺的降解活性产生强烈影响。相比之下,亚精胺的降解率稳定在(22.26±1.71)%左右,不受亚硝酸盐质量浓度的影响,分析原因可能是底物和酶的结合位点对亚硝酸盐的干扰具有较好抗性。其他生物胺的降胺率维持在较低的水平,变化趋势与亚精胺相似,受亚硝酸盐影响较小。
2.4 基因组特征
通过全基因组测序技术分析菌株LS1-002-014与生物胺代谢相关的关键基因,研究液态培养条件下该菌生物胺的代谢途径。结果表明,菌株LS1-002-014的完整基因组由一条4 214 996 bp的环状染色体和一条7 410 bp的质粒组成(图5),GenBank登录号分别为CP089530、CP089531,基因组特征如电子版增强出版附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.042443),染色体长度为4 214 996 bp,GC为46.12%。基因组分析结果确认菌株LS1-002-014为Bacillus amyloliquefaciens,其与Bacillus amyloliquefaciens TA208的ANI值为93.72%,与Bacillus amyloliquefaciens GKT04(GenBank登录号:CP072120.1)的ANI值高达98.98%,显示出较高的基因组相似性。基因组分析还显示,菌株共含有4 148个编码基因,占整个基因组的88.61%。12个成簇的规则间隔短回文重复序列(CRISPRs)和209个RNA,其中包含27个rRNA,86个tRNA,96个其他ncRNA。
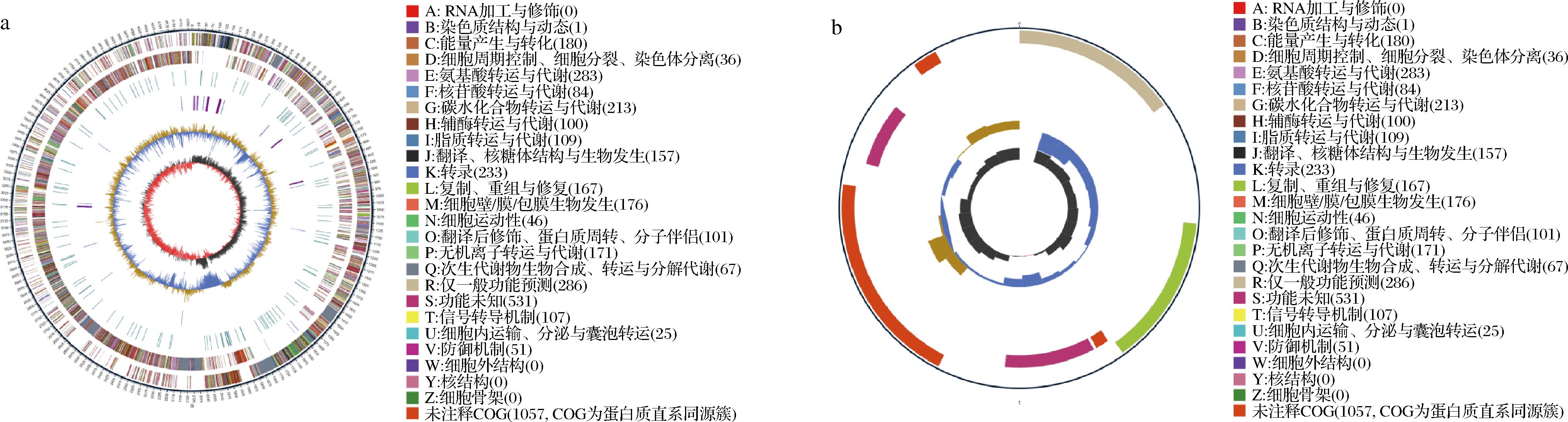
a-圆形染色体遗传图谱;b-质粒的循环图谱
图5 Bacillus amyloliquefaciens LS1-002-014的环状基因组图谱
Fig.5 Circular genomic mapping of Bacillus amyloliquefaciens LS1-002-014
注:染色体从外到中心的圆圈分别代表基因组大小、基因组正链与负链上的基因、重复序列、tRNA和rRNA、GC含量、GC-skew。
2.5 菌株LS1-002-014基因的功能注释
基于菌株LS1-002-014全基因组功能注释结果(表2),KEGG数据库共注释1 670个蛋白编码基因,eggNOG和GO数据库分别注释3 124和3 022个基因。各数据库注释差异可能与功能分类标准不同相关。
表2 菌株LS1-002-014基因功能注释
Table 2 Notes on gene function of strain LS1-002-014
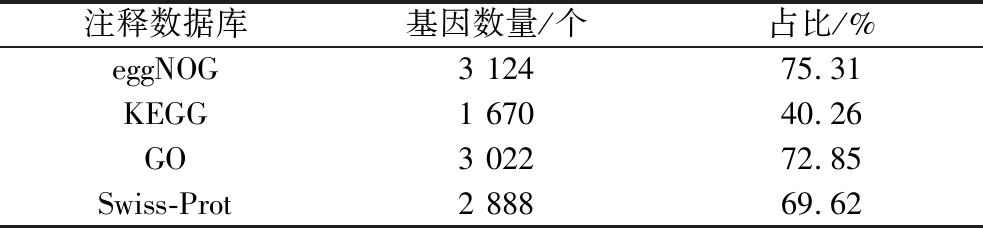
注释数据库基因数量/个占比/%eggNOG3 12475.31KEGG1 67040.26GO3 02272.85Swiss-Prot2 88869.62
2.5.1 菌株LS1-002-014 GO数据库注释与分析
在GO数据库中,基因功能被划分为三大类:生物过程、细胞组分和分子功能,对应注释到的基因数量分别为2 219、1 492、2 400(图6)。在生物过程类别中,注释到与代谢过程相关的基因数量最多,其中碳水化合物代谢、甘油代谢及半乳糖代谢等关键代谢途径共涉及1 514个基因,这些基因对于菌株的生理活动和代谢活性具有重要意义。此外,1 218个基因与细胞过程相关,该部分基因进一步揭示了菌株在细胞水平上的功能特征。
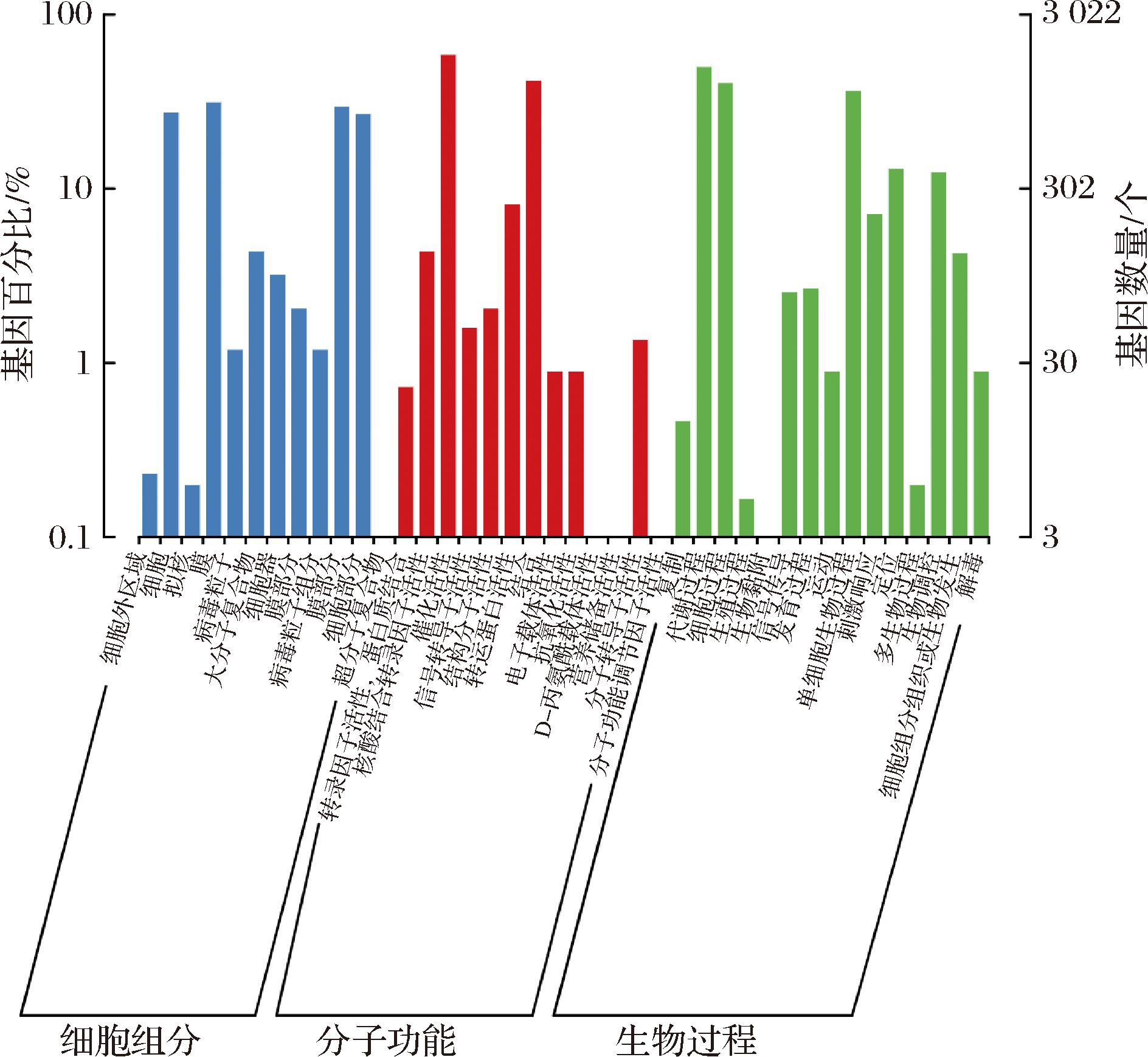
图6 菌株LS1-002-014 GO数据库注释结果
Fig.6 Annotation results of strain LS1-002-014 GO database
在细胞组分类别中,注释到与膜相关的基因数量达到949个,这表明该菌株可能具备较强的物质转运能力和跨膜交互作用能力。在分子功能类别中,注释到与催化功能相关基因有1 775个,这些基因不仅能够调控糖代谢、脂代谢等关键生化反应,还能指导多种功能性蛋白的合成。此外,注释到与结合功能相关的基因数量也多达1 256个,这些基因主要参与生物分子间的相互作用和调控,表明该菌株可能具备良好的代谢协同能力。
2.5.2 菌株LS1-002-014基因的KEGG功能注释
KEGG数据库整合了基因组、化学分子和生化系统等方面的数据,其中核心的代谢通路数据库将生物代谢通路分为7个大类:细胞过程(cellular processes)、药物开发(drug development)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、人类疾病(human diseases)、新陈代谢(metabolism)和有机体系统(organismal systems)[23]。
根据KEGG功能注释结果(图7)显示,菌株LS1-002-014的基因功能主要集中在新陈代谢、环境信息处理和遗传信息处理四大方面。在新陈代谢通路中共有1 291个基因得到了注释,氨基酸生物合成代谢相关基因数量最多(119个),其中包括前文提到的Agmatinase酶的关键合成基因。此外,本研究还注释到了相容性溶质积累系统中的关键酶,包括谷氨酸激酶(ProB,EC:2.7.2.11)和谷氨酸-5-半醛脱氢酶(ProA,EC:1.2.1.41),它们在芽孢杆菌属应对盐胁迫过程中发挥重要作用。碳水化合物代谢相关的基因也具有较高比例(100个),这表明该菌株具备强大的糖类代谢能力。在环境信息处理方面,共有233个基因被注释,其中与ABC转运蛋白相关的基因有119个,主要与膜转运系统相关;与双组分系统相关的基因有114个,其中RNA聚合酶σB因子(SigB)、渗透保护物质摄取系统A-D(opuA-opuD)等σB应激调控系统中的相关基因也被注释到。这表明菌株LS1-002-014具有较强的环境适应能力、物质转运效率和信号调控能力,能够在多变的环境条件下有效生存并完成复杂代谢任务,这与前期对其生长特性的研究结果一致。在遗传信息处理方面,有164个基因得到了注释,其中与核糖体相关的基因最多(56个),说明该菌株具备较强的蛋白质合成能力。
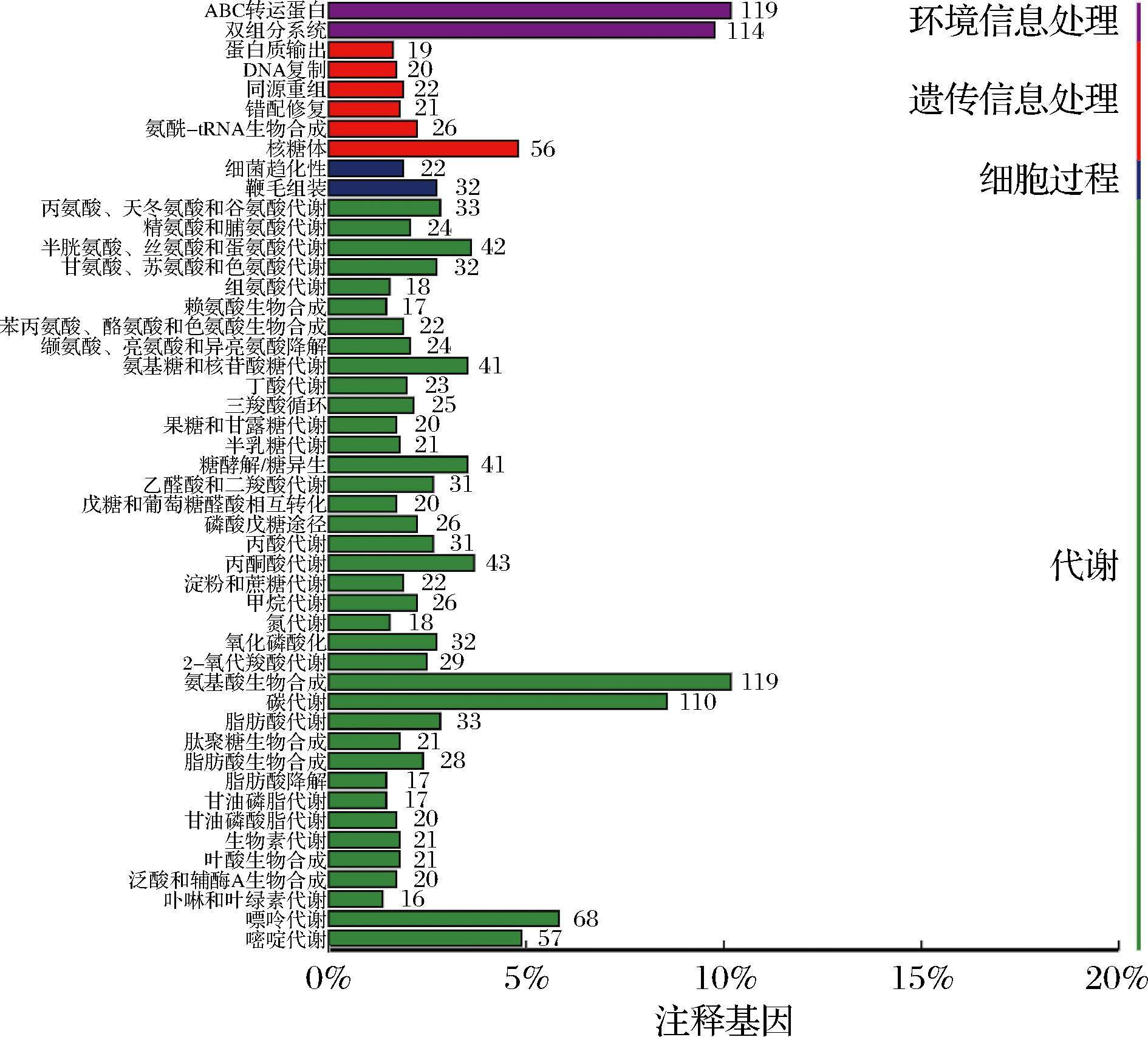
图7 菌株LS1-002-014基因的KEGG功能注释
Fig.7 KEGG functional annotation of genes in strain LS1-002-014
综上所述,KEGG功能注释结果表明,菌株LS1-002-014在碳水化合物代谢、氨基酸代谢和膜转运功能等方面表现出卓越的代谢能力和环境适应性,同时兼具较高的安全性和稳定性。这些特点使其成为一种理想的候选菌株,具有应用于食品发酵领域的潜力。
2.5.3 菌株LS1-002-014基因的eggNOG功能分类
基于eggNOG数据库的功能分类结果如电子版增强出版附图1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.042443),菌株LS1-002-014的基因组主要富集于3大功能类别,它们是“氨基酸转运和代谢(E类)”、“转录(K类)”和“碳水化合物转运和代谢”(C类)。首先,在“氨基酸转运和代谢”中,有286个基因被注释,这表明该菌株在氨基酸的利用、合成以及调控方面具有较高的转化能力。这可能赋予了该菌株在不同生长环境下获取和分配氮源的灵活性,从而增强其竞争力和适应性,这与上述关于菌株LS1-002-014降胺特性的研究结果相符。此外,在“转录”中,有233个基因被注释,说明该菌株拥有复杂的基因表达调控机制,这对于精确响应环境信号、优化代谢通路以及维持细胞内平衡具有重要意义。最后,在“碳水化合物转运和代谢”中,有224个基因被注释,这表明该菌株在糖类分解、利用及调控方面具有较强的能力,这对于其在环境中的碳源获取和能量代谢效率至关重要。这些功能富集结果综合揭示了LS1-002-014菌株在代谢多样性、基因表达调控以及分子适应性方面的潜力,为进一步研究其工业应用潜力(如碳源利用、高效代谢或产物合成)提供了重要的理论依据。
2.6 亚精胺生成及代谢相关基因及代谢途径的构建
实验结果表明,菌株LS1-002-014对亚精胺的降解率在不同温度、NaCl质量分数及亚硝酸盐浓度下均能保持相对高效稳定,且该菌的生长量与亚精胺浓度呈现剂量依赖效应。基于此,我们构建了该菌株的亚精胺代谢通路,通过分析KEGG注释及代谢通路,发现菌株LS1-002-014拥有一条高效的亚精胺生成及代谢路径(图8)。这条代谢通路的核心是精氨酸代谢到亚精胺的转化过程(图8虚线),涉及多个关键酶的作用,如精氨酸脱羧酶(speA)、鸟氨酸脱羧酶(speB)、N-乙酰转移酶(speG)和亚精胺合成酶(speE)等。菌株LS1-002-014的亚精胺代谢通路始于精氨酸,它可通过精氨酸酶(arg)转化为鸟氨酸(ornithine),或经过speA转化为胍丁胺(agmatine)。鸟氨酸经speC转化为腐胺,而胍丁胺经speB转化为腐胺,腐胺在speE作用下与S-腺苷甲硫胺酸结合形成亚精胺。

图8 基于KEGG构建亚精胺代谢通路
Fig.8 Construction of spermine metabolic pathway based on KEGG
注:红圈和黑圈分别表示本研究中编码关键酶的已注释到和未注释到的基因。引导线中虚线为亚精胺生成路径,实线为代谢路径,不同颜色表示不同的代谢路径。speA-精氨酸脱羧酶;speB-胍基丁胺酶;speC-鸟氨酸脱羧酶;speE-亚精胺合成酶;speG-二胺-乙酰转移酶;spdH-多胺脱氢酶;arg-精氨酸酶;MAO-单胺氧化酶;ALDH-乙醛脱氢酶;prr-氨基丁酸醛脱氢酶;kuaB-γ-胍基丁醛脱氢酶;MPAO-多胺氧化酶。
尽管解淀粉芽孢杆菌LS1-002-014在亚精胺降解中表现出高效的降解率和稳定性,但基因组分析显示其缺乏传统生物胺降解的关键基因(如单胺氧化酶MAO和腐胺合成酶speC)(图8中黑色圈部分),表明该菌株可能采用了非经典代谢途径来降解亚精胺。这一现象与CHE等[24]的研究存在相似性,其研究指出如铜绿假单胞菌等部分微生物通过多胺转运蛋白potE介导亚精胺的跨膜运输,随后由亚精胺脱氢酶(spdH)催化其完成脱氢反应,并非依靠传统的MAO途径。我们推测解淀粉芽孢杆菌LS1-002-014可能也采用类似的替代路径。此外,我们注意到该菌株中存在多铜氧化酶,这类酶可能在生物胺降解过程中发挥类似MAO的功能,从而保障了亚精胺代谢的完整性[25]。
这些结果为深入理解该菌株对亚精胺的高效降解机制提供了理论依据,同时也揭示了其在生物技术领域的潜力。尤其是在食品工业中,控制生物胺的含量是保障食品安全和品质的重要环节。菌株LS1-002-014的高效降胺特性及其独特的代谢策略,使其成为开发新型降胺技术的优选菌株。
3 结论
本研究证实,菌株LS1-002-014对7种生物胺的降解具有特异性,其中对亚精胺的降解效果在37 ℃下达最大,为(35.91±2.09)%(P<0.001)。此外,研究发现温度、NaCl质量分数和亚硝酸盐浓度等因素对菌株的生物胺降解活性有影响,在NaCl质量分数(0~2.5 g/L)和最适温度(37 ℃)下亚精胺降解率显著提升,在高盐环境下生物胺降解率有所下降,但菌株依然维持一定的降解活性,表现其具有较强的盐胁迫适应性。全基因组分析揭示了该菌株具备较强的环境适应性,携带speA(精氨酸脱羧酶)、speB(胍丁胺酶)、speG(乙酰转移酶)及speE(亚精胺合成酶)等关键代谢基因簇,可通过多种代谢途径维持亚精胺的降解功能。综上所述,菌株LS1-002-014具备在复杂环境中维持高效降解生物胺的能力,在发酵食品生物胺控制领域具有重要现实意义。基于其耐盐性、温度适应性和多酶协同代谢机制,该菌株可适用于酱油、干酪、发酵香肠等复杂发酵体系,尤其在盐分波动或分段控温工艺中可减少环境调控成本,其天然代谢特性避免了化学处理引发的食品安全争议。未来需进一步探究菌株LS1-002-014在更多复杂环境下(如温度-盐度耦合)的代谢响应机制,以及speE等关键酶在亚精胺代谢中的协同作用,探索该菌在实际发酵生产中的应用效果与可行性。
[1] WANG X L, LIU X T, SUN C M, et al.Effect of temperature on the quality and microbial community during Daocai fermentation[J].Food Chemistry:X, 2024, 24:101827.
[2] 何丝汀, 王力, 任艳玲.镇远陈年道菜的制作工艺及乳酸菌的分离与鉴定[J].现代食品, 2020, 26(11):164-166.
HE S T, WANG L, REN Y L.Study on producing process, isolation and identification of lactic acid bacteria in Zhenyuan Daocai[J].Modern Food, 2020, 26(11):164-166.
[3] DE ROOS J, DE VUYST L.Acetic acid bacteria in fermented foods and beverages[J].Current Opinion in Biotechnology, 2018, 49:115-119.
[4] CHAI L J, ZHANG J Y, GAO T, et al.Seasonality shapes the microbiota and metabolome of strong-flavor Baijiu during fermentation and affects its flavor characteristics[J].Food Bioscience, 2024, 62:105534.
[5] YANG J, DING X W, QIN Y R, et al.Safety assessment of the biogenic amines in fermented soya beans and fermented bean curd[J].Journal of Agricultural and Food Chemistry, 2014, 62(31):7947-7954.
[6] TUBOLY E, LEBOVICS V K, GA L Ö, et al.Microbiological and lipid oxidation studies on mechanically deboned Turkey meat treated by high hydrostatic pressure[J].Journal of Food Engineering, 2003, 56(2-3):241-244.
L Ö, et al.Microbiological and lipid oxidation studies on mechanically deboned Turkey meat treated by high hydrostatic pressure[J].Journal of Food Engineering, 2003, 56(2-3):241-244.
[7] 徐洁, 方芳.发酵乳杆菌多铜氧化酶的异源表达及酶学性质[J].生物工程学报, 2019, 35(7):1286-1294.
XU J, FANG F.Expression and characterization of a multicopper oxidase from Lactobacillus fermentum[J].Chinese Journal of Biotechnology, 2019, 35(7):1286-1294.
[8] LEE Y C, KUNG H F, HUANG Y L, et al.Reduction of biogenic amines during miso fermentation by Lactobacillus plantarum as a starter culture[J].Journal of Food Protection, 2016, 79(9):1556-1561.
[9] WOLDEMARIAMYOHANNES K, WAN Z, YU Q L, et al.Prebiotic, probiotic, antimicrobial, and functional food applications of Bacillus amyloliquefaciens[J].Journal of Agricultural and Food Chemistry, 2020, 68(50):14709-14727.
[10] PANDEY G R, SHRESTHA A, KARKI T B, et al.Screening and identification of thermotolerant and osmotolerant Bacillus amyloliquefaciens BKHE isolated from kinema of eastern Nepal for alkaline protease production[J].International Journal of Microbiology, 2022, 2022(1):6831092.
[11] ZAMAN M Z, ABU BAKAR F, SELAMAT J, et al.Occurrence of biogenic amines and amines degrading bacteria in fish sauce[J].Czech Journal of Food Sciences, 2010, 28(5):440-449.
[12] KEITAROU KIMURA, SATOSHI YOKOYAMA.Trends in the application of Bacillus in fermented foods[J].Current Opinion in Biotechnology, 2019,56:36-42.
[13] PALACIOS-RODRIGUEZ A P, ESPINOZA-CULUP A, DUR
A, DUR N Y, et al.Antimicrobial activity of Bacillus amyloliquefaciens BS4 against gram-negative pathogenic bacteria[J].Antibiotics, 2024, 13(4):304.
N Y, et al.Antimicrobial activity of Bacillus amyloliquefaciens BS4 against gram-negative pathogenic bacteria[J].Antibiotics, 2024, 13(4):304.
[14] SIMON SARKADI L.Chapter 27-Biogenic Amines in Fermented Foods and Health Implications[M]//Fermented Foods in Health and Disease Prevention.Boston:Academic Press, 2017:625-651.
[15] DI MARTINO M L, CAMPILONGO R, CASALINO M, et al.Polyamines:Emerging players in bacteria-host interactions[J].International Journal of Medical Microbiology, 2013, 303(8):484-491.
[16] QIN W, WEI S P, ZHENG Y, et al.Ammonia-oxidizing bacteria and Archaea exhibit differential nitrogen source preferences[J].Nature Microbiology, 2024, 9(2):524-536.
[17] PANG B, ZHOU L, CUI W J, et al.Improvement of the thermostability and activity of pullulanase from Anoxybacillus sp.WB42[J].Applied Biochemistry and Biotechnology, 2020, 191(3):942-954.
[18] 段雨帆, 钟嫒嫒, 肖愈, 等.一株具有降生物胺能力葡萄球菌的筛选及其降解特性[J].现代食品科技, 2023, 39(10):104-112.
DUAN Y F, ZHONG A A, XIAO Y, et al.Selection of a biogenic amine-degrading Staphylococcus strain and evaluation of its degradation properties[J].Modern Food Science and Technology, 2023, 39(10):104-112.
[19] 张美敬, 刘秀明, 邹亚杰, 等.侧耳属食用菌高温胁迫条件优化研究[J].菌物学报, 2015, 34(4):662-669.
ZHANG M J, LIU X M, ZOU Y J, et al.Optimization of heat stress for Pleurotus spp.cultivation[J].Mycosystema, 2015, 34(4):662-669.
[20] PRESCOTT R D, DECHO A W.Flexibility and adaptability of quorum sensing in nature[J].Trends in Microbiology, 2020, 28(6):436-444.
[21] ZHANG Y M, QIAO B, SHANG W, et al.Improving salt-tolerant artificial consortium of Bacillus amyloliquefaciens for bioconverting food waste to lipopeptides[J].Waste Management, 2024, 181:89-100.
[22] KEMPF B, BREMER E.OpuA, an osmotically regulated binding protein-dependent transport system for the osmoprotectant glycine betaine in Bacillus subtilis[J].Journal of Biological Chemistry, 1995, 270(28):16701-16713.
[23] ZHANG W W, GUO Y X, CHEN Q J, et al.Metagenomic insights into the lignocellulose degradation mechanism during short-term composting of peach sawdust:Core microbial community and carbohydrate-active enzyme profile analysis[J].Environmental Technology &Innovation, 2025, 37:103959.
[24] CHE S Y, LIANG Y K, CHEN Y J, et al.Structure of Pseudomonas aeruginosa spermidine dehydrogenase:A polyamine oxidase with a novel heme-binding fold[J].The FEBS Journal, 2022, 289(7):1911-1928.
[25] LI B B, LU S L.The importance of amine-degrading enzymes on the biogenic amine degradation in fermented foods:A review[J].Process Biochemistry, 2020, 99:331-339.