随着人类社会的快速发展,化石燃料的大规模利用和森林的乱砍滥伐造成了碳循环的失衡,导致大气中的CO2增多,引发了“温室效应”和全球变暖。为此,我国提出了“碳中和”的理念,包括节能减排和发展可再生能源等方式。厌氧消化(anaerobic digestion,AD)是生产可再生能源的技术,利用其过程产生的沼气可以减少化石燃料的使用。虽然厌氧消化技术在降解有机污染物和产生沼气的应用方面已经有较大的进展,但仍存在稳定性较差和甲烷产量较低等问题,因此需要提高厌氧消化的稳定性和甲烷产量。
电催化厌氧消化(electrocatalytic anaerobic digestion,EAD)吸引了一些研究者的目光。EAD是在厌氧环境下通过外加电场的作用,使电活性微生物富集,催化CO2还原为甲烷。AN等[1]提到电场环境富集电活性产电菌(exoelectrogenic bacteria,EEB)和电活性产甲烷菌(electrotrophic methanogenic archaea,EMA),能够通过直接电子转移(direct interspecies electron transfer,DIET)促进甲烷的生成。EEB在阳极生长,直接将电子从有机物转移至阳极;EMA能够接受来自阴极的电子,增加CO2的还原量来促进甲烷的生成。AO等[2]研究了双室微生物电解池集成厌氧消化系统,在外加电压的作用下,电活性菌能够在电极表面及沼液中富集,这可以同时增强DIET过程和难降解底物的水解。FLORES-RODRIGUEZ等[3]将生物电化学技术应用于厌氧消化过程中,在1.0 V外加电压下,投加2 000 mg/L的乙酸钠进行发酵。此过程中,EEB在阳极将有机物氧化,产生电子、质子、CO2和挥发性脂肪酸(volatile fatty acids,VFAs),电子通过外电路移动至阴极,阴极上的微生物再利用这些电子、质子和CO2产生甲烷等物质,最后使甲烷生成量相比于对照组提升了3.34倍。上述研究表明,外加电压能够有效提升厌氧消化的甲烷产率。然而,在电产甲烷过程中,H+的消耗显著增加,导致系统pH值升高,同时促进了CO2在基质液中的溶解,进而产生更多的无机碳(HCO3-/CO32-)[4]。无机碳增多会造成EAD沼液中碱度过高,抑制甲烷的生成[5],由于碱度逐步积累,即使在外加电压条件下,也阻碍了H+的电离释放,因此限制了嗜氢产甲烷代谢。乙酸作为产甲烷阶段的底物,能够为产甲烷菌提供碳源,提升甲烷产率。同时,乙酸也能够中和EAD沼液中的碱度,消除碱度过高对产甲烷的影响。
本研究以提升EAD过程的产甲烷效能、稳定运行并推进技术应用为目的。首先,利用乙酸中和HCO3-和CO32-,消除沼液中积累的碱度,实现EAD系统的稳定运行。其次,由于外加电压的催化作用,强化厌氧消化过程的电子转移,增强以CO2为反应物的嗜氢产甲烷过程,从而提高沼气中的甲烷含量。最后,通过实验和机理研究,提出以乙酸为唯一底物的EAD表观产甲烷反应方程式。该式能表达以乙酸为底物的EAD反应机理,对优化运行设置及预测甲烷产量具有重要意义。
1 材料和方法
1.1 材料与试剂
接种污泥取自本团队自行研制的有效容积为100 L的CSTR厌氧反应器,在中温条件下[(37.5±0.5) ℃]已连续稳定运行4年,使用畜禽养殖废弃物和有机碳源(酸化面粉)进行批次投料。接种污泥的总固体(total solids,TS)为9.0%,挥发性固体(volatile solids,VS)为5.2%,pH值为7.93,碱度为4 413 mg/L。将污泥离心和过40目筛网过滤后接种于EAD反应器内。
乙酸、盐酸和NaHCO3,西陇科学股份有限公司;高纯甲烷、高纯CO2,柳州市弘润气体有限公司;碳刷电极材料,荆州浩特新材料有限公司。
1.2 仪器与设备
3BG磁力搅拌玻璃发酵罐,上海保兴生物有限公司;SUP-5022 pH传感器,杭州美仪自动化技术股份有限公司;PLUS-E3超纯水仪,南京易普易达科技发展有限公司;DHG-9146A电热恒温干燥箱,上海精宏实验设备有限公司;5-12马弗炉,上海康路仪器设备有限公司;SF-TGL-16G 高速离心机,上海菲恰尔分析仪有限公司;pH计,上海雷磁公司;GC-17A气相色谱仪,岛津公司;Clarus 590 GC气相色谱仪,珀金埃尔默公司。
1.3 实验方法
1.3.1 实验装置
EAD反应器使用3.2 L发酵罐(图1),有效发酵体积为3 L。将pH传感器、阴极和阳极等放置在玻璃发酵罐当中。实验流程:投加乙酸时,关闭气路2(生化产气气路),打开气路1(化学产气气路),确保乙酸与碱度反应所释放的CO2进入化学集气袋;乙酸投完后,打开气路2,关闭气路1,使生化反应产生的沼气进入生化集气袋。通过传感器获取pH值数据并存储至上位机内;每2 h更换生化气路的集气袋收集沼气,后续检测沼气中的甲烷含量和沼气产量;每天固定时间点取5 mL的液体样测量VFAs。
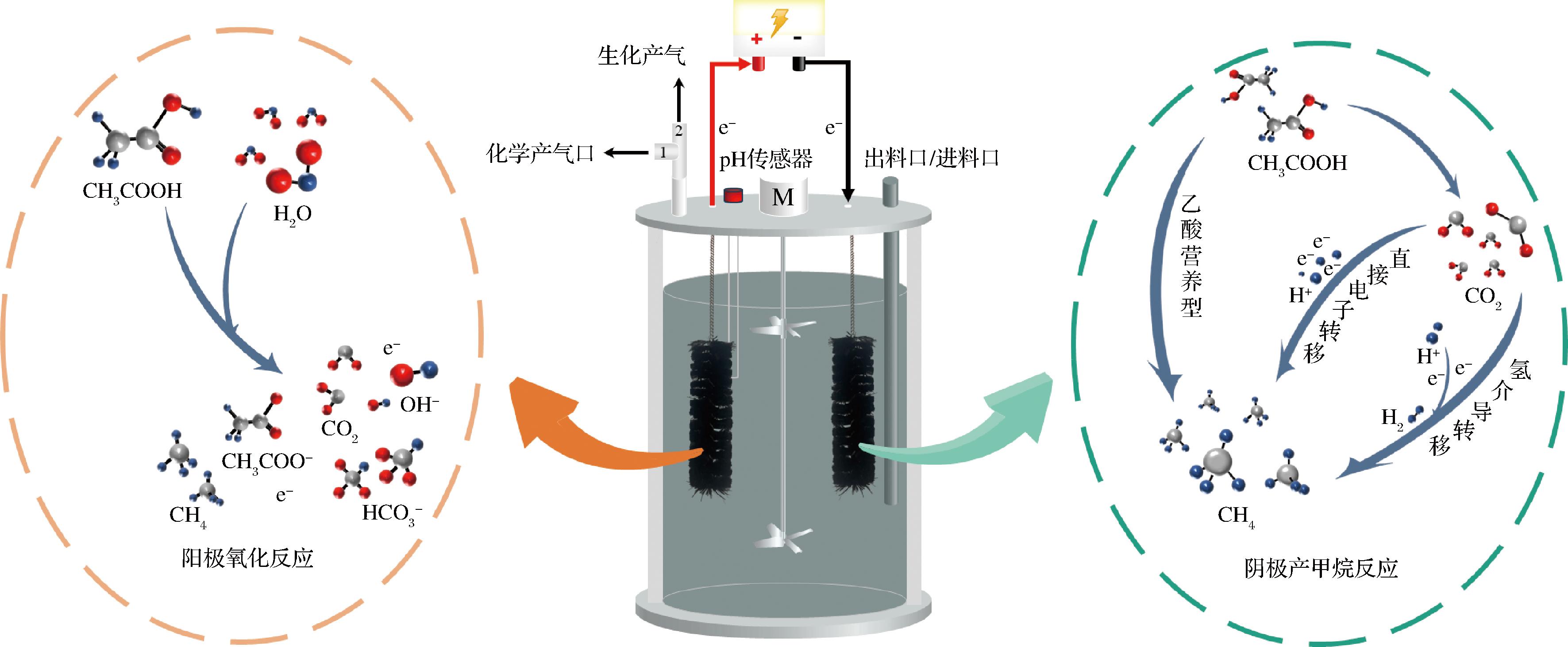
图1 电催化厌氧消化实验装置
Fig.1 Electrocatalytic anaerobic digestion experimental setup
1.3.2 实验设计
实验唯一底物为乙酸(CH3COOH),通过蠕动泵匀速投加至EAD中。根据运行4年的100 L厌氧消化发酵罐中有机物的投加量,将8 333 mg/L的乙酸设为初始质量浓度,逐次递增乙酸浓度。本实验根据乙酸投加量可分为3个阶段,分别为8 333(A)、10 000(B)和11 667 mg/L(C)。每阶段重复4批次,如表1所示,每批次发酵时间为4 d(A1代表8 333 mg/L质量浓度的第1个批次,以此类推)。实验中,通过重复投加相同乙酸浓度的实验,使微生物群落适应该种乙酸浓度环境,确保微生物种群结构与数量保持稳定。
表1 电催化厌氧消化产甲烷实验设计
Table 1 Experimental design of electrocatalytic anaerobic digestion for methane production
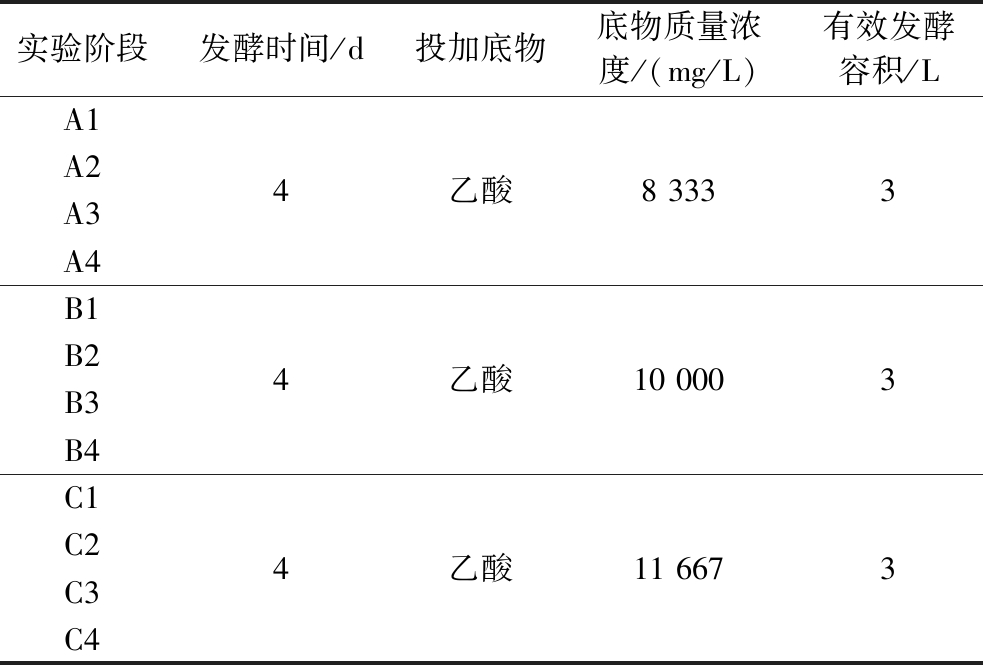
实验阶段发酵时间/d投加底物底物质量浓度/(mg/L)有效发酵容积/LA1A2A3A44乙酸8 3333B1B2B3B44乙酸10 0003C1C2C3C44乙酸11 6673
1.3.3 分析方法
TS和VS含量采用标准质量法[6]进行测量;电催化厌氧消化液相中的碱度浓度(HCO3-和CO32-)通过双终点滴定法[7]检测;pH值通过Sup-5022 pH传感器监测;沼气产量通过排水集气法收集。
沼气组分测定使用气相色谱仪(GC-17A,PEG-20M色谱柱,柱温60 ℃,进样口温度120 ℃,检测器温度200 ℃,载气为高纯N2);VFAs测定使用气相色谱仪(Clarus 590 GC,FFAP色谱柱,FID检测器,柱温140 ℃,进样口温度150 ℃,检测器温度230 ℃,载气为高纯N2)。
委托生工生物工程(上海)公司采用微生物高通量测序分析反应器中古菌和细菌的群落结构,其中DNA采用OMEGA试剂盒 E.Z.N.ATM Mag-Bind Soil DNA Ki进行提取,随后使用Qubit3.0 DNA检测试剂盒对基因组DNA定量。
2 结果与分析
2.1 电催化厌氧消化中的乙酸降解和CO2还原过程
厌氧消化的产甲烷阶段通过乙酸营养型产甲烷途径将乙酸分解成甲烷和CO2。产甲烷菌分解乙酸生成的气体中甲烷和CO2含量各占50%。然而,实际沼气中甲烷含量往往大于50%,这与氢营养型产甲烷途径还原CO2产生甲烷有关。厌氧消化的产氢产乙酸阶段产生的H2,参与CO2的还原过程,能够有效提高甲烷含量[8]。基于H2参与CO2的还原过程,通过电催化厌氧消化来提升甲烷含量。外加电场能够为CO2还原提供更为丰富的电子,EMA能够通过直接电子转移方式从电极上获得电子还原CO2;也能够通过氢转移方式产生甲烷,H+在电活性微生物的作用下变成H2后,参与CO2还原,迅速转变为甲烷。同时,同型产乙酸菌也能够在电催化条件下将CO2还原成乙酸,随后参与产甲烷过程。因此在电催化条件下能够利用H+直接参与CO2的还原。上述产甲烷机理[9]见表2。
表2 电催化厌氧消化产甲烷机理[9]
Table 2 Mechanism of methane production by electrocatalytic anaerobic digestion[9]
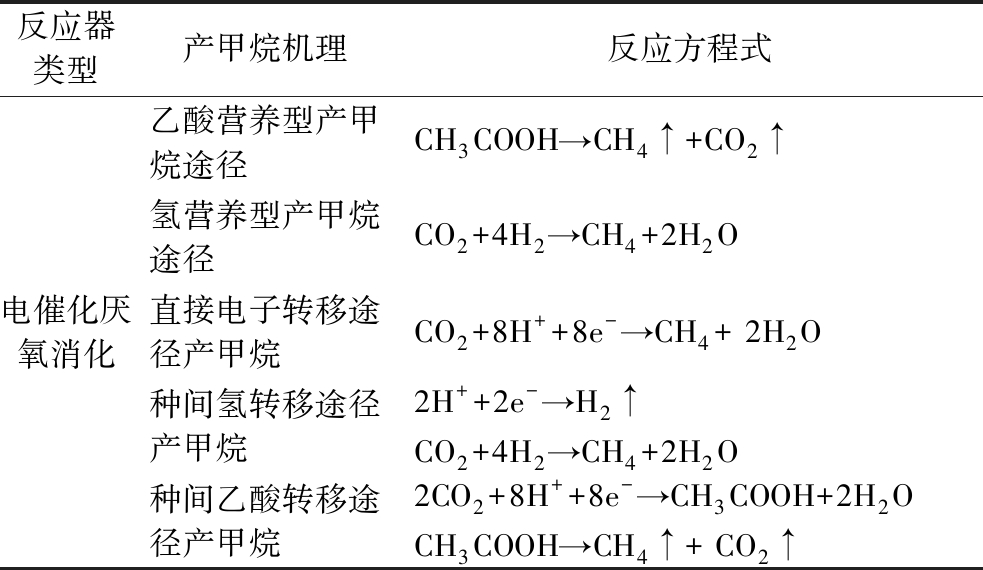
反应器类型产甲烷机理反应方程式电催化厌氧消化乙酸营养型产甲烷途径CH3COOH→CH4↑+CO2↑氢营养型产甲烷途径CO2+4H2→CH4+2H2O直接电子转移途径产甲烷CO2+8H++8e-→CH4 + 2H2O种间氢转移途径产甲烷2H++2e-→H2↑CO2+4H2→CH4+2H2O种间乙酸转移途径产甲烷2CO2+8H++8e-→CH3COOH+2H2OCH3COOH→CH4↑+ CO2↑
相较于传统AD,EAD具有更为丰富的产甲烷途径。为深入研究EAD的产甲烷效能,有必要提出综合性的表观产甲烷反应式,使其反映以乙酸为底物时的产甲烷过程。以乙酸作为唯一底物进行电催化厌氧消化时,产甲烷菌能够有效分解乙酸,释放甲烷和CO2。之后,部分的CO2溶于水后转变为H2CO3,其解离出的H+参与CO2的还原反应[10]。同时,CO2的还原过程还伴随着大量碱性离子(HCO3-+CO32-)的生成[11]。根据上述产甲烷过程,提出EAD的表观产甲烷反应式(1)。
7CH3COOH+3H2O+8e-→8CH4↑+2HCO3-+3CO32-+CO2↑
(1)
反应式(1)中,CH3COOH、CH4、(HCO3-+CO32-)和CO2摩尔数的比值为7∶8∶5∶1。参与产甲烷过程的物质摩尔数的实验值及理论值如图2-a所示[计算摩尔数时将n(CH3COOH)作为基准(设为7),同时保持其他数与该基准值的相对比例不变],图2-a中可知4种物质的摩尔数比接近于7∶8∶5∶1,但仍存在误差。首先是A、B和C的第一批次甲烷、碱度摩尔数显著偏低,此现象说明EAD存在微生物群落对乙酸浓度递增后的适应与调整过程,该过程影响了CO2的还原,导致碱度积累和甲烷产量减少。其次,实验测得CO2摩尔数始终偏高,这主要源于发酵前期,乙酸与碱度发生化学反应有滞后性,使部分应该归属于化学产气的CO2在气路切换后进入生化产气袋中。此外,A、B和C的二、三和四批次的碱度略偏高,这是由于还原CO2的反应包括产甲烷过程和产乙酸过程,产乙酸过程也提供了额外的碱度。通过分析实验数据和误差,验证了参与产甲烷反应的各物质之比基本符合7∶8∶5∶1的规律。图2-b展示各批次的碱度浓度变化,投加的乙酸首先通过化学反应[反应式(2)、反应式(3)]有效消耗上批次积累的碱度,生成CO2(EAD各批次的化学产气数据详见表3),显著降低EAD的初始碱度。随后,进入生化阶段,产甲烷菌分解乙酸产生甲烷和CO2后,EMA还原部分的CO2后在系统内重新生成碱度[见反应式(1)]。EAD中以乙酸为底物的发酵过程伴随着基质液碱度的积累和释放,这有效调控EAD的碱度,使pH值维持在适宜的范围内,提高系统的运行稳定性。乙酸降解效率是反应器运行稳健的关键因素,乙酸积累会导致反应器的酸败。由图2-c可知,EAD能够快速将乙酸代谢,这得益于电场环境下氧化还原作用的增强,阳极与EEB的协同作用将乙酸快速降解;同时,阴极与EMA的促进作用产生甲烷,有效增强了乙酸代谢作用,从而使反应器稳定运行。碱度积累和乙酸降解共同影响pH值的回升,分析图2-d的pH值变化规律。3个阶段的pH值维持在6.0~8.6,该pH值范围适合厌氧消化嗜中性微生物的生长[12],因此pH值都能够在4 d的发酵时间内上升至最高值,并没有出现酸抑制现象。厌氧消化末期出现最大pH值为8.62并保持稳定,归因于发酵末期大部分的乙酸被降解,限制其继续为产甲烷菌提供碳源。同时,碱度上升至阈值,使CO2在沼液中的溶解度显著降低,阻碍其还原过程,对参与还原的氢营养型产甲烷菌等微生物产生不利影响。通过监测EAD运行状态下的乙酸根浓度、碱度浓度和pH值变化规律,可以准确了解EAD的产甲烷进程以及运行状况,从而确保EAD反应器稳定运行。
CH3COOH+HCO3-→CH3COO-+H2O+CO2↑
(2)
2CH3COOH+CO32-→2CH3COO-+H2O+CO2↑
(3)
表3 EAD的化学产气及其CO2含量
Table 3 Chemical reaction of EAD produces gas and CO2 content
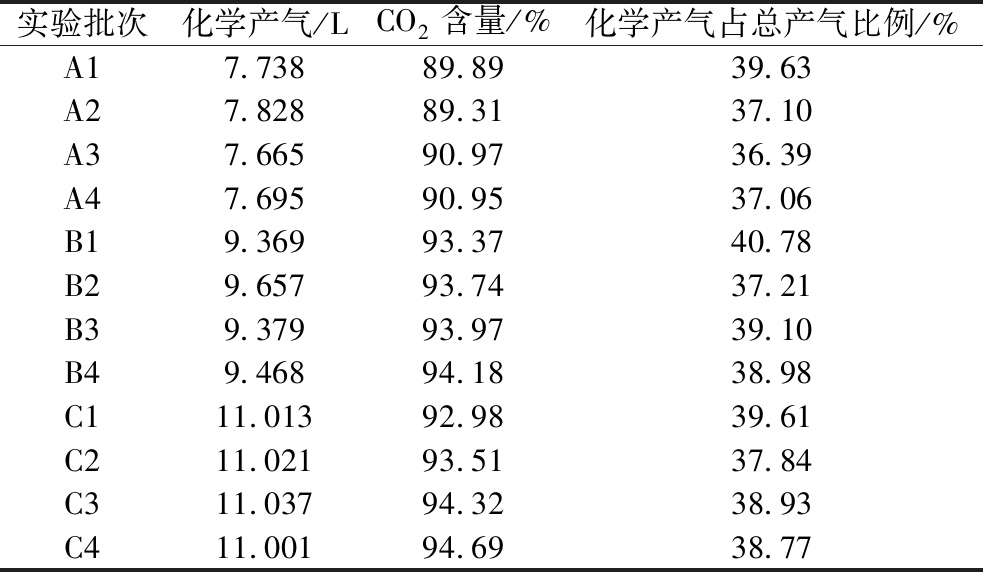
实验批次化学产气/LCO2含量/%化学产气占总产气比例/%A17.73889.8939.63A27.82889.3137.10A37.66590.9736.39A47.69590.9537.06B19.36993.3740.78B29.65793.7437.21B39.37993.9739.10B49.46894.1838.98C111.01392.9839.61C211.02193.5137.84C311.03794.3238.93C411.00194.6938.77
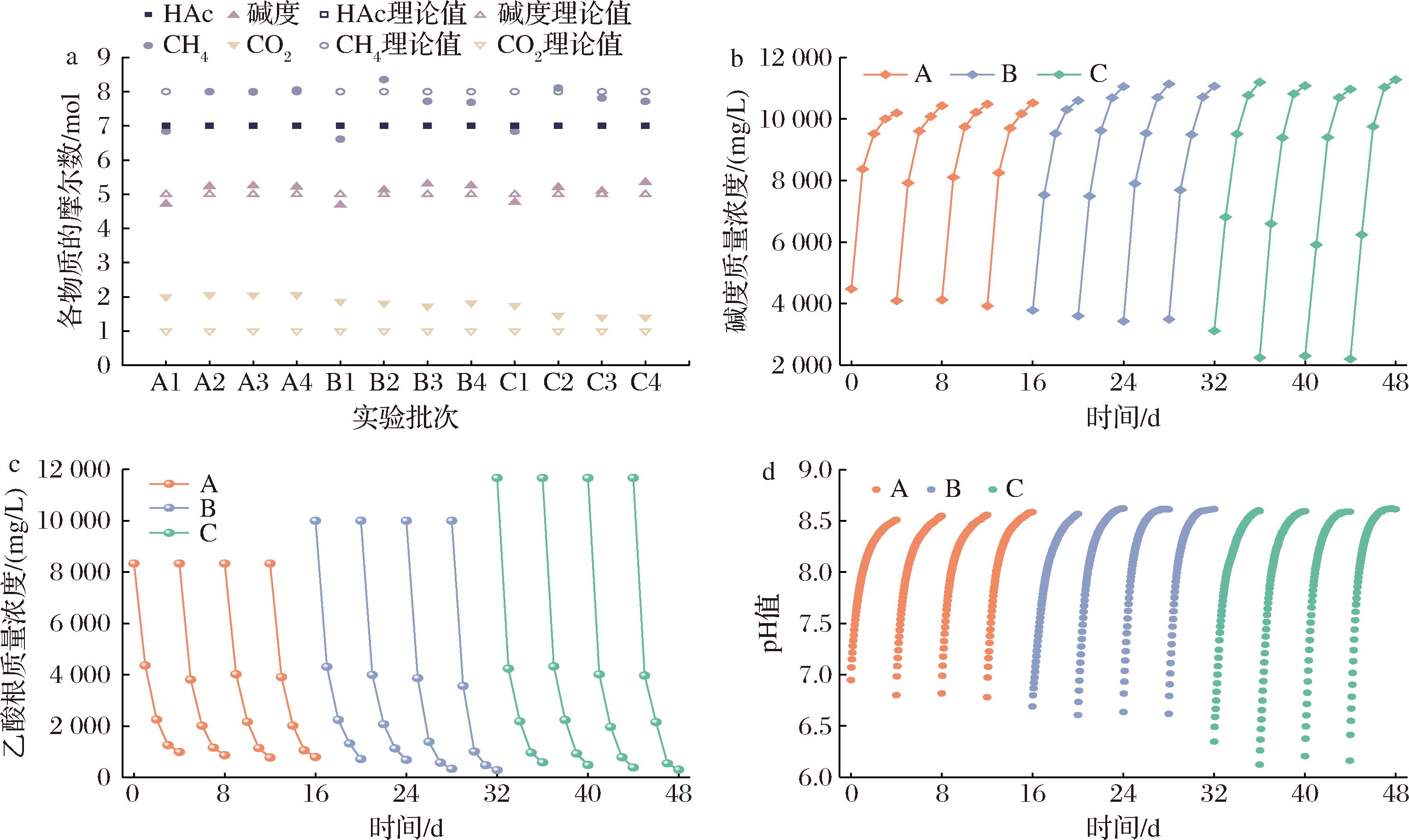
a-物质的摩尔数;b-碱度;c-乙酸根浓度;d-pH值
图2 乙酸降解与CO2还原过程中参数的变化
Fig.2 Variation of parameters during degradation of acetic acid and reduction of CO2
2.2 乙酸投加量对系统产甲烷效率的影响及机理研究
图3展示各批次沼气中甲烷含量随时间的变化曲线,该曲线能够反映EAD反应器的运行状态和效率。可将产甲烷过程大致划分为4个阶段:初始阶段,甲烷含量呈现出较低值,标志着化学产气过程向生化产气过程的过渡;随后是上升阶段,甲烷含量能够在约10 h内骤升至70%以上,这得益于乙酸能够直接作为产甲烷阶段的底物,避免了水解酸化等产乙酸步骤的限速,同时电场环境也增强了氧化还原反应的效率,能够有效还原CO2;紧接着是稳定阶段,甲烷含量增势放缓,这时产甲烷菌的代谢能力达到较高水平,甲烷的生成速率达到最大值;最后是下降阶段,底物不足和碱度积累使甲烷的生成速率降低,此时甲烷含量趋于稳定或略有下降。
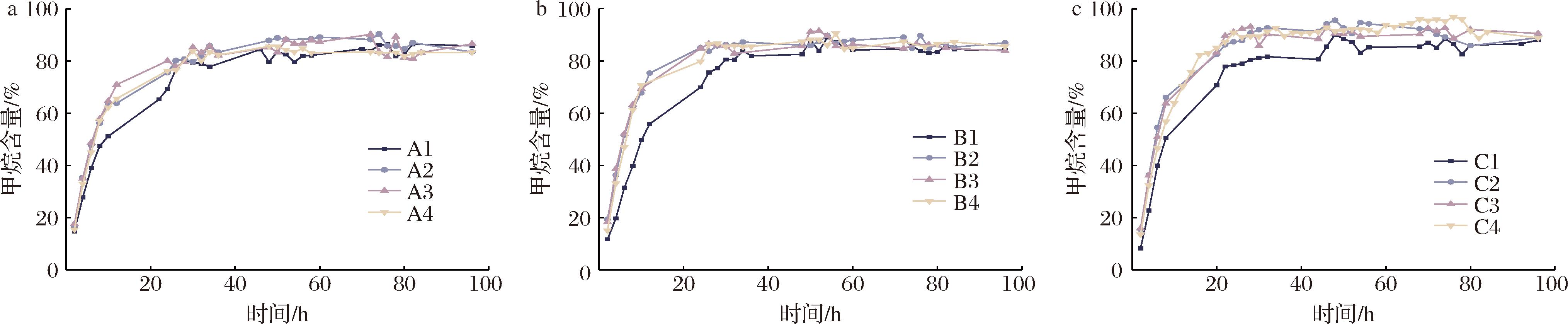
a-A阶段;b-B阶段;c-C阶段
图3 不同乙酸投加量下甲烷含量随时间变化情况
Fig.3 Variation of methane content with time under different dosages of acetic acid
对比相同阶段的4个批次甲烷含量曲线,第一批次的甲烷含量变化曲线显著区别于后面三批次。这一现象归结于乙酸投加量增加后,EAD的发酵环境改变,微生物群落适应环境的过程。微生物经过第一批次的驯化作用,逐渐适应了新环境,因此后三批次的甲烷含量变化曲线趋于稳定,促进甲烷的高效产生。对比图3-a~图3-c,A、B和C三阶段的甲烷含量曲线的阈值和整体水平随乙酸投加量增加而逐步升高,这是由于乙酸投加量增加后能够为产甲烷菌提供更多的碳源,增强微生物的代谢作用,能够从沼液中获取更多的H+参与CO2的还原。在以乙酸为唯一底物进行电催化厌氧消化过程中,甲烷含量能够骤升且保持在较高水平,特别是C4批次达到峰值96.88%,这表明EAD在处理高浓度乙酸时具有较好的稳定性、耐冲击性和产甲烷效率。
累积产甲烷量是衡量电催化厌氧消化的重要指标之一,其变化趋势如图4所示。加大乙酸的投加量,累积产甲烷量也随之增加。这是因为乙酸为产甲烷阶段的底物,底物的增加能够有效增加累积产甲烷量[13]。传统厌氧消化在乙酸质量浓度大于767 mg/L时造成酸抑制[14],电催化厌氧体系投加高浓度乙酸,无酸化现象,反而具有提升产气的效果。这是因为在电场环境下,能够增加对降解乙酸/乙酸根产生甲烷的酶的表达[15];同时,EAD中EEB会分解乙酸生成电子和质子,加快乙酸的利用和降解。A1、B1和C1三个批次,其曲线明显低于相同乙酸浓度条件下的后续三批次,这是乙酸浓度递增后影响了首批次微生物的代谢过程。值得注意的是,B2与C2批次在相同乙酸浓度条件下展现出更高的累积产甲烷量,这可能与B1和C1批次不适应环境而凋亡的微生物分解释放的营养物额外贡献有关,由此可知,EAD系统具备短时间内恢复并适应新环境的能力。此外,各批次后期均出现明显拐点,产甲烷效率下降,与甲烷含量反映出的下降阶段相呼应。综合分析累积产甲烷量,同阶段曲线,前两批次波动显著,第三、四批次则趋于平稳,反映出系统逐渐适应乙酸递增后的环境,达到稳态的趋势。
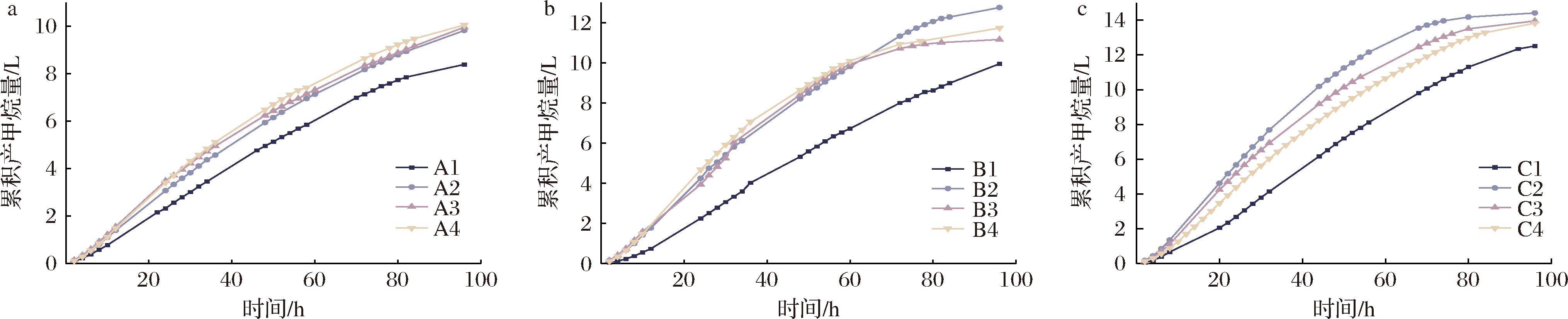
a-A阶段;b-B阶段;c-C阶段
图4 不同乙酸投加量下累积产甲烷量随时间变化情况
Fig.4 Cumulative methane production as a function of time at different acetic acid dosages
如表4所示,电催化条件对产甲烷性能具有强化作用。乙酸作为EAD的底物,反应器内发生的产甲烷反应主要是嗜乙酸产甲烷和嗜氢产甲烷这2种途径。乙酸产甲烷途径中甲烷的产生来源于它们的甲基[16]。除此之外,乙酸也能够在乙酸氧化菌和产甲烷菌之间的共生作用产生甲烷。EAD中一些乙酸营养型产甲烷菌在电催化作用下会激活其还原CO2的能力,并成为优势菌种,如甲烷丝菌(Methanothrix)等。因此,EAD体系中存在更丰富的CO2还原机制,能显著增加甲烷收益。随着乙酸投加量的增加,平均甲烷含量从62.58%升至80.59%,单日平均池容产气率从1.153 m3/(m3·d)涨至1.442 m3/(m3·d)。乙酸投加量增加不仅有效促进了碱度的释放,显著降低了碱度对产甲烷过程的抑制作用,而且为产甲烷菌提供了更为丰富的碳源,从而有助于提升产甲烷过程的效率与产量。
表4 A4、B4和C4批次的单日平均池容产气率和平均甲烷含量
Table 4 Single-day average pool gas production rates and average methane content for batches A4, B4 and C4
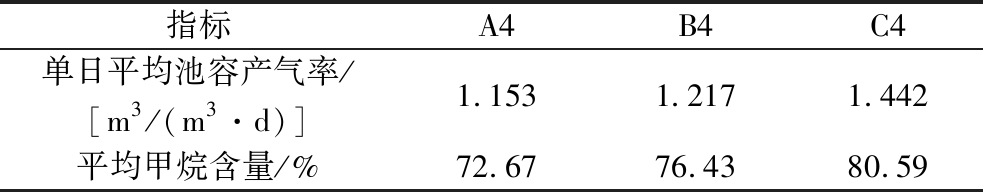
指标A4B4C4单日平均池容产气率/ [m3/(m3·d)]1.1531.2171.442平均甲烷含量/%72.6776.4380.59
2.3 EAD环境下微生物相对丰度的变化
微生物菌群结构组成能够影响沼气发酵过程中的性能[17],在电催化条件和高浓度乙酸环境下持续运行48 d,观察EAD微生物相对丰度的变化情况。AD和EAD反应器内悬浮污泥微生物的产甲烷古菌优势菌属(相对丰度>1%),如图5-a所示。EAD和AD的产甲烷古菌的相对丰度有较大差异。在EAD和AD中发现的相同种类产甲烷古菌,它们分别是甲烷丝菌(Methanothrix)、甲烷螺菌(Methanospirillum)、甲烷杆菌(Methanobacterium)、马赛球菌(Methanomassiliicoccus)、甲烷袋状菌(Methanoculleus)以及广古菌门(Euryarchaeota)。相比于AD来说,EAD中Methanothrix和Euryarchaeota有所增加,其他的产甲烷古菌出现不同程度的减少。EAD中的Methanothrix为优势菌种,它的相对丰度从20.17%增至69.61%。Methanothrix在AD中为乙酸营养型产甲烷菌,电场环境下Methanothrix激活还原CO2的能力,在阴极和沼液中富集参与CO2的还原生成甲烷。Euryarchaeota的相对丰度从3.22%增长至19.57%。在EAD系统中,尽管产甲烷古菌的多样性有所下降,但实验数据显示,甲烷产量却有了显著提升。这一结果揭示,Methanothrix和Euryarchaeota在EAD环境中展现出了更高的产甲烷效率和活性。Methanospirillum的相对丰度从20.55%降至8.96%,Methanobacterium、Methanomassiliicoccus和Methanoculleus为氢营养型产甲烷菌,它们利用H2或甲酸作为电子供体来还原CO2产甲烷[18],但它们的相对丰度都出现了不同程度的降低,这可能存在高浓度的底物抑制作用和还原CO2的过程以直接电子转移方式占优有关。最后是甲烷八叠球菌(Methanosarcina),它的相对丰度从37.35%下降至0.002%,这是一种兼性产甲烷菌,它可以利用乙酸也可以利用H2/CO2生成甲烷,但是它在EAD中对还原CO2产生甲烷几乎没有贡献,可能是因为它在高乙酸浓度水平下被完全抑制。电催化条件以乙酸为底物进行厌氧消化时,能够影响产甲烷菌的菌群组成。其中,Methanothrix逐渐适应环境,相对丰度增至69.61%,成为EAD中的优势菌种。相对丰度较高的Methanothrix菌种有助于EAD的长期稳定运行和产甲烷效率,因此EAD能够展现优秀的产甲烷能力和稳定性,可以显著提高沼气中的甲烷含量。
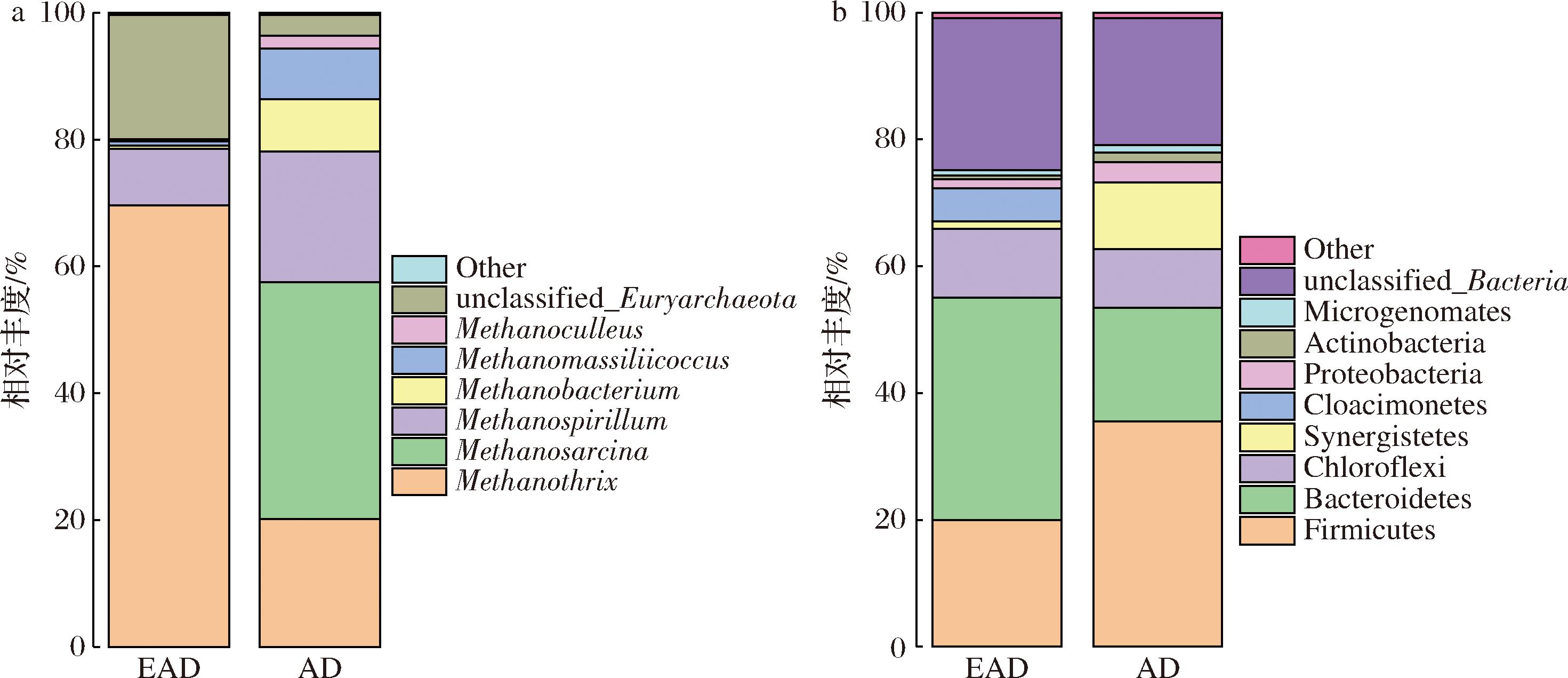
a-产甲烷古菌的相对丰度;b-细菌的相对丰度
图5 EAD与AD中微生物相对丰度对比
Fig.5 Comparison of the relative abundance of microorganisms in EAD and AD
AD和EAD反应器内悬浮污泥微生物的细菌优势菌门(相对丰度>1%),如图5-b所示。2种反应器中主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、互养菌门(Synergistetes)、阴沟单胞菌门(Cloacimonetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)组成。相比于AD来说,EAD中的Firmicutes相对丰度从35.52%降至19.98%;Firmicutes在厌氧消化过程中的主要作用是降解大分子有机物和VFAs,它还与生物电化学系统中电流的产生有着密切的关系,能够在电场环境下通过还原CO2产生乙酸[19]。Firmicutes的减少可能是因为投加底物为乙酸,涉及大分子有机物的降解减少,但Firmicutes在EAD系统中仍维持较高的相对丰度,说明Firmicutes仍在还原CO2的过程中发挥重要作用。Bacteroidetes的相对丰度增加幅度较大,相对丰度从17.93%增至35.05%。Bacteroidetes的作用是降解多糖、蛋白质等复杂化合物,同时产生H2、CO2、葡萄糖和VFAs等[20],而在EAD中,Bacteroidetes的相对丰度增多,这可能是它在还原CO2过程中发挥了重要作用。在EAD中,Cloacimonetes的相对丰度为5.16%,它是一种以氨基酸发酵产生CO2和H2的物种,并且与产甲烷古菌存在共养关系[21]。因此,它的相对丰度增加与高乙酸水平下微生物凋亡分解有关。Synergistetes的作用是降解纤维素、蛋白质和脂肪酸等多种物质[22]。它在EAD中相对丰度有所降低,这可能与投料策略有关。在经过电催化条件和高浓度乙酸环境的驯化下,Firmicutes由于底物限制导致相对丰度减少。同时,一些能够增强产甲烷作用的细菌(如Bacteroidetes)相对丰度得到增长。
3 结论
本研究以提升EAD过程的产甲烷效能、稳定运行并推进技术应用为目的。由于外加电压的辅助,EAD过程能够更有效地将CO2还原为甲烷,但也因此在沼液中累积了HCO3-和CO32-,造成系统的不稳定。以乙酸作为唯一底物,在每一个投加批次内除去上批次积累的碱度,可以将pH值稳定在电催化厌氧消化适宜的6.0~8.6,使系统得以稳定运行;同时,乙酸也能够使EAD的消化过程直接进入产甲烷阶段,加快对产甲烷菌的驯化,提高启动的驯化效率。其中,Methanothrix逐渐适应环境,成为EAD中的优势产甲烷菌种(相对丰度为69.61%),展现优越的产甲烷效能。随着投加的乙酸浓度逐渐递增,各项参数的变化显示,EAD对于高浓度乙酸具有较好的耐冲击性和稳定性,其中以11 667 mg/L的乙酸为底物进行厌氧消化时,EAD反应器能够稳定运行,单日平均池容产气率为1.442 m3/(m3·d),沼气中平均甲烷含量提高至80.59%,最高的甲烷含量达到96.88%。根据实验和机理研究,提出了以乙酸为唯一底物的表观产甲烷反应式。并经实验数据验证,以乙酸为唯一底物的电催化厌氧消化表观反应方程式显示CH3COOH、CH4、(HCO3-+CO32-)和CO2的摩尔数比为7∶8∶5∶1。该反应式对理解EAD技术的反应机制、优化操作条件以及预测产物生成量具有重要意义,其还可以准确地描述EAD过程中的物质转化和能量流动,为未来的研究和应用提供了有力支持。
[1] AN Z K, SONG Y C, KIM K T, et al.The bioaugmentation of electroactive microorganisms enhances anaerobic digestion[J].Fermentation, 2023, 9(11):988.
[2] AO T J, ZHAO X Q, MEHMOOD M A, et al.A double-chamber microbial electrolysis cell improved the anaerobic digestion efficiency and elucidated the underlying bio-electrochemical mechanism[J].Chemical Engineering Journal, 2023, 471:144228.
[3] FLORES-RODRIGUEZ C, NAGENDRANATHA REDDY C, MIN B.Enhanced methane production from acetate intermediate by bioelectrochemical anaerobic digestion at optimal applied voltages[J].Biomass and Bioenergy, 2019, 127:105261.
[4] LIU C Q, XIAO J W, LI H Y, et al.High efficiency in situ biogas upgrading in a bioelectrochemical system with low energy input[J].Water Research, 2021, 197:117055.
[5] ZHANG Y P, LI J Z, LIU F Q, et al.Reduction of Gibbs free energy and enhancement of Methanosaeta by bicarbonate to promote anaerobic syntrophic butyrate oxidation[J].Bioresource Technology, 2018, 267:209-217.
[6] SUMMERS Z M, FOGARTY H E, LEANG C, et al.Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria[J].Science, 2010, 330(6009):1413-1415.
[7] ANDERSON G K, YANG G.Determination of bicarbonate and total volatile acid concentration in anaerobic digesters using a simple titration[J].Water Environment Research, 1992, 64(1):53-59.
[8] RAY S, KUPPAM C, PANDIT S, et al.Biogas upgrading by hydrogenotrophic methanogens:An overview[J].Waste and Biomass Valorization, 2023, 14(2):537-552.
[9] VILLANO M, AULENTA F, CIUCCI C, et al.Bioelectrochemical reduction of CO2 to CH4 via direct and indirect extracellular electron transfer by a hydrogenophilic methanogenic culture[J].Bioresource Technology, 2010, 101(9):3085-3090.
[10] TIAN T, QIAO S, YU C, et al.Bio-electrochemically assisting low-temperature anaerobic digestion of low-organic strength wastewater[J].Chemical Engineering Journal, 2018, 335:657-664.
[11] LIU C Q, YUAN X, GU Y Y, et al.Enhancement of bioelectrochemical CO2 reduction with a carbon brush electrode via direct electron transfer[J].ACS Sustainable Chemistry &Engineering, 2020, 8(30):11368-11375.
[12] LACKNER N, WAGNER A O, MARKT R, et al.pH and phosphate induced shifts in carbon flow and microbial community during thermophilic anaerobic digestion[J].Microorganisms, 2020, 8(2):286.
[13] 姜立, 张成明, 韩娅新, 等.底物浓度对餐厨垃圾厌氧消化的影响[J].食品与发酵工业, 2016, 42(4):57-62.
JIANG L, ZHANG C M, HAN Y X, et al.Effect of substrate concentrations on anaerobic digestion of kitchen waste[J].Food and Fermentation Industries, 2016, 42(4):57-62.
[14] FRANKE-WHITTLE I H, WALTER A, EBNER C, et al.Investigation into the effect of high concentrations of volatile fatty acids in anaerobic digestion on methanogenic communities[J].Waste Management, 2014, 34(11):2080-2089.
[15] WANG H, DU H X, XIE H Y, et al.Dual-chamber differs from single-chamber microbial electrosynthesis in biogas production performance under low temperature (15 ℃)[J].Bioresource Technology, 2021, 337:125377.
[16] LI Q, LIU Y Q, YANG X H, et al.Kinetic and thermodynamic effects of temperature on methanogenic degradation of acetate, propionate, butyrate and valerate[J].Chemical Engineering Journal, 2020, 396:125366.
[17] 张成明, 李砚飞, 董保成, 等.碱处理对玉米秸秆固态厌氧消化过程中菌群结构的影响[J].食品与发酵工业, 2022, 48(4):69-74.
ZHANG C M, LI Y F, DONG B C, et al.Effect of alkali treatment on the microbial community structure in solid-state anaerobic digestion of corn straw[J].Food and Fermentation Industries, 2022, 48(4):69-74.
[18] NGUYEN D, KHANAL S K.A little breath of fresh air into an anaerobic system:How microaeration facilitates anaerobic digestion process[J].Biotechnology Advances, 2018, 36(7):1971-1983.
[19] KIMURA Z I, KURIYAMA H, IWASAKI Y.Exploring acetogenesis in Firmicutes:From phylogenetic analysis to solid medium cultivation with solid-phase electrochemical isolation equipments[J].Microorganisms, 2023, 11(12):2976.
[20] NARIHIRO T, SEKIGUCHI Y.Microbial communities in anaerobic digestion processes for waste and wastewater treatment:A microbiological update[J].Current Opinion in Biotechnology, 2007, 18(3):273-278.
[21] STOLZE Y, BREMGES A, RUMMING M, et al.Identification and genome reconstruction of abundant distinct taxa in microbiomes from one thermophilic and three mesophilic production-scale biogas plants[J].Biotechnology for Biofuels, 2016, 9:156.
[22] LEI Z, ZHI L, JIANG H Y, et al.Characterization of microbial evolution in high-solids methanogenic co-digestion of canned coffee processing wastewater and waste activated sludge by an anaerobic membrane bioreactor[J].Journal of Cleaner Production, 2019, 232:1442-1451.