膳食纤维作为第七类营养素,具有稳定血糖、控制体重和维持心血管健康等诸多功能,也是缓解、治疗部分慢性疾病的重要途径[1]。
抗性糊精是一种短链葡萄糖聚合物,属于小分子水溶性膳食纤维,具有一定抗消化性[1]。抗性糊精具有优良加工性能,因此被广泛应用于食品中,发挥膳食纤维与益生元的功能,抗性糊精还具有降血脂、改善表观矿物质吸收和减少内脏脂肪积累等生理作用,且与其分子结构和功能特性有着密不可分的关系[1]。
最早的抗性糊精制备方法是酸热法,该法以有机酸或无机酸为催化剂,在高温条件下对淀粉进行长时间处理制得焦糊精,随后对焦糊精进行酶解脱支与精制得到抗性糊精[1]。研究表明,较高的酸度有利于增加抗性糊精中抗性部分的含量,然而酸热法存在产品颜色深、不环保、反应条件较为恶劣等问题[2]。酶解法是采用不同酶水解淀粉,改变淀粉本身结构,使其不易被消化,该法具有反应条件温和、副反应少、不需要酸碱中和等优势[3]。近年来,开发新型的生产工艺流程生产抗性糊精是目前的研究方向之一。酶解脱支结合重结晶工艺是淀粉进行脱支后得到不同链长的直链淀粉,再通过重结晶诱导形成抗性糊精的工艺[4]。在抗性糊精的制备过程中常将淀粉完全脱支,同时会伴随产生较多单糖、二糖等物质,这些副产物会影响抗性糊精/抗性麦芽糊精的纯度和得率。研究表明,使用不同浓度的乙醇水溶液对抗性麦芽糊精进行醇沉分离纯化,可提高抗性麦芽糊精的含量[5]。
本课题组在前期采用脱支和重结晶法对蜡质玉米和普通玉米淀粉进行处理制备抗性糊精,其抗消化能力有所提升但仍有很大改进空间[6]。在此研究基础上,本研究以蜡质木薯淀粉(waxy tapioca starch, WTS)为原料,采用酶解脱支、重结晶工艺结合乙醇醇沉制备蜡质木薯抗性麦芽糊精(waxy tapioca resistant maltodextrin,WTRMD),采用核磁共振氢谱法(nuclear magnetic resonance,1H-NMR)表征WTS和WTRMD的糖苷键结构;采用体积排阻色谱法(size exclusion chromatography,SEC)测定WTS和WTRMD的链长数量分布;采用差示扫描量热法(differential scanning calorimetry,DSC)测定WTS和WTRMD的热力学特性;并通过体外模拟消化法测定WTRMD的抗消化性。同时,探究绿色制备工艺中关键参数(酶量、重结晶温度和醇沉浓度)对抗性麦芽糊精的结构和消化特性的影响机制,并构建其构效关系,以期为制备高抗性的抗性麦芽糊精绿色工艺提供指导意义。
1 材料与方法
1.1 材料与试剂
WTS,东莞东美食品有限公司;苯甲酸、无水乙酸钠、CaCl2(均为分析纯),天津市大茂化学试剂厂;无水乙醇(分析纯),江苏强盛功能化学股份有限公司;普鲁兰酶(2 000 U/g),上海麦克林生化科技有限公司;猪胰酶(8×USP)、淀粉葡萄糖苷酶(≥260 U/mL),美国Sigma-Aldrich公司;D-葡萄糖检测试剂盒,爱尔兰Megazyme公司。
1.2 设备
DSC 3 差示扫描量热仪,瑞士METTLER TOLEDO公司;Evolution 201/202 紫外分光光度计,美国 Thermo Fisher Scientific公司;Avance Ⅲ HD 400 MHz 核磁共振波谱仪、D8-ADVANCE X-射线衍射仪,德国Brucker Optics公司;PA 800 Plus 毛细管电泳系统,美国Beckman Coulter公司;1100系列高效液相色谱仪、Poroshell 120 EC-C18 色谱柱,美国Agilent Technologies 公司。
1.3 实验方法
1.3.1 抗性麦芽糊精的制备
1.3.1.1 WTS酶解脱支
称取20.0 g干基WTS加入含有0.02%(质量分数)的叠氮化钠的醋酸钠缓冲溶液(0.01 mol/L,pH 5.2),进行加热搅拌糊化(100 ℃,30 min)。淀粉糊冷却至58 ℃,加入普鲁兰酶(基于干基淀粉质量),淀粉糊于58 ℃恒温水浴锅中搅拌酶解脱支24 h,使其形成更多线性短直链淀粉。
1.3.1.2 WTRMD乙醇醇沉
将酶解脱支后的淀粉糊置于高压灭菌锅中132 ℃灭酶30 min,然后10 000 r/min离心15 min。将收集得到的上清液与50%和55%(体积分数)的乙醇混匀(1∶4,体积比),后放置于水浴锅中加热搅拌(50 ℃,10 min),随后10 000 r/min离心15 min并收集沉淀物为粗WTRMD,用无水乙醇醇洗2次,然后置于50 ℃热风干燥箱中烘干,得到粗WTRMD。
1.3.1.3 WTRMD重结晶
将干燥后的粗WTRMD样品分散于去离子水中(质量分数10%),置于高压灭菌锅中132 ℃灭菌30 min使其充分溶解,随后置于4 ℃和50 ℃条件下重结晶2 d。将重结晶的粗WTRMD 10 000 r/min离心15 min,取其沉淀物并用去离子水洗涤2次再次离心(10 000 r/min,15 min),取其沉淀物冻干,得到WTRMD。
根据制备抗性麦芽糊精的不同工艺条件进行分组。WTRMD-1:普鲁兰酶(90%,质量分数,基于WTS干基质量)、50%乙醇醇沉和50 ℃重结晶;WTRMD-2:普鲁兰酶(80%,质量分数,基于WTS干基质量)、55%乙醇醇沉和4 ℃重结晶;WTRMD-3:普鲁兰酶(10%,基于WTS干基质量)、50%乙醇醇沉和4 ℃重结晶。
1.3.2 核磁共振波谱
采用1H-NMR测定不同工艺条件制备的WTRMD的分子结构和糖苷键类型,化学位移0.479 0处为D2O信号,并以此校准化学位移称取50 mg WTRMD与WTS,将二者溶于0.55 mL D2O中,以冷冻干燥方式重复处理3次,使其与重水之间充分交换,记录在25 ℃、400 MHz条件下的1H-NMR谱,128次扫描,扫描宽度为16 mm,采样时间4 s,延迟时间1 s,得到1H-NMR谱图。
1.3.3 淀粉链长分布测定
使用SEC测定WTS及WTRMD的淀粉链长数量分布。分别取5 mg WTRMD和WTS样品于离心管中,加入0.2 mL蒸馏水,置于水浴锅中加热搅拌(100 ℃,10 min),加入850 μL 0.05 mol/L pH=3.75的乙酸钠缓冲液,加热搅拌(100 ℃,10 min)。待冷却后添加0.1 mL 0.1 U的异淀粉酶,于恒温振荡水浴锅(37 ℃,24 h)进行脱支处理,随后将样品置于水浴锅(100 ℃,10 min)中进行灭酶处理。将样品离心(11 000 r/min,5 min),取2 mg上清液于0.5%(质量分数)LiBr的DMSO中,在80 ℃条件下溶解2 h。测试条件:系统温度80 ℃,流动相DMSO/LiBr,流速0.6 mL/min,使用标准普鲁兰多糖校准。采用干涉型时差折光检测器测定出口处溶液的浓度,得到质量分布w(lgX),式中X为聚合度。由公式Nde(X)=X-2w(lgX)转换为淀粉链长数量分布Nde(X)。洗出体积转换为流体力学体积Rh,用Mark-Houwink方程计算计算脱支样品的聚合度,80 ℃下DMSO/LiBr脱支链淀粉溶液的Mark-Houwink系数为K=0.015 0 mL/g,α=0.743[7]。
1.3.4 结晶特性、热力学特性及消化特性的测定
参考徐美琪等[6]的方法,测定WTRMD及WTS的结晶特性、热力学特性、消化特性。
1.3.5 统计分析
实验重复测定3次,数据处理采用Excel进行消化性计算,采用SPSS计算标准偏差和显著性误差分析,采用MestReNove处理NMR数据,使用Origin 2021进行作图。
2 结果与分析
2.1 核磁共振波谱分析
由图1所示,WTS在化学位移4.5~5.5区域内并没有异头氢信号,而WTRMD在化学位移5.37、5.19、4.63、4.61处均出现新的异头氢信号。根据α型吡喃糖H-1质子的化学位移>4.95和β型吡喃糖H-1质子的化学位移<4.95这一特性,推断WTRMD在制备过程中生成了α型糖苷键和β型糖苷键[8]。在酶解脱支-乙醇醇沉-重结晶制备WTRMD过程中,淀粉分子会发生水解、转糖苷化和再聚合等系列化学反应,通过形成分子间或分子内相互作用力产生新的糖苷键,这些新生成的糖苷键可以有效降低淀粉酶对α-1,4-糖苷键和α-1,6-糖苷键的酶解速率,使WTRMD具有良好的抗消化性[9]。
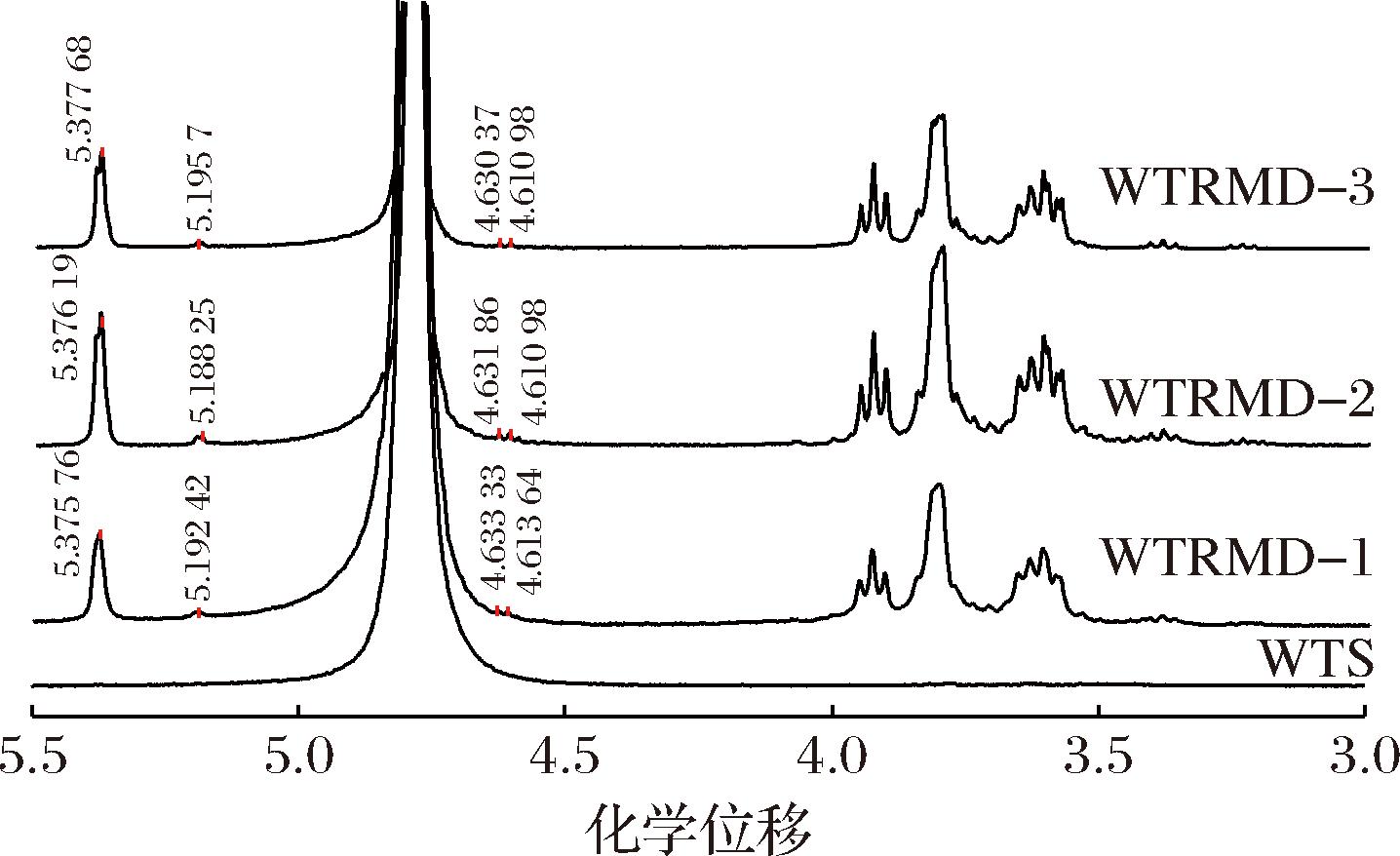
图1 WTRMD与WTS的一维氢谱图
Fig.1 One-dimensional hydrogen spectra of WTRMD and WTS
2.2 链长分布
WTS与WTRMD链长数量分布Nde(X)如图2所示。淀粉链长以聚合度X表示,将X≤100的部分定义为支链淀粉,将100<X≤10 000的部分定义为直链淀粉[2]。由数量分布可知,支链淀粉(amylopectin,AP)部分,即X≤100,出现3个峰,分别记作AP1(X≤10)、AP2(11≤X≤30)和AP3(31≤X≤100),而直链淀粉部分未出现明显峰。
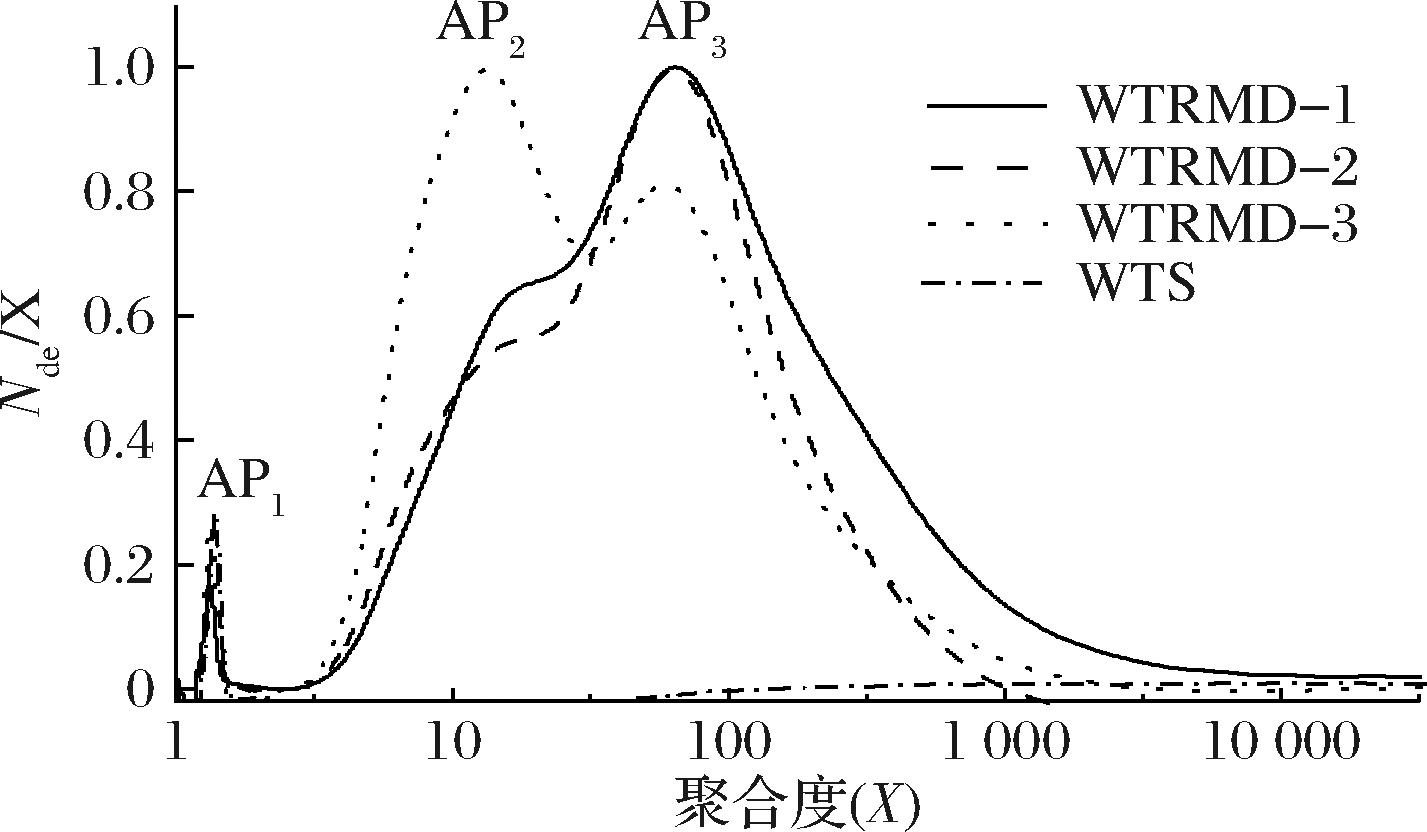
图2 WTS与WTRMD链长的数量分布
Fig.2 Number distribution of WTS and WTRMD chain lengths
WTRMD制备过程中,普鲁兰酶通过水解α-1,6-糖苷键对WTS进行脱支,生成线性短直链淀粉分子,这些线性短直链淀粉分子的聚合度主要集中在支链淀粉B3链链长范围(X>37)内,此外还有部分直链淀粉分子(X>100)位于直链淀粉范围内。研究表明,抗性麦芽糊精中含有的线性短直链淀粉分子(X>37)数量越多,淀粉分子之间越容易形成双螺旋结构,双螺旋结构的增加有利于抗消化性的提升[10]。而WTRMD-2的线性短直链淀粉分子(X>37)的数量多于WTRMD-1和WTRMD-3,这是决定WTRMD-2的抗消化性较强的原因之一,这将在后续消化性结果部分进行详细阐述。
2.3 结晶特性分析
如图3所示,WTS的衍射图谱在15°、17°、18°和23°有强衍射峰,表明WTS是典型的A型晶体结构[6]。与WTS相比,WTRMD的晶型和结晶度发生明显变化。淀粉重结晶过程中,形成的晶型结构、相对结晶度与淀粉分子链长分布、重结晶温度密切相关[11-12]。
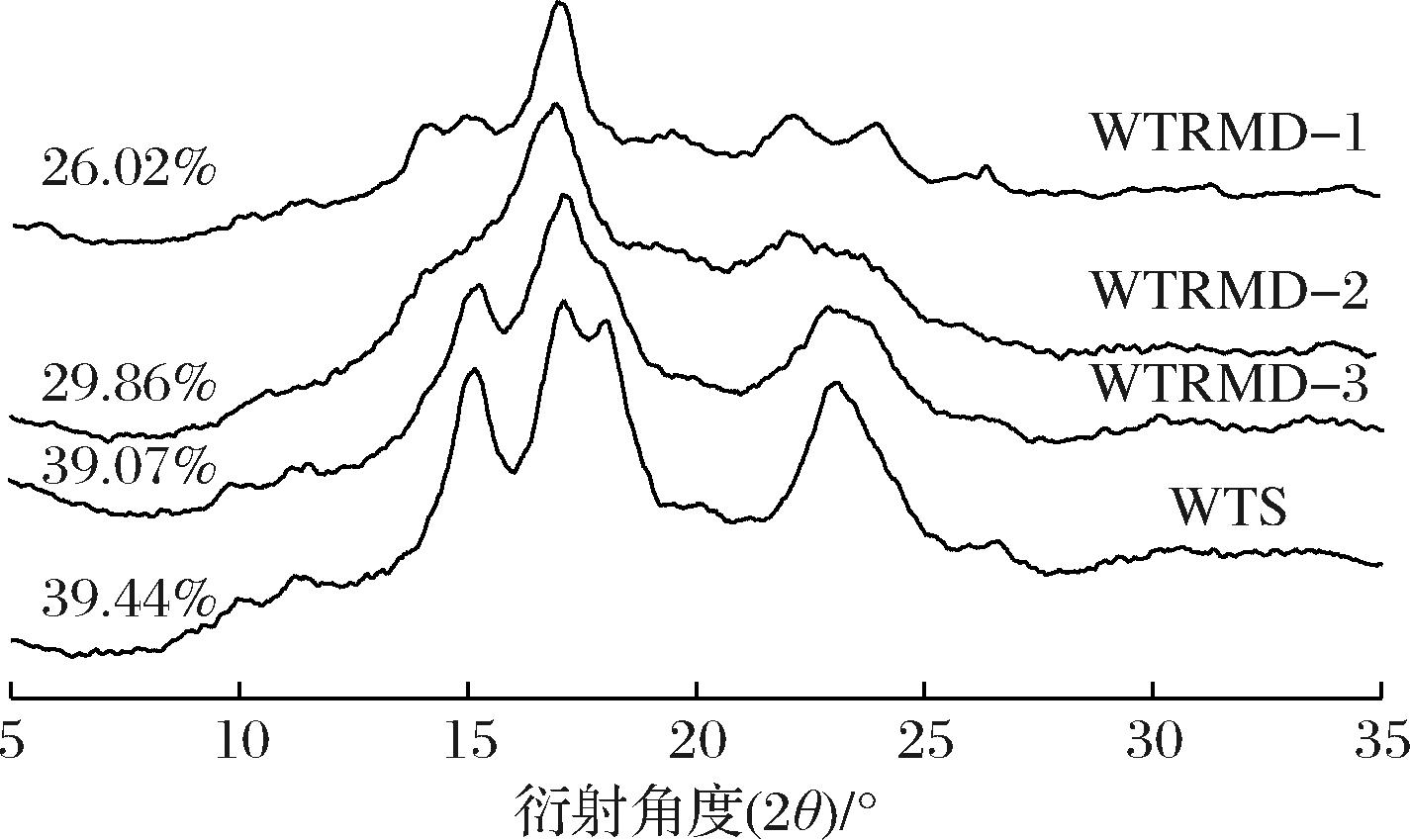
图3 WTRMD与WTS的X-射线衍射图谱
Fig.3 X-ray diffraction patterns of WTRMD and WTS
WTRMD-1的衍射图谱在15°、18°的衍射峰强度下降,23°的强衍射峰转变为22°、24°的双衍射峰,呈现B型晶体结构。由于WTRMD-1在制备过程中重结晶温度(50 ℃)较高,B3链比例较高,形成的晶型结构较完善[13-14]。WTRMD-2的衍射图谱在17°有强衍射峰,在23°有较弱衍射峰,A型特征峰减弱,B型特征峰有所增强,WTRMD-2呈现不完美的B型晶型结构。WTRMD-2在迅速冷却重结晶过程中(4 ℃),B3链比例最高,有利于线性短直链淀粉分子重组形成B型晶型结构。但是在重结晶过程中,线性短直链淀粉分子没有足够的时间发生重排来不及形成更多的有序结构,导致其所形成的晶体结构并不完美[15-16]。WTRMD-3的衍射图谱在15°、17°、23°有强衍射峰,A型特征峰略有减弱,但并未呈现B型晶型结构,主要归因于WTRMD-3的脱支程度较低,没有足够多的线性短直链淀粉分子参与重结晶过程,导致不易形成B型晶型结构。3种WTRMD的相对结晶度依次为:WTRMD-3>WTRMD-2>WTRMD-1。相对结晶度的高低受双螺旋结构和晶型结构的影响。双螺旋结构主要由线性短直链淀粉分子之间的相互作用形成,低温条件下有助于双螺旋结构的形成[13,16]。线性短直链淀粉分子的数量与WTRMD制备过程中WTS酶解脱支的程度有关,脱支程度越高,最终得到的线性短直链淀粉分子数量越多,有利于双螺旋结构的形成。不同晶型结构的淀粉具有不同的相对结晶度[17]。WTRMD-1具有较完美的B型晶型结构,其相对结晶度是26.02%,在B型晶型结构的相对结晶度范围内;WTRMD-2具有较不完美的B型晶型结构,由于其在低温(4 ℃)条件下重结晶且含有更多的线性短直链淀粉分子,因此WTRMD-2的相对结晶度(29.86%)略高于WTRMD-1的相对结晶度。WTRMD-3由于脱支程度较低,所含有的线性短直链淀粉分子(X>37)较少,在重结晶过程中不易形成B型晶型结构,因此WTRMD-3的相对结晶度(39.07%)远高于其余2种WTRMD。
2.4 热力学特性分析
如表1所示,与WTS相比,3种WTRMD的起始温度(To)、峰值温度(Tp)、终止温度(Tc)、糊化温度范围(Tc~To)均显著升高(P<0.05),ΔH均显著降低(P<0.05),表明WTS经过酶解脱支-乙醇醇沉-重结晶耦合工艺制备的WTRMD具有良好的热稳定性。
表1 WTRMD及WTS的热力学特征值
Table 1 Thermal transformation properties of WTRMD and WTS

样品名称To/℃Tp/℃Tc/℃Tc~To/℃ΔH/(J/g)WTRMD-1108.53±0.42a115.62±0.26a120.52±0.75a11.99±1.11c1.95±0.20bWTRMD-282.27±0.63c98.52±1.97b109.21±2.45b21.94±1.85a3.27±0.61bWTRMD-390.60±3.11b99.68±0.88b107.88±0.40b17.29±2.96b2.26±0.30bWTS66.88±0.10d70.63±0.01c76.82±0.15c9.94±0.14c17.11±1.33a
注:同列字母不同代表数据之间有显著性差异(P<0.05)。
WTS在酶解脱支过程中,原有淀粉结构被破坏,生成大量线性短直链淀粉分子,其在适宜温度条件下重结晶形成新的晶型结构。温度对WTRMD的晶型结构产生重要影响,较高的重结晶温度(50 ℃)能提高线性短直链淀粉分子的迁移速率,促进晶体成核、结晶形成完美晶型;反之,低温条件下容易促进淀粉链之间的双螺旋结构,增加WTRMD的相对结晶度。WTRMD的热力学特性转变与其晶型结构和相对结晶度的改变有关。3种WTRMD的晶型结构改变各有不同,整体而言,WTRMD的焓值显著降低主要归因于:a)WTRMD经过酶解脱支-乙醇醇沉-重结晶耦合工艺制得,其分子结构发生重组生成了新的结晶结构,较原淀粉而言结晶度和有序性较低,在糊化过程中需要的能量会减少[5,14];b)WTRMD分子质量较小,聚合度较低,结晶度较低[18];c)WTRMD制备过程中可能会引入更多的亲水基团或改变分子链柔性,使得整体焓值降低[18]。WTRMD的Tc~To显著升高主要归因于制备过程中容易产生结构的复杂性和异质性,导致糊化温度分布更广[19-20];加之经过酶解脱支-乙醇醇沉-重结晶耦合工艺制备WTRMD后产生的晶体结构热稳定性更高。
2.5 体外消化性分析
如图4所示,WTRMD与WTS的快消化淀粉(rapid digestible starch,RDS)含量依次是:WTS>WTRMD-3>WTRMD-1>WTRMD-2;慢消化淀粉(slow digestible starch,SDS)含量依次是:WTS>WTRMD-2>WTRMD-3>WTRMD-1,制得的WTRMD抗消化能力均有显著提升(P<0.05),表现为RDS含量显著下降(P<0.05),抗性淀粉(resistant starch,RS)含量显著升高(P<0.05)。
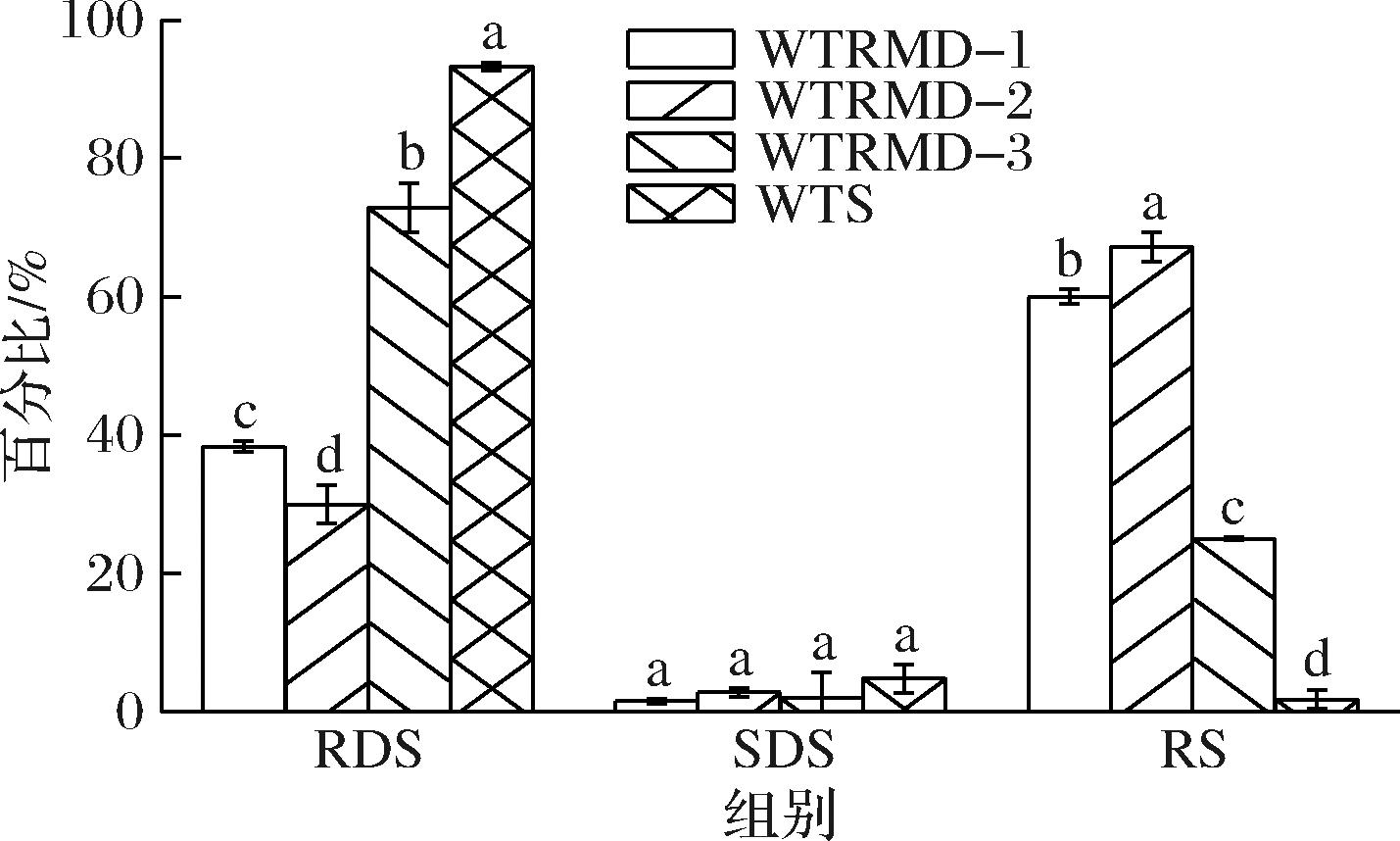
图4 WTRMD及WTS的体外消化特性
Fig.4 In vitro digestive properties of WTRMD and WTS
注:不同小写字母表示差异显著(P<0.05)。
WTRMD抗消化性显著提升有以下原因:a)WTRMD在制备过程中经过酶解脱支得到线性短直链淀粉分子,在重结晶过程中,线性短直链淀粉分子之间发生相互作用形成有序双螺旋结构,并形成新的晶型结构,有序结构的增加可以限制α-淀粉酶的酶解;b)新生成的晶型结构热稳定性提高,使WTRMD的抗消化性增加[14,21];c)在WTRMD制备过程中,WTS发生了糖苷键断裂和转糖苷反应,线性短直链淀粉分子经过重新排列生成抗消化的α型糖苷键和β型糖苷键,从而提高了WTRMD的抗消化性。
在3种WTRMD中,WTRMD-2的SDS、RS含量高于其余2种WTRMD,具有更好的抗消化性。这主要归因于WTRMD-2在酶解脱支、乙醇醇沉后得到的线性短直链淀粉分子(X>37)占比最高,重结晶温度较低,线性短直链淀粉分子易形成结晶度较高的双螺旋结构使其热稳定性增加。酶解脱支程度会影响脱支所得线性短直链淀粉分子的链长长度及数量。适当提高乙醇浓度可提高其线性短直链淀粉分子(X>37)的含量,结合较低的结晶温度,能够促使淀粉分子重新排列生成更多抗消化的α型糖苷键和β型糖苷键,进而形成新的晶型结构[4,22]。
3 结论
本研究以WTS为原料,采用不同的酶解脱支、重结晶结合醇沉工艺条件制备WTRMD,探究不同工艺制备条件(酶量、重结晶温度和醇沉浓度)对抗性麦芽糊精的结构及消化特性的影响机制。通过酶解脱支-乙醇醇沉-重结晶工艺条件制备的WTRMD,均发生糖苷键断裂与转糖苷反应,晶型结构发生转变,相对结晶度降低,生成抗消化的α型糖苷键和β型糖苷键,热稳定性提升,抗消化性显著提升。制备工艺条件中脱支程度和乙醇浓度是影响WTRMD线性短直链淀粉分子数量及其链长长度的重要因素。重结晶温度和酶解脱支-乙醇醇沉得到的线性短直链淀粉分子的数量及链长长度是影响WTRMD热稳定性和抗消化性的重要因素。WTRMD-2的抗消化性最佳,表明在该工艺条件下制备的抗性麦芽糊精消化性最佳,本研究将为进一步拓展抗性麦芽糊精的绿色制备工艺提供指导意义。
[1] 王六强, 张新武, 马飞飞, 等.抗性糊精的生产应用现状研究与展望[J].农产品加工, 2020(11):75-77;80.
WANG L Q, ZHANG X W, MA F F, et al.Research and prospect of production and application of resistant dextrin[J].Farm Products Processing, 2020(11):75-77;80.
[2] 李洪岩, 毛慧佳, 周梦莎, 等.酸热加工对焦糊精结构和理化性质的影响研究进展[J].食品与生物技术学报, 2022, 41(11):22-30.
LI H Y, MAO H J, ZHOU M S, et al.Research progress in acid and thermal treatment affecting structure and physicochemical properties of pyrodextrin[J].Journal of Food Science and Biotechnology, 2022, 41(11):22-30.
[3] 刘军, 陈晟, 吴敬, 等.Thermus thermophilus分支酶的重组表达及其在抗性糊精制备中的应用[J].食品工业科技, 2017, 38(24):79-83.
LIU J, CHEN S, WU J, et al.Recombinant expression and application in preparation of resistant dextrin of branching enzyme from Thermus thermophilus[J].Science and Technology of Food Industry, 2017, 38(24):79-83.
[4] 常然然. 重结晶型抗性淀粉制备、消化过程及酵解规律研究[D].无锡:江南大学, 2021.
CHANG R R.Recrystallized resistant starch:Preparation and its digestion process and fermentation[D].Wuxi:Jiangnan University, 2021.
[5] LEE D J, KIM J Y, LIM S T.Debranched waxy maize resistant dextrin:Synthesis, ethanol fractionation, crystallization, and characterization[J].Carbohydrate Polymers, 2023, 301:120319.
[6] 徐美琪, 李思漫, 刘欣, 等.脱支和重结晶法制备抗性糊精的结构和功能特性分析[J].食品工业科技, 2024, 45(5):37-43.
XU M Q, LI S M, LIU X, et al.Structural and functional characterization of resistant dextrins prepared by debranching and recrystallization methods[J].Science and Technology of Food Industry, 2024, 45(5):37-43.
[7] 徐美琪, 张昱格, 陈旭, 等.冰湖野米粉及其淀粉的精细结构、理化和消化特性研究[J].食品安全质量检测学报, 2022, 13(16):5279-5287.
XU M Q, ZHANG Y G, CHEN X, et al.Study on the fine structure, physicochemical and digestive characteristics of Zizania palustris flour and its starch[J].Journal of Food Safety &Quality, 2022, 13(16):5279-5287.
[8] WEIL W, WEIL R C, KEAWSOMPONG S, et al.Pyrodextrins from waxy and normal tapioca starches:Molecular structure and in vitro digestibility[J].Carbohydrate Polymers, 2021, 252:117140.
[9] 甄远航. 抗性糊精的分离纯化及其在面制品中的应用研究[D].无锡:江南大学, 2021.
ZHEN Y H.Isolation and purification of resistant dextrin and its application in flour product[D].Wuxi:Jiangnan University, 2021.
[10] HU P S, ZHAO H J, DUAN Z Y, et al.Starch digestibility and the estimated glycemic score of different types of rice differing in amylose contents[J].Journal of Cereal Science, 2004, 40(3):231-237.
[11] LEE D J, KIM J M, LIM S T.Characterization of resistant waxy maize dextrins prepared by simultaneous debranching and crystallization[J].Food Hydrocolloids, 2021, 112:106315.
[12] LIU X C, QIAO L, KONG Y X, et al.Characterization of the starch molecular structure of wheat varying in the content of resistant starch[J].Food Chemistry:X, 2024, 21:101103.
[13] TANG J, ZOU F X, GUO L, et al.The relationship between linear chain length distributions of amylopectin and the functional properties of the debranched starch-based films[J].Carbohydrate Polymers, 2022, 279:119012.
[14] XIE A J, LI M H, LI Z W, et al.A preparation of debranched waxy maize starch derivatives:Effect of drying temperatures on crystallization and digestibility[J].International Journal of Biological Macromolecules, 2024, 264:130684.
[15] KIM M A, CHOI S J, MOON T W.Digestibility of retrograded starches with A- and B-type crystalline structures[J].Journal of the Korean Society for Applied Biological Chemistry, 2015, 58(4):487-490.
[16] MA R R, ZHAN J L, JIANG Z J, et al.Effect of cooling rate on long-term recrystallized crystal of rice starch in the presence of flavor compounds[J].Food Chemistry, 2021, 345:128763.
[17] DOME K, PODGORBUNSKIKH E, BYCHKOV A, et al.Changes in the crystallinity degree of starch having different types of crystal structure after mechanical pretreatment[J].Polymers, 2020, 12(3):641.
[18] LI F, MUHMOOD A, AKHTER M, et al.Characterization, health benefits, and food applications of enzymatic digestion- resistant dextrin:A review[J].International Journal of Biological Macromolecules, 2023, 253:126970.
[19] LI Z R, LIU Y, HUANG Y H, et al.Identification of the key structure, preparation conditions and properties of resistant dextrin for indigestibility based on simulated gastrointestinal conditions[J].International Journal of Food Science &Technology, 2022, 57(11):7233-7244.
[20] JANE J L.Current understanding on starch granule structures[J].Journal of Applied Glycoscience, 2006, 53(3):205-213.
[21] ZHONG H X, SHE Y X, YANG X J, et al.Analysis of the interaction between double-helix starch molecule and α-amylase[J].Innovative Food Science &Emerging Technologies, 2024, 94:103658.
[22] YAN Z Q, ZHANG M M, XU M J, et al.Effect of debranching and differential ethanol precipitation on the formation and fermentation properties of maize starch-lipid complexes[J].Journal of Agricultural and Food Chemistry, 2022, 70(29):9132-9142.