牛骨胶原蛋白肽作为一种小分子肽,具有抑菌、抗炎、抗氧化及促进骨骼健康等多种生物活性,通常被作为原料用于制备保健食品、化妆品等,市场接受度较高[1]。近年来,除了对牛骨胶原蛋白肽生物活性研究外,其活性鉴定方式的研究也在不断深入。通常采用的活性鉴定方法是逐级分离纯化,其过程复杂且耗时较长,并且可能会导致部分活性肽段遗漏[2]。体内实验鉴定活性的方法虽最为准确,但成本较高,不适用于快速筛选。因此,如何快速且高效地鉴定牛骨胶原蛋白肽活性仍是难点。生物信息学是一门综合技术,主要通过计算机手段对生物数据统计、解析、比对,来阐明生物数据中所包含的生物学意义。随着生物信息学技术的发展,通过计算机模拟酶解、前体蛋白的选择、酶解产物的活性预测等技术因具有低成本和高效的优点,在蛋白肽研究中被广泛应用[3]。
赵伟睿[4]应用生物信息学方法,通过模拟酶解技术确定了采用Acalase酶解麦胚蛋白制备ACE抑制肽。侯晓艳[5]将质谱鉴定得到的肽序列通过在线软件预测得到16个潜在抗菌肽,并通过实验验证得到AGDKKIKIGINGFGRIGRL为一种新型抗菌肽。LI等[6]通过生物信息学预测得到7条未被报道的苦荞肾素抑制肽,并通过分子对接技术发现多肽对肾素产生抑制活性的关键可能是疏水相互作用。
目前,应用生物信息学方法预测牛骨胶原蛋白肽生物活性的研究较少。本研究以牛骨胶原蛋白肽为研究对象,通过生物信息学方法预测其潜在生物活性,并分析其与ACE和DPP-IV的相互作用机制,再对预测结果进行体外活性验证,以期为采用生物信息学技术快速预测牛骨胶原蛋白肽的生物活性提供更多科学依据。
1 材料与方法
1.1 材料与试剂
牛骨胶原蛋白肽,肽谷生物科技无锡有限公司。
FAPGG(N-[3-(2-呋喃基)丙烯酰]-Phe-Gly-Gly),Sigma-Aldrich(上海)贸易有限公司;ACE(血管紧张素转化酶),上海鼓臣生物科技有限公司;DPP-IV抑制剂筛选检测试剂盒,美国Cayman公司;盐酸、NaOH、NaCl、硼酸、硼砂等试剂均为分析纯,国药集团试剂有限公司。
1.2 仪器与设备
BSA124S-CW分析天平,德国Sartorius公司;HS7磁力搅拌器,德国IKA公司;CU-420电热恒温水槽,江苏盛蓝仪器制造有限公司;SH-1000酶标仪,日本Corona Electric公司;UV-2100分光光度计,UNICO美国尤尼柯(上海)仪器有限公司;UltiMate 3000高效液相液质色谱仪,美国赛默飞世尔公司。
1.3 实验方法
1.3.1 肽序列的鉴定
LC/MS-MS对牛骨胶原蛋白肽的肽序列进行鉴定。样品经过C18柱进行脱盐处理。系统为串联EASY-nano LC 1200的Q-Exactive Plus质谱仪,分析柱为Acclaim Pep Map C18(75 μm×25 cm),上样体积1.5 μL,柱流速300 nL/min,柱温40 ℃,电喷雾电压2 kV。在60 min的梯度内分离样品,洗脱梯度为0~47 min,2%~35% B;47~48 min,35%~100% B;48~60 min,100% B。
质谱仪以数据依赖采集的模式运行,自动在MS和MS/MS采集模式间切换。其中MS质谱参数设置为:扫描范围200~2 000 m/z;分辨率70 000;自动增益控制目标3e6;最大注入时间50 ms。HCD-MS/MS质谱参数设置为:分辨率17 500;自动增益控制目标1e5;最大注入时间45 ms;碰撞能量28;动态排除时间为30 s。
1.3.2 理化性质预测
通过质谱鉴定得到的肽序列应用生物信息学方法对牛骨胶原蛋白肽的生物活性进行筛选和预测。质谱鉴定结果分为数据库检索肽段和全新发现肽段,根据肽段可信度评分,分别将-10lgP>50和ALC>80%的肽序列选取出来,后将其在Peptide Ranker网站对其生物活性进行预测。参考杨楠[7]的方法,选取生物活性预测得分>0.8的肽段进行疏水性预测,预测得分越高,理论疏水性越强。之后截取疏水性得分>0.5分的肽段在Toxin Pred网站进行毒性预测,预测得分为负值则表明肽段无毒,筛选出疏水性良好且无毒的肽段[8]。最后将其在BIOPEP网站对肽段的同源生物活性进行分析[9]。
1.3.3 分子对接
基于1.3.2节对多肽生物活性及理化性质筛选得到的疏水性良好且无毒的潜在生物活性肽整理后分别与不同受体蛋白进行分子对接,来预测牛骨胶原蛋白肽的生物活性。
由RCSB蛋白质数据库(RCSB Protein Data Bank,http://www.rcsb.org/)检索获取不同受体蛋白的晶体结构:ACE(PDB ID:1O86),DPP-IV(PDB ID:5T4H)[10-11]。在Pymol软件中删除受体蛋白外的所有水分子及其他小分子,其中ACE受体蛋白保留Zn2+和Cl-。并在AutoDock Tools 1.5.7中进行加氢、平衡电荷处理,最后将处理好的受体蛋白保存为.pdbqt文件格式。随后使用ChemDraw软件绘制配体多肽的结构并将其转化为3D结构,并在MM2力场条件下,使其达到能量最小化。此外,为提高牛骨胶原蛋白肽与不同受体蛋白的对接准确度,使用Grid程序下的Grid Box命令设置反应约束盒子位置及尺寸(表1)。最后将受体蛋白与配体多肽在AutoDock Tools 1.5.7软件中进行半柔性对接,预测不同配体和受体蛋白的对接结合能,根据对接结合能评分预测其潜在生物活性。
表1 不同受体蛋白对接参数
Table 1 Docking parameters of different receptor proteins

受体蛋白网格中心坐标网格大小ACEx=43.821 y=38.240 z=46.71237.5×37.5×37.5DPP-IVx=42.101 y=48.931 z=42.77830×30×30
1.3.4 体外活性验证
1.3.4.1 ACE抑制活性测定
牛骨胶原蛋白肽ACE抑制活性测定根据MA等[12]的方法略作改进后确定。于96孔酶标板中依次加入100 μL 1 mol/L FAPGG(溶于50 mmol/L Tris-HCl缓冲溶液,pH 7.5,含0.3 mol/L NaCl),50 μL样品溶液,最后加入50 μL 60 mU/mL ACE(溶于硼酸盐缓冲溶液,pH 8.3,含0.3 mol/L NaCl)启动反应。并在37 ℃条件下反应30 min,于345 nm处测定吸光度的下降。空白组使用50 mmol/L Tris-HCl缓冲溶液代替样品溶液进行测定,反应开始前ACE溶液于37 ℃条件下水浴活化30 min。ACE抑制率的计算如公式(1)所示:
ACE抑制率![]()
(1)
式中:ΔA空白,空白组吸光度在30 min的下降值;ΔA样品,样品组吸光度在30 min的下降值。
1.3.4.2 DPP-IV抑制活性测定
牛骨胶原蛋白肽DPP-IV抑制活性测定采用DPP-IV抑制剂筛选检测试剂盒。实验设置3组实验组,分别为实验组、对照组和空白组。于96孔酶标板中依次加入30 μL缓冲溶液(溶于20 mmol/L Tris-HCl缓冲溶液,pH 8.0,含100 mmol/L NaCl和1 mmol/L EDTA),10 μL DPP-IV,10 μL样品溶液,最后加入50 μL DPP底物(含100 μmol/L H-Gly-Pro)启动反应。并在37 ℃条件下孵育30 min,于荧光酶标仪中,测定样品在激发波长360 nm、发射波长460 nm处的荧光强度。其中对照组和空白组以去离子水代替样品溶液,空白组以缓冲溶液代替DPP-IV溶液进行实验。DPP-IV抑制率的计算如公式(2)所示:
DPP-IV抑制率![]()
(2)
式中:F对照,对照组荧光强度;F空白,空白组对照强度;F样品,实验组荧光强度。
1.3.5 数据分析
所有实验数据均进行3次平行测定,采用SPSS 26进行分析,实验结果以“平均值±标准偏差”表示,采用Origin 2018软件绘制图形。
2 结果与分析
2.1 牛骨胶原蛋白肽生物活性预测
实验所用牛骨胶原蛋白肽中50%的肽分子质量小于1 kDa,并且约80%的肽分子质量在3 kDa以下。表明该牛骨胶原蛋白肽水解较为彻底,小肽含量高。目前,MENG等[13]的研究报道,相对分子质量低于3 kDa的核桃蛋白具有最强的ACE抑制活性。另外,JIN等[14]报道的鲑鱼皮胶原蛋白肽经过超滤处理后,分子质量在3 kDa以下的组分对于DPP-IV的抑制活性得到大幅提高。因此相较于高分子质量的多肽,低分子质量的寡肽更易于与酶结合,从而表达出更强的抑制活性。
采用HPLC-MS/MS技术对分子质量在3 kDa以下的牛骨胶原蛋白肽进行肽序列的鉴定,共鉴定得到17 825条肽段,包括数据库检索和从头测序肽段,分别选取可信度评分-10lgP>50和ALC>80%的肽段,共2 551条肽段进行后续筛选。
首先在Peptide ranker网站预测肽段的生物活性以计算得分值表示,评分为0~1,得分越高,表示更有可能具有生物活性。本研究预测得到510条肽段生物活性评分大于0.8的肽段,可提高生物活性肽的筛选效率,但Peptide Ranker网站仅能预测肽段具有生物活性的可能性,无法预测其具体的生物活性[15]。已有大量文献报道,疏水性氨基酸与肽段活性密切相关。因此通过蛋白平均疏水性网站预测肽段的疏水性,发现510条肽段中有60条肽段疏水性平均值大于0.5,评分大于0.5分的肽段中疏水性氨基酸出现频率较高,这与LI等[16]制备的大球盖菇菌肽研究报道一致。接着将60条肽段在Toxin Pred网站预测肽段毒性,毒性评分为负值表示为肽段无毒,结果显示60条肽段均为非毒性肽段。最后将60条肽段在BIOPEP网站分析肽段的同源生物活性,未发现相关肽段生物活性报道,为本研究首次发现的生物活性肽。
应用分子对接技术对上述60条肽段进行活性预测。分子对接通过采用计算机手段模拟配体多肽与受体蛋白之间的相互作用,可预测结合能大小与结合方式。利用Auto Dock Tools软件将筛选得到的肽段与ACE和DPP-IV分别进行100次半柔性对接,得到最低对接结合能。表2结果显示牛骨胶原蛋白肽与酶的最低结合能分别为:-11 kcal/mol(ACE)<-9.1 kcal/mol(DPP-IV)。肽段与酶的结合能越低,表明肽段与酶结合所需的能量越低,这说明肽段与酶的结合越紧密,对酶的抑制活性越强,可以推测牛骨胶原蛋白肽对于ACE具有最强的抑制活性。
表2 牛骨胶原蛋白肽中潜在活性肽段筛选
Table 2 Screening of potentially active peptides in bovine bone collagen peptide
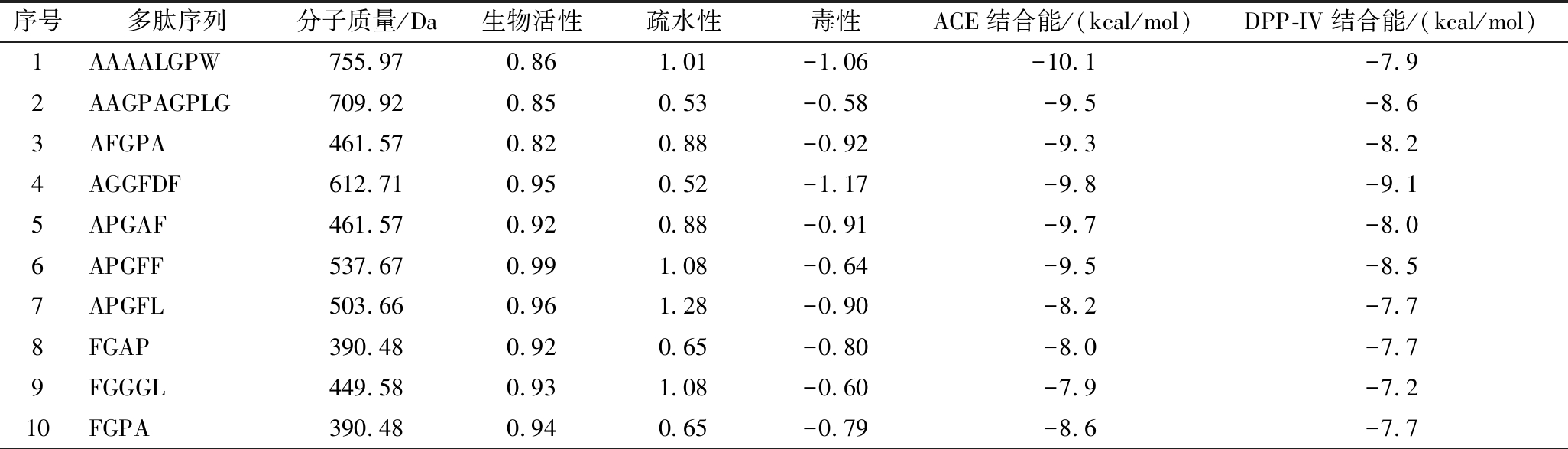
序号多肽序列分子质量/Da生物活性疏水性毒性ACE结合能/(kcal/mol)DPP-IV结合能/(kcal/mol)1AAAALGPW755.970.861.01-1.06-10.1-7.92AAGPAGPLG709.920.850.53-0.58-9.5-8.63AFGPA461.570.820.88-0.92-9.3-8.24AGGFDF612.710.950.52-1.17-9.8-9.15APGAF461.570.920.88-0.91-9.7-8.06APGFF537.670.991.08-0.64-9.5-8.57APGFL503.660.961.28-0.90-8.2-7.78FGAP390.480.920.65-0.80-8.0-7.79FGGGL449.580.931.08-0.60-7.9-7.210FGPA390.480.940.65-0.79-8.6-7.7
续表2
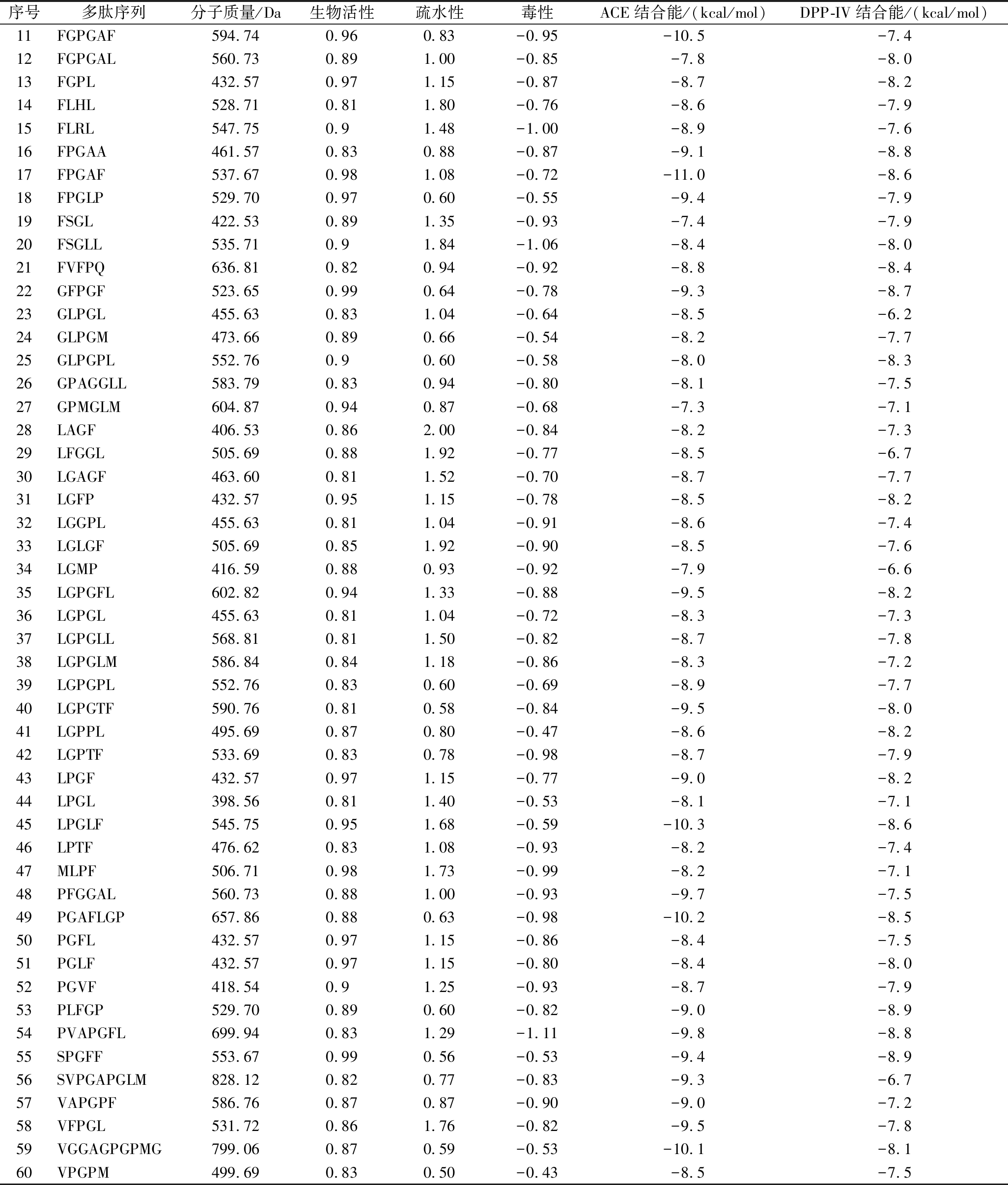
序号多肽序列分子质量/Da生物活性疏水性毒性ACE结合能/(kcal/mol)DPP-IV结合能/(kcal/mol)11FGPGAF594.740.960.83-0.95-10.5-7.412FGPGAL560.730.891.00-0.85-7.8-8.013FGPL432.570.971.15-0.87-8.7-8.214FLHL528.710.811.80-0.76-8.6-7.915FLRL547.750.91.48-1.00-8.9-7.616FPGAA461.570.830.88-0.87-9.1-8.817FPGAF537.670.981.08-0.72-11.0-8.618FPGLP529.700.970.60-0.55-9.4-7.919FSGL422.530.891.35-0.93-7.4-7.920FSGLL535.710.91.84-1.06-8.4-8.021FVFPQ636.810.820.94-0.92-8.8-8.422GFPGF523.650.990.64-0.78-9.3-8.723GLPGL455.630.831.04-0.64-8.5-6.224GLPGM473.660.890.66-0.54-8.2-7.725GLPGPL552.760.90.60-0.58-8.0-8.326GPAGGLL583.790.830.94-0.80-8.1-7.527GPMGLM604.870.940.87-0.68-7.3-7.128LAGF406.530.862.00-0.84-8.2-7.329LFGGL505.690.881.92-0.77-8.5-6.730LGAGF463.600.811.52-0.70-8.7-7.731LGFP432.570.951.15-0.78-8.5-8.232LGGPL455.630.811.04-0.91-8.6-7.433LGLGF505.690.851.92-0.90-8.5-7.634LGMP416.590.880.93-0.92-7.9-6.635LGPGFL602.820.941.33-0.88-9.5-8.236LGPGL455.630.811.04-0.72-8.3-7.337LGPGLL568.810.811.50-0.82-8.7-7.838LGPGLM586.840.841.18-0.86-8.3-7.239LGPGPL552.760.830.60-0.69-8.9-7.740LGPGTF590.760.810.58-0.84-9.5-8.041LGPPL495.690.870.80-0.47-8.6-8.242LGPTF533.690.830.78-0.98-8.7-7.943LPGF432.570.971.15-0.77-9.0-8.244LPGL398.560.811.40-0.53-8.1-7.145LPGLF545.750.951.68-0.59-10.3-8.646LPTF476.620.831.08-0.93-8.2-7.447MLPF506.710.981.73-0.99-8.2-7.148PFGGAL560.730.881.00-0.93-9.7-7.549PGAFLGP657.860.880.63-0.98-10.2-8.550PGFL432.570.971.15-0.86-8.4-7.551PGLF432.570.971.15-0.80-8.4-8.052PGVF418.540.91.25-0.93-8.7-7.953PLFGP529.700.890.60-0.82-9.0-8.954PVAPGFL699.940.831.29-1.11-9.8-8.855SPGFF553.670.990.56-0.53-9.4-8.956SVPGAPGLM828.120.820.77-0.83-9.3-6.757VAPGPF586.760.870.87-0.90-9.0-7.258VFPGL531.720.861.76-0.82-9.5-7.859VGGAGPGPMG799.060.870.59-0.53-10.1-8.160VPGPM499.690.830.50-0.43-8.5-7.5
通过检测,实验所用的牛骨胶原蛋白肽含有丰富的必需氨基酸。如图1-a所示,其主要氨基酸中Gly含量最高,其次是Pro、Glu和Ala,并且Gly和Pro含量均在氨基酸总量10%以上,其中疏水性氨基酸在总氨基酸组成中占比31.93%。据研究报道,含有疏水性氨基酸残基的肽链更可能具有ACE和DPP-IV抑制活性[17-18]。
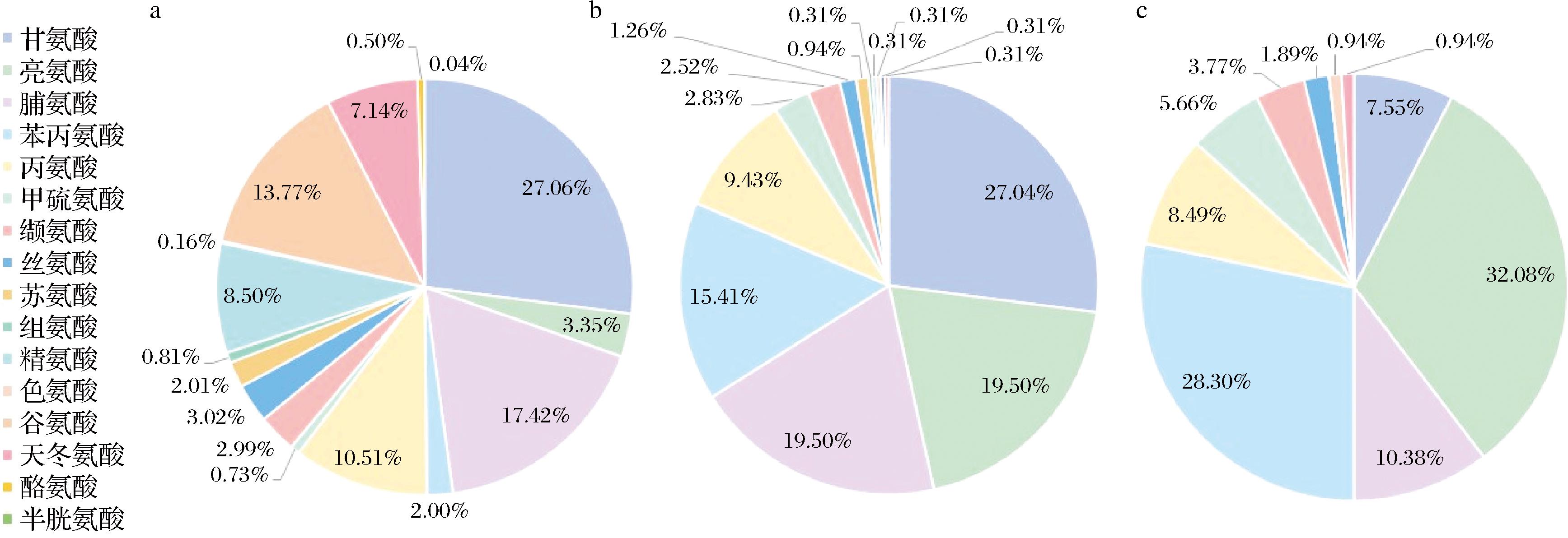
a-牛骨胶原蛋白肽总氨基酸组成;b-潜在活性肽段总氨基酸组成;c-潜在活性肽段两端氨基酸组成
图1 牛骨胶原蛋白肽及潜在活性肽段氨基酸组成
Fig.1 Amino acid composition of bovine collagen peptide and potentially active peptides
潜在活性肽段的氨基酸组成如图1所示,疏水性氨基酸总量在氨基酸组成中占比超过90%,其中牛骨胶原蛋白肽的标志性氨基酸Gly和Pro含量最高。与CHEN等[17]研究报道的罗非鱼皮胶原蛋白肽一致,疏水性氨基酸和Pro含量较高的胶原蛋白水解物以及两端含有疏水性氨基酸的肽段可以发挥良好的ACE抑制活性。此外本研究筛选得到的肽段包括大量Gly-Pro-Y重复肽段,由FU等[18]的报道可知,胶原蛋白肽的重复序列Gly-X-Y可以作为有效的ACE抑制剂,其中X通常为Pro。综合以上推测,本研究的牛骨胶原蛋白肽具有良好的ACE抑制潜力。
已有研究表明,富含Pro和Ala等疏水性氨基酸的多肽可以增强肽段与DPP-IV活性位点的相互作用,并且Ala和Gly容易被DPP-IV的疏水口袋接受,从而达到抑制DPP-IV活性的效果[19]。本研究的牛骨胶原蛋白肽和潜在活性肽段总氨基酸组成中,Gly、Pro和Ala等疏水性氨基酸的含量均较高。并且有研究发现,DPP-IV抑制肽通常在N端具有Xaa-Pro或Xaa-Ala序列(Xaa为任意氨基酸),其能够被DPP-IV水解,从而起到良好的DPP-IV抑制效果[20]。本研究筛选得到的潜在活性肽段中有18条肽段具有此类序列,推测这些肽段具有DPP-IV抑制潜力。因此,可以推测牛骨胶原蛋白肽对于DPP-IV可能也具有良好的抑制活性。
2.2 分子对接可视化分析
为进一步探究牛骨胶原蛋白肽与ACE和DPP-IV酶的相互作用机制,如图2所示,首先采用Pymol和Discovery Studio软件将不同酶对接结合能最低肽段的分子对接结果进行可视化,并进一步分析多肽与不同酶之间的相互作用机制。
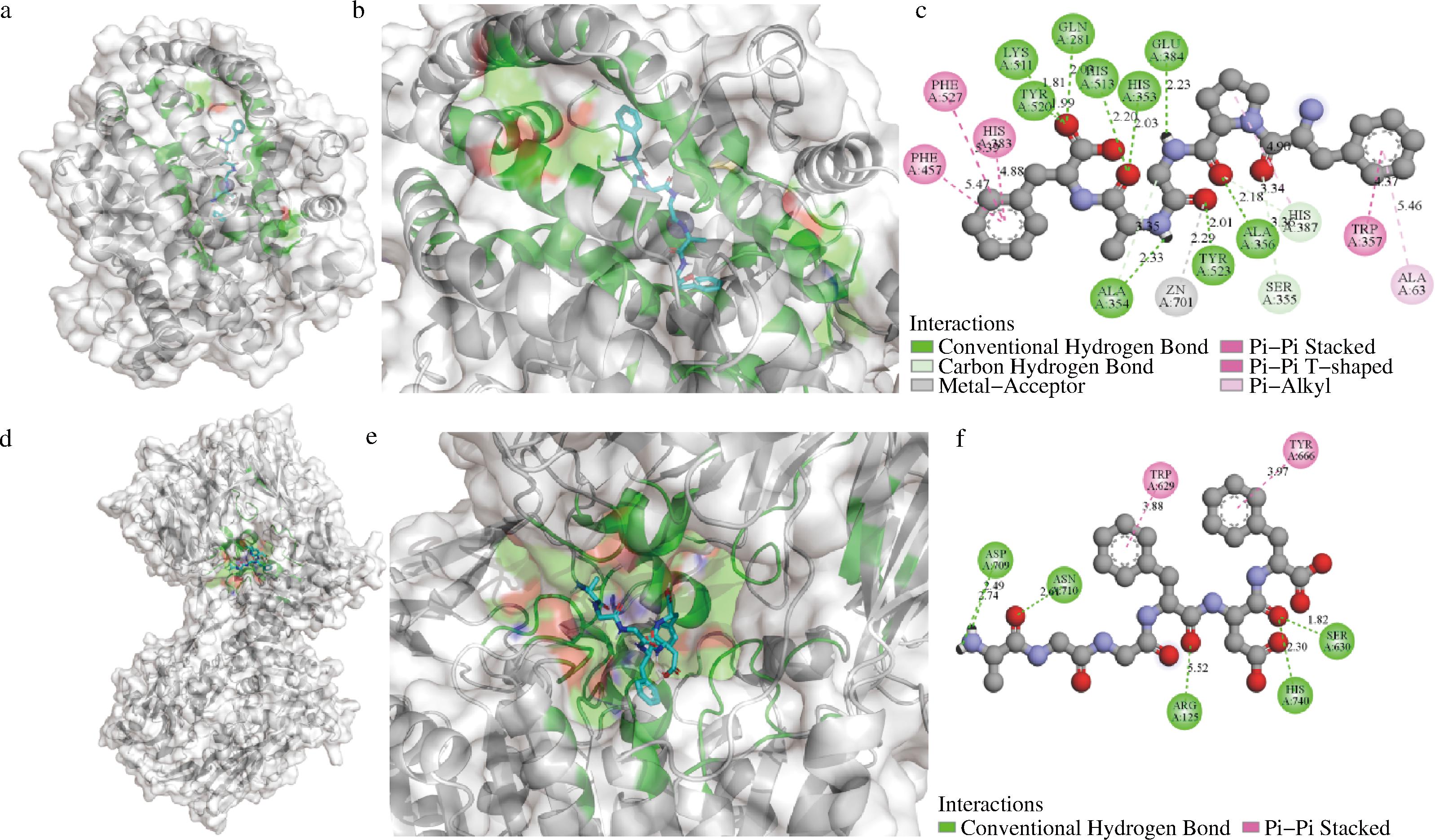
a-FPGAF与ACE分子对接示意图;b-FPGAF与ACE作用位点三维示意图;c-FPGAF与ACE作用方式二维示意图;d-AGGFDF与DPP-IV分子对接示意图;e-AGGFDF与DPP-IV作用位点三维示意图;f-AGGFDF与DPP-IV作用方式二维示意图
图2 多肽与不同酶分子对接模拟图
Fig.2 Molecular docking simulation of peptides with different enzymes
据报道,ACE相互作用残基的活性位点可分为3个活性口袋。S1口袋包括Ala354、Glu384和Tyr523残基;S2口袋包括Gln281、His353、Lys511、His513和Tyr520残基;S1′口袋包含Glu162残基[21]。如图2-a所示,FPGAF可以与S1和S2口袋中的活性位点产生氢键相互作用,与Zn2+产生配位相互作用,另外,FPGAF还可以与His383残基产生疏水相互作用。先前研究表明,生物活性肽多与S2口袋的活性位点产生相互作用,且与Zn2+间产生的金属配位相互作用会影响ACE活性,另外ACE中C结构域的His383残基是维持血压平衡,调节心血管功能的主要作用位点[22]。因此,肽段与这些残基产生相互作用,通过影响ACE活性,从而达到抑制ACE的目的。
DPP-IV被报道其空腔活性中心具有疏水性S1活性口袋和带电S2活性口袋。其中S1口袋包括催化三联体Ser630-Asp708(Asn710)-His740以及Tyr547、Tyr631、Trp659、Val656、Tyr662、Tyr666、Val711残基;S2口袋包括Arg125、Glu205、Glu206、Val207、Ser209、Arg358、Phe357残基[21]。如图2-b所示,AGGFDF可与催化三联体和S2口袋中的Arg125残基产生氢键相互作用,与S1口袋的Tyr666残基产生疏水相互作用。与先前的研究一致,生物活性肽与催化三联体中Ser630和His740残基的相互作用对于DPP-IV抑制活性具有重要影响[23]。
表3的分子对接可视化结果显示,牛骨胶原蛋白肽可以通过氢键和疏水相互作用与ACE和DPP-IV在其主要活性残基进行结合,且与ACE相互作用的主要活性位点最多,相较于DPP-IV酶,牛骨胶原蛋白肽与ACE的结合更紧密,可能具有最强的ACE抑制活性。
表3 对接结合能最低肽段与不同酶相互作用方式及区域
Table 3 Interaction mode and region of the lowest docking binding energy peptides with different enzymes
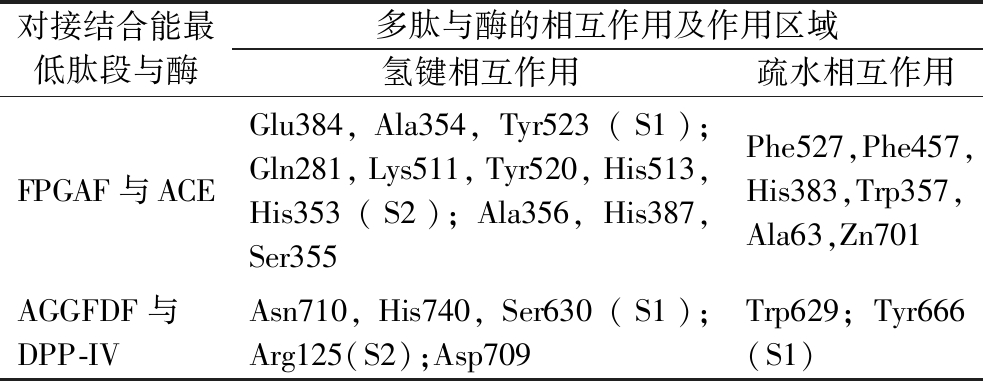
对接结合能最低肽段与酶多肽与酶的相互作用及作用区域氢键相互作用疏水相互作用FPGAF与ACEGlu384,Ala354,Tyr523(S1);Gln281,Lys511,Tyr520,His513,His353(S2);Ala356,His387,Ser355Phe527,Phe457,His383,Trp357,Ala63,Zn701AGGFDF与DPP-IVAsn710,His740,Ser630(S1);Arg125(S2);Asp709Trp629;Tyr666(S1)
2.3 体外活性验证
根据生物信息学对于牛骨胶原蛋白肽的生物活性预测结果,对其与不同酶的抑制活性进行了体外实验验证。
首先,牛骨胶原蛋白肽浓度与ACE抑制活性之间的关系如图3-a所示,随其浓度的升高,ACE抑制率逐渐升高,经过非线性曲线拟合后得到其对于ACE的半抑制质量浓度为3.48 mg/mL。于小栋[24]以牦牛骨为原料制备的牦牛骨胶原蛋白ACE抑制肽IC50值为4.52 mg/mL,明显高于本研究结果。其次如图3-b所示,随牛骨胶原蛋白肽浓度的提高,其对于DPP-IV抑制活性也不断提高,经过非线性拟合得到其对于DPP-IV半抑制质量浓度为19.94 mg/mL,王贝贝[25]的研究表明,羊皮胶原蛋白肽对DPP-IV的半抑制质量浓度为19.78 mg/mL,这与本研究结果接近。因此,本牛骨胶原蛋白肽具有较强的ACE抑制活性和良好的DPP-IV抑制活性。
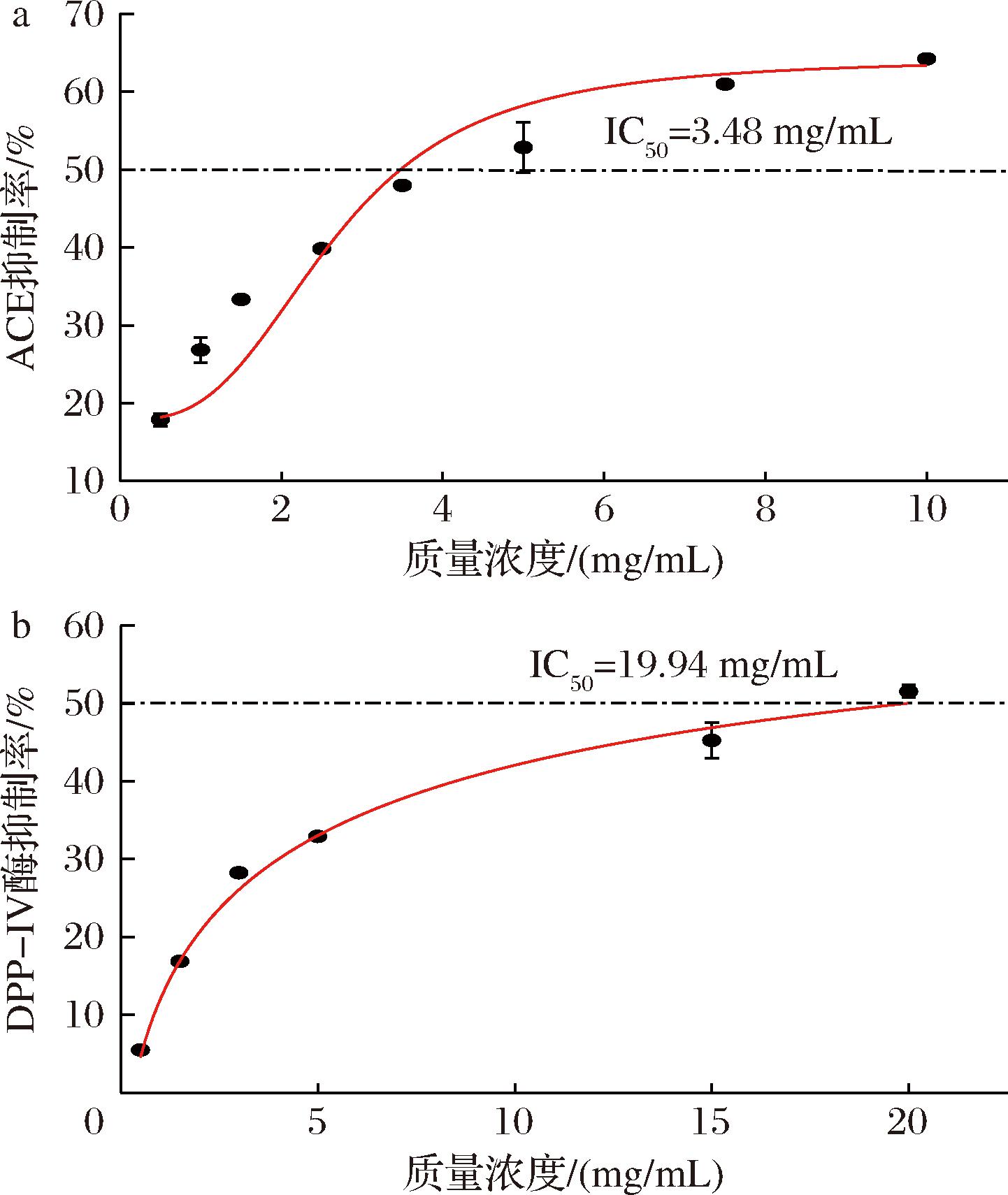
a-ACE抑制活性;b-DPP-IV抑制活性
图3 牛骨胶原蛋白肽体外生物活性验证
Fig.3 In vitro bioactivities of bovine bone collagen peptide
由生物信息学可知,肽与酶的最低结合能越低,则酶的抑制活性越强。牛骨胶原蛋白肽与ACE的结合能最低且相互作用的活性位点最多,因此,其对于ACE的抑制活性最强,体外活性实验验证了结合能预测结果。
3 结论
在本研究中,应用生物信息学方法预测并实验验证了牛骨胶原蛋白肽对于ACE和DPP-IV的抑制活性。其对于酶的抑制活性具有明显的浓度依赖性,抑制活性ACE>DPP-IV,生物信息学预测结果与实验结果一致。分子对接可视化结果显示,牛骨胶原蛋白肽可以通过氢键和疏水相互作用与酶的主要活性位点产生结合,导致酶的结构发生变化,从而影响酶的活性。这为牛骨胶原蛋白肽的功能挖掘与创新应用提供了科学指导。本研究原料仅涉及牛骨胶原蛋白肽,后期可对不同来源的肽进行系统生物信息学预测,提高筛选生物活性肽的效率。
[1] FU Y, THERKILDSEN M, ALUKO R E, et al.Exploration of collagen recovered from animal by-products as a precursor of bioactive peptides:Successes and challenges[J].Critical Reviews in Food Science and Nutrition, 2019, 59(13):2011-2027.
[2] 于志鹏, 薛如阳, 赵文竹, 等.肽组学在食源性活性肽研究中应用的进展[J].食品工业科技, 2016, 37(4):382-385.
YU Z P, XUE R Y, ZHAO W Z, et al.Progress on the application of peptidomics methods in food-derived bioactive peptides[J].Science and Technology of Food Industry, 2016, 37(4):382-385.
[3] 周亭屹, 高新昌, 党亚丽, 等.基于生物信息学技术的生物活性肽研究进展[J].食品工业科技, 2019, 40(12):335-340.
ZHOU T Y, GAO X C, DANG Y L, et al.Research development of the bioactive peptides based on bioinformatics[J].Science and Technology of Food Industry, 2019, 40(12):335-340.
[4] 赵伟睿. 生物信息学模拟制备降血压肽及酶膜耦合制备麦胚ACE抑制肽的研究[D].镇江:江苏大学, 2015.
ZHAO W R.Computer simulation of proteolysis of protein to produce antihypertensive peptides and production of ace inhibitory peptides from hydrolysates of defatted wheat germ protein in continuous member reactor[D].Zhenjiang:Jiangsu University, 2015.
[5] 侯晓艳. 基于生物信息学与多肽组学的花椒籽抗菌肽筛选及抑菌机理研究[D].雅安:四川农业大学, 2019.
HOU X Y.Discovery and identification of antimicrobial peptide from Zanthoxylum bungeanum seeds by bioinformatics and peptidomics and its mechanisms against E.coli and S.aureus[D].Ya’an:Sichuan Agricultural University, 2019.
[6] LI Y F, GU M Y, SHI F, et al.Identification of novel renin inhibitory peptides from Tartary buckwheat albumin hydrolysates by molecular docking[J].Process Biochemistry, 2024, 138:120-129.
[7] 杨楠. 苦荞蛋白ACE抑制肽的制备及活性研究[D].无锡:江南大学, 2023.
YANG N.Study on the preparation and activity of ACE inhibitory peptides from tartary buckwheat protein[D].Wuxi:Jiangnan University, 2023.
[8] SHARMIN K N, AMIZA M A, AHMAD F, et al.In silico analysis of Gracilaria changii proteins for potential bioactive peptides[J].IOP Conference Series:Earth and Environmental Science, 2022, 967(1):012017.
[9] ZHENG Y J, WANG X, ZHUANG Y L, et al.Isolation of novel ACE-inhibitory and antioxidant peptides from quinoa bran albumin assisted with an in silico approach:Characterization, in vivo antihypertension, and molecular docking[J].Molecules, 2019, 24(24):4562.
[10] 张婷. 牛血红蛋白ACE抑制活性肽序列的鉴定、预测及其抑制机制研究[D].长春:吉林大学, 2015.
ZHANG T.Identification and prediction of bovine hemoglobin derived ace-inhibitory peptides and its inhibitory molecular mechanism[D].Changchun:Jilin University, 2015.
[11] ZHANG X G, WANG R C, CHENG C L, et al.Identification of two novel dipeptidyl peptidase-IV inhibitory peptides from sheep whey protein and inhibition mechanism revealed by molecular docking[J].Food Bioscience, 2022, 48:101733.
[12] MA K E, WANG Y J, WANG M J, et al.Antihypertensive activity of the ACE-renin inhibitory peptide derived from Moringa oleifera protein[J].Food &Function, 2021, 12(19):8994-9006.
[13] MENG M, SHE Z Y, FENG Y Y, et al.Optimization of extraction process and activity of angiotensin-converting enzyme (ACE) inhibitory peptide from walnut meal[J].Foods, 2024, 13(7):1067.
[14] JIN R T, TENG X Y, SHANG J Q, et al.Identification of novel DPP-IV inhibitory peptides from Atlantic salmon (Salmo salar) skin[J].Food Research International, 2020, 133:109161.
[15] BLEAKLEY S, HAYES M, SHEA N O, et al.Predicted release and analysis of novel ACE-I, renin, and DPP-IV inhibitory peptides from common oat (Avena sativa) protein hydrolysates using in silico analysis[J].Foods, 2017, 6(12):108.
[16] LI W, CHEN W C, MA H L, et al.Structural characterization and angiotensin-converting enzyme (ACE) inhibitory mechanism of Stropharia rugosoannulata mushroom peptides prepared by ultrasound[J].Ultrasonics Sonochemistry, 2022, 88:106074.
[17] CHEN J L, RYU B, ZHANG Y Y, et al.Comparison of an angiotensin-I-converting enzyme inhibitory peptide from tilapia (Oreochromis niloticus) with captopril:Inhibition kinetics, in vivo effect, simulated gastrointestinal digestion and a molecular docking study[J].Journal of the Science of Food and Agriculture, 2020, 100(1):315-324.
[18] FU Y, YOUNG J F, LØKKE M M, et al.Revalorisation of bovine collagen as a potential precursor of angiotensin I-converting enzyme (ACE) inhibitory peptides based on in silico and in vitro protein digestions[J].Journal of Functional Foods, 2016, 24:196-206.
[19] NONGONIERMA A B, FITZGERALD R J.Features of dipeptidyl peptidase IV (DPP-IV) inhibitory peptides from dietary proteins[J].Journal of Food Biochemistry, 2019, 43(1):e12451.
[20] NONGONIERMA A B, FITZGERALD R J.Prospects for the management of type 2 diabetes using food protein-derived peptides with dipeptidyl peptidase IV (DPP-IV) inhibitory activity[J].Current Opinion in Food Science, 2016, 8:19-24.
[21] GU Y X, LI X, QI X F, et al.In silico identification of novel ACE and DPP-IV inhibitory peptides derived from buffalo milk proteins and evaluation of their inhibitory mechanisms[J].Amino Acids, 2023, 55(2):161-171.
[22] HE R, ALUKO R E, JU X R.Evaluating molecular mechanism of hypotensive peptides interactions with renin and angiotensin converting enzyme[J].PLoS One, 2014, 9(3):e91051.
[23] RASMUSSEN H B, BRANNER S, WIBERG F C, et al.Crystal structure of human dipeptidyl peptidase IV/CD26 in complex with a substrate analog[J].Nature Structural Biology, 2003, 10(1):19-25.
[24] 于小栋. 牦牛骨胶原蛋白肽的制备及其功能特性研究[D].西宁:青海师范大学, 2020.
YU X D.Preparation and functional properties of yak bone collagen peptide[D].Xining:Qinghai Normal University, 2020.
[25] 王贝贝. 羊皮胶原基DPP-Ⅳ抑制活性肽的制备及活性机制分析[D].无锡:江南大学, 2021.
WANG B B.Preparation and mechanism analysis of DPP-IV inhibitory peptides of sheepskin collagen[D].Wuxi:Jiangnan University, 2021.