在海洋环境中,海藻处于海洋食物链的底部,是水生环境中氧气的主要生产者,为其他生物提供生存所必须的氧气[1]。海藻可以通过其光合色素进一步分类为红藻(红藻纲)、绿藻(绿藻纲)和褐藻(褐藻纲)[2],褐藻生物量巨大,生长速度较快,被视为最有前景的海洋生物资源之一。褐藻含有多种生物活性物质,如褐藻胶、岩藻聚糖、岩藻黄质、甘露醇、多酚和植物激素等[3],其中褐藻胶是褐藻细胞壁的主要成分,约占褐藻干物质的22%~44%(质量分数),是一种由β-D-甘露糖醛酸(β-D-mannuronate,M)及α-L-古罗糖醛酸(α-L-guluronate,G)通过1,4-糖苷键共价连接而成的酸性阴离子线性多糖,可由M或G单独排列或M/G交替随机排列而成[4],M和G的比例对褐藻胶的物理化学及生物性质有着显著影响。褐藻胶由于具有良好的凝胶性、增稠性和稳定性,已经广泛应用于食品、化工、纺织和医疗行业[5],但同时由于分子质量大、水溶性低也限制了它的进一步应用。与褐藻胶相比,其降解产物褐藻寡糖具有结构简单、溶解度高等优点,以及许多优异的生物活性,如抗炎、抗肿瘤、促进作物生长等。生物降解法(酶解法)目前已经广泛应用于降解褐藻胶得到褐藻寡糖,褐藻胶裂解酶以β-消除机制对褐藻胶进行降解,通过切断褐藻胶的1,4-糖苷键在C4和C5位置间形成双键,将褐藻胶水解成不饱和褐藻寡糖(alginate oligosaccharides, AOS)[6]。
褐藻胶裂解酶已从多种海洋生物中获得,包括海洋软体动物、海洋细菌、海洋藻类等[7]。根据碳水化合物活性酶(carbohydrate-active enzymes,CAZy)数据库,褐藻胶裂解酶分为14个多糖裂解酶家族(PL5、6、7、8、14、15、17、18、31、32、34、36、39、41),其中PL5、PL7家族的较为常见[8-9];按照酶的作用方式可分为内切酶和外切酶;根据酶的底物特异性可分为专一性降解多聚甘露糖醛酸(PolyM)、专一性降解多聚古罗糖醛酸(PolyG)以及对两者都可以降解的双功能酶[10]。目前已报道的大多数还是具有PolyM偏好性的褐藻胶裂解酶,对于PolyG偏好性裂解酶仅有十余种[11],主要分布于弧菌属(Vibrio sp.)、微泡菌属(Microbulbifer sp.)、假交替单胞菌属(Pseudoalteromonas sp.)等[11-13],有待于发掘更多具有PolyG偏好性的褐藻胶裂解酶。目前对于褐藻酸裂解酶的研究大多基于菌株的筛选、基因的克隆表达等,不同的褐藻胶裂解酶的酶学性质不尽相同,对酶学性质的研究可以使酶发挥出最大潜力,因此发现更多的新型褐藻胶裂解酶,探索其性质、结构、功能等对推进工业化应用及海洋酶学的发展具有重要意义。
本研究从实验室前期筛选获得的海洋弧菌Vibrio sp.L2中克隆出一段具有褐藻胶裂解酶活性的基因,成功构建了表达菌株,经研究发现该菌株为PL7家族的褐藻胶裂解酶,对其酶学性质进行分析,可以为推动酶的工业化应用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
海洋弧菌Vibrio sp.L2及表达载体pET-24a(+)为本实验室保藏;大肠杆菌感受态细胞E.coli DH5α、E.coli BL21(DE3),北京擎科生物科技股份有限公司;细菌基因组DNA提取试剂盒、快速质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒,天根生化科技有限公司;快速PCR聚合酶PrimeSTAR® Max DNA Polymerase,TaKaRa公司;限制性内切酶及T4 DNA连接酶,NEB公司;褐藻酸钠,山东洁晶集团股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),索莱宝生物科技有限公司;其他试剂均为国产分析纯试剂。
1.2 仪器与设备
SW-CJ-2FD超净工作台,安泰空气技术有限公司;恒温培养摇床,知楚仪器有限公司;JY96-IIN型超声波细胞粉碎机,宁波新芝科技生物股份有限公司;Infinite M200PRO酶标仪,瑞士Tecan公司;定性梯度PCR仪,德国耶拿分析仪器股份公司;高压蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;GS-680J 凝胶成像系统,培青科技有限公司;P-900 AKTA Explorer蛋白快速纯化仪,GE公司。
1.3 实验方法
1.3.1 褐藻胶裂解酶基因AlgL3199的克隆
以海洋弧菌Vibrio sp.L2基因组为模板设计引物,正向引物(5′-3′)F-CGCCATATGGCGTGTTCGA-CAGCAGAACAATC,反向引物(5′-3′)R-CCGCTC-GAGCGGTTGATCAAGCGTTAACTTGTAG,正向与反向引物中分别引入Nde I和Xho I两个酶切位点。使用细菌基因组DNA提取试剂盒提取Vibrio sp.L2的基因组为模板,PCR扩增出不含信号肽的褐藻胶裂解酶基因AlgL3199。PCR扩增体系为PrimeSTAR® Max DNA聚合酶25 μL,正向及反向引物各1 μL,DNA模板1 μL,ddH2O 22 μL;PCR扩增程序为98 ℃预变性2 min,98 ℃变性10 s,60 ℃复性10 s,72 ℃延伸1 min,72 ℃充分延伸10 min,共35个循环。PCR产物使用琼脂糖凝胶电泳验证,条带正确则进行胶回收,-20 ℃保存。
1.3.2 褐藻胶裂解酶AlgL3199重组质粒的构建
将1.3.1节得到的PCR产物及pET-24a(+)载体质粒在37 ℃双酶切3 h,酶切后的产物经琼脂糖凝胶电泳验证,条带正确则进行胶回收,使用T4 DNA连接酶进行连接。将上述连接产物在65 ℃热灭活10 min。取10 μL连接产物加入至大肠杆菌感受态细胞E.coli DH5α,转化完成并活化的菌液涂布在含有卡那霉素(kanamycin,kana)抗性的LB固体培养基上,37 ℃培养箱培养12~16 h,挑单菌落接种至5 mL含有kana抗性的LB液体培养基中,37 ℃培养12~16 h,将菌液送至上海生工测序鉴定重组质粒pET-24a(+)/AlgL3199是否构建成功,选择测序正确的菌株提取质粒转入到表达宿主E.coli BL21(DE3)中,转入成功后挑单菌落培养,保菌后放置于-80 ℃冰箱保存备用。
1.3.3 pET- 24a(+)/AlgL3199的诱导表达及分离纯化
将保存的甘油菌按照1%的接种量接种至5 mL含有kana抗性的LB液体培养基中进行活化,之后接种到500 mL LB液体培养基中(含kana抗性),在37 ℃,200 r/min条件下培养至OD600值在0.6~0.8,加入异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)使终浓度为0.2 mmol/L,在16 ℃,200 r/min诱导20 h。诱导结束后8 000 r/min离心10 min,菌体沉淀用20 mmol/L pH 7.0 PBS重悬,超声波破碎60 min(功率300 W,工作时间4 s,冷却时间8 s),破碎后菌液8 000 r/min离心20 min,弃沉淀,取上清液作为粗酶液,用0.22 μm的滤膜过滤后使用HisTrapTM HP柱亲和层析纯化,通过SDS-PAGE进行验证。
1.3.4 褐藻胶裂解酶比活力测定
采用DNS法对纯酶液测定酶活力,取1 mL 10 g/L的褐藻酸钠底物溶液(底物溶于10 mmol/L Gly-NaOH缓冲液,pH 10.0),加入1 mL稀释一定倍数的纯酶液,40 ℃反应30 min,加入1 mL DNS终止反应,沸水浴5 min显色,冷却至室温后加蒸馏水定容至25 mL。以灭活酶液作为空白对照,在520 nm波长下测定吸光度值,每个反应做3个平行。代入葡萄糖醛酸标准曲线中计算反应生成的还原糖含量。酶活力单位定义为:在该反应条件下,每分钟裂解褐藻酸钠产生1 μg还原糖所需的酶量定义为一个酶活力单位(U)。使用BCA蛋白浓度测定试剂盒测定酶液的蛋白浓度。比活力(U/mg)=酶活力(U/mL)/蛋白质量浓度(mg/mL)。
1.3.5 褐藻胶裂解酶酶学性质检测
1.3.5.1 最适温度及温度稳定性
将纯酶与10 g/L的褐藻酸钠底物溶液分别在10~60 ℃(间隔5 ℃)下反应30 min,测定重组酶AlgL3199与底物反应的最适温度,测定酶活力方法见1.3.4节,以最高酶活力定义为100%,计算相对酶活力。
测定温度稳定性时将纯酶分别在10~60 ℃温育1 h,在最适温度下测定重组酶AlgL3199在不同温度温浴后的残余活性,测定酶活力方法见1.3.4节,以未经过热处理的纯酶酶活力作为100%,计算相对酶活力。
1.3.5.2 最适pH及pH稳定性
配制不同pH (Na2HPO4-柠檬酸缓冲液pH 3.0~6.0,Na2HPO4-NaH2PO4缓冲液pH 6.0~8.0,Tris-HCl缓冲液pH 8.0~9.0,甘氨酸-NaOH缓冲液pH 9.0~10.0,Na2HPO4-NaOH缓冲液pH 10.0~12.0,浓度均为10 mmol/L)的10 g/L褐藻酸钠底物溶液,分别加入纯酶液测定反应的最适pH,测定酶活力方法见1.3.4节,以最高酶活力定义为100%,确定重组酶AlgL3199反应的最适pH。
测定重组酶AlgL3199 pH稳定性时,将酶液分别与10 mmol/L不同pH、无底物的缓冲液混合,4 ℃下孵育12 h。在最适温度、最适pH下测定残余活性,测定酶活力方法见1.3.4节,以最高酶活力定义为100%。
1.3.5.3 金属离子及化合物对酶活力的影响
为测定不同金属离子及化合物对重组酶AlgL3199酶活力的影响,将褐藻酸钠底物溶液分别与不同金属离子及化合物混合[Co2+、Cu2+、Mn2+、Zn2+、Ca2+、Fe3+、Ni2+、Na+、K+、Mg2+、Al3+、Ba2+、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三硫苏糖醇、EDTA]使体系中的金属离子终浓度分别为1 mmol/L和5 mmol/L,空白对照组加入相同体积的蒸馏水,在最适温度、最适pH下按照1.3.4节中的方法测定酶活力,以空白对照组酶活力为100%。
1.3.5.4 NaCl浓度对酶活力的影响
在酶与底物反应的混合体系中分别加入终浓度为0~1.25 mol/L的NaCl,按照1.3.4节中的方法,在最适反应条件下测定重组酶AlgL3199的酶活力,以不加NaCl的酶活力为100%,研究不同浓度的Na+对酶活力的作用效果。
1.3.5.5 底物特异性及动力学参数的测定
选取PolyM、PolyG、褐藻酸钠底物,配制成质量浓度为10 g/L的底物溶液(底物溶于10 mmol/L Gly-NaOH缓冲液,pH 10.0)。按照1.3.4节中的方法,检测重组酶AlgL3199对不同底物的酶解能力,以最大酶活力为100%,计算相对酶活力。
分别配制质量浓度为1~50 mg/mL的褐藻酸钠溶液、PolyM溶液、PolyG溶液,在最适反应条件下按照1.3.4节中的测定酶活力方法,以S为横坐标,V为纵坐标,使用Origin 2021软件进行拟合米氏方程,得出米氏常数方程Km、Vmax值、计算kcat值和kcat/Km。
1.3.6 重组酶AlgL3199酶解产物分析
1.3.6.1 薄层色谱(thin layer chromatography,TLC)分析
选取PolyM、PolyG、褐藻酸钠底物,配制成质量浓度为10 g/L的底物溶液(底物溶于10 mmol/L Gly-NaOH缓冲液,pH 10.0)。40 ℃温浴10 min后加入酶液进行反应,分别于反应时间1、5、10、30、60、120、180、240、300 min取样并煮沸灭活,5 000 r/min超滤离心5 min,取0.5 μL反应产物点样于TLC硅胶板(共点样3次),用展开剂(正丁醇∶甲酸∶水=4∶6∶1)展开样品,结束后吹干硅胶板,将板插入苯胺-二苯胺显色剂中,拿出后用吹风机吹至表面无水,放在加热板上260~300 ℃加热显色1 min,确定重组酶AlgL3199的降解过程及降解产物的组分。
1.3.6.2 电离喷雾质谱(electrospray ionization mass spectrometry,ESI-MS)分析产物
ESI-MS通过对降解产物中寡糖的质荷比进行分析来确定寡糖组分的聚合度。将薄层层析反应4 h的酶解产物进行质谱分析,ESI-MS检测条件:波长335 nm的氮气激光器,相对激光强度90%,使用频率1 000 Hz,加速/提取/聚焦电压分别为19、18、7 kV。将1 μL基质与1 μL样品混合,吸取1 μL混合液体点在靶板上进行检测。
2 结果与分析
2.1 褐藻胶裂解酶AlgL3199的序列分析
本实验室筛选获得的海洋弧菌Vibrio sp.L2中克隆出的褐藻胶裂解酶基因AlgL3199序列全长为1 038 bp,共编码346个氨基酸,经Signalp 6.0(SignalP 6.0-DTU Health Tech-Bioinformatic Services)预测信号肽切割位点在第16和第17个氨基酸之间,去掉信号肽后,通过在线软件Protparam(http://web.expasy.org/p -rotparam/)预测AlgL3199的理论分子质量为36.06 kDa,理论等电点为5.31。
通过MEGA11.0软件构建系统发育树,如图1所示,AlgL3199与其他属于PL7家族的基因处于同一分支。PL7家族包含3个高度保守的结构域:SA3(RXEXR),SA4 (YXKAGXYXQ)和SA5(QXH)[14],将AlgL3199与其他PL7家族的褐藻胶裂解酶进行多序列比对,序列分别来自Vibrio sp.S11_S32(WP_190337830.1)、Microbulbifer sp. 6532A(BAJ62034.1)、Vibrio sp.Aly08(QCX08462.1)、Falsirhodobacter sp.Alg1(BAV10560.1)、Vibrio sp.AlyW201(QIV66983.1),根据图2对比结果,发现AlgL3199 具有这3种保守结构域,综上AlgL3199属于PL7家族的褐藻胶裂解酶。
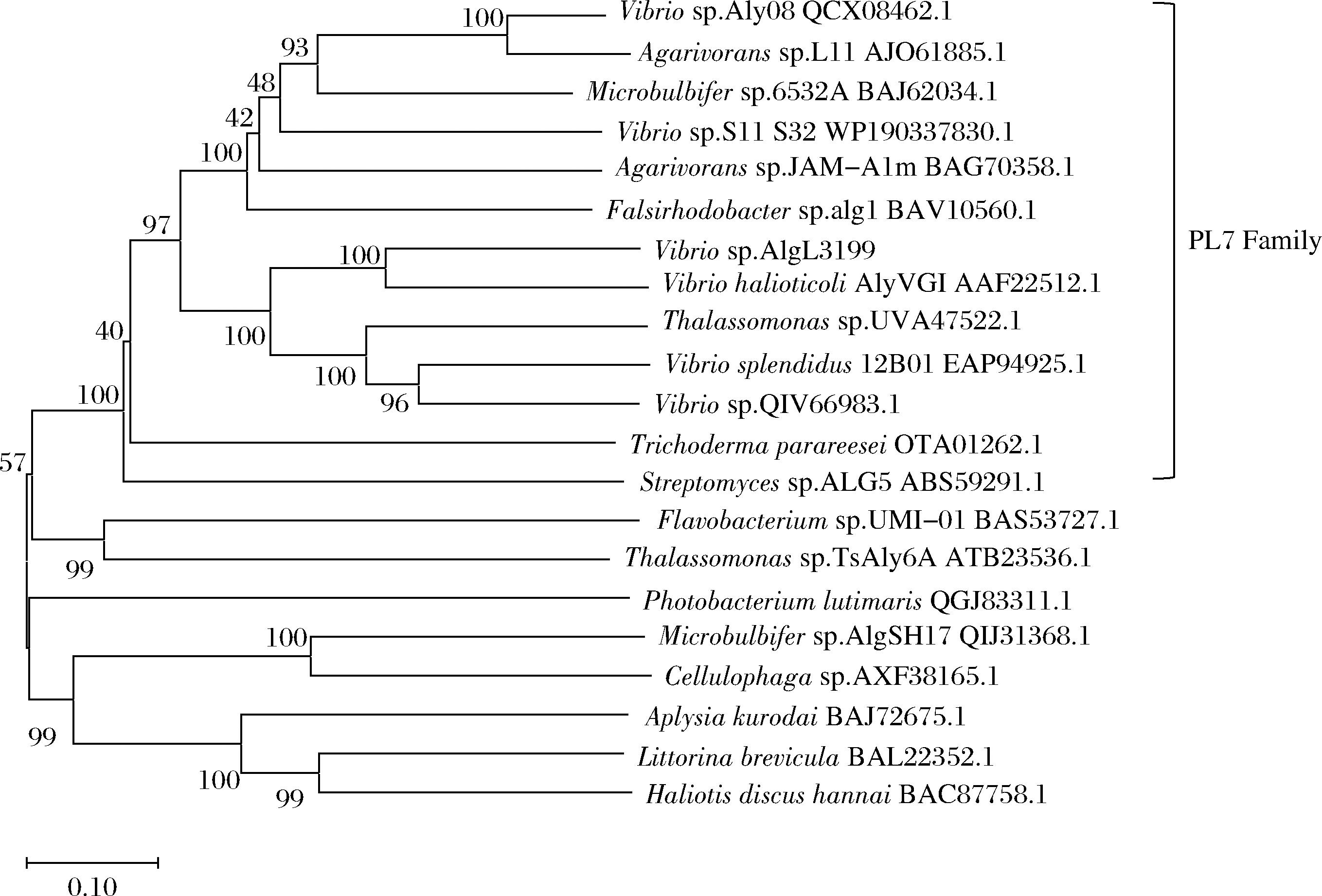
图1 褐藻胶裂解酶AlgL3199的系统发育树
Fig.1 Phylogenetic tree of alginate lyase AlgL3199

图2 褐藻胶裂解酶AlgL3199与PL7家族褐藻胶裂解酶的序列比对
Fig.2 Sequence alignment of alginate lyase AlgL3199 to PL7 family alginate lyases
2.2 褐藻胶裂解酶AlgL3199的克隆及重组质粒的构建
以海洋弧菌Vibrio sp.L2基因组为模板,扩增出一段不含信号肽的褐藻胶裂解酶基因AlgL3199,经琼脂糖凝胶电泳验证(图3),在分子质量为1 000 bp左右有一明显条带,与预测片段大小相符,将该片段与pET-24a(+)载体双酶切连接后导入E.coli DH5α,挑单菌落培养,经测序后进行序列对比,结果显示该基因与Vibrio sp.L2中克隆出的基因序列相同,这说明重组质粒pET- 24a(+)-AlgL3199构建成功。
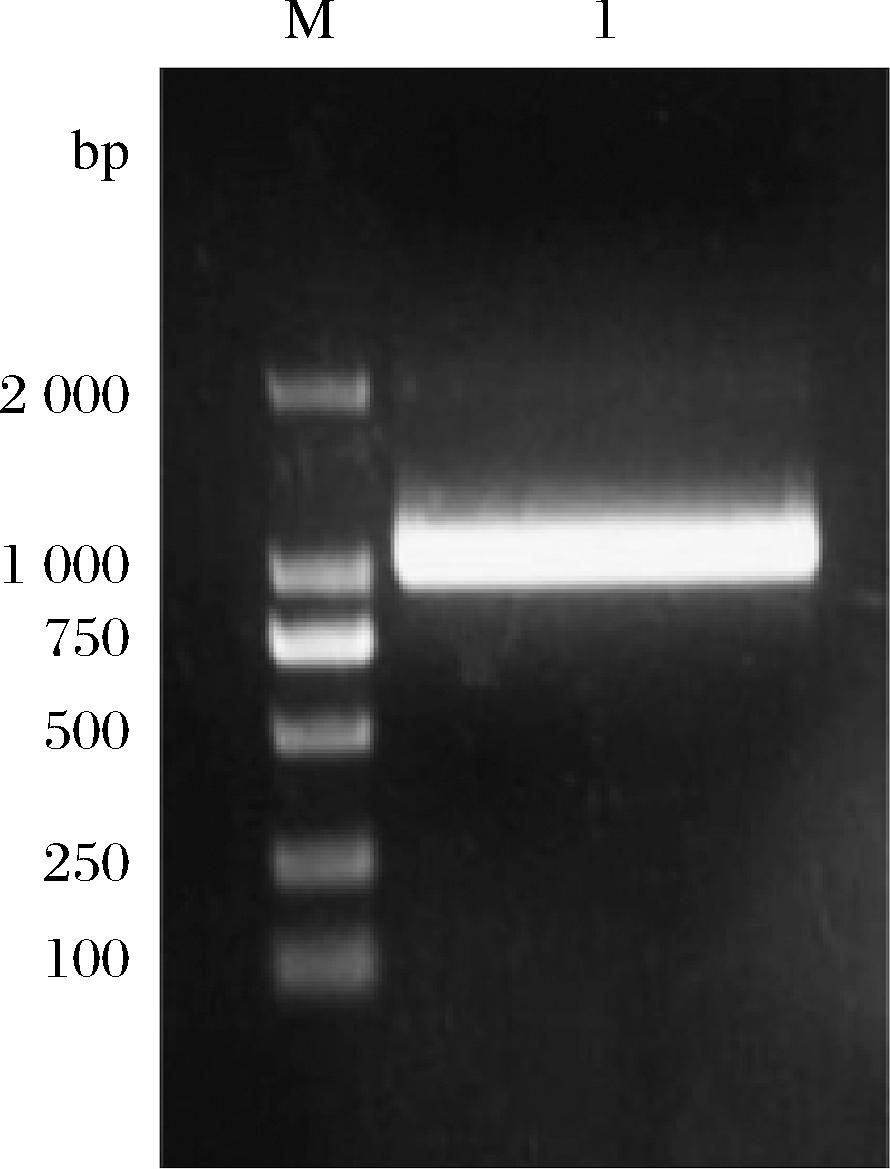
M-2 000 bp的DNA maker;1-AlgL3199的PCR扩增条带。
图3 AlgL3199的PCR扩增
Fig.3 PCR amplification of AlgL3199
2.3 重组酶AlgL3199的诱导表达、分离纯化及比活力测定
重组酶AlgL3199在IPTG浓度0.2 mmol/L,16 ℃的条件下诱导20 h得到粗酶液,通过SDS-PAGE进行验证,验证结果如图4所示,在35~48 kDa 有一条带,与理论分子质量36.06 kDa基本一致。该结果表明重组褐藻胶裂解酶AlgL3199基因成功诱导表达。重组酶AlgL3199通过HisTrapTM HP柱亲和层析的方法进行纯化,纯化后经SDS-PAGE验证,在35 kDa和48 kDa之间有一清晰的蛋白条带(图4),与AlgL3199理论分子质量(36.06 kDa)基本一致。按照1.3.4节的方法对纯化后的重组酶AlgL3199进行比活力的测定,计算结果为4 268.07 U/mg,表1中列举了几种PL-7家族的褐藻胶裂解酶的比活力进行比较。
表1 已报道的PL-7家族褐藻胶裂解酶比活力比较
Table 1 Reported comparison of the specific activity of alginate lyases of the PL-7 family
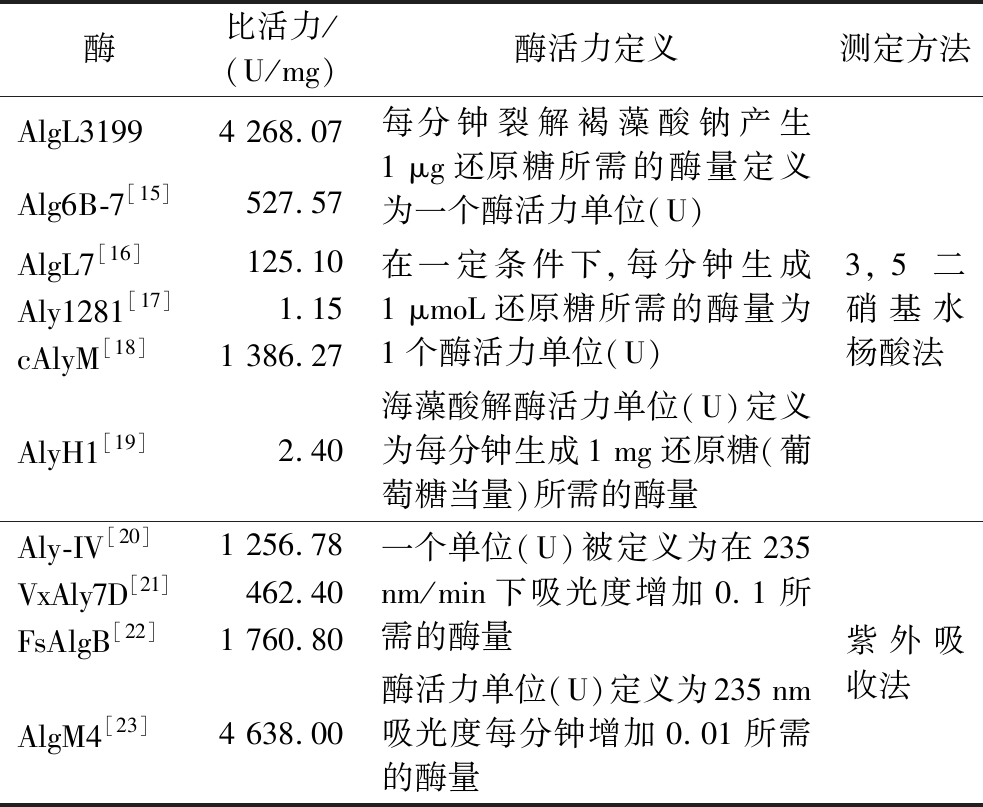
酶比活力/(U/mg)酶活力定义测定方法AlgL31994 268.07Alg6B-7[15]527.57AlgL7[16]125.10Aly1281[17]1.15cAlyM[18]1 386.27AlyH1[19]2.40每分钟裂解褐藻酸钠产生1 μg还原糖所需的酶量定义为一个酶活力单位(U)在一定条件下,每分钟生成1 μmoL还原糖所需的酶量为1个酶活力单位(U)海藻酸解酶活力单位(U)定义为每分钟生成1 mg还原糖(葡萄糖当量)所需的酶量3,5 二硝基水杨酸法Aly-IV[20]1 256.78VxAly7D[21]462.40FsAlgB[22]1 760.80AlgM4[23]4 638.00一个单位(U)被定义为在235 nm/min下吸光度增加0.1所需的酶量酶活力单位(U)定义为235 nm吸光度每分钟增加0.01所需的酶量紫外吸收法
表2 AlgL3199动力学参数
Table 2 AlgL3199 kinetic parameters

底物Km/(mg/mL)Vmax/[μg/(mL·min)]kcat/s-1kcat/Km/[mL/(mg·s)]PolyM6.8141.087 058.421 036.48PolyG6.3444.427 632.301 203.83褐藻酸钠6.6641.077 056.701 059.56
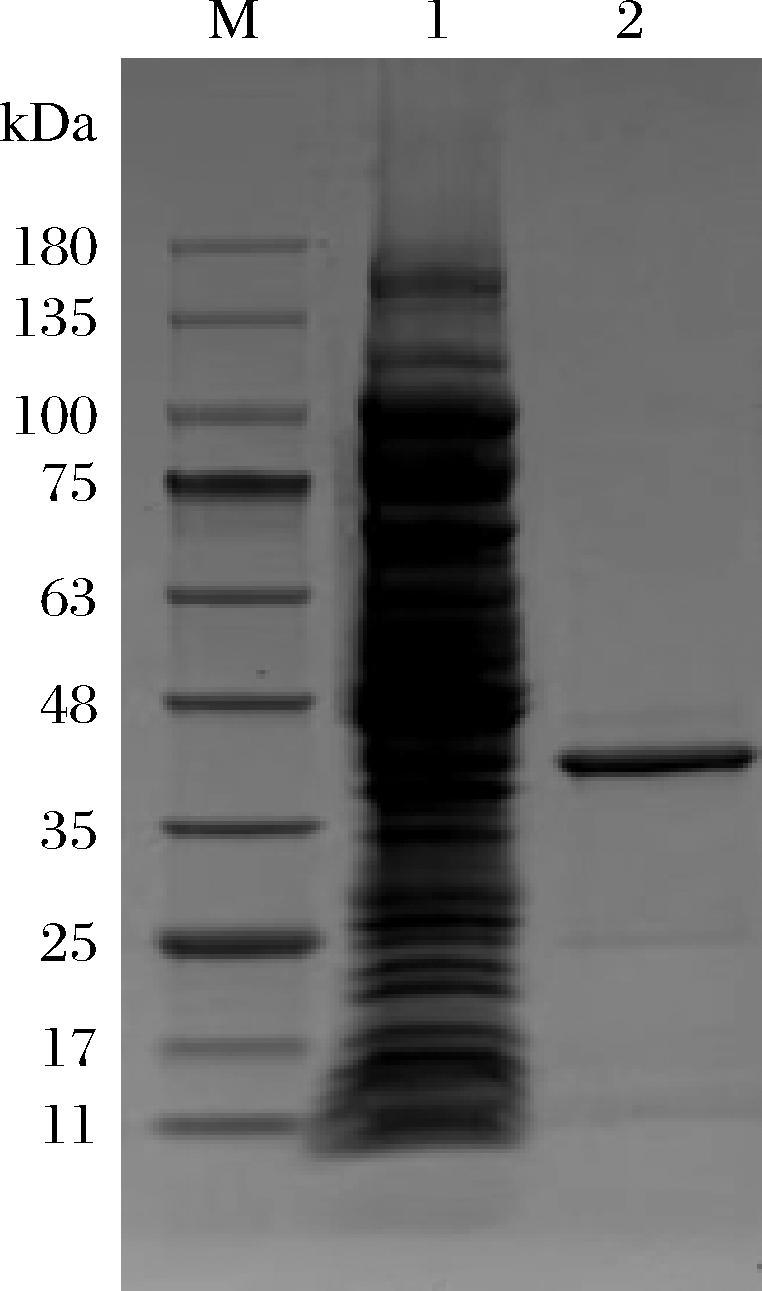
M-蛋白maker;1-AlgL3199粗酶液;2-AlgL3199纯酶液。
图4 AlgL3199的SDS-PAGE 图
Fig.4 SDS-PAGE of AlgL3199
2.4 重组酶AlgL3199的酶学性质分析
2.4.1 重组酶AlgL3199最适温度及温度稳定性
在不同温度下对重组酶AlgL3199进行酶活力测定,结果如图5-a所示,AlgL3199最适反应温度为40 ℃,当在35~45 ℃反应时,AlgL3199的相对酶活力可在80%以上。AlgL3199在不同温度温育1 h后,于最适反应温度测定酶活力,结果如图5-b所示,在10~35 ℃温育1 h后,残余酶活力仍可保留80%以上,当温育温度提高至40 ℃以上时,AlgL3199褐藻胶裂解酶酶活力逐渐降低,到50 ℃时活力降低至24.24%,由此可见AlgL3199属于低温酶。研究表明大多数海洋来源褐藻胶裂解酶最适温度范围为30~50 ℃,在低温条件下稳定性较好,如Alg17B,最适温度为45 ℃,但其在45 ℃、1 h的稳定性较差,残余酶活力在15%以下,在25~35 ℃热稳定性良好,酶活力保持80%[24];Alyw202在45 ℃时活性最高,在低于40 ℃的温度下Alyw202非常稳定,孵育2 h后,其活性保持在60%左右,但随着温度的升高活性急剧下降[25]。
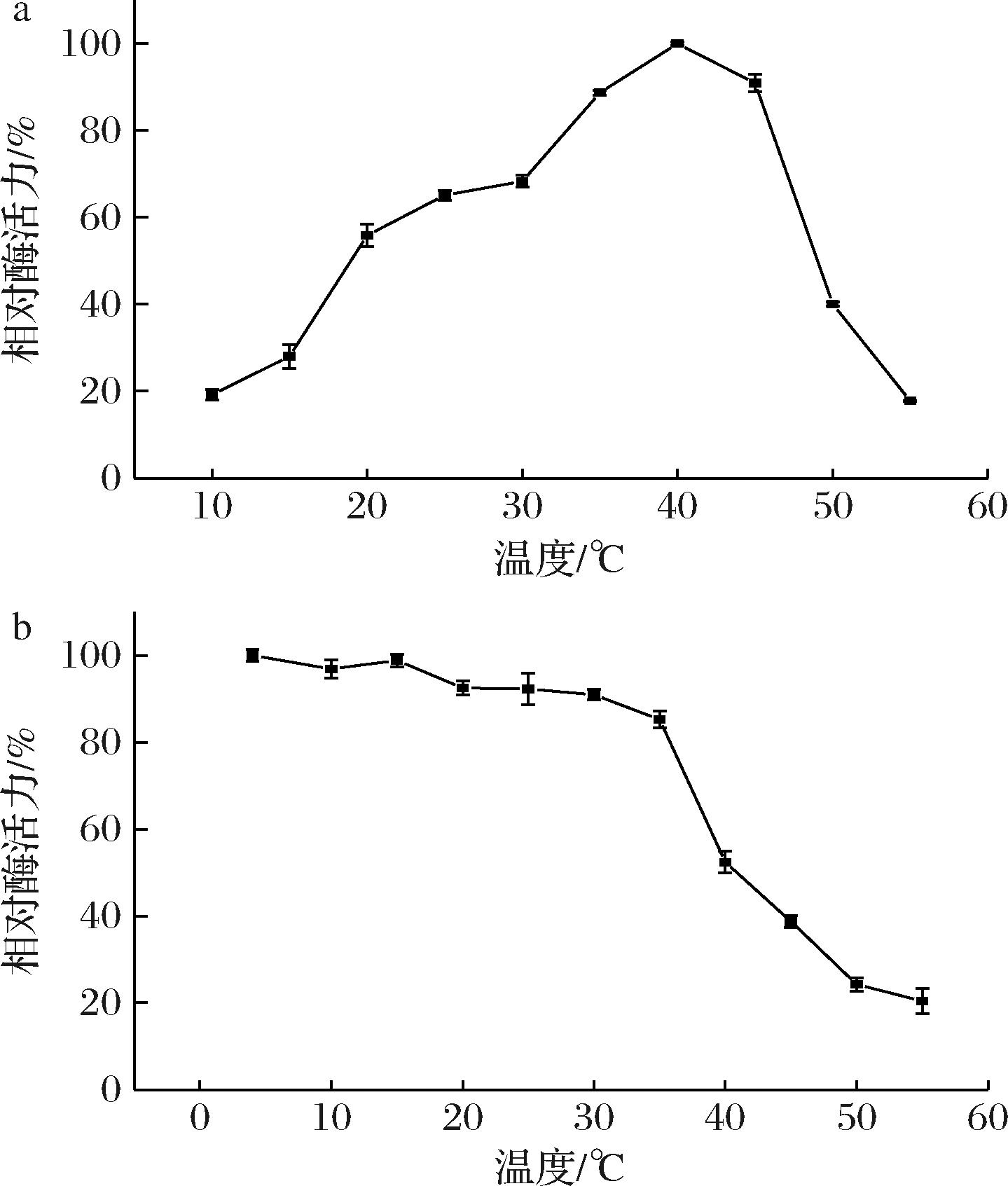
a-最适温度;b-温度稳定性
图5 温度对AlgL3199酶活力的影响
Fig.5 Effect of temperature on the activity of AlgL3199 enzyme
2.4.2 重组酶AlgL3199最适pH及pH稳定性
在不同pH下对重组酶AlgL3199进行酶活力测定,结果如图6-a所示,AlgL3199的最适pH值为10.0、最适缓冲液为10 mmol/L的Gly-NaOH,该酶在pH 8.0~10.0测定酶活力时,相对酶活力都可保持在70%以上。AlgL3199在不同pH溶液中孵育12 h后,于最适pH下测定残余酶活力,结果如图6-b所示,在pH 8.0(Tris-HCl)~10.0(Gly-NaOH),AlgL3199可保留90%以上的活力。在先前的研究中,大多数报道的褐藻胶裂解酶在中性环境下表现出最佳的pH值,如来源于Microbulbifer sp.Q7的AlyM[12]、Vibrio xiamenensis QY104的VxAly7D[21]以及Vibrio splendidus 12B01的AlyE[26]最适pH值均在7.0~7.5。褐藻酸钠在偏酸性条件下会形成难溶的褐藻酸,而中性及碱性环境可以增大其溶解性与流动性,同时在一些需要联合多种酶协同工作的反应中,中性或碱性褐藻胶裂解酶可与其他酶(如蛋白酶、淀粉酶等)联用,以提高底物的利用率和反应的整体效率,因此对于碱性褐藻胶裂解酶的发掘也必不可少,例如VsAly7D在pH值为9.0~10.0的条件下保持稳定12 h,剩余活力为80%[27],来源于自浅海热液系统耐热菌 Yeosuana marina sp.JLT21的YMA-1催化褐藻酸钠降解最适反应pH值为9.0[28]。根据实验结果,重组酶AlgL3199也是一种碱性稳定的海藻酸解酶,更适合在弱碱性条件下储存,这为碱性褐藻胶裂解酶的发掘与应用提供了新依据。
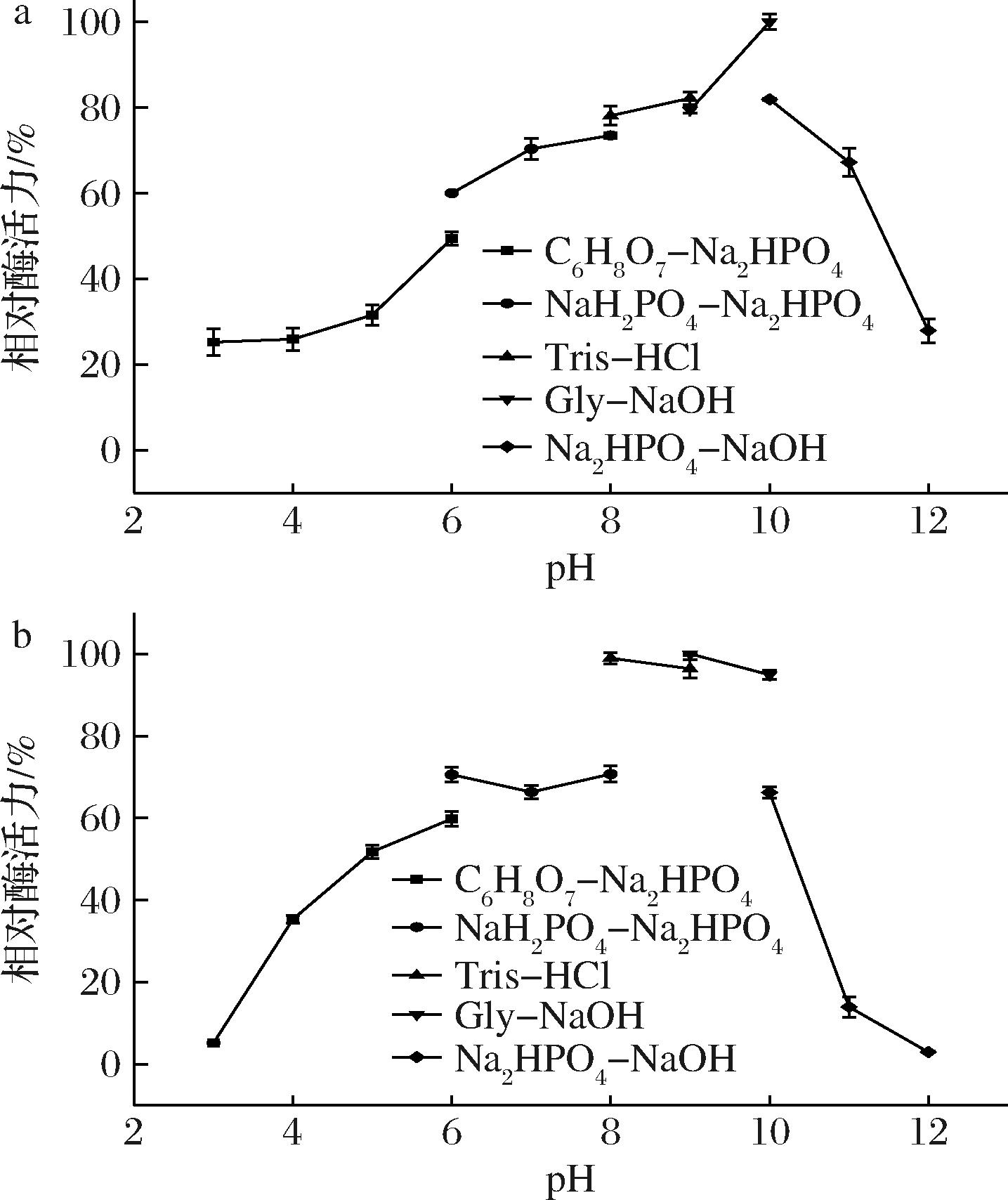
a-最适pH;b-pH稳定性
图6 pH对AlgL3199酶活力的影响
Fig.6 Effect of pH on the activity of AlgL3199 enzyme
2.4.3 金属离子及化合物对重组酶活力的影响
在酶活力测定的反应体系中加入不同的金属离子及化合物,使其终浓度为1 mmol/L和5 mmol/L,测定其对重组酶AlgL3199活力的影响,结果如图7所示,在金属离子及化合物终浓度为1 mmol/L时,Cu2+、Mn2+、Co2+对重组酶AlgL3199有明显促进作用,相对酶活力分别达到204.56%、170.99%、185.86%,Ni2+、Fe3+有轻微促进作用,Ba2+有轻微抑制作用,而化合物EDTA及SDS使重组酶AlgL3199完全失活,其余金属离子及化合物与未添加金属离子的对照组相近;当金属离子及化合物终浓度为5 mmol/L时,Cu2+、Mn2+、Co2+、Ni2+、Fe3+的促进作用减弱,但仍高于未添加金属离子的对照,Mg2+、Ba2+、Zn2+出现了不同程度的抑制作用,酶活力分别降低至82.13%、30.08%、56.27%。酶活性一般在二价阳离子条件下受到影响,二价阳离子通过诱导蛋白质构象改变、替代其他酶辅因子、交替酶稳定性等方式,作为增加/抑制酶活性的辅因子[29]。因此在后续应用中,可辅助添加具有激活作用的金属离子来提升酶活力,但同时要注意金属离子浓度的选择。
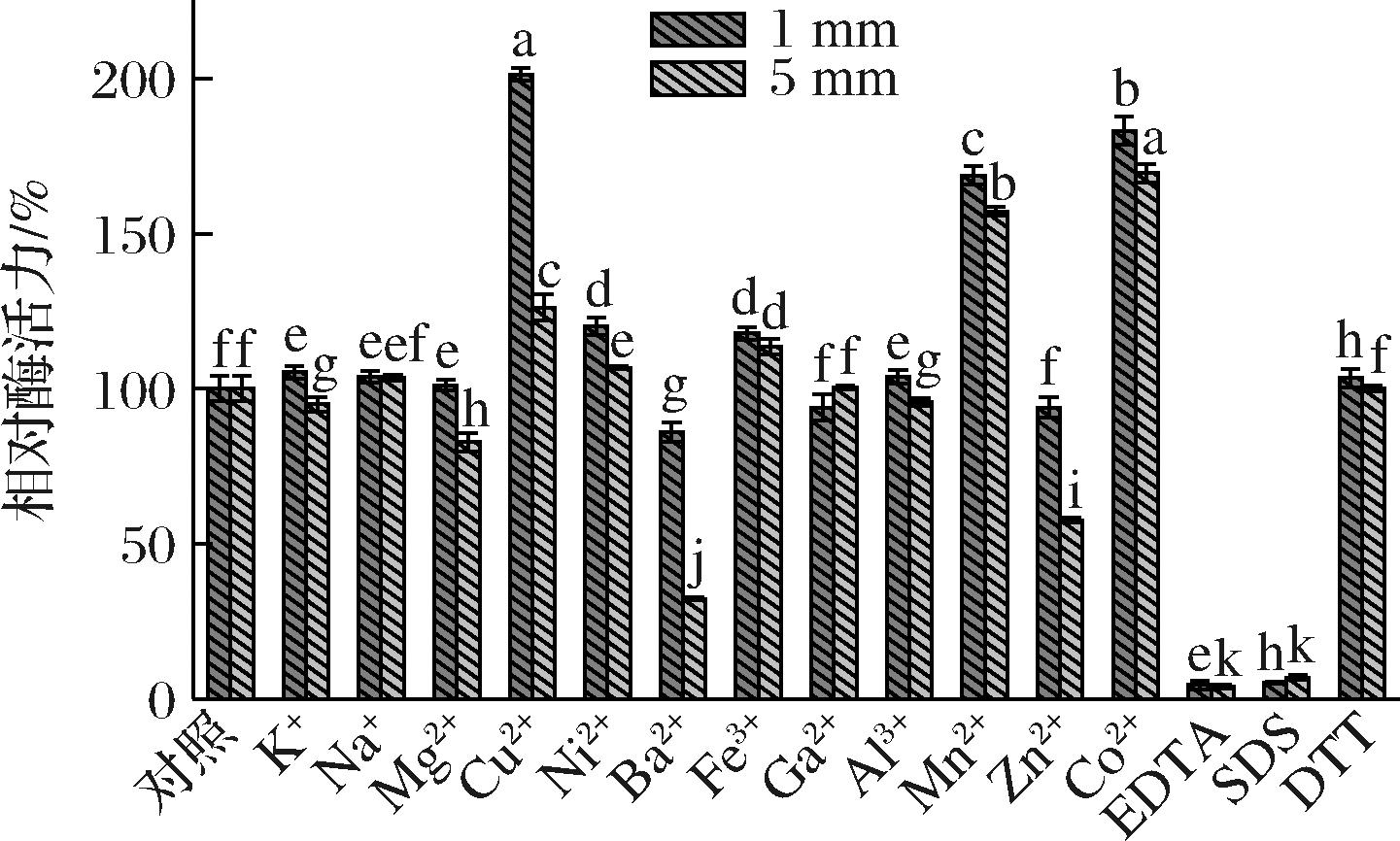
图7 金属离子及化合物对AlgL3199酶活力的影响
Fig.7 Effects of metal ions and compounds on the activity of AlgL3199 enzyme
注:不同小写字母表示不同组别的差异显著(P<0.05)(下同)。
2.4.4 NaCl浓度重组酶活力的影响
海洋来源的褐藻胶裂解酶大多是耐盐的,且一定浓度的盐对酶活力有促进作用,因此研究了不同浓度NaCl对AlgL3199酶活力的影响。如图8所示,NaCl终浓度在0~1.25 mol/L时,对AlgL3199有激活作用,在终浓度为1.125 mol/L时,NaCl的激活作用达到最大,相对酶活力为148.74%。NaCl (10 mmol/L~3 mol/L)对Aly08的活性均有增强作用,在300 mmol/L NaCl条件下活性达到最大值,比不加NaCl条件下的活性约高8倍[30];AlyC3在NaCl浓度为0.5 mol/L时活性最高且以二聚体形式存在,是0 mol/L时活性的2.9倍,文章中阐明盐度是通过影响酶的聚集状态调节AlyC3酶的活性[31];Aly1281在NaCl浓度为0~1.2 mol/L范围内活性显著增强,0.7 mol/L时可达550%以上,Aly1281在300 mmol/L NaCl条件下的均方根偏差(root mean square deviation,RMSD)值高于无NaCl条件下的RMSD值,这表明盐的加入增加了Aly1281的整体结构波动,使结构域构象稳定或柔性化[17]。因此,推断NaCl对于AlgL3199的激活作用很可能是改变了酶的构象或性质,增强了其对底物的亲和力。同时酶对NaCl的耐受作用使得它在工业上应用时省去脱盐步骤,更加便利。
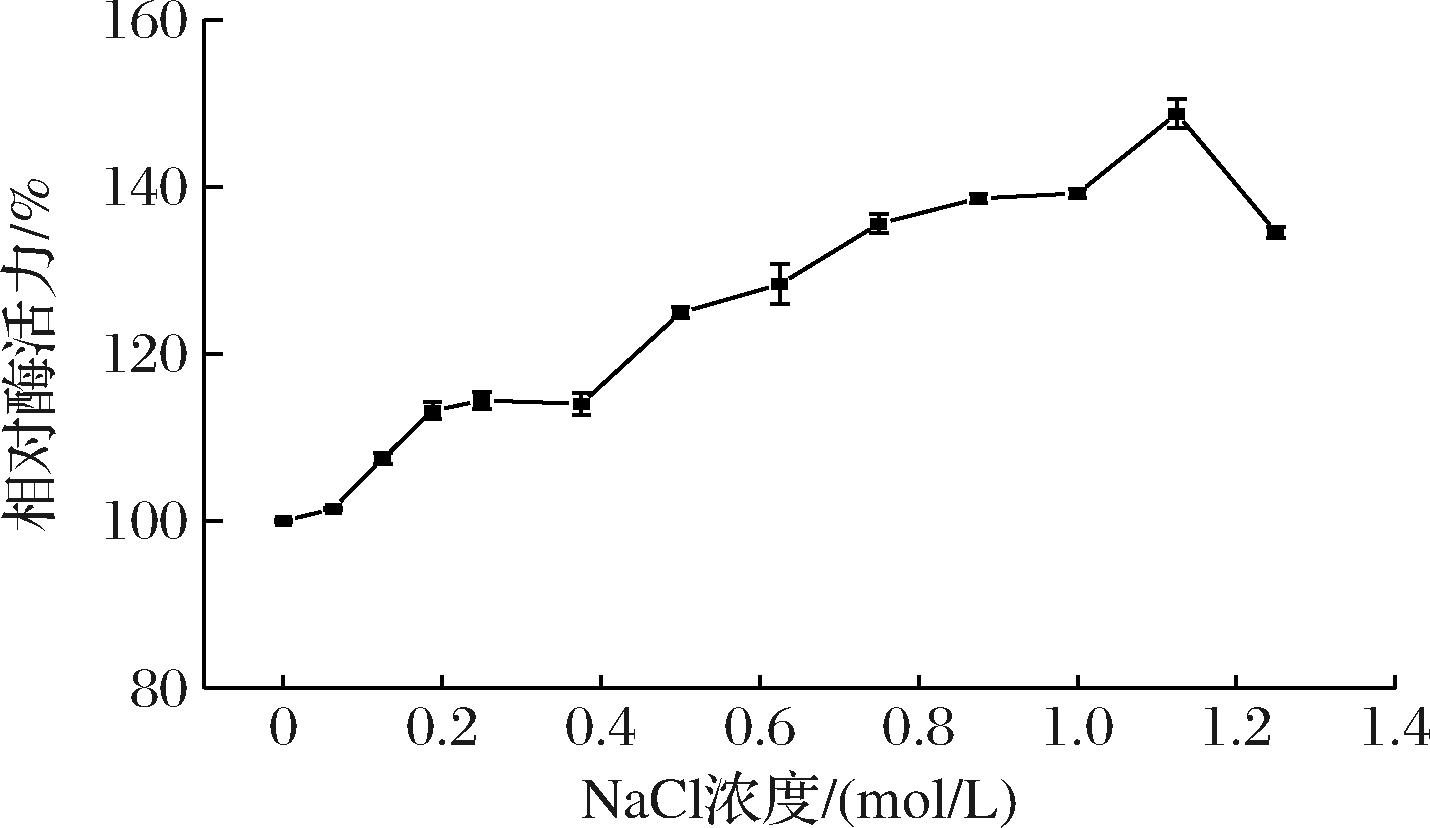
图8 NaCl浓度对AlgL3199酶活力的影响
Fig.8 Effect of NaCl concentration on the activity of AlgL3199 enzyme
2.4.5 重组酶AlgL3199的底物特异性及动力学参数
通过对底物特异性的研究发现,重组褐藻胶裂解酶AlgL3199对PolyM、PolyG、褐藻酸钠均有降解作用,如图9-a所示,AlgL3199对褐藻酸钠和PolyG的降解作用要高于对PolyM的降解,且更偏好PolyG,因此认为该酶是偏好于降解PolyG的双功能褐藻胶裂解酶。一些研究报道,负责降解PolyG和PolyM的酶分别含有QIH和QVH氨基酸残基的保守区域,表明氨基酸残基I可能特异性识别PolyG[32],在对重组酶AlgL3199进行序列分析时也发现其存在QIH保守区域,与其底物偏好性相符。目前只发现了少数具有PolyG偏好的褐藻胶裂解酶,如来自Vibrio sp.SY08的AlySY08[33]、来自Vibrio sp.QY105的AlyV5[34]、来自Vibrio sp.DS32的vralg1[11]等。具有PolyG偏好性的褐藻胶裂解酶可用于制备古罗糖醛酸寡糖(guluronate oligosaccharides,GAOS),GAOS具有抗氧化、抗病毒、抗炎活性等,据研究30 mg/kg GAOS在佐剂诱导的关节炎、实验性自身免疫性脑脊髓炎、肾病综合征和肾小球肾炎等多种试验模型中具有免疫抑制作用[35],还有研究发现古罗糖醛酸寡糖可以有效抑制烟草花叶病毒的活性[36],因此发掘更多具有PolyG偏好性的褐藻胶裂解酶对于制备GAOS有重要意义。
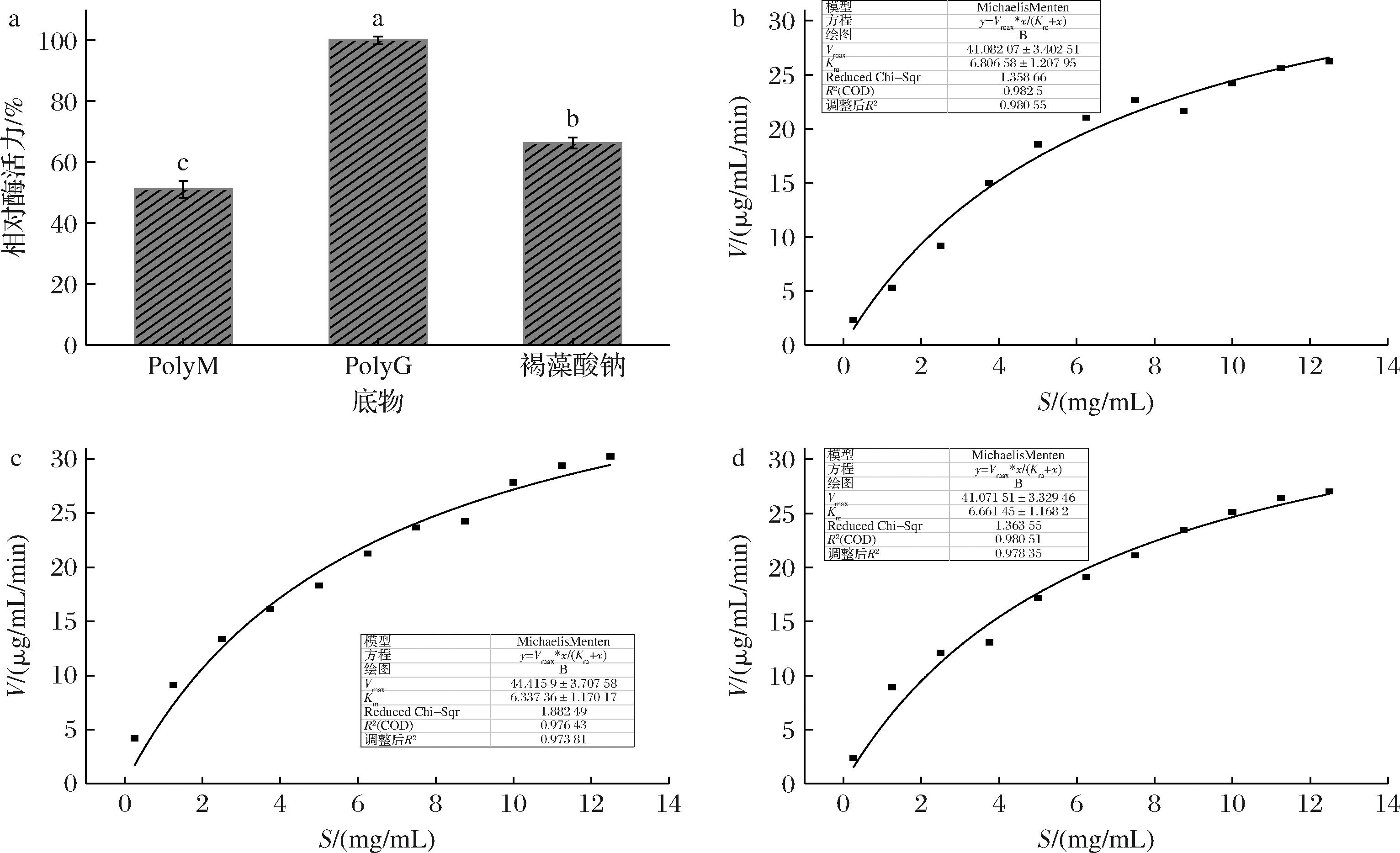
a-AlgL3199的底物特异性;b~d-AlgL3199降解PolyM、PolyG、褐藻酸钠的MichaelisMenten图
图9 AlgL3199的底物特异性分析及动力学参数
Fig.9 Substrate-specific analysis and kinetic parameters of AlgL3199
分别以不同浓度的PolyM、PolyG及褐藻酸钠为底物,测定重组酶AlgL3199的动力学参数,由表1结果可知,褐藻胶裂解酶AlgL3199降解PolyG的Km值小于其降解褐藻酸钠和PolyM的Km值,这说明AlgL3199对PolyG的亲和力更高,且以PolyG为底物的Vmax和kcat/Km大于另外2种底物,催化效率更高,综合底物特异性及动力学参数分析,PolyG更适合作为褐藻胶裂解酶AlgL3199的底物。
2.5 重组酶AlgL3199酶解产物分析
2.5.1 TLC结果分析
不同分子质量的褐藻寡糖具有不同的生物特性[37],为了探究寡糖产物的组成成分,将重组酶AlgL3199分别与褐藻酸钠底物溶液、PolyM、PolyG混合反应,间隔不同时间取样,采用TLC对酶解产物进行初步聚合度的鉴定,由图10-a可知,AlgL3199酶解褐藻酸钠在反应时间为1 min到5 h这段时间内,随着反应时间的延长,产物种类逐渐增加,由最初1 min时产物只有三糖和微量四糖到20 min时五糖六糖增加,且能看出随反应时间的加长,产物浓度逐渐增加,根据TLC板显色的深浅可知主产物为三糖,且1 h后产物并没有随酶解时间延长而发生改变,可能是酶与底物的结合达到饱和,产物降解完全。图10-b为AlgL3199酶解PolyM结果,在反应初始到反应5 h产物均没有随酶解时间延长而发生改变。图10-c显示,AlgL3199酶解PolyG与酶解褐藻酸钠相似,都是反应初期主产物是三糖,终产物是二糖到六糖,但随着反应时间的继续延长,五糖、六糖也可被继续降解,终产物大多稳定在二、三、四糖,且浓度逐渐升高。
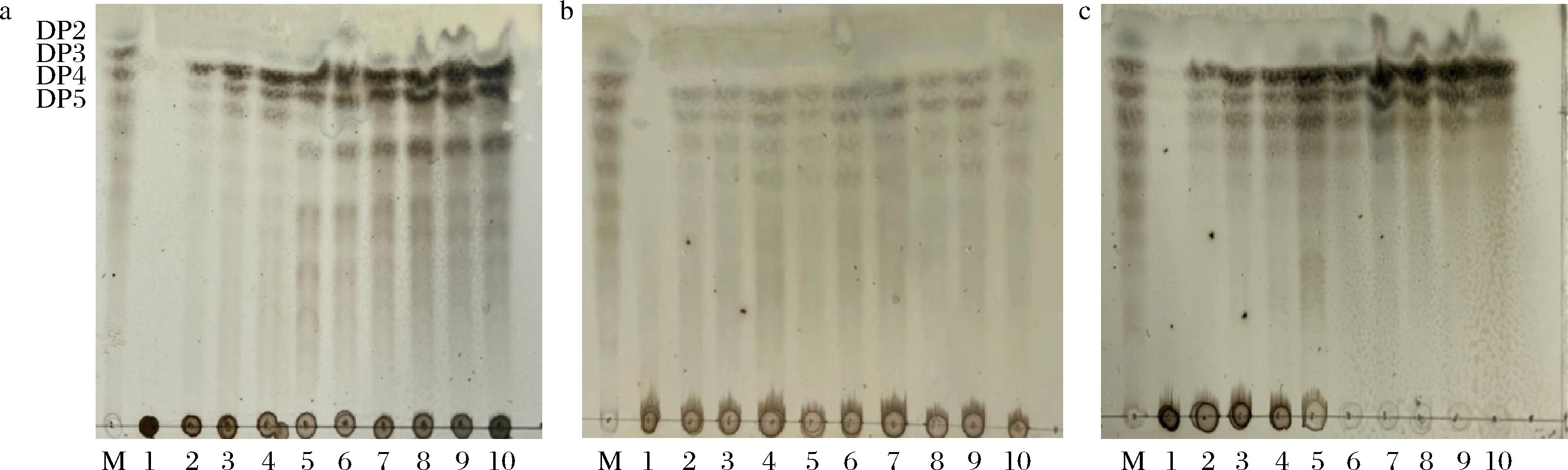
M-褐藻寡糖标品;1-未加酶的底物;2-反应1 min降解产物;3-反应5 min降解产物;4-反应10 min降解产物;5-反应20 min降解产物;6-反应30 min降解产物;7-反应1 h降解产物;8-反应2 h降解产物;9-反应3 h降解产物;10-反应5 h降解产物。
a-AlgL3199降解褐藻酸钠的TLC分析;b-AlgL3199降解PolyM的TLC分析;c-AlgL3199降解PolyG的TLC分析
图10 AlgL3199降解产物的TLC分析
Fig.10 TLC analysis of AlgL3199 degradation products
2.5.2 ESI-MS分析产物
AlgL3199酶解褐藻酸钠、PolyM、PolyG终产物的ESI -MS分析结果如图11所示,AlgL3199酶解褐藻酸钠和PolyG的主产物均为二糖(351.08 m/z)、三糖(527.09 m/z)、四糖(703.12 m/z)和少量的五糖(879.21 m/z)、六糖(1 055.23 m/z),AlgL3199酶解PolyM的终产物为单糖(175.01 m/z)、二糖(351.08 m/z)、三糖(527.09 m/z)、四糖(703.12 m/z)。结合AlgL3199酶解褐藻酸钠及PolyG的TLC及ESI-MS结果表明,AlgL3199对于褐藻酸钠和PolyG的作用方式为内切,产生的低聚合度寡糖更有利于其在食品、药品和生物材料等领域的应用,大多数PL-7家族的褐藻胶裂解酶均可通过内切方式产生聚合度为2~4的寡糖,如来源于Marinimicrobium sp.H1的AlgH[19]、来源于Thalassomonas sp.LD5的TsAly7B[38]等。
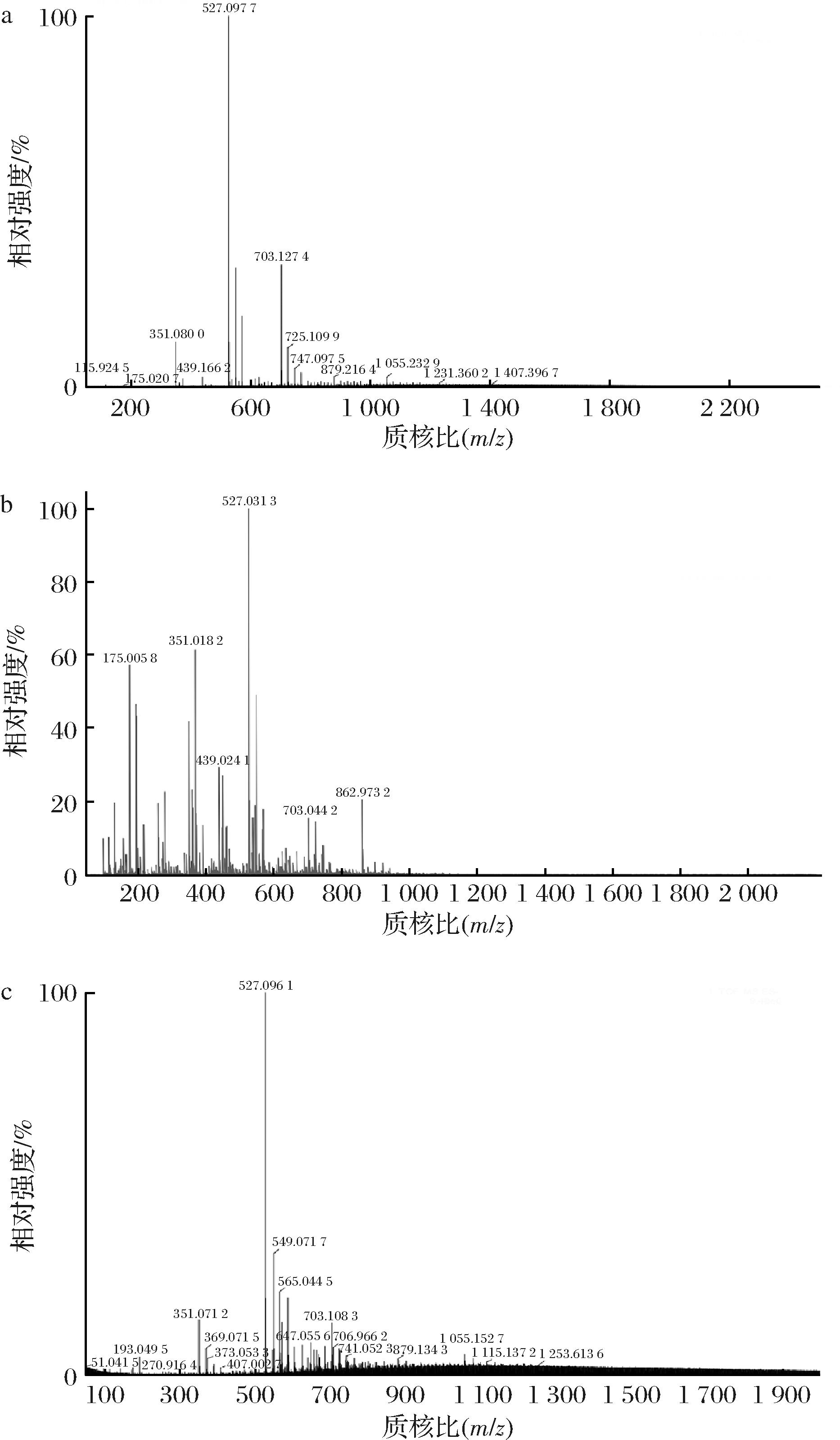
a-AlgL3199降解褐藻酸钠;b-AlgL3199降解PolyM;c-AlgL3199降解 PolyG
图11 AlgL3199降解不同底物终产物的质谱分析
Fig.11 Mass spectrometry analysis of the final degradation products of different substrate by AlgL3199
3 结论
褐藻胶裂解酶性质各异,发掘性质稳定的褐藻胶裂解酶更利于其进一步工业化生产与应用,本研究通过双酶切技术表达构建了一株产褐藻胶裂解酶基因AlgL3199,通过系统发育树及序列比对确认其为PL7家族的褐藻胶裂解酶。重组酶AlgL3199最适温度40 ℃,最适pH 10.0,在10~35 ℃温育1 h仍可保留80%以上的活性,在pH 8~10范围内孵育12 h可保留70%以上的酶活力,金属离子Cu2+、Mn2+、Co2+添加量为1 mmol/L时,对重组酶AlgL3199有明显促进作用,同时重组酶AlgL3199还具有一定的盐激活效应,在NaCl终浓度0~1.25 mol/L时均能提高酶活力,对其底物特异性及产物进行分析,发现重组酶AlgL3199是一种具有PolyG偏好性的双功能酶,对于PolyG和褐藻酸钠的降解能力要高于PolyM,3种底物的主要降解产物以三糖产率最高,后续可定向制备低分子质量的AOS、MAOS、GAOS,以满足褐藻寡糖在医疗、化妆品、农业等方面的广泛应用。
[1] PLAZA M, CIFUENTES A, IB
 EZ E.In the search of new functional food ingredients from algae[J].Trends in Food Science &Technology, 2008, 19(1):31-39.
EZ E.In the search of new functional food ingredients from algae[J].Trends in Food Science &Technology, 2008, 19(1):31-39.
[2] MOTUHI S E, MEHIRI M, PAYRI C E, et al.Marine natural products from new Caledonia:A review[J].Marine Drugs, 2016, 14(3):58.
[3] LI S Y, HE N N, WANG L N.Efficiently anti-obesity effects of unsaturated alginate oligosaccharides (UAOS) in high-fat diet (HFD)-fed mice[J].Marine Drugs, 2019, 17(9):540.
[4] LIU M, LIU L, ZHANG H F, et al.Alginate oligosaccharides preparation, biological activities and their application in livestock and poultry[J].Journal of Integrative Agriculture, 2021, 20(1):24-34.
[5] SONG L, GUO Y F, WANG Y L, et al.Preparation of alginate oligosaccharides from Laminaria japonica biomass by a novel biofunctional alginate lyase with pH and salt tolerance[J].Processes, 2023, 11(5):1495.
[6] 罗丹丹, 薛永常.褐藻胶裂解酶的研究进展[J].生物学杂志, 2016, 33(6):95-98.
LUO D D, XUE Y C.Advance in alginate lyases[J].Journal of Biology, 2016, 33(6):95-98.
[7] PENG C E, WANG Q B, LU D R, et al.A novel bifunctional endolytic alginate lyase with variable alginate-degrading modes and versatile monosaccharide-producing properties[J].Frontiers in Microbiology, 2018, 9:167.
[8] 刘芳, 舒志强, 王共明, 等.产褐藻胶裂解酶菌株S10的鉴定、全基因组测序及分析[J].食品科学, 2024, 45(22):2273-2284.
LIU F, SHU Z Q, WANG G M, et al.Identification, whole-genome sequencing and analysis of Vibrio alginolyticus S10, a strain producing alginate lyase[J].Food Science, 2024, 45(22):2273-2284.
[9] CHENG D Y, JIANG C C, XU J C, et al.Characteristics and applications of alginate lyases:A review[J].International Journal of Biological Macromolecules, 2020, 164:1304-1320.
[10] XU F, WANG P, ZHANG Y Z, et al.Diversity of three-dimensional structures and catalytic mechanisms of alginate lyases[J].Applied and Environmental Microbiology, 2018, 84(3):e02040-17.
[11] 李慧敏, 邵宗泽, 路瑶, 等.弧菌DS32褐藻胶裂解酶基因vralg1的异源表达和酶学性质研究[J].应用海洋学学报, 2024, 43(2):255-265.
LI H M, SHAO Z Z, LU Y, et al.Heterologous expression and enzymatic properties of the alginate lyase gene vralg1 from Vibrio sp.DS32[J].Journal of Applied Oceanography, 2024, 43(2):255-265.
[12] YANG M, YU Y, YANG S X, et al.Expression and characterization of a new PolyG-specific alginate lyase from marine bacterium Microbulbifer sp.Q7[J].Frontiers in Microbiology, 2018, 9:2894.
[13] MATSUSHIMA R, DANNO H, UCHIDA M, et al.Analysis of extracellular alginate lyase and its gene from a marine bacterial strain, Pseudoalteromonas atlantica AR06[J].Applied Microbiology and Biotechnology, 2010, 86(2):567-576.
[14] GAO S K, YIN R, WANG X C, et al.Structure characteristics, biochemical properties, and pharmaceutical applications of alginate lyases[J].Marine Drugs, 2021, 19(11):628.
[15] LU Y, ZHOU J L, GU Q Y, et al.Cloning, expression and improvement of catalytic activity of alginate lyase by site-directed mutation[J].Systems Microbiology and Biomanufacturing, 2022, 2(3):555-567.
[16] 黄小艺, 李鹤宾, 陈艳红, 等.N端非催化结构域对微泡菌ALW1褐藻胶裂解酶AlgL7酶学性质的影响[J].食品科学, 2023, 44(16):169-176.
HUANG X Y, LI H B, CHEN Y H, et al.Effects of N-terminal non-catalytic domains on enzymatic properties of the alginate lyase AlgL7 from Microbulbifer sp.ALW1[J].Food Science, 2023, 44(16):169-176.
[17] ZHANG Y H, SHAO Y, JIAO C, et al.Characterization and application of an alginate lyase, Aly1281 from marine bacterium Pseudoalteromonas carrageenovora ASY5[J].Marine Drugs, 2020, 18(2):95.
[18] YANG M, LI N N, YANG S X, et al.Study on expression and action mode of recombinant alginate lyases based on conserved domains reconstruction[J].Applied Microbiology and Biotechnology, 2019, 103(2):807-817.
[19] YAN J J, CHEN P, ZENG Y, et al.The characterization and modification of a novel bifunctional and robust alginate lyase derived from Marinimicrobium sp.H1[J].Marine Drugs, 2019, 17(10):545.
[20] CHAO Y X, WANG S Y, WU S Q, et al.Cloning and characterization of a new endo-type polyG-specific alginate lyase from bacteria Vibrio sp.QD-5[J].Acta Oceanologica Sinica, 2019, 38(6):65-74.
[21] TANG L Y, WANG Y, GAO S, et al.Biochemical characteristics and molecular mechanism of an exo-type alginate lyase VxAly7D and its use for the preparation of unsaturated monosaccharides[J].Biotechnology for Biofuels, 2020, 13:99.
[22] ZHU B W, NI F, SUN Y, et al.Elucidation of degrading pattern and substrate recognition of a novel bifunctional alginate lyase from Flammeovirga sp.NJ-04 and its use for preparation alginate oligosaccharides[J].Biotechnology for Biofuels, 2019, 12:13.
[23] HUANG G Y, WANG Q Z, LU M Q, et al.AlgM4:A new salt-activated alginate lyase of the PL7 family with endolytic activity[J].Marine Drugs, 2018, 16(4):120.
[24] HUANG G Y, WEN S H, LIAO S M, et al.Characterization of a bifunctional alginate lyase as a new member of the polysaccharide lyase family 17 from a marine strain BP-2[J].Biotechnology Letters, 2019, 41(10):1187-1200.
[25] MA Y, LI J, ZHANG X Y, et al.Characterization of a new intracellular alginate lyase with metal ions-tolerant and pH-stable properties[J].Marine Drugs, 2020, 18(8):416.
[26] 郑智, 张红秀, 刘伟治, 等.褐藻胶裂解酶AlyE2酶学性质研究[J].中国海洋大学学报(自然科学版), 2022, 52(12):44-50.
ZHENG Z, ZHANG H X, LIU W Z, et al.Enzymatic characterization of alginate lyase AlyE2[J].Periodical of Ocean University of China, 2022, 52(12):44-50.
[27] ZHANG F C, FU Z, TANG L Y, et al.Biochemical characterization of a novel exo-type PL7 alginate lyase VsAly7D from marine Vibrio sp.QY108[J].International Journal of Molecular Sciences, 2021, 22(16):8402.
[28] 常晴, 束月蓉, 王文韬, 等.来自Yeosuana marina sp.JLT21内切型海藻酸裂解酶的异源表达及酶学表征[J].生物技术通报, 2022, 38(2):123-131.
CHANG Q, SHU Y R, WANG W T, et al.Heterologous expression and characterization of endo-type alginate lyase from Yeosuana marina sp.JLT21[J].Biotechnology Bulletin, 2022, 38(2):123-131.
[29] BARZKAR N, SHENG R L, SOHAIL M, et al.Alginate lyases from marine bacteria:An enzyme ocean for sustainable future[J].Molecules, 2022, 27(11):3375.
[30] WANG Y N, CHEN X H, BI X L, et al.Characterization of an alkaline alginate lyase with pH-stable and thermo-tolerance property[J].Marine Drugs, 2019, 17(5):308.
[31] XU F, CHEN X L, SUN X H, et al.Structural and molecular basis for the substrate positioning mechanism of a new PL7 subfamily alginate lyase from the Arctic[J].Journal of Biological Chemistry, 2020, 295(48):16380-16392.
[32] SHU Z Q, WANG G M, LIU F, et al.Genome sequencing-based mining and characterization of a novel alginate lyase from Vibrio alginolyticus S10 for specific production of disaccharides[J].Marine Drugs, 2023, 21(11):564.
[33] LI S Y, WANG L N, HAO J H, et al.Purification and characterization of a new alginate lyase from marine bacterium Vibrio sp.SY08[J].Marine Drugs, 2016, 15(1):1.
[34] WANG Y, GUO E W, YU W G, et al.Purification and characterization of a new alginate lyase from a marine bacterium Vibrio sp[J].Biotechnology Letters, 2013, 35(5):703-708.
[35] XING M C, CAO Q, WANG Y, et al.Advances in research on the bioactivity of alginate oligosaccharides[J].Marine Drugs, 2020, 18(3):144.
[36] 王宇.聚甘露糖醛酸和聚古罗糖醛酸跨Caco-2细胞单层的转运机制[D].济南:山东大学,2020.
WANG Y.Transport mechanism of polymanuronic acid and polyguluronic acid across Caco-2 cell monolayers[D].Jinan:Shandong University,2020.
[37] 李玉芬. 褐藻胶寡糖的酶解制备及其应用研究[D].福州:福州大学, 2018.
LI Y F.Studies on the application of enzymatically prepared alge oligaosaaccharides[D].Fuzhou:Fuzhou University, 2018.
[38] ZHANG Z L, TANG L Y, BAO M M, et al.Functional characterization of carbohydrate-binding modules in a new alginate lyase, TsAly7B, from Thalassomonas sp.LD5[J].Marine Drugs, 2019, 18(1):25.