免疫调节是一种通过调控机体免疫系统活动来维持健康的生理功能,一般通过增强抵抗病原体的能力或抑制过度的免疫反应来减少对自身组织的损伤。临床上常使用匹多莫德片、环孢素软胶囊等,涵盖免疫抑制剂和免疫增强剂[1],尽管它们在治疗过程中有效,但往往伴有不同程度的不良副作用。近年来,海洋生物来源的免疫调节成分因其副作用小、安全性高、疗效显著,逐渐成为新型免疫调节剂研究关注的焦点。
牡蛎(Crassostrea spp.)属双瓣腮纲[2],是我国四大主要养殖贝类之一,其肉质鲜嫩且营养丰富,被誉为“海洋牛奶”。牡蛎具有多种保健功能作用,2002年被原中国卫生部列入首批药食两用食品名录,是开发功能性食品的理想原料[3]。据相关文献报道,从牡蛎肉中分离纯化得到的酶解产物具有预防化学性肝损伤、抗氧化、免疫调节、改善生殖功能、抗肿瘤等多种生物活性[4]。具有免疫活性的牡蛎酶解产物尤其引人关注,但由于牡蛎酶解产物成分复杂、功效成分含量较低且耗时较长,加大了筛选分离出有效生物活性肽的操作难度[5-6]。
姜玉等[7]通过虚拟酶解和分子对接从菲律宾蛤仔中筛选出了8种潜在的活性肽,其中DQTF和GYTR两条肽段表现出良好的抗炎活性;步营等[8]通过虚拟酶解和分子对接从虾夷扇贝中筛选出了具有抗2019新型冠状病毒能力的生物活性肽段,其中CSNAIPEL、LPIY和QRPR三条肽段均表现出较好的抗新型冠状病毒能力。分子对接技术能够通过计算机模拟预测肽段与靶标蛋白之间的相互作用,从而有效筛选出具有高结合亲和力的活性肽,不仅提高了筛选效率,还可分析肽段与蛋白结合的具体位点和作用机制。与传统的生物活性筛选方法相比,分子对接技术的成本较低且时间短,有助于加快活性肽的发现和筛选优化过程[9]。本研究旨在通过分子对接技术筛选牡蛎免疫活性肽,并通过体外实验验证其免疫调节作用及抗氧化活性。此研究可为开发基于天然免疫调节剂的牡蛎功能性食品提供理论依据。
1 材料与方法
1.1 材料与试剂
小鼠单核巨噬细胞系RAW264.7细胞,武汉普诺赛生命科技有限公司;本研究团队前期从牡蛎酶解产物中分离纯化获得了2条具有免疫作用的活性肽,氨基酸序列分别为Leu-Leu-Gln-Leu-Gly-Ser-Gly-Arg(LLQLGSGR,OP1)和Asp-Asn-Ser-Ile-Ala-Met-Glu-Ser-Met-Lys(DNSIAMESMK,OP2)[10],委托上海强耀生物科技有限公司合成,纯度分别为98.87%和96.13%。
RAW264.7专用培养基,武汉普诺赛生命科技有限公司;细胞增殖-毒性检测试剂盒(cell counting Kit-8,CCK-8),加拿大Biosharp公司;NO检测试剂盒、中性红细胞增殖及细胞毒性检测试剂盒,上海碧云天生物技术有限公司;IL-1β、TNF-α、ELISA试剂盒,上海酶联生物科技有限公司;DPPH自由基清除能力试剂盒、羟自由基测试试剂盒、抑制与产生超氧阴离子自由基测定试剂盒,南京建成生物工程研究所;脂多糖(lipopolysaccharide, LPS),北京索莱宝生物科技有限公司。
1.2 仪器与设备
HHT4-LX-C50L型立式压力蒸汽灭菌器,上海博讯实业有限公司;CKX41型倒置显微镜,日本Olympus公司;SW-CJ-2FD型超净工作台,苏州净化有限公司;Forma 370型CO2恒温箱、Varioskan Flash型全自动酶标仪,美国Thermo公司。
1.3 数据库与软件
RCSB PDB(https://www.rcsb.org/);Pymol 3.8;AutoDock Tools-1.5.6;Discovery Studio 2019;AutoDock Vina;Schrodinger 2019.01;ChemDraw 23.1.1;Chem3D。
1.4 实验方法
1.4.1 分子对接
1.4.1.1 肽段、受体蛋白的准备
使用ChemDraw构建肽段结构,并使用Chem3D软件对肽段进行能量最小化优化,保存为pdb格式,再导入AutoDock Tools-1.5.6进行加氢处理,检测扭转中心和扭转键,设置原子类型,保存为pdbqt文件。Toll样受体2(Toll-like receptor 2,TLR2,PDB ID:6 NIG)、Toll样受体4(Toll-like receptor 4,TLR4,PDB ID:2Z63)[11]的晶体结构从蛋白质数据库(https://www.rcsb.org/)中获取,使用Discovery Studio 2019与AutoDock Tools-1.5.6软件删除无关配体与水分子并进行加氢处理,设置原子类型并保存为pdbqt文件。
1.4.1.2 分子对接
使用Discovery Studio 2019对处理好的蛋白和肽段进行半柔性对接。将处理后的15条肽段作为小分子配体,2个蛋白靶点作为受体,通过AutoDock Vina进行分子对接,并使用Pymol 3.8软件对结果进行可视化。
1.4.2 OP1与OP2对RAW264.7细胞的免疫调节作用研究
1.4.2.1 RAW264.7细胞培养
RAW264.7细胞在专用培养基中,于37 ℃、5% CO2培养箱中孵育。细胞铺满培养瓶80%以上时进行传代,并选取对数生长期的细胞进行实验。
1.4.2.2 CCK-8法细胞增殖实验
将密度约为1×104个/mL的RAW264.7细胞悬液接种至96孔板,100 μL/孔。培养24 h后去除上清液,每孔分别加入100 μL不同质量浓度(50、100、200、400、800 μg/mL)的OP1,OP2,空白对照组加入细胞基本培养液,阳性对照组加入1 μg/mL的LPS,每个组设6个平行孔。培养24 h后弃上清液,按照CCK-8试剂盒说明,每孔加入10 μL CCK-8试剂培养箱孵育1 h后,用酶标仪于450 nm下检测吸光度值,按公式(1)计算细胞增殖率。
细胞增殖率![]()
(1)
式中:A1、B1、C1分别为样品组、空白组和空白对照组吸光度值,下同。
1.4.2.3 中性红吞噬实验
按1.4.2.2节的方法处理细胞,弃去上清液,根据中性红试剂盒说明,PBS润洗1次后,每孔加入10 μL中性红染色液。37 ℃恒温培养箱中继续培养2 h取出,PBS润洗2次后,每孔加入100 μL中性红检测裂解液,室温摇床上裂解10 min,用酶标仪于540 nm波长处测定吸光度值,按公式(2)计算吞噬指数。
吞噬指数![]()
(2)
1.4.2.4 OP1、OP2对RAW264.7细胞分泌NO的影响
按1.4.2.2节的方法处理细胞,收集RAW264.7细胞上清液,根据NO检测试剂盒说明书要求操作,测定各组分中NO的分泌量。
1.4.2.5 OP1、OP2对RAW264.7细胞IL-1β和TNF-α分泌量的影响
实验分组及细胞前期处理步骤与1.4.2.2节相同。各组分别加入药物培养24 h后,用无菌离心管收集培养上清液,3 000 r/min离心10 min去除颗粒和聚合物,再次收集上清液,并按试剂盒说明书要求操作,检测各组上清液中IL-1β和TNF-α细胞因子的含量。
1.4.3 OP1与OP2的体外抗氧化能力测定
DPPH自由基清除能力、抑制羟自由基能力、抑制氧自由基能力、总抗氧化能力均按照试剂盒说明书要求进行测定。
1.5 数据处理
应用Pymol 3.8软件对分子对接结果可视化。数据以“平均值±标准差”表示,采用SPSS 27.0、Excel 2019和GraphPad 8.0等软件对数据进行分析处理和图表的制作,P<0.05表示数据具有显著性差异,P<0.01表示数据具有极显著性差异,P<0.001表示数据具有极其显著性差异。
2 结果与分析
2.1 分子对接结果分析
TLR2和TLR4是免疫系统中的关键模式识别受体(pattern recognition receptors, PRRs),在识别病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)和内源性危险相关分子模式(danger-associated molecular patterns, DAMPs)中发挥重要作用[12]。这些受体在先天免疫和适应性免疫中,如树突状细胞、巨噬细胞、单核细胞、中性粒细胞及上皮细胞中均有广泛表达[13]。一般来说,如果配体与目标蛋白的结合能<-5.0 kcal/mol,则配体与受体蛋白的结合是稳定的[14]。分子对接结果如表1所示,可以看到,有14条肽段与TLR2蛋白结合能均<-5.0 kcal/mol,表明肽段与TLR2蛋白能形成稳定的复合物;此外,有9条肽段与TLR4蛋白结合能<-5.0 kcal/mol,其中OP1与TLR2、TLR4的结合能分别为-7.7 kcal/mol与-6.3 kcal/mol,说明其结合紧密且匹配度较高,因此选用这条多肽进行下一步分析验证。由于OP2与OP1均来源于同一物种,故也选用OP2进行实验对比。
表1 肽段的分子对接得分
Table 1 Molecular docking score of peptides
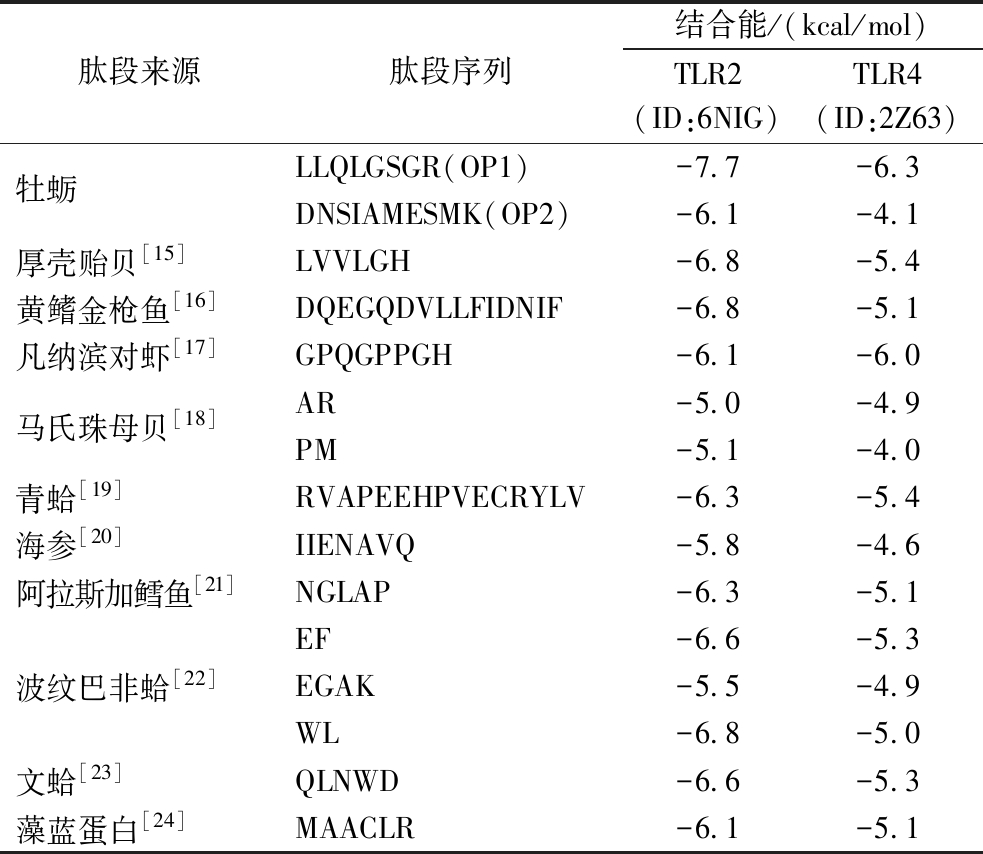
肽段来源肽段序列结合能/(kcal/mol)TLR2(ID:6NIG)TLR4(ID:2Z63)牡蛎LLQLGSGR(OP1)-7.7-6.3DNSIAMESMK(OP2)-6.1-4.1厚壳贻贝[15]LVVLGH-6.8-5.4黄鳍金枪鱼[16]DQEGQDVLLFIDNIF-6.8-5.1凡纳滨对虾[17]GPQGPPGH-6.1-6.0马氏珠母贝[18]AR-5.0-4.9PM-5.1-4.0青蛤[19]RVAPEEHPVECRYLV-6.3-5.4海参[20]IIENAVQ-5.8-4.6阿拉斯加鳕鱼[21]NGLAP-6.3-5.1波纹巴非蛤[22]EF-6.6-5.3EGAK-5.5-4.9WL-6.8-5.0文蛤[23]QLNWD-6.6-5.3藻蓝蛋白[24]MAACLR-6.1-5.1
2.2 OP1和OP2与TLR2、TLR4的分子对接作用构象分析
研究表明,氢键相互作用力(影响程度大于电荷相互作用和π-π键相互作用)对稳定多肽-受体复合物的晶体结构起着重要作用,对底物的抑制或活化方面也有着积极的促进效果[25]。免疫活性肽通过与TLR2和TLR4的活性位点形成氢键,与TLRs相互作用,触发一系列细胞信号转导通路,刺激巨噬细胞,激活机体免疫反应[26]。如图1、图2所示,通过Pymol软件分析多肽与受体蛋白之间相互作用位点可以发现,OP1与TLR2蛋白的氨基酸残基ASP-305、PHE-349、LEU-350之间形成了3个氢键,长度分别为2.5、2.3、2.2 Å,结合能为-7.7 kcal/mol;OP2与TLR2蛋白的氨基酸残基TYR-323、PHE-349、LEU-350之间形成了4个氢键,长度分别为2.1、2.9、2.3、2.1 Å,结合能为-6.1 kcal/mol。以上对接得分较好,表明OP1与OP2均能与TLR2蛋白良好结合,形成稳定的复合物。
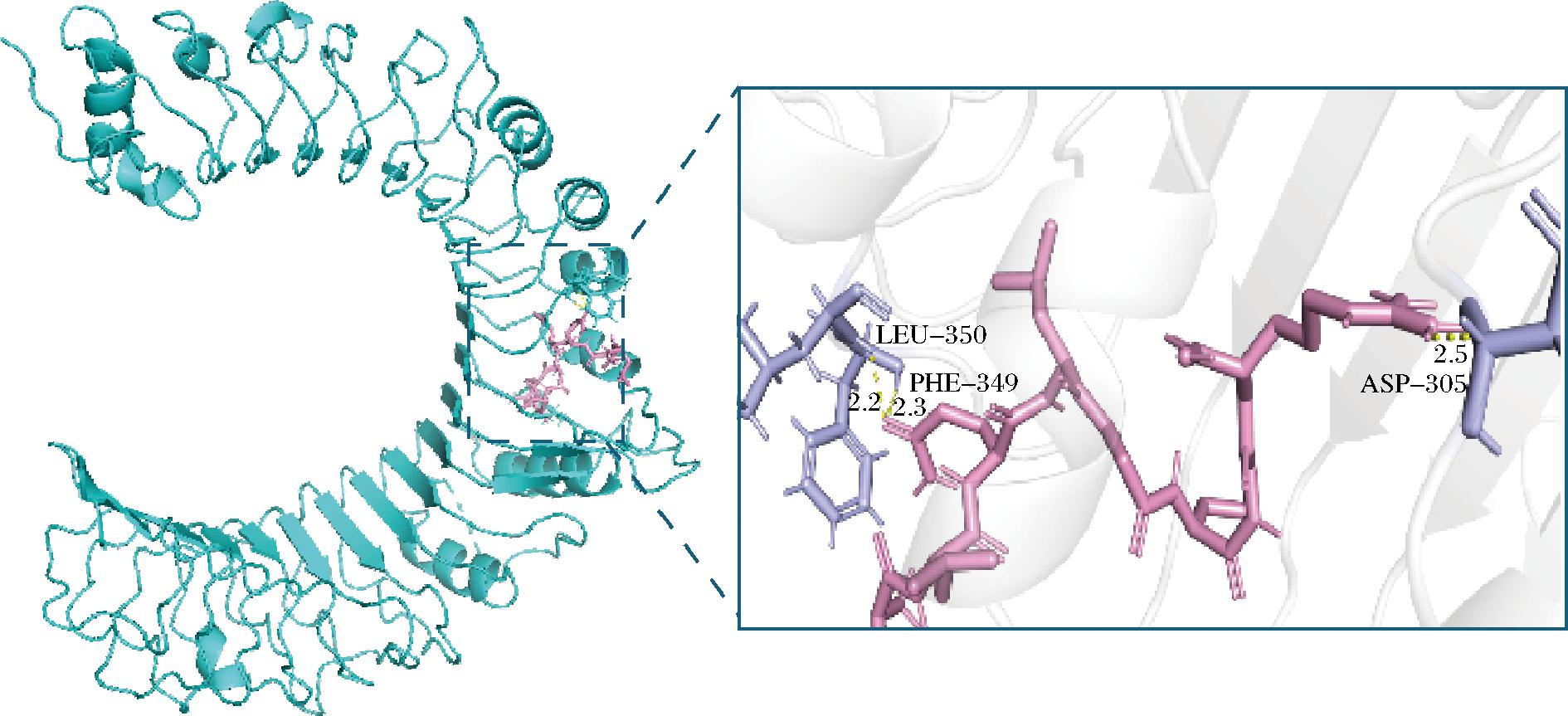
图1 OP1-TLR2的分子对接图
Fig.1 Molecular docking diagram of OP1-TLR2
注:图中黄色虚线表示氢键,紫色代表相关氨基酸残基,粉色代表多肽小分子配体(下同)。
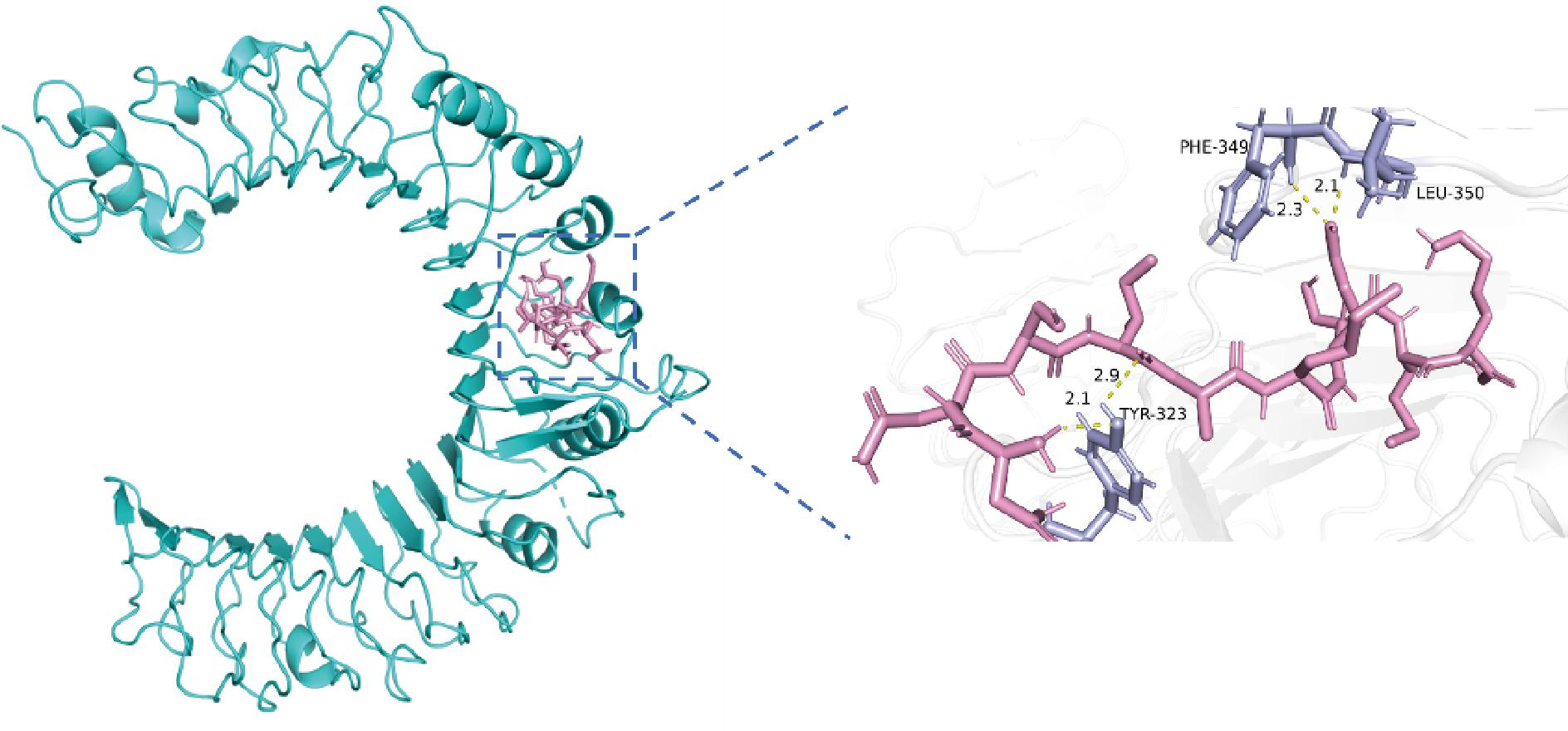
图2 OP2-TLR2的分子对接图
Fig.2 Molecular docking diagram of OP2-TLR2
如图3、图4所示,OP1与TLR4蛋白的氨基酸残基PHE-408、ASN-409、HIS-431、GLY-480、GLN-505、ASN-530、THR-553、GLN-531之间形成了11个氢键,长度分别为2.2、2.3、2.2、2.8、2.2、2.4、2.9、2.1、2.2、2.2、2.6 Å,氢键距离较短,结合能为-6.3 kcal/mol;OP2与TLR4蛋白的氨基酸残基ASN-365、HIS-431之间形成了4个氢键,长度分别为2.7、2.0、2.3、2.8 Å,结合能为-4.1 kcal/mol。
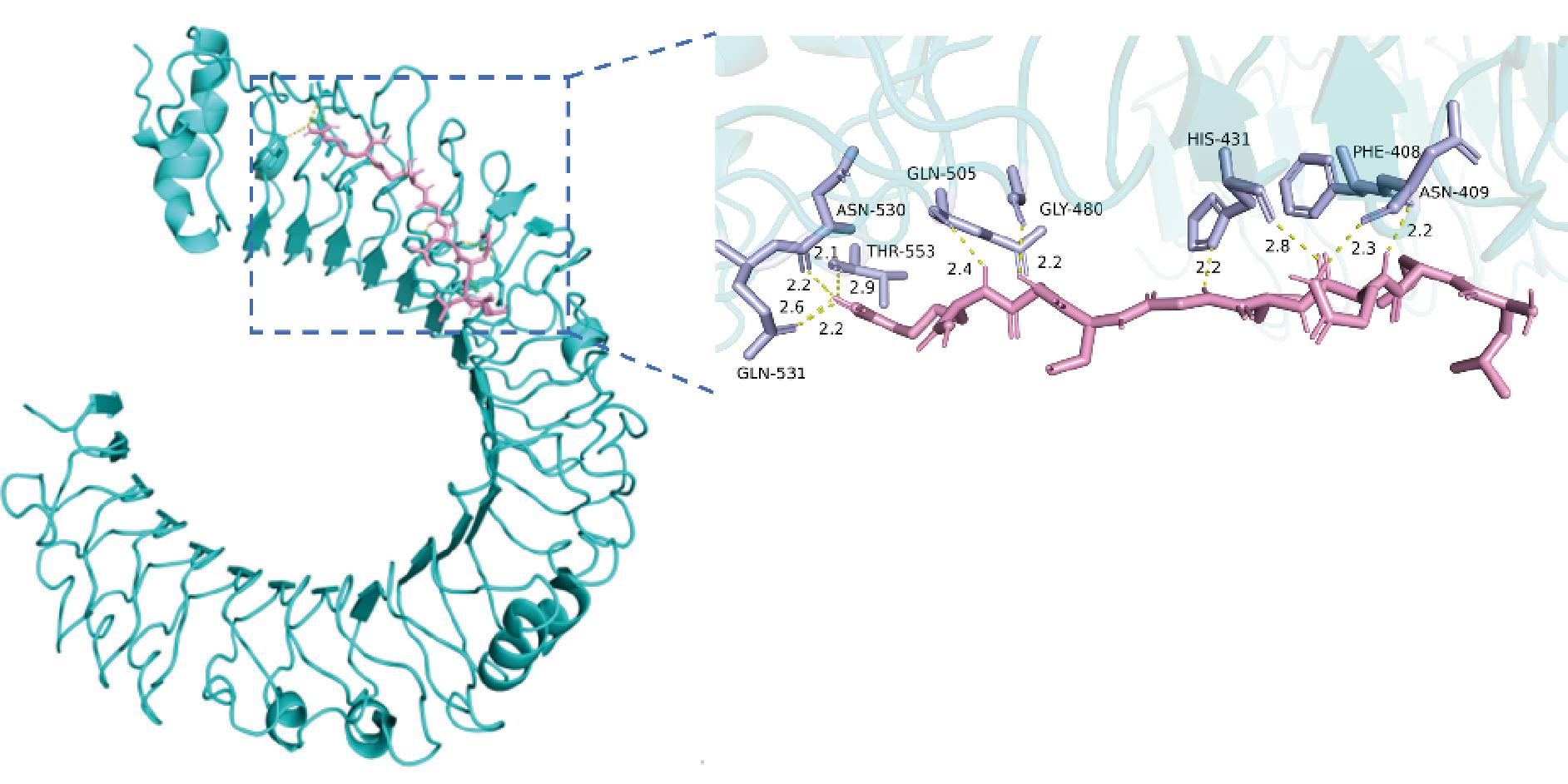
图3 OP1-TLR4的分子对接图
Fig.3 Molecular docking diagram of OP1-TLR4
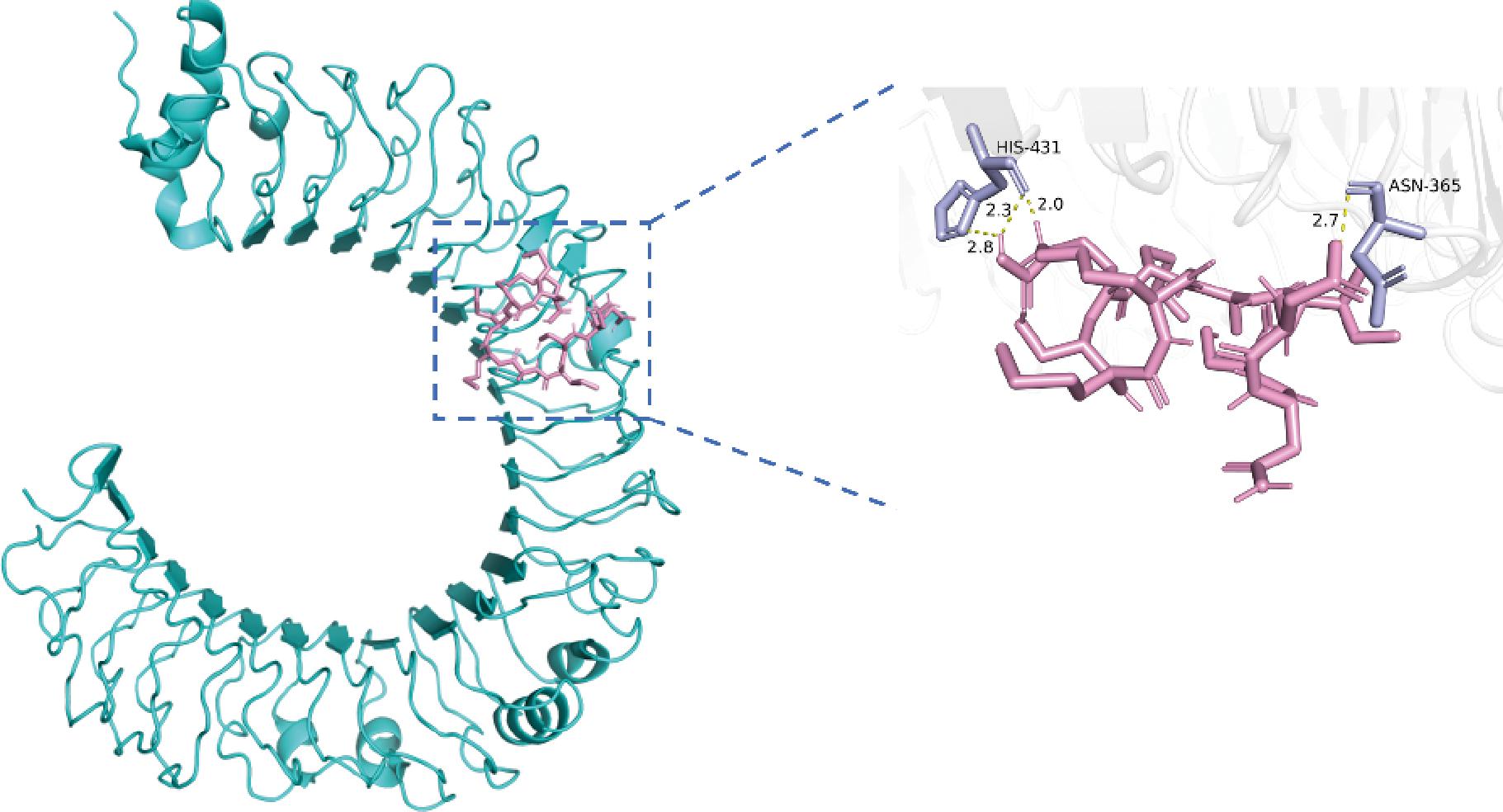
图4 OP2-TLR4的分子对接图
Fig.4 Molecular docking diagram of OP2-TLR4
2.3 OP1与OP2的体外免疫活性验证
2.3.1 OP1与OP2对RAW264.7细胞活力的影响
用不同浓度的OP1、OP2处理RAW264.7细胞,采用CCK-8法检测其对细胞活力的影响。如图5所示,不同浓度的OP1和OP2对RAW264.7细胞活力的影响存在差异。与空白对照组相比,OP1在质量浓度100、200 μg/mL下显著提高了RAW264.7细胞活力(P<0.05),而在质量浓度50 μg/mL下虽然未见显著性差异(P>0.05),但细胞活力与对照组相比无明显抑制作用,表明OP1在该浓度下对细胞无毒害作用。此外,OP2在质量浓度50、100、200 μg/mL下均显著提高了RAW264.7细胞活力(P<0.001,P<0.01),其中质量浓度50 μg/mL时细胞活力最高。随着OP1和OP2质量浓度的增加,细胞活力呈现下降趋势。当质量浓度升至400 μg/mL时,与空白对照组相比,OP1和OP2对RAW264.7细胞活力产生抑制作用。综上,OP1与OP2在50~200 μg/mL对RAW264.7细胞均无毒性,且能提高细胞活力。因此,选用此浓度范围的OP1与OP2进行后续实验。
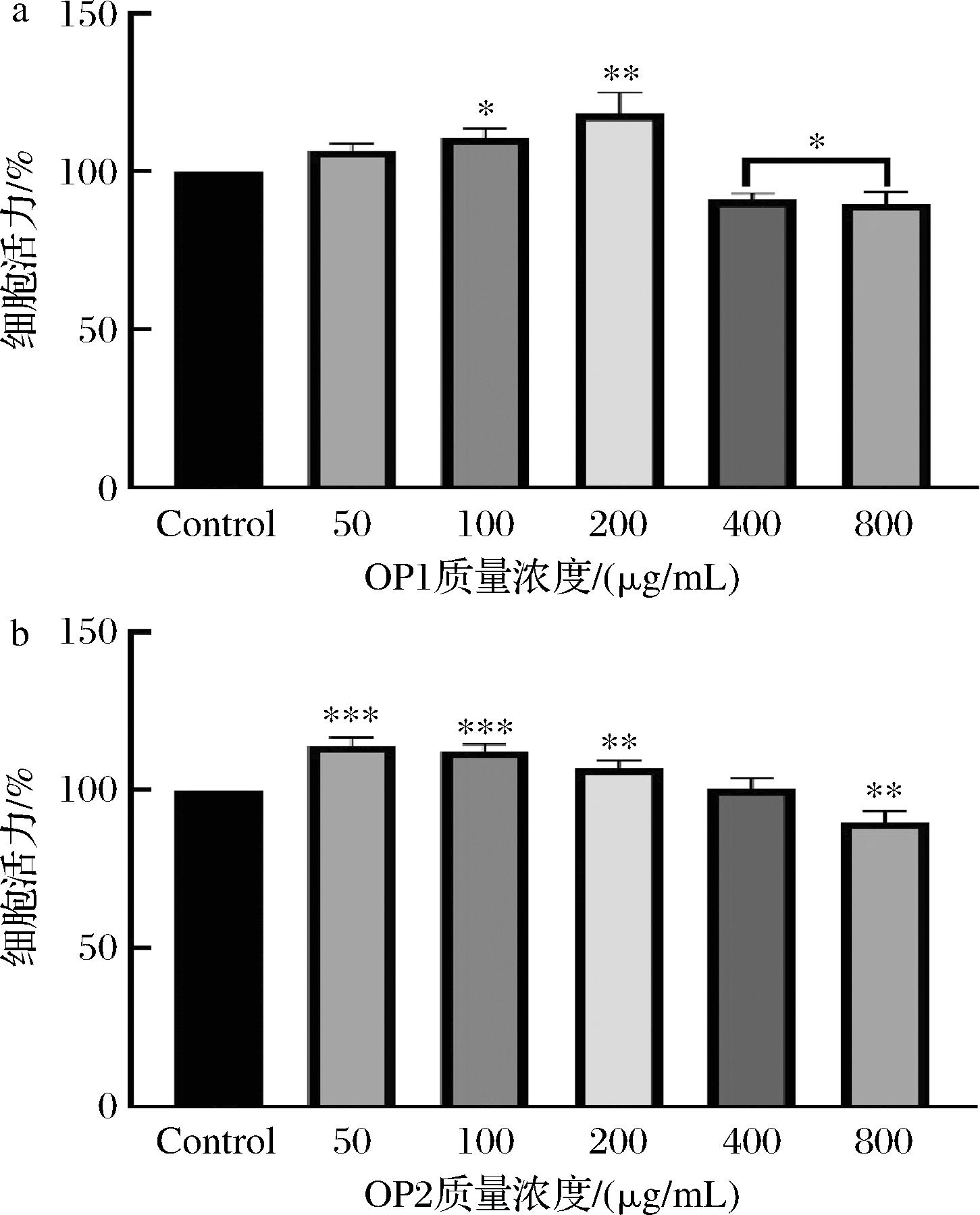
a-OP1;b-OP2
图5 OP1和OP2对RAW264.7细胞活力的影响
Fig.5 Effect of OP1 and OP2 on the viability of RAW264.7 cells
注:与空白对照组相比,*表示P<0.05,**表示P<0.01,***表示P<0.001(下同)。
2.3.2 OP1与OP2对RAW264.7细胞产NO的影响
通过NO检测试剂盒检测OP1与OP2对RAW264.7细胞产生NO含量的影响。如图6所示,与空白对照组相比,OP1对RAW264.7细胞NO分泌量的刺激作用呈剂量正相关性,与叶盛旺等[27]的研究具有相同的趋势。OP1质量浓度为50、100 μg/mL时,细胞NO的分泌量无明显增加,质量浓度为200 μg/mL时能显著增加细胞NO的分泌量(P<0.05),但弱于LPS组。OP2在50~200 μg/mL,细胞NO的分泌量均无明显增加。以上结果显示,OP1在较高质量浓度时(200 μg/mL)相较OP2对RAW264.7细胞的NO分泌更具有刺激作用,表明OP1可能具备更强的免疫调节潜力。
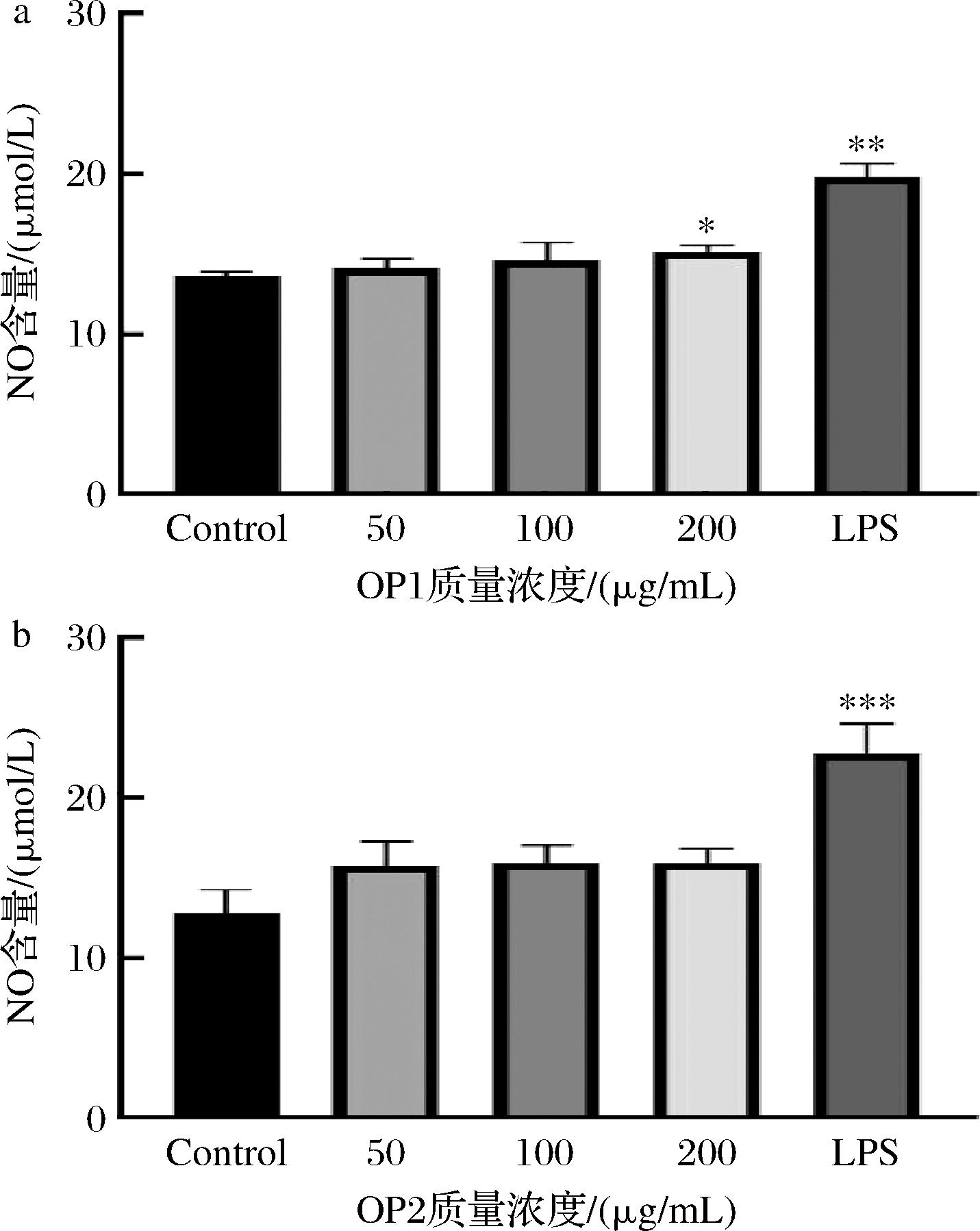
a-OP1;b-OP2
图6 OP1和OP2对RAW264.7细胞产NO的影响
Fig.6 Effect of OP1 and OP2 on NO productions by RAW264.7 cells
2.3.3 OP1和OP2对RAW264.7细胞吞噬功能的影响
巨噬细胞作为一类重要的免疫细胞,与机体非特异性免疫和特异性免疫都有密切联系。巨噬细胞一方面通过吞噬和杀伤作用以及介导炎症反应影响机体的非特异性免疫机制,另一方面在特异性免疫中发挥免疫调节功能和加工、呈递抗原的作用[28]。而吞噬作用作为巨噬细胞主要的非特异性免疫手段,能够在一定程度反映出机体的免疫状态。
采用中性红法检测各组RAW264.7细胞吞噬功能的变化。结果表明,当质量浓度为50、200 μg/mL时,OP1的吞噬指数略高于空白对照组,对增强RAW264.7细胞吞噬能力不明显(图7-a),OP1质量浓度为100 μg/mL时促进细胞吞噬能力效果显著(P<0.001),吞噬指数达到1.45±0.04。OP1在50 μg/mL时增强RAW264.7细胞的吞噬功能效果较弱,同时高质量浓度(200 μg/mL)的OP1可能引起细胞的应激反应或其他调节机制,抑制了吞噬功能的进一步增强。相比之下,100 μg/mL是OP1充分激活细胞吞噬功能的最适浓度。由图7-b可知,与空白对照组相比,当OP2质量浓度为50 μg/mL时能显著性增强RAW264.7细胞的吞噬能力(P<0.01),但随着质量浓度的增加,OP2对RAW264.7细胞吞噬能力的刺激作用逐渐降低。以上结果表明,OP1和OP2在不同浓度下对RAW264.7细胞吞噬功能的影响存在差异。在质量浓度50~200 μg/mL,OP1在100 μg/mL时效果最显著,而OP2在50 μg/mL时具有最佳促进作用,表明这2种化合物的免疫调节效果与其浓度密切相关。
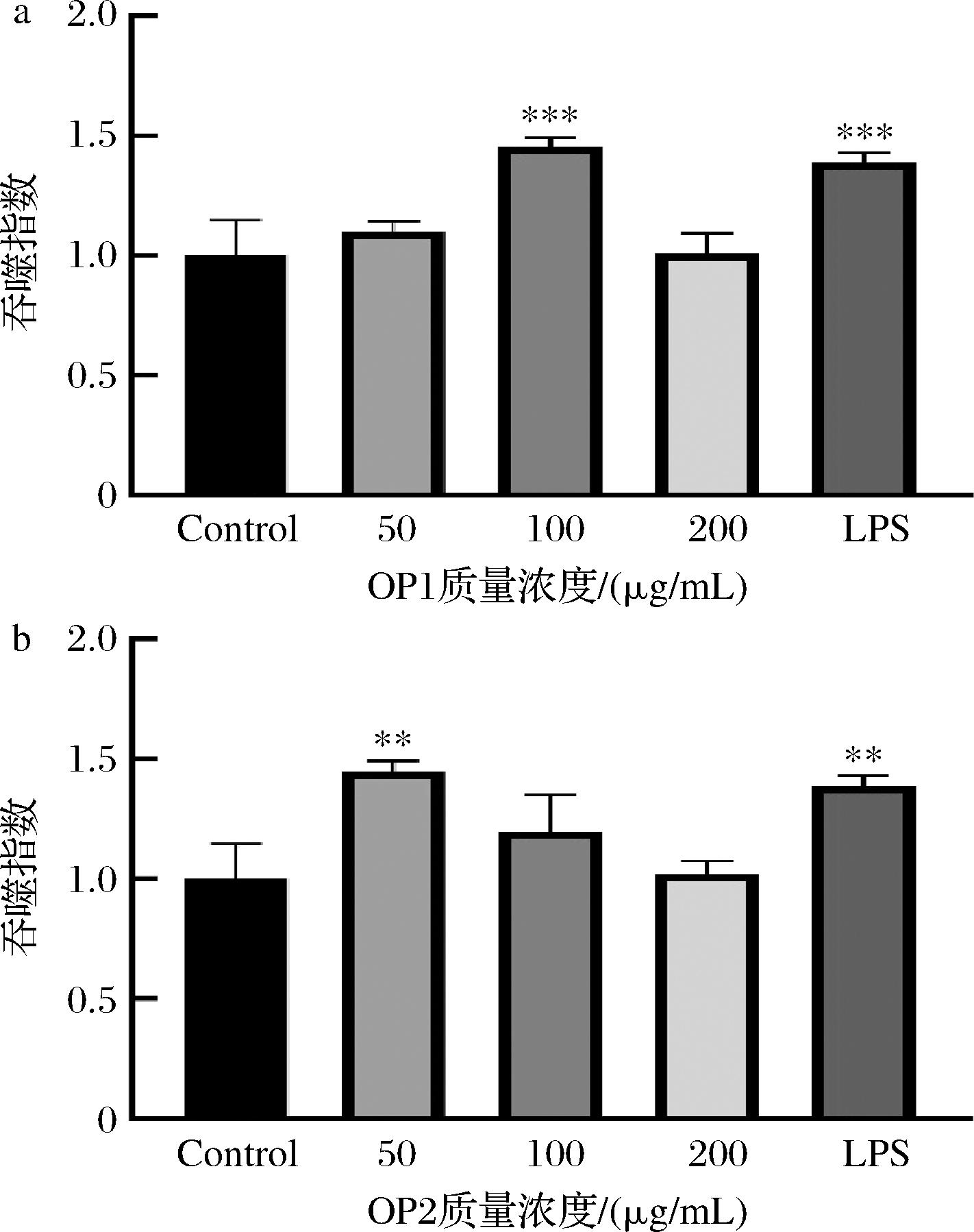
a-OP1;b-OP2
图7 OP1和OP2对RAW264.7细胞吞噬能力的影响
Fig.7 Effect of OP1 and OP2 on the phagocytosis of RAW264.7 cells
2.3.4 OP1和OP2对RAW264.7细胞IL-1β、TNF-α分泌量的影响
由图8可知,OP和OP2处理对RAW264.7细胞IL-1β分泌的影响因浓度不同而表现出差异。与空白对照组相比,IL-1β的分泌量随着OP1浓度的增加呈现下降趋势,在50 μg/mL和100 μg/mL时均能显著促进RAW264.7细胞IL-1β的分泌(P<0.01,P<0.05),但在200 μg/mL无显著性差异(P>0.05)。这种现象可能与细胞因子的负反馈调控机制有关,细胞在高浓度刺激下通过负反馈机制抑制进一步的IL-1β分泌,以避免过度的炎症反应。此外,与空白对照组相比,OP2在50 μg/mL时显著促进了IL-1β的分泌(P<0.05),但在100 μg/mL和200 μg/mL时,IL-1β的分泌量无显著性差异(P>0.05)。
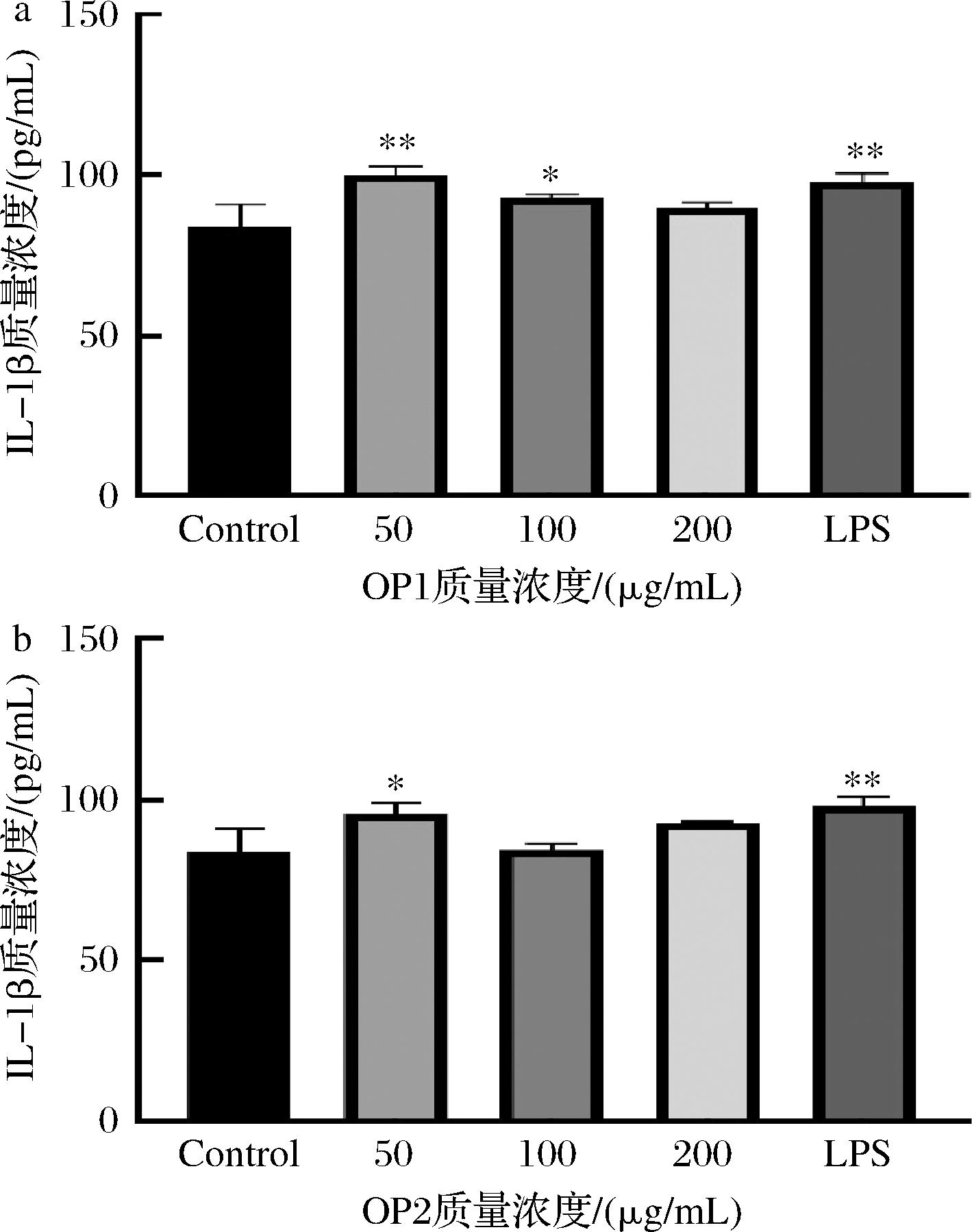
a-OP1;b-OP2
图8 OP1和OP2对RAW264.7细胞IL-1β分泌量的影响
Fig.8 Effect of OP1 and OP2 on the secretion of IL-1β in RAW264.7 cells
由图9可知,OP1和OP2作用于RAW264.7细胞24 h后,各剂量组较空白对照组均能显著性增加RAW264.7细胞培养上清液中细胞因子TNF-α的分泌量(P<0.01),且OP1对TNF-α的分泌量已高于LPS阳性对照组。以上结果表明,OP1和OP2均具有增强RAW264.7细胞分泌TNF-α的作用。
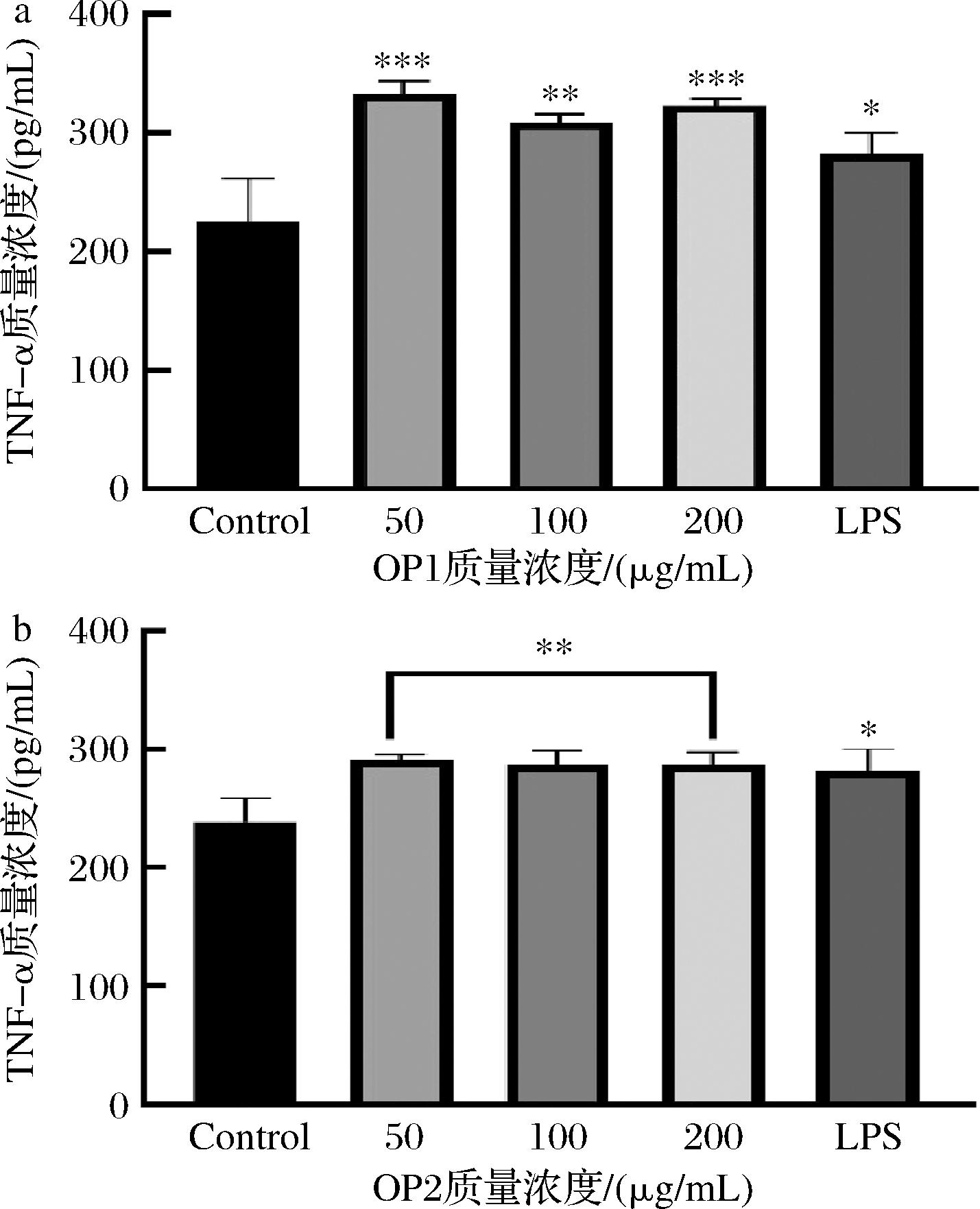
a-OP1;b-OP2
图9 OP1和OP2对RAW264.7细胞TNF-α分泌量的影响
Fig.9 Effect of OP1 and OP2 on the secretion of TNF-α in RAW264.7 cells
2.4 OP1与OP2的体外抗氧化活性验证
2.4.1 OP1与OP2对DPPH自由基的清除能力分析
DPPH是一种稳定的自由基,常用于评估抗氧化剂的自由基清除能力。抗氧化剂通过供给氢原子或电子将DPPH还原为稳定的分子,从而消除自由基的影响[29]。由图10可知,在一定浓度范围内,OP1与OP2的DPPH自由基清除能力具有浓度依赖趋势,这与DPPH清除实验的基本原理一致。当OP1、OP2质量浓度为200 μg/mL时,两者最高清除率分别为49.10%和56.32%,OP1的清除能力略低于OP2。
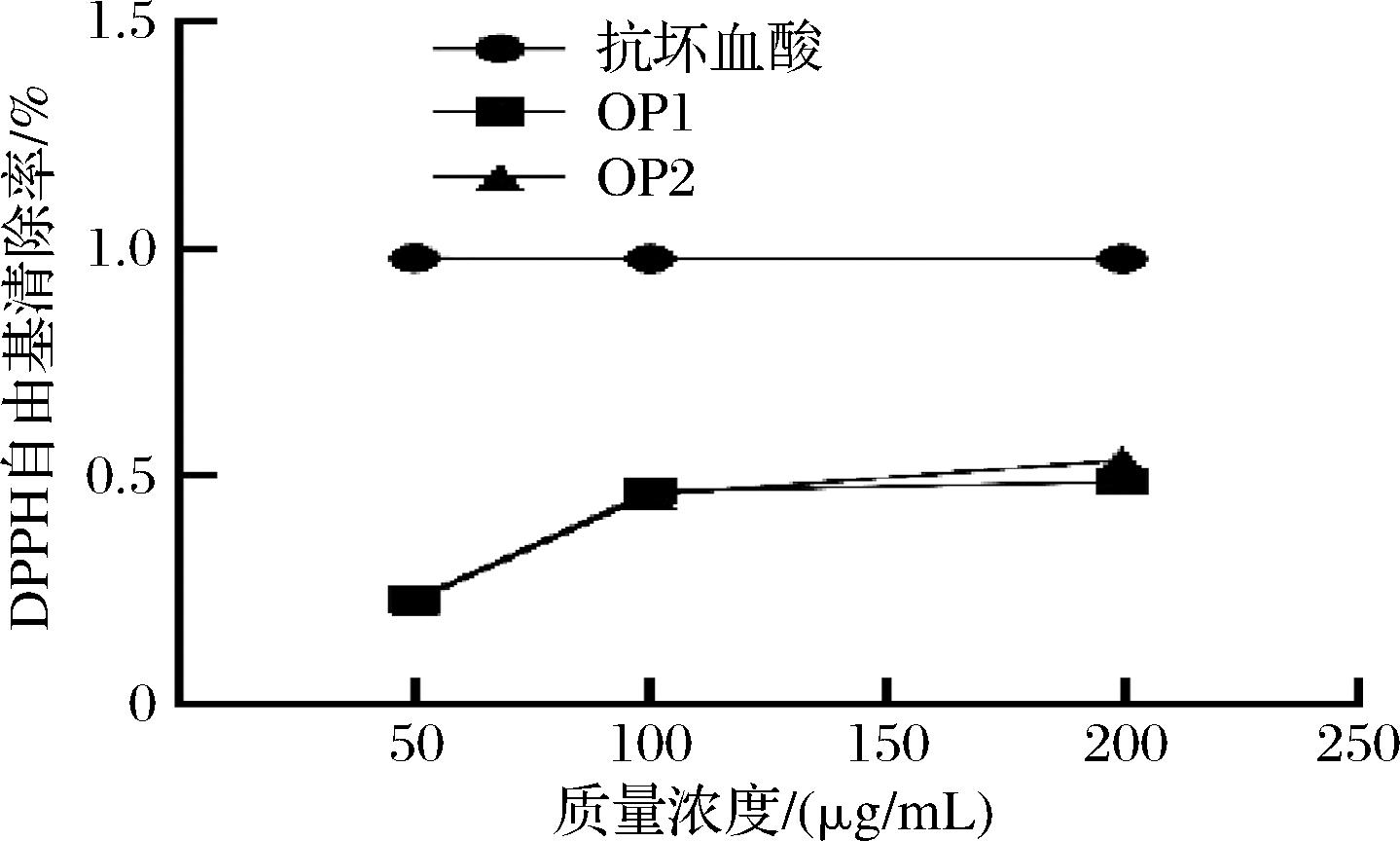
图10 OP1、OP2和抗坏血酸对DPPH自由基的清除能力
Fig.10 DPPH free radical scavenging capacity of OP1, OP2 and ascorbic acid
2.4.2 OP1与OP2对羟自由基的清除能力分析
羟自由基是活性氧(reactive oxygen species,ROS)的一种,极具反应性,能够攻击多种生物分子,包括DNA、蛋白质和脂质,从而导致细胞损伤甚至死亡[30],一般通过判断其清除能力以评估抗氧化物质的效果。由图11可知,在一定浓度范围内,OP1和OP2对羟自由基均表现出一定的清除效果,且清除率随着质量浓度的增加而逐渐升高。当溶液质量浓度为200 μg/mL时,两者对羟自由基的清除率达到最高,分别为37.82%和41.46%,这与羟自由基的高反应性及其对生物大分子造成氧化损伤的潜在危害有关。此外,与OP1相比,OP2对羟自由基的清除率更高,说明其抗氧化性更强。
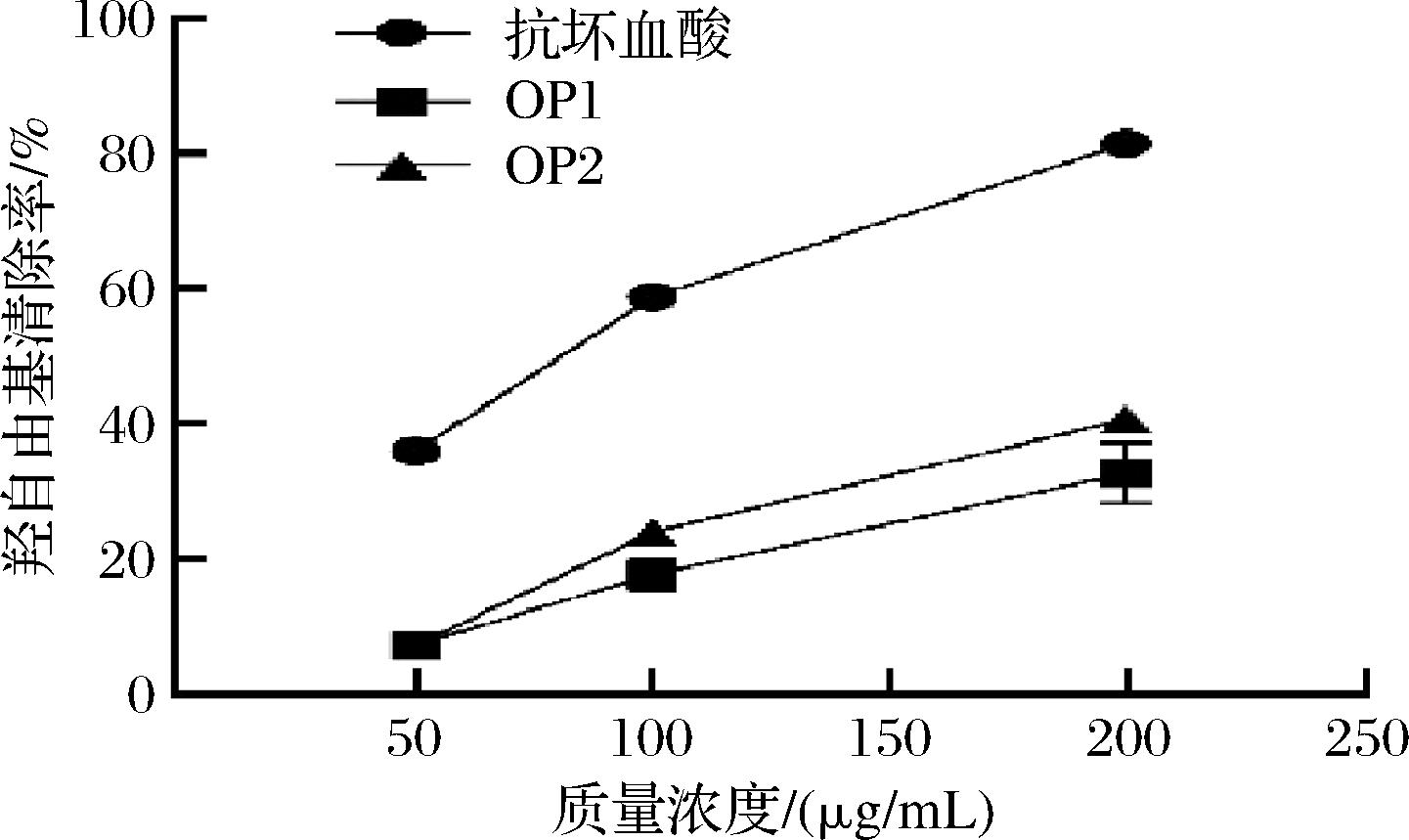
图11 OP1、OP2和抗坏血酸对羟自由基的清除能力
Fig.11 Hydroxyl radical scavenging capacity of OP1, OP2 and ascorbic acid
2.4.3 OP1与OP2对超氧阴离子自由基的清除能力分析
超氧阴离子是一种极具反应性的物质,能够参与氧化链反应,对细胞结构造成损伤。物质可以通过提供电子将其还原为O2或H2O2,从而终止氧化链反应以起到抗氧化剂的作用[29]。如图12所示,OP1对超氧阴离子的清除作用表现出明显的量效关系,即随着质量浓度的增加,清除能力逐渐增强。与OP1不同,OP2在100 μg/mL后,随着浓度的增加,清除能力反而开始下降。这可能是由于在高浓度下,OP2的结构或电子供体功能受到抑制,导致其抗氧化能力减弱[29]。这种反应与抗氧化剂的双重功能有关,某些抗氧化剂在较低浓度时表现为自由基清除剂,而在高浓度时可能转变为促氧化剂。尽管OP1与OP2的清除能力弱于抗坏血酸,但总体上两者均表现出一定的抗氧化潜力。
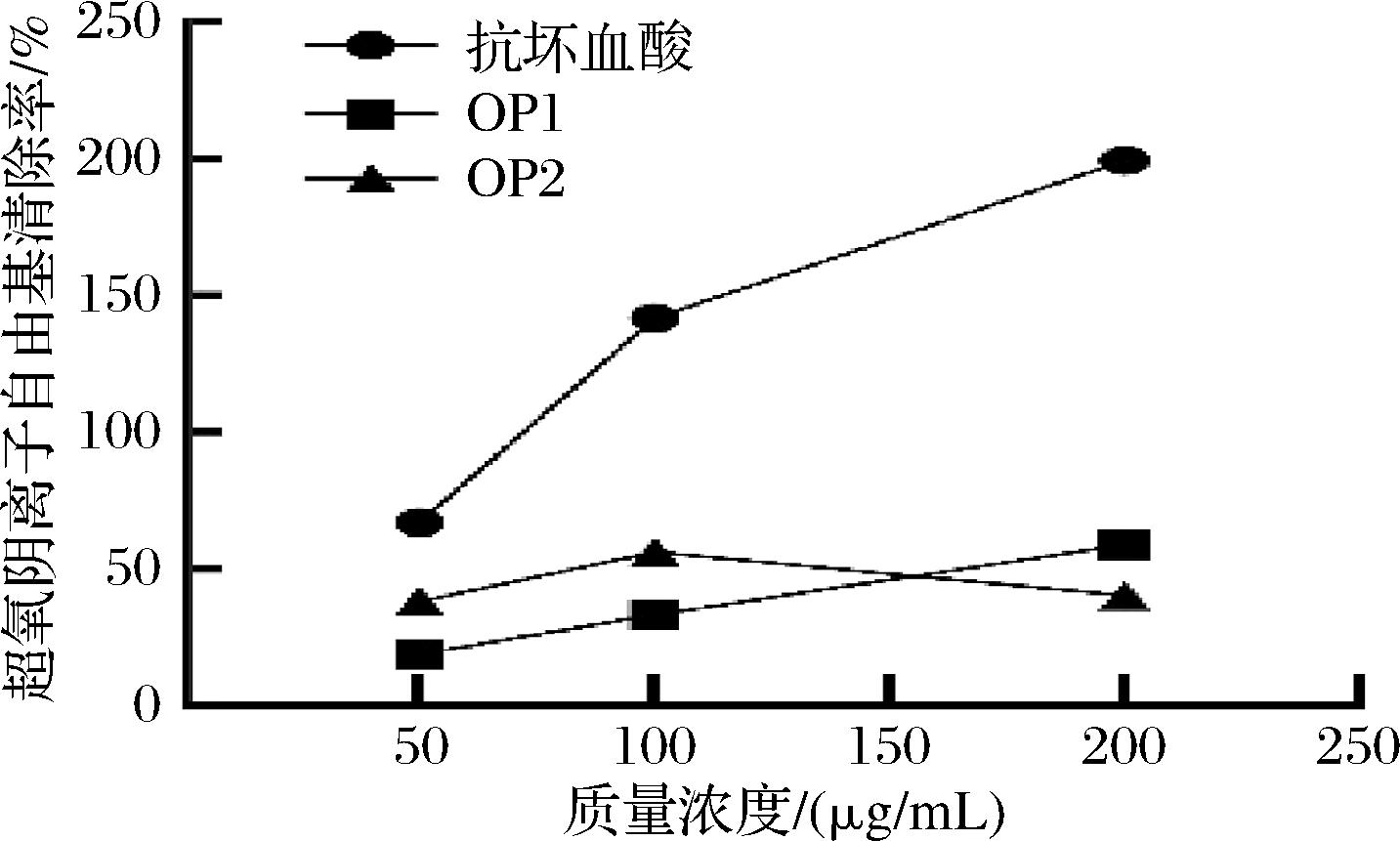
图12 OP1、OP2和抗坏血酸对超氧阴离子
自由基的清除能力
Fig.12 Scavenging capacity of OP1, OP2, and ascorbic acid to superoxide anion free radicals
3 结论
本研究通过分子对接技术筛选了牡蛎提取物中的免疫活性肽,并在体外实验中验证了其免疫调节和抗氧化作用。结果显示,OP1和OP2肽段与TLR2和TLR4的结合能较强,表现出良好的结合能力。在体外细胞实验中,OP1显著增加了RAW264.7细胞NO的产生量和TNF-α的分泌量,并促进了细胞的增殖和吞噬功能。相较之下,OP2主要在增强TNF-α的分泌以及促进细胞增殖方面表现出显著效果。此外,在抗氧化实验中,OP1和OP2均表现出较强的DPPH自由基、羟自由基和超氧阴离子自由基清除能力。本研究为牡蛎提取物中免疫活性肽的应用开发提供了数据支持,同时为牡蛎资源的深度开发和综合利用奠定了基础。
[1] STRZELEC M, DETKA J, MIESZCZAK P, et al.Immunomodulation-a general review of the current state-of-the-art and new therapeutic strategies for targeting the immune system[J].Frontiers in Immunology, 2023, 14:1127704.
[2] 方玲, 马海霞, 李来好, 等.华南地区近江牡蛎营养成分分析及评价[J].食品工业科技, 2018, 39(2):301-307; 313.
FANG L, MA H X, LI L H, et al.Analysis and evaluation of nutrient composition in Ostrea rivularis from South China Sea coast[J].Science and Technology of Food Industry, 2018, 39(2):301-307; 313.
[3] 方磊, 李国明, 徐姗姗, 等.牡蛎生物活性肽的研究进展[J].食品安全质量检测学报, 2018, 9(7):1548-1553.
FANG L, LI G M, XU S S, et al.Research progress of bioactive peptides from oyster[J].Journal of Food Safety &Quality, 2018, 9(7):1548-1553.
[4] 曾静, 方伟, 周天琼.牡蛎肽生物活性最新研究进展[J].药学实践与服务, 2023, 41(7):403-407.
ZENG J, FANG W, ZHOU T Q.Research advances in bioactivity of oyster peptides[J].Journal of Pharmaceutical Practice and Service, 2023, 41(7):403-407.
[5] LEE T G, MARUYAMA S.Isolation of HIV-1 protease-inhibiting peptides from thermolysin hydrolysate of oyster proteins[J].Biochemical and Biophysical Research Communications, 1998, 253(3):604-608.
[6] 李超柱, 陈艳华, 陈艳辉, 等.牡蛎活性肽的分离及其免疫抑制作用的实验研究[J].海洋科学, 2013, 37(4):52-56.
LI C Z, CHEN Y H, CHEN Y H, et al.Separation and immunosuppressive activity analysis of the bioactive peptides from oyster[J].Marine Sciences, 2013, 37(4):52-56.
[7] 姜玉, 林海生, 秦小明, 等.分子对接技术筛选菲律宾蛤仔抗炎肽[J].食品与发酵工业, 2023, 49(13):144-151.
JIANG Y, LIN H S, QIN X M, et al.Screening of anti-inflammatory peptides from Ruditapes philippinarum by molecular docking[J].Food and Fermentation Industries, 2023, 49(13):144-151.
[8] 步营, 何玮, 王飞, 等.基于分子对接技术从虾夷扇贝中筛选抗SARS-CoV-2活性肽研究[J].食品科学技术学报, 2020, 38(4):54-62.
BU Y, HE W, WANG F, et al.Screening research of anti-SARS-CoV-2 peptides from Mizuhopecten yessoensis based on molecular docking[J].Journal of Food Science and Technology, 2020, 38(4):54-62.
[9] TONOLO F, GRINZATO A, BINDOLI A, et al.From in silico to a cellular model:Molecular docking approach to evaluate antioxidant bioactive peptides[J].Antioxidants, 2023, 12(3):665.
[10] LI W, XU C, ZHANG C H, et al.The purification and identification of immunoregulatory peptides from oyster (Crassostrea hongkongensis) enzymatic hydrolysate[J].RSC Advances, 2019, 9(56):32854-32863.
[11] JI C F, ZHANG Z Y, CHEN J R, et al.Immune-enhancing effects of a novel glucan from purple sweet potato Ipomoea batatas (L.) lam on RAW264.7 macrophage cells via TLR2- and TLR4-mediated pathways[J].Journal of Agricultural and Food Chemistry, 2021, 69(32):9313-9325.
[12] LIU Y, YIN H, ZHAO M, et al.TLR2 and TLR4 in autoimmune diseases:A comprehensive review[J].Clinical Reviews in Allergy &Immunology, 2014, 47(2):136-147.
[13] KIM H J, KIM H, LEE J H, et al.Toll-like receptor 4 (TLR4):New insight immune and aging[J].Immunity &Ageing, 2023, 20(1):67.
[14] LIAO F, YOUSIF M, HUANG R Y, et al.Network pharmacology- and molecular docking-based analyses of the antihypertensive mechanism of Ilex kudingcha[J].Frontiers in Endocrinology, 2023, 14:1216086.
[15] 曾瑜. 厚壳贻贝活性肽的分离纯化、表征及其免疫调节作用的研究[D].舟山:浙江海洋大学, 2022.
ZENG Y.Separation, purification, characterization, and immunomodulatory effects of bioactive peptides from Mytilus coruscus[D].Zhoushan:Zhejiang Ocean University, 2022.
[16] 巫楚君. 黄鳍金枪鱼酶解肽的制备、鉴定及其对RAW264.7细胞免疫调节活性研究[D].广州:广东药科大学, 2021.
WU C J.Preparation, identification, and immunomodulatory activity on RAW264.7 cells of enzymatic hydrolysates from Thunnus albacares[D].Guangzhou:Guangdong Pharmaceutical University, 2021.
[17] 蒋蔚薇. 凡纳滨对虾虾头免疫活性肽的制备及其免疫作用研究[D].上海:上海海洋大学, 2023.
JIANG W W.Preparation and immunological effects of immunoactive peptides from the heads of Litopenaeus vannamei[D].Shanghai:Shanghai Ocean University, 2023.
[18] 邓志程, 张迪, 吉宏武, 等.马氏珠母贝免疫活性肽的纯化与鉴定[J].广东海洋大学学报, 2017, 37(4):78-86.
DENG Z C, ZHANG D, JI H W, et al.Purification and identification of immunomodulating peptides from enzymatic hydrolysates of Pinctada martensi[J].Journal of Guangdong Ocean University, 2017, 37(4):78-86.
[19] LI W, YE S W, ZHANG Z W, et al.Purification and characterization of a novel pentadecapeptide from protein hydrolysates of Cyclina sinensis and its immunomodulatory effects on RAW264.7 cells[J].Marine Drugs, 2019, 17(1):30.
[20] 杨军楠, 李学鹏, 王金厢,等.新型海参免疫活性肽IIENAVQ的免疫活性及免疫通路的研究[C].中国食品科学技术学会第二十届年会, 中国湖南长沙, 2023.
YANG J N, LI X P, WANG J X, et al.Study on the immunoactivity and immune pathways of the novel Holothuria immunoactive peptide IIENAVQ[C].20th Annual Meeting of the Chinese Institute of Food Science and Technology, Changsha, Hunan, China, 2023.
[21] HOU H, FAN Y, LI B F, et al.Preparation of immunomodulatory hydrolysates from Alaska pollock frame[J].Journal of the Science of Food and Agriculture, 2012, 92(15):3029-3038.
[22] HE X Q, CAO W H, PAN G K, et al.Enzymatic hydrolysis optimization of Paphia undulata and lymphocyte proliferation activity of the isolated peptide fractions[J].Journal of the Science of Food and Agriculture, 2015, 95(7):1544-1553.
[23] CARRASCO-CASTILLA J, HERN NDEZ-
NDEZ- LVAREZ A J, JIMÉNEZ-MART
LVAREZ A J, JIMÉNEZ-MART NEZ C, et al.Use of proteomics and peptidomics methods in food bioactive peptide science and engineering[J].Food Engineering Reviews, 2012, 4(4):224-243.
NEZ C, et al.Use of proteomics and peptidomics methods in food bioactive peptide science and engineering[J].Food Engineering Reviews, 2012, 4(4):224-243.
[24] 张廷新. 藻蓝蛋白免疫肽的酶解制备、结构鉴定及功效评价[D].济南:齐鲁工业大学, 2023.
ZHANG T X.Enzymatic preparation, structural identification, and efficacy evaluation of immune peptides from phycocyanin[D].Jinan:Qilu University of Technology, 2023.
[25] CAPORALE A, ADORINNI S, LAMBA D, et al.Peptide-protein interactions:From drug design to supramolecular biomaterials[J].Molecules, 2021, 26(5):1219.
[26] PATRA R, DAS N C, MUKHERJEE S.Toll-like Receptors (TLRs) as Therapeutic Targets for Treating SARS-CoV-2:An Immunobiological Perspective[M].Coronavirus Therapeutics—Volume I.Cham:Springer International Publishing, 2021:87-109.
[27] 叶盛旺, 杨最素, 李维, 等.青蛤酶解多肽对RAW264.7巨噬细胞的免疫调节作用[J].食品科学, 2019, 40(7):185-191.
YE S W, YANG Z S, LI W, et al.Immunomodulatory effects of peptides from enzymatic hydrolysate of Cyclina sinensis on RAW264.7 macrophages[J].Food Science, 2019, 40(7):185-191.
[28] 周滨, 张桂梅, 冯作化.体内IFN-γ基因转染小鼠腹腔巨噬细胞抗肿瘤作用的研究[J].中国免疫学杂志, 1998(1):24-28.
ZHOU B, ZHANG G M, FENG Z H, et al.Study on the antitumor effects of peritoneal macrophages from mice transfected with the IFN-γ gene in vivo[J].Chinese Journal of Immunology, 1998(1):24-28.
[29] CHAKNIRAMOL S, WIERSCHEM A, CHO M G, et al.Physiological and clinical aspects of bioactive peptides from marine animals[J].Antioxidants, 2022, 11(5):1021.
[30] HUANG P T, MIAO J Y, LI J L, et al.Novel antioxidant peptides from pearl shell meat hydrolysate and their antioxidant activity mechanism[J].Molecules, 2023, 28(2):864.