杏仁是我国传统药食两用资源,含有50%左右脂肪、25%蛋白质与多种维生素,具有丰富的营养价值和药用作用[1]。杏仁蛋白富含人体必需的8种氨基酸[2],是重要的食用蛋白资源。研究表明,杏仁蛋白具有调节肠道菌群[3]、增强免疫、降糖降脂[4]、防癌抗癌等生理活性功能。杏仁粕是杏仁提取杏仁油后的副产物,饼粕中蛋白质含量高达64.8%[5],目前大多杏仁粕被用作制备肥料与动物饲料,造成了较大的资源浪费。因此,提取杏仁粕中蛋白质是高效利用杏仁粕、解决当前植物蛋白资源短缺问题[6]的重要途径之一。
当前,杏仁等植物蛋白常见的提取方式主要包括碱溶酸沉法、盐析法、酶提取法、醇沉法等,不同提取方法会对植物蛋白的结构和功能特性造成不同的影响[7]。碱溶酸沉法是工业中应用最广泛的蛋白质提取方法,此方法成本低廉、易于操作,可实现蛋白质的重复提取,但存在蛋白质提取率低、提取时间长、蛋白质易在酸碱环境中变性、降解等问题。解春艳等[8]利用碱溶酸沉提取的杏仁蛋白具有较好的持水性和持油性,含量为43.79 mg/g。糟龙[5]对比了不同碱性pH下制备的蛋白,发现不同碱提条件对杏仁蛋白结构影响显著。盐析法是将蛋白质溶于水中,通过添加盐离子使提取液达到一定的饱和浓度,蛋白质的溶解度被改变进而析出,具有条件温和、操作简单、提取时间短的优点,但提取的蛋白质含盐较多,需要进一步的纯化。刘凯等[9]通过盐法制备杏仁蛋白,提取率可达72%。酶解法通过精准控制酶解条件利用特定酶进行水解提取蛋白质,具有从油料作物中高效提取蛋白[10]、选择性强且能够保留生物活性的优点,适用于分离提取特定功能蛋白。醇沉法通过加入醇类有机溶剂(如乙醇或丙醇)除去杂质并使蛋白质沉淀,步骤直观且易于控制,能够有效地从复杂样品中分离并浓缩蛋白[11],已成功运用于玉米蛋白制备及脱色[12]与快速沉淀牛奶中的蛋白[13]。
本研究结合杏仁蛋白的特性,以碱溶酸沉法、盐析法、酶提取法及醇沉法4种方法提取蛋白,对比分析不同方法提取的杏仁蛋白在结构和功能性质等方面的区别,以期为杏仁蛋白加工及新产品的研发,拓宽其在食品行业的应用提供理论参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
杏仁购于新疆乌鲁木齐市沙依巴克区华凌干果市场;菜籽油购于中粮集团有限公司。
碱性蛋白酶(200 U/mg)、考马斯亮蓝G250,上海源叶生物科技有限公司;SDS-PAGE凝胶制备试剂盒、Tris,北京市索莱宝科技有限公司;蛋白含量测定试剂盒,苏州梦犀生物医药科技有限公司;其他试剂均为分析纯,天津鑫铂特化工有限公司。
1.1.2 仪器与设备
ZYJ-7090单螺杆榨油机,东莞市方太电器有限公司;SF-GL-16A高速冷冻离心机,上海菲恰尔分析仪器有限公司;ALpha 2-4 LSCplus冷冻干燥机,德国Christ公司;ZS90粒度电位仪,英国马尔文仪器有限公司;DSC 214差示扫描量热仪,耐驰科学仪器商贸(上海)有限公司;UV-1200型紫外可见分光光度计,上海美谱达仪器有限公司;XRS+凝胶成像仪,美国Bio-rad公司;Cary Eclipse G9800A荧光分光光度计,安捷伦科技(中国)有限公司;iS20傅里叶红外变换光谱仪、HAAKE Mars40型动态流变仪,美国赛默飞世尔公司。
1.2 试验方法
1.2.1 杏仁预处理
杏仁浸泡4 h后手工去皮,干燥后60 ℃冷榨去油,得到的杏仁粕以料液比1∶6(g∶mL)加入石油醚浸提脱脂,重复3次,自然晾干后过60目筛,得到脱脂杏仁粉,置于4 ℃保存。
1.2.2 杏仁蛋白的制备
工艺1:碱溶酸沉法[14]。脱脂杏仁粉以料液比1∶30(g∶mL)比例加入蒸馏水,调节溶液pH至8.5,50 ℃水浴下连续搅拌浸提1 h,4 500 r/min离心20 min,沉淀物重复提取2次,合并上清液,加入1 mol/L HCl调节溶液pH至4.5,静置沉淀30 min后离心,弃去上清液,蒸馏水洗沉淀3~5次,冷冻干燥后得到杏仁碱溶蛋白。
工艺2:盐析法[15]。脱脂杏仁粉与0.01 mol/L PBS以料液比1∶12(g∶mL)配成杏仁溶液,4 ℃冷浸12 h。将所得溶液超声波破碎60 min,破碎过程中使用冰浴进行间隙冷却以防止蛋白质变性,间隙时间为2 s∶1 s。4 000 r/min离心30 min后取上清液加入(NH4)2SO4,使饱和度达到25%。静置2 h后5 000 r/min离心30 min,取上清液继续添加(NH4)2SO4至溶液饱和度到达50%,4 ℃静置2 h后5 000 r/min离心30 min,取沉淀溶解后经分子截留量为7 000 Da的透析袋透析、冻干,得到盐析蛋白。
工艺3:酶提取法[16]。脱脂杏仁粉1∶5加水溶解,47 ℃水浴加热并调节溶液pH至11.5,将碱性蛋白酶以0.45%([E]/[S])(900 U/g)的比例加入到蛋白溶液中,充分反应3.5 h,过程中持续滴加1 mol/L NaOH保持溶液pH不变,随后在水浴锅中加热灭酶(90 ℃,10 min),通过5 000 r/min离心20 min去除不溶物质,上清液冷冻干燥即为酶提蛋白。
工艺4:醇沉法[17]。称取预处理后的脱脂杏仁粉,1∶11(g∶mL)加入体积分数75%的乙醇溶液,并在50 ℃条件下搅拌1 h,5 000 r/min离心20 min,得到的沉淀重复操作2次,冷冻干燥得到醇沉蛋白。
1.2.3 蛋白质提取率与纯度测定
蛋白质含量的测定采用GB 5009.5—2016 《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法,按公式(1)和公式(2)计算杏仁蛋白的提取率与纯度:
蛋白纯度![]()
(1)
蛋白提取率![]()
(2)
式中:c,标准酸溶液浓度,mol/L;m,待测试样质量,g;V0,空白样标定标准酸消耗量,mL;V,待测试样滴定标准酸消耗量,mL;F,蛋白折算系数,杏仁蛋白质为5.18。
1.2.4 粒径及zeta电位的测定
通过粒度电位仪进行粒径及zeta电位的测定。分别称取冻干后的样品溶于磷酸盐缓冲液(0.01 mol/L,pH 7.0),制备0.1 mg/mL的蛋白溶液,充分水合后在12 000 r/min离心10 min,上清液过0.45 μm微孔滤膜,25 ℃下平衡30 s后进行测试。
1.2.5 热学性质测定
通过差示扫描量热仪(differential scanning calorimeter,DSC)测定蛋白样品的热学性质。称取5 mg冻干后的蛋白质样品密封于铝盘中,以空白铝盘作对照。在40~200 ℃范围内以10 ℃/min的速度进行扫描,得到杏仁蛋白的热效应曲线。
1.2.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
将蛋白质配成2 mg/mL的溶液,与5×上样缓冲液以体积比4∶1混合,沸水浴5 min。取10 μL样品上样,使用5%浓缩胶与12%分离胶,设置浓缩胶80 V、30 min,分离胶120 V、120 min。电泳结束后,在染色液(1 g/mL考马斯亮蓝R250、500 mL/L甲醇,100 mL/L乙酸)中摇床染色1 h,之后使用脱色液(250 mL/L甲醇,70 mL/L乙酸)脱色,直至电泳条带变得清晰,置于成像仪下观察。
1.2.7 傅里叶红外光谱扫描
将冷冻干燥后的蛋白样品与KBr以1∶100混合研磨后压片,以纯KBr为空白,使用傅里叶红外光谱仪进行扫描。在4 000~400 cm-1波数内扫描32次。以纯KBr为基线背景,使用OMNIC 32处理光谱曲线并用PeakFit 4.12软件对酰胺I带(1 600~1 700 cm-1)进行高斯拟合,用各特征峰面积的比率来表示蛋白质二级结构的相对含量。
1.2.8 内源性荧光光谱扫描
配制质量浓度为0.2 mg/mL的蛋白溶液。以蛋白质分子内部的荧光基团为探针,设置荧光光谱激发波长为245 nm,激发和发射狭缝宽5 nm,在290~400 nm进行扫描,每组样品扫描3次,取峰值变化最稳定的一组图谱,记录最大荧光强度和最大发射波长用作分析。
1.2.9 溶解度测定
采用双辛可宁酸法(bicinchoninic acid assay,BCA)测定可溶性蛋白质含量。配置1 g/L的杏仁蛋白溶液,在室温下磁力搅拌2 h充分水合,5 000 r/min离心15 min,吸取1 mL上清液准确稀释1倍,使蛋白溶液最终浓度为0.5 g/L。分别取50 μL牛血清蛋白标准液及样品置于EP管中,并加入950 μL的BCA工作液(BCA试剂与Cu试剂50∶1混匀后60 ℃水浴30 min)混匀,60 ℃水浴30 min。冷却至室温后,于562 nm处测量样品的吸光度值。
1.2.10 乳化性(emulsification activity index,EAI)和乳液稳定指数(emulsion stability index,ESI)测定
根据PEARCE等[18]的方法并稍加修改,配制15 mL质量浓度为1 g/L的蛋白质溶液,调节pH值到7.0,充分搅拌分散后加入5 mL葵花籽油,将混合物在高速匀浆机中以12 000 r/min的速度均质1 min。均质完成后立即从距烧杯底部约0.5 cm处抽取50 μL乳液样本,并与5 mL 1 g/L SDS溶液混合均匀,在500 nm处测定该溶液的吸光度。15 min后再次吸取乳液重复操作并测量吸光度。EAI和ESI按公式(3)和公式(4)计算:
(3)
(4)
式中:T,2.303;N,稀释倍数,100;C,蛋白质量浓度,g/mL;ψ,乳液中油的体积分数,0.25;A0,均质后立即测得的混合液吸光度;A15,静置15 min后混合液的吸光度;Δt,15。
1.2.11 流变性测定
蛋白质样品的流变学特性通过配备有平板(直径40 mm,间隙0.05 mm)的流变仪测定。配置50 g/L的杏仁蛋白溶液,在25 ℃下测定0.01~100 s-1剪切速率范围内蛋白质样品溶液的表观黏度。
1.3 数据处理
所有试验重复3次,结果取平均值。使用SPSS 22.0进行数据统计与显著性(P<0.05)分析、并用Origin 96软件作图。
2 结果与分析
2.1 不同提取方法对杏仁蛋白纯度与提取率的影响
如图1所示,4种工艺中盐析法提取杏仁蛋白的纯度最高,为80.60%。碱溶酸沉法次之(73.77%),酶解法和醇沉法提取效果较差,仅为59.66%和56.17%。该结果与高芳[19]的研究结果一致。酶提法与醇沉法的杏仁蛋白提取率较高,分别为63.05%与67.55%。在盐析过程中,无机盐的加入使蛋白质的表面电荷被中和[20],表面结合水减少,蛋白质溶解度降低,导致蛋白质析出,此外蛋白质与蛋白质之间存在强烈的疏水相互作用,排除了蛋白质与非蛋白质物质的相互作用,因此盐析法的纯度高。醇沉法通过乙醇浸泡除去杏仁粕中油脂、多糖和酚类化合物等其他成分浓缩蛋白,杏仁蛋白在乙醇中溶解度较低,损失较少,因此提取率高。但由于乙醇对杏仁粕中其他成分的除去效果不同,可能会保留部分杂质,从而影响蛋白质的纯度与其他功能特性。在酶解过程中,杏仁粕中的非蛋白质成分也会被降解或释放,使目标蛋白降解不完全,并产生其他副产物,导致杏仁蛋白纯度降低。
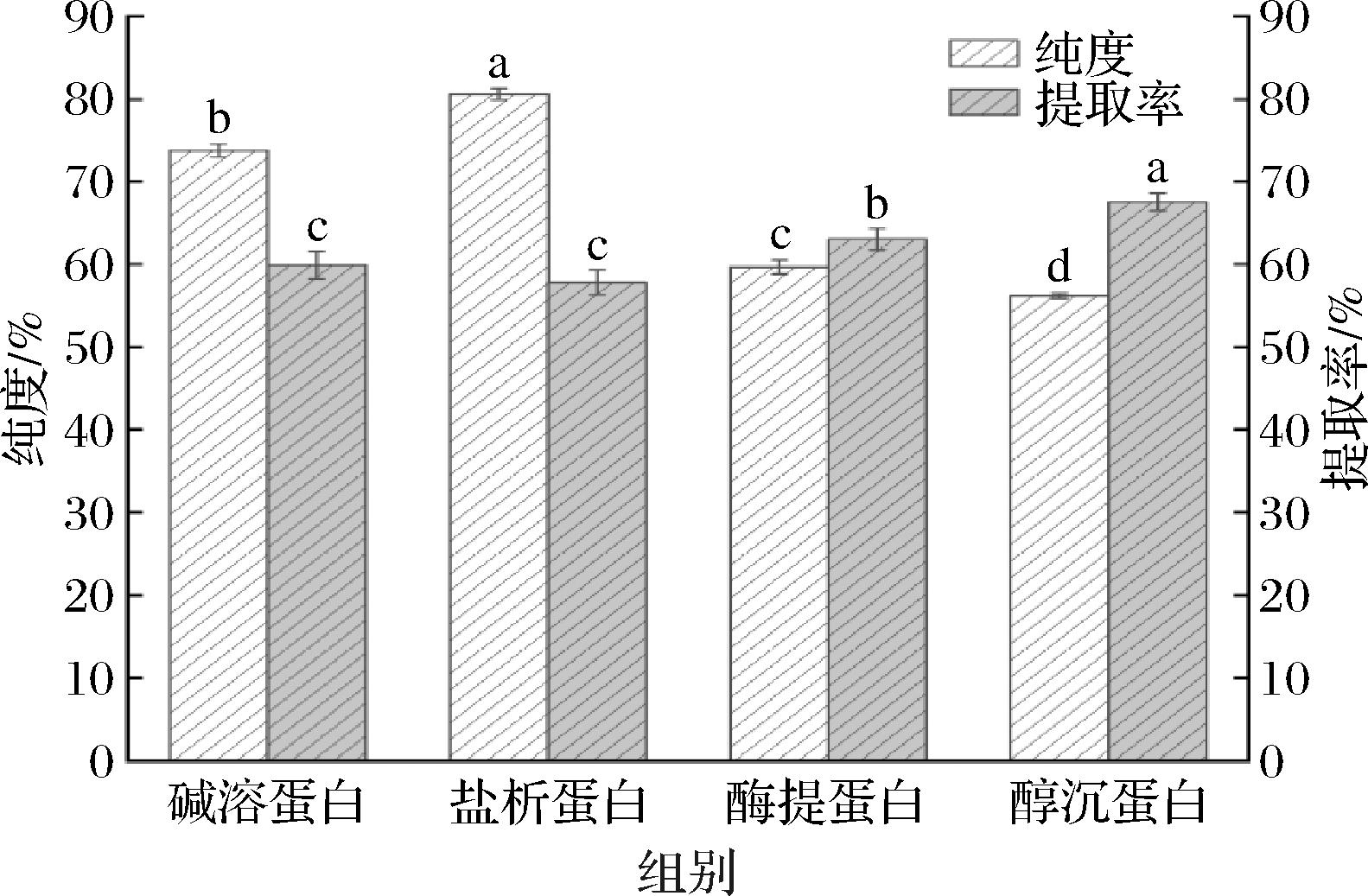
图1 不同提取方法制备杏仁蛋白的纯度与提取率
Fig.1 Purity and extraction rate of almond protein with different extraction methods
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 不同提取方法对杏仁蛋白粒径和zeta电位的影响
如图2所示,杏仁蛋白的粒径强度主要分布在10 nm与190 nm附近,其中醇沉蛋白在10 nm处的粒径强度分布明显高于其他蛋白,盐析法提取的杏仁蛋白的粒径分布曲线出现较明显左移,在粒径较大的190 nm附近相对其他蛋白分布更少,因此这2种蛋白平均粒径较小。图3为不同杏仁蛋白的平均粒径和zeta电位,4种蛋白的zeta电位值均为负数,表明杏仁蛋白表面带负电荷的氨基酸更多。zeta电位的绝对值越大,表明溶液中蛋白质之间的静电相互作用越强,蛋白质分子在溶液中的分散就越稳定,反映蛋白质溶液体系的稳定性[21]。酶提蛋白溶液的稳定性显著(P<0.05)高于其他品种,盐析蛋白次之,可能是由于碱溶酸沉及乙醇沉淀2种提取方法破坏了蛋白质的高级结构,暴露了更多的正电荷基团,使杏仁蛋白表面的氨基酸种类及数量产生差异,导致蛋白颗粒间的氢键、疏水键等非共价键断裂,静电排斥力减弱。
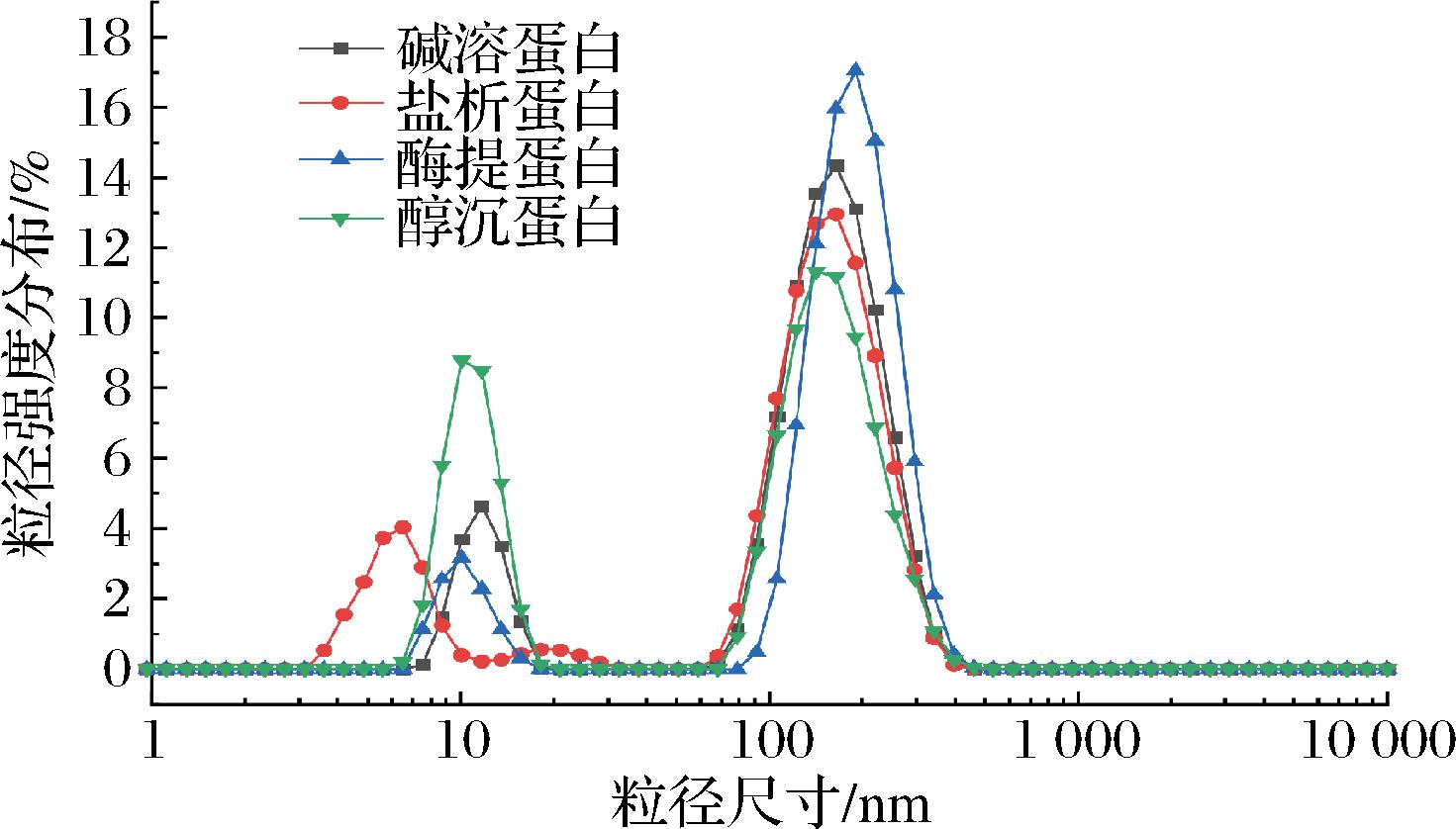
图2 不同杏仁蛋白的粒径强度分布
Fig.2 Particle size distribution of different almond protein
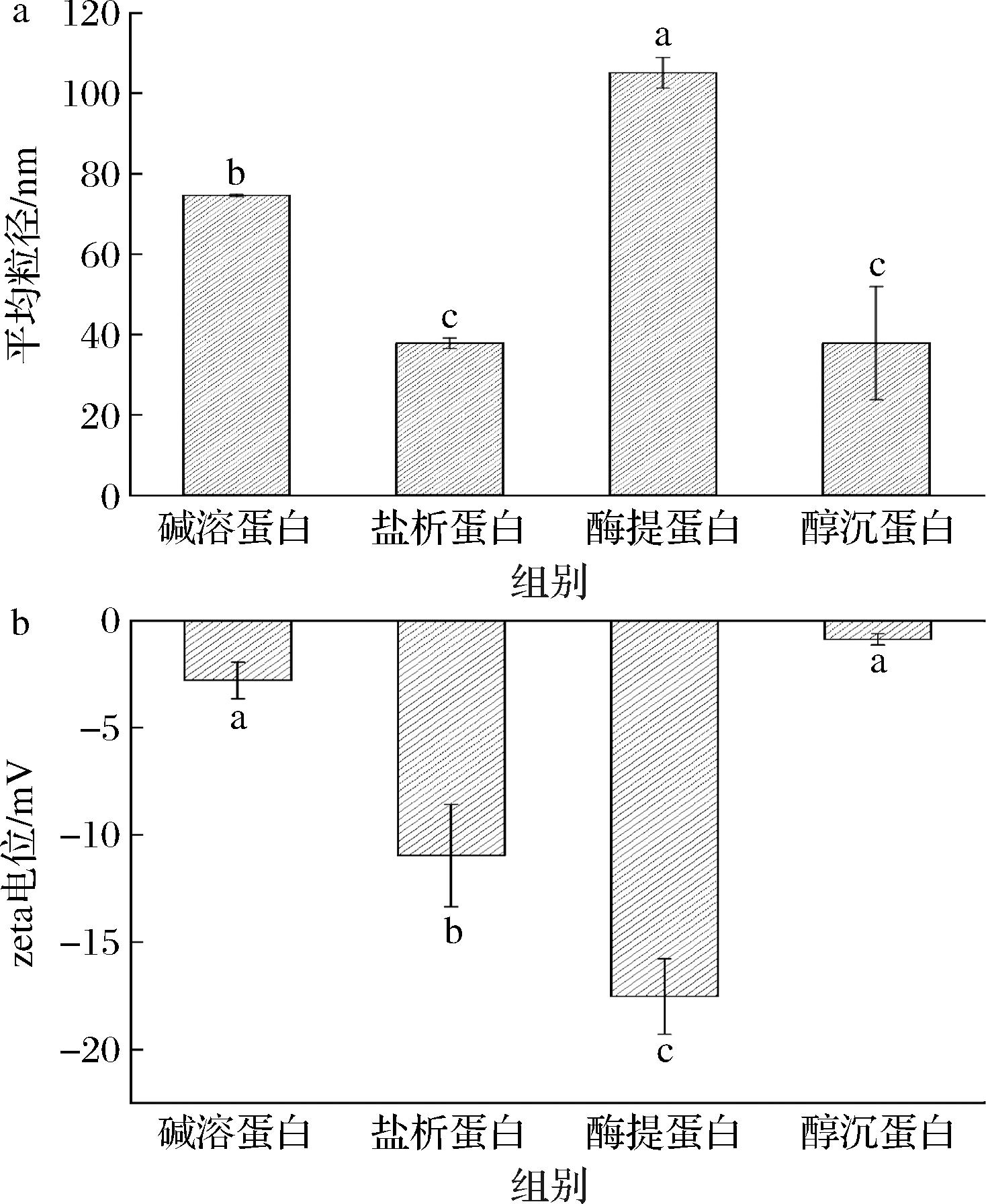
a-平均粒径;b-zeta电位
图3 不同杏仁蛋白的平均粒径和zeta电位
Fig.3 Particle size and zeta potential of different almond protein
2.3 不同提取方法对杏仁蛋白热学性质的影响
蛋白样品的热学性质通过DSC进行测定,分析蛋白样品在40~200 ℃吸热扫描过程中的变性和展开。蛋白质样品的热稳定性如表1所示,不同杏仁蛋白的DSC曲线如图4所示,其中热焓值代表诱导热变性过程所需的能量,通常用来评价蛋白质分子的空间结构有序性[22]。盐析蛋白热变性温度(Td)与热焓值(ΔH)最高,说明盐析法制备的杏仁蛋白需要更多的能量来诱导变性,具有更好的热稳定性,有利于在短时间的高温加工环境中保持蛋白质的天然形态。
表1 不同杏仁蛋白的热稳定性
Table 1 Thermal characteristics of different almond protein
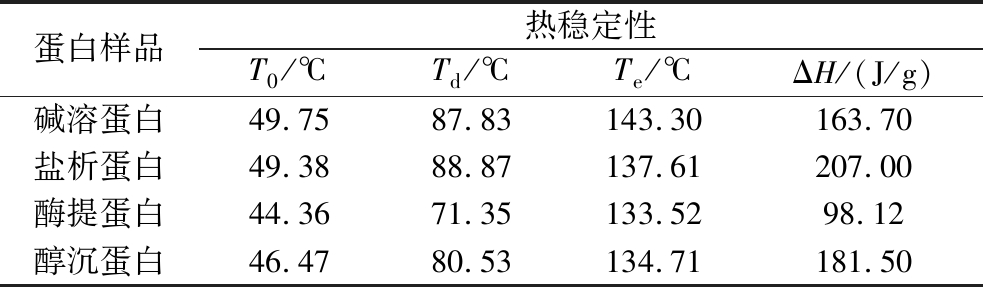
蛋白样品热稳定性T0/℃Td/℃Te/℃ΔH/(J/g)碱溶蛋白49.7587.83143.30163.70盐析蛋白49.3888.87137.61207.00酶提蛋白44.3671.35133.5298.12醇沉蛋白46.4780.53134.71181.50
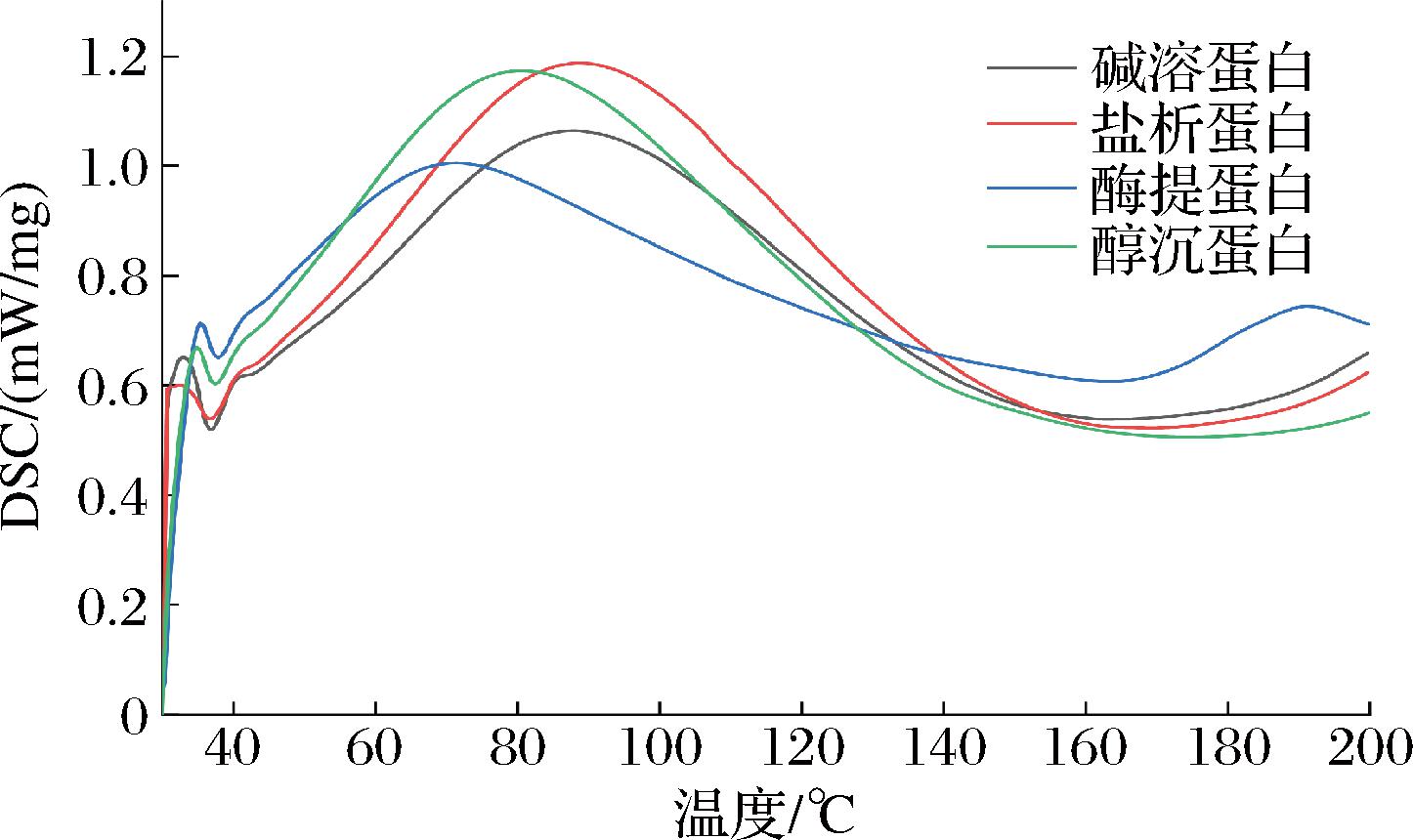
图4 不同杏仁蛋白的DSC曲线
Fig.4 DSC curve of different almond protein
2.4 不同提取方法对杏仁蛋白亚基的影响
SDS-PAGE是将蛋白质按亚基分子质量的不同进行梯度分离,蛋白质的分子质量分布情况可对照Marker来表征。由图5可知,4种蛋白在17~25 kDa范围内灰度值较高,说明在此范围内蛋白的分子质量含量丰富。酶法提取的杏仁蛋白亚基与其他3种差异显著,在25~48 kDa范围内无条带出现,且在11~17 kDa低分子质量处出现染色,推测酶提取过程中大分子质量蛋白被分解。碱溶酸沉法、盐析法、醇沉法3种提取方法所得到的杏仁蛋白亚基条带无显著差异,分子质量范围约为17~48 kDa,其中盐析法制备的蛋白在25~35 kDa范围内条带颜色较深,可能是由于提取过程中过高的盐浓度改变了蛋白质分子的构象,并使蛋白分子质量变小,从而导致不同杏仁蛋白在理化与功能特性上存在差异。
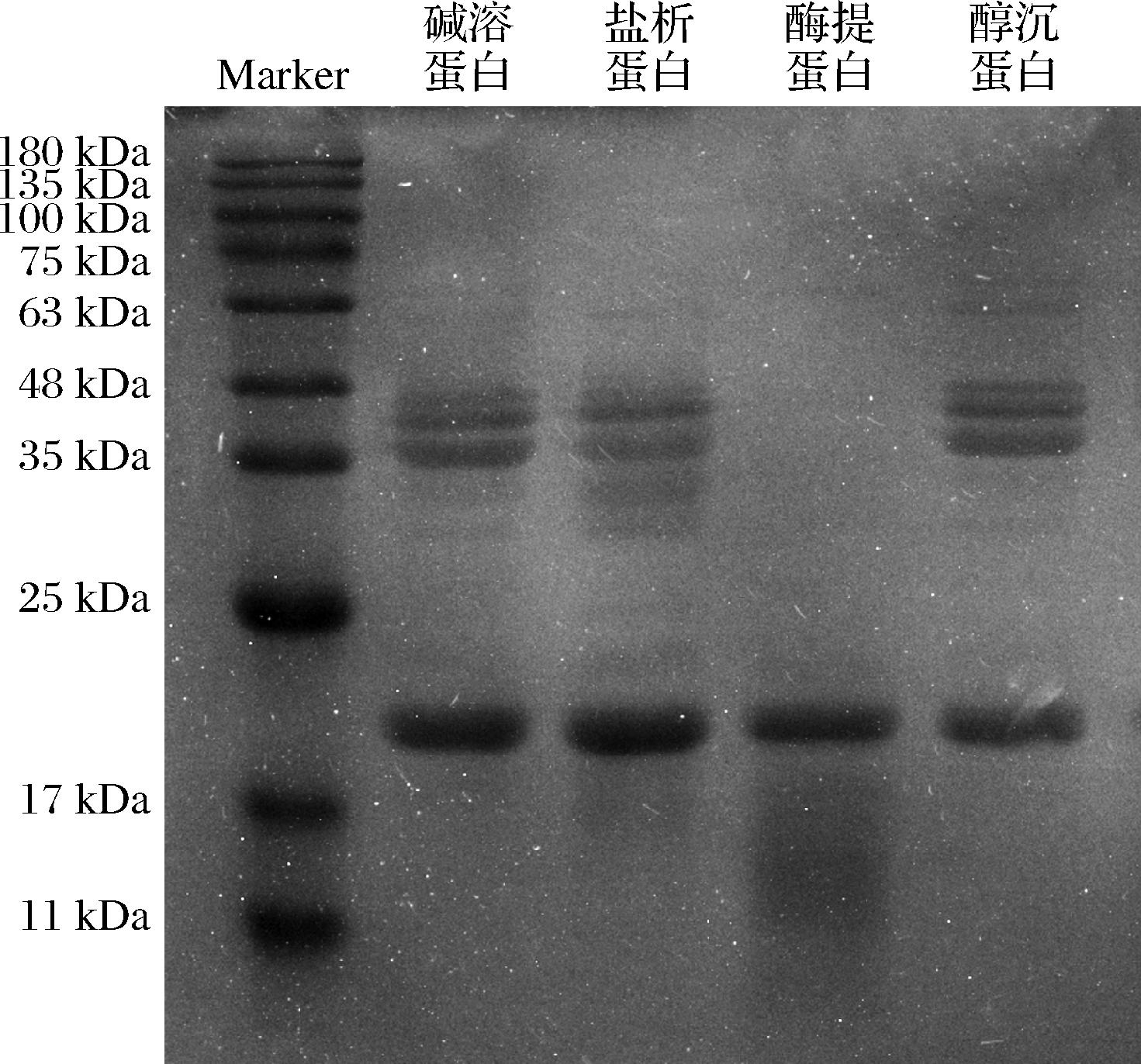
图5 不同杏仁蛋白的SDS-PAGE分析图谱
Fig.5 SDS-PAGE pattern of different almond protein
2.5 不同提取方法对杏仁蛋白二级结构的影响
图6为不同提取方法下杏仁蛋白红外光谱及二级结构含量变化图。3 420 cm-1附近的峰为酰胺A带吸收峰,可能与C—H和NH2拉伸振动有关[23]。2 850 cm-1附近的酰胺B带象征CH2的不对称拉伸。1 600~1 700 cm-1的酰胺I带与蛋白质中蛋白质连接键C![]() O的拉伸振动或H键耦合COO相关,常被用于分析蛋白质二级结构的变化。酰胺Ⅱ带(1 546~1 541 cm-1)与酰胺Ⅲ带(1 386~1 240 cm-1)则分别对应平面内N—H弯曲与C—N拉伸振动[24]。
O的拉伸振动或H键耦合COO相关,常被用于分析蛋白质二级结构的变化。酰胺Ⅱ带(1 546~1 541 cm-1)与酰胺Ⅲ带(1 386~1 240 cm-1)则分别对应平面内N—H弯曲与C—N拉伸振动[24]。
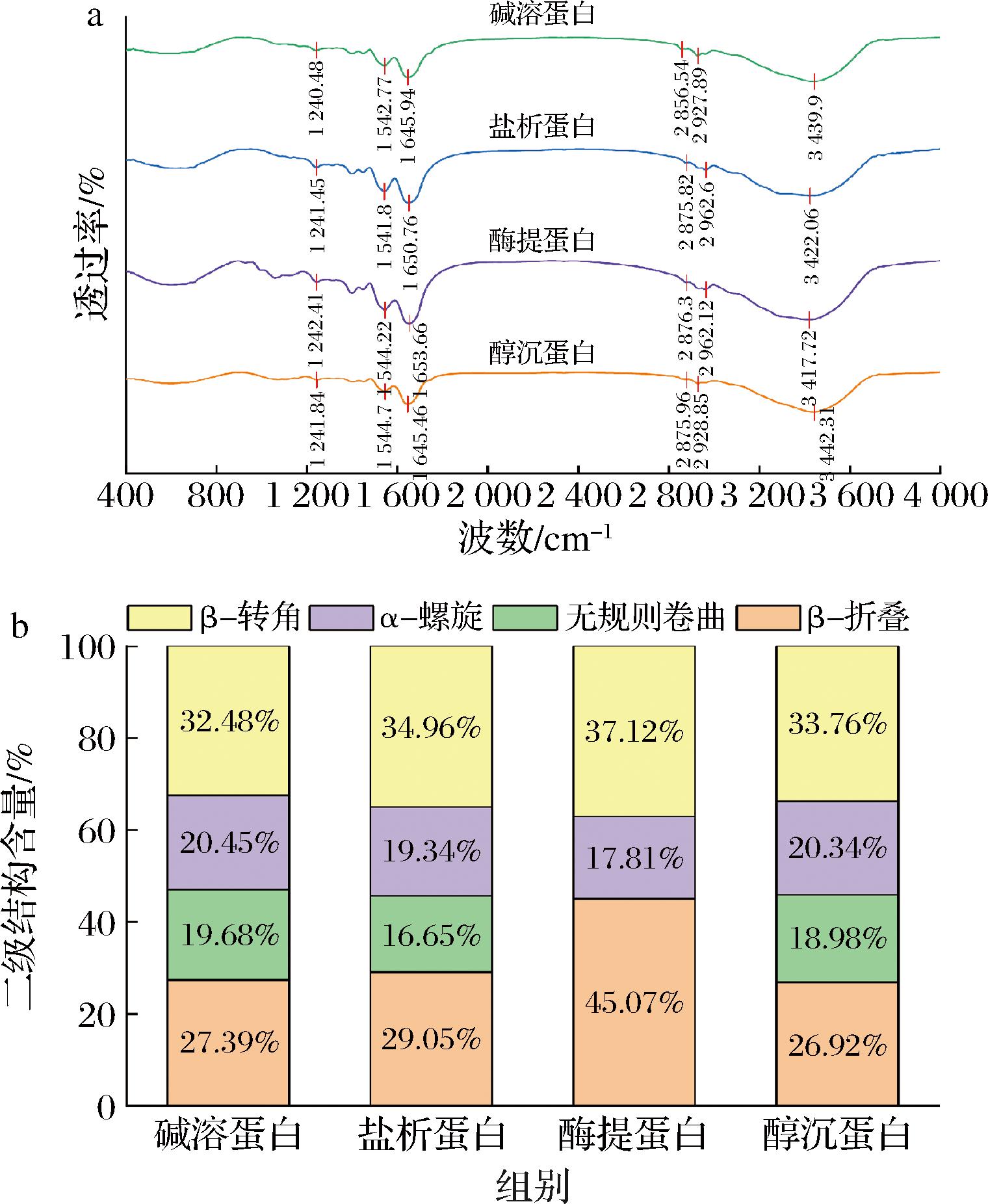
a-红外光谱;b-二级结构含量
图6 不同杏仁蛋白的红外光谱及二级结构分布图
Fig.6 Infrared spectra and secondary structure distribution of different almond protein
图6中各官能团的峰值位置不同,表明在提取过程中蛋白质结构受到了不同程度的影响,4种杏仁蛋白的结构存在差异。碱溶蛋白与醇沉蛋白的酰胺A带在相对更低波长处出现,推测酸碱环境以及乙醇处理对蛋白质氢键造成了不可逆的破坏。通过酰胺I带二阶导数图谱中各二级结构的波段位置和对应特征吸收峰的面积大小定量分析蛋白质的二级结构结果如图6-b所示,β-折叠和β-转角是杏仁蛋白的主要二级结构,这与李晶晶等[25]的研究结果相同。碱溶蛋白与醇沉蛋白中β-折叠和β-转角减少,无规则卷曲和α-螺旋含量相对增多,说明碱溶酸沉与乙醇沉淀工艺导致蛋白质分子间的氢键被破坏,增加了蛋白分子的无序性,使结构更加疏松。而盐析法与酶提取法制备的低分子质量蛋白中α-螺旋与β-折叠含量相对较高,表明2种蛋白具有更加紧密的结构,二级结构相对更加稳定,这与2.2节zeta电位测定中盐析蛋白与酶提蛋白溶液稳定性更好的结果一致。
2.6 不同提取方法对杏仁蛋白荧光光谱的影响
内源性荧光光谱可以用于分析蛋白质的三级结构变化。由图7可知,经过不同处理得到的杏仁蛋白内源性最大荧光峰位(最大吸收波长)无明显差异,且均小于330 nm,这说明不同杏仁蛋白质分子的结构变化较小,色氨酸残基均位于蛋白质的内部非极性区,在溶液中的暴露程度相近[26]。不同蛋白质的荧光强度具有一定差异,表明不同提取方法对蛋白质中芳香族氨基酸含量有一定影响,蛋白结构发生了不同程度的折叠或聚集[27],蛋白中的赖氨酸残基数量或位置发生变化。酶提蛋白与盐析蛋白的荧光强度较高,说明原本在分子外部极性环境中的芳香族氨基酸残基(色氨酸、酪氨酸、苯丙氨酸残基)被转移到内部的非极性环境中,蛋白的三级结构舒张程度较低,卷曲程度高。
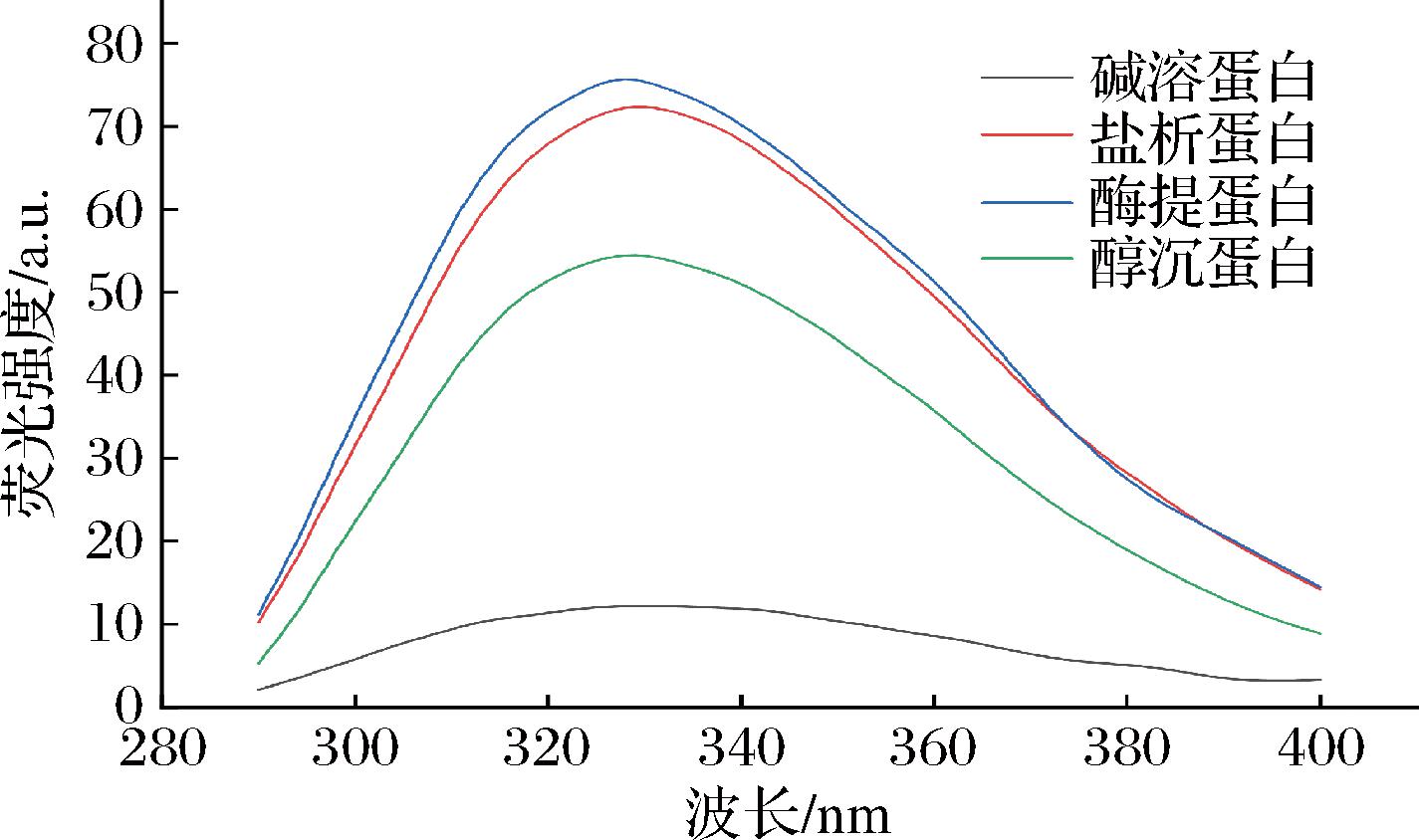
图7 不同杏仁蛋白的荧光光谱图
Fig.7 Fluorescence spectra of different almond protein
2.7 不同提取方法对杏仁蛋白溶解度的影响
蛋白质的溶解性是决定其功能特质展现的先决要素。唯有在溶解状态下,蛋白质分子才能更有效地展现其起泡性、乳化性以及其他特性。溶解度与蛋白质的表面疏水性和结构有关,不同杏仁蛋白的溶解度如图8所示,盐析蛋白和酶提蛋白的溶解度显著高于碱溶蛋白和醇沉蛋白,与ZHANG等[28]的研究结果一致。酶提蛋白的溶解度最高,为66.91%,可能是由于加入的蛋白酶能将部分不易溶解的杏仁蛋白酶解为水溶性较强的小分子蛋白。碱溶酸沉法和醇沉法提取的杏仁蛋白溶解度较低,可能是由于强酸强碱与乙醇处理破坏了蛋白质分子内部的稳定结构,使蛋白分子内部中的疏水基团暴露,形成较大的聚集体,从而导致蛋白质在水溶液中的溶解度降低。冶梓芩等[29]通过不同提取菜籽与亚麻籽蛋白,发现酶解法与盐析法提取的蛋白溶解性显著高于碱溶酸沉法与乙醇浸提法,与本研究结果一致。
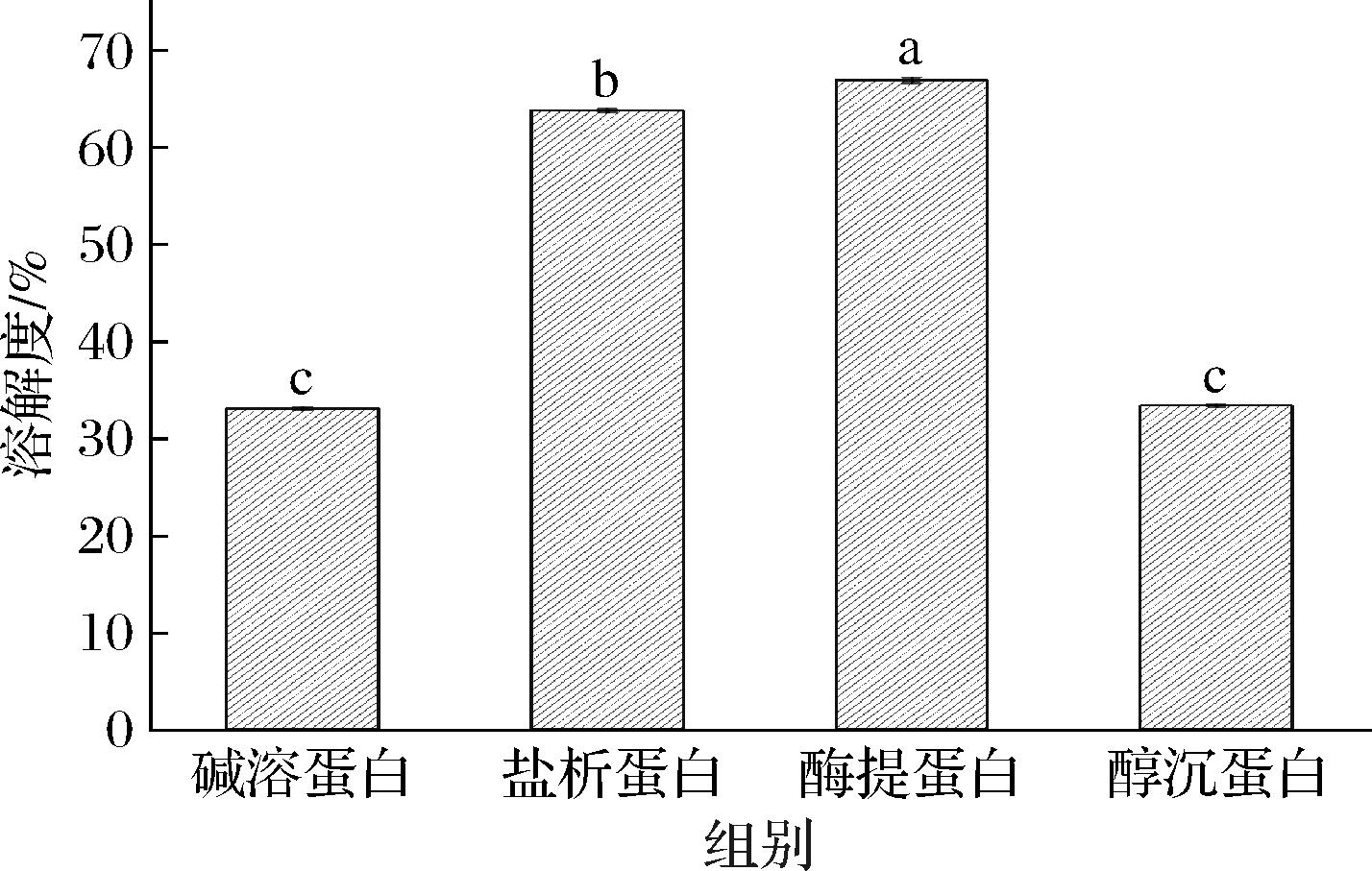
图8 不同方法提取的杏仁蛋白的溶解度
Fig.8 Solubility of almond protein with different extraction methods
2.8 不同提取方法对杏仁蛋白乳化能力的影响
EAI是衡量蛋白质与水油作用形成乳状物的能力,ESI是衡量乳状物保持其稳定结构的能力,通常用来评价蛋白质的乳化性质。不同方法提取的杏仁蛋白的乳化能力如图9所示,4种方法提取杏仁蛋白的EAI与各蛋白的纯度变化趋势一致,其中盐析法提取的蛋白乳化性(32.06 m2/g)显著(P<0.05)高于其他杏仁蛋白,这可能是由于盐析杏仁蛋白溶解度比碱溶蛋白大,其分子向水油界面扩散的速度更快,有利于水油快速吸附形成均匀分散体系。通过酶提法制备的杏仁蛋白的ESI最高,为129.01 min,是由于酶提蛋白相较于其他蛋白具有更强的静电排斥力,使蛋白乳液的体系结构保持稳定,这与2.2节杏仁蛋白zeta电位测定结果一致。有研究表明,蛋白质的乳化性能与其氨基酸组成、电荷分布、分子大小以及构象有关,因而不同提取方法对蛋白品质特性具有一定影响[30]。
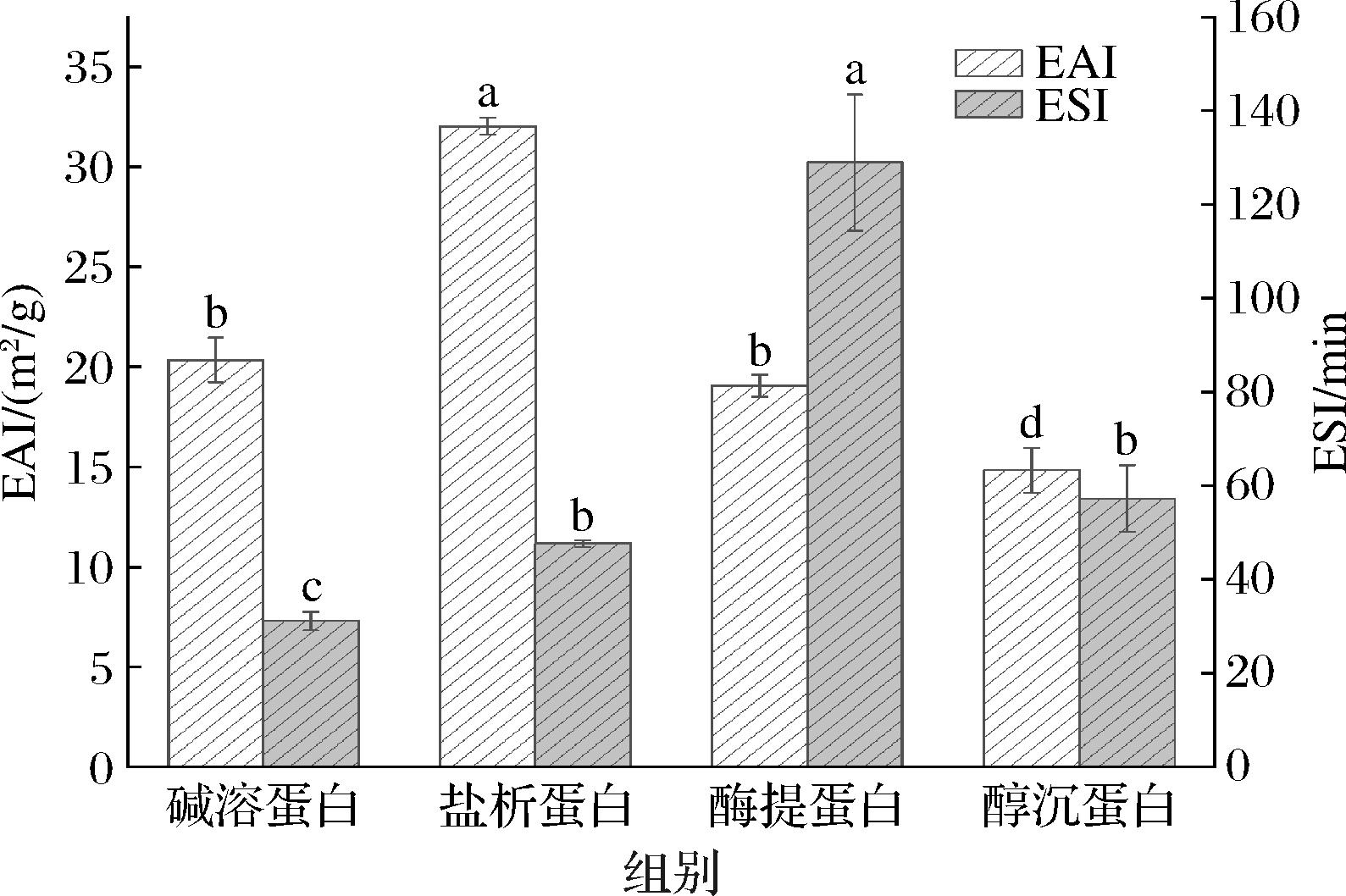
图9 不同杏仁蛋白的EAI及ESI
Fig.9 Emulsification activity index and emulsion stability index of different almond protein
2.9 不同提取方法对杏仁蛋白流变性质的影响
杏仁蛋白的流变性质对其应用和加工有重要影响。图10显示了不同提取方法对杏仁蛋白流变性质的影响,在0.1~100 s-1的剪切速率范围内,所有蛋白溶液都表现出剪切稀化行为,表观黏度随剪切速率的增大而减小,因此杏仁蛋白溶液体系属于典型的假塑性流体体系。碱溶蛋白溶液与醇沉蛋白溶液的表观黏度明显高于其他组,这可能与这2种蛋白具有更大的分子质量有关[31],这些蛋白在溶液中形成的网络结构更加复杂,从而增加了流体的黏度[32]。盐析蛋白溶液与酶提蛋白的黏度曲线在剪切速率升速的过程中出现波动,可能是由于2种蛋白的静电斥力较大[33],在溶液中展现较低的聚集倾向,流体内部的蛋白分子在特定剪切速率作用下不断重新排列,形成不同的网络结构,进而影响流体的表观黏度。
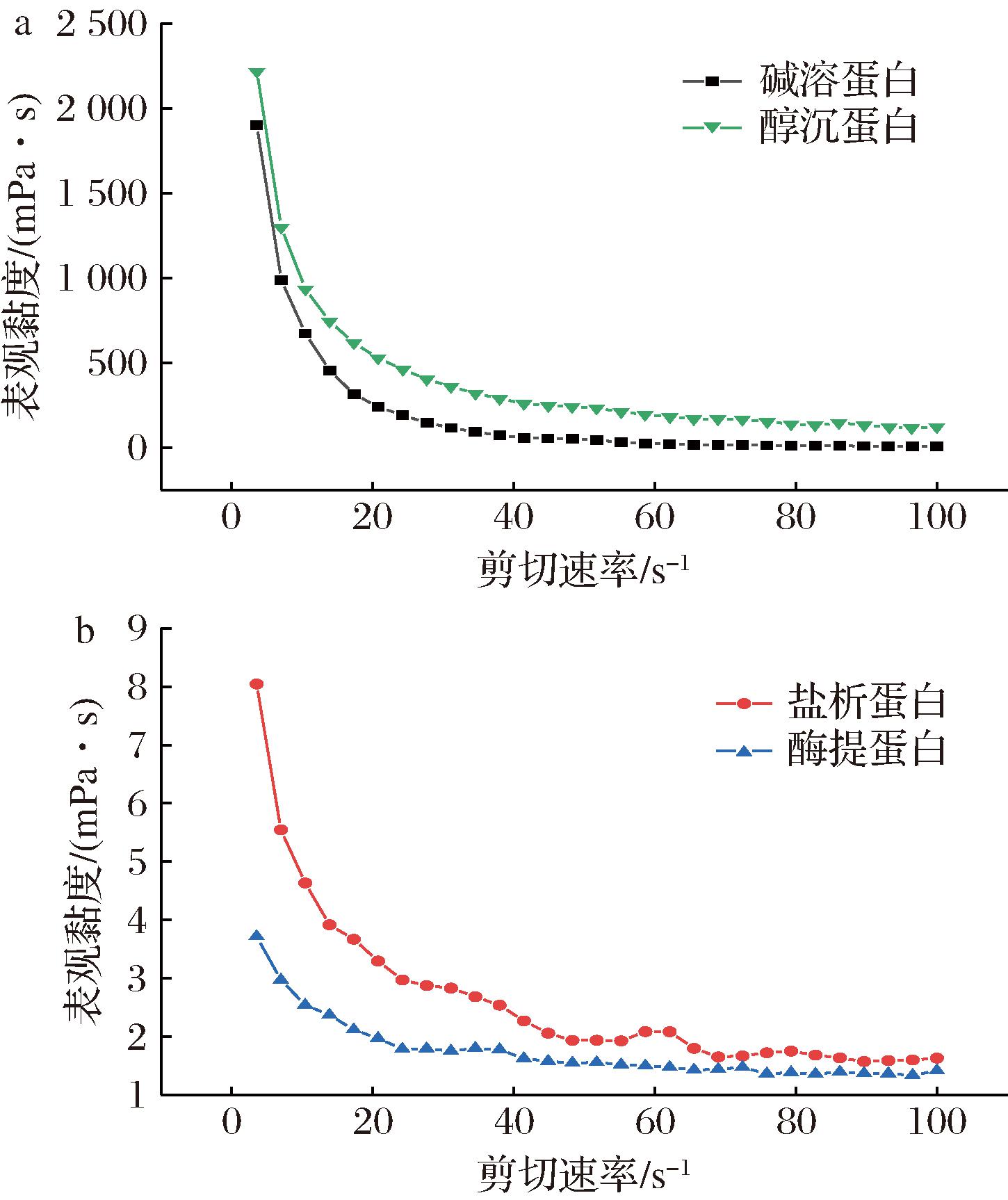
a-碱溶蛋白和醇沉蛋白;b-盐析蛋白和酶提蛋白
图10 不同杏仁蛋白的表观黏度与剪切速率关系图
Fig.10 Relationship between apparent viscosity and shear rate of different almond protein
3 结论与讨论
研究结果表明,盐析法提取的杏仁蛋白纯度最高,为80.60%,醇沉蛋白提取率最高(67.55%),但纯度最低(56.17%)。盐析蛋白与酶提蛋白亚基分布更小,较小分子质量条带强度显著增加。酶提蛋白的无规则卷曲消失,β-折叠含量相对最高(45.07%),具有相对最高的溶解度(66.91%)与溶液稳定性(zeta电位,乳化稳定性129.01 min)。碱溶蛋白的内源荧光强度显著低于其他不同提取方法所得蛋白,表观黏度与醇沉蛋白相近,相对较高。盐析蛋白热稳定性(88.87 ℃,207 J/g)与乳化性(32.06 m2/g)都优于其他3种方法,且溶解性良好(63.80%),在食品加工中有较好的应用前景。不同方法提取的杏仁蛋白具有不同功能性质,在实际应用中可根据加工方式选择合适的提取工艺,为杏仁蛋白的进一步研究应用与加工原料筛选提供理论基础。
[1] AKHONE M A, BAINS A, TOSIF M M, et al.Apricot kernel:Bioactivity, characterization, applications, and health attributes[J].Foods, 2022, 11(15):2184.
[2] 卢冉, 王炳智, 田英姿.不同品种杏仁氨基酸组成分析及综合评价[J].食品科学, 2021, 42(24):229-235.
LU R, WANG B Z, TIAN Y Z.Analysis and comprehensive evaluation of amino acid compositions of apricot seed kernels from different cultivars[J].Food Science, 2021, 42(24):229-235.
[3] CREEDON A C, DIMIDI E, HUNG E S, et al.The impact of almonds and almond processing on gastrointestinal physiology, luminal microbiology, and gastrointestinal symptoms:A randomized controlled trial and mastication study[J].The American Journal of Clinical Nutrition, 2022, 116(6):1790-1804.
[4] OJO O, WANG X H, OJO O O, et al.The effects of almonds on gut microbiota, glycometabolism, and inflammatory markers in patients with type 2 diabetes:A systematic review and meta-analysis of randomised controlled trials[J].Nutrients, 2021, 13(10):3377.
[5] 糟龙. 不同品种杏仁蛋白特性及即食豆腐开发研究[D].阿拉尔:塔里木大学, 2023.
ZAO L.Research on the characteristics of different varieties of almond protein and the development of instant tofu[D].Alaer:Tarim University, 2023.
[6] 陈臣, 周洁, 周琦, 等.杏仁中的香气化合物及其风味品质影响因素研究进展[J].食品科学, 2023, 44(19):320-329.
CHEN C, ZHOU J, ZHOU Q, et al.Research progress on aroma compounds in almonds and factors influencing its flavor quality[J].Food Science, 2023, 44(19):320-329.
[7] RAVINDRAN N, KUMAR SINGH S, SINGHA P.A comprehensive review on the recent trends in extractions, pretreatments and modifications of plant-based proteins[J].Food Research International, 2024, 190:114575.
[8] 解春艳, 李丛胜, 路艳霞, 等.苦杏仁蛋白提取条件优化及加工特性研究[J].食品科技, 2015, 40(2):294-298.
XIE C Y, LI C S, LU Y X, et al.Extraction technique and characteristics of protein from bitter apricot kernel[J].Food Science and Technology, 2015, 40(2):294-298.
[9] 刘凯, 梁俊玉, 肖引, 等.磷酸盐法提取杏仁蛋白的工艺研究[J].武警医学, 2013, 24(9):783-785.
LIU K, LIANG J Y, XIAO Y, et al.Extracting process conditions from almond dregs by phosphate method[J].Medical Journal of the Chinese People’s Armed Police Forces, 2013, 24(9):783-785.
[10] SHI T T, CAO J R, CAO J, et al.Almond (Amygdalus communis L.) kernel protein:A review on the extraction, functional properties and nutritional value[J].Food Research International, 2023, 167:112721.
[11] KUMAR M, TOMAR M, POTKULE J, et al.Advances in the plant protein extraction:Mechanism and recommendations[J].Food Hydrocolloids, 2021, 115:106595.
[12] DU J, SHI J C, OBADI M, et al.Decolorization of commercial zein via protein precipitation involving organic solvents at low temperatures[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020, 596:124738.
[13] CHIAVELLI L U R, GODOY A C, DA SILVEIRA R, et al.Optimization of milk sample cleanup using response surface methodology[J].Food Analytical Methods, 2020, 13(1):166-175.
[14] 俞雅琼, 于辉, 高蕾, 等.新疆甜杏仁分离蛋白提取工艺研究[J].新疆农业大学学报, 2009, 32(4):31-34.
YU Y Q, YU H, GAO L, et al.A study extraction of protein separated from sweet almond in Xinjiang[J].Journal of Xinjiang Agricultural University, 2009, 32(4):31-34.
[15] 张帆. 苦杏仁蛋白提取及其对人结肠腺癌细胞生长影响[D].北京:北京林业大学, 2011.
ZHANG F.Extraction and effect on human colon adenocarcinoma cell growth of apricot kernel protein[D].Beijing:Beijing Forestry University, 2011.
[16] 刘媛, 王健, 曲丽洁.酶法提取杏仁水解蛋白工艺研究[J].粮食与油脂, 2013, 26(3):18-20.
LIU Y, WANG J, QU L J.Study on extraction processing of almond protein hydrolysate by enzymes[J].Cereals &Oils, 2013, 26(3):18-20.
[17] 刘玉兰, 王丹, 张东东, 等.苦杏仁醇洗浓缩蛋白制取及脱苷条件研究[J].中国油脂, 2016, 41(12):26-30.
LIU Y L, WANG D, ZHANG D D, et al.Preparation of alcohol leached protein concentrate from bitter apricot kernel cake and removal of amygdalin[J].China Oils and Fats, 2016, 41(12):26-30.
[18] PEARCE K N, KINSELLA J E.Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry, 1978, 26(3):716-723.
[19] 高芳. 杏仁组织中蛋白质实验室提取方法优化[J].中国实验方剂学杂志, 2013, 19(17):38-40.
GAO F.Optimization of laboratory extraction method for tissue proteins in armeniacae Semen amarum[J].Chinese Journal of Experimental Traditional Medical Formulae, 2013, 19(17):38-40.
[20] 刘春杰, 赵新军, 蒋中英.盐离子对蛋白质带电特性的影响[J].原子与分子物理学报, 2021, 38(2):31-38.
LIU C J, ZHAO X J, JIANG Z Y.Effect of salt ions on the charging properties of proteins[J].Journal of Atomic and Molecular Physics, 2021, 38(2):31-38.
[21] 齐宝坤, 李杨, 王中江, 等.不同品种大豆分离蛋白zeta电位和粒径分布与表面疏水性的关系[J].食品科学, 2017, 38(3):114-118.
QI B K, LI Y, WANG Z J, et al.Relationship between surface hydrophobicity and zeta potential as well as particle size distribution of soybean protein isolates from different varieties[J].Food Science, 2017, 38(3):114-118.
[22] 耿蕊. pH偏移结合温和热处理对大豆分离蛋白结构及功能性的影响及其与肌原纤维蛋白的互作[D].哈尔滨:东北农业大学, 2015.
GENG R.Structural and functional properties of soy protein iso-late treated by pH shifting combined with mild heating and its interaction with myofibril protein[D].Harbin:Northeast Agricultural University, 2015.
[23] ZHENG L, WANG Z J, KONG Y, et al.Different commercial soy protein isolates and the characteristics of Chiba tofu[J].Food Hydrocolloids, 2021, 110:106115.
[24] BECK T L, MCGREGOR P J, TAKAMI M, et al.Spatially resolved molecular hydrogen emission in the inner 200AU environments of classical T tauri stars[EB/OL].https://arxiv.org/abs/0711.3844v1.
[25] 李晶晶, 罗婷婷, 胡海玥, 等.不同提取方法对杏仁蛋白结构和功能特性的影响[J].食品工业科技, 2025, 46(5):72-80.
LI J J, LUO T T, HU H Y, et al.Effects of different extraction methods on structure and functional characteristics of almond protein[J].Science and Technology of Food Industry, 2025, 46(5):72-80.
[26] 吴伟. 蛋白质氧化对大豆蛋白结构和凝胶性质的影响[D].无锡:江南大学, 2010.
WU W.Effect of protein oxidation on the structure and gel proper-ties of soybean protein[D].Wuxi:Jiangnan University, 2010.
[27] JIA X, NING X, LI W L, et al.Non-covalent interaction between almond protein and sinapic acid:Impact on protein structure and antioxidant activity[J].Oil Crop Science, 2019, 4(4):275-284.
[28] ZHANG D Q, MU T H, SUN H N, et al.Comparative study of potato protein concentrates extracted using ammonium sulfate and isoelectric precipitation[J].International Journal of Food Properties, 2017, 20(9):2113-2127.
[29] 冶梓芩, 王进英, 马桂兰, 等.不同提取方法对菜籽蛋白和亚麻籽饼蛋白品质特性影响研究[J].中国油脂, 2024,49(11):130-137.
YE Z Q, WANG J Y, MA G L, et al.Study on the effect of different extraction methods on the quality characteristics of rapeseed and flaxseed meal protein[J].China Oils and Fats, 2024, 49(11):130-137.
[30] LIU Y Q, WU Q Z, ZHANG J, et al.Food emulsions stabilized by proteins and emulsifiers:A review of the mechanistic explorations[J].International Journal of Biological Macromolecules, 2024, 261:129795.
[31] ZHANG Z H, LIU Y.Recent progresses of understanding the viscosity of concentrated protein solutions[J].Current Opinion in Chemical Engineering, 2017, 16:48-55.
[32] ALSHAREEDAH I, BORCHERDS W M, COHEN S R, et al.Sequence-specific interactions determine viscoelasticity and aging dynamics of protein condensates[J].Nature Physics, 2024, 20(9):1482-1491.
[33] ZIDAR M, ROZMAN P, BELKO-PARKEL K, et al.Control of viscosity in biopharmaceutical protein formulations[J].Journal of Colloid and Interface Science, 2020, 580:308-317.