桃胶(peach gum, PG)是因桃树受到微生物感染或机械损伤后分泌的胶状物质[1],其主要活性成分为桃胶多糖(peach gum polysaccharide, PGP),一种天然高分子聚合物。前期研究表明,PGP的主链骨架由β-(1→6)-半乳聚糖构成,在O-3和O-4处分支,支链主要包括2种类型:1)O-3位置:末端为α-Araf-(1→5)-α-Araf-(1→2)或α-Araf-(1→;2)O-4位置:末端为多个α-Araf-(1→3,4)-α-Galp-(1→或α-Araf-(1→3)-α-Araf-(1→[2]。KARDO OV
OV 等[3]使用黄曲霉部分降解PGP,获得独特寡糖来阐明其结构。YAO等[4]采用H2O2水解制备出的桃胶低聚糖对枯草芽孢杆菌、金黄色葡萄球菌和大肠杆菌均具有较高的抗菌活性。此外,CHEN等[5]通过超声波辅助提取PGP并探究其降解规律,但由于提取过程中存在杂质、多糖纯度不足等问题,可能干扰精准揭示超声波对其精细结构的影响。因此,直接针对多糖本身,系统揭示PGP降解的规律特征及其构效关系,是当前亟待突破的核心挑战。
等[3]使用黄曲霉部分降解PGP,获得独特寡糖来阐明其结构。YAO等[4]采用H2O2水解制备出的桃胶低聚糖对枯草芽孢杆菌、金黄色葡萄球菌和大肠杆菌均具有较高的抗菌活性。此外,CHEN等[5]通过超声波辅助提取PGP并探究其降解规律,但由于提取过程中存在杂质、多糖纯度不足等问题,可能干扰精准揭示超声波对其精细结构的影响。因此,直接针对多糖本身,系统揭示PGP降解的规律特征及其构效关系,是当前亟待突破的核心挑战。
现有研究表明,PGP具有降血糖、抗氧化、改善便秘和促进肠道健康等多种生物活性[6-9]。然而,多糖的生物学功能与其分子质量密切相关[10]。例如,香菇多糖超声波处理后,低分子质量组分(301~1 010 kDa)的抗肿瘤活性显著优于高分子质量组分(1 160~1 760 kDa),甚至超过抗癌药物5-氟尿嘧啶[11];类似地,低分子质量壳聚糖(200 kDa)对大肠杆菌和金黄色葡萄球菌的抑菌效果也高于高分子质量组分(1 500 kDa)[12]。可见,低分子质量多糖通常表现出更优的生物活性。但需注意的是,PGP的分子质量普遍高达103~104 kDa[13-14],其较大的分子质量可能限制其生物利用度和功能表达,进而影响实际应用效果。
超声波作为一种绿色高效的物理改性技术,广泛用于降解和修饰多糖。超声波技术通过空化效应实现多糖分-链的断裂。在液体介质中,声波诱导产生剧烈振荡的微气泡,这些气泡在溃灭瞬间释放机械剪切力和热化学能,协同作用于多糖分子的糖苷键;同时,伴随产生的冲击波通过微射流和剪切力破坏多糖链间的氢键、疏水相互作用等非共价作用力,从而瓦解大分子聚集体[15-17]。研究表明,该技术可精准调控多糖分子质量并保留其功能结构。例如,TECSON等[18]证实κ-卡拉胶经85%振幅超声波处理180 min后,分子质量从1 140 kDa显著降至42 kDa,且低质量浓度(5 mg/mL)条件下降解效率更高;ZHANG等[19]证实,柑橘多糖经超声波处理后,单糖组成与骨架结构未改变,但分子质量及多分散性系数显著降低,表明其具有低结构损伤、窄分子质量分布的优点。值得注意的是,降解产物的生物活性往往显著提升,低分子质量金针菇多糖通过促进双歧杆菌增殖,并增加短链脂肪酸产量,从而优化肠道微生态平衡[20]。此外,超声波技术因其操作简便、参数(振幅、时间等)灵活可调而具备广泛适用性。例如,通过调节超声波强度可改变多糖链构象,促使其从多链聚集体向伸展的单链结构转变[17],从而进一步拓展其应用潜力。
本文首先从原桃胶中提取纯化获得了高纯度的桃胶多糖,在此基础上,基于尺寸排阻色谱(size exclusion chromatography,SEC)检测超声波前后PGP的分子参数,以重均分子质量为指标,考察了超声波时间、多糖浓度和超声波振幅对降解效果的影响,分析PGP降解动力学,同时,对比了超声波前后多糖的单糖组成、分子参数及溶液构象的变化,为PGP构效关系的研究提供更广泛参考。
1 材料与方法
1.1 材料与试剂
原桃胶,中国浙江省湖州市;NaNO3,国药集团化学试剂有限公司;葡萄糖、半乳糖醛酸、四硼酸钠、间羟基联苯、没食子酸、福林酚溶液(1 mol/L)和Na2CO3,上海源叶生物科技有限公司;浓硫酸、苯酚,上海泰坦科技股份有限公司;L-岩藻糖(fucose, Fuc)、D-阿拉伯糖(arabinose, Ara)、D-半乳糖(galactose, Gal)、D-葡萄糖(glucose, Glc)、D-木糖(xylose, Xyl)、D-甘露糖(mannose, Man)、D-半乳糖醛酸(galacturonic acid, GalA)、D-葡萄糖醛酸(glucuronic acid, GlcA),美国Sigma-Aldrich化学公司;无水乙酸钠、NaOH溶液(50%,质量分数),美国Thermo-Fisher公司。
1.2 仪器与设备
HC-3018R高速冷冻离心机,杭州得聚仪器设备有限公司;真空冷冻干燥机,美国Virtis公司;超声波细胞破碎仪,美国BRANSON公司;1260 Infinity Ⅱ高效液相色谱系统,美国安捷伦科技公司;Optilab T-rEX多角度激光光散射检测器、ViscoStar Ⅲ黏度检测器、DAWN HELEOS示差折光检测器,美国怀雅特技术公司;752型紫外可见分光光度计,上海光谱仪器有限公司;ICS-5000+离子色谱仪,美国Thermo公司。
1.3 实验方法
1.3.1 PGP的制备
将原桃胶高速粉碎后过100目筛,料液比为1∶100(g∶mL)下加入超纯水溶胀过夜。100 ℃热水搅拌浸提6 h,4 500 r/min离心15 min后取上清液后浓缩至原体积的1/6,浓缩液透析48 h(截留分子质量8~14 kDa)后冷冻干燥得到PGP粉末,PGP提取率按公式(1)计算。根据苯酚-硫酸法,以葡萄糖作为标准测定PGP的总糖含量[21];糖醛酸含量通过间羟基联苯法测定[22],以半乳糖醛酸作为标准;多酚含量通过福林酚法测定[23],以没食子酸作为标准;蛋白质含量通过元素分析仪测定,计算方法是氮含量乘6.25[24]。
PGP提取率![]()
(1)
式中:m1,PGP粉末质量,g;m2,原桃胶粉质量,g。
1.3.2 PGP的超声波降解
实验采用20 kHz超声波频率,配置6 mm直径探头,探头浸入深度为2 cm,脉冲模式设置为5 s工作周期与5 s间歇周期交替运行。多糖溶液体积为40 mL,用体积为50 mL圆底离心管为反应容器进行超声波处理,首先分析超声波时间(1、2、3、4、5、8、10、15、20、25、30 min)对多糖重均分子质量(molecular mass,Mw)影响,进一步探讨多糖质量浓度(2、5、10、20、30 mg/mL)和超声波振幅(10%、20%、30%、40%、50%)的影响,并探究不同多糖质量浓度、超声波振幅下PGP的降解动力学。
1.3.3 SEC分析
采用SEC串联多角度激光光散射器(multi-angle laser light scattering detector,MALLS)、差压式黏度检测器(differential pressure viscosity detector,DP)和示差检测器(refractive index detector,RID)来分析样品的重均分子质量、特性黏度和多分散性等参数[25]。
色谱柱:OHpak SB-803HQ(8.0 mm×300 mm)和 OHpak SB-805HQ(8.0 mm×300 mm)串联;流动相0.1 mol/L NaNO3溶液;流速0.6 mL/min;柱温40 ℃;样品配制:用流动相配成1 mg/mL溶液,过三次0.22 μm水相滤头后备用;进样量100 μL;数据采集与分析:ASTRA 7.1.3 软件,并基于zimm-plot算分子参数,其中dn/dc值设置为0.145 mL/g。
1.3.4 降解动力学
PGP在不同超声波处理下的行为由零阶、一阶和二阶反应动力学模型描述,降解速率常数(k)由公式(2)~公式(4)推导[26-27]:
M0-Mt=k0t
(2)
ln(MO/Mt)=k1t
(3)
1/Mt-1/Mt=k2t
(4)
式中:k0,零阶动力学速率常数,kDa/min;k1,一阶动力学速率常数,1/min;k2,二阶动力学速率常数,1/(kDa·min);t,超声波时间,min;Mt和M0分别是时间t和时间0的Mw,kDa。
1.3.5 单糖组成分析
样品的单糖组成使用ICS-5000+离子色谱仪进行检测[2]。首先称取10 mg样品于密封玻璃瓶中,冰水浴下加入1 mL 12 mol/L浓H2SO4溶液,室温搅拌水解30 min,再缓慢加水将H2SO4溶液稀释至2 mol/L,混匀后于100 ℃油浴中水解2 h。取出迅速冷却,水解液稀释50~100倍,用0.22 μm水相滤膜过滤3次注入液相小瓶后进样分析。采用Fuc、Ara、Gal、Glc、Xyl、Man、GalA、GlcA等标准品进行定性和定量分析。
色谱柱:CarboPacTM PA20 (3 mm×150 mm);流动相:A相是超纯水,B相是250 mmol/L NaOH溶液,C相是1 mol/L NaOAc溶液,D相是200 mmol/L NaOH溶液,进行梯度洗脱,洗脱程序参照张宏媛等[28];数据采集与分析:Chromeleon 7软件。
1.3.6 数据处理
所有实验3次平行测定,结果表示为“平均值±标准差”。使用SPSS软件进行差异显著性和方差分析(P<0.05,差异显著),通过Origin 2021进行图表绘制。
2 结果与分析
2.1 PGP的化学组成分析
通过热水提取结合透析纯化,从原桃胶中得到了桃胶多糖,提取率为85.47%(质量分数)。化学成分分析表明,PGP总糖含量为91.33%,糖醛酸含量为8.38%,蛋白质含量为0.53%,多酚含量为0.22%,这表示PGP是一种结合有少量蛋白质和多酚的酸性多糖,其基本组成与DING等[1]研究黄桃胶多糖含有96.30%总糖、8.71%糖醛酸、0.11%蛋白质和0.23%多酚含量略有差异,这可能与原料来源有关系,刘路弘[29]研究也表明,不同桃树来源的桃胶,其多糖和总黄酮含量不同,其中不同桃树来源的PGP其多糖含量顺序为油桃(73.88%)>蟠桃(72.94%)>普通桃(72.11%)>油蟠桃(68.84%),而总黄酮含量顺序为油桃(0.83%)>油蟠桃(0.76%)>普通桃(0.57%)>蟠桃(0.46%)
2.2 不同超声波条件对PGP降解效果的影响
2.2.1 超声波时间对PGP分子质量的影响
超声波时间的长短直接影响多糖降解效果,其对PGP分子质量的影响如图1所示。采用SEC-MALLS分析了多糖的分子参数,在质量浓度5 mg/mL、振幅30%时,延长超声波时间导致多糖峰洗脱时间后移(图1-a),表明分子质量降低。具体而言,如图1-b所示,可知PGP的分子质量随超声波时间呈现阶段性下降趋势,在0~2 min内分子质量快速下降,2~5 min内下降速率逐步减慢,5~10 min内降幅进一步减小,而在10~30 min内分子质量趋于稳定。PGP在2 min内可能是多糖分子聚集体的降解,空化效应产生的剪切力破坏了溶液中多糖分子的聚集体,随着超声波时间的增加,多糖链或糖苷键被破坏,而不是解聚。YAN等[17]也发现羧酸化可得然多糖经超声波后,分子质量随超声波时间增加而快速下降,90 min后趋于稳定。基于上述超声波时间对PGP分子质量的阶段性影响,进一步选取1、2、5、10、20、30 min作为关键时间节点,系统研究多糖质量浓度和超声波振幅对PGP分子质量的影响。
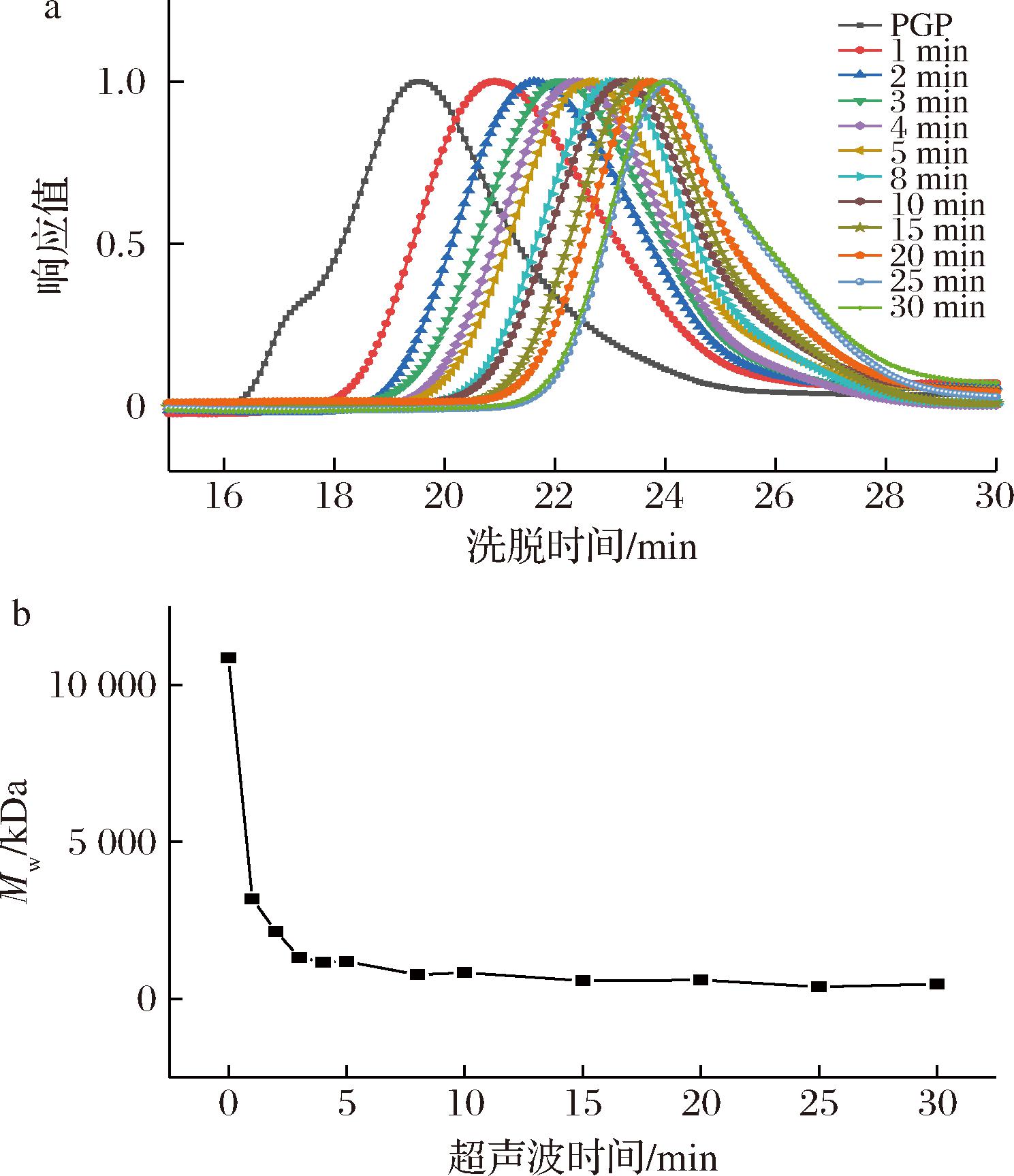
a-SEC谱图(DRI信号);b-分子质量变化趋势图
图1 超声波时间对PGP分子质量的影响
Fig.1 Effect of ultrasonic time on molecular weight of PGP
2.2.2 多糖质量浓度对PGP分子质量的影响
多糖质量浓度的大小会影响超声波传播速度、空化效应强弱等,从而影响超声波处理效果,多糖质量浓度对PGP分子质量的影响如图2所示。与未处理的PGP相比,低浓度多糖样品的洗脱峰出峰时间显著延后(图2-a~图2-f)。随着超声波处理时间的延长(0~10 min),出峰时间差异逐渐增大;但当超声波时间达到10 min后,不同质量浓度组间的出峰时间趋于接近。如图2-g所示,在不同质量浓度下,PGP分子质量随时间变化的趋势一致,10 min内,质量浓度越低,多糖的分子质量降低程度越低,10 min后,10 mg/mL质量浓度组的降解产物分子质量最低。造成此现象的原因可能是超声波的空化效应需要一定的介质浓度来传递能量,质量浓度过低,随着时间的延长,空化效应不足以有效破坏多糖,而质量浓度过高,溶液越黏稠,影响溶剂和聚合物间能量传递,降解效果降低[30]。

a-超声波1 min下SEC谱图;b-超声波2 min下SEC谱图;c-超声波5 min下SEC谱图;d-超声波10 min下SEC谱图;e-超声波20 min下SEC谱图;f-超声波30 min下SEC谱图(DRI信号);g-分子质量变化趋势图
图2 多糖质量浓度对PGP分子质量的影响
Fig.2 Effect of polysaccharide concentration on PGP molecular mass
2.2.3 超声波振幅对PGP分子质量的影响
超声波振幅决定了波能的强度,进一步影响多糖降解效果,其对PGP分子质量的影响如图3所示。与未处理PGP相比,超声波振幅的增加会显著延迟洗脱峰的出峰时间(图3-a~图3-f)。随着超声波处理时间的延长,这种由振幅引起的出峰时间差异进一步扩大。如图3-g所示,PGP的分子质量随振幅的增加而逐渐降低,低振幅10%下PGP降解效果不明显,而更高的振幅有助于多糖的降解。这归因于超声波振幅越大,超声波空化效应和剪切力作用越强,降解作用越强[18]。PGP的降解效果随超声波振幅的增大而逐渐增强,5 min后,30%振幅降解效果与40%、50%振幅逐步接近,表明30%振幅足以有效降解PGP。

a-超声波1 min下SEC谱图;b-超声波2 min下SEC谱图;c-超声波5 min下SEC谱图;d-超声波10 min下SEC谱图;e-超声波20 min下SEC谱图;f-超声波30 min下SEC谱图(DRI信号);g-分子质量变化趋势图
图3 超声波振幅对PGP分子质量的影响
Fig.3 Effect of ultrasound amplitude on the molecular mass of PGP
2.3 降解动力学分析
在超声波降解多糖过程中,为达到高效可行的目的,需兼顾降解程度与降解效率的调控,动力学参数分析可为降解速率的量化表征提供理论依据。零阶动力学模型描述分子质量随时间线性降低,速率常数k0的单位为kDa/min,表示单位时间内分子质量减少的绝对量,降解速率与分子质量无关;一阶动力学模型描述分子质量呈指数衰减,速率常数k1的单位为1/min,表示单位时间内分子质量的相对减少比例;二阶动力学模型描述分子质量与时间线性相关,速率常数k2的单位[1/(kDa·min)]反映单位时间内分子质量倒数的变化速率。
2.3.1 不同多糖质量浓度下PGP降解动力学分析
采用零阶、一阶和二阶动力学模型对不同质量浓度PGP的降解曲线进行线性拟合(图4-a~图4-c),根据模型特性,拟合直线的斜率对应PGP的降解速率,各模型的拟合系数(R2)及动力学速率常数(k)详见表1。如表1所示,二阶动力学模型的拟合系数(R2≥0.944)高于零阶(R2≥0.584)和一阶模型(R2≥0.792),因此二阶动力学模型最适合描述PGP的降解过程。PGP降解速率随质量浓度的增加呈先上升后下降趋势,在质量浓度10 mg/mL时,达到最大降解速率5.317×10-5[1/(kDa·min)],表明每分钟内分子质量的倒数降低5.317×10-5 (kDa)-1。当浓度过高或过低时,反应速率常数均有不同程度的降低,这可能由于较高浓度下,分子间缠结影响溶剂与聚合物间能量传递,降解速率降低[30];而质量浓度过低时,溶质分子少,超声波空化效应作用机会少[31]。因此,这一浓度下,超声能量能高效传递至分子链,实现多糖分子链断裂效率的最大化。
表1 拟合不同质量浓度下PGP溶液的动力学速率常数及相应的分子质量变化决定系数
Table 1 Fitting kinetic rate constant and corresponding determination coefficient of molecular mass change of PGP solution at different concentrations
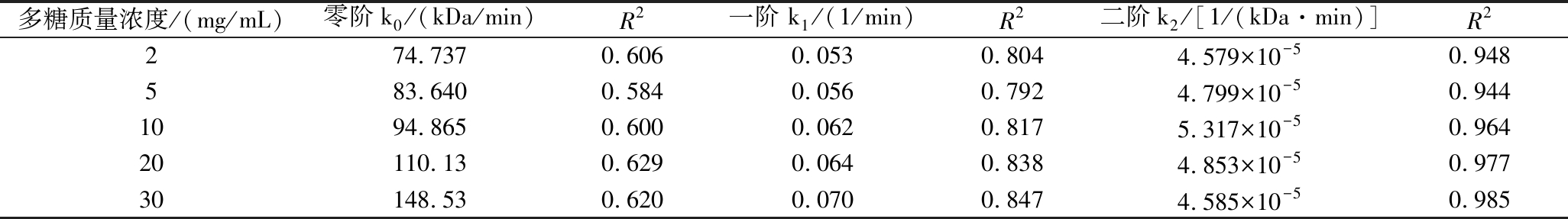
多糖质量浓度/(mg/mL)零阶k0/(kDa/min)R2一阶 k1/(1/min)R2二阶k2/[1/(kDa·min)]R2274.7370.6060.0530.8044.579×10-50.948583.6400.5840.0560.7924.799×10-50.9441094.8650.6000.0620.8175.317×10-50.96420110.130.6290.0640.8384.853×10-50.97730148.530.6200.0700.8474.585×10-50.985
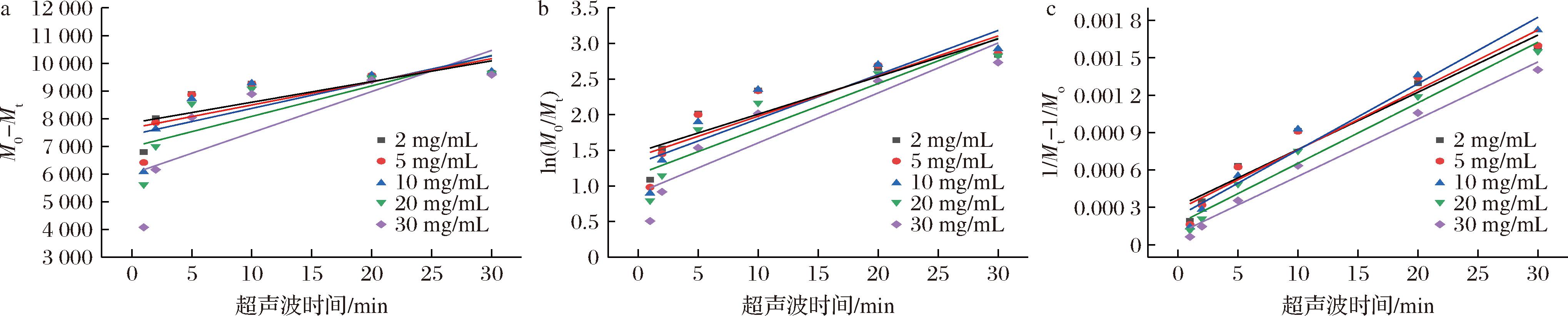
a-零阶动力学模型;b-一阶动力学模型;c-二阶动力学模型
图4 不同多糖质量浓度下PGP降解动力学曲线
Fig.4 Kinetic curves of PGP degradation under different polysaccharide concentrations
2.3.2 不同超声波振幅下PGP降解动力学分析
如图5-a~图5-c所示,分别为不同超声波振幅下PGP的零阶、一阶和二阶动力学线性拟合曲线,其拟合系数(R2)及动力学速率常数(k)详见表2。同样,二阶动力学模型的R2较高,更适合拟合不同超声波振幅下PGP的降解过程。当超声波振幅从10%增加到50%时,反应速率常数k2从2.205×10-5显著增加至5.389×10-5[1/(kDa·min)]。随着超声波振幅的增加,PGP的降解速率首先迅速增加(10%~30%),然后缓慢增加(30%~50%),这表明30%振幅足以降解PGP,考虑到实际应用中的仪器损耗,可选用30%振幅达到效率-能耗的平衡。PGP的降解速率随超声波振幅增加而升高。XIAO等[27]研究也发现,金针菇多糖的超声波降解行为符合二阶动力学模型,其降解速率随超声波强度增加呈先迅速上升后缓慢增长趋势。
表2 拟合不同超声波振幅下PGP溶液的动力学速率常数及相应的分子质量变化决定系数
Table 2 Fitting kinetic rate constant and corresponding determination coefficient of PGP solution molecular mass change under different ultrasonic amplitudes
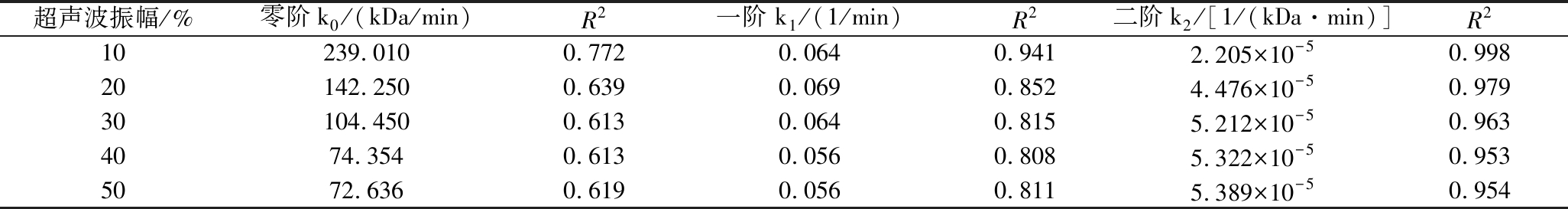
超声波振幅/%零阶k0/(kDa/min)R2一阶 k1/(1/min)R2二阶k2/[1/(kDa·min)]R210239.0100.7720.0640.9412.205×10-50.99820142.2500.6390.0690.8524.476×10-50.97930104.4500.6130.0640.8155.212×10-50.9634074.3540.6130.0560.8085.322×10-50.9535072.6360.6190.0560.8115.389×10-50.954
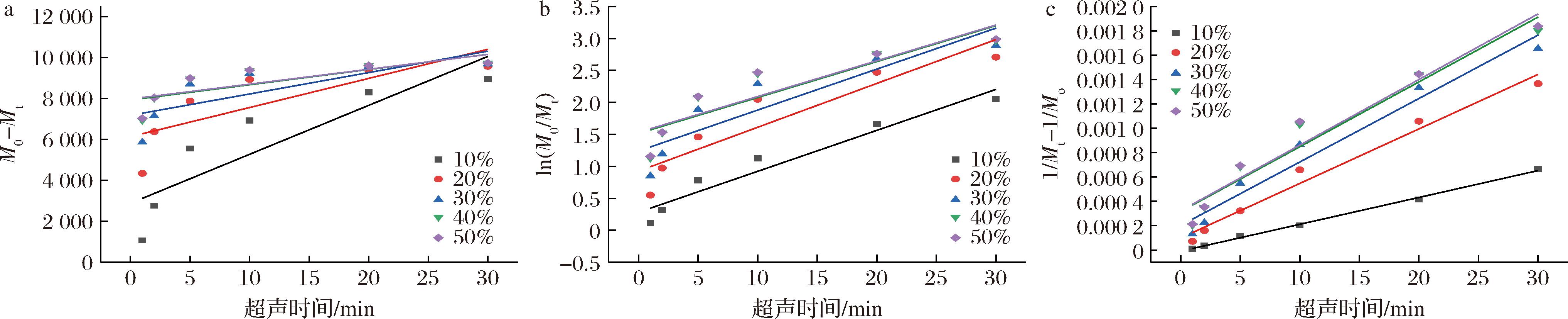
a-零阶动力学模型;b-一阶动力学模型;c-二阶动力学模型
图5 不同超声振幅下PGP降解动力学曲线
Fig.5 Kinetic curves of PGP degradation under different ultrasonic amplitude
根据以上结果,可知PGP降解速率主要取决于处理时间、多糖质量浓度和超声波振幅[32]。在PGP质量浓度10 mg/mL和超声波振幅30%下,分别超声波1、2、5、10、20、30 min,获取不同桃胶降解组分(ultrasonic peach gum polysaccharides,UPGPs)来研究超声波对PGP结构的影响,并分别命名为UP1、UP2、UP5、UP10、UP20和UP30。
2.4 超声波对PGP结构的影响
2.4.1 分子参数及构象特征
超声波对PGP分子参数的影响见图6,PGP与UPGPs的色谱图均为单一洗脱峰,随着超声波时间的增加,降解产物的洗脱峰保留时间延后。超声波前后多糖的具体分子参数见表3,PGP的重均分子质量(Mw)为10 880 kDa,数均分子质量(number-average molecular mass,Mn)为5 423 kDa,多分散系数(polydispersion coefficient,PDI)为2.006,特性黏度[η]为1.83 dL/g,均方回旋半径(mean square radius of rotation,Rg)为331.4 nm,流体力学半径(fluid mechanics radius,Rh)为117.8 nm,这些结果表明PGP是高分子质量聚合物。PDI是表征高分子的分子质量分布的参数,超声后多糖PDI从2.006降至1.386,表示PGP从一个宽分布的高分子链向窄分布的分子链变化。[η]为聚合物在溶液中占据的每单位质量体积,是表征溶液中分子结构的重要参数。超声波前后,PGP的[η]从1.83显著降至0.28,超声波后多糖链长缩短,分子间聚集性减弱[28]。多糖的Rh和Rg在超声波处理后均有下降,表明其在水溶液中的聚集状态被破坏。研究表明,多种物理化学方法均可有效消除多糖溶液聚集现象,其中超声波、加热可部分降解多糖[33]。
表3 PGP和降解组分的分子质量及分子参数
Table 3 Molecular weight and parameters of PGP and degradation components
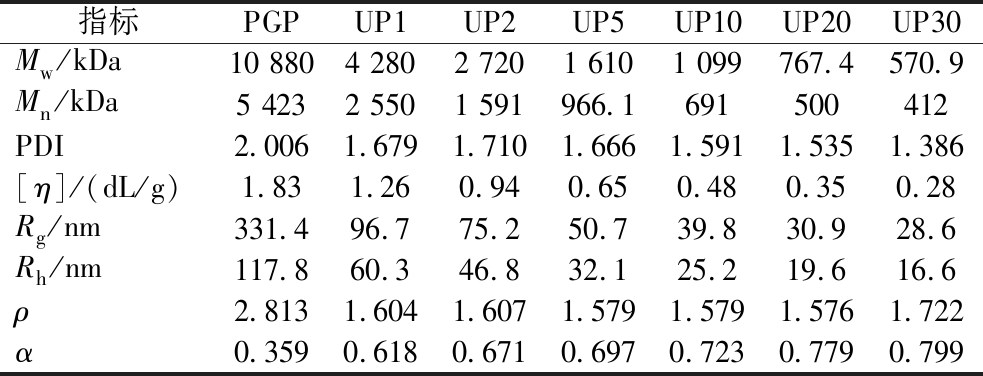
指标PGPUP1UP2UP5UP10UP20UP30Mw/kDa10 8804 2802 7201 6101 099767.4570.9Mn/kDa5 4232 5501 591966.1691500412PDI2.0061.6791.7101.6661.5911.5351.386[η]/(dL/g)1.831.260.940.650.480.350.28Rg/nm331.496.775.250.739.830.928.6Rh/nm117.860.346.832.125.219.616.6ρ2.8131.6041.6071.5791.5791.5761.722α0.3590.6180.6710.6970.7230.7790.799
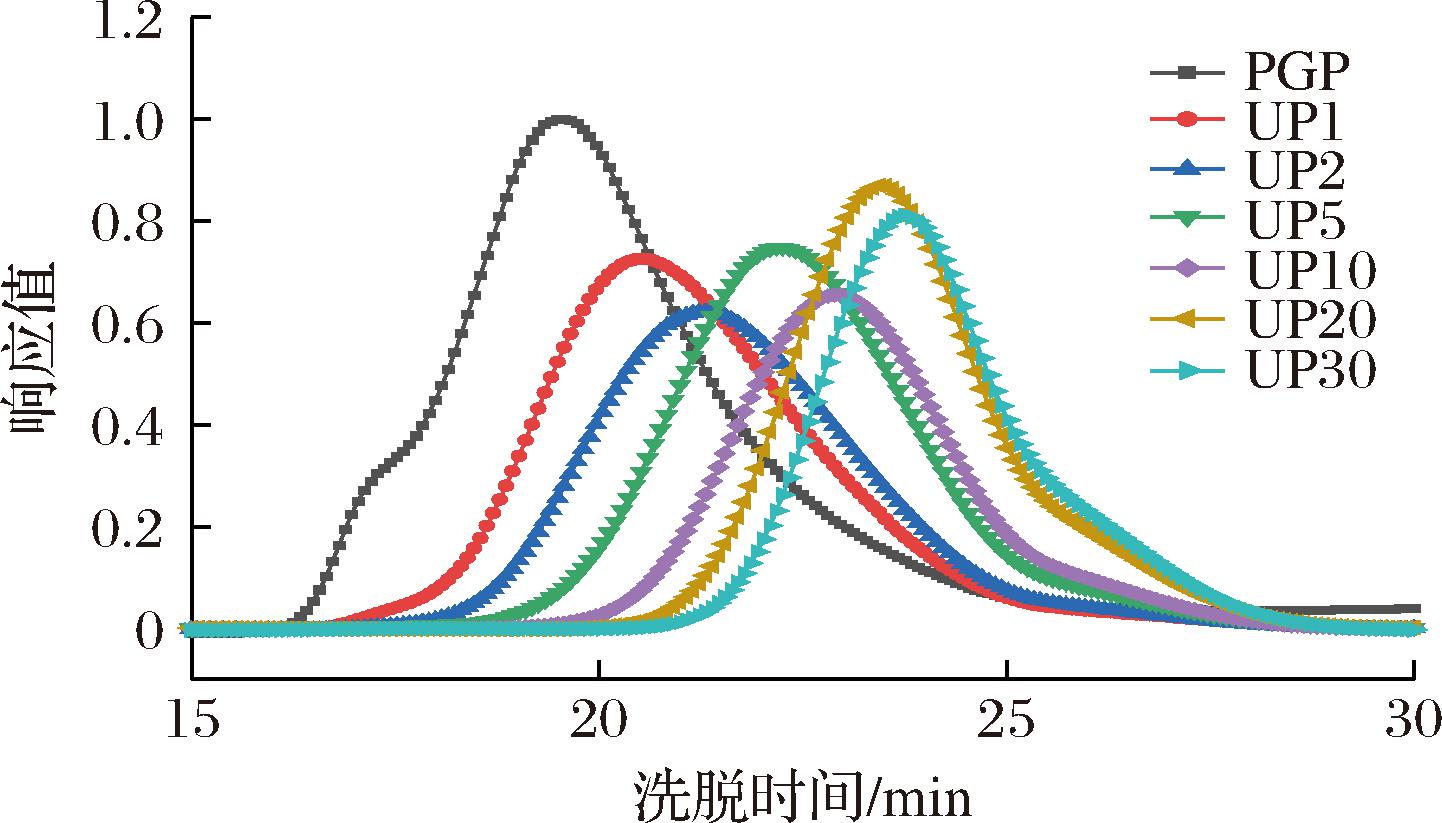
图6 PGP与降解组分的分子排阻色谱
Fig.6 Molecular exclusion chromatography of PGP and degraded components
根据Mark-Houwink方程([η]=kMwɑ)构建Mw和[η]的关系,可判断聚合物分子链在溶液中的构象特征,当α<0.5时,表明聚合物为球形结构;当α在0.5~0.8,为无规线团;当α在0.8~2,为刚性棒状结构[34]。在0.1 mol/L NaNO3溶液中,PGP的α值为0.359,是一种球形结构,与前期研究一致[2],PGP是一种紧凑球形构象。通过结构参数ρ(ρ=Rg/Rh)进一步表征多糖构象,当ρ值为0.775时对应球形构象,1.5~1.8对应无规线团构象[35];ρ>2,为高支化结构,ρ≫2,为刚性链[36]。PGP的ρ值为2.813,属于高支化结构,超声波后多糖ρ值均介于1.5~1.8,为无规线团构象。超声波后,PGP从高支化的球形构象向无规线团转变,可能是超声波产生的机械剪切力破坏了分子间氢键,打断了多糖聚集状态,球形结构被改变。车前子多糖经超声波后溶液构象也发生显著变化,从高度支化的拓扑结构转变为无序的线团形态[36]。
2.4.2 单糖组成
为了进一步明确超声波前后PGP的结构变化,采用ICS-5000+离子色谱仪对其进行单糖组成分析。结果表明(图7和表4):PGP主要由Ara(40.85%)、Gal(36.98%)、Xyl(13.90%)、GalA(6.31%)和GlcA(1.95%)组成,与我们之前研究略有不同[1],这可能是测定方法不同所致,但Ara和Gal仍然是PGP主要单糖成分,表明PGP是一类阿拉伯半乳聚糖类多糖。超声波处理后UPGPs表现出与PGP相同的单糖种类,其含量比例变化无显著差异。这表明超声波降解PGP时,打断和破坏了多糖主链[37],但对支链分布无显著影响,因此超声波处理前后单糖组成比例相对稳定。前期研究也发现桑黄菌丝体多糖和马尾藻多糖超声波后单糖组成类型也未改变,含量无显著变化[38-39]。
表4 PGP和降解组分的单糖组成
Table 4 Monosaccharide composition of PGP and degradation components
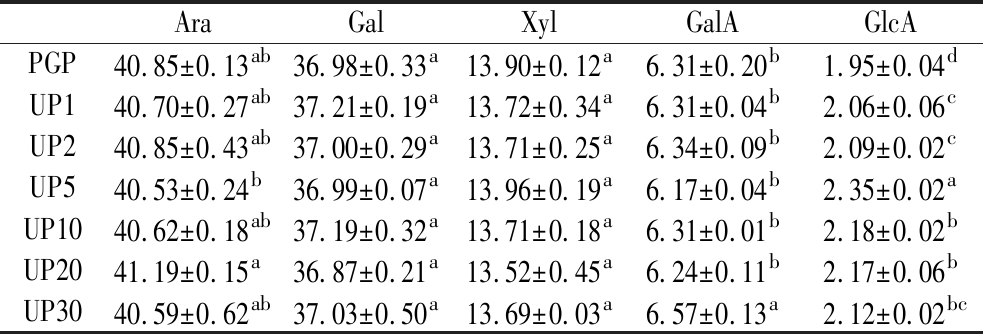
AraGalXylGalAGlcAPGP40.85±0.13ab36.98±0.33a13.90±0.12a6.31±0.20b1.95±0.04dUP140.70±0.27ab37.21±0.19a13.72±0.34a6.31±0.04b2.06±0.06cUP240.85±0.43ab37.00±0.29a13.71±0.25a6.34±0.09b2.09±0.02cUP540.53±0.24b36.99±0.07a13.96±0.19a6.17±0.04b2.35±0.02aUP1040.62±0.18ab37.19±0.32a13.71±0.18a6.31±0.01b2.18±0.02bUP2041.19±0.15a36.87±0.21a13.52±0.45a6.24±0.11b2.17±0.06bUP3040.59±0.62ab37.03±0.50a13.69±0.03a6.57±0.13a2.12±0.02bc
注:不同小写字母表示差异显著(P<0.05)。
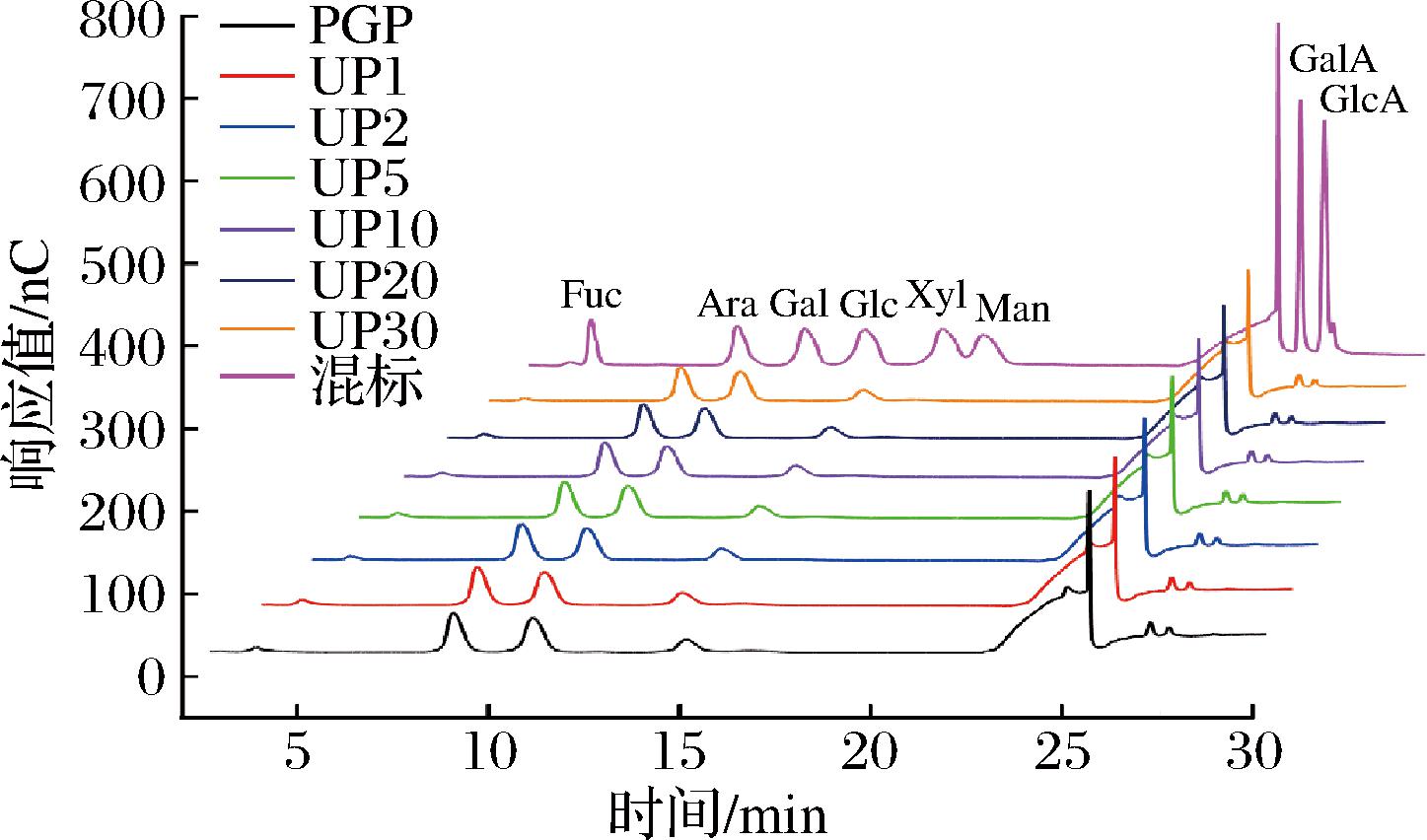
图7 PGP与降解组分离子色谱图
Fig.7 Ion chromatogram of PGP and degradation components
3 结论
本文通过热水提取结合透析纯化,从原桃胶中制备了纯多糖PGP。采用超声波技术对PGP进行降解处理,系统考察了超声波时间、多糖质量浓度和超声波振幅对降解效果的影响规律,并深入分析了降解动力学特性及结构变化特征。结果表明,超声波降解PGP时,随着处理时间的增加,分子质量先迅速下降后缓慢降低;多糖质量浓度和超声波振幅研究表明,低质量浓度下PGP降解效果明显,10 min后,质量浓度10 mg/mL下分子质量降低程度更大,高振幅促进多糖分子质量的降低。动力学分析表明,超声波降解PGP符合二级动力学方程(1/Mt-1/M0=kt),PGP的降解速率随多糖质量浓度的增加先升高再降低,在质量浓度10 mg/mL时,最大反应速率常数为5.317×10-5 (kDa)-1/min,同时,PGP的降解速率随超声波振幅的增加先快速增加(10%~30%)再缓慢增加(30%~50%),振幅30%下足以高效降解PGP。此外通过分子参数、溶液构象和单糖组成发现,超声波处理降解了PGP主链,使分子质量分布变窄,溶液构象从高支化球形结构转变为无规线团。该研究为超声波提取技术优化及多糖分子改性提供理论参考,为后续深入研究奠定基础,从而推动PGP的高值化开发利用。
[1] DING J, ZHANG H, TIAN Y J, et al.Rheological properties of Prunus persica exudate:Potential effects of proteins and polyphenols[J].International Journal of Biological Macromolecules, 2019, 133:831-838.
[2] ZHANG H, LI C C, DING J, et al.Structural features and emulsifying stability of a highly branched Arabinogalactan from immature peach (Prunus persica) exudates[J].Food Hydrocolloids, 2020, 104:105721.
[3] KARDO OV
OV A, ROS
A, ROS K J, KUBALA J.Utilization of degraded peach gum polysaccharide by Aspergillus flavus[J].Phytochemistry, 1975, 14(2):341-343.
K J, KUBALA J.Utilization of degraded peach gum polysaccharide by Aspergillus flavus[J].Phytochemistry, 1975, 14(2):341-343.
[4] YAO X C, CAO Y, WU S J.Antioxidant activity and antibacterial activity of peach gum derived oligosaccharides[J].International Journal of Biological Macromolecules, 2013, 62:1-3.
[5] CHEN J X, BI J F, LI J Y, et al.Understanding the two-stage degradation process of peach gum polysaccharide within ultrasonic field[J].Food Chemistry, 2024, 451:139397.
[6] CHEN J X, ZHOU M, LIU M, et al.Physicochemical, rheological properties and in vitro hypoglycemic activities of polysaccharide fractions from peach gum[J].Carbohydrate Polymers, 2022, 296:119954.
[7] ZENG S H, LONG J W, SUN J H, et al.A review on peach gum polysaccharide:Hydrolysis, structure, properties and applications[J].Carbohydrate Polymers, 2022, 279:119015.
[8] 高帆, 苏洁, 周衡朴, 等.桃胶多糖对便秘模型小鼠的改善作用研究[J].食品与发酵工业, 2024, 50(19):40-48.
GAO F, SU J, ZHOU H P, et al.Improving effect of peach gum polysaccharide on constipation model mice[J].Food and Fermentation Industries, 2024, 50(19):40-48.
[9] XU B, SUN P, LU J, et al.Studies of peach gum polysaccharide on gut microbiota in vitro fermentation by human feces[J].Journal of Future Foods, 2025, 5(1):79-87.
[10] HU J L, NIE S P, LI C, et al.Ultrasonic irradiation induces degradation and improves prebiotic properties of polysaccharide from seeds of Plantago asiatica L.during in vitro fermentation by human fecal microbiota[J].Food Hydrocolloids, 2018, 76:60-66.
[11] ZHENG X, LU F Z, XU X J, et al.Extended chain conformation of β-glucan and its effect on antitumor activity[J].Journal of Materials Chemistry B, 2017, 5(28):5623-5631.
[12] LIU H, BAO J G, DU Y M, et al.Effect of ultrasonic treatment on the biochemphysical properties of chitosan[J].Carbohydrate Polymers, 2006, 64(4):553-559.
[13] YANG M, TAO L, WANG Z L, et al.The mechanism of peach gum polysaccharide preventing UVB-induced skin photoaging by regulating matrix metalloproteinanse and oxidative factors[J].Molecules, 2023, 28(10):4104.
[14] 张入元. 桃胶多糖的制备及其在乳液稳定中的应用[D].杭州:浙江大学, 2023.
ZHANG R Y.Preparation of peach gum polysaccharide and its application in emulsion stabilization[D].Hangzhou:Zhejiang University, 2023.
[15] ASHOKKUMAR M.The characterization of acoustic cavitation bubbles-An overview[J].Ultrasonics Sonochemistry, 2011, 18(4):864-872.
[16] YANG L Q, ZHANG L M.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers, 2009, 76(3):349-361.
[17] YAN J K, PEI J J, MA H L, et al.Effects of ultrasound on molecular properties, structure, chain conformation and degradation kinetics of carboxylic curdlan[J].Carbohydrate Polymers, 2015, 121:64-70.
[18] TECSON M G, ABAD L V, EBAJO V D, et al.Ultrasound-assisted depolymerization of kappa-carrageenan and characterization of degradation product[J].Ultrasonics Sonochemistry, 2021, 73:105540.
[19] ZHANG L F, ZHANG X Z, LIU D H, et al.Effect of degradation methods on the structural properties of Citrus pectin[J].LWT-Food Science and Technology, 2015, 61(2):630-637.
[20] 肖金容. 金针菇多糖超声改性研究及其对乙醇损伤的人胃黏膜细胞保护作用[D].南京:南京农业大学, 2022.
XIAO J R.Ultrasonic Modification of flammulina velutipes polysaccharide and its protective effect on human gastric epithelial cells injured by ethanol[D].Nanjing:Nanjing Agricultural University, 2022.
[21] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[22] BLUMENKRANTZ N, ASBOE-HANSEN G.New method for quantitative determination of uronic acids[J].Analytical Biochemistry, 1973, 54(2):484-489.
[23] FAN M H, ZHU J X, QIAN Y L, et al.Effect of purity of tea polysaccharides on its antioxidant and hypoglycemic activities[J].Journal of Food Biochemistry, 2020, 44(8):e13277.
[24] SRIPERM N, PESTI G M, TILLMAN P B.Evaluation of the fixed nitrogen-to-protein (N∶P) conversion factor (6.25) versus ingredient specific N∶P conversion factors in feedstuffs[J].Journal of the Science of Food and Agriculture, 2011, 91(7):1182-1186.
[25] ZHANG H, LI C C, LAI P F H, et al.Fractionation, chemical characterization and immunostimulatory activity of β-glucan and galactoglucan from Russula vinosa Lindblad[J].Carbohydrate Polymers, 2021, 256:117559.
[26] YANG H H, BAI J W, MA C L, et al.Degradation models, structure, rheological properties and protective effects on erythrocyte hemolysis of the polysaccharides from Ribes nigrum L[J].International Journal of Biological Macromolecules, 2020, 165:738-746.
[27] XIAO J R, CHEN X, ZHAN Q P, et al.Effects of ultrasound on the degradation kinetics, physicochemical properties and prebiotic activity of Flammulina velutipes polysaccharide[J].Ultrasonics Sonochemistry, 2022, 82:105901.
[28] 张宏媛, 钱佳俊, 李哲远, 等.部分酸水解对桃胶多糖结构和乳化功能的影响[J].食品科学, 2023, 44(4):99-106.
ZHANG H Y, QIAN J J, LI Z Y, et al.Effect of partial acid hydrolysis on the structure and emulsifying function of peach gum polysaccharide[J].Food Science, 2023, 44(4):99-106.
[29] 刘路弘. 江苏桃流胶情况调查及桃胶营养成分分析[D].南京:南京农业大学, 2020.
LIU L H.Study on the peach gummosis and the nutritional compounds of peach gum in Jiangsu province[D].Nanjing:Nanjing Agricultural University, 2020.
[30] MOHOD A V, GOGATE P R.Ultrasonic degradation of polymers:Effect of operating parameters and intensification using additives for carboxymethyl cellulose (CMC) and polyvinyl alcohol (PVA)[J].Ultrasonics Sonochemistry, 2011, 18(3):727-734.
[31] ANTTI G, PENTTI P, HANNA K.Ultrasonic degradation of aqueous carboxymethylcellulose:Effect of viscosity, molecular mass, and concentration[J].Ultrasonics Sonochemistry, 2008, 15(4):644-648.
[32] BASEDOW A M, EBERT K H.Ultrasonic degradation of polymers in solution[C].Physical Chemistry.Berlin, Heidelberg:Springer Berlin Heidelberg, 1977:83-148.
[33] GUO Q B, WANG Q, CUI S W, et al.Conformational properties of high molecular weight heteropolysaccharide isolated from seeds of Artemisia sphaerocephala Krasch[J].Food Hydrocolloids, 2013, 32(1):155-161.
[34] 干鸿翔, 杨笑妮, 谢凡, 等.脐橙皮果胶的提取、结构特征及流变特性[J].食品与发酵工业, 2025, 51(7):276-285.
GAN H X, YANG X N, XIE F, et al.Extraction, structural characterization and rheological properties of pectin from navel orange peels[J].Food and Fermentation Industries, 2025, 51(7):276-285.
[35] QIU W Y, CAI W D, WANG M, et al.Effect of ultrasonic intensity on the conformational changes in Citrus pectin under ultrasonic processing[J].Food Chemistry, 2019, 297:125021.
[36] 夏强, 黄丹菲, 余强, 等.超声解聚对大粒车前子多糖流变性质、溶液构象及活性的影响[J].食品工业科技, 2016, 37(17):80-85.
XIA Q, HUANG D F, YU Q, et al.Effects of ultrasonic depolymerization on the rheological property, solution conformation and activities of polysaccharides isolated from the seeds of Plantago asiatica L.[J].Science and Technology of Food Industry, 2016, 37(17):80-85.
[37] PU Y Y, ZOU Q S, HOU D Z, et al.Molecular weight kinetics and chain scission models for dextran polymers during ultrasonic degradation[J].Carbohydrate Polymers, 2017, 156:71-76.
[38] YAN J K, WANG Y Y, MA H L, et al.Ultrasonic effects on the degradation kinetics, preliminary characterization and antioxidant activities of polysaccharides from Phellinus linteus mycelia[J].Ultrasonics Sonochemistry, 2016, 29:251-257.
[39] YUAN D, LI C, HUANG Q, et al.Ultrasonic degradation effects on the physicochemical, rheological and antioxidant properties of polysaccharide from Sargassum pallidum[J].Carbohydrate Polymers, 2020, 239:116230.