百里香酚(2-异丙基-5-甲基苯酚),归类于单萜酚类化合物,主要分布于唇形科类植物中。作为美国食品药品监督管理局(Food and Drug Administration,FDA)认定的安全物质(Generally Recognized as Safe,GRAS),其应用具有可靠的法规依据[1]。研究表明,百里香酚具有多重生物活性,如显著的抗氧化性、抗炎性以及广谱抗菌性,因而可作为天然防腐剂、功能添加剂和抗菌剂广泛应用于食品、化妆品及医药等领域[2]。特别是在食品保鲜方面,百里香酚可通过抑制脂质氧化降解和病原菌增殖,从而实现对食品品质的保护。然而,百里香酚易挥发、气味刺激、水溶性差等特性严重限制了其在食品包装领域的实际应用。因此,开发有效的封装技术以提高百里香酚的稳定性和适用性,已成为食品活性包装领域亟待解决的关键问题。
微胶囊化是一种利用壁材包埋固体、液体或气体芯材的封装方法[3]。该技术利用壁材形成的屏障将芯材与外界环境隔离,从而实现对芯材的保护。研究表明,微胶囊化不仅能显著提高精油的稳定性,减少挥发损失,还能增强其抗氧化能力,同时改善其风味特性,避免与食品直接接触时的不良反应[4]。因此,微胶囊化被认为是保护百里香酚等热敏活性成分的有效策略。目前,常用的壁材有阿拉伯胶、琼脂、蛋白质和环糊精等。其中,β-环糊精因其成本低廉、安全性高和生物相容性好等特点,已成为全球广泛关注的壁材。例如,黎汉清等[5]以β-环糊精制备丁香精油微胶囊,成功将草莓的货架期延长了2 d。YUE等[6]通过响应面法优化了茶树油/β-环糊精微胶囊的制备工艺,在最佳工艺条件下所得微胶囊的包埋率高达87.47%。
本研究以百里香酚为芯材,β-环糊精为壁材,采用饱和水溶液法制备微胶囊。采用响应面试验优化微胶囊的制备工艺,并表征微胶囊的理化性质,以探究其结构与性能之间的关系,为其在食品等领域的应用提供理论依据和技术支持。
1 材料与方法
1.1 材料
百里香酚,上海迈瑞尔生化科技有限公司;β-环糊精、无水乙醇、平板计数琼脂、NaCl,国药集团化学试剂有限公司;LB肉汤,上海泰坦科技股份有限公司;DPPH,无锡莱弗思生物实验器材有限公司。
1.2 仪器与设备
UV-1800紫外分光光度计,日本岛津国际贸易公司;NEXUS傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪,美国尼高力公司;Evo18型钨灯丝扫描电子显微镜(scanning electron microscope,SEM),德国卡尔蔡司公司;Q500型热重分析(thermogravimetric analysis,TGA)仪,美国沃特世公司;Bruker D8型X射线衍射(X-ray diffraction,XRD)仪,德国布鲁克AXS有限公司。
1.3 实验方法
1.3.1 微胶囊的制备
参照YING等[7]的方法,稍作修改。称取3 g的β-环糊精溶于50 mL去离子水,在50 ℃的恒温水浴锅中搅拌30 min形成透明溶液。百里香酚与无水乙醇以料液比为1∶10 (g∶mL)配制成百里香酚精油溶液,逐滴缓慢加入到β-环糊精溶液中,继续搅拌2 h。结束后,将溶液放进4 ℃冰箱中冷藏24 h并进行抽滤(使用去离子水和无水乙醇交替冲洗滤渣3次)。最后,将得到的抽滤产物放入45 ℃的真空干燥箱中干燥至恒重。
1.3.2 微胶囊包埋效果的评价
1.3.2.1 百里香酚标准曲线的绘制
称取0.250 g百里香酚至50 mL容量瓶中,用无水乙醇定容,从中分别量取不同体积的百里香酚精油溶液于100 mL的容量瓶中,得到质量浓度分别为20、40、60、80、100、120 mg/mL的百里香酚精油溶液。定容、摇匀后测其在最大吸收波长277 nm处的紫外吸光度值。建立X(百里香酚精油质量浓度)对Y(吸光度)的标准曲线。
1.3.2.2 百里香酚包埋率的测定
称取适量微胶囊,并加入无水乙醇。超声波处理30 min,涡流搅拌10 min,以充分破坏微胶囊结构并释放其中的百里香酚。随后,将混合液以5 000 r/min的速度离心25 min。取上清液并稀释,在277 nm波长处测其吸光值。根据标准曲线计算微胶囊中被包埋的百里香酚的含量。微胶囊对百里香酚的包埋率按公式(1)计算。
包埋率![]()
(1)
式中:m1,微胶囊中百里香酚的质量,g;m2,加入的百里香酚的总质量,g。
1.3.3 微胶囊制备单因素条件的筛选
以包埋率为指标,选择包埋温度、包埋时间和芯壁比为单因素进行试验,以筛选出微胶囊制备工艺的最佳单因素条件。每一水平试验中固定2个因素条件,仅改变另一单因素。其中,相对固定包埋温度、包埋时间、壁芯比分别为:50 ℃、2 h、10。单因素试验水平见表1。
表1 单因素试验水平表
Table 1 Single-factor test level

因素水平包埋温度/℃5055606570包埋时间/h12345壁芯比68101214
1.3.4 响应面优化微胶囊的制备工艺
为了确定微胶囊的最佳包埋条件,在单因素试验结果的基础上,继续采用Box-Behnken设计响应面试验。响应面试验因素水平表见表2。
表2 响应面试验因素水平表
Table 2 Factors and levels of response surface methodology
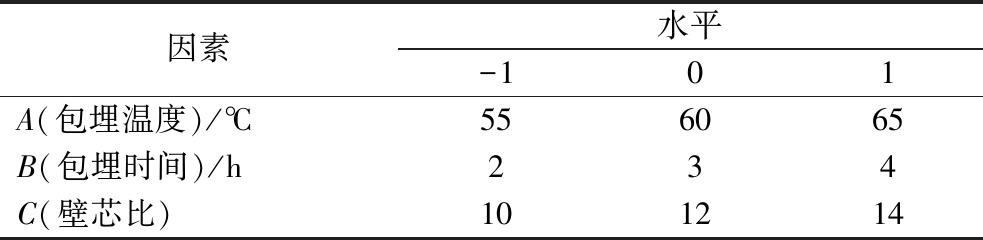
因素水平-101A(包埋温度)/℃556065B(包埋时间)/h234C(壁芯比)101214
1.3.5 验证试验
根据响应面试验优化得到最佳微胶囊包埋条件,进行验证试验,将实际值与理论值进行对比分析,验证模型是否可行。
1.3.6 微胶囊的表征
1.3.6.1 FTIR测试
采用FTIR结合衰减全反射(attenuated total reflection,ATR)技术对β-环糊精、百里香酚和微胶囊的化学结构进行分析。将样品放置在傅里叶红外光谱仪ATR附件的晶体表面,进行红外光谱测试。测试条件设置为:扫描范围4 000~400 cm-1,分辨率4 cm-1,扫描次数32次。
1.3.6.2 XRD测试
将样品均匀平铺于石英载玻片表面,再将其放入样品台中进行测试。测试条件设置为:电压40 kV,电流30 mA,扫描速度5 °/min,2θ为5°~50°。
1.3.6.3 SEM测试
将样品固定在载物台的导电胶上,并进行喷金处理,利用扫描电子显微镜放大并观察其形貌。
1.3.6.4 热重(thermogravimetric,TG)测试
利用TG分析仪测定样品的热稳定性。分别取5~10 mg β-环糊精、百里香酚和微胶囊样品,放置在Al2O3坩埚中进行测试。操作条件设置为:温度范围25~600 ℃;升温速率10 ℃/min;N2流速20 mL/min。
1.3.6.5 微胶囊的缓释性测试
参照付红军等[8]的方法,稍作修改。将百里香酚微胶囊分散于培养皿中,分别放置在4 ℃和25 ℃的避光条件下保存(湿度保持一致)30 d,每隔2 d取相同质量的微胶囊测其百里香酚的含量。微胶囊的释放率按公式(2)计算。
释放率![]()
(2)
式中:mi,第i天百里香酚的含量,mg;m0,微胶囊对百里香酚的总包埋量,mg。
1.3.6.6 DPPH抗氧化测试
参考钟秋夏等[9]的方法,称取一定量的微胶囊与10 mL 0.05 mmol/L的DPPH-乙醇溶液混合,得到质量浓度分别为2、4、6、8、10 mg/mL微胶囊溶液,于25 ℃黑暗条件下反应30 min,并进行离心处理。取上清液测吸光度值。DPPH自由基清除率按公式(3)计算。
DPPH自由基清除率![]()
(3)
式中:A0和Ai分别为DPPH-乙醇溶液和微胶囊溶液在517 nm波长处的吸光度。
1.3.6.7 抗菌性测试
分别选取大肠杆菌、金黄色葡萄球菌为阴性和阳性试验菌,通过菌落计数法对微胶囊的抗菌效果进行测定。分别称取5、10、15 mg的微胶囊粉末并进行紫外灭菌,并与2 mL 106 CFU/mL的菌液混合。将混合体系置于37 ℃恒温摇床中,以150 r/min的转速持续培养5 h。以不含微胶囊的菌液为对照。培养完成后,将各菌液依次稀释为103 CFU/mL,吸取适量的菌液均匀涂布于琼脂平板上。将上述平板置于37 ℃恒温箱中培养24 h后进行计数。抑菌率按公式(4)计算。
抑菌率![]()
(4)
式中:Wt,对照组细菌菌落数;Qt,试验组细菌菌落数。
1.4 数据处理与分析
每组实验平行测定3次,SPSS 26和Origin 2017软件分别用于统计分析及绘图。采用单因素ANOVA检验方法表示数据间的显著性差异,P<0.05为显著。利用Design Expert 13.0进行响应面分析。
2 结果与分析
2.1 微胶囊包埋效果的评价
如图1所示,通过线性拟合得到百里香酚精油浓度(x)与吸光度(y)之间的标准曲线方程:y=0.013 5x-0.179 9,R2=0.993 5,拟合效果良好,可用于测定微胶囊中百里香酚的含量。
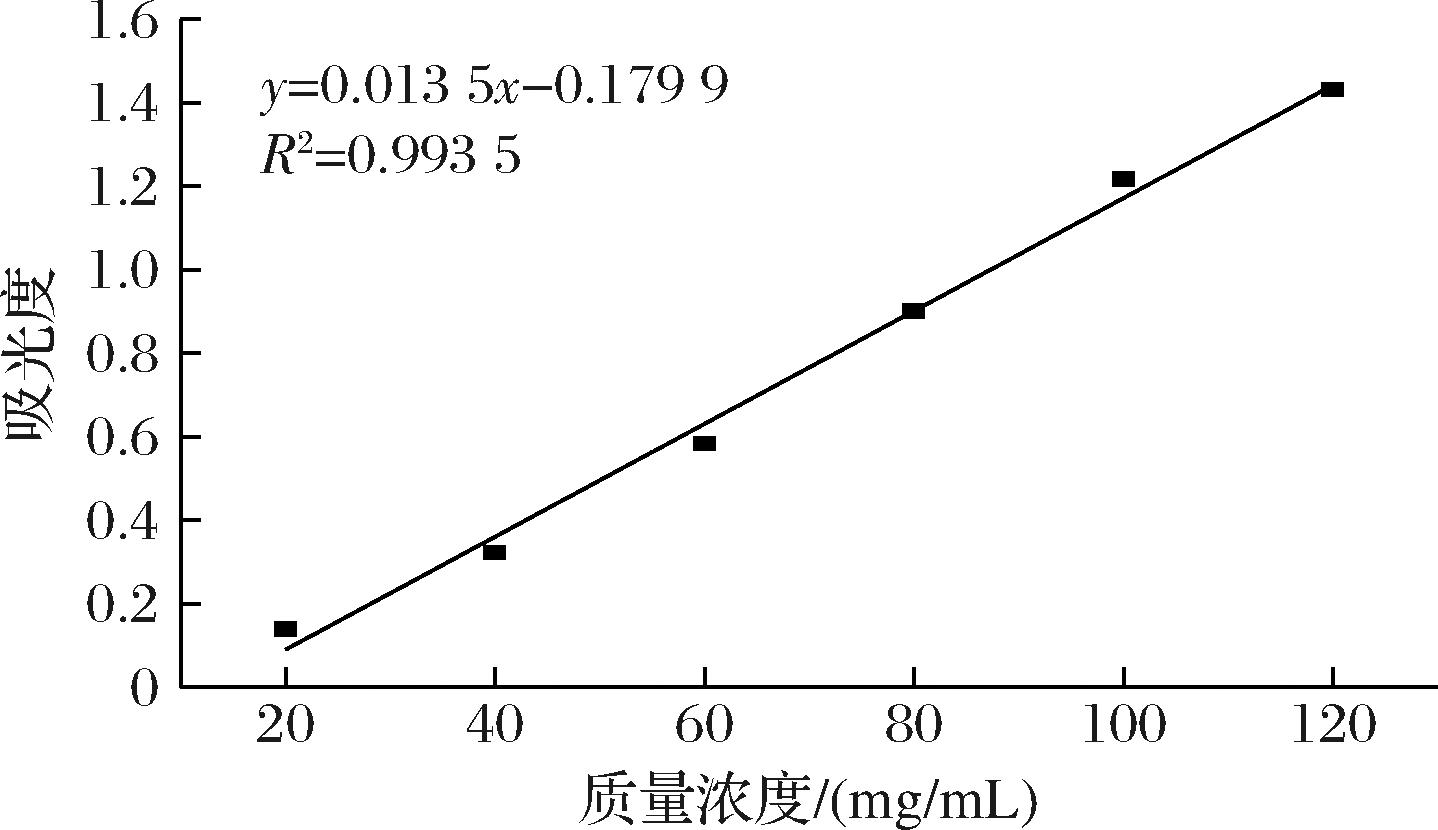
图1 百里香酚的标准曲线
Fig.1 Standard curve of thymol
2.2 单因素试验分析
2.2.1 包埋温度对包埋率的影响
如图2所示,包埋温度对微胶囊的包埋率存在重要影响。随包埋温度的升高,微胶囊的包埋率呈现先上升后下降的变化,影响显著(P<0.05)。当温度达到60 ℃时,包埋率达到最大值70.98%。这可以解释为,随着温度的升高,客体分子运动加剧,有利于向环糊精内腔扩散,包埋率得以提高。但随着温度的继续增加,精油挥发损失,导致包埋率降低。YUE等[6]在研究β-环糊精/茶树油包合物时同样发现,60 ℃时包埋率出现显著峰值(74.44%),与本研究结果相似。因此,选取60 ℃作为包埋的最佳温度。
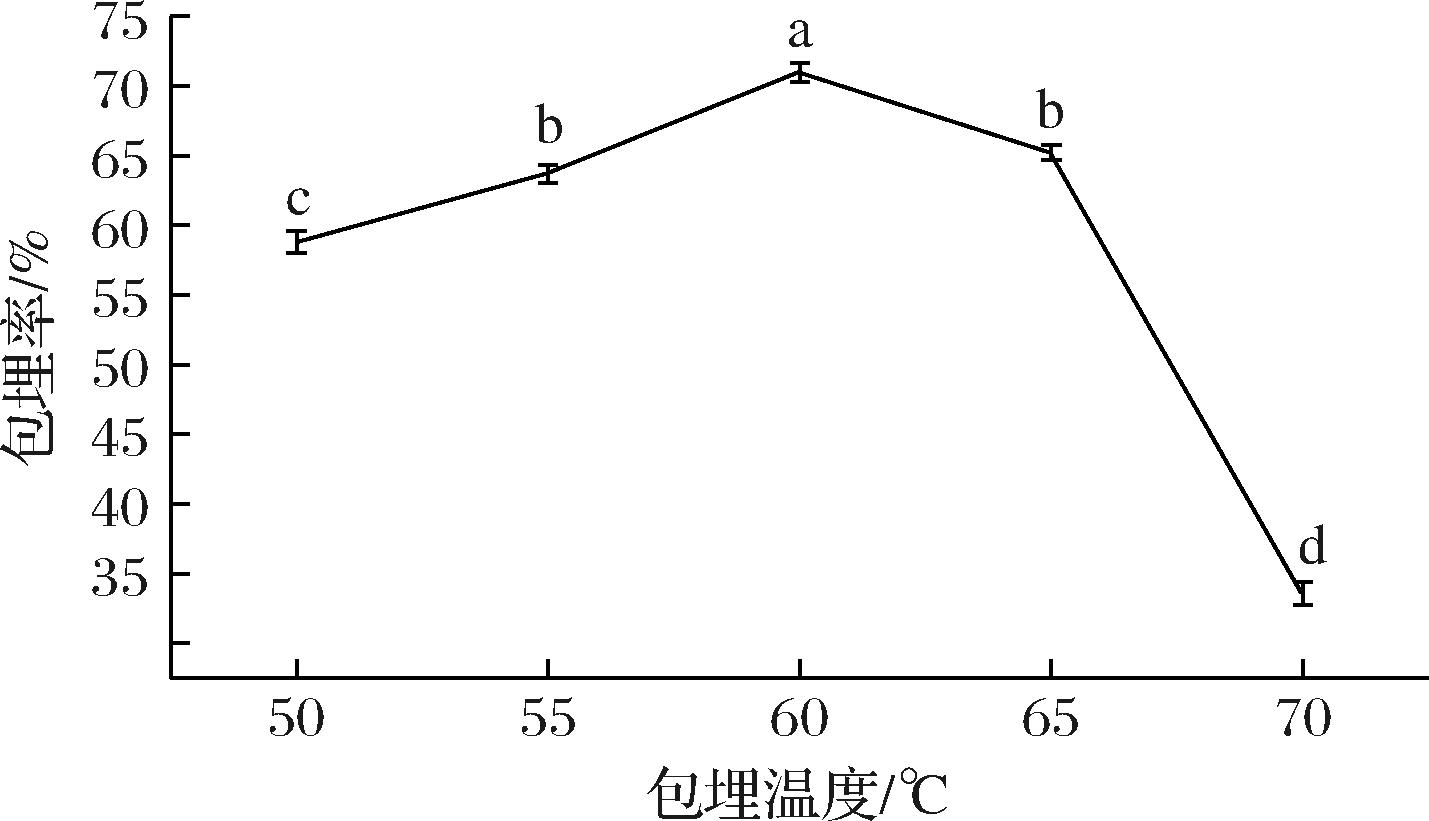
图2 包埋温度对包埋率的影响
Fig.2 Effect of embedding temperature on the embedding rate of microcapsule
注:同一指标不同小写字母表示差异显著(P<0.05)(下同)。
2.2.2 包埋时间对包埋率的影响
如图3所示,包埋时间对微胶囊的包埋率有一定影响。微胶囊的包埋率随包埋时间的延长也呈现先增大后减小的趋势。当包埋时间为3.0 h时,包埋率为65.32%,显著高于其他水平(P<0.05)。其原因可能是长时间的搅拌使疏水性的油滴变得均匀且微小,从而便于进入环糊精疏水空腔[10]。但当搅拌时间过长时,会导致主客体之间的结合力(疏水作用力及范德华力)减弱,甚至分离。因此,选择最佳包埋时间为3.0 h。
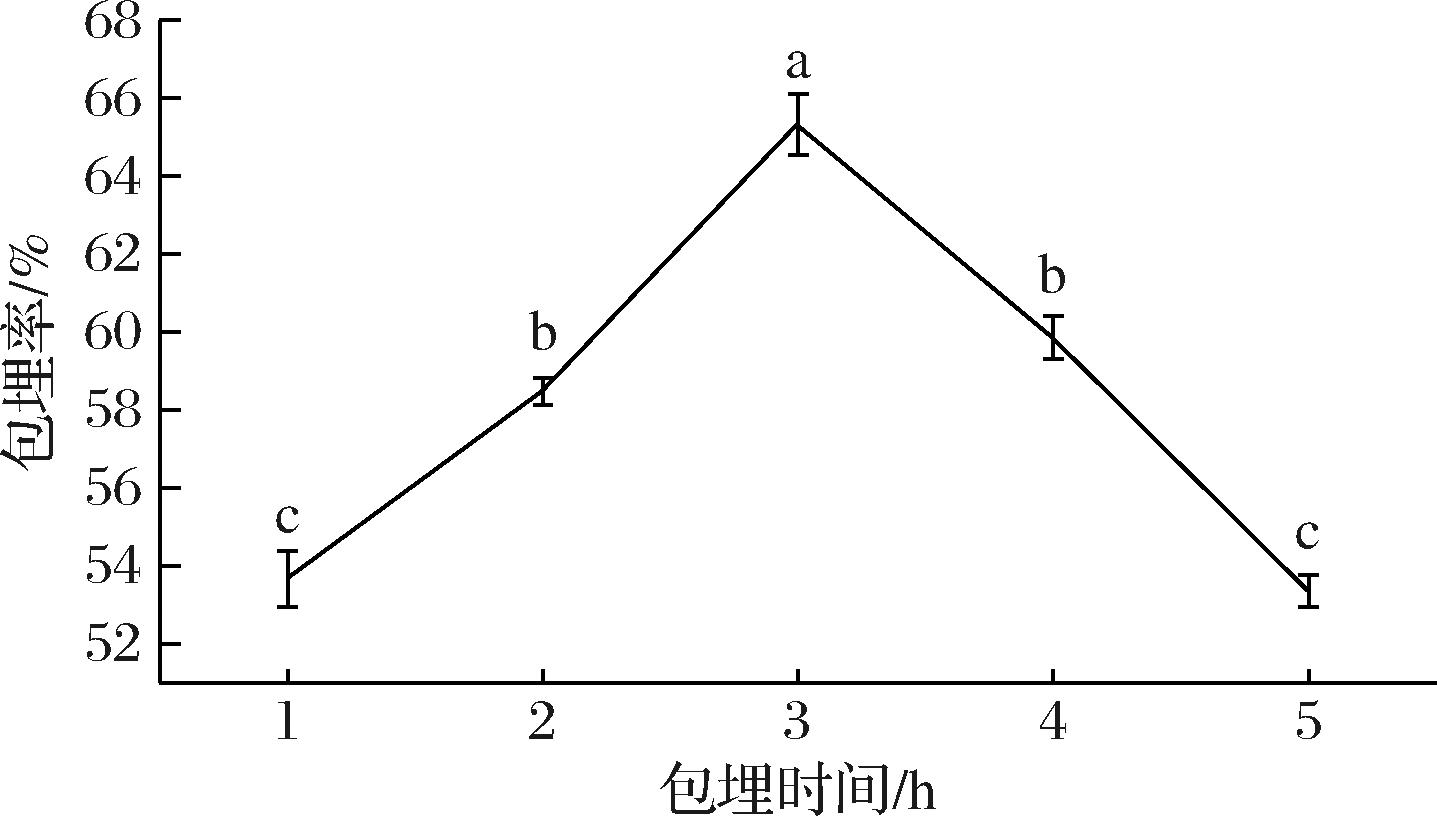
图3 包埋时间对包埋率的影响
Fig.3 Effect of embedding time on the embedding rate of microcapsule
2.2.3 壁芯比对包埋率的影响
如图4所示,壁芯比也对微胶囊的包埋率产生重要影响。当壁芯比由6升至12时,微胶囊的包埋率由41.19%升至63.78%,变化极显著(P<0.05)。但随着壁材含量继续增大,包埋率却出现减小的趋势。这是因为客体分子与主体分子形成包合物的过程是一种动态平衡。壁材含量增大,能够为芯材提供更多的空腔,包埋率也相应增大。当壁材含量过高时,体系黏度增大,不利于客体分子的运动,导致包埋率减小。因此,选取壁芯比12作为包合的最佳比例。
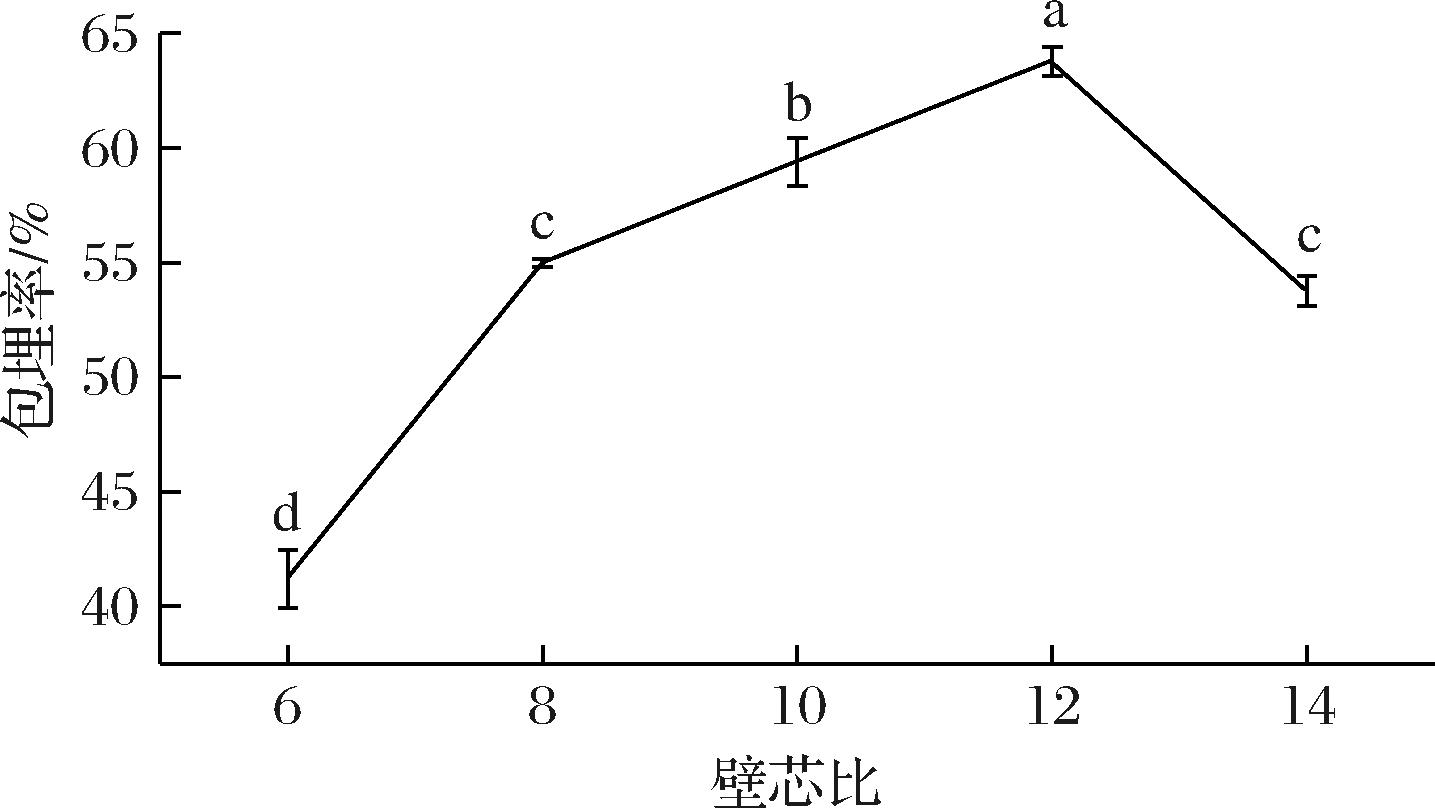
图4 壁芯比对微胶囊包埋率的影响
Fig.4 Effect of wall-core ratio on the embedding rate of microcapsule
2.3 响应面优化微胶囊的制备工艺
2.3.1 响应模型的建立与分析
响应面试验设计和结果见表3。利用Design-Expert 13.0软件对17组数据进行多重回归分析,得到响应值与自变量之间的回归方程,Y=79.30-3.30A-2.68B-2.00C-6.32AB+0.965 0AC+2.76BC-5.27A2-4.37B2-9.99C2。
表3 响应面试验设计及结果
Table 3 Design and results for response surface experimental
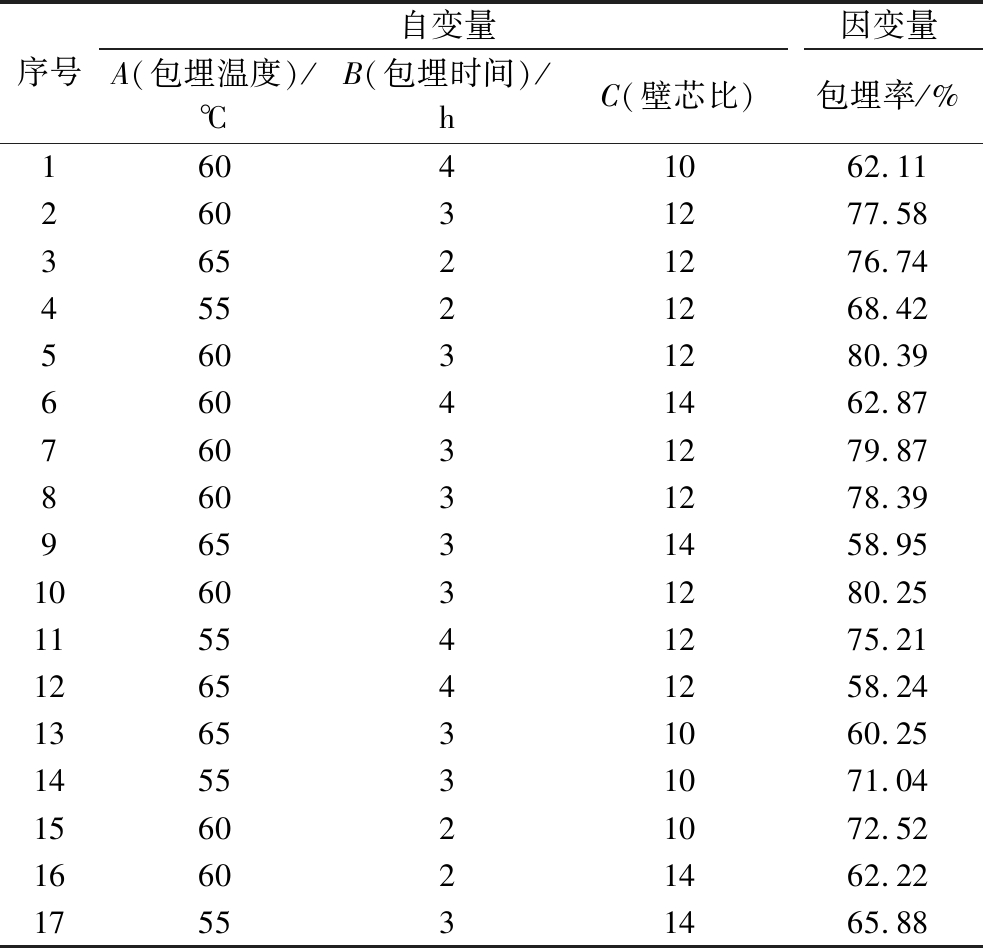
序号自变量因变量A(包埋温度)/℃B(包埋时间)/hC(壁芯比)包埋率/%16041062.1126031277.5836521276.7445521268.4256031280.3966041462.8776031279.8786031278.3996531458.95106031280.25115541275.21126541258.24136531060.25145531071.04156021072.52166021462.22175531465.88
回归模型差异显著性检验及方差分析见表4。根据HUANG等[11]的建议,使用模型系数(R2),校正系数(AdjR2)、变异系数(coefficient of variation,CV)、充分精度(adequate precision,AP)和失拟项值综合评价模型的精度。表格中的结果显示:F=44.95,(P<0.000 1)回归模型非常显著,可根据试验值来分析和预测响应值。包合率与各因素之间的相关系数R2为0.983 0,表明该回归模型拟合度高。且模型校正系数AdjR2=0.961 1,与R2接近,表明该模型能解释96.11%包埋率的变化。CV体现实际值与预测值之间的差异。CV值越小,表明试验具有良好的重复性和可行性。AP,用于表示预测值和实际值之间的精度,AP≥4被认为是有效模型的基本标准。表中,CV(0.023),AP(17.772)>4,证实模型具备较强的响应信号解析能力。失拟项值为11.94,不显著(P>0.05),意味着预测值与实际值之间无显著性差异。综上所述,该模型可用于分析和预测最佳包埋条件。
表4 响应面回归方程方差分析
Table 4 Analysis of response surface regression equation
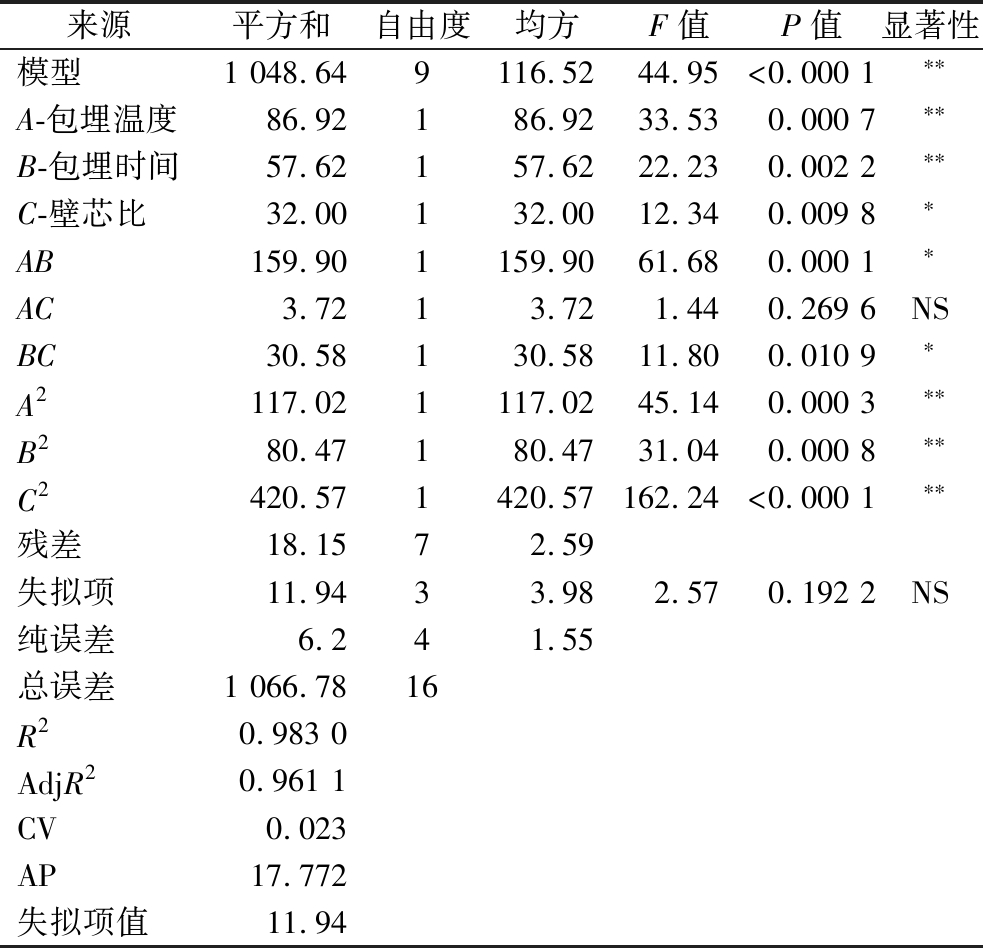
来源平方和自由度均方F值P值显著性模型1 048.649116.5244.95<0.000 1∗∗A-包埋温度86.92186.9233.530.000 7∗∗B-包埋时间57.62157.6222.230.002 2∗∗C-壁芯比32.00132.0012.340.009 8∗AB159.901159.9061.680.000 1∗AC3.7213.721.440.269 6NSBC30.58130.5811.800.010 9∗A2117.021117.0245.140.000 3∗∗B280.47180.4731.040.000 8∗∗C2420.571420.57162.24<0.000 1∗∗残差18.1572.59失拟项11.9433.982.570.192 2NS纯误差6.241.55总误差1 066.7816R20.983 0AdjR20.961 1CV0.023AP17.772失拟项值11.94
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
通过比较表4中的F值,可以得到各因素对包埋率的影响程度:包埋温度(A)>包埋时间(B)>壁芯比(C)。相互作用效应顺序为:AB>BC>AC。
2.3.2 不同因素交互作用分析
图5~图7为不同因素交互作用的响应面图。二维等高线图密集且呈椭圆,三维响应面图越陡峭,则表明两因素之间的交互作用越显著。
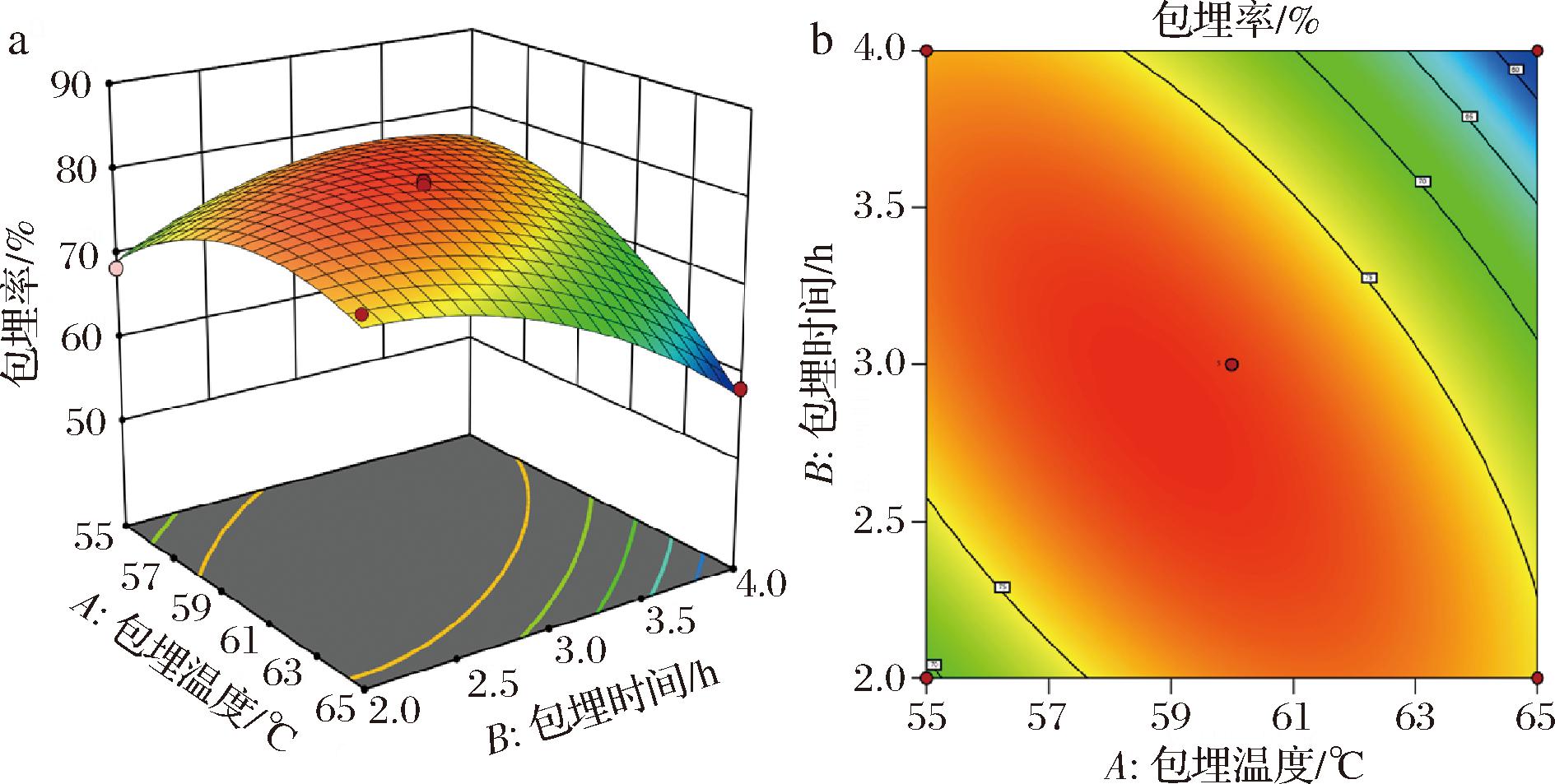
a-三维响应面图;b-二维等高线图
图5 包埋温度和包埋时间的交互作用对包埋率的影响
Fig.5 Effect of the interaction between embedding temperature and embedding time on embedding efficiency
图5为包埋温度和包埋时间对包埋率的交互作用响应面图。三维响应图中的响应曲面十分陡峭(图5-a),且等高线图中等高线呈扁椭圆形(图5-b),说明包埋率变化非常快,包埋温度和包埋时间两因素之间交互作用对精油包埋率影响极显著(P<0.01)。造成这一现象的具体原因可由上述2.2.1节和2.2.2节的单因素分析解释。
如图6所示,三维响应面表面陡峭(图6-a),且等高线呈椭圆形(图6-b),说明包埋温度和包埋时间两因素之间交互作用强,对包埋率影响显著(P<0.05)。造成这一现象的具体原因可由上述2.2.2节和2.2.3节的单因素分析解释。
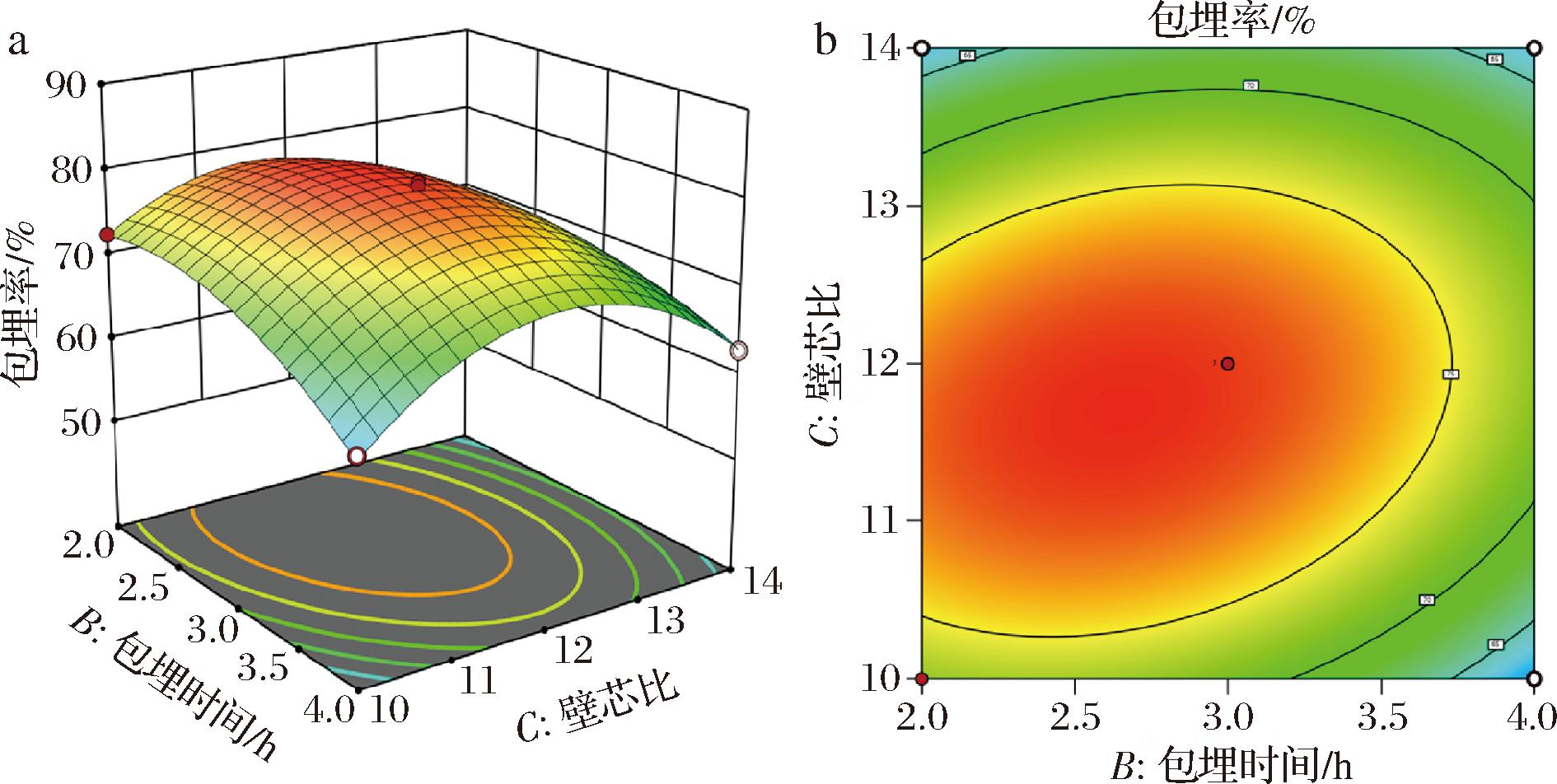
a-三维响应面图;b-二维等高线图
图6 包埋时间和壁芯比的交互作用对包埋率的影响
Fig.6 Effect of the interaction between embedding time and wall-core ratio on embedding efficiency
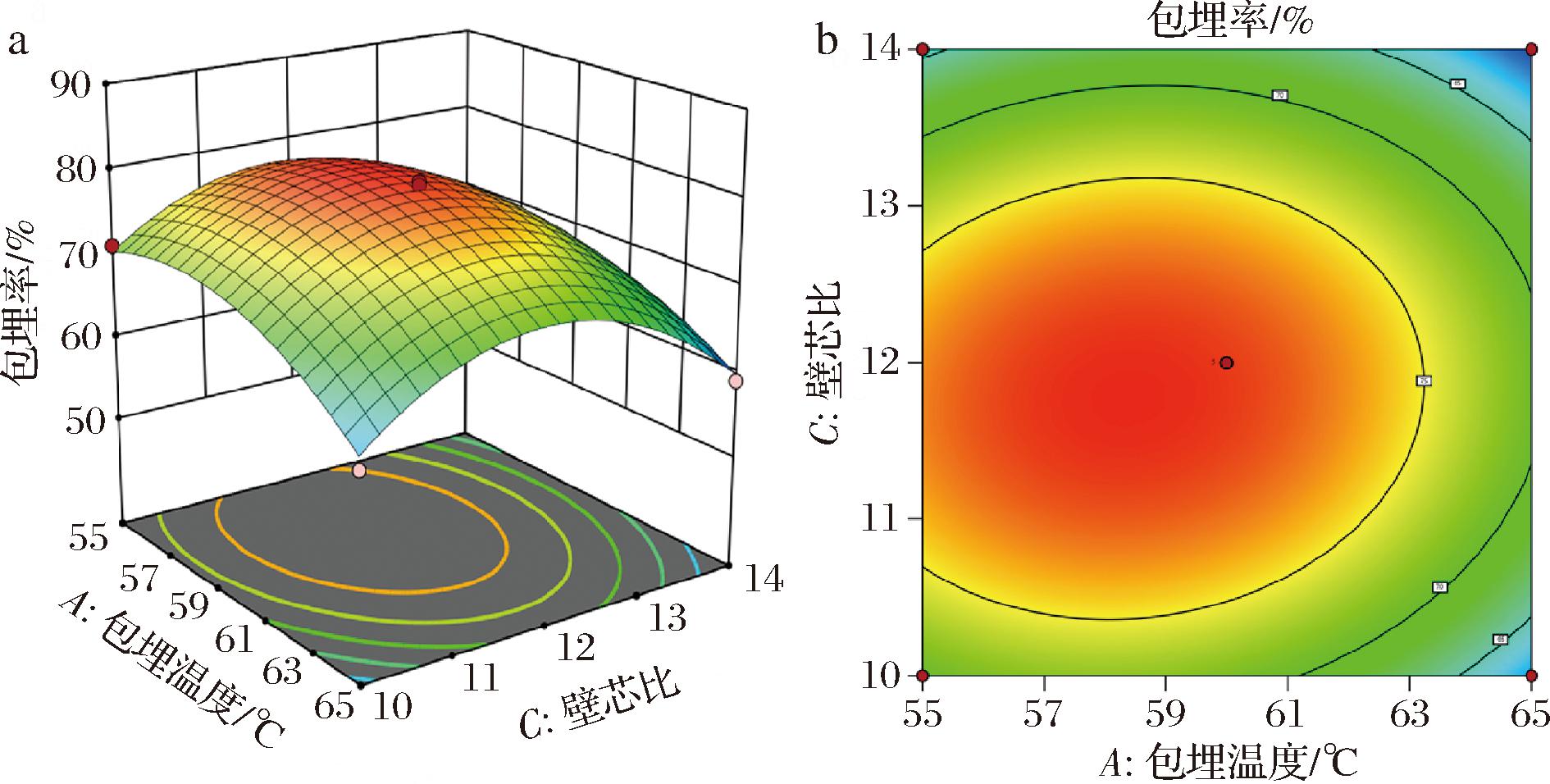
a-三维响应面图;b-二维等高线图
图7 包埋温度和壁芯比的交互作用对包埋率的影响
Fig.7 Effect of the interaction between embedding temperature and wall-core ratio on embedding efficiency
如图7所示,三维图中的响应曲面较为平缓(图7-a),且二维图中等高线呈圆形(图7-b),精油包埋率随两因素的变化较慢,包埋温度和壁芯比交互作用对包埋率影响不显著(P<0.05)。
综上所述,微胶囊的包埋率会受不同因素的相互作用的影响,且影响程度与2.3.1节中分析结果一致。
2.4 验证试验
通过模型分析得出微胶囊的最佳包埋工艺条件为:包埋温度58.986 4 ℃、包埋时间2.796 4 h、壁芯比11.723 5,预测包埋率为80.042 2%。结合实际试验,将条件调整为:包埋温度59 ℃、包埋时间2.8 h、壁芯比12,在此条件下,微胶囊的实际包埋率为81.73%。预测值与实际值之间仅存在1.687 8%的相对误差,说明建立的模型可用于优化微胶囊的制备工艺条件。
2.5 微胶囊的表征
2.5.1 FTIR分析
如图8所示,β-环糊精在3 290、2 930、1 644、1 156、1 021 cm-1处的特征峰分别对应着O—H拉伸振动,C—H 拉伸振动,H—O—H的弯曲振动,C—O伸缩振动,C—O—C弯曲振动。百里香酚的特征峰则位于2 957 cm-1(芳香环的C—H拉伸振动),1 622 cm-1(苯环的C![]() C拉伸振动),1 462 cm-1(苯环的特征峰)[12]。通过对比分析发现,微胶囊的光谱特征与β-环糊精高度相似,但在1 153 cm-1 和1 024 cm-1处的吸收峰显著增强。这归因于β-环糊精的骨架发生振动,环状结构产生变形,表明百里香酚已嵌入β-环糊精的内腔。此外,百里香酚在3 166 cm-1和1 622 cm-1处的特征峰强度减弱,并分别位移至3 286 cm-1和1 639 cm-1处。这是由于β-环糊精通过氢键等相互作用将百里香酚固定于其内腔中所致[13]。值得注意的是,百里香酚在1 650~1 450 cm-1范围内处的特征峰被β-环糊精的弯曲振动所覆盖,这进一步证实了百里香酚被成功包合于β-环糊精的空腔中[14-15]。
C拉伸振动),1 462 cm-1(苯环的特征峰)[12]。通过对比分析发现,微胶囊的光谱特征与β-环糊精高度相似,但在1 153 cm-1 和1 024 cm-1处的吸收峰显著增强。这归因于β-环糊精的骨架发生振动,环状结构产生变形,表明百里香酚已嵌入β-环糊精的内腔。此外,百里香酚在3 166 cm-1和1 622 cm-1处的特征峰强度减弱,并分别位移至3 286 cm-1和1 639 cm-1处。这是由于β-环糊精通过氢键等相互作用将百里香酚固定于其内腔中所致[13]。值得注意的是,百里香酚在1 650~1 450 cm-1范围内处的特征峰被β-环糊精的弯曲振动所覆盖,这进一步证实了百里香酚被成功包合于β-环糊精的空腔中[14-15]。
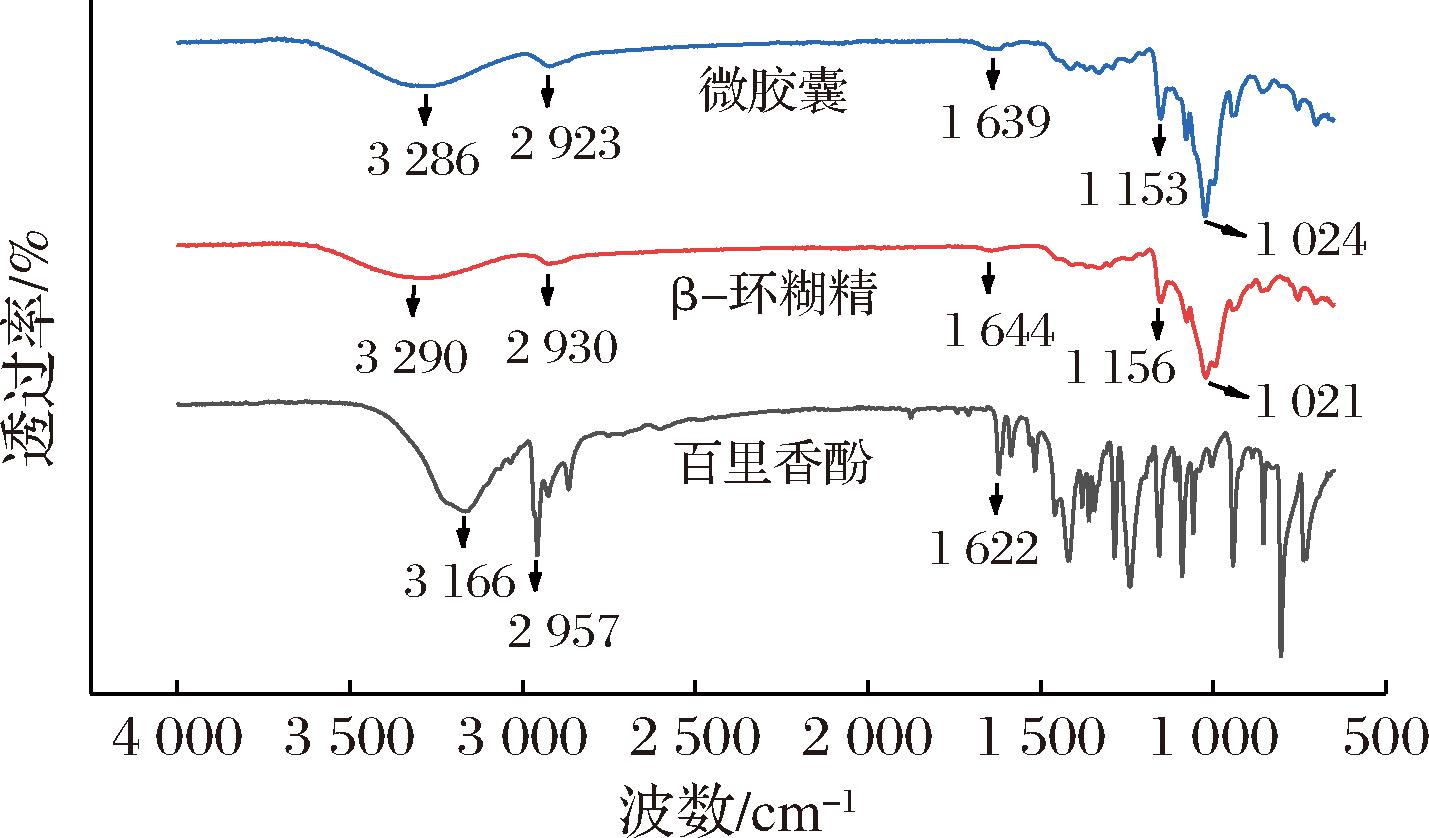
图8 百里香酚、β-环糊精和微胶囊的红外光谱图
Fig.8 FTIR spectra of thymol, β-CD and microcapsule
2.5.2 XRD分析
如图9所示,β-环糊精在10.34°、12.15°、17.48°、18.52°、19.22°、20.43°、21.11°和22.42°处呈现系列特征峰,与其典型的笼状晶体结构一致[16]。百里香酚在8.15°、8.54°、16.58°、17.05°、18.86°、19.20°和25.75°处出现高强度尖锐衍射峰,表明其具有高度有序的晶体结构。新特征峰的出现、原特征峰的消失或偏移都可以作为包合物形成的强有力证据。从图中可看出,微胶囊的衍射谱图谱较β-环糊精发生显著改变,原位于2θ=10.34°和12.15°的特征峰完全消失,同时在11.20°处产生新的衍射峰。这种晶体衍射模式的改变表明百里香酚分子与β-环糊精空腔发生特异性相互作用,导致主体分子晶格重构并形成新型包合物[17]。该结果与EL KHARRAF等[18]在迷迭香精油-环糊精微胶囊体系中的XRD研究一致,进一步证实了微胶囊的成功制备。
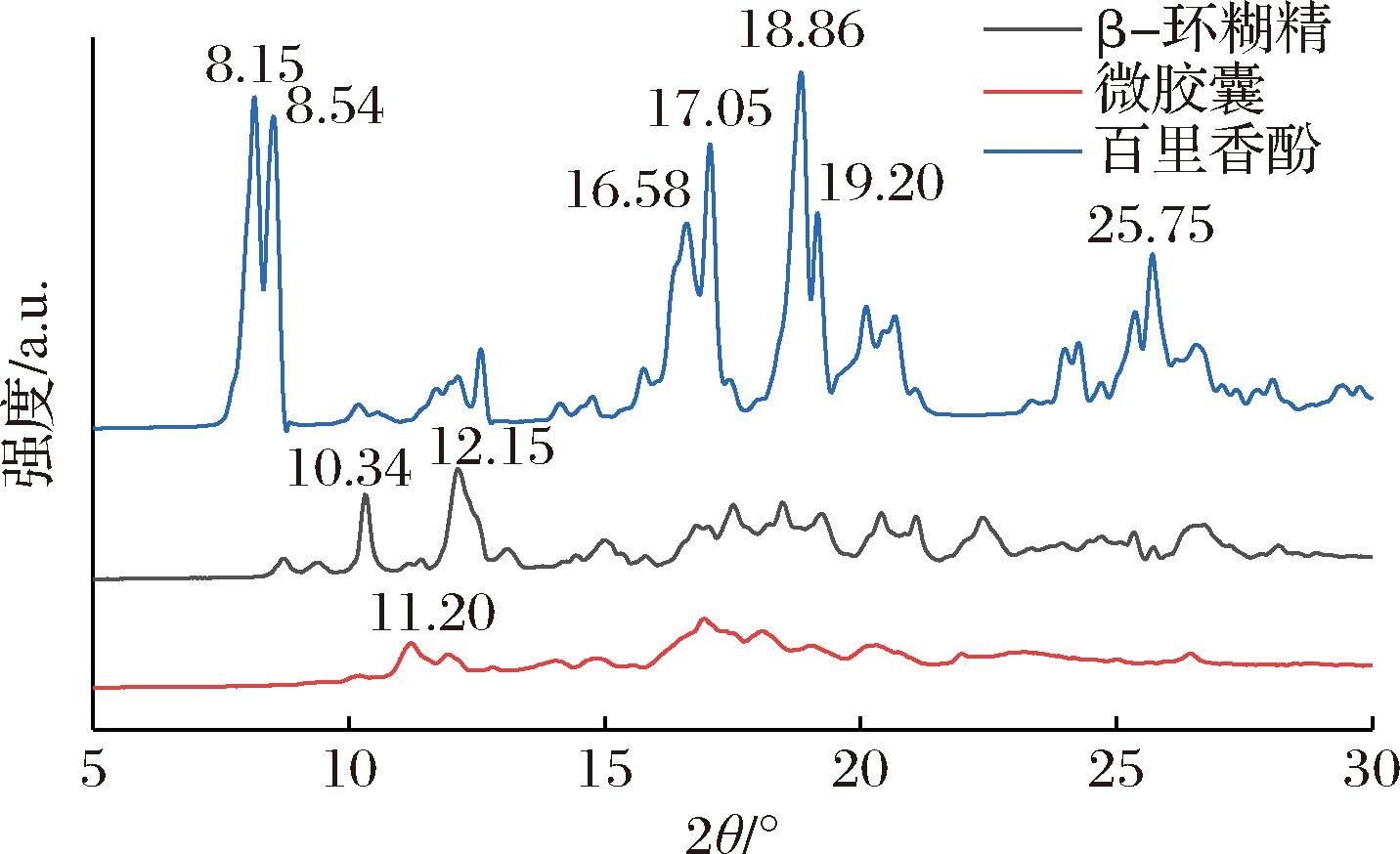
图9 百里香酚、β-环糊精和微胶囊的XRD图
Fig.9 XRD analysis of thymol, β-CD and microcapsule
2.5.3 SEM分析
如图10所示,β-环糊精呈现出不规则块状,结构完整性强(图10-a)。当进一步放大时(图10-b),可观察到其表面存在明显的平行条纹。相比之下,微胶囊样品呈现显著的形貌重构,低倍镜下显示为高聚集度的细小晶态颗粒(图10-c),而高倍镜则揭示其具有规整的多层片状结构(图10-d)。这是由于β-环糊精与百里香酚之间的相互作用力,如范德华力、氢键、疏水作用力,使其形态发生了改变[19]。微胶囊与β-环糊精在SEM图像上的形态差异表明有新化合物的生成,这一结果与XRD的分析一致,也进一步证明百里香酚被成功包埋于β-环糊精中。

a-β-环糊精放大200倍;b-β-环糊精放大2 000倍;c-微胶囊放大200倍;d-微胶囊放大2 000倍
图10 β-环糊精和微胶囊的SEM图
Fig.10 SEM images of β-CD and microcapsule
2.5.4 TG分析
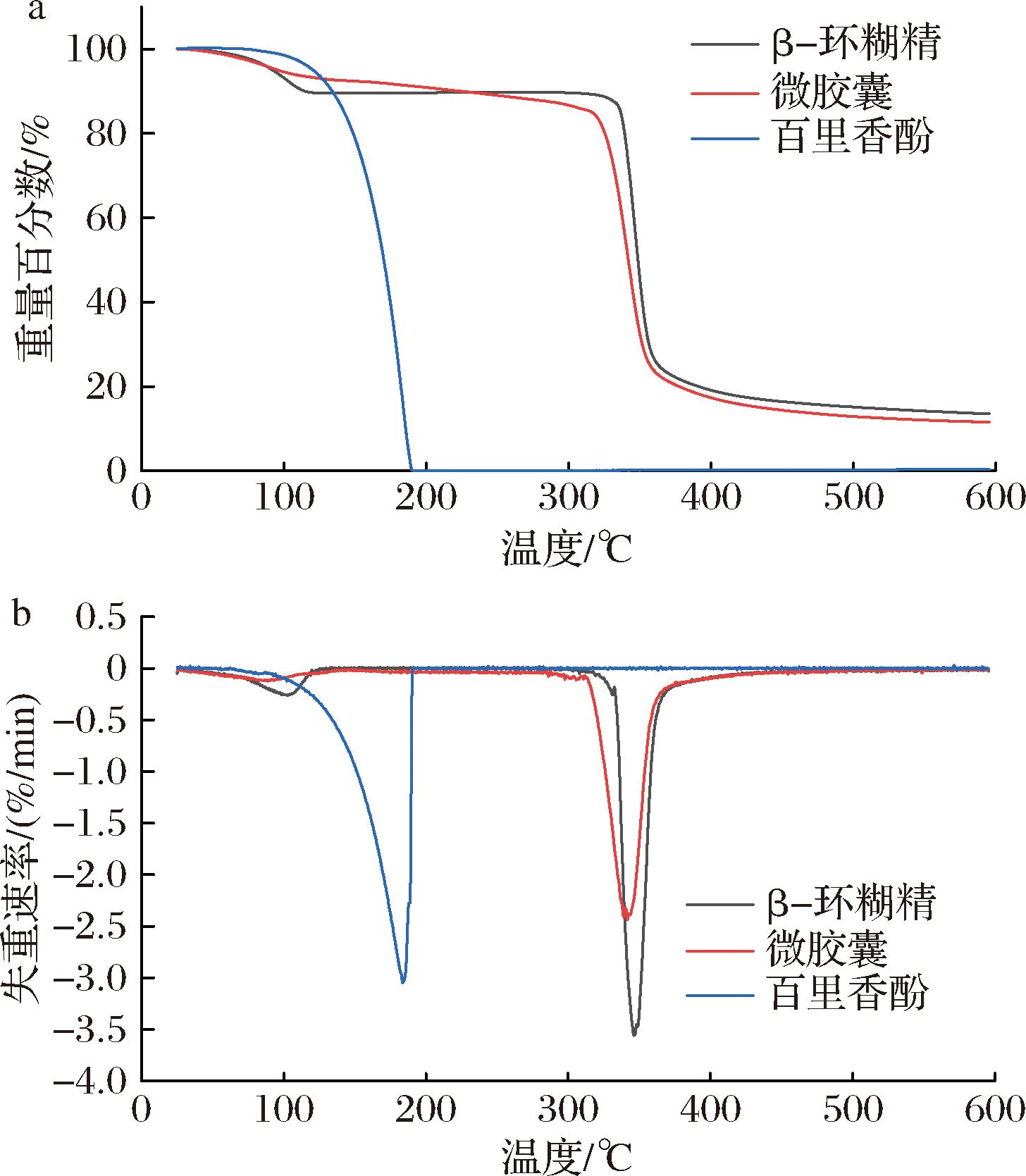
百里香酚、β-环糊精及微胶囊的TG和微分热重(differential thermogravimetry, DTG)曲线如图11所示。由图11-a可知,百里香酚精油在188 ℃前完全失重,表明其热稳定性较差。而β-环糊精的热分解呈现3个阶段:初始阶段(<115 ℃),失重10.39%,对应着自由水和结合水的损失;主分解阶段(115~360 ℃),源于分子骨架的热裂解,质量损失近70%;碳化阶段(360~600 ℃)为残余有机质的分解。值得注意的是,微胶囊的热行为发生显著改变:其主失重阶段(25~320 ℃)起始温度较纯百里香酚提高137 ℃,表明芯材挥发被有效抑制;后续两阶段(320~355 ℃及355~600 ℃)分别对应壁材降解与碳化过程。以上结果表明微胶囊双层结构的形成使得百里香酚被封闭在β-环糊精的内腔中受到保护。
a-TGA曲线;b-DTG曲线
图11 百里香酚、β-环糊精和微胶囊的热稳定性分析曲线
Fig.11 Thermal stability analysis curves of thymol, β-CD and microcapsule
DTG曲线主要体现了样品的失重速率。如图11-b所示,百里香酚、β-环糊精、微胶囊的最大降解温度分别为184.13、347.61、341.04 ℃,微胶囊最大分解温度较芯材提高156.91 ℃,但略低于纯壁材。这种变化证实微胶囊化能有效延缓百里香酚的热分解。此外,单因素试验2.2.1节中所得到的最佳包埋温度(60 ℃)明显低于百里香酚的热分解温度(184.13 ℃),表明该温度选择可以兼顾包合动力学优势与热敏性物质保护,具有可行性。
2.5.5 微胶囊缓释性分析
百里香酚在不同温度下的释放率变化如图12所示。随贮藏时间的延长,精油的释放率逐渐增加,具体表现为突释、缓增、平缓3个阶段[20]。初期阶段(0~10 d),精油呈现快速释放的特征,在4 ℃和25 ℃下的累计释放量分别达到34.54%和53.54%。这一阶段释放机制主要源于2方面:一是微胶囊表面未被包埋的精油通过物理脱附直接扩散;二是β-环糊精表层孔道中的百里香酚分子通过浓度梯度的被动扩散逸出。中期阶段(10~20 d),精油的释放速率减缓,在第20天时累计释放量分别增至46.51%(4 ℃)和55.27%(25 ℃)的释放量。该阶段精油分子需穿透β-环糊精的三维网络结构,其扩散行为受主客体分子间作用力的显著影响。后期阶段(20~30 d),体系趋于动态平衡。因此,该释放特性表明β-环糊精的包埋有效延缓了百里香酚的扩散速率。
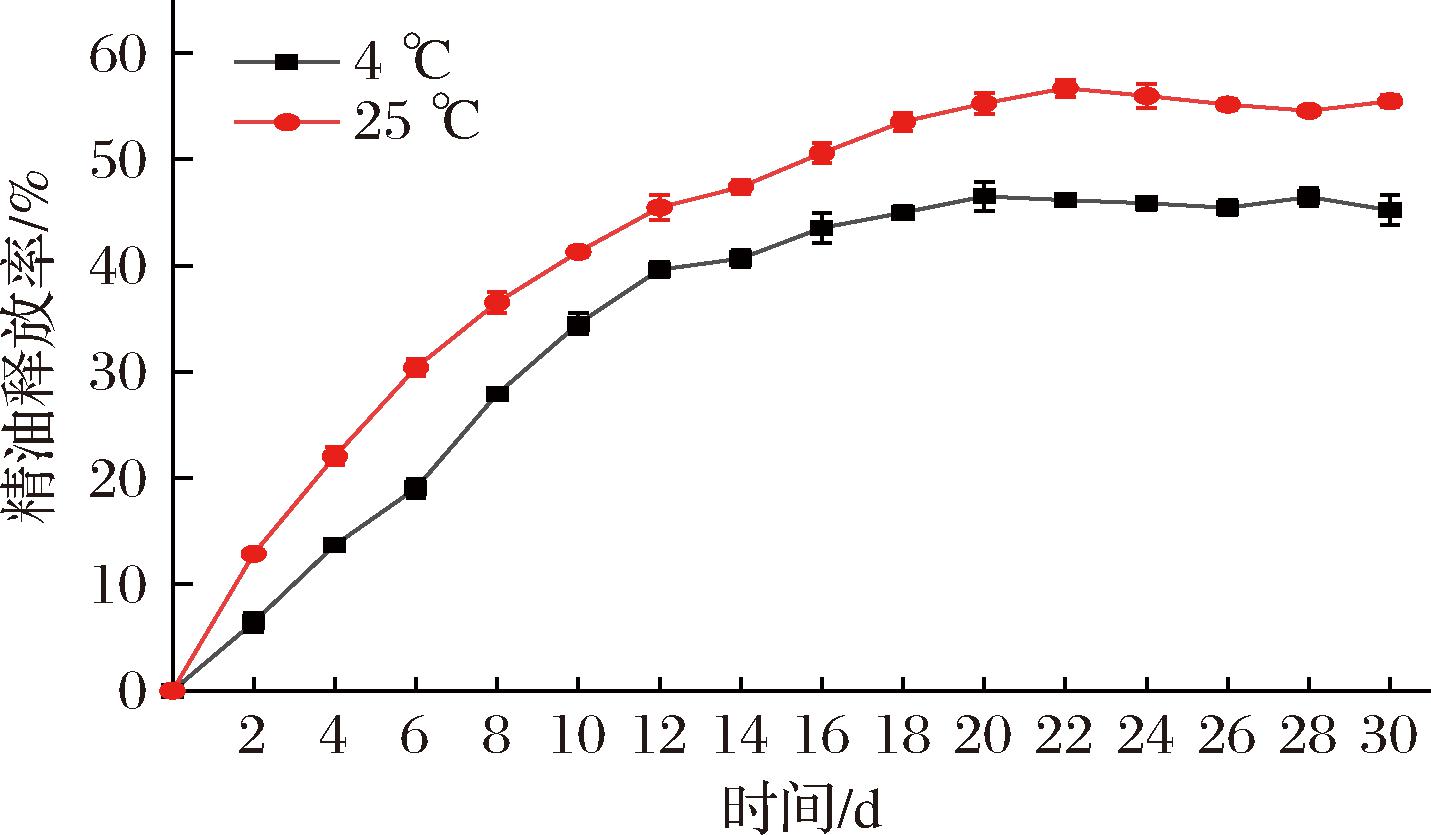
图12 微胶囊在4 ℃和25 ℃下的缓释曲线
Fig.12 Sustained release curve of microcapsules at 4 ℃ and 25 ℃
2.5.6 DPPH抗氧化分析
图13显示了微胶囊的DPPH抗氧化能力。结果表明,微胶囊的抗氧化活性在2~10 mg/mL的范围内呈现显著浓度依赖性。当质量浓度由2 mg/mL升至10 mg/mL时,微胶囊的抗氧化能力由54.40%升至81.61%。该抗氧化效应的产生机制可通过氢原子转移理论阐释,即酚类化合物通过提供氢原子将DPPH自由基还原为稳定态的DPPH-H[21]。百里香酚分子中的邻位取代基(羟基、甲基及异丙基)形成的离域电子体系,能有效提供氢原子或电子以中和自由基[22]。以上结果表明微胶囊化有效保持了百里香酚的抗氧化能力,为其在食品活性包装材料上的开发提供了理论依据。
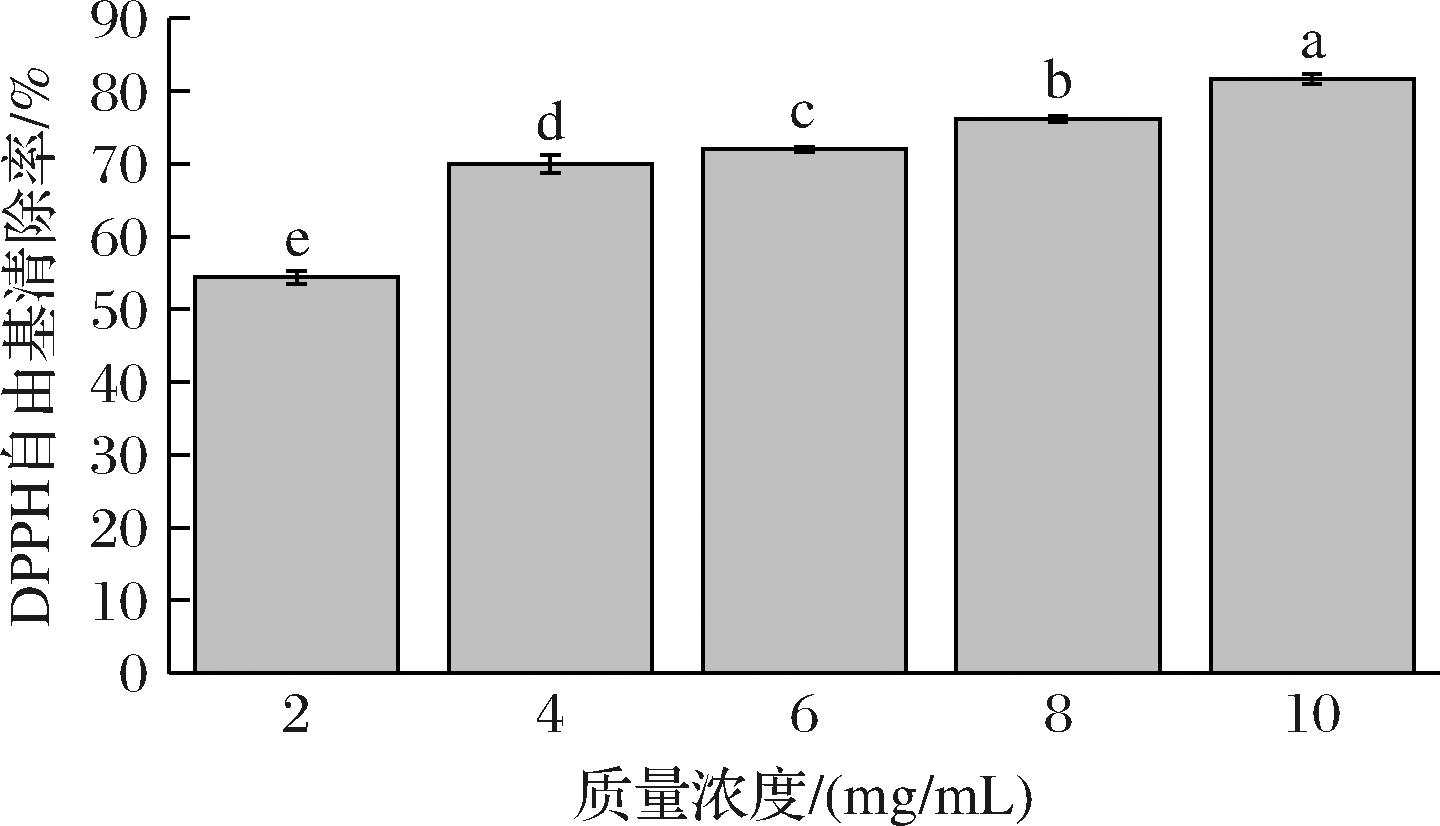
图13 不同浓度微胶囊的抗氧化能力
Fig.13 Antioxidant capacity of microcapsule at different concentrations
注:同一指标不同小写字母表示差异性显著(P<0.05)。
2.5.7 抗菌性分析
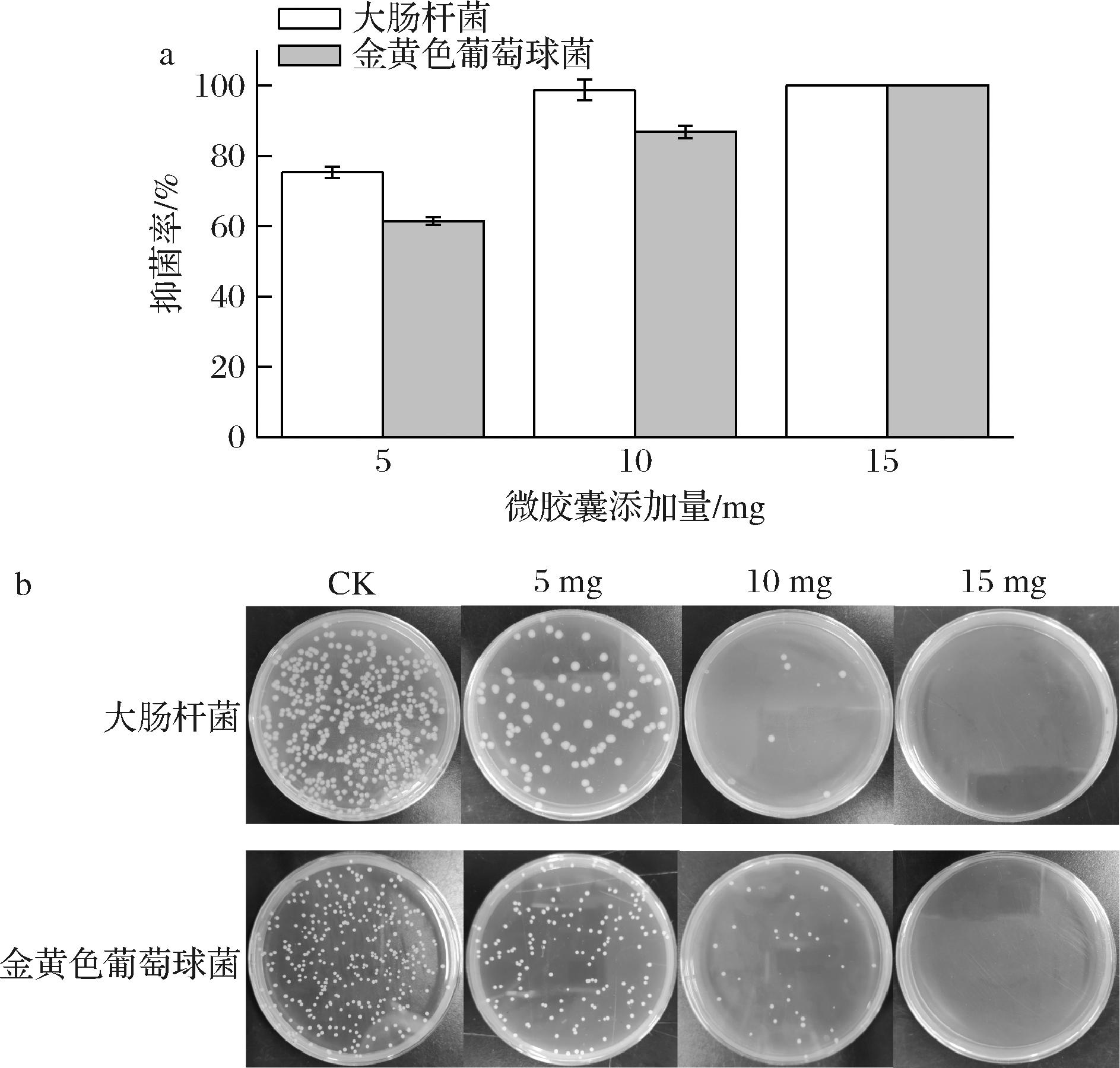
如图14所示,以不含微胶囊的菌液为对照,当微胶囊的添加量为10 mg时,其对大肠杆菌和金黄色葡萄球菌的抑菌率分别为98.75%、86.82%。当微胶囊的添加量升高至15 mg时,对2种菌的抑菌率均达100%。试验结果表明百里香酚微胶囊对大肠杆菌和金黄色葡萄球菌均表现出显著的抑菌活性。百里香酚的抗菌活性主要是通过破坏细菌细胞壁和细胞膜的完整性,导致细胞内容物的泄漏,从而抑制细菌生长[23]。此外,百里香酚还会与细菌的DNA相互作用,诱导细菌细胞内的结构发生改变,最终导致细菌死亡[24]。百里香酚对大肠杆菌表现出更强的抑菌效果,可能由于百里香酚精油中的抗菌成分因具备较强的脂溶性特性,更易渗透大肠杆菌的外层膜结构。相比之下,金黄色葡萄球菌的致密细胞壁层在一定程度上限制了活性成分的跨膜转运[25]。
a-抑菌率;b-菌落
图14 微胶囊对大肠杆菌、金黄色葡萄球菌的抑菌效果
Fig.14 Antibacterial effect of microcapsule on Escherichia coli and Staphylococcus aureus
3 结论与讨论
本研究基于响应面法优化得到百里香酚微胶囊的最佳制备工艺条件:包埋温度59 ℃、包埋时间2.8 h、壁芯比12,此条件下的包埋率达81.73%。FTIR、XRD和SEM分析均证实百里香酚被有效包封于β-环糊精的内腔。热分析和释放性试验的结果表明,微胶囊化有效改善了百里香酚的热稳定性且在4 ℃ 和25 ℃下30 d内分别呈现持续缓释特性。此外,百里香酚微胶囊亦表现出良好的DPPH抗氧化能力和优异的抗菌效果。该研究为开发兼具热稳定性增强与可控缓释功能的食品活性包装提供了理论依据与技术支撑。
[1] KFOURY M, LANDY D, RUELLAN S, et al.Determination of formation constants and structural characterization of cyclodextrin inclusion complexes with two phenolic isomers:Carvacrol and thymol[J].Beilstein Journal of Organic Chemistry, 2016, 12:29-42.
[2] CELEBIOGLU A, YILDIZ Z I, UYAR T.Thymol/cyclodextrin inclusion complex nanofibrous webs:Enhanced water solubility, high thermal stability and antioxidant property of thymol[J].Food Research International, 2018, 106:280-290.
[3] SOUSA V I, PARENTE J F, MARQUES J F, et al.Microencapsulation of essential oils:A review[J].Polymers, 2022, 14(9):1730.
[4] GRANADOS A D P F, DUARTE M C T, NOGUERA N H, et al.Impact of microencapsulation on Ocimum gratissimum L.essential oil:Antimicrobial, antioxidant activities, and chemical composition[J].Foods, 2024, 13(19):3122.
[5] 黎汉清, 罗文翰, 肖更生, 等.丁香精油微胶囊的制备及其对草莓保鲜效果的研究[J].食品与发酵工业, 2021, 47(21):191-196.
LI H Q, LUO W H, XIAO G S, et al.Preparation of microcapsule of clove essential oil and preservation effect on strawberry[J].Food and Fermentation Industries, 2021, 47(21):191-196.
[6] YUE Q, SHAO X F, WEI Y Y, et al.Optimized preparation of tea tree oil complexation and their antifungal activity against Botrytis cinerea[J].Postharvest Biology and Technology, 2020, 162:111114.
[7] YING T H, JIANG C H, MUNIR S, et al.Synthesis and application of gelatin-based controlled-release antibacterial films containing oregano essential oil/β-cyclodextrin microcapsules for chilling preservation of grass carp fillets[J].Food Chemistry, 2024, 451:139465.
[8] 付红军, 李亚萍,王艳, 等.响应面法优化山苍子精油微胶囊的制备工艺及其缓释性能研究[J].中国粮油学报, 2024, 39(12):133-138.
FU H J, LI Y P, WANG Y, et al.Optimization of litsea cubeba essential oil microcapsules preparation by response surface methodology and its slow-release performance research[J].Journal of the Chinese cereals and oils association, 2024, 39(12):133-138.
[9] 钟秋夏, 郑海英, 朱燕丽, 等.百里香酚微胶囊的制备及其对草莓的保鲜效果[J].食品科学, 2023, 44(11):167-176.
ZHONG Q X, ZHENG H Y, ZHU Y L, et al.Preparation of thymol-containing microcapsules and its application in strawberry preservation[J].Food Science, 2023, 44(11):167-176.
[10] 张光杰. 基于八角茴香精油/环糊精包合物的活性复合膜体系构建及性能研究[D].长春:吉林大学, 2019.
ZHANG G J.Construction and properties of a active composite film system based on star anise essential oil/cyclodextrin inclusion complex[D].Changchun:Jilin University, 2019.
[11] HUANG J L, PU J R, YANG Z B, et al.Development of a Syzygium aromaticum, L.essential oil/hydroxypropyl-β-cyclodextrin inclusion complex:Preparation, characterization, and evaluation[J].Industrial Crops and Products, 2024, 214:118500.
[12] MEBARKI N, ZIANE H, FAZOUANE F, et al.Microencapsulation of Thymus fontanesii extracts in pectin/casein:Characterization, release behavior and storage stability[J].Iranian Polymer Journal, 2022, 31(3):301-316.
[13] HUANG X Q, GUO H H, XIE Q L, et al.Preparation and embedding characterization of hydroxypropyl-β-cyclodextrin/menthyl acetate microcapsules with enhanced stability[J].Pharmaceutics, 2023, 15(7):1979.
[14] KUZMANOVI NEDELJKOVI
NEDELJKOVI S,
S,  UJI
UJI NIKOLI
NIKOLI N, RADAN M, et al.Microencapsulation of Origanum heracleoticum L.and Thymus vulgaris L.essential oils-Novel strategy to combat multi-resistant Acinetobacter baumannii[J].Industrial Crops and Products, 2024, 216:118762.
N, RADAN M, et al.Microencapsulation of Origanum heracleoticum L.and Thymus vulgaris L.essential oils-Novel strategy to combat multi-resistant Acinetobacter baumannii[J].Industrial Crops and Products, 2024, 216:118762.
[15] QIAN Y F, SHI C J, SUN L, et al.Characterization of β-cyclodextrin inclusion complexes embedded with lemongrass and basil essential oils and their modified sustained-release pads for large yellow croaker (Larimichthys crocea) fillet preservation[J].Food Bioscience, 2025, 66:106157.
[16] GAO Q, ZHENG J B, VAN DER MEEREN P, et al.A comparative study on stabilizing and releasing thymol by pre-formed V-type starch and β-cyclodextrin[J].Food Hydrocolloids, 2024, 156:110233.
[17] ALIZADEH N, NAZARI F.Thymol essential oil/β-cyclodextrin inclusion complex into chitosan nanoparticles:Improvement of thymol properties in vitro studies[J].Journal of Molecular Liquids, 2022, 346:118250.
[18] EL KHARRAF S, FARAH A, EL HADRAMI E M, et al.Encapsulation of Rosmarinus officinalis essential oil in β-cyclodextrins[J].Journal of Food Processing and Preservation, 2021, 45(10):e15806.
[19] XU T F, LIU J F, WANG P, et al.Characterisation of C-β-cyclodextrin-thymol inclusion complexes as delivery systems for antibacterial and antioxidant applications[J].Flavour and Fragrance Journal, 2025,40(3):467-476.
[20] 戴瑶, 陈玥琰, 张翔, 等.壬醛与香芹酚复合抑菌微胶囊的制备及其对蓝莓的保鲜作用[J].食品与发酵工业,2024, 50(9):238-247.
DAI Y, CHEN Y Y, ZHANG X, et al.Preparation of composite antibacterial microcapsules with nonanal and carvacrol and its application in blueberry preservation[J].Food and Fermentation Industry, 2024, 50(9):238-247.
[21] ICHIKAWA K, SASADA R, CHIBA K, et al.Effect of side chain functional groups on the DPPH radical scavenging activity of bisabolane-type phenols[J].Antioxidants, 2019, 8(3):65.
[22] CHROHO M, ROUPHAEL Y, PETROPOULOS S A, et al.Carvacrol and thymol content affects the antioxidant and antibacterial activity of Origanum compactum and Thymus zygis essential oils[J].Antibiotics, 2024, 13(2):139.
[23] KACHUR K, SUNTRES Z.The antibacterial properties of phenolic isomers, carvacrol and thymol[J].Critical Reviews in Food Science and Nutrition, 2020, 60(18):3042-3053.
[24] ABDOLLAHI A, FEREYDOUNI N, MORADI H, et al.Nanoformulated herbal compounds:Enhanced antibacterial efficacy of camphor and thymol-loaded nanogels[J].BMC Complementary Medicine and Therapies, 2024, 24(1):138.
[25] 魏金环, 王子坤, 陆蕊, 等.负载百里香精油/大豆油/百里香酚的纳米乳液制备及其性能研究[J/OL].食品与发酵工业, 2025:1-11.(2025-02-19).https://link.cnki.net/doi/10.13995/j.cnki.11-1802/ts.041584.
WEI J H, WANG Z K, LU R, et al.Preparation and performance study of nanoemulsion loaded with thyme essential oil, soybean oil, and thymol[J/OL].Food and Fermentation Industries, 2025:1-11.(2025-02-19).https://link.cnki.net/doi/10.13995/j.cnki.11-1802/ts.041584.