仔姜组织脆嫩、风味浓郁,含有丰富的姜辣素、姜酮、姜烯、姜精油等多种活性物质,具有健胃去寒、化痰止咳、解毒、抗癌等功效[1],是深受人们喜爱的调味品。仔姜常因皮薄、肉嫩、纤维素含量低,在贮运过程中容易发生机械损伤、失水萎蔫、组织褐变、腐烂变质等现象,严重影响食用价值和商品性,造成巨大的经济损失。目前,虽然已有部分关于仔姜贮运保鲜技术的研究,如低温保鲜、气调保鲜、钙处理以及保鲜剂联合处理等[2],但在市场上推广应用较少。因此,亟需一种绿色安全、便捷高效的保鲜技术,用以减缓仔姜品质劣变,延长其贮藏保鲜期。
二氧化氯(ClO2)是一种新型安全防腐剂,具有高氧化性,常以气态分子或水溶液形式存在,因其具有持续性长、易贮运、安全性高等特点,逐渐成为果蔬贮藏保鲜领域的研究热点[3]。ClO2的果蔬保鲜机制主要包括2个方面:一是通过阻碍蛋氨酸转化,抑制乙烯合成、降低呼吸速率,减缓糖消耗、调节活性氮代谢等生理活动抑制果蔬褐变[4-6];二是通过渗透并氧化蛋白质、介导病原菌死亡,减轻采后病害,从而调控果蔬贮藏品质[7-8]。目前,ClO2保鲜技术已在猕猴桃[9]、香梨[10]、翠红李[11]等水果中进行了研究及应用。在先前的研究中,团队制备了以NaClO2为主要材料的高稳定性缓释型固态ClO2保鲜剂,并在鲜切西兰花上应用,效果显著[12]。
非靶向代谢组学采用LC-MS、GC-MS、核磁共振(nuclear magnetic resonance,NMR)技术,无偏向性地检测内源代谢物动态变化,并进行定性和相对定量分析以筛选出差异代谢物,通过路径富集分析直观反应生物体内生化变化,被广泛应用于食品品质鉴定、生物活性成分鉴定、病理生物标记物鉴定等领域[13-15]。代谢组学在果蔬的口感质地、次生代谢物和特征风味物质等方面的研究已有广泛应用[16],但是基于代谢组学探究ClO2气体对仔姜贮藏品质调控机制的研究较少。因此,本实验利用实验室自制的ClO2气调保鲜剂,进一步研究ClO2对仔姜贮藏品质的影响,并通过非靶向代谢组学分析贮藏前后不同代谢路径中的差异代谢物变化,揭示调控机制,为仔姜贮藏保鲜提供新的理论支撑。
1 材料与方法
1.1 材料与仪器
实验材料:四川指头仔姜,购自山东省济南市四季鲜果蔬店,挑选新鲜带泥、成熟度一致、无机械损伤、大小均匀和无病虫害的试样,运至实验室。
仪器设备:New Classic ME型电子天平,梅特勒-托利多仪器(上海)有限公司;IN612C型低温恒温培养箱,重庆雅马拓科技有限公司;CR-400型色差仪,河北美能达建材科技有限公司;雷磁DDB-303A型便携式电导率仪,上海仪电科学仪器股份有限公司;Wonbio-E型全自动样品快速研磨仪,上海万柏生物科技有限公司;QE plus型高分辨质谱仪、Dionex U3000 UHPLC型高效液相色谱仪,赛默飞世尔科技公司。
1.2 样品处理
将采购的仔姜进行自来水清洗、2%(体积分数)次氯酸钠消毒并沥干水分,分别称取(200.0±5.0) g置于无添加剂的保鲜盒(对照组)和含有2 g ClO2缓释剂的保鲜盒(处理组)中。保鲜盒选用11 cm×8.5 cm×6.3 cm密封性较好的食品级保鲜盒,ClO2缓释剂选用本课题组以NaClO2为主要材料,酒石酸为活化剂,羧甲基纤维素钠、聚丙烯酰胺和NaHCO3为缓释剂,NaCl和CaCl2为稳定剂研发的高稳定性缓释型固态ClO2保鲜剂,配比是NaClO2∶酒石酸∶NaHCO3∶NaCl∶CaCl2∶羧甲基纤维素钠∶聚丙烯酰胺为2∶3∶1∶1∶0.6∶2.5∶0.4(质量比)。每组3个生物学重复,置于15 ℃恒温箱中,贮藏8 d(前期预实验发现在贮藏第8天时对照组的仔姜已经完全失去食用价值),每2 d取样1次,一部分用于测定色差、失重率、相对电导率等指标,一部分于液氮下速冻后迅速转移至-80 ℃冰箱,用于后续指标测定。其中选取第0天和第6天(前期预实验发现在贮藏第6天时2组仔姜的表观症状差异最明显)样品进行非靶向代谢组学分析。
1.3 指标测定
1.3.1 色泽测定
选取仔姜块茎赤道部位的表皮,用色差仪测定其色泽(L*、a*、b*),并参照RINALDO等[17]方法计算褐变指数和白度指数。
1.3.2 失重率测定
采用称量法计算失重率,每组样品进行3个生物学重复,测量贮藏前后的质量,失重率以仔姜质量损失百分比表示。
1.3.3 相对电导率测定
参照WU等[18]的方法测定仔姜的相对电导率,略有修改。先将仔姜切成5 mm厚的薄片,用直径10 mm的打孔器打取薄片,称取5.0 g薄片放置于100 mL锥形瓶中,加入50 mL蒸馏水浸泡30 min后测定浸泡液的电导率,封口膜封口,沸水水浴15 min后,冷却至室温测定浸泡液的电导率,根据煮沸前后的电导率计算相对电导率,结果以%表示。
1.3.4 非靶向代谢组学检测
称取60.0 mg样品转移到1.5 mL Eppendorf管中,加入20 μL溶解液(甲醇中含有0.3 mg/mL L-2-氯苯丙氨酸)作为内标,以及0.6 mL甲醇和水的混合物7∶3(体积比),样品在-20 ℃预冷2 min,在60 Hz下研磨2 min,在冰水浴中30 kHz超声提取30 min,-20 ℃预冷20 min后,13 000 r/min、4 ℃离心10 min,吸取150 μL上清液,通过0.22 μm微孔过滤器转移到LC样品瓶中,-80 ℃保存,用于超高效液相色谱- 串联质谱(ultra performance liquid chromatography/tandem mass spectrometry,UPLC-MS/MS)分析。采用ACQUITY UPLC I-Class系统(Waters Corporation,Milford,USA)分析ESI正负离子模式下的代谢谱。选取ACQUITY UPLC BEH C18色谱柱(1.7 μm,2.1 mm×100 mm),柱温45 ℃,流速0.4 mL/min,进样体积1 μL,分别使用均含有0.1%的甲酸和乙腈/甲醇(体积比2∶3)作为流动相A和B。线性洗脱条件:0 min,1% B;1 min,30% B;2.5 min,60% B;6.5 min,90% B;8.5 min,100% B;10.7 min,100% B;10.8 min,1% B和13 min,1% B。在全扫描模式和MSE模式下进行数据采集分析。
1.4 数据统计分析
实验数据采用Excel 2010和Origin 2018软件进行数据分析和绘图,SPSS数据处理系统进行差异显著性分析。数据表示为“平均值±标准差”(n=3)。
2 结果与分析
2.1 ClO2处理对仔姜采后贮藏期间褐变的影响
仔姜在贮藏过程中易发生褐变,影响其贮藏品质。由图1-a和图1-b可知,随着贮藏时间的延长,仔姜褐变指数呈上升趋势,白度指数呈下降趋势。在整个贮藏期间,处理组的仔姜褐变指数和白度指数与对照组间存在显著差异(P<0.05),并且在贮藏初期效果更为明显。在贮藏第6天时,处理组的仔姜褐变指数和白度指数分别比第1天高54.01%和低8.05%。且与第6天对照组的褐变指数和白度指数相比,处理组分别低19.76%和高9.82%。这说明ClO2能有效抑制仔姜贮藏期间的褐变,延缓白度指数的降低。
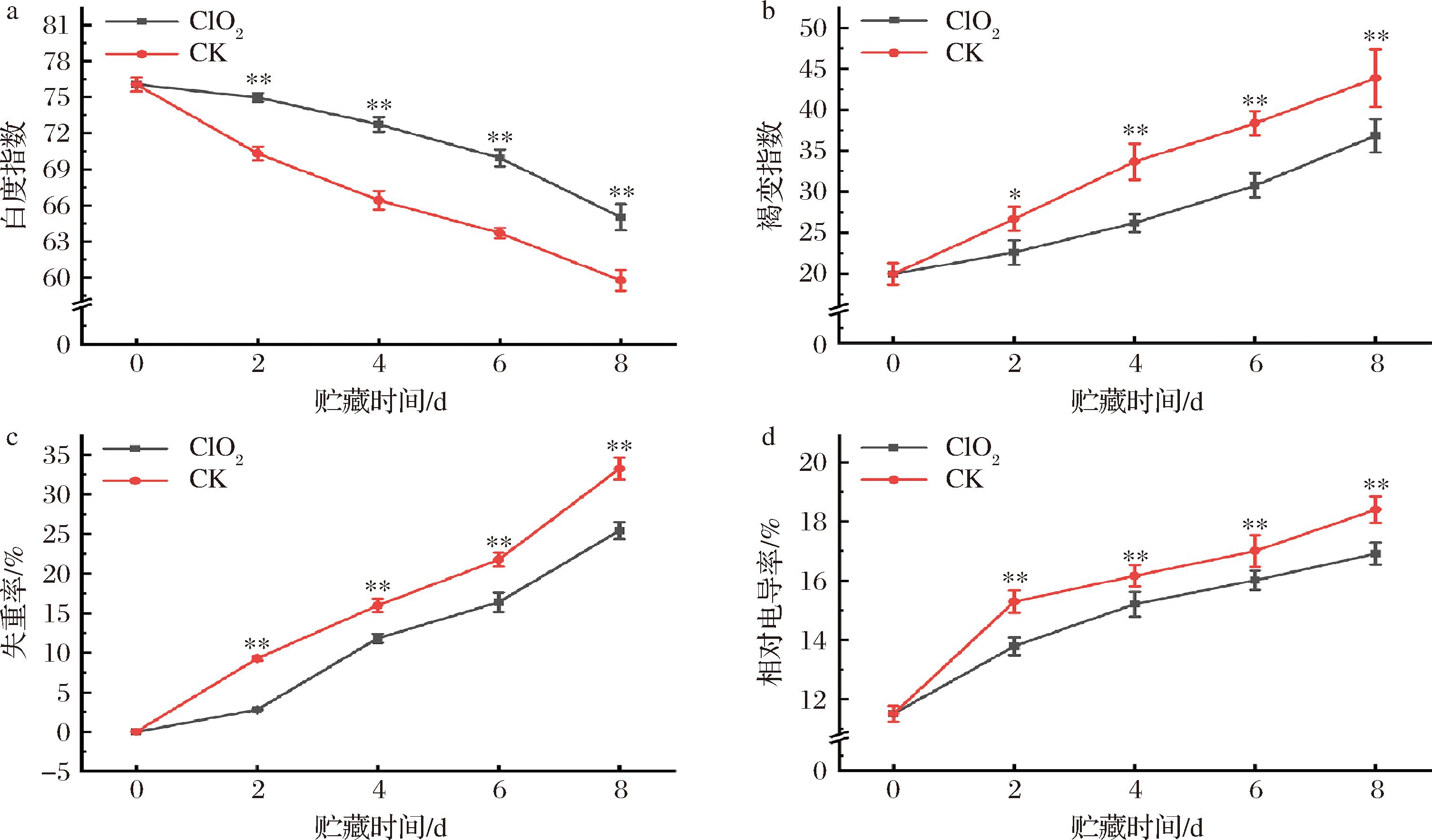
a-白度指数;b-褐变指数;c-失重率;d-相对电导率
图1 ClO2对仔姜贮藏期间品质变化的影响
Fig.1 Effect of chlorine dioxide on the quality changes of young ginger during storage
注:处理与对照之间的*表示显著差异(*,P<0.05;**,P<0.01)。
2.2 ClO2对仔姜采后贮藏期间失重率的影响
仔姜在贮藏过程中内部组织仍会进行生理活动,其中的蒸腾作用和呼吸作用会加速水分损失和物质消耗[19],导致质量下降。由图1-c可知,在整个贮藏过程中仔姜的失重率随着贮藏时间的延长不断增加,而处理组的仔姜失重率始终低于对照组。贮藏至第4、6、8天时,处理组的失重率分别为对照组的73.98%、75.24%和76.45%,且两处理间差异极显著(P<0.01)。这说明ClO2可有效延缓仔姜失重率的升高,减少质量损失,从而延缓其萎蔫劣变。
2.3 ClO2处理对仔姜采后贮藏期间相对电导率的影响
细胞膜结构破坏会加速果蔬腐烂变质[20]。细胞膜完整性是衡量果蔬贮藏品质的重要指标,常用相对电导率表征。如图1-d所示,在整个贮藏期间,2组仔姜的相对电导率均呈逐渐上升的趋势,贮藏至第2天时升高最为迅速,且对照组和处理组相对电导率分别为初始的1.33和1.20倍。贮藏2 d后,处理组相对电导率升高速率减缓。但是处理组的相对电导率始终低于对照组,贮藏至第8天时,处理组的相对电导率比对照组低约8.81%。因此,ClO2可有效抑制仔姜采后贮藏期间相对电导率的升高,维持其细胞膜的完整性。
2.4 ClO2对仔姜采后贮藏期间代谢物的影响
2.4.1 仔姜不同组间样本相关性分析
利用UPLC-MS/MS技术检测不同处理的仔姜在贮藏0 d和6 d后代谢物的变化。为了确保在采集过程中的稳定性,每10个样本作为一个质控(quality control,QC)样本。通过对样本进行主成分分析(principal component analysis,PCA),发现相同样品的质控样本紧密聚集,表明本实验数据稳定性好、重复性佳。仔姜质控样本同组样本较聚集,不同组间样本分离明显,说明不同样本间存在显著性差异(图2)。PCA结果表明组内样本重复性较好,且不同组间差异显著,体现样本的可靠性,检测数据可用于后续差异代谢物分析。
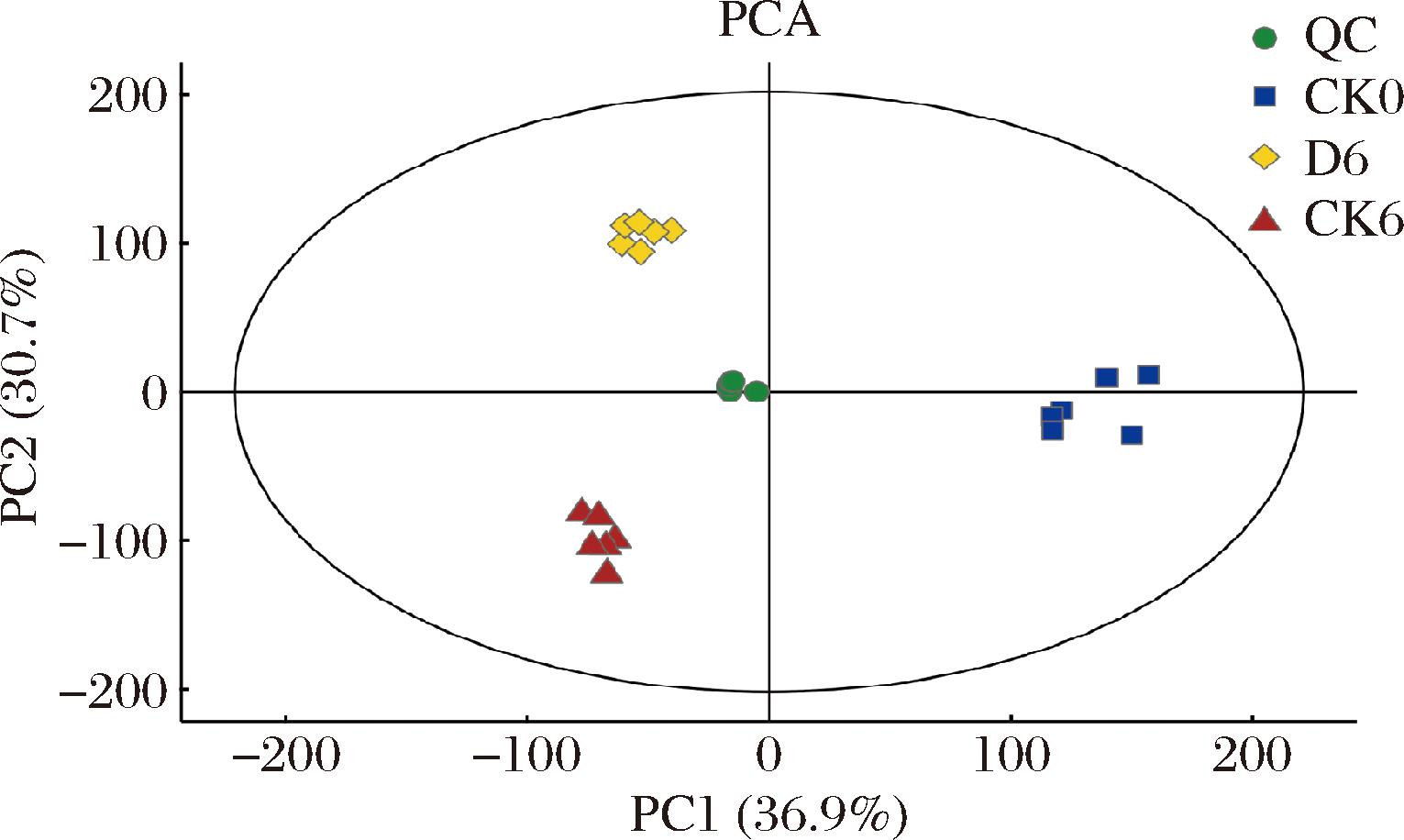
图2 仔姜不同样本间相关性分析图
Fig.2 Correlation analysis between different samples of young ginger
2.4.2 仔姜不同组间差异代谢物筛选
根据PCA结果,以变量投影重要性(variable important in projection,VIP)≥1、P<0.05且差异倍数(fold change,FC)≥2为筛选条件,对仔姜样本检测出的代谢物进行变量统计分析。结果表明,差异代谢物共计875个,其中上调的有575个,下调的有298个,且差异代谢物的丰度表达存在显著性差异,在整个贮藏过程中,差异代谢物上调表达显著高于下调表达(图3和表1)。其中,处理组第6天与对照组第0天相比(D6 VS CK0),筛选出462个差异代谢物,其中显著性上调的差异代谢物有260个,下调的差异代谢物有111个(图3-a);对照组第6天与对照组第0天相比(CK6 VS CK0),筛选出473个差异代谢物,其中显著上调的差异代谢物有的202个,下调的有177个(图3-b);处理组第6天与对照组第6天相比(D6 VS CK6),共筛选出544个差异代谢物,其中显著上调的有265个,下调的有160个(图3-c)。与其他2个比较组相比,D6 VS CK0组间的差异代谢物总数较少,这说明ClO2较好地保持了仔姜内代谢物的数量和含量变化,减缓了内部物质的代谢消耗,维持了其贮藏品质。
表1 仔姜差异代谢物的表达 单位:个
Table 1 Expression of differential metabolites in young ginger
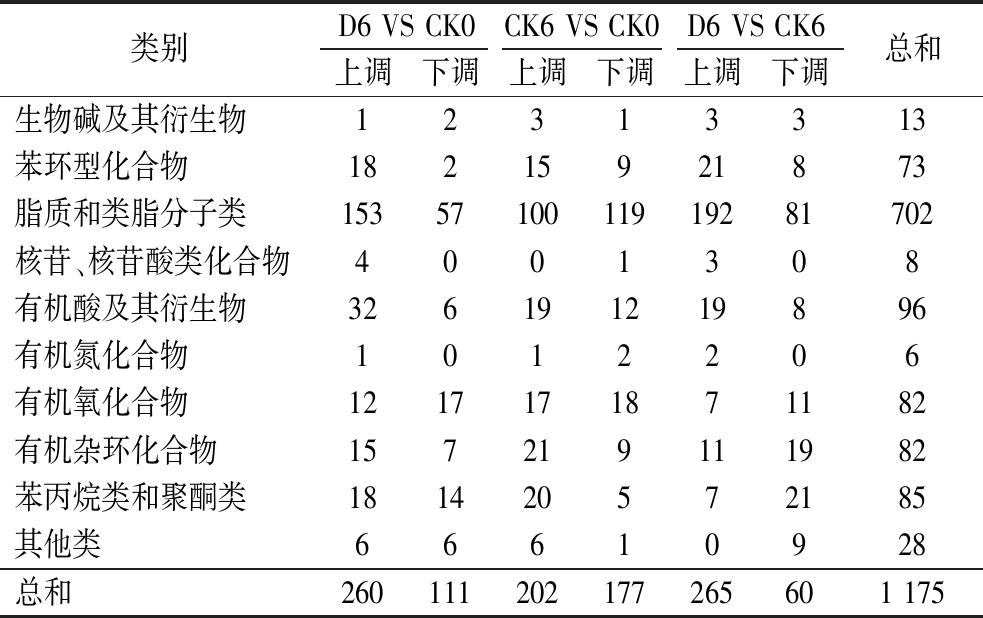
类别D6 VS CK0CK6 VS CK0D6 VS CK6上调下调上调下调上调下调总和生物碱及其衍生物12313313苯环型化合物18215921873脂质和类脂分子类1535710011919281702核苷、核苷酸类化合物4001308有机酸及其衍生物326191219896有机氮化合物1012206有机氧化合物1217171871182有机杂环化合物157219111982苯丙烷类和聚酮类181420572185其他类66610928总和260111202177265601 175
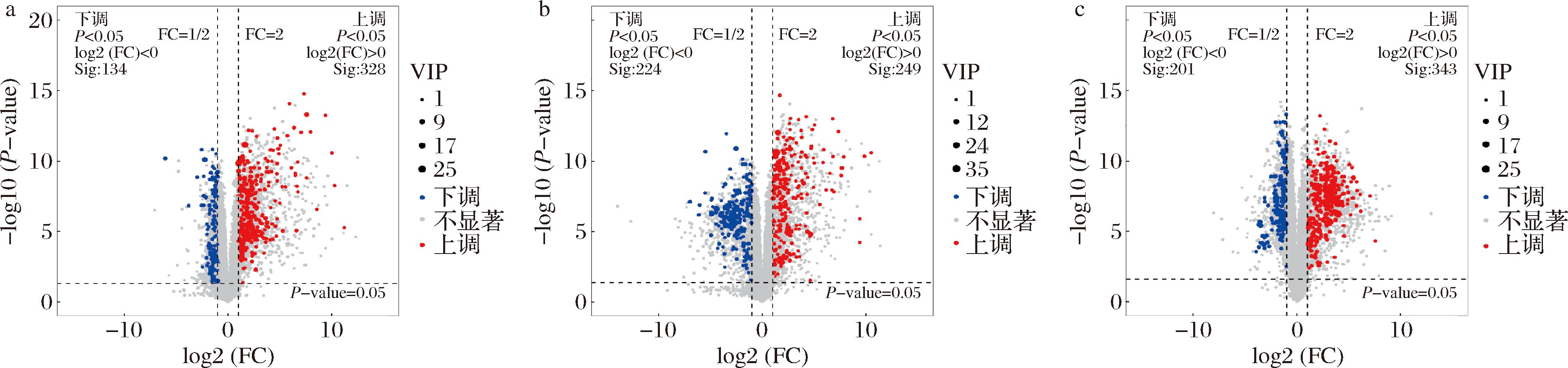
a-D6 VS CK0组差异代谢物火山图;b-CK6 VS CK0组差异代谢物火山图;c-D6 VS CK6组差异代谢物火山图
图3 仔姜不同组间差异代谢物火山图
Fig.3 Volcano diagram of differential metabolites between different groups of ginger
为了更直观地展示比较组间差异代谢物及其含量变化规律,对显著性差异代谢物进行分类统计。由表1可知,3个比较组间的代谢物种类有很大的差异性。在贮藏过程中,ClO2处理主要显著上调仔姜内部脂质和类脂分子类、有机酸及其衍生物、苯丙烷类、聚酮类以及苯环类代谢物。根据代谢物的表达丰度进行层次聚类分析,结果如图4所示,在贮藏过程中相对表达丰度逐渐增加的差异代谢物有13种,包括香豆酸、2-羟基肉桂酸、20-羟基白三烯B4、L-色氨酸、表没食子儿茶素、(+)-儿茶素、氧化型谷胱甘肽、3-丙基苹果酸、3-羟基-N6-三甲基-L-赖氨酸、甘油磷酸胆碱、顺式玉米素-O-葡萄糖苷、2,6-二磷酸β-D-果糖、酪胺葡糖苷酸;表达丰度逐渐减少的差异代谢物有16种,包括D-半乳糖、二十碳五烯酸、20羟基二十碳四烯酸、D-葡萄糖酸、乳糖胺、神经酸、奎宁酸、8,9-环氧二十碳三烯酸、γ-氨基丁酸、肉豆蔻酸、L-磷酸精氨酸、α-生育酚、15-羟基二十碳-5Z,8Z,11Z,13E-四烯酸、赤霉素A12醛、花生四烯酸。在贮藏过程中,ClO2可以增加L-异亮氨酸、香豆素酸、2-羟基肉桂酸、(+)-没食子酸、儿茶素、氧化谷胱甘肽、谷胱甘肽、甘油磷胆碱、L-亮氨酸、顺式-玉米素-O-葡萄糖苷等差异代谢物含量,减少D-半乳糖、乳糖胺、D-葡萄糖酸、γ-氨基丁酸、D-葡萄糖醛酸、白三烯E4等差异代谢物含量。贮藏第6天时,与对照组相比,ClO2显著上调了20-羟基二十碳四烯酸、二十碳五烯酸、9,10,13-三羟基十八烯酸、8,9-环氧二十碳三烯酸、13(S)-羟基十八碳三烯酸、谷胱甘肽、9(S)-羟基十八碳三烯酸、α-生育酚、白三烯B4、白三烯F4、11(12)-二烯-5α,13α二醇、花生四烯酸、11(12)-二烯-5α-醇等差异代谢物表达量,下调了L-色氨酸、赤霉素A5和麦角硫因等差异代谢物的表达量。

a-D6 VS CK0组差异代谢物热图;b-CK6 VS CK0组差异代谢物热图;c-D6 VS CK6组差异代谢物热图
图4 仔姜不同组间的差异代谢物热图分析
Fig.4 Thermogram analysis of differential metabolites between different groups of young ginger
2.4.3 差异代谢物相关性分析
基于Pearson相关系数,将显著性差异最大的20种代谢物进行相关性网络分析,展示代谢物之间及代谢物在不同样本之间的相关性。在D6 VS CK0组中与香豆酸相关的差异代谢物最多,分别与L-异亮氨酸、神经氨酸、2-羟基肉桂酸、D-葡萄糖酸-1,4-内酯、3,4-二氢-2H-1-苯并吡喃-2-酮、N-丙二酰色氨酸、N-乙酰-DL-色氨酸和甘氨酰-脯氨酰-甲硫氨酰-苯丙氨酰-缬氨酰胺呈正相关,与磺胺呈负相关(图5-a);CK6 VS CK0组中与姜酮酚相关的差异代谢物最多,分别与香豆酸、N-乙酰基-DL-色氨酸、吲哚丙烯酸、N-丙二酰色氨酸、(Z)-1-(甲硫基)-5-苯基-1-戊烯-3-炔、2-羟基肉桂酸、3,4-二氢-2H-1-苯并吡喃-2-酮和3-甲基亚砜呈正相关,与12-羟基二十碳五烯酸、5α-雄烯酮-3-17-酮、D-半乳糖和磺胺呈负相关(图5-b);D6 VS CK6中与4Z,7Z,9E,11E,13Z,16Z,19Z-二十二碳七烯酸相关的差异代谢物最多,分别与20-羟基二十碳四烯酸、17-苯基三硝基PGF2酰胺、12-羟基二十碳五烯酸、麦角甾酰胺 H呈正相关,与γ-CEHC Glc呈负相关(图5-c)。
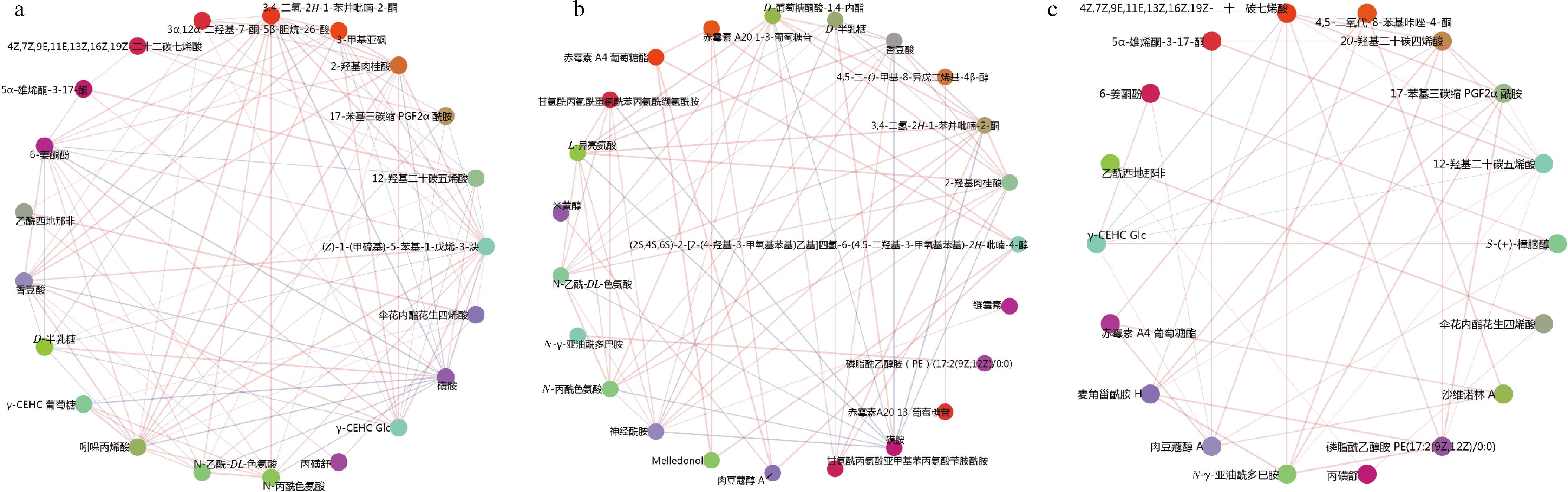
a-D6 VS CK0组差异代谢物相关性网络图;b-CK6 VS CK0组差异代谢物相关性网络图;c-D6 VS CK6组差异代谢物相关性网络图
图5 仔姜不同组间的差异代谢物相关性网络图分析
Fig.5 Network diagram of differential metabolite correlation between different groups of young ginger
注:连线的粗细代表关联性的高低程度,连线为红色为正相关,连线为蓝色为负相关。
2.4.4 仔姜不同处理组间差异代谢物KEGG分析
为了进一步揭示ClO2处理对仔姜贮藏品质和营养成分的调控机制,利用KEGG数据库对检测出的差异代谢物进行功能注释和代谢通路富集分析。结果表明,D6 VS CK0组中筛选出33个差异代谢物,被KEGG注释到35个通路,其中显著富集(P<0.05)的是亚油酸代谢、缬氨酸、亮氨酸和异亮氨酸生物合成、花生四烯酸代谢和谷胱甘肽代谢等通路,亚油酸代谢通路富集的差异代谢物最多,包括9,10,13-三羟基十八烯酸、9-氧化辛二烯酸、13(S)-羟基庚酯、9(S)-羟基庚酯、11-羟基庚酯、12,13-二羟基十八碳烯酸(图6-a);CK6 VS CK0组中37个差异代谢物被注释到37个通路中,其中花生四烯酸代谢和苯丙氨酸、酪氨酸和色氨酸生物合成路径显著富集,差异代谢物8,9-环氧二十碳三烯酸、20-羟-二十烷四烯酸、19(S)-羟-二十烷四烯酸、花生四烯酸酯、15-羟基二十碳-5Z,8Z,11Z,13E-四烯酸、8,9-EET富集在花生四烯酸代谢路径中(图6-b);D6 VS CK6组中有23个差异代谢物被注释到19个通路中,且主要富集在亚油酸代谢、花生四烯酸代谢、不饱和脂肪酸的生物合成和二萜生物合成4条路径中,其中花生四烯酸酯、11-羟基庚酯、9-氧化辛二烯酸、9(S)-羟基庚酯、13(S)-羟基庚酯、9,10,13-三羟基十八烯酸在亚油酸代谢通路中显著上调(图6-c)。

a-D6 VS CK0组差异代谢物通路分析;b-CK6 VS CK0组差异代谢物通路分析;c-D6 VS CK6组差异代谢物通路分析
图6 仔姜不同组间的差异代谢物通路分析
Fig.6 Analysis of differential metabolite pathways between different groups of young ginger
3 讨论
仔姜具有皮薄汁多的品质特征,在贮藏过程中表皮易出现褐斑或凹陷等症状[21],且极易失水萎蔫,严重影响其商品价值。ClO2是一种安全有效的保鲜剂,在荔枝[22]、猕猴桃[9]、翠红李[11]和鲜切西兰花[12]等果蔬的贮藏保鲜上均有报道。本研究发现ClO2对仔姜的贮藏也起到一定的保鲜效果,尤其在失水萎蔫和褐变等方面有显著的抑制作用(图1)。在贮藏过程中,仔姜的失重率逐渐上升,杜美军等[23]用1-甲基环丙烯处理减缓仔姜失水萎蔫。本实验中经ClO2处理后的仔姜失重率低于对照组,延缓仔姜失重上升,维持组织硬度,抑制组织褐变,保持良好的贮藏品质。本实验中ClO2处理后的仔姜褐变度明显低于对照组,说明ClO2同样能有效抑制仔姜失水和褐变,维持贮藏品质。
在贮藏过程中,果蔬仍进行蒸腾作用,过度的渗透失水会造成质壁分离,破坏细胞膜结构,通透性失调,从而造成果蔬外形皱缩、光泽消退等品质劣变现象[24]。本实验中仔姜的相对电导率持续增加,这说明在贮藏过程中仔姜的细胞膜结构会遭到破坏,降低或失去选择透性,从而加速仔姜萎蔫[25]。细胞膜由蛋白质和脂质组成,通过不饱和脂肪酸等物质维持结构稳定。SINHA等[26]研究表明三酰基甘油脂肪酶可以调节亚油酸、亚麻酸等不饱和脂肪酸过氧化,增加膜脂不饱和度,从而改变膜的通透性。本研究发现ClO2通过刺激三酰基甘油脂肪酶催化亚麻油酸酯上调亚油酸代谢、花生四烯酸代谢和不饱和脂肪酸的生物合成等路径中11(S)-羟基庚酯、9(S)-羟基庚酯、13(S)-羟基庚酯、9-氧化辛二烯酸、9,10,13-三羟基十八烯酸、甘油磷酸胆碱、花生四烯酸、花生酮、19(S)-羟-二十烷四烯酸、20-羟-二十烷四烯酸、白三烯F4、白三烯B4等脂类物质的相对含量(图7)。由此,推测ClO2可以通过调控11(S)-羟基庚酯、甘油磷酸胆碱、花生酮等不饱和脂肪酸含量,维持细胞膜的完整性,从而减少物质和水分流失,保持仔姜贮藏品质。
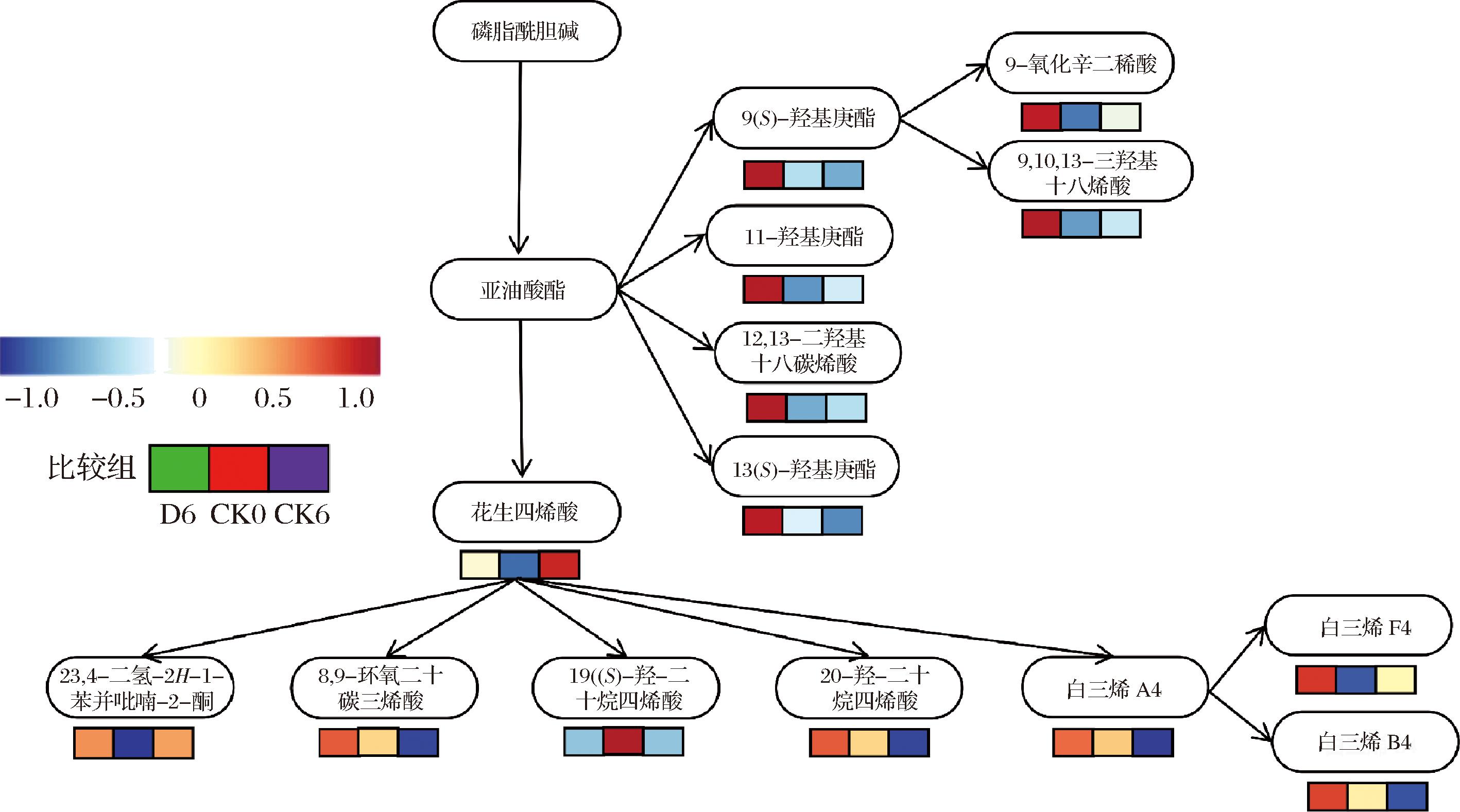
图7 仔姜不同组间不饱和脂肪酸代谢通路分析图
Fig.7 Analysis of metabolic pathway of unsaturated fatty acids in different groups of young ginger
细胞膜主要是通过大量不饱和脂肪酸维持结构稳定,当受到破坏时会产生大量活性氧,导致不饱和脂肪酸氧化和酶失活等一系列损伤,加速细胞衰老死亡[27]。随着贮藏时间的延长,仔姜褐变越严重,推测是由于细胞结构被破坏,活性氧与酚类物质接触等造成的[28]。酚类物质是植物体内重要的非酶类抗氧化物质[29],可以减缓活性氧对细胞结构的损伤。通过非靶代谢检测,发现ClO2可以上调圣草酚、表儿茶素、儿茶素、反式-L-羟基肉桂酸酯、4-氨基丁酸、4-香豆素、芥酸、咖啡酸、香豆酸、2-羟基肉桂酸、阿魏酸等酚类物质的含量(图4)。ZHANG等[30]通过多组学研究发现,仔姜成分中的酚类物质具有保护膜脂质结构,减缓氧化褐变的功效。本试验中,经ClO2处理的仔姜褐变程度低于对照组(图1-a,图1-b),由此推测ClO2通过增加酚类物质含量,降低细胞膜氧化损伤程度,延缓仔姜褐变,维持贮藏品质。
4 结论
本实验研究了ClO2对仔姜贮藏品质的调控作用。结果表明,15 ℃贮藏条件下ClO2对仔姜具有明显的生理调节作用,减缓失重率、相对电导率、褐变指数增加和白度指数的下降,维持贮藏品质。ClO2主要是通过调控甘油磷酸胆碱、圣草酚、表儿茶素、芥酸、咖啡酸、香豆素酸等不饱和脂肪酸和酚类物质含量稳持细胞膜结构,减轻膜脂过氧化程度,减少物质消耗和水分流失,从而较好地维持仔姜的营养成分,保持了良好的感官品质。本研究不仅为仔姜贮藏保鲜技术提供了新的理论支撑,也对ClO2在果蔬保鲜领域的推广应用开辟了新的思路。
[1] JIA X Y, DU M J, ZHENG Y L, et al.Automatic periodical SO2 fumigation improves the storage quality of tender ginger[J].Journal of Food Processing and Preservation, 2021, 45(4):e14949.
[2] 颜强, 侯颖辉, 陈静忠, 等.仔姜贮藏与泡制技术研究进展[J].保鲜与加工, 2021, 21(6):127-131.
YAN Q, HOU Y H, CHEN J Z, et al.Research progress on storage and processing technology of young ginger(Zingiber officinale)[J].Storage and Process, 2021, 21(6):127-131.
[3] LIU R, ZHU X H, WANG J, et al.Activated release of chlorine dioxide gas from polyvinyl alcohol microcapsule (ethylcellulose/sodium-chlorite) hybrid films for active packaging of litchi during postharvest storage[J].Postharvest Biology and Technology, 2023, 196:112173.
[4] SUN X X, ZHOU B, LUO Y G, et al.Effect of controlled-release chlorine dioxide on the quality and safety of cherry/grape tomatoes[J].Food Control, 2017, 82:26-30.
[5] GUO Q, WU B, PENG X Y, et al.Effects of chlorine dioxide treatment on respiration rate and ethylene synthesis of postharvest tomato fruit[J].Postharvest Biology and Technology, 2014, 93:9-14.
[6] INTARASIT S.Effects of gaseous chlorine dioxide on reactive nitrogen species metabolism of postharvest ‘Daw’ longan fruit in relation to pericarp browning[D].Chiang Mai:Graduate School, Chiang Mai University, 2022.
[7] YAN R, CHEN Q M, FU M R.Chlorine dioxide generation method and its action mechanism for removing harmful substances and maintaining quality attributes of agricultural products[J].Food and Bioprocess Technology, 2019, 12(7):1110-1122.
[8] CHAI H E, HWANG C A, HUANG L H, et al.Feasibility and efficacy of using gaseous chlorine dioxide generated by sodium chlorite-acid reaction for decontamination of foodborne pathogens on produce[J].Food Control, 2020, 108:106839.
[9] 王国立, 吴素芳, 谭永元, 等.二氧化氯对“贵长” 猕猴桃采后贮藏品质的影响[J].贵州农业科学, 2022, 50(1):69-76.
WANG G L, WU S F, TAN Y Y, et al.Effects of chlorine dioxide treatment on post-harvest storage quality of Guichang kiwifruit[J].Guizhou Agricultural Sciences, 2022, 50(1):69-76.
[10] 刘云飞, 纪海鹏, 陈存坤,等.二氧化氯对香梨贮藏后期品质保持效果的研究[J].包装工程, 2020, 41(5):1-7.
LIU Y F, JI H P, CHEN C K, et al.Effect of chlorine dioxide treatment on quality maintenance of Korla pears in later storage period[J] Packaging Engineering, 2020, 41 (5):1-7.
[11] 赵治兵, 刘永玲, 李莹, 等.二氧化氯浓度对翠红李贮藏品质的影响[J].食品与机械, 2021, 37(8):153-157.
ZHAO Z B, LIU Y L, LI Y, et al.Effect of chlorine dioxide concentration on storage quality of Cuihong plum[J].Food &Machinery, 2021, 37(8):153-157.
[12] 张玉萍, 贾卫亮, 孟伦, 等.固态二氧化氯缓释保鲜剂的制备及其对鲜切西兰花的保鲜效果[J].食品工业科技, 2024, 45(20):312-319.
ZHANG Y P, JIA W L, MENG L, et al.Preparation of solid chlorine dioxide slow-release preservative and its preservation effect on fresh-cut broccoli[J].Science and Technology of Food Industry, 2024, 45(20):312-319.
[13] MART NEZ BUENO M J, D
NEZ BUENO M J, D AZ-GALIANO F J, RAJSKI
AZ-GALIANO F J, RAJSKI  , et al.A non-targeted metabolomic approach to identify food markers to support discrimination between organic and conventional tomato crops[J].Journal of Chromatography A, 2018, 1546:66-76.
, et al.A non-targeted metabolomic approach to identify food markers to support discrimination between organic and conventional tomato crops[J].Journal of Chromatography A, 2018, 1546:66-76.
[14] SELAMAT J, ROZANI N A A, MURUGESU S.Application of the metabolomics approach in food authentication[J].Molecules, 2021, 26(24):7565.
[15] 康聪. 基于非靶向代谢组学研究黄龙病菌对砂糖橘的影响[D].广州:仲恺农业工程学院, 2019.
KANG C.Research on the effect of huanglong pathogen on sugar orange based on non-targeted metabolomics[D].Guangzhou:Zhongkai University of Agriculture and Engineering, 2019.
[16] UTPOTT M, RODRIGUES E, DE OLIVEIRA RIOS A, et al.Metabolomics:An analytical technique for food processing evaluation[J].Food Chemistry, 2022, 366:130685.
[17] RINALDO D, SOTIN H, PÉTRO D, et al.Browning susceptibility of new hybrids of yam (Dioscorea alata) as related to their total phenolic content and their phenolic profile determined using LC-UV-MS[J].LWT, 2022, 162:113410.
[18] WU W J, GAO H Y, CHEN H J, et al.Combined effects of aqueous chlorine dioxide and ultrasonic treatments on shelf-life and nutritional quality of Bok choy (Brassica chinensis)[J].LWT, 2019, 101:757-763.
[19] 付云云, 蒋成, 闫小倩, 等.水杨酸处理对仔姜保鲜效果的影响[J].食品与机械, 2019, 35(4):157-162.
FU Y Y, JIANG C, YAN X Q, et al.Effect of salicylic acid treatment on fresh-keeping of baby gingers[J].Food &Machinery, 2019, 35(4):157-162.
[20] XU D Y, ZUO J H, FANG Y L, et al.Effect of folic acid on the postharvest physiology of broccoli during storage[J].Food Chemistry, 2021, 339:127981.
[21] 刁源, 曾顺德, 程杨, 等.电子束辐照对生鲜仔姜采后贮藏品质的影响[J].南方农业, 2023, 17(5):190-193.
DIAO Y, ZENG S D, CHENG Y, et al.Effect of electron beam irradiation on postharvest storage quality of fresh tender ginger[J].South China Agriculture, 2023, 17(5):190-193.
[22] 郭莉, 吴广, 尹青春, 等.二氧化氯缓释剂对低温贮藏荔枝品质及关键花青素的影响[J].食品工业科技, 2024, 45(6):297-303.
GUO L, WU G, YIN Q C, et al.Impact of chlorine dioxide slow-releasing preservative on quality and key anthocyanins of litchi during low temperature storage[J].Science and Technology of Food Industry, 2024, 45(6):297-303.
[23] 杜美军, 张鲜桃, 刘震远, 等.1-MCP与脉冲熏硫联合调控四川仔姜保鲜效果研究[J].中国调味品, 2021, 46(3):7-10.
DU M J, ZHANG X T, LIU Z Y, et al.Research on the effect of 1-MCP and pulse sulfur fumigation on the preservation of Sichuan tender ginger[J].China Condiment, 2021, 46(3):7-10.
[24] ROMERO P, ROSE J K C.A relationship between tomato fruit softening, cuticle properties and water availability[J].Food Chemistry, 2019, 295:300-310.
[25] 贾晓昱, 杜美军, 张鲜桃, 等.不同浓度CO2对四川仔姜采后贮藏品质的影响[J].中国果菜, 2019, 39(12):7-11.
JIA X Y, DU M J, ZHANG X T, et al.Effect of control atomospher on postharvest storage quality of Sichuan tender ginger[J].China Fruit &Vegetable, 2019, 39(12):7-11.
[26] SINHA K, KAUR R, SINGH N, et al.Mobilization of storage lipid reserve and expression analysis of lipase and lipoxygenase genes in rice (Oryza sativa var.Pusa Basmati 1) bran during germination[J].Phytochemistry, 2020, 180:112538.
[27] 廖雯, 代慧, 舒丽洁,等.呼吸调控下的细胞膜完整性对仔姜贮藏失水的影响[J].食品与发酵工业, 2024, 50(3):232-240.
LIAO W, DAI H, SHU L J, et al.Effects of respiration-regulated cell membrane integrity on water loss in ginger storage[J] Food and Fermentation Industries, 2024, 50 (3):232-240.
[28] 徐斌, 唐继兴, 赵垚垚,等.咪鲜胺和二氧化氯处理对仔姜贮藏品质的影响[J].包装工程, 2022, 43(13):100-106.
XU B, TANG J X, ZHAO Y Y, et al.Effect of treatment of prochloraz and chlorine dioxide on storage quality of tender ginger[J] Packaging Engineering, 2022, 43 (13):100-106.
[29] WANG W L, CAO Z M, HOU F R, et al.Quality maintenance mechanism of oxalic acid treatment in fresh-cut apple fruit during storage based on nontarget metabolomics analysis[J].Food Chemistry, 2024, 436:137685.
[30] ZHANG P, WANG Y H, WANG J, et al.Transcriptomic and physiological analyses reveal changes in secondary metabolite and endogenous hormone in ginger (Zingiber officinale Rosc.) in response to postharvest chilling stress[J].Plant Physiology and Biochemistry, 2023, 201:107799.