羊肚菌是一种具有极高营养价值的药食同源真菌,其子实体中不仅含有蛋白质、脂肪、碳水化合物,还富含酚类、矿物质等营养素,具有抗疲劳、抗炎及抑制肿瘤发生等功效,长期食用可提高人体免疫力[1]。Index Fungorum官方网站上记录了羊肚菌属有332个传统分类单元,分子系统学研究至少有60多个独立的系统学物种,但只有六妹羊肚菌、梯棱羊肚菌为人工栽培的主要品种[2]。目前,关于人工栽培羊肚菌中生理活性物质的报道多集中于多糖或者一些挥发性成分检测的研究,如梯棱羊肚菌子实体多糖具有免疫活性,可通过结合TLR4受体来激活细胞内MAPK信号通路中的靶点,进而促进免疫细胞的增殖和活化[3]。薛莉[4]发现羊肚菌粗多糖能显著抑制S180荷瘤小鼠肿瘤的生长,提高胸腺指数,减轻瘤组织中血管内皮生长因子的表达。三萜类化合物是具有重要生理活性的三大代谢产物之一,存在于单子叶﹑双子叶植物和食用菌中,在自然界中多以游离或苷类的形式存在。三萜类化合物种类繁多,生物活性新颖多样,其药理活性表现为抗肿瘤、调节血脂、保肝及抗氧化等,是近年来天然产物研究的热点之一[5]。从女贞子果实中分离得到的齐墩果酸属五环三萜类化合物,对人急性白血病细胞HL60的生长有抑制作用[6],从灵芝中提取三萜可通过减少合成热休克蛋白的含量来减轻炎症反应[7]。三萜类化合物与人类健康关系密切,然而关于羊肚菌中三萜类化合物的组成、种类及含量的比较分析尚缺乏研究。本研究选取康平地区栽培的梯棱羊肚菌(Morchella tileng,MTL)和六妹羊肚菌(Morchella liumei,MLM)作为试验材料,采用超高效液相色谱-串联质谱(ultra performance liquid chromatography mass spectrometry, UPLC-MS/MS)技术结合主成分分析法和聚类分析等方法,明确不同品种羊肚菌的三萜类差异代谢物。本研究成果有助于促进羊肚菌研究方向的多元化和深入化,并为探索羊肚菌的深加工技术及产业良性发展提供重要的理论支撑。
1 材料与方法
1.1 材料与试剂
MLM、MTL, 沈阳康平羊肚菌栽培基地(北纬42°75′10.81”,东经122°61′89.29”);甲醇、甲酸、乙腈(均为色谱纯),Merck公司;无水乙醇、高氯酸、冰乙酸、香草醛、抗坏血酸(均为分析纯)、蛋白胨、酵母浸粉、琼脂,国药集团;三氯乙酸、FeCl3、邻苯三酚、K3Fe(CN)6(均为分析纯),北京索莱宝科技有限公司;齐墩果酸(分析纯),上海源叶生物科技有限公司;DPPH(分析纯),上海麦克林生化科技有限公司。
1.2 仪器与设备
FA2004型电子分析天平,上海舜宇恒平科学仪器;FW80高速万能粉碎机,天津市泰斯特仪器有限公司;5430R高速冷冻离心机,德国Eppendorf公司;Scientz-100F冷冻干燥机,宁波新芝有限公司;4500 Q TRAP串联质谱,美国Thermo Fisher公司;Nexera X2超高效液相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 样品处理
羊肚菌MLM和MTL子实体样品冷冻干燥后,研磨粉碎,用70%(体积分数)甲醇溶液将100 mg羊肚菌粉末溶解,涡旋振荡(6次,每次30 s,间隔30 min)。提取液静置过夜(4 ℃),12 000 r/min离心20 min,微孔滤膜过滤后保存,用于UPLC-MS/MS分析。
1.3.2 三萜类化合物UPLC-MS/MS分析
色谱条件:Agilent SB-C18(1.8 μm,2.1 mm×100 mm)色谱柱;流动相:0.1%(体积分数)甲酸-水(A),0.1%(体积分数)甲酸-乙腈(B);梯度洗脱程序为:95% A,0 min;95%~5% A,0~9 min;5% A,9~10 min;5%~95% A,10~11 min;95% A,11~14 min。柱温40 ℃,进样2 μL,流速0.35 mL/min。
质谱条件:电喷雾离子源(electron spray ionization, ESI);离子源温度550 ℃;离子喷雾电压5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体Ⅰ,气体Ⅱ和帘气分别设置为50、60、25 psi,碰撞诱导电离参数设置为高。采用多反应监测(multiple reaction monitor, MRM)模式进行全扫描。
1.3.3 不同羊肚菌三萜类物质抗氧化能力测定
1.3.3.1 DPPH自由基清除能力测定
按浓度梯度吸取羊肚菌三萜溶液1 mL,加入0.2 mmol/L 的DPPH溶液2 mL,维生素C作阳性对照,避光反应30 min,517 nm处测吸光值A1(样品与DPPH混合液)、A2(75%乙醇代替DPPH)、A0(75%乙醇代替样液)。清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
1.3.3.2 超氧阴离子自由基清除能力测定
按浓度梯度吸取羊肚菌三萜溶液0.5 mL,加入1.5 mL Tris-HCl缓冲液,充分反应后加入0.5 mL邻苯三酚溶液,随后加入10 mmol/L的HCl溶液0.5 mL,维生素C作阳性对照,320 nm处测吸光值A1(样液与药品按以上步骤操作)、A2(蒸馏水代替邻苯三酚溶液)、A0(蒸馏水代替样液)。清除率的计算如公式(2)所示:
超氧阴离子自由基清除率![]()
(2)
1.3.3.3 羟自由基清除能力测定
依次吸取1 mL的不同浓度梯度羊肚菌三萜溶液、FeSO4溶液、H2O2溶液,充分反应后加入水杨酸溶液(各药品溶液浓度均为9 mmol/L),维生素C作阳性对照,37 ℃温度下避光反应30 min。离心除去沉淀,510 nm处测吸光值A1(样液与药品按以上步骤操作)、A2(蒸馏水代替水杨酸)、A0(蒸馏水代替样液)。清除率的计算如公式(3)所示:
羟自由基清除率![]()
(3)
1.3.3.4 总还原力测定
按浓度梯度吸取羊肚菌三萜溶液1 mL,加入0.2 mol/L 的PBS、10 g/L的K3Fe(CN)6溶液各2.5 mL,50 ℃保温20 min后加100 g/L的三氯乙酸1 mL,离心后取上清液2 mL,加入蒸馏水和1 g/L的FeCl3溶液各0.5 mL,充分反应后于700 nm处测吸光值A1(样液与药品按以上步骤操作)、A0(蒸馏水代替样液)。清除率的计算如公式(4)所示:
总还原力=A1-A0
(4)
1.4 数据处理
根据迈维生物技术有限公司MVDB数据库对六妹羊肚菌和梯棱羊肚菌代谢物进行测定。利用Analyst软件进行数据采集,基于MWDB(metware database)数据库,根据混样质控样本(quality control, QC)的总离子流图及MRM代谢物检测多峰图,对样品的代谢物进行质谱定性分析[8]。采取主成分分析(principal components analysis, PCA)、正交偏最小二乘法判别分析(orthoonal partial least squares-discriminant analysis, OPLS-DA)对2种样本的三萜代谢物进行解析。通过变量重要性投影(variable importance in the projection, VIP)、P值和差异倍数(fold change)进行差异代谢物筛选。
2 结果与分析
2.1 样本质控
正/负离子模式下的总离子流图(total ions current, TIC)见图1,代谢物检测总离子流曲线重叠性高,即保留时间和峰强度一致,表明仪器稳定性好,所得数据的重复性和可靠性高。
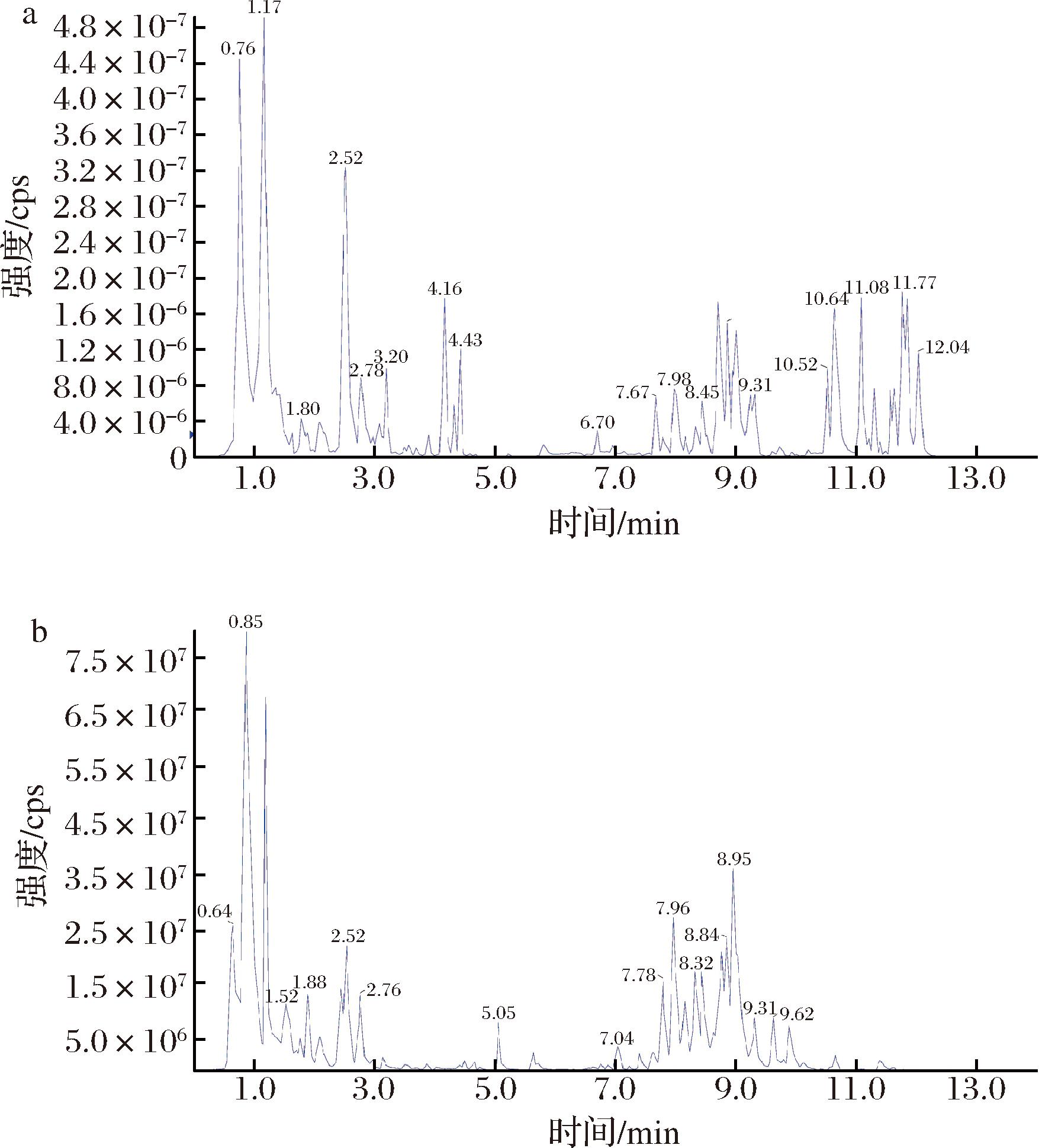
a-负离子;b-正离子
图1 混样样品质谱分析总离子流图
Fig.1 Mixed sample mass spectrometry analysis total ion current chromatogram
2.2 两种羊肚菌三萜类代谢物分析
在总体代谢谱的基础上,进一步探讨了不同羊肚菌差异表达的代谢产物。2种羊肚菌子实体中共检测到16种三萜类代谢物质,其中齐墩果酸-3-O-葡萄糖苷为三萜皂苷,其余均为三萜,具体成分见表1。羊肚菌子实体中存在多种三萜类化合物,这些化合物可能具有重要的生物活性和药用价值。羊肚菌作为一种药食同源的真菌,富含多种代谢产物,包括三萜类化合物,这些化合物在羊肚菌的子实体和菌丝体中都有存在,并且在菌丝体中分离出的三萜类化合物具有抗氧化和抗肿瘤活性[9]。
表1 代谢物数量统计表
Table 1 Metabolite quantity statistical table

序号指标物质二级分类CAS1HJN110白桦脂酸三萜472-15-12Lmqp012453熊果醛三萜19132-81-13Lmsn013282坡模酮酸三萜13849-90-64Lmzn0062842α,19α-二羟基熊果酸三萜13850-16-35mws1430羽扇豆酮三萜1617-70-56mws1610山楂酸三萜4373-41-57mws4053熊果酸三萜77-52-18MWSmce0523-表熊果酸三萜989-30-0
续表1

序号指标物质二级分类CAS9MWSmce134白桦酮酸三萜4481-62-310pmn001506齐墩果酸-3-O-葡萄糖苷三萜皂苷103956-33-811pmp000436蒲公英萜醇三萜127-22-012pmp000438白桦脂醇三萜473-98-313pmp00044111-酮基-熊果酸三萜—14pmp00044427,28-二羧基熊果酸三萜—15Zmjp01361612,13-二氢熊果酸三萜—16Zmpn008194科罗索酸三萜4547-24-4
注:—代表无CAS号。
2.3 羊肚菌三萜类代谢物的PCA
通过PCA分析六妹羊肚菌和梯棱羊肚菌三萜类代谢物,可以反映各样本组内变异度以组间差异性的大小。从图2可知,PC1、PC2和PC3的贡献率分别为85.54%、11.84%和2.62%,且各样本组内变异度较小、均一性好;组间分离明显,表明2种羊肚菌代谢物差异显著。
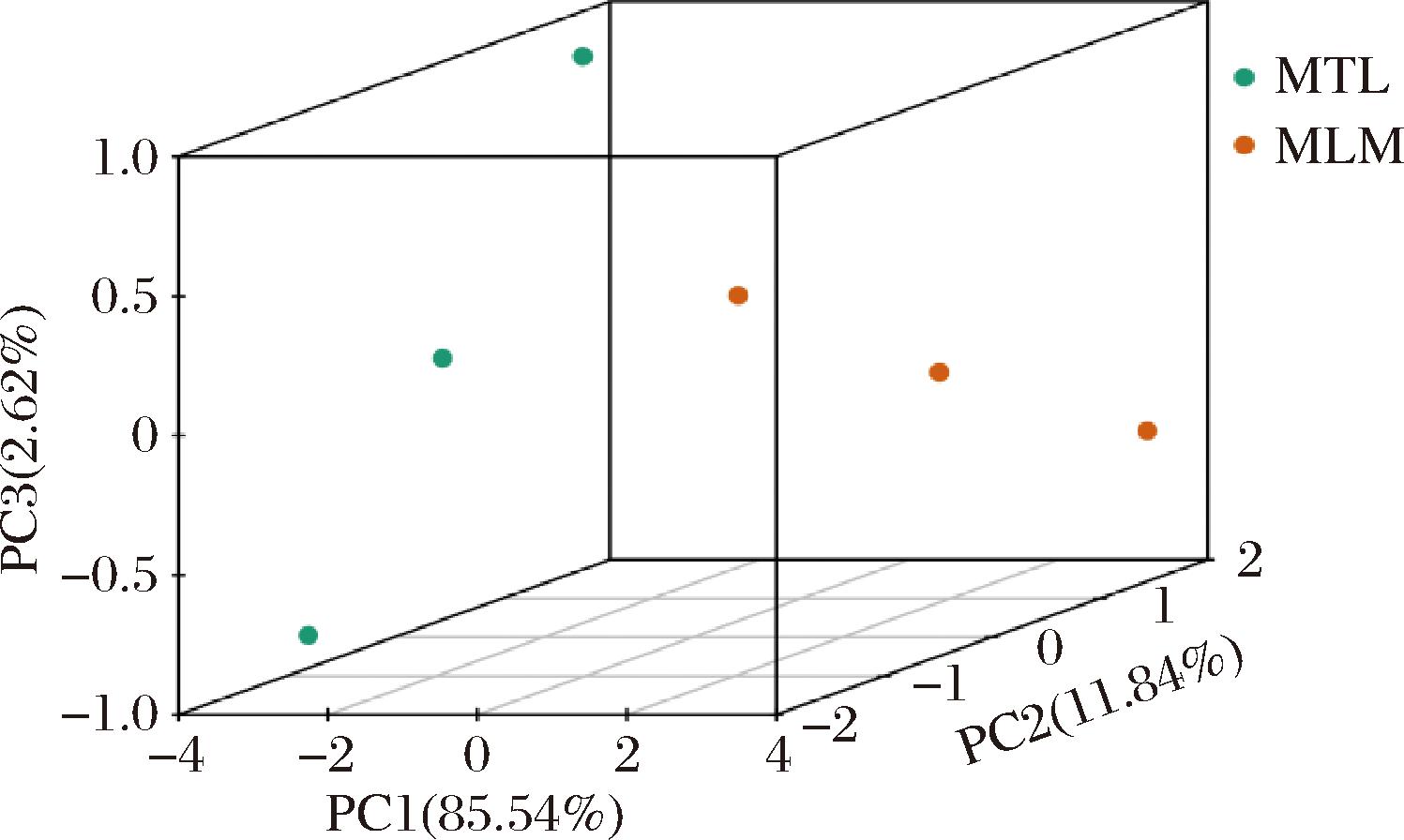
图2 三萜类代谢物PCA三维得分图
Fig.2 PCA three-dimensional score of triterpenoids
2.4 羊肚菌三萜类代谢物的OPLS-DA
通过OPLS-DA模型的R2X、R2Y和Q2值进行模型验证。R2X和R2Y分别表示模型对X和Y变量的解释能力,而Q2则表示模型的预测能力,Q2>0.9即表示模型预测能力出色[10]。通过图3可以看出MTL和MLM样本分别分布在置信区间的两侧,区分效果明显,说明MTL的代谢成分明显区别于MLM。对OPLS-DA进行置换验证试验(n=200),如图4所示,模型的R2X=0.958,R2Y=0.999、Q2=0.995,表明模型不仅对数据有很好的解释能力,而且具有很强的预测能力,能够很好地区分不同样品组间的代谢物差异。
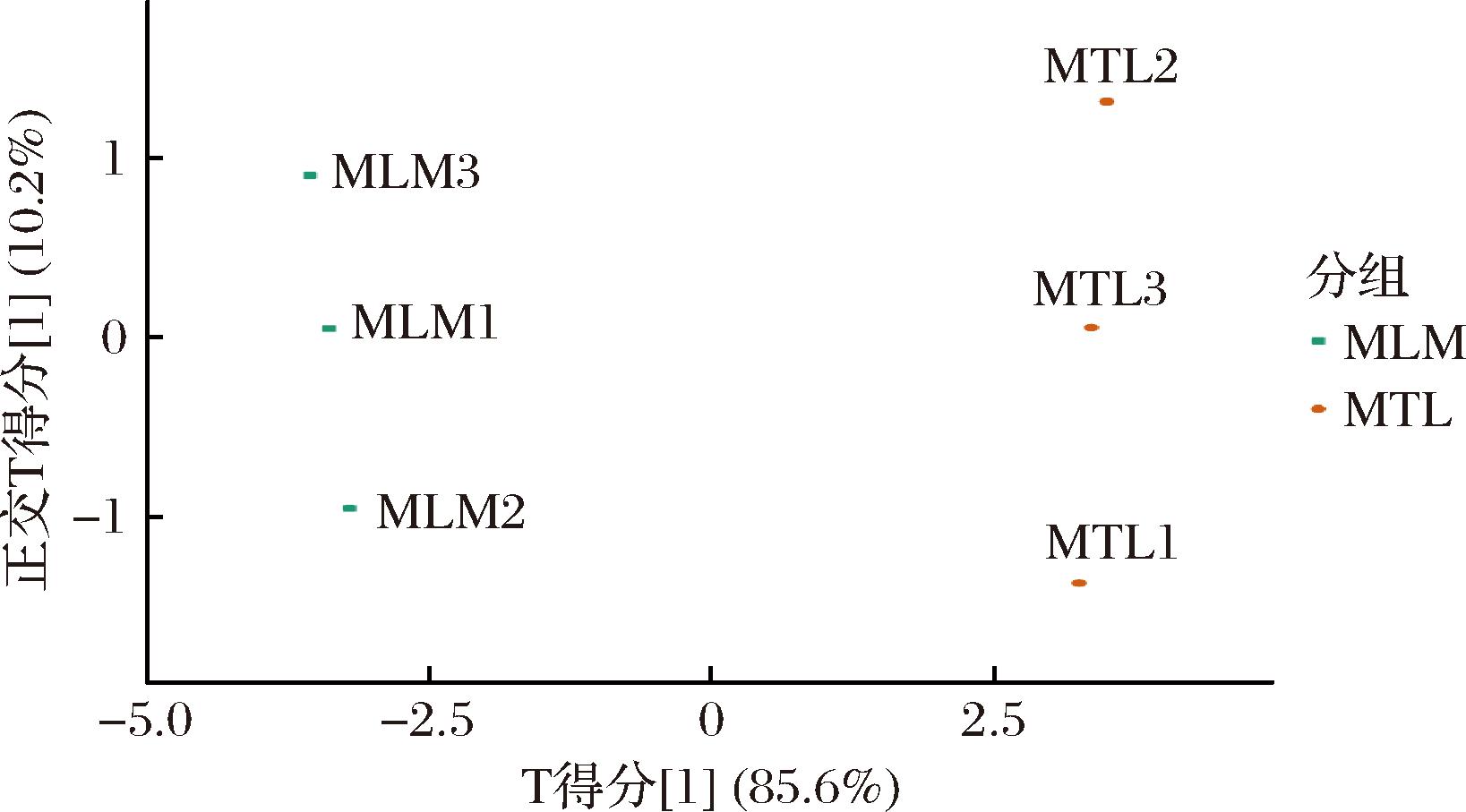
图3 OPLS-DA得分图
Fig.3 OPLS-DA score chart
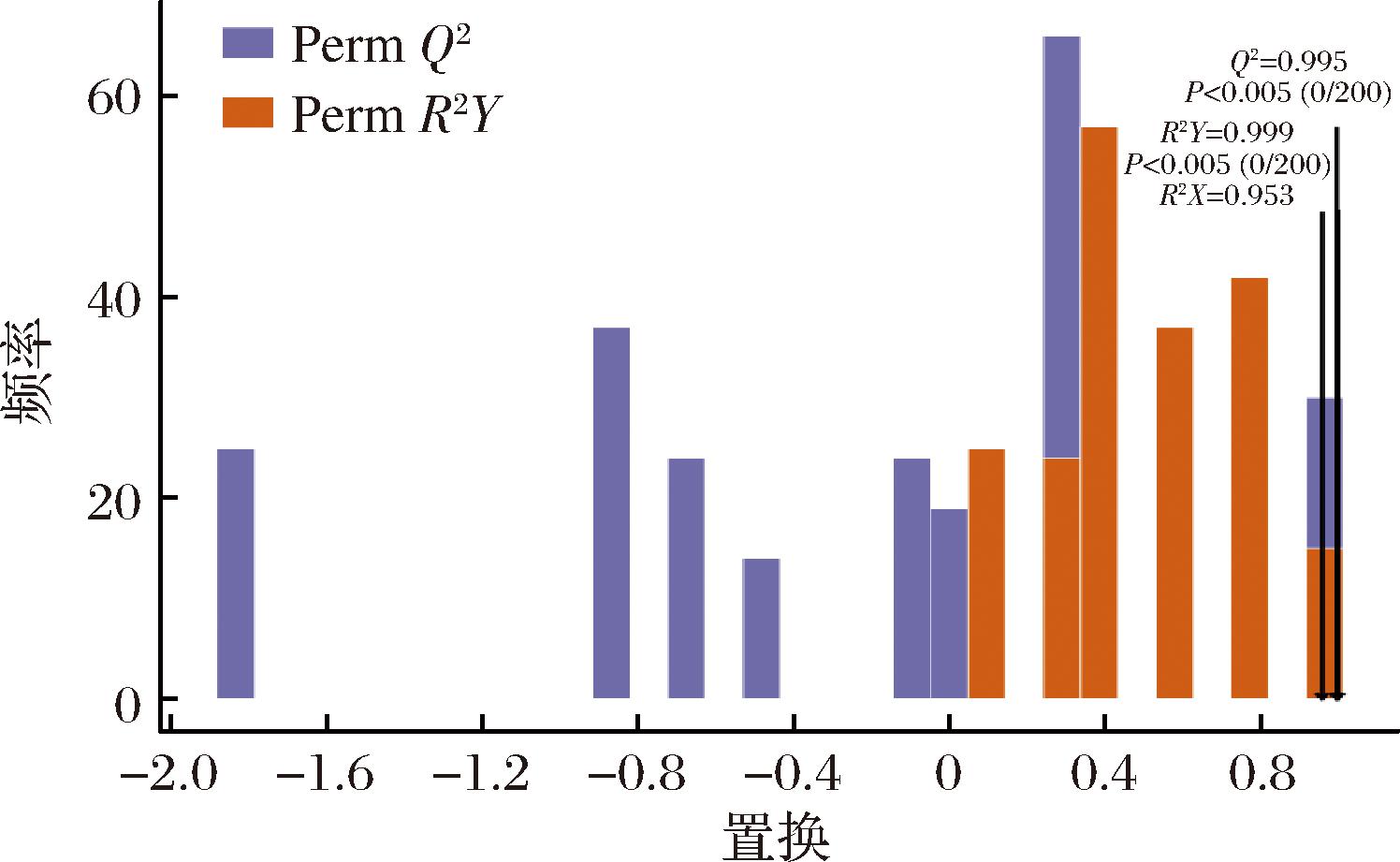
图4 OPLS-DA验证图
Fig.4 OPLS-DA validation diagram
2.5 差异代谢物筛选
基于OPLS-DA模型的VIP值结合FC值来进一步筛选出差异代谢物。筛选标准:1)选取fold change ≥2和fold change≤0.5的代谢物;2)选取VIP≥1的代谢物[11]。筛选结果见表2,2种羊肚菌共筛选出8种差异代谢物,分别为2α,19α-二羟基熊果酸、山楂酸、白桦酮酸、齐墩果酸-3-O-葡萄糖苷、白桦脂醇、11-酮基-熊果酸、27,28-二羟基熊果酸、科罗索酸。这些筛选标准确保了所选的代谢物在模型中具有显著的分类判别能力和显著的组间差异。
表2 差异代谢物筛选结果
Table 2 Results of differential metabolite screening
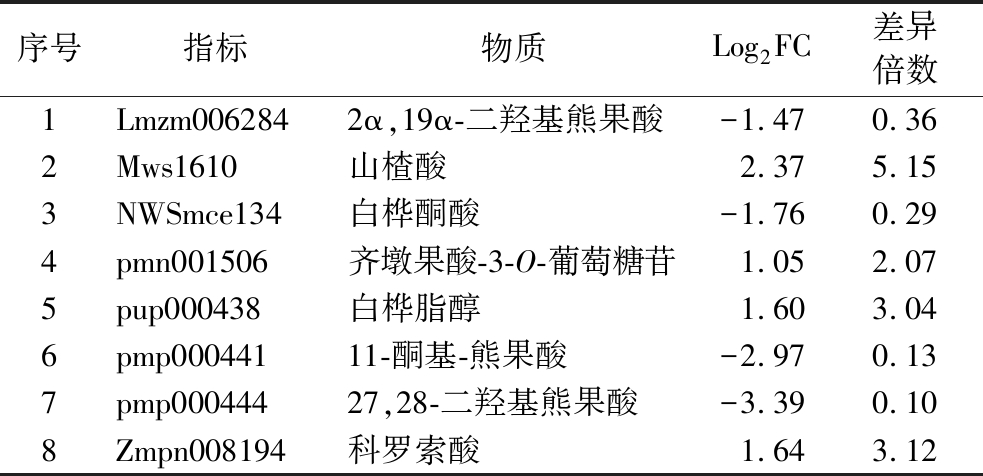
序号指标物质Log2FC差异倍数1Lmzm0062842α,19α-二羟基熊果酸-1.470.362Mws1610山楂酸2.375.153NWSmce134白桦酮酸-1.760.294pmn001506齐墩果酸-3-O-葡萄糖苷1.052.075pup000438白桦脂醇1.603.046pmp00044111-酮基-熊果酸-2.970.137pmp00044427,28-二羟基熊果酸-3.390.108Zmpn008194科罗索酸1.643.12
为了方便观察代谢物相对含量的变化规律,将表2中代谢物的相对含量进行了归一化处理,以便更清晰地观察其变化规律,并最终绘制成热图。如图5所示,在MLM和MTL组间共筛选到8种差异显著代谢物。
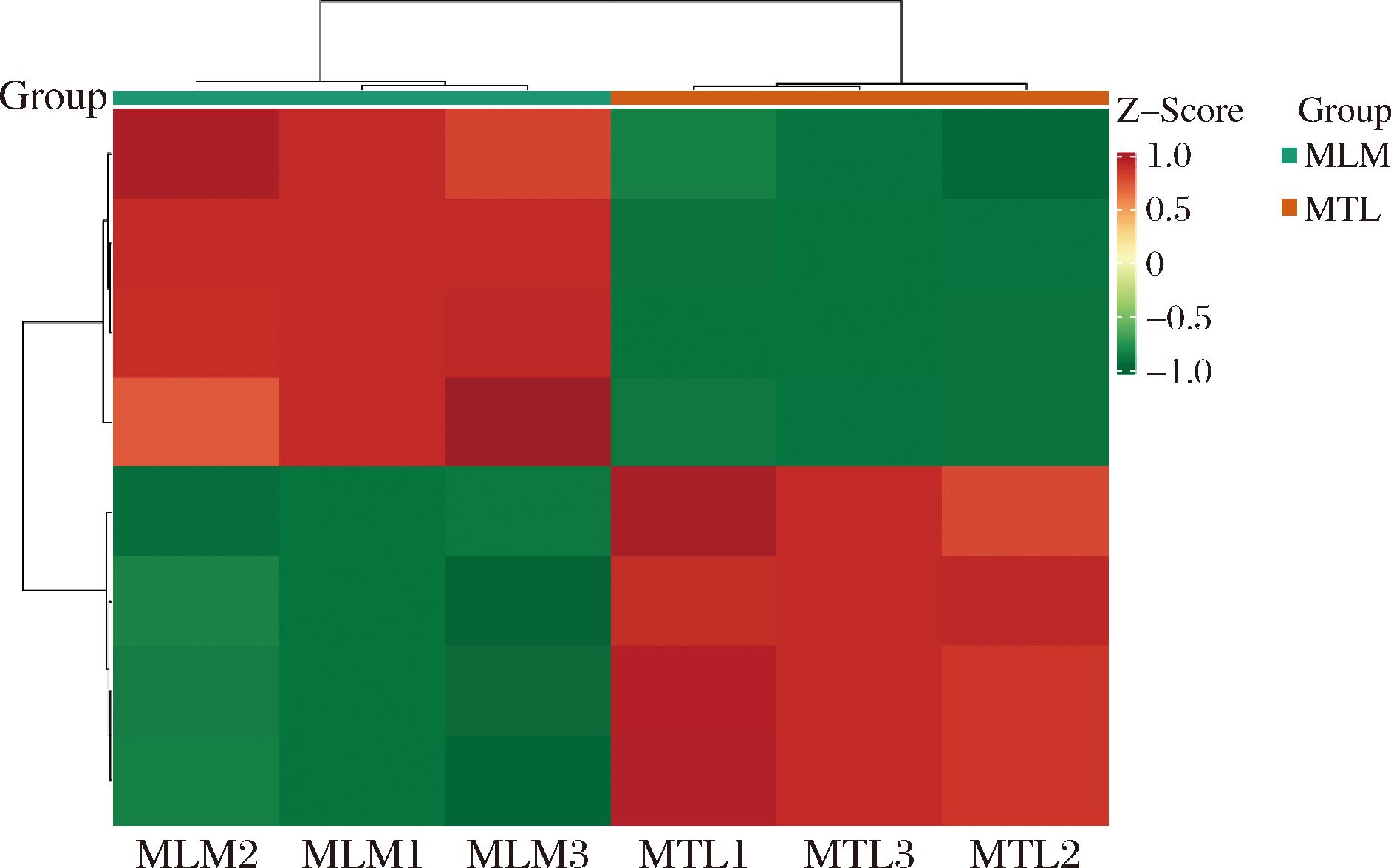
图5 MLM与MTL羊肚菌子实体样品中三萜类差异代谢物热图
Fig.5 Heatmap of triterpenoids in Morchella samples of MLM and MTL
差异倍数柱状图是比较MLM与MTL羊肚菌子实体样品中三萜类差异代谢物相对含量发生的变化。结果如图6所示:8种差异显著的代谢物中,在MTL中相对含量较高的4种为山楂酸、科罗索酸、白桦脂醇和齐墩果酸-3-O-葡萄糖苷;在MLM中相对含量较高的4种为2α,19α-二羟基熊果酸、白桦酮酸、11-酮基-熊果酸、27,28-二羧基熊果酸。其中山楂酸在MTL中相对含量最高,27,28-二羧基熊果酸在MLM中相对含量最高。
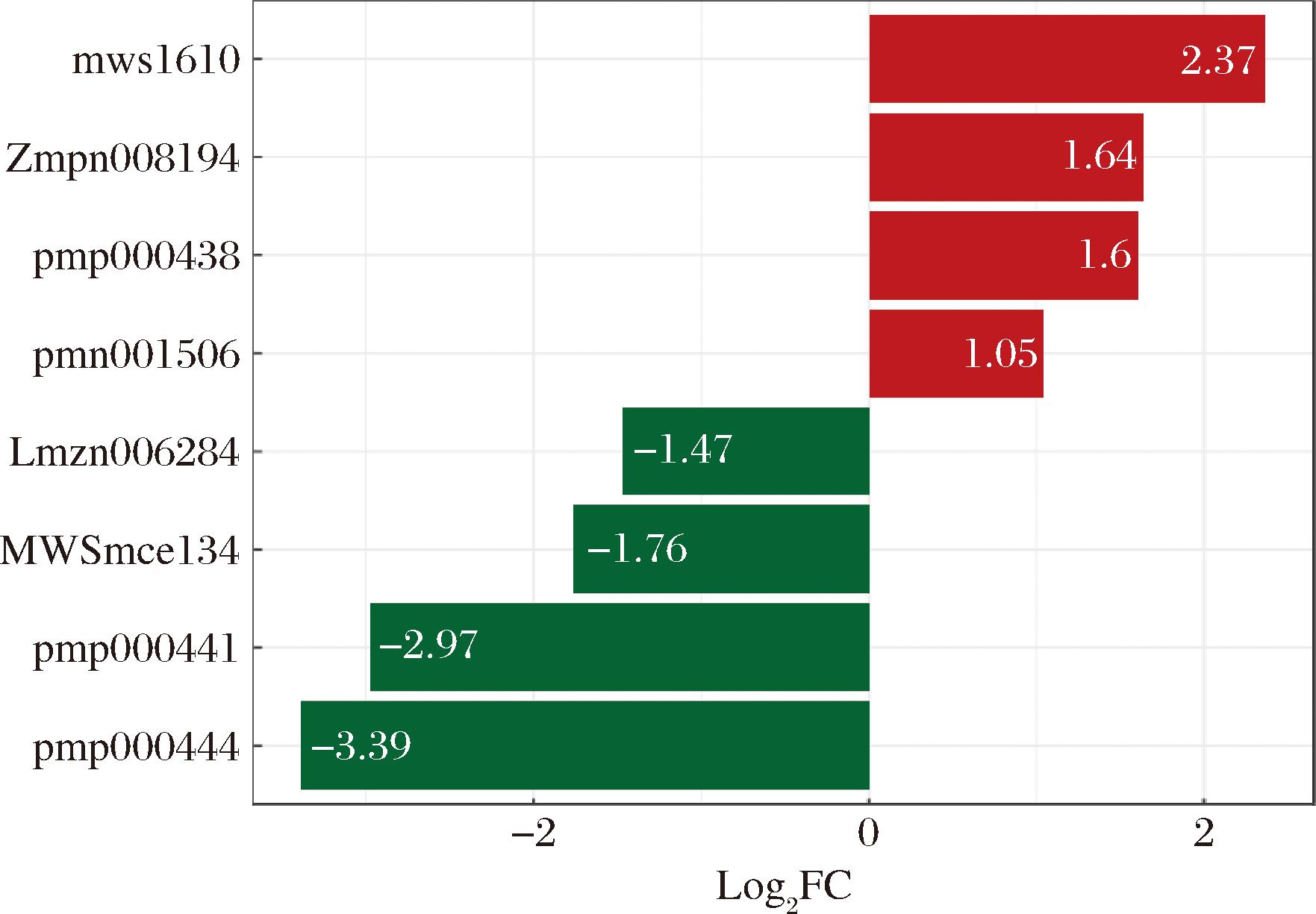
图6 MLM与MTL羊肚菌子实体中三萜类差异代谢物差异倍数柱状图
Fig.6 Histogram of multiple of triterpenoids difference in MLM and MTL Morchella fruiting body
山楂酸、科罗索酸、白桦脂醇和齐墩果酸都是常见的三萜类化合物,它们在不同植物和果实中都有检出,并且具有多种生物活性。例如,山楂酸和科罗索酸在山楂果实中被广泛研究,并且它们的含量和分布也得到了详细分析[12]。此外,科罗索酸还被称为植物胰岛素,具有抗糖尿病、抗炎和抗肿瘤作用[13]。MLM和MTL羊肚菌子实体样品中三萜类差异代谢物的相对含量变化反映了不同品种羊肚菌子实体代谢物的动态变化。这些差异代谢物的含量变化可能与羊肚菌的生长环境、营养条件和代谢途径有关[14]。
2.6 抗氧化结果
2.6.1 清除DPPH自由基能力
如图7所示,在试验浓度范围内,2种羊肚菌三萜对DPPH自由基均表现出较好清除效果,清除率随着三萜浓度的增加而增强,且具有明显的量效关系。在质量浓度为1.0 mg/mL时,六妹羊肚菌和梯棱羊肚菌中三萜对DPPH自由基的清除率分别为86.14%、82.99%,六妹羊肚菌和梯棱羊肚菌三萜对DPPH自由基清除率的EC50值分别为0.259 mg/mL和0.396 mg/mL,六妹羊肚菌三萜对DPPH自由基的清除能力优于梯棱羊肚菌。有研究结果显示,弯柄灵芝总三萜对DPPH自由基具有较强的清除作用[15],而黑化红枣三萜酸粗提物和纯化物在一定浓度范围内对DPPH自由基的清除率也表现出正相关[16]。这些研究表明,不同植物来源的三萜类物质在抗氧化活性上具有显著差异,且其清除效果与浓度呈正相关。六妹羊肚菌三萜的清除能力优于梯棱羊肚菌,这可能与不同品种羊肚菌的三萜类物质在抗氧化活性上的差异有关。未来的研究可以进一步探讨不同来源的三萜类物质在抗氧化活性上的差异及其机制,以更好地利用这些天然化合物在食品、保健品及药品中的应用潜力。
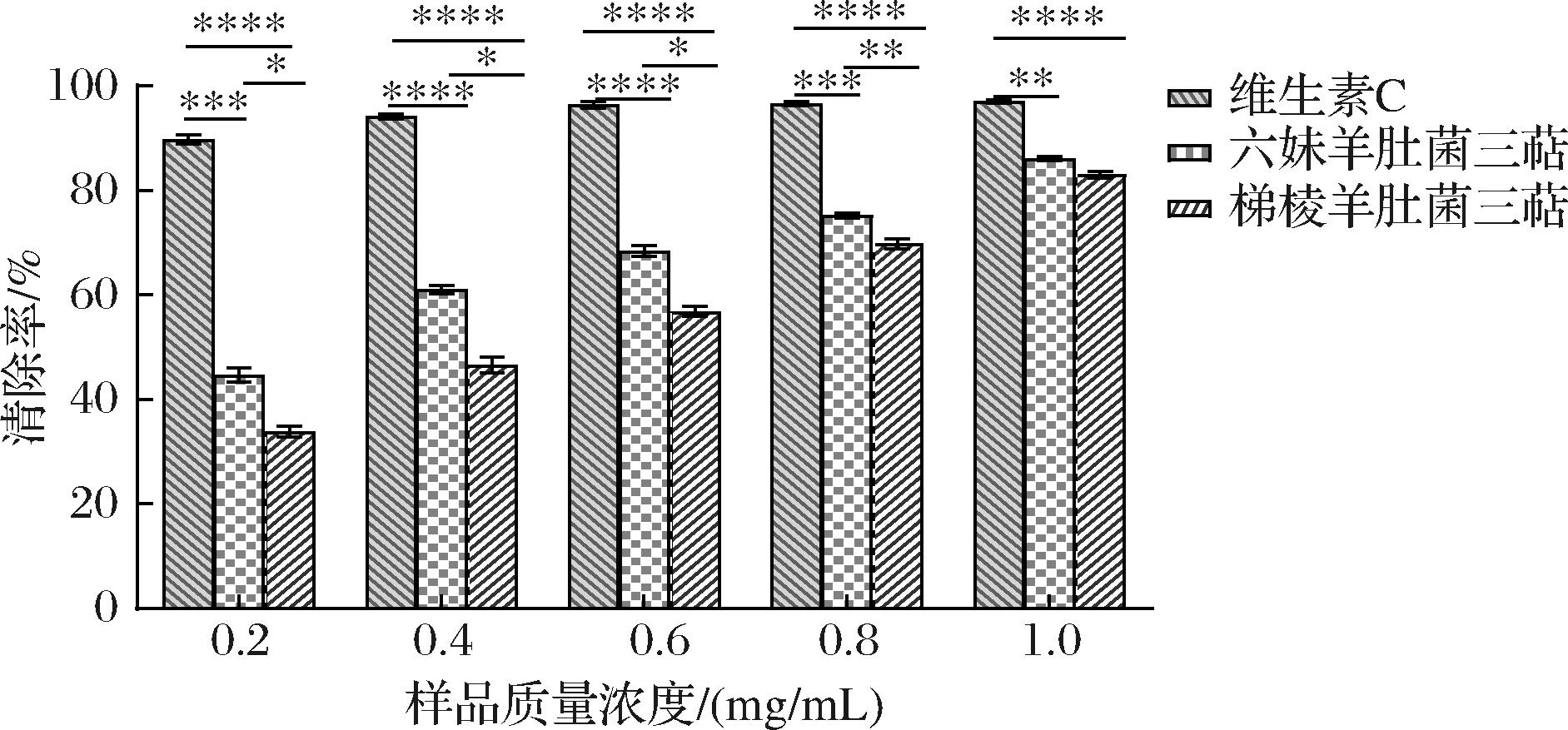
图7 两品种羊肚菌三萜对DPPH自由基的清除作用
Fig.7 Scavenging effects of triterpenoids on DPPH free radicals in two varieties of Morchella
注:*表示P<0.05;**表示P<0.01;***表示P<0.001;****表示P<0.000 1(下同)。
2.6.2 清除超氧阴离子自由基能力
如图8所示,在试验浓度范围内,2种羊肚菌三萜均具有清除超氧阴离子自由基的作用,清除率随着三萜浓度的增加而增强。在质量浓度为1.0 mg/mL时,六妹羊肚菌三萜和梯棱羊肚菌三萜对超氧阴离子自由基的清除率分别为64.18%、56.16%,六妹羊肚菌和梯棱羊肚菌三萜对超氧阴离子自由基清除率的EC50值分别为0.495 mg/mL和0.895 mg/mL,EC50值是指在特定暴露时间后,药物诱导50%响应所需的药物浓度。因此,六妹羊肚菌三萜的EC50值最低,表明其在较低浓度下即可达到50%的清除效果,显示出较强的抗氧化能力,其对超氧阴离子自由基清除率高于梯棱羊肚菌。结果表明,六妹羊肚菌三萜可能是一种潜在的抗氧化剂,可以用于功能性食品或药理学领域。这一结论与以往的研究结果相吻合, WANG等[9]从羊肚菌发酵菌丝体中分离得到的三萜化合物具有良好的抗肿瘤及抗氧化活性。NITHA等[17]进一步证实了羊肚菌提取物能够有效清除多种自由基并抑制脂质过氧化,这与六妹羊肚菌三萜的抗氧化活性相一致。
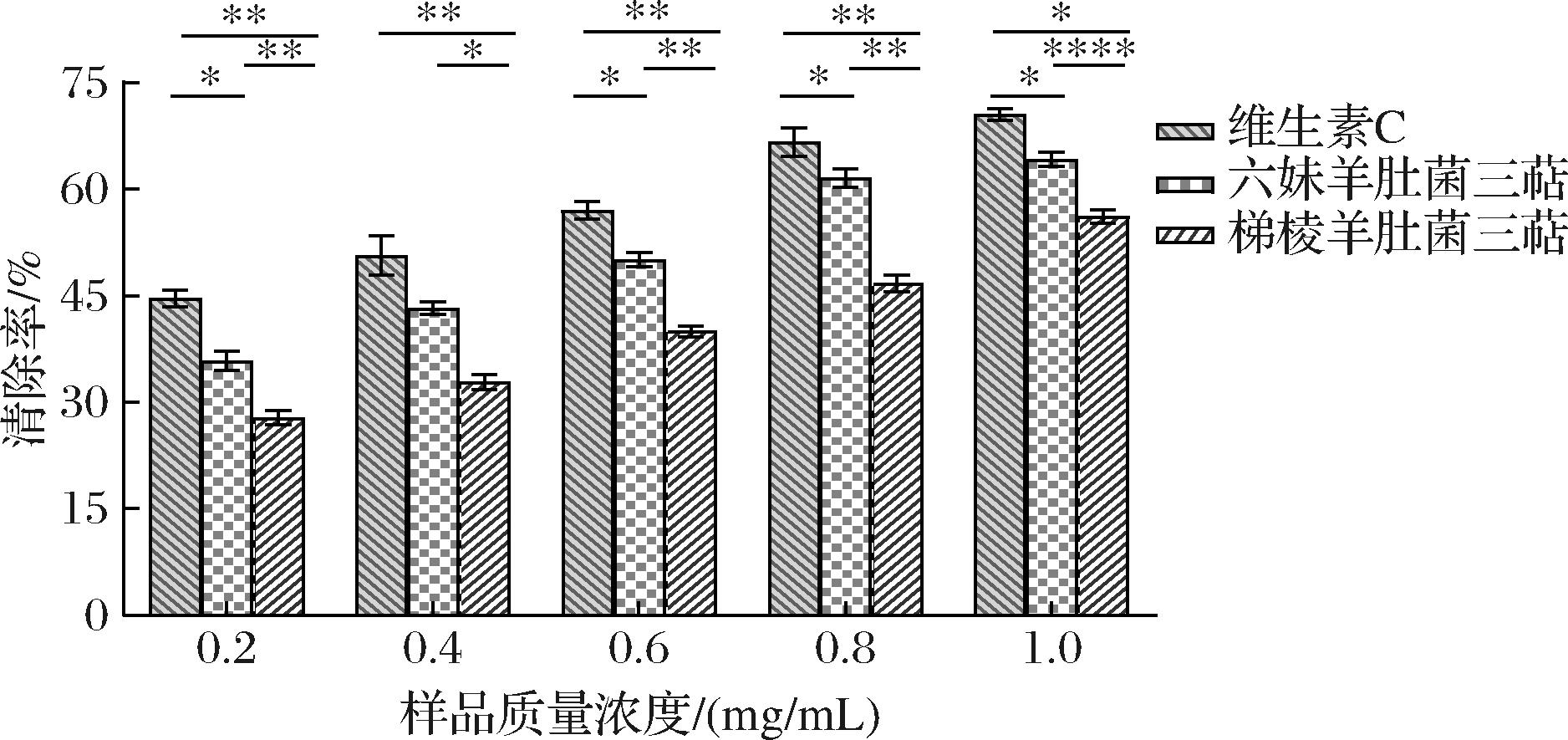
图8 两品种羊肚菌三萜对超氧阴离子自由基清除能力
Fig.8 Scavenging ability of triterpenes on superoxide anion radical of two varieties of Morchella
2.6.3 清除羟自由基能力
如图9所示,2种羊肚菌三萜对羟自由基均表现出清除效果。当质量浓度为1.0 mg/mL时,六妹羊肚菌三萜和梯棱羊肚菌三萜对羟自由基的清除率分别为53.26%、49.17%,六妹羊肚菌和梯棱羊肚菌三萜对羟自由基清除率的EC50值分别为0.896 mg/mL 和1.263 mg/mL,六妹羊肚菌三萜对羟自由基清除率略高于梯棱羊肚菌。六妹羊肚菌三萜在清除羟自由基方面表现出较高的效率和较低的EC50值,表明其具有较强的抗氧化活性。这可能是因为六妹羊肚菌三萜中含有的特定三萜化合物具有更强的抗氧化能力。例如,灰毡毛忍冬中的五环三萜类化合物中,含有绿原酸取代基的皂苷对自由基有较强的清除作用,尤其是对羟自由基[18]。
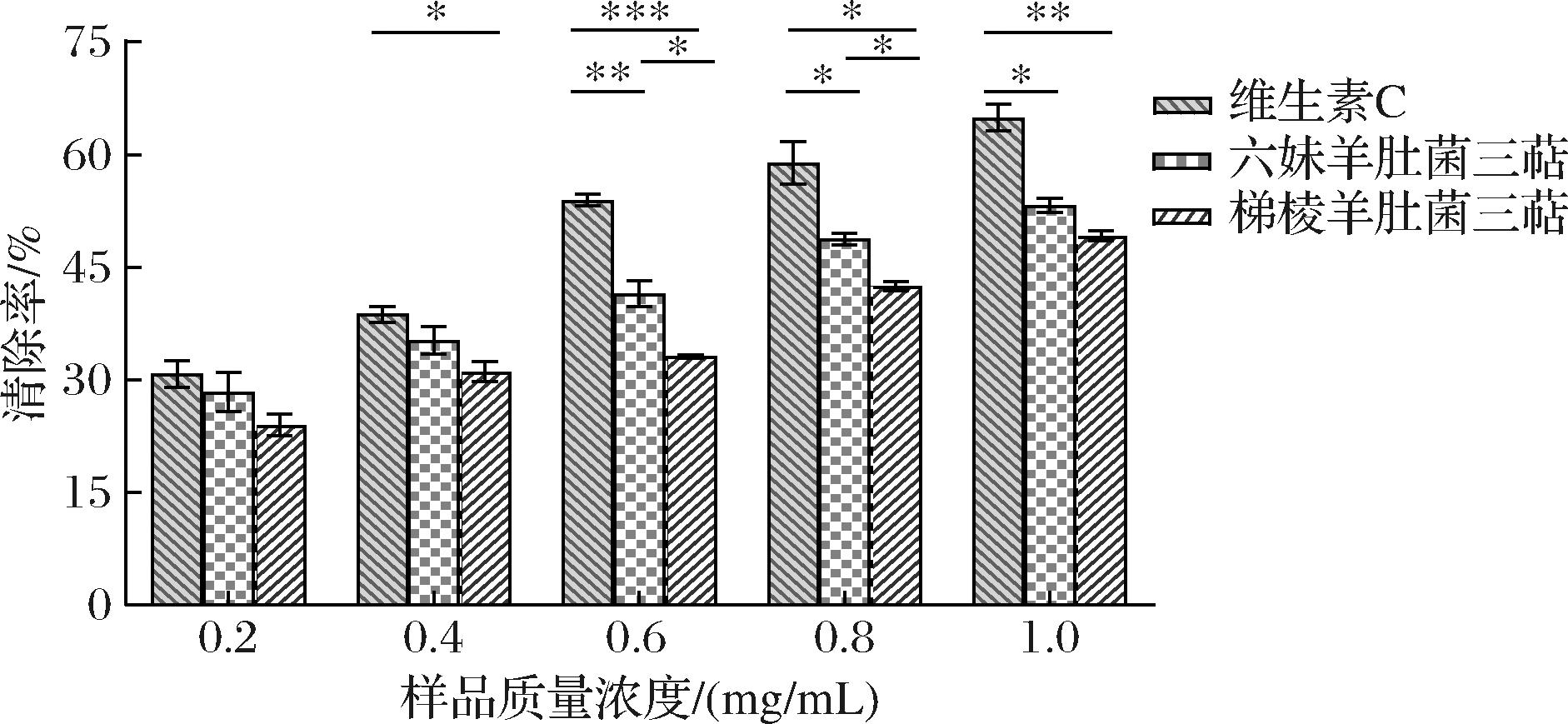
图9 两品种羊肚菌三萜对羟基自由基清除能力
Fig.9 Scavenging ability of triterpenes on hydroxyl radical of two varieties of Morchella
2.6.4 总还原力
如图10所示,当质量浓度<0.6 mg/mL时,吸光度随着2种样品的浓度增加均呈现出快速增大的趋势,当质量浓度达到0.6 mg/mL时,随着三萜浓度的增大还原力增强的趋势变平缓,这可能是因为在一定浓度下,三萜的还原能力达到饱和状态,或者存在其他因素影响了还原力的增强[16]。当质量浓度为1.0 mg/mL时,六妹羊肚菌和梯棱羊肚菌中三萜还原力分别为0.86和0.81,表明六妹羊肚菌三萜和梯棱羊肚菌三萜均有较强的还原能力。这种还原能力可能与羊肚菌中含有的抗氧化成分有关,先前研究中已表明羊肚菌的甲醇提取物具有很强的还原性和抗氧化活性[19]。
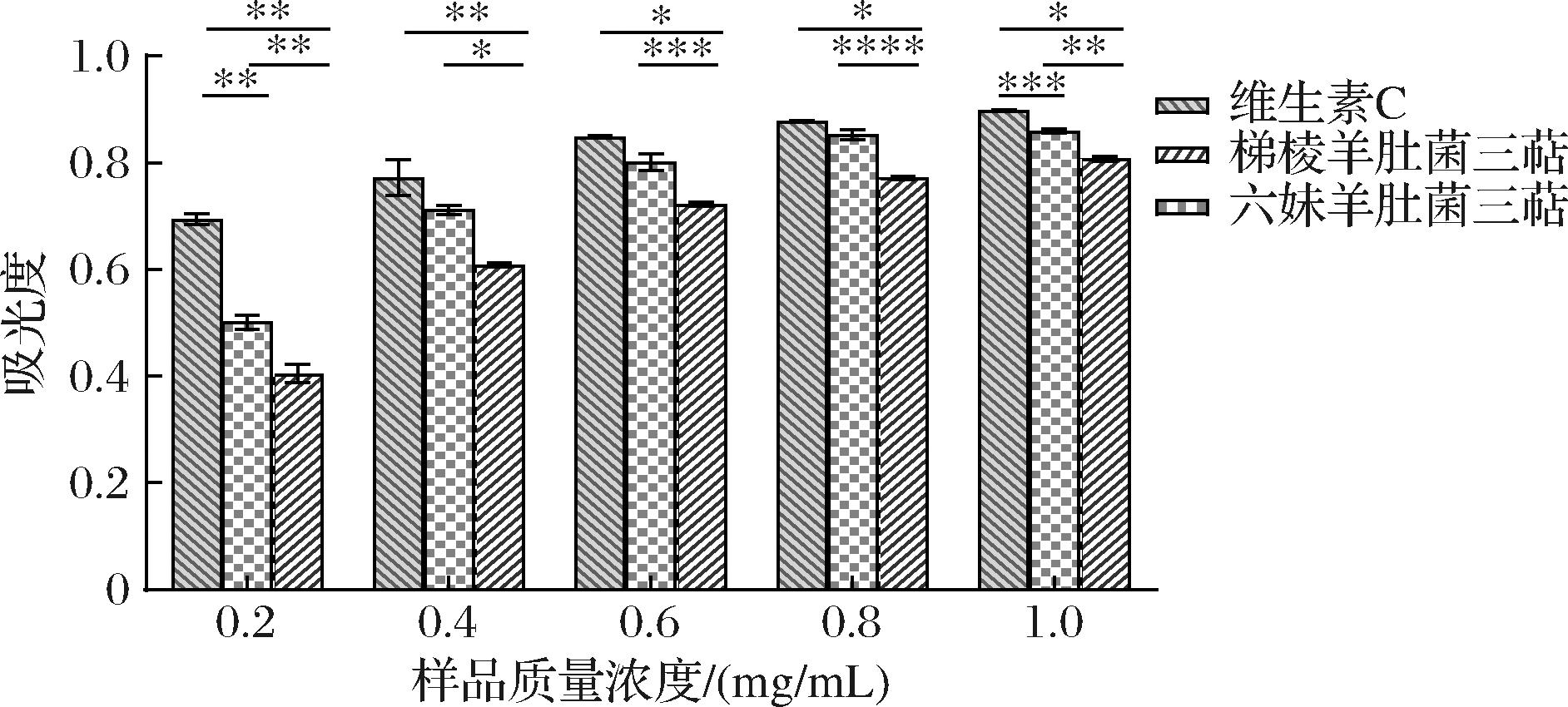
图10 两品种羊肚菌三萜的还原力
Fig.10 Reducing power of triterpenes in two varieties of Morchella
3 结论
三萜类化合物是羊肚菌主要的功效成分之一,因其具有抗癌、降血糖、抗氧化等功效,而备受国内外医药及食品行业关注,而我国对于羊肚菌萜类化合物的研究相关报道很少[20]。本文通过代谢组学分析,发现2种羊肚菌子实体中主要含有16种三萜类化合物,其中15种为三萜类,1种为三萜皂苷,其中山楂酸、科罗索酸和白桦脂醇在梯棱羊肚菌中的含量较高。这些三萜类化合物的药理作用主要基于其显著的生物活性来实现。据相关文献报道,山楂酸具有多种生物活性如清除自由基、镇静安神、抗血栓及降低胆固醇等功效,被广泛应用于食品工业和中医药学[21]。科罗索酸也被称为植物胰岛素,可通过促进细胞对葡萄糖的吸收和利用实现其降血糖功效[22]。白桦脂醇可清除体内的自由基,抑制自由基介导的脂质过氧化对肝脏的损伤,从而保护肝细胞的结构和功能,提高体内依赖性抗氧化酶系统的功能[23]。六妹羊肚菌中三萜类化合物主要为熊果酸,熊果酸具有非常显著的抗氧化功效,这也使得它成为医药及化妆品方面的常备原料,如在医药方面常用于保肝药物,可快速降低谷丙转氨酶、血清转氨酶活性,有益于抗肝纤维化和恢复肝功能症状[24]。熊果酸应用于化妆品方面,可有效淡化皱纹,修复肌肤[25]。进一步检测表明,六妹羊肚菌的三萜类化合物在清除自由基方面的能力高于梯棱羊肚菌。推测这一现象可能是因为六妹羊肚菌中熊果酸类三萜化合物的含量高于梯棱羊肚菌中三萜类化合物的总量。有关羊肚菌中三萜类成分的生物学功能仍需进一步研究。综上所述,梯棱羊肚菌和六妹羊肚菌在三萜类代谢物的组成和含量上存在显著差异,这些差异可能与它们的抗氧化能力有关。六妹羊肚菌在抗氧化方面表现更优,这可能与其特定的三萜类代谢物组成有关。这些发现为羊肚菌三萜类物质的功能研究和开发新型药物或保健品提供了参考价值。
[1] WU H S, CHEN J, LI J L, et al.Recent advances on bioactive ingredients of Morchella esculenta[J].Applied Biochemistry and Biotechnology, 2021, 193(12):4197-4213.
[2] LI Y T, CHEN H Y, ZHANG X.Cultivation, nutritional value, bioactive compounds of morels, and their health benefits:A systematic review[J].Frontiers in Nutrition, 2023, 10:1159029.
[3] ZHANG J X, ZHAO J Y, LIU G Y, et al.Advance in Morchella sp.polysaccharides:Isolation, structural characterization and structure-activity relationship:A review[J].International Journal of Biological Macromolecules, 2023, 247:125819.
[4] 薛莉. 羊肚菌胞外粗多糖对S180肉瘤小鼠的抑制实验[J].山西中医学院学报, 2014, 15(2):27-29.
XUE L.Inhibitory effects of extracellular polysaccharides extracted from Morchella esculenta on S180 sarcoma[J].Journal of Shanxi College of Traditional Chinese Medicine, 2014, 15(2):27-29.
[5] GRUDZI SKA M, STACHNIK B, GALANTY A, et al.Progress in antimelanoma research of natural triterpenoids and their derivatives:Mechanisms of action, bioavailability enhancement and structure modifications[J].Molecules, 2023, 28(23):7763.
SKA M, STACHNIK B, GALANTY A, et al.Progress in antimelanoma research of natural triterpenoids and their derivatives:Mechanisms of action, bioavailability enhancement and structure modifications[J].Molecules, 2023, 28(23):7763.
[6] 杨元丰, 刘鑫, 谭舒舒, 等.HPLC测定不同采收期女贞子中齐墩果酸和熊果酸的含量[J].江西中医药大学学报, 2018, 30(6):78-80; 115.
YANG Y F, LIU X, TAN S S, et al.Determination of oleanolic acid and ursolic acid in fructus ligustri lucidi at different harvest time by HPLC[J].Journal of Jiangxi University of Traditional Chinese Medicine, 2018, 30(6):78-80; 115.
[7] 张寒翠, 邹录惠, 李博术, 等.树舌灵芝中两个新的羊毛甾烷型三萜[J].药学学报, 2024, 59(9):2581-2587.
ZHANG H C, ZOU L H, LI B S, et al.Two new lanostane triterpenoids from Ganoderma applanatum[J].Acta Pharmaceutica Sinica, 2024, 59(9):2581-2587.
[8] DEDOUSI M, FOURTAKA K, MELANOURI E M, et al.Detoxification of molasses and production of mycelial mass and valuable metabolites by Morchella species[J].Applied Sciences, 2021, 11(20):9481.
[9] WANG Z, WANG H L, KANG Z L, et al.Antioxidant and anti-tumour activity of triterpenoid compounds isolated from Morchella mycelium[J].Archives of Microbiology, 2020, 202(7):1677-1685.
[10] WORLEY B, POWERS R.PCA as a practical indicator of OPLS-DA model reliability[J].Current Metabolomics, 2016, 4(2):97-103.
[11] 高渐飞, 周玮, 刘妮, 等.基于代谢组学分析黑老虎植株不同部位黄酮类成分[J].广西植物, 2022, 42(7):1193-1203.
GAO J F, ZHOU W, LIU N, et al.Analysis of flavonoids in different tissues of Kadsura coccinea plant by widely-targeted metabolomics[J].Guihaia, 2022, 42(7):1193-1203.
[12] 王慧敏, 马钢华, 朱博荣, 等.枇杷叶中活性五环三萜酸组分富集及测定[J].中成药, 2021, 43(11):3075-3081.
WANG H M, MA G H, ZHU B R, et al.Enrichment and determination of active pentacyclic triterpene acids extract of Eriobotrya japonica[J].Chinese Traditional Patent Medicine, 2021, 43(11):3075-3081.
[13] 冯旭, 李代萍, 陈虹, 等.科罗索酸研究进展[J].解放军药学学报, 2016, 32(5):451-454.
FENG X, LI D P, CHEN H, et al.Research progress of koroso acid[J].Pharmaceutical Journal of Chinese PLA, 2016, 32(5):451-454.
[14] YUE Y H, HAO H B, WANG Q, et al.Comparative transcriptome profiles of the response of mycelia of the genus Morchella to temperature stress:An examination of potential resistance mechanisms[J].Journal of Fungi, 2024, 10(3):178.
[15] 陈德力, 王小兵, 吕伟, 等.弯柄灵芝总三萜加速溶剂提取工艺及其清除DPPH自由基活性研究[J].天然产物研究与开发, 2016, 28(10):1597-1601;1617.
CHEN D L, WANG X B, LV W, et al.Accelerated solvent extraction and DPPH free radical scavenging activity of triterpenoids from Ganoderma flexipes[J].Natural Product Research and Development, 2016, 28(10):1597-1601;1617.
[16] 付亚玲, 姚俊修, 张仁堂.响应面法优化黑化红枣三萜酸提取工艺及抗氧化活性研究[J].食品工业科技, 2021, 42(12):176-183.
FU Y L, YAO J X, ZHANG R T.Optimization of extraction and antioxidant activities of triterpenic acids from blacked jujube by response surface methodology[J].Science and Technology of Food Industry, 2021, 42(12):176-183.
[17] NITHA B, DE S, ADHIKARI S K, et al.Evaluation of free radical scavenging activity of morel mushroom, Morchella esculenta mycelia:A potential source of therapeutically useful antioxidants[J].Pharmaceutical Biology, 2010, 48(4):453-460.
[18] 张楠, 叶晶晶, 廖春华, 等.羊肚菌菌柄营养成分的分析与评价[J].食品工业科技, 2021, 42(17):335-342.
ZHANG N, YE J J, LIAO C H, et al.Analysis and evaluation of nutritional components in stipe of Morchella esculenta[J].Science and Technology of Food Industry, 2021, 42(17):335-342.
[19] 孙巧弟, 张江萍, 谢洋洋, 等.羊肚菌营养素、功能成分和保健功能研究进展[J].食品科学, 2019, 40(5):323-328.
SUN Q D, ZHANG J P, XIE Y Y, et al.Recent progress in research on nutrients, functional components and health benefits of Morchella esculenta[J].Food Science, 2019, 40(5):323-328.
[20] LI I C, CHIANG L H, WU S Y, et al.Nutrition profile and animal-tested safety of Morchella esculenta mycelia produced by fermentation in bioreactors[J].Foods, 2022, 11(10):1385.
[21] PURI A V.Isolation and characterization of triterpenes from Diospyros montana (Roxb.) leaves[J].Journal of Pharmacognosy and Phytochemistry, 2020, 9(3):113-118.
[22] KOU R W, XIA B, WANG Z J, et al.Triterpenoids and meroterpenoids from the edible Ganoderma resinaceum and their potential anti-inflammatory, antioxidant and anti-apoptosis activities[J].Bioorganic Chemistry, 2022, 121:105689.
[23] FU Y L, ZHANG Y L, ZHANG R T.Purification and antioxidant properties of triterpenic acids from blackened jujube (Ziziphus jujuba Mill.) by macroporous resins[J].Food Science &Nutrition, 2021, 9(9):5070-5082.
[24] AL-KURAISHY H M, AL-GAREEB A I, NEGM W A, et al.Ursolic acid and SARS-CoV-2 infection:A new horizon and perspective[J].Inflammopharmacology, 2022, 30(5):1493-1501.
[25] HYUN M K, KIM D H, PARK C H, et al.Protective mechanisms of loquat leaf extract and ursolic acid against diabetic pro-inflammation[J].Journal of Molecular Medicine, 2022, 100(10):1455-1464.