肌原纤维蛋白(myofibrillar proteins,MPs)作为肉类蛋白质的主要成分,其凝胶特性会影响肉制品产品的理化特性和感官特性,因此对肉类品质和保质期起着至关重要的作用[1]。在肉制品生产加工过程中,MPs会在热诱导过程中形成结构致密的三维网状结构,这是形成凝胶的重要过程。同时,在此过程中,MPs也易受氧化损伤,蛋白质发生结构断裂、交联、聚集等一系列变化,进而引起其生化功能的变化,过度聚集则会影响其凝胶特性和生化功能[2]。
藏茶作为一种后发酵的黑茶,原料茶经过杀青、揉捻、渥堆发酵、干燥等多道工序,其中渥堆是决定藏茶发酵品质的重要工序。在渥堆过程中,茶叶在潮湿的环境下进行堆积,来自茶叶原料、空气以及水中的曲霉属、青霉属和酵母属等微生物,在渥堆发酵阶段迅速繁殖[3],使茶色素类、蛋白质、茶多糖等有益物质成分含量增加,最终使藏茶呈现出与绿茶、红茶截然不同的口感和风味[4]。
植物提取物多为多酚类、多糖类等化合物,具有一定的抑菌和抗氧化作用,因其具有无毒、稳定性好且制备过程简便等特点而受到青睐,通常可以作为天然抗氧化剂应用于食品中,不仅对产品感官特性产生的负面影响较小,且在低浓度下即可展现显著的生物活性[5]。在食品工业中,植物提取物因其天然、安全、高效的抗氧化和抗菌特性,逐渐成为研究的焦点。藏茶中含有茶多酚、茶多糖、茶色素及有机酸等活性成分,其抗氧化和抑菌特性使其在食品保鲜领域显示出巨大的应用潜力,尽管已有研究探讨了植物提取物对食品品质的影响,但关于藏茶提取物(Tibetan tea extract,TTE)作为一种天然食品添加剂对肉及肉制品影响的研究还相对缺乏。
TTE含有多种多酚类和多糖类物质,可能对MPs的凝胶特性产生多方面的影响。本研究旨在通过使用体积分数为70%的乙醇溶液作为提取剂,提取藏茶中的活性成分,并探究不同浓度TTE对猪肉MPs特性的影响,为TTE在肉制品加工中的实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
藏茶(团结康砖),雅安茶厂股份有限公司;新鲜猪后腿肉,雅安好又鲜商贸有限公司;无水乙醇、福林酚、无水碳酸钠、AlCl3、NaNO2,成都科隆化学品有限公司,均为分析纯。
1.2 仪器与设备
UV-1800PC紫外分光光度计,上海美谱达仪器有限公司;AH-BASIC高速均质乳化机,常州越新仪器制造有限公司;Power PacTM HV电泳仪,美国 Bio-Rad;NicoletiS10傅里叶红外色谱仪,赛默飞世尔科技有限公司;TA-XT plus型物性分析仪、旋转流变仪,美国TA公司;SU8020高分辨率发射扫描电镜,日立高新技术集团。
1.3 方法
1.3.1 TTE的提取
参考王凝等[6]的方法并做相应修改。称取粉碎后的藏茶粉按料液比1∶20(g∶mL)加入体积分数70%乙醇,70 ℃超声波(超声波功率212 W)浸提60 min,抽滤得滤液;滤渣按料液比1∶10(g∶mL)加入体积分数70%乙醇,超声波浸提45 min后抽滤,重复上述操作,合并3次滤液,55 ℃旋转蒸发仪减压浓缩,浓缩提取液于真空冷冻干燥、研磨及过筛后,得到的物质即为TTE,于-20 ℃贮藏备用。
1.3.2 TTE化学成分测定
茶多酚含量测定参考福林酚比色法[7];茶多糖含量测定参考苯酚-硫酸法[8];总黄酮类含量测定参考LIU等[9]的方法并稍作修改,采用亚硝酸钠-三氯化铝法测定藏茶中总黄酮含量。
1.3.3 猪肉肌原纤维蛋白提取
参考ZHOU等[10]的方法并做相应修改。将新鲜猪后腿肉制成质地均匀的猪肉糜,将猪肉糜按1∶4(g∶mL)的比例加入缓冲液Ⅰ(0.1 mol/L NaCl、10 mmol/L Na2HPO4、2 mmol/L MgCl2、pH 7.0),使用高速均质机以10 000 r/min的转速匀浆60 s,4 ℃条件下5 000×g离心15 min,保留沉淀,重复上述操作2次。加入与沉淀比例为1∶4(g∶mL)的缓冲液Ⅱ(0.1 mol/L NaCl溶液)将处理后的沉淀高速匀浆60 s,4 ℃,5 000 ×g离心15 min弃去上清液,重复操作3次,最后1次匀浆后用纱布过滤除去结缔组织,并将pH值调至6.25,再次离心后得到沉淀即为MPs。采用双缩脲法测定蛋白质含量。提取的MPs需在4 ℃保存,48 h内使用。
1.3.4 藏茶提取物-猪肉肌原纤维蛋白溶液与凝胶制备
参考ZHOU等[10]的方法并做相应修改。用溶解液(0.6 mol/L NaCl,0.05 mol/L KH2PO4,pH 6.0)调节蛋白质量浓度至70 mg/mL,分别加入TTE 0.00%、0.50%、1.00%、1.50%、2.00%、2.50%和3.00%(质量分数,以MPs质量为基准),高速均质机匀浆至形成均匀稳定的混合液,得到藏茶提取物-猪肉肌原纤维蛋白复合溶液。
复合溶液放入预热好的80 ℃水浴锅中加热30 min,水浴完成后冷却至室温,制得的藏茶提取物-猪肉肌原纤维蛋白复合凝胶。于4 ℃平衡12 h,每次测定之前,将凝胶回温30 min。
1.3.5 复合凝胶保水性(water-holding capacity, WHC)的测定
参考余青等[11]的方法并稍作修改。将复合蛋白凝胶切成大小均一的凝胶块,使用滤纸包裹,4 ℃,4 000 r/min离心15 min,称量离心前、后凝胶块质量m0和m1。保水性按公式(1)计算:
保水性![]()
(1)
式中:m1,离心后样品质量,g;m0,离心前样品质量,g。
1.3.6 复合凝胶水分含量的测定
参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》。
1.3.7 复合凝胶凝胶强度的测定
参考XUE等[12]的方法并做适当修改,采用质构仪测定凝胶强度,采用TPA模式,探头型号P/5,测前速率2 mm/s,测中速率1 mm/s,测后速率1 mm/s,压缩比50%,触发力3 g。
1.3.8 复合凝胶色差的测定
将复合蛋白凝胶切成1 cm厚的薄片,使用色差仪对复合蛋白凝胶的L*值(亮度值)、a*值(红度值)和b*值(黄度值)进行测定。
1.3.9 复合凝胶流变学特性的测定
参考贾娜等[13]的方法并做适当修改。
1.3.10 复合溶液粒径的测定
参考SUN等[14]的方法,将肌原纤维蛋白溶液调至0.2 mg/mL,使用马尔文粒度仪测定。
1.3.11 复合溶液SDS-PAGE的测定
参考XIAO等[15]的方法并适当调整,在非还原条件下进行。将5 mg/mL的复合蛋白溶液与上样缓冲液混合,煮沸5 min后使用质量分数4%~20%的预制胶进行电泳。
1.3.12 复合溶液内源性荧光光谱的测定
参考孙乐常等[16]的方法。将复合蛋白溶液浓度调至0.2 mg/mL,利用荧光分光光度计测定,激发波长300 nm,发射波长扫描范围300~500 nm,激发和发射波长的狭缝宽度均为5 nm。
1.3.13 复合溶液紫外光谱的测定
参考AI等[17]的方法,使用紫外分光光度计测定0.2 mg/mL复合蛋白溶液在200~400 nm紫外吸收光谱。
1.3.14 复合凝胶微观结构的测定
参考HAN等[18]的方法,将凝胶样品切成适宜大小,经固定、洗涤、脱水、干燥及喷金后,使用10 000×扫描电镜观察。
1.4 数据分析与统计
每个实验平行3次,取平均值,结果以“平均值±标准差”表示。使用SPSS 26进行数据分析,使用Origin 2021绘制图表。
2 结果与分析
2.1 藏茶提取物化学成分
经测定,TTE中茶多酚含量为(227.11±1.82) mg/g,茶多糖含量为(134.19±4.05) mg/g,总黄酮含量为(256.19±4.14) mg/g。
2.2 对复合肌原纤维蛋白凝胶保水性、水分含量及凝胶强度的影响
WHC通常反映蛋白质与水相互作用与结合的能力,WHC作为衡量肉及肉制品品质重要指标之一,网状结构中水分含量高低能影响其质地、出品率等指标[19]。如图1所示,当TTE添加量增加时,复合凝胶水分含量下降,WHC呈现上升趋势,且当TTE添加量大于2.5%时,复合凝胶的WHC显著优于空白组(P<0.05),但当TTE添加量较低时,并未观察到WHC与空白组有显著性差异。这一现象可能与凝胶形成的完整性有关,通常多酚和多糖的羟基可以与MPs分子相互作用,促使MPs形成更加完整且致密的三维网状结构;也可能归因于TTE中的多糖类物质能够通过氢键结合水分子,并且多糖能与MPs形成蛋白质凝胶网状结构,储存大量水分,从而表现出良好的WHC[20]。结果表明,TTE可以增强MPs复合凝胶束缚水分子的能力,从而增加WHC。这与此前贾娜等[13]的研究结果变化趋势一致。
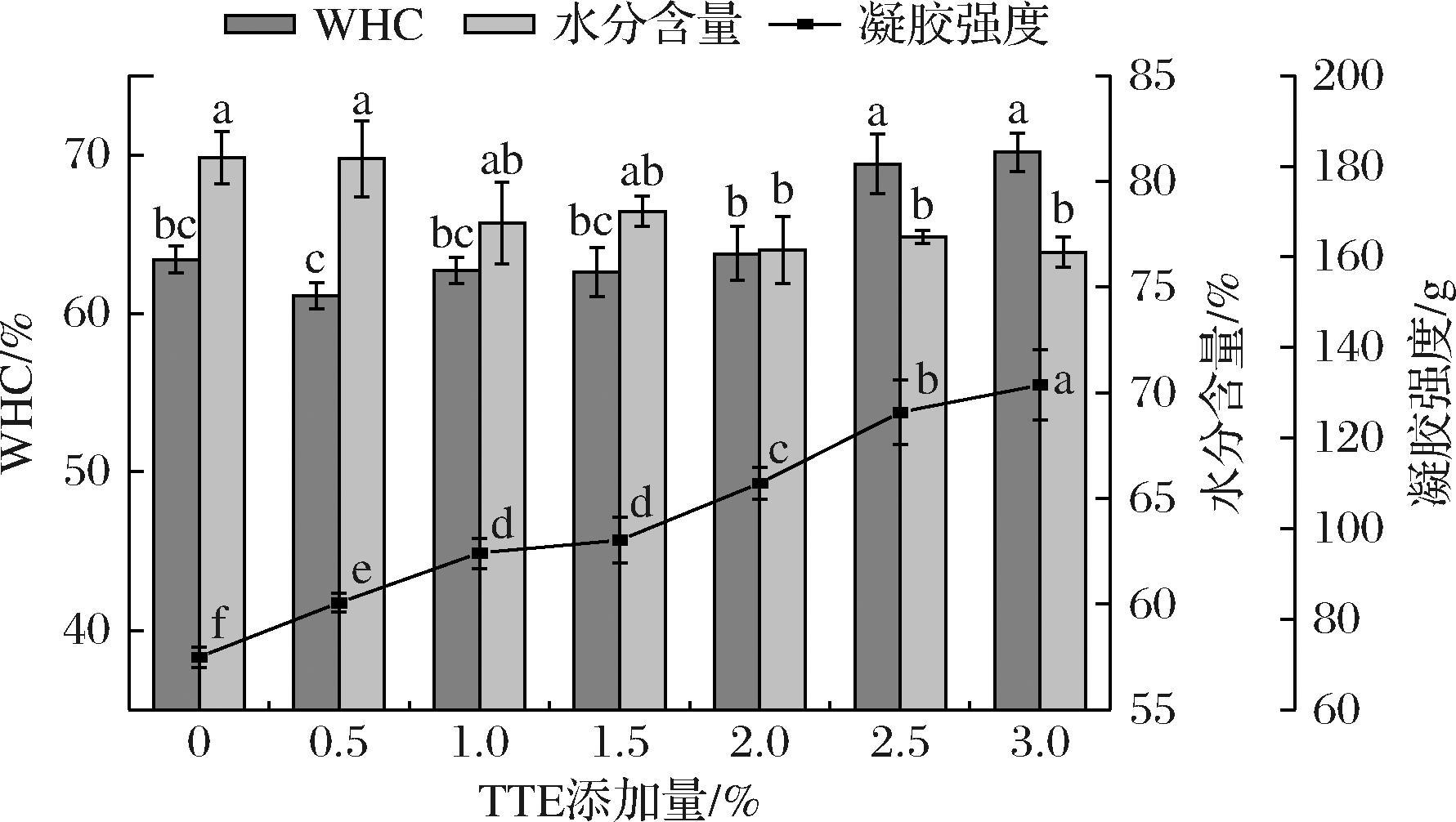
图1 TTE添加量对猪肉肌原纤维蛋白凝胶保水性、水分含量及凝胶强度的影响
Fig.1 Effect of TTE addition on WHC,moisture content and gel strength of pork myofibrillar protein gel
注:不同小写字母表示具有显著性差异(P<0.05)(下同)。
凝胶强度反映了蛋白质三维网状结构的稳定性和弹性,对于衡量蛋白质的成胶能力至关重要[21]。图1结果表明,凝胶强度与TTE添加量呈现出显著的正相关趋势,与水分含量呈现负相关。与未添加TTE的空白组相比,不同添加量的TTE对凝胶的稳定性和网状结构有一定影响,呈现显著计量依赖关系(P<0.05),TTE添加量越多,凝胶强度越大。这一现象可能归因于凝胶水分含量减少,同时TTE富含多酚类及多糖类物质,这些成分能参与蛋白质分子的凝胶化过程,通过增强凝胶的保水性,促进形成质地更加饱满、结构更加致密的三维网状蛋白凝胶结构,从而显著提升凝胶强度[22]。此外,多酚类化合物的抗氧化特性有助于抑制蛋白质的氧化变性,以维持较稳定的三维网状结构,进一步增强凝胶强度。XU等[23]将没食子酸等6种多酚类物质与猪肉MPs结合,发现其能有效改善MPs的凝胶特性,与本文研究结果一致。因此,适量添加TTE对于改善MPs的凝胶强度具有积极作用。
2.3 对复合肌原纤维蛋白凝胶色差的影响
色泽作为消费者选购商品第一决定因素,能直接影响消费者对商品的喜爱程度,复合凝胶的色泽受众多因素影响,与包括凝胶内部结构、蛋白质组成、聚合及交联程度以及表面光学特性等因素有关[24]。如表1所示,与0.00%TTE组相比,添加了TTE的复合凝胶的色泽有显著变化(P<0.05),随着TTE添加量的增加,复合凝胶的亮度值L*呈现显著下降趋势,红度值a*和黄度值b*均显著上升。复合凝胶色泽的变化可能归因于TTE本身所含的茶褐素、茶黄色以及茶红素较多,因此随添加量的增加复合凝胶的色差变化明显。其次,TTE中含有多种多酚类与多糖类物质,能够与肌原纤维蛋白分子发生作用,促使形成更加稳定的三维网状结构,从而改善复合凝胶色泽。BUAMARD等[25]发现椰壳提取物能够降低沙丁鱼鱼糜凝胶的白度值,可能与椰壳提取物本身色泽有关,也可能是椰壳提取物中的多酚类物质与MPs作用,使凝胶白度值呈下降趋势,与本研究结果一致。
表1 TTE添加量对猪肉肌原纤维蛋白凝胶色差的影响
Table 1 Effect of TTE addition on the water retention of pork myofibrillar protein gel
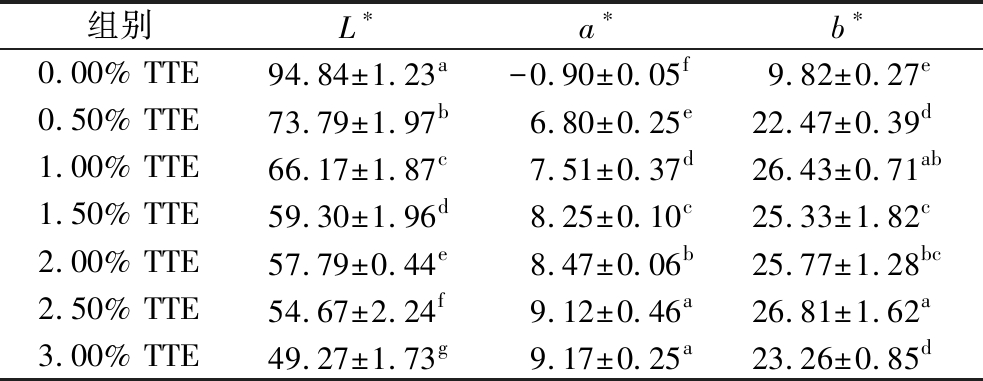
组别L∗a∗b∗0.00% TTE94.84±1.23a-0.90±0.05f9.82±0.27e0.50% TTE73.79±1.97b6.80±0.25e22.47±0.39d1.00% TTE66.17±1.87c7.51±0.37d26.43±0.71ab1.50% TTE59.30±1.96d8.25±0.10c25.33±1.82c2.00% TTE57.79±0.44e8.47±0.06b25.77±1.28bc2.50% TTE54.67±2.24f9.12±0.46a26.81±1.62a3.00% TTE49.27±1.73g9.17±0.25a23.26±0.85d
注:同列不同小写字母表示具有显著性差异(P<0.05)(下同)。
2.4 对复合肌原纤维蛋白流变学特性的影响
储能模量(G′)能反映在MPs热诱导凝胶形成过程中的能量变化,能表示凝胶的动态弹性变化,其高值表明凝胶具有更好的弹性和紧密的结构[26]。如图2-a所示,不同TTE添加量下的G′具有相同的变化趋势。20~55 ℃,G′整体呈现下降趋势,随着温度的升高,储能模量逐渐减小,在53 ℃达到最小值,由肌球蛋白的初始二聚化和蛋白质间交联构建弱凝胶引起;从55 ℃开始,G′再次呈现小幅度上升趋势,这可能是由于肌球蛋白头部结构的变性和聚集,促进了凝胶结构的形成,并且随着TTE添加量增多,G′上升幅度更为显著,表明TTE的添加有助于提升复合凝胶的弹性;60~65 ℃,G′有轻微下降,此时MPs肌球蛋白尾部发生变形和去折叠化,导致凝胶三维网状结构受到轻微破坏;在65~73 ℃,G′持续上升,而在73 ℃之后,G′稍有下降,总体呈现平稳趋势,可能由于肌球蛋白与肌动蛋白间产生不可逆的交联,导致MPs主要作用力交联作用增强,蛋白完全变性,此时形成的凝胶强度更强、弹性更好。与0.00%TTE组相比,随着TTE添加量的增加,复合凝胶的凝胶弹性均高于0.00%TTE组,三维网状结构更加稳定,这与复合凝胶的凝胶强度变化趋势相同,且在TTE添加量达到3.00%时,G′为最高值,表明此时复合凝胶弹性最佳。图2-b为耗能模量(G″)变化图,G″反映了凝胶的黏性变化。样品的G″与G′变化趋势相似,通常样品的升温初期到50 ℃前后,G″呈现下降趋势,表明黏度减小;随着温度的进一步升高,蛋白质逐渐变性并形成凝胶结构,黏度增大。
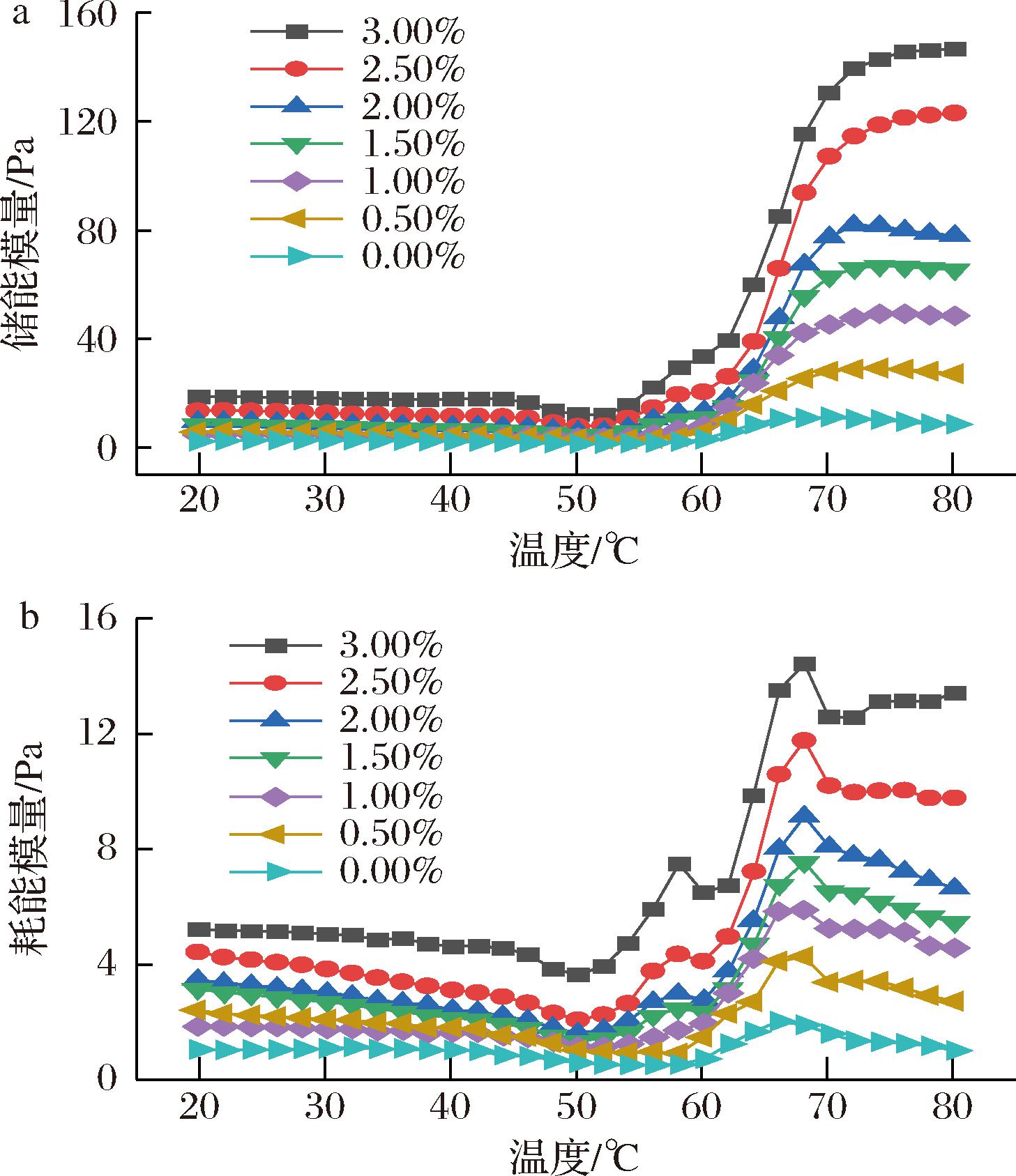
a-储能模量;b-耗能模量
图2 TTE添加量对猪肉肌原纤维蛋白流变学特性的影响
Fig.2 Effect of TTE addition on the rheological properties of pork myofibrillar protein
在相同温度范围内,随着TTE添加量的增加,G′和G″都有相同增长趋势,表明TTE能促进MPs形成完整且稳定的三维网状结构,改善MPs黏弹性和凝胶强度,且G″远低于G′表明样品具有更好的凝胶强度。这可能是由于TTE作用于MPs,诱导MPs内部结构活性基团的暴露,与TTE相互作用形成更致密的凝胶结构;同时,TTE中的多糖等物质可能作为填充剂,与蛋白质结合,形成具有良好黏弹性的三维网状结构,有利于形成完整且致密的凝胶结构。
2.5 对复合肌原纤维蛋白溶液粒径的影响
蛋白质的粒径变化是评估MPs聚集程度和分子间相互作用变化的重要指标,通常与蛋白质结构的聚集、解聚以及变性过程密切相关[27]。如图3所示,在较低的TTE添加量(0.05%~1.00%)下,MPs的聚集程度增加,导致粒径尺寸增大。这一现象可能由两方面因素引起:一方面,TTE可能诱导MPs分子结构的展开,进而促进其聚集;另一方面,TTE可能与MPs发生非共价交联,形成较大体积的聚合物,从而导致MPs粒径的增加。然而,当TTE的添加量超过1.00%时,MPs的粒径显著减小(P<0.05),这表明TTE的添加可以缓解蛋白质变性聚集。这种现象可能归因于TTE中抗氧化活性成分有效地抑制了MPs的氧化聚集,使得MPs氧化变性减弱,从而平均粒径减小;此外,过量的TTE可能干扰蛋白质间的相互作用,阻碍了蛋白质的聚集,导致蛋白质平均粒径的降低[28]。
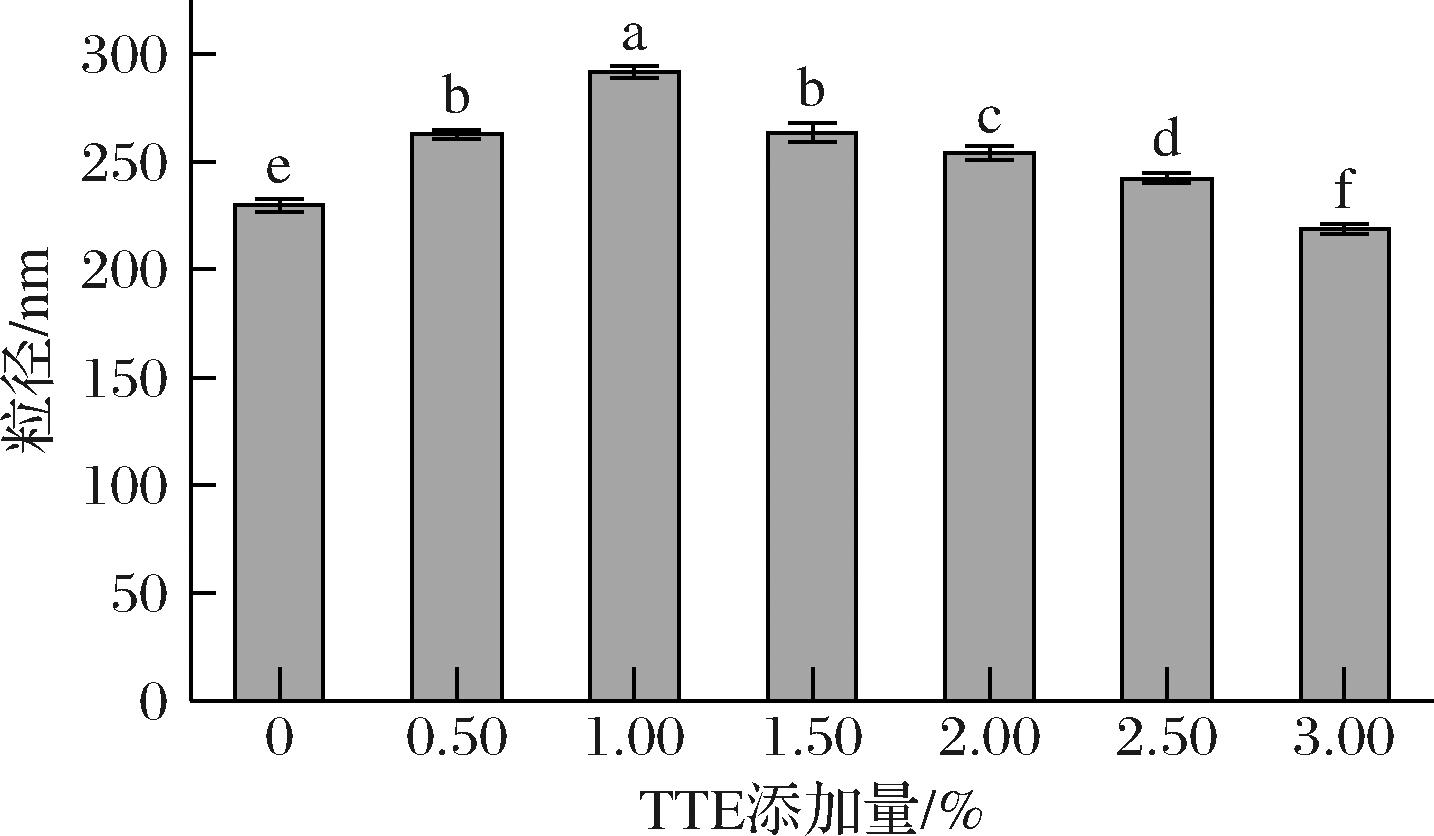
图3 TTE添加量对猪肉肌原纤维蛋白粒径的影响
Fig.3 Effect of TTE addition on the particle size of porcine myofibrillar proteins
2.6 对复合肌原纤维蛋白凝胶SDS-PAGE的影响
通过非还原条件下的SDS-PAGE条带分布的变化情况可了解到TTE作用于MPs的一级结构变化。图4可以明显观察到4种不同分子质量的条带,分别为肌球蛋白重链(200 kDa)、副肌球蛋白(100 kDa)、肌动蛋白(42 kDa)和原肌球蛋白(35 kDa),其中肌球蛋白重链和肌动蛋白是最为明显的2个条带,这归因于它们是肌原纤维蛋白形成凝胶的重要组成部分,含量相对较高,因此条带颜色较深[29]。可以发现TTE与MPs相互作用后没有出现新条带,表明在该条件下TTE对MPs一级结构影响较小,MPs未形成新的基团。对比0.00%TTE组,随着TTE添加量增多,肌球蛋白重链条带灰度有所下降,说明TTE可能促进了蛋白质分子的交联和聚集,生成大分子聚合物,这一现象可能与TTE中的多酚类物质与羟基自由基反应生成的酚羟基有关,后者与MPs相互作用,促进了蛋白质分子的交联。然而,当TTE的添加量进一步增加时,肌球蛋白重链和肌动蛋白的条带灰度反而加深,聚集程度减弱,表明TTE在一定程度上抑制了蛋白质分子的过度交联和聚集。刘文娟等[30]在研究带鱼肌原纤维蛋白中添加胡柚皮粉时也发现了相同的变化规律。
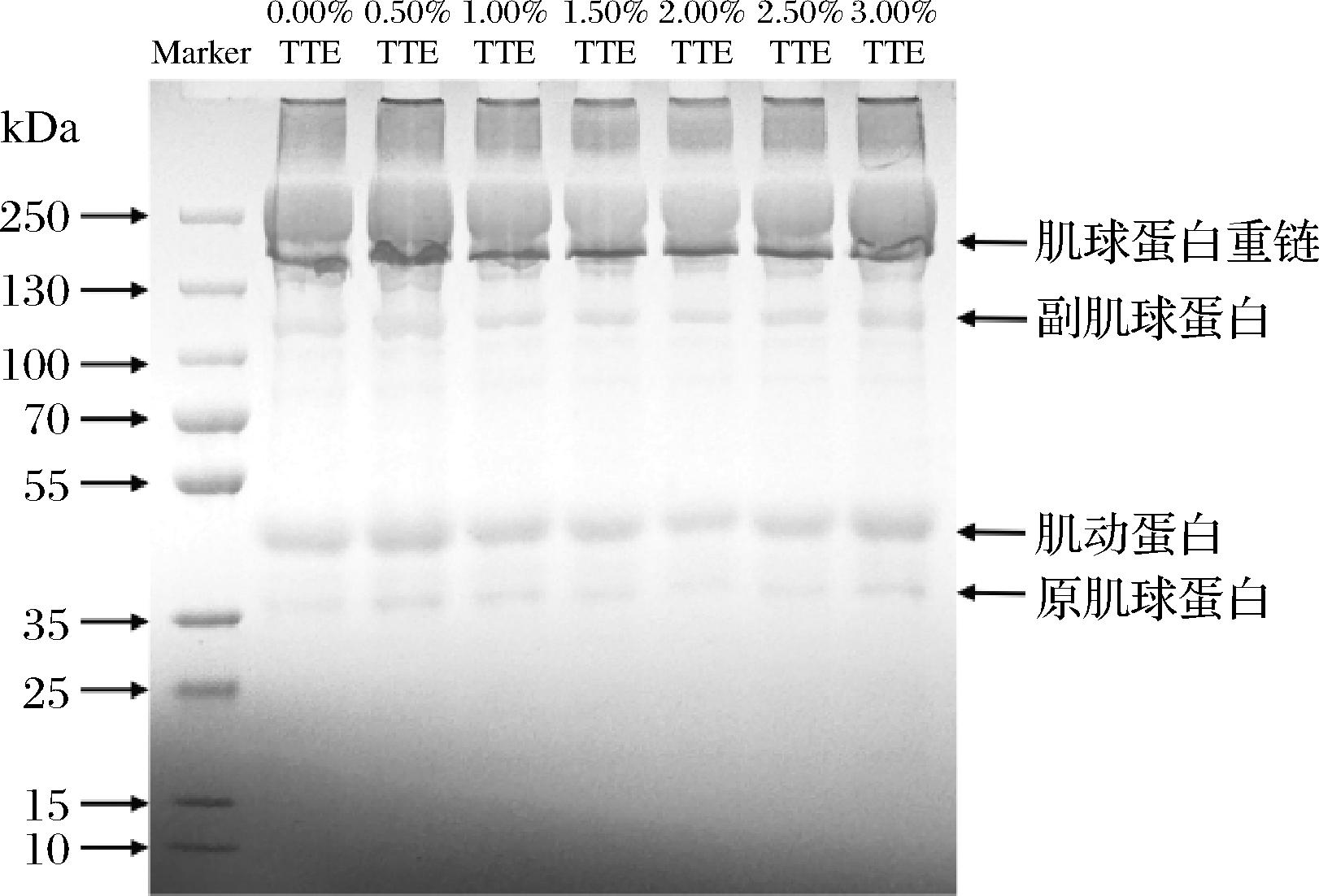
图4 TTE添加量对猪肉肌原纤维蛋白凝胶SDS-PAGE的影响
Fig.4 Effect of TTE addition on the SDS-PAGE of pork myofibrillar protein gels
2.7 对复合肌原纤维蛋白凝胶荧光光谱的影响
在蛋白质分子中,色氨酸(Trp)、酪氨酸(Tyr)以及苯丙氨酸(Phe)3种作为能发射荧光的氨基酸,通常能反映MP的三级结构变化。肌原纤维蛋白通常以紧密折叠的形式存在,其氨基酸基团被包裹在内部的疏水环境中,从而展现出较强的内源荧光强度。当蛋白质结构发生变化时,内部的氨基酸基团会随着多肽链的展开而暴露于外部环境中,导致蛋白质内源荧光强度降低[31]。其中Trp对结构转变过程中微环境的极性灵敏度高,因此通常以色氨酸残基荧光强度高低来表示MP三级结构变化。
如图5所示,随着TTE添加量的增加,复合凝胶荧光强度明显降低,这表明添加TTE一定程度上能改变MP三级结构,引起肌原纤维蛋白构象的变化。TTE与MPs相互作用促使MPs三级结构展开,使得疏水残基暴露于极性环境中,TTE通过共价和非共价相互作用与色氨酸残基结合,导致荧光猝灭,从而降低了内源性荧光强度,且这种效应存在剂量依赖性。此外,TTE中的多酚类物质能够促进MPs的去折叠化,使得更多的色氨酸残基暴露,进一步减弱荧光强度[32]。CAO等[33]研究没食子酸(gallic acid,GA)对MPs的作用时,发现GA的加入会使荧光强度随添加量增加而减小,与本研究结果趋势相同。
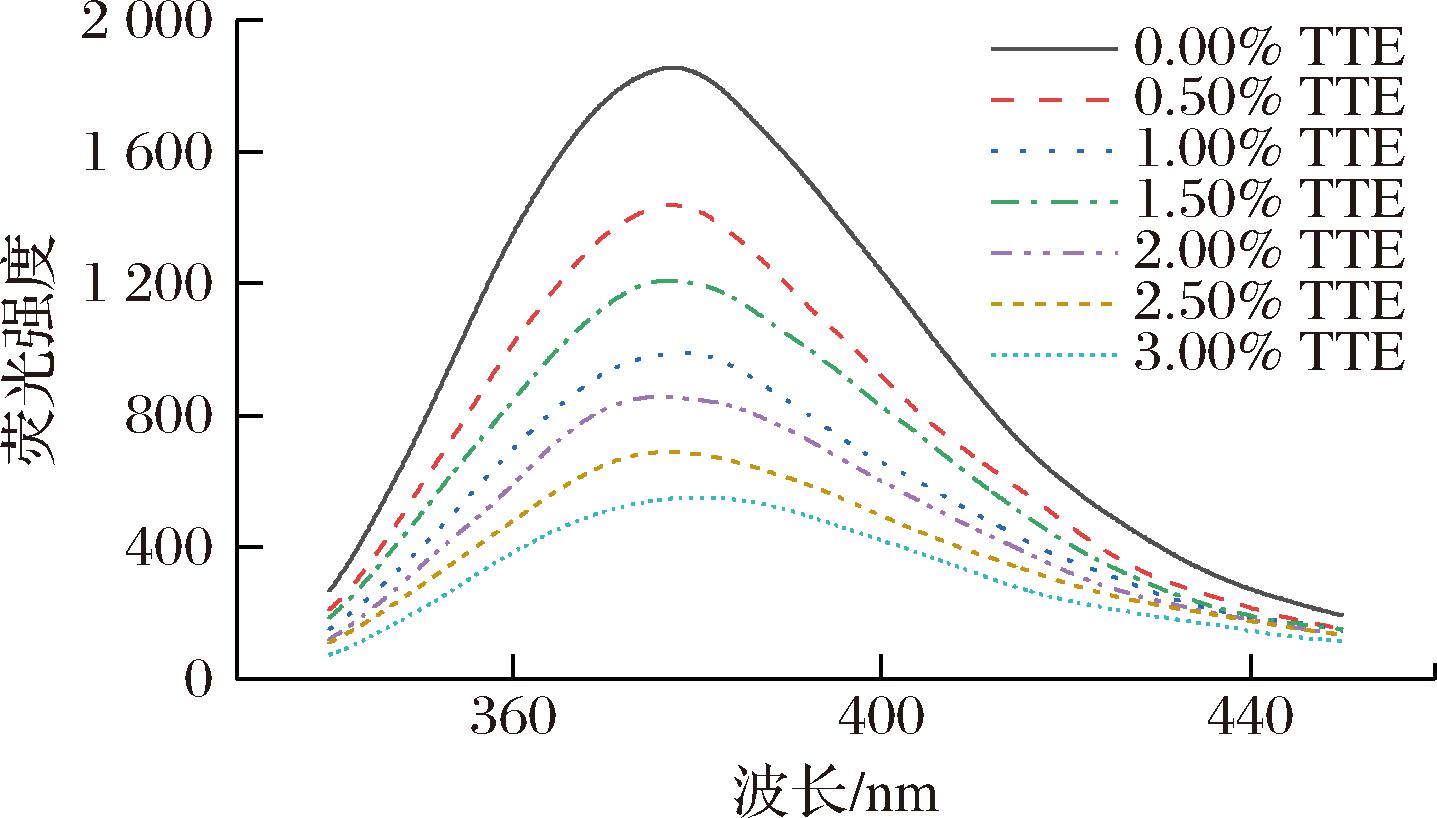
图5 TTE添加量对猪肉肌原纤维蛋白内源荧光光谱的影响
Fig.5 Effect of TTE addition on the fluorescence emission spectrum of pork myofibrillar protein
2.8 对复合肌原纤维蛋白凝胶紫外光谱的影响
Trp、Tyr、Phe三种氨基酸残基在不同波长处有吸收峰,Trp和Tyr在波长280 nm处有吸收峰,此外,肽键在波长225 nm处有一个特征吸收峰[34]。通过图6可以看出,复合蛋白溶液在220 nm和270 nm处有2个特征吸收峰,且随TTE添加量增多,特征吸收峰均逐渐增大。在220 nm处,紫外吸收峰有轻微红移,归因于TTE与MPs相互作用后,TTE诱导蛋白质构象发生变化,MPs解折叠,内部疏水残基暴露,发色基团含量相对增加,因此使紫外吸收峰增大。
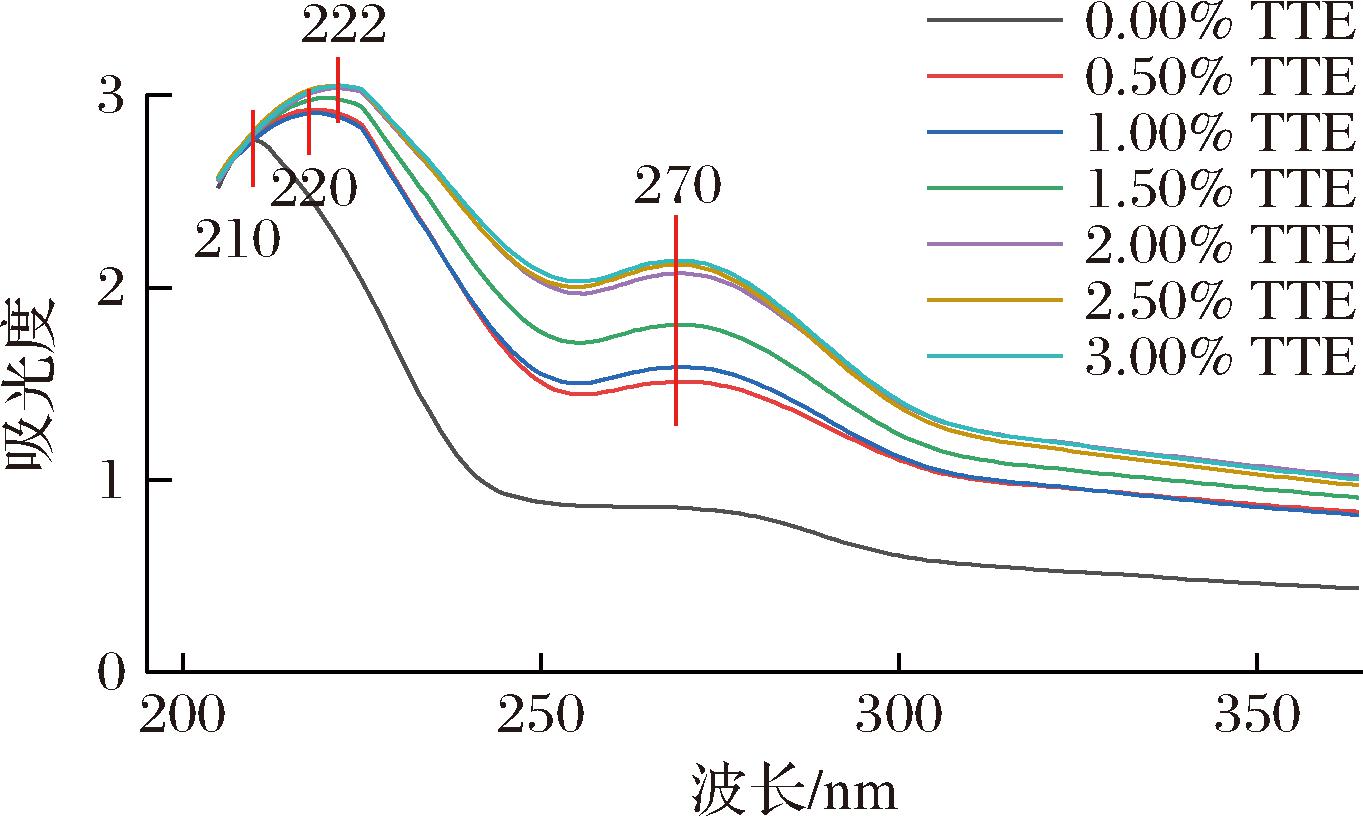
图6 TTE添加量对猪肉肌原纤维蛋白紫外光谱的影响
Fig.6 Effect of TTE addition on the ultraviolet spectrum of pork myofibrillar protein
2.9 对复合肌原纤维蛋白凝胶微观结构的影响
微观结构是决定蛋白凝胶物理性质的关键因素,通常与凝胶的凝胶强度、持水性及稳定性等性质相关[35]。利用SEM检测了不同添加浓度的TTE与MPs凝胶的微观结构,结果如图7所示,0.00%TTE组组表面呈现出明显的不均匀性,凹凸不平且粗糙,有不规则孔洞,孔隙分布不均;相比之下,不同添加量的TTE形成的肌原纤维蛋白凝胶均发生不同程度的聚集,观察到凝胶微观结构表面更为光滑和均匀,孔隙数量减少,这有助于降低水分的流失通道,从而增强凝胶的保水性和凝胶强度。随着TTE添加量增加,MPs聚集现象更为显著,表明添加适量的TTE能够促进MPs之间交联和聚集,这与MPs的保水性和凝胶强度趋势相同。

图7 TTE添加量对猪肉肌原纤维蛋白微观结构的影响
Fig.7 Effect of TTE addition on the gel microstructure of pork myofibrillar protein
3 结论
TTE对猪肉肌原纤维蛋白凝胶的凝胶特性、蛋白结构及微观结构产生了显著影响。具体而言,TTE的添加显著提高了MPs凝胶的保水性和凝胶强度,主要归因于TTE中的多酚类和多糖类物质参与了蛋白质分子的凝胶过程,增强了凝胶的三维网状结构,从而提升了其WHC和凝胶强度。此外,MPs凝胶的G′和G″也受到影响,TTE有助于形成更稳定和弹性更好的凝胶结构。微观结构的观察进一步证实了TTE的积极作用,使其孔隙减少且更为紧密,质地更加均匀,这有助于提高凝胶的保水性和凝胶强度。同时,TTE增加了MPs溶液的浊度和粒径,表明TTE促进了MPs的聚集和交联,改变了蛋白质结构,蛋白结构展开和疏水残基的暴露。综合上述发现,TTE作为一种有前景的食品添加剂,其对MPs凝胶特性的改善作用显著,这不仅增强了其在食品工业中的应用潜力,也为开发新型食品材料提供了新的思路。
[1] ZHAO X, XU X L, ZHOU G H.Covalent chemical modification of myofibrillar proteins to improve their gelation properties:A systematic review[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):924-959.
[2] ROSENFELD M A, VASILYEVA A D, YURINA L V, et al.Oxidation of proteins:Is it a programmed process?[J].Free Radical Research, 2018, 52(1):14-38.
[3] ZHANG L, ZHANG Z Z, ZHOU Y B, et al.Chinese dark teas:Postfermentation, chemistry and biological activities[J].Food Research International, 2013, 53(2):600-607.
[4] WANG Z Q, LI H Y, HUANG W M, et al.Landscapes of the main components, metabolic and microbial signatures, and their correlations during pile-fermentation of Tibetan tea[J].Food Chemistry, 2024, 430:136932.
[5] NIKMARAM N, BUDARAJU S, BARBA F J, et al.Application of plant extracts to improve the shelf-life, nutritional and health-related properties of ready-to-eat meat products[J].Meat Science, 2018, 145:245-255.
[6] 王凝, 张宇佳, 兰朝华, 等.不同等级藏茶抗氧化活性及抑菌能力对比研究[J].四川轻化工大学学报(自然科学版), 2021, 34(6):40-46.
WANG N, ZHANG Y J, LAN C H, et al.Comparative study on antioxidant and antibacterial activity of different grades of Tibetan tea[J].Journal of Sichuan University of Science &Engineering (Natural Science Edition), 2021, 34(6):40-46.
[7] 中华全国供销合作总社杭州茶叶研究院, 国家茶叶质量监督检验中心, 泉州出入境检验检疫局综合技术服务中心, 等.茶叶中茶多酚和儿茶素类含量的检测方法[Z].国家市场监督管理总局,中国国家标准化管理委员会,2018:12.
Hangzhou Tea Research Institute of All-China Supply and Marketing Cooperative, National Tea Quality Supervision Inspection and Test Center, Quanzhou Entry-Exit Inspection and Quarantine Bureau Comprehensive Technical Service Center, et al.Determination of tea polyphenols and catechins in tea[Z].State Administration for Market Regulation,Standardization Administration of China,2018:12.
[8] 张媛媛, 张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学, 2016, 37(4):158-163.
ZHANG Y Y, ZHANG B.Comparison of phenol-sulfuric acid and anthrone-sulfuric methods for determination of polysaccharide in green tea[J].Food Science, 2016, 37(4):158-163.
[9] LIU Y, LUO L Y, LIAO C X, et al.Effects of brewing conditions on the phytochemical composition, sensory qualities and antioxidant activity of green tea infusion:A study using response surface methodology[J].Food Chemistry, 2018, 269:24-34.
[10] ZHOU L, ZHANG J, LORENZO J M, et al.Effects of ultrasound emulsification on the properties of pork myofibrillar protein-fat mixed gel[J].Food Chemistry, 2021, 345:128751.
[11] 余青. 超微粉碎麦麸膳食纤维和富硒西蓝花对香肠品质的影响[D]. 武汉:武汉轻工大学, 2020.
YU Q.Effects of superfine grinding wheat brandietary fiber and selenium-enriched broccolipowder on the quality of sausages[D]. Wuhan:Wuhan Polytechnic University, 2020.
[12] XUE S W, YANG H J, WANG H H, et al.High-pressure effects on the molecular aggregation and physicochemical properties of myosin in relation to heat gelation[J].Food Research International, 2017, 99:413-418.
[13] 贾娜, 林世文, 刘丹, 等.芦丁诱导猪肉肌原纤维蛋白结构变化对蛋白凝胶特性的改善作用[J].食品科学, 2021, 42(8):67-73.
JIA N, LIN S W, LIU D, et al.Improvement effects of structural changes of pork myofibrillar protein induced by rutin on its gel properties[J].Food Science, 2021, 42(8):67-73.
[14] SUN Q X, KONG B H, OUYANG Z, et al.Tracking protein aggregation behaviour and emulsifying properties induced by structural alterations in common carp (Cyprinus carpio) myofibrillar protein during long-term frozen storage[J].International Journal of Biological Macromolecules, 2024, 264:130171.
[15] XIAO H M, WU Y F, LIU J, et al.Potential mechanism of different gelation properties of white and red muscle fibre from crocodile (Crocodylus siamensis) meat:Study of myofibrillar protein[J].LWT, 2021, 143:111045.
[16] 孙乐常, 周典颖, 杜瀚, 等.魔芋胶对南美白对虾肌原纤维蛋白凝胶特性的影响[J].食品科学, 2022, 43(12):42-50.
SUN L C, ZHOU D Y, DU H, et al.Effect of konjac glucomannan on gelling properties of myofibrillar protein from the Pacific white shrimp litopenaeus vannamei[J].Food Science, 2022, 43(12):42-50.
[17] AI M M, TANG T, ZHOU L D, et al.Effects of different proteases on the emulsifying capacity, rheological and structure characteristics of preserved egg white hydrolysates[J].Food Hydrocolloids, 2019, 87:933-942.
[18] HAN M Y, WANG P, XU X L, et al.Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J].Food Research International, 2014, 62:1175-1182.
[19] 贾娜, 王乐田, 马露, 等.香辛料提取物对猪肉肌原纤维蛋白功能性质的影响[J].食品与发酵工业, 2016, 42(2):82-88.
JIA N, WANG L T, MA L, et al.Effect of spice extracts on functional properties of myofibrillar protein in minced pork[J].Food and Fermentation Industries, 2016, 42(2):82-88.
[20] LIU M, CHEN G J, ZHANG H X, et al.Heat-induced inulin-gluten gel:Insights into the influences of inulin molecular weight on the rheological and structural properties of gluten gel to molecular and physicochemical characteristics[J].Food Hydrocolloids, 2021, 111:106397.
[21] FENG J, BAI X, LI Y, et al.Improvement on gel properties of myofibrillar protein from chicken patty with potato dietary fiber:Based on the change in myofibrillar protein structure and water state[J].International Journal of Biological Macromolecules, 2023, 230:123228.
[22] HUANG C Y, BLECKER C, WEI X R, et al.Effects of different plant polysaccharides as fat substitutes on the gel properties, microstructure and digestion characteristics of myofibrillar protein[J].Food Hydrocolloids, 2024, 150:109717.
[23] XU Q D, YU Z L, ZENG W C.Structural and functional modifications of myofibrillar protein by natural phenolic compounds and their application in pork meatball[J].Food Research International, 2021, 148:110593.
[24] 宋春勇, 洪鹏志, 周春霞, 等.负载白藜芦醇的红花籽油乳液对金线鱼鱼糜凝胶品质的影响[J].食品科学, 2022, 43(24):102-109.
SONG C Y, HONG P Z, ZHOU C X, et al.Effect of safflower seed oil emulsion loaded with resveratrol on the quality of Nemipterus virgatus surimi gel[J].Food Science, 2022, 43(24):102-109.
[25] BUAMARD N, BENJAKUL S, KONNO K.Improvement of gel quality of sardine surimi with low setting phenomenon by ethanolic coconut husk extract[J].Journal of Texture Studies, 2017, 48(1):47-56.
[26] WU Z W, SHANG X Y, HOU Q, et al.Using ultrasonic-assisted sodium bicarbonate treatment to improve the gel and rheological properties of reduced-salt pork myofibrillar protein[J].Meat Science, 2024, 212:109465.
[27] ZHAO S M, YANG L, HEI M R, et al.Conformation and functional modification of porcine myofibrillar protein by pepper leaf polyphenols under oxidative condition[J].LWT, 2024, 198:116017.
[28] 王悦松, 刘香玲, 李学鹏, 等.白藜芦醇对鲢鱼肌原纤维蛋白凝胶特性的影响[J].食品科学, 2023, 44(12):42-49.
WANG Y S, LIU X L, LI X P, et al.Effect of resveratrol on gel properties of silver carp myofibrillar protein[J].Food Science, 2023, 44(12):42-49.
[29] ZHOU Y, DAI H J, MA L, et al.Effect and mechanism of Psyllium husk (Plantago ovata) on myofibrillar protein gelation[J].LWT, 2021, 138:110651.
[30] 刘文娟, 木尼热, 吴春华, 等.胡柚皮粉对带鱼肌原纤维蛋白凝胶特性的影响[J].现代食品科技, 2015, 31(1):77-83.
LIU W J, MU N R, WU C H, et al.Effect of Citrus Changshan-Huyou peel powder on the gelling properties of hairtail(Trichiurus lepturus) myofibrillar protein[J].Modern Food Science and Technology, 2015, 31(1):77-83.
[31] 李军. 盐离子和TG酶对鲢肌原纤维蛋白溶胶冷冻稳定性及凝胶品质的影响[D].无锡:江南大学, 2023.
LI J.The effects of salt ions and TGase on the frozenstability and gelling properties of silver carpmyofibrillar proteins sol[D].Wu Xi:Jiangnan University, 2023.
[32] HUANG X, SUN L, LIU L, et al.Study on the mechanism of mulberry polyphenols inhibiting oxidation of beef myofibrillar protein[J].Food Chemistry, 2022, 372:131241.
[33] CAO Y G, TRUE A D, CHEN J, et al.Dual role (anti- and pro-oxidant) of gallic acid in mediating myofibrillar protein gelation and gel in vitro digestion[J].Journal of Agricultural and Food Chemistry, 2016, 64(15):3054-3061.
[34] 吴丹, 徐桂英.光谱法研究蛋白质与表面活性剂的相互作用[J].物理化学学报, 2006, 22(2):254-260.
WU D, XU G Y.Study on protein-surfactant interaction by spectroscopic methods[J].Acta Physico-Chimica Sinica, 2006, 22(2):254-260.
[35] HUANG X, YANG H, LOU A H, et al.Effect of Psyllium husk powder on the gelation behavior, microstructure, and intermolecular interactions in myofibrillar protein gels from Andrias davidianus[J].Food Chemistry, 2024, 458:140266.