乳糖不耐受(lactose intolerance, LI)是由于小肠中乳糖酶活性不足,导致摄入的乳糖不能被完全消化和吸收,未被吸收的乳糖进入结肠后,经肠道菌群的发酵产酸产气,从而出现腹痛、腹胀或腹泻等一系列消化道临床症状。研究普遍认为,LI表现出的症状程度与未吸收的乳糖量呈相关性,即少量乳糖摄入可能不会引起明显症状,而大量摄入则可能引发显著的LI症状。它与乳糖吸收不良(lactose malabsorption, LM) 概念相比,LI更强调由乳糖酶引发的非感染性腹泻等症状[1-2]。事实上,除了罕见的先天性乳糖酶缺乏外,还有原发性和继发性的LI存在,这导致世界范围各个年龄段都会有人存在LI。长久以来,人类应对LI有多种策略,其中,对于轻度LI,专家均建议无需盲目回避乳制品和乳糖,可根据自身情况,通过合理选择乳制品、调整摄入方式和摄入量,来逐步提高耐受性、减轻肠道不适症状,从而维护自身健康[3]。乳品是婴幼儿营养的主要食物来源,是否可以通过适宜乳品来提高婴幼儿对乳糖的耐受性,使机体可以适应轻度乳糖不耐受还有待研究。因此,探究不同乳源对婴幼儿产生乳糖不耐受情况及其影响是极其必要的。
近年来,许多学者对牛、羊乳产生乳糖不耐受的差异及机理开展了相关研究。郝淑苹等[4]通过临床试验观察乳糖不耐受成人饮用牛乳与羊乳后的胃肠道反应,未见显著差异,但因年龄性别均未进行统计划分,且样本量较少,未能分析具体原因。BAHBAH等[5]作了一项中东和北非的牛奶不耐受调查,而后提出羊奶配方可能是牛奶不耐受婴儿的合适替代品。为了更好地研究牛、羊乳粉对乳糖不耐受的影响,尤其是在对乳糖酶活性、生长发育及胃肠消化指标变化方面,我们首先应当建立合适的乳糖不耐受动物模型。
建立乳糖不耐受的动物模型有采用高乳糖诱导、轮状病毒感染诱导以及乳糖酶基因敲除等方法。其中,高乳糖诱导乳糖不耐受建模方法比轮状病毒感染诱导的方法现实操作可行性强,可模拟广泛存在的因生长、疾病、膳食等因素引起的乳糖酶活性降低情况。而敲除乳糖酶基因方法,价格昂贵,该模型代表的是较少数的先天乳糖酶缺陷。相关报道称[6],大鼠肠道乳糖酶活性在断奶后出现和人类高度相似的下降现象,适宜作为构建乳糖不耐受模型的动物。而利用高乳糖诱导机体产生乳糖不耐受,最关键的是选择合适的乳糖摄入含量。因为LIUZZI等[7]使用35%高乳糖诱导,使大鼠产生慢性腹泻,发现随着实验进展,大鼠出现了对乳糖的耐受;CAIN等[8]使用60%(质量分数)高乳糖诱导使大鼠腹泻,发现大鼠乳糖酶活性在此乳糖含量下出现显著提高;而后薛红等[9]使用30%、40%、50%(质量分数)的高乳糖逐周饲喂大鼠,建立慢性腹泻,该研究为乳糖不耐受所致高渗透性腹泻的病理生理机制提供了新证据;2023年TEICHENNÉ等[10]提出大鼠1次摄入足够多的乳糖或持续暴露富含高乳糖的膳食都是可以作为1种天然的乳糖不耐受模型的观点;2024年卡丽比努尔·艾尔肯等[11]使用小鼠进行高乳糖灌胃模拟乳糖不耐受模型,并在此基础上探究低乳糖发酵马乳对乳糖不耐受的影响。从中医研究角度来看,乳糖不耐受也会出现“脾虚泄泻”的症状。近年来,卢梦雄等[12]构建了脾虚证高乳糖腹泻模型,其中指出高乳糖腹泻动物模型可以模拟临床乳糖不耐受的症状;王翼天等[13]使用高乳糖构建乳糖不耐受肝郁脾虚证模型,展现乳糖在小肠吸收不良的特点。
乳糖不耐受的发生与摄入乳糖剂量有关,腹泻是乳糖不耐受的典型临床症状[14]。基于上述背景,本文在前人研究基础上,采用大鼠定量摄入不同含量乳糖饲料的方法,重点研究了高乳糖造模下对幼鼠时期乳糖酶活性的影响,从而确定乳糖不耐受模型的最佳乳糖含量与实验周期。同时,研究和明确牛、羊乳粉对乳糖不耐受幼鼠模型在乳糖酶活性、生长发育以及胃肠道功能指标等方面的差异影响,期待这项研究能为建立高乳糖诱导的乳糖不耐受动物模型提供新的思路和方法,也为婴幼儿选择乳糖不耐受适应性奶源提供参考意见。
1 材料与方法
1.1 实验动物与试剂
无特定病原体(specific pathogen free,SPF)级雌性Wistar幼鼠,3周龄,体重45~65 g,购于北京维通利华动物技术有限公司,许可证号:SCXK(京)2021-0006。动物在温度(23±3) ℃,湿度50%~70%的环境下适应性喂养3 d,每周2次消毒清洁。观察适应性喂养阶段大鼠的常规指标,包括体重、精神状态、活动和进食量等,无明显异常后,开始构建动物实验模型。所有实验经过湖南中医药大学动物管理委员会批准(HNUCMZ1-2309-11)。
AIN-93G大豆蛋白固体饲料、高乳糖(含量为0%、50%、60%、67%,质量分数,下同)纯化饲料,江苏协同饲料有限公司;大鼠乳糖酶(lactase,Lac)、二胺氧化酶(diamine oxidase,DAO)、胃动素(motilin,MTL)、生长抑素(somatostatin,SS)试剂盒,上海酶联生物科技有限公司;伊红染液、苏木素染液,南京米徕迪生物科技有限公司。
TD5A-WS医用离心机,湖南湘仪实验室仪器开发有限公司;RT-6100酶标仪,深圳雷杜生命科学股份有限公司;VS200数字玻片扫描系统,奥林巴斯公司。
1.2 实验方法
1.2.1 高乳糖诱导的乳糖不耐受建模动物实验
适应性喂养3 d后,随机将50只Wistar幼鼠分为空白组、0%高乳糖-模型组、50%高乳糖-模型组、60%高乳糖-模型组和67%高乳糖-模型组,每组10只,每只幼鼠单独1个代谢笼。各组小鼠喂养的饲料成分如表1所示,使用了美国营养学会(American Institute of Nutrition,AIN)制定的AIN-93G 纯化饲料作为基本饲料,以满足幼鼠生长发育所需营养,并在保证各大营养素总量不变的基础上设计成不同含量的乳糖饲料。其中,为了避免饲料中酪蛋白影响,造模实验各组将饲料中蛋白质均更换为大豆分离蛋白,碳水化合物全部替换为不同质量分数的乳糖和蔗糖。根据预实验确定配制饲料最佳固形物含量为48%,即用48 g纯化饲料粉+52 g动物饮用水制成,混合均匀后定量喂食给每只幼鼠。
表1 基于AIN-93G的幼鼠高乳糖纯化饲料配方 单位:g
Table 1 AIN-93G-based high-lactose purified feed formulation for rat pups
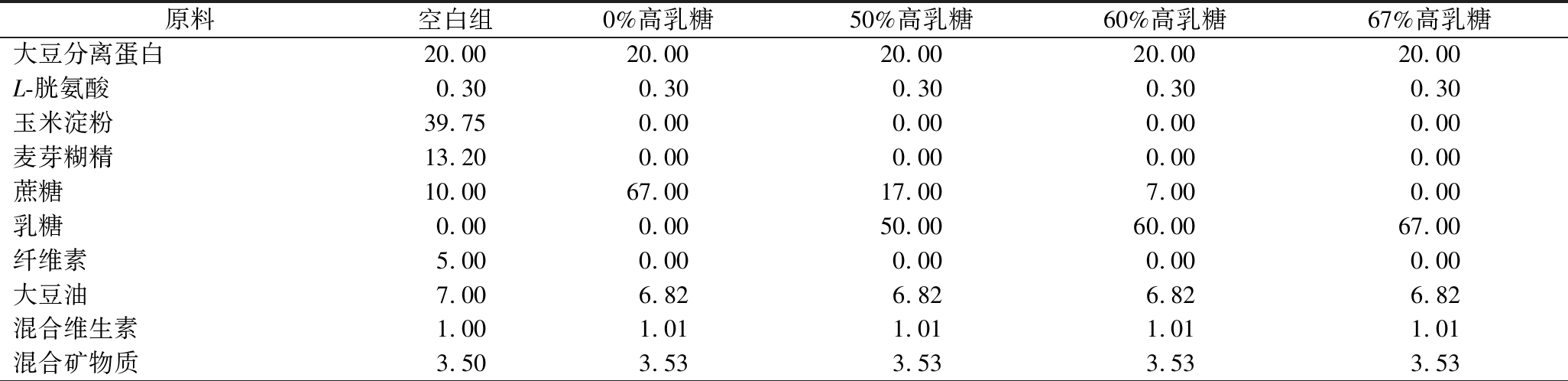
原料空白组0%高乳糖50%高乳糖60%高乳糖67%高乳糖大豆分离蛋白20.0020.0020.0020.0020.00L-胱氨酸0.300.300.300.300.30玉米淀粉39.750.000.000.000.00麦芽糊精13.200.000.000.000.00蔗糖10.0067.0017.007.000.00乳糖0.000.0050.0060.0067.00纤维素5.000.000.000.000.00大豆油7.006.826.826.826.82混合维生素1.001.011.011.011.01混合矿物质3.503.533.533.533.53
续表1
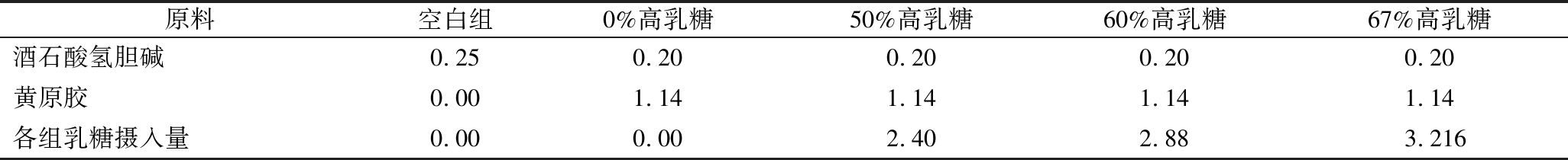
原料空白组0%高乳糖50%高乳糖60%高乳糖67%高乳糖酒石酸氢胆碱0.250.200.200.200.20黄原胶0.001.141.141.141.14各组乳糖摄入量0.000.002.402.883.216
饲料摄入周期一共为7 d,期间各组均自由饮水,空白组自由进食固体饲料,而模型组和实验组固定每日早上9∶00和下午16∶00分别进食1次,每次5 g,每日总进食量为10 g,并于代谢笼中放置干净滤纸,每小时更换1次,记录幼鼠每日腹泻情况、精神状态及活动情况,并在摄入0 d和7 d后称量体重。分别在实验第4天和第8天早上每组各取5只幼鼠进行解剖。
1.2.2 高乳糖诱导的乳糖不耐受建模动物实验
3周龄的Wistar幼鼠适应性喂养3 d后,随机将40只幼鼠分为空白组、67%高乳糖-模型组、67%高乳糖-牛乳粉组(牛乳粉组)、67%高乳糖-羊乳粉组(羊乳粉组),每组10只。其余,同1.1节,所有程序均严格按照中国实验动物使用和护理法规进行。
表2为牛、羊乳粉三大营养素具体含量。因牛、羊乳粉中同样含有蛋白质,将纯化饲料中的大豆分离蛋白去掉,其余成分保持不变,由牛、羊乳粉提供蛋白质。
表2 牛、羊乳粉三大营养素含量 单位:g/100 g
Table 2 Three nutrients content of cow and goat milk powder

样品碳水化合物蛋白质脂肪牛乳粉422528羊乳粉382527
各组饲料的配制依旧是按照48%固形物含量,为保证碳水化合物各组摄入量一致的前提下,分配牛、羊乳粉以及无蛋白高乳糖纯化饲料粉的占比,加水混合均匀后定量喂食给各组幼鼠,具体信息如表3。乳糖摄入量计算是根据牛、羊乳粉提供的乳糖(近似将乳粉中的碳水化合物全部视为是乳糖)+无蛋白高乳糖纯化饲料粉提供的乳糖。
表3 牛、羊乳粉对高乳糖诱导的乳糖不耐受大幼鼠影响实验饲料配比及乳糖摄入量
Table 3 Effects of cow and goat milk powder on high lactose-induced lactose intolerance in rat pups in experimental feed ratios and lactose intake

组别1~7 d摄入饲料固形物含量/%每日每只幼鼠乳糖摄入量/(g/d)空白组AIN-93G大豆固体饲料-自由进食/067%高乳糖-模型组67%乳糖纯化饲料483.216
续表3

组别1~7 d摄入饲料固形物含量/%每日每只幼鼠乳糖摄入量/(g/d)67%高乳糖-(牛乳粉组)无蛋白高乳糖纯化饲料+牛乳粉483.02467%高乳糖-(羊乳粉组)无蛋白高乳糖纯化饲料+羊乳粉482.928
1.2.3 幼鼠腹泻及体重情况分析
幼鼠于造模第1天和造模最后1天称重,体重增长率按公式(1)计算:
体重增长率![]()
(1)
式中:m1,造模第1天的体重,g;m2,造模最后1天的体重,g。
将大鼠单只放入垫有滤纸的代谢笼内,滤纸更换频率1次/h,滤纸连续收集记录4 h,每只幼鼠滤纸上的腹泻率按公式(2)计算:
腹泻率![]()
(2)
式中:n1,腹泻幼鼠只数,个;n2,幼鼠总只数,个。
腹泻级根据滤纸上污迹范围大小分为4级,1级:污迹直径<1 cm;2级:1 cm≤污迹直径<2 cm;3级;2 cm≤污迹直径<3 cm;4级:污迹直径≥3 cm。
1.2.4 幼鼠血清中Lac、DAO、MTL以及SS含量水平分析
实验结束后,注射戊巴比妥钠处死幼鼠,腹主动脉取血,4 ℃静置 4 h后3 500 r/min离心15 min,分离血清,采用ELISA试剂盒检测血清中Lac、DAO、MTL以及SS含量水平。
1.2.5 幼鼠组织取材及苏木精-伊红(hematoxylin-eosin,HE)染色观察
取幼鼠的胃、小肠(十二指肠、空肠和回肠)、脾脏、肝脏后,用0.9%(质量分数)NaCl溶液洗净,再用滤纸吸干水分。其中,脾脏和肝脏称重,并按公式(3)和公式(4)计算器官指数,胃和小肠用多聚甲醛溶液固定,后用HE染色进行观察。
脾脏器官指数![]()
(3)
肝脏器官指数![]()
(4)
式中:m2,造模最后1天的体重,g;m3,脾脏质量,mg;m4,肝脏质量,mg。
1.2.6 数据处理
数据处理采用Excel 2016和SPSS 25,作图采用GraphPad Prism软件,使用Origin Pro 2023进行Pearson相关性分析。数据结果以“平均值±标准差”表示,采用P值表示统计结果的差异性显著情况,P<0.05表示两组间差异具有统计学意义,P<0.05标记为“*”,P<0.01标记为“**”,P<0.001标记为“***”,星号越多,显著性越大。
2 结果与分析
2.1 高乳糖诱导的乳糖不耐受幼鼠模型建立
2.1.1 摄入不同含量高乳糖饲料幼鼠日常表现
造模实验期间,空白组和0%高乳糖-模型组的幼鼠毛发均正常,肛门干净,活动及精神状态良好,粪便呈黑色且颗粒分明。而其他给予50%、60%与67%的3组高乳糖饲料的幼鼠大部分每日摄入饲料1~4 h后,即出现明显的黄色水样腹泻,且随着乳糖浓度增加,腹泻程度明显增加;随着实验时间延长,摄入高乳糖的3组幼鼠颈部毛发逐渐发黄凌乱,失去光泽,还有部分大鼠出现进食缓慢、活动减少的现象。
2.1.2 摄入不同含量高乳糖饲料幼鼠体重变化情况
如表4所示,造模实验期间,空白组由于自由摄食不含乳糖的饲料,其 7 d内体重显著增加了48.83%。而其他4组由于每天定量摄入饲料,7 d内体重均无显著增加,且67%高乳糖-模型组体重出现了负增长趋势,但这4组之间的体重无显著性差异。
表4 摄入不同含量高乳糖饲料各组幼鼠第0天与第7天体重变化情况
Table 4 Changes in body weights on d 0 and d 7 in groups of rats fed different high lactose diets
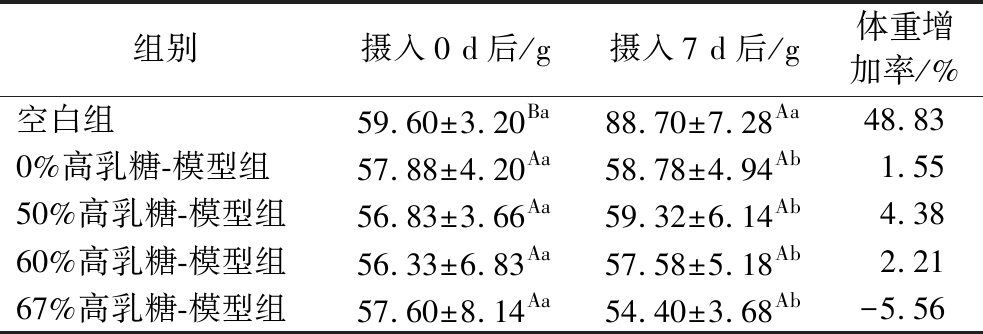
组别摄入0 d后/g摄入7 d后/g体重增加率/%空白组59.60±3.20Ba88.70±7.28Aa48.830%高乳糖-模型组57.88±4.20Aa58.78±4.94Ab1.5550%高乳糖-模型组56.83±3.66Aa59.32±6.14Ab4.3860%高乳糖-模型组56.33±6.83Aa57.58±5.18Ab2.2167%高乳糖-模型组57.60±8.14Aa54.40±3.68Ab-5.56
注:同行上标的不同大写字母表示具有显著差异,同列上标的不同小写字母表示具有显著差异(P<0.05)(下同)。
2.1.3 摄入不同含量高乳糖饲料幼鼠腹泻情况
腹泻是乳糖不耐受的一个典型症状,当机体摄入大量乳糖后,乳糖的消化吸收出现问题,均可导致肠腔内的乳糖浓度和渗透压升高,发酵产生的H2、CH4等气体刺激肠道蠕动,从而出现腹泻症状,导致肠黏膜持续损害和肠黏膜修复延迟,严重者甚至造成贫血、死亡等后果[15]。
如表5所示,造模实验第3天和7天,除空白组和0%高乳糖-模型组外, 50%、60%和67%高乳糖-模型组幼鼠均出现腹泻,且随着乳糖含量增高,腹泻级和腹泻率显著增加;并且出现腹泻的各组在第3天的腹泻程度比第7天严重。大鼠开始接触乳糖时,腹泻情况严重,但随着继续接触乳糖,腹泻情况有所减轻,我们实验同样发现摄入50%、60%高乳糖-模型组幼鼠在后期腹泻会出现恢复现象,这表明大鼠在一定程度上能适应乳糖。
表5 摄入不同含量高乳糖饲料各组幼鼠3 d和7 d后的腹泻情况
Table 5 Diarrhea after 3 days and 7 days in groups of young rats consuming diets with different levels of high lactose content
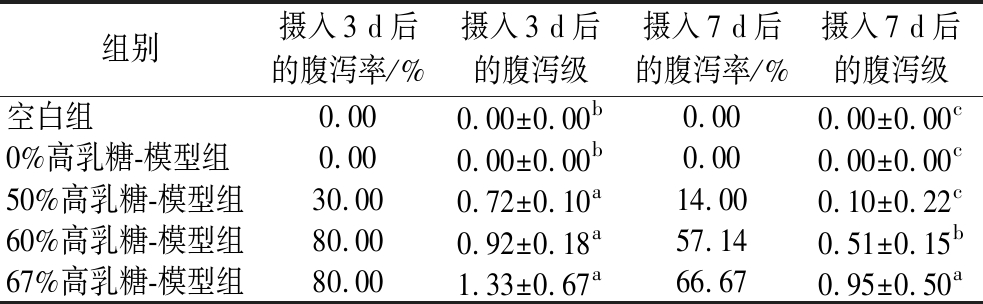
组别摄入3 d后的腹泻率/%摄入3 d后的腹泻级摄入7 d后的腹泻率/%摄入7 d后的腹泻级空白组0.000.00±0.00b0.000.00±0.00c0%高乳糖-模型组0.000.00±0.00b0.000.00±0.00c50%高乳糖-模型组30.000.72±0.10a14.000.10±0.22c60%高乳糖-模型组80.000.92±0.18a57.140.51±0.15b67%高乳糖-模型组80.001.33±0.67a66.670.95±0.50a
注:每组n = 10只,3 d与7 d各5只(下同)。
2.1.4 摄入不同含量高乳糖饲料幼鼠血清及小肠各段中乳糖酶活性
由图1所示,摄入饲料3 d后,各组之间的血清乳糖酶差异不大,但7 d后,50%和60%高乳糖-模型组中血清乳糖酶出现极显著增加(P<0.001),相比之下,67%高乳糖-模型组幼鼠血清中乳糖酶活性未出现显著变化(P>0.05)。乳糖作为乳糖酶底物可以诱导乳糖酶活性增加[16],50%和60%高乳糖饲料中乳糖含量可以刺激机体分泌乳糖酶,但我们发现到了67%乳糖浓度时可以抑制机体中乳糖酶活性,并产生持续性腹泻,从而达到乳糖不耐的造模要求。
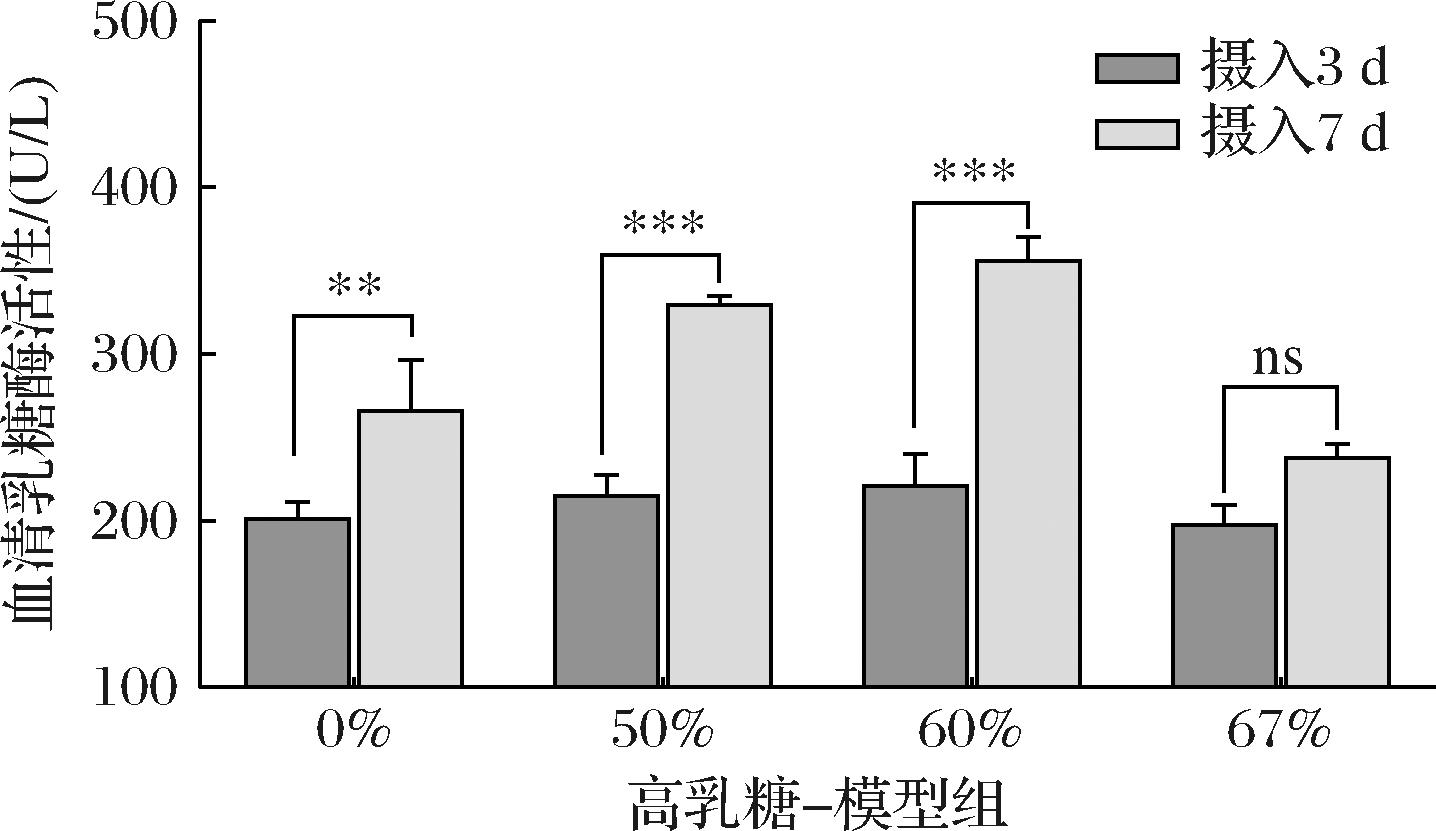
图1 摄入3 d与7 d不同含量高乳糖饲料各组幼鼠血清乳糖酶活性对比
Fig.1 Comparison of serum lactase activity of rat pups in different diets containing high lactose content after 3 days and 7 days
注:**表示组间存在极显著差异(P<0.01);***表示差异极显著(P<0.001);ns表示不存在显著差异(下同)。
图2为摄入不同含量高乳糖饲料幼鼠小肠各段乳糖酶活性变化。与图1相类似,这4组中,整体来说,0%与50%高乳糖-模型组中小肠各段的乳糖酶活性在200 U/L左右,60%高乳糖-模型组中小肠各段的乳糖酶活性大于200 U/L,而67%高乳糖-模型组中小肠各段的乳糖酶活性小于200 U/L,这说明67%高乳糖饲料能明显抑制小肠各段中的乳糖酶活性。
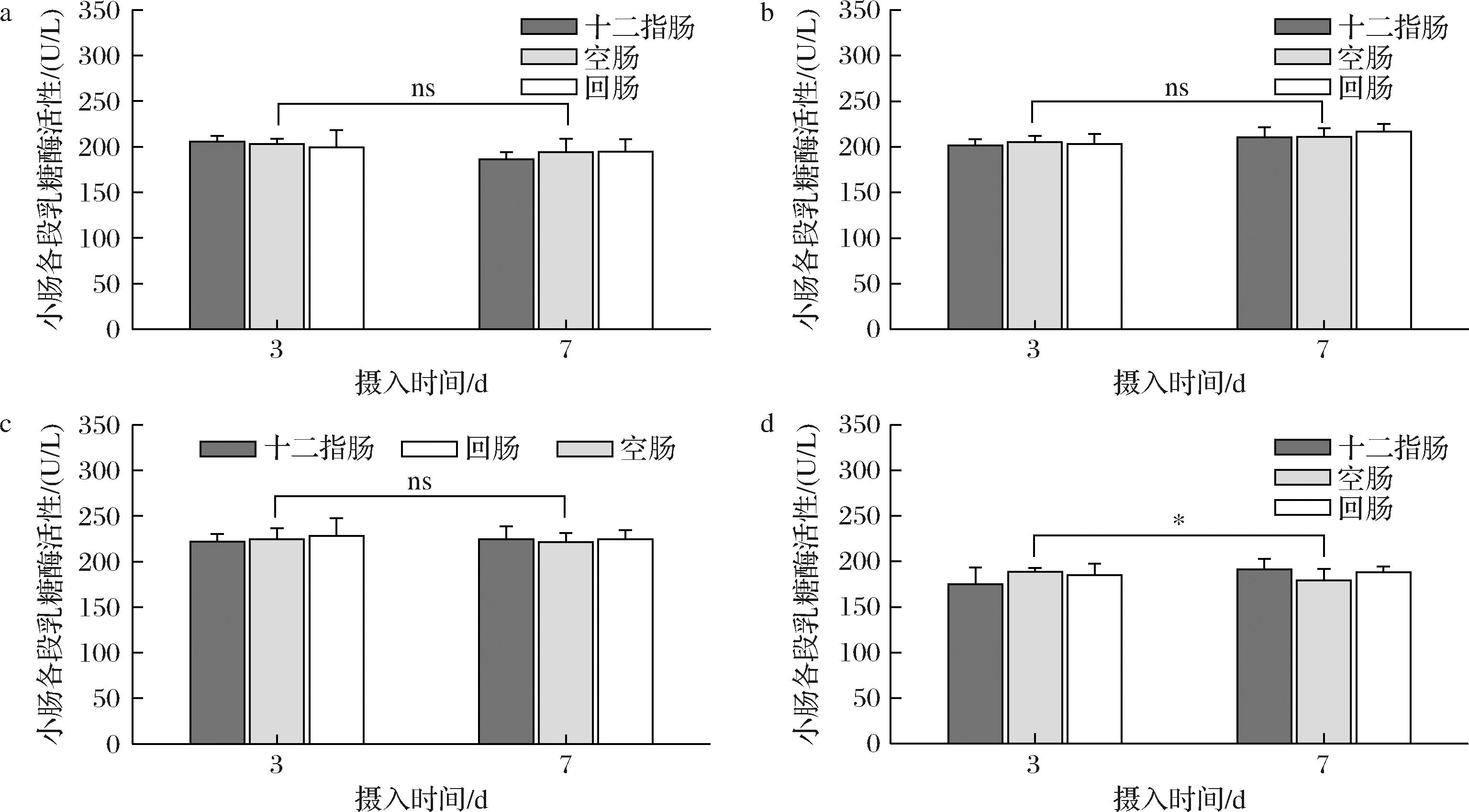
a-0%乳糖;b-50%乳糖;c-60%乳糖;d-67%乳糖
图2 摄入3 d与7 d不同含量高乳糖饲料的各组幼鼠小肠各段乳糖酶活性对比
Fig.2 Comparison of lactase activity in small intestine of rat pups after 3 days and 7 days of different high-lactose diets
值得注意的是,乳糖酶活性在空肠中是表达最高的,只有67%高乳糖-模型组幼鼠的空肠中乳糖酶活性,随着摄入天数的增加,出现显著下降(P<0.05),其余各组空肠乳糖酶活性未见显著变化。综上所述,从血清与小肠各段的乳糖酶活性变化,可以表明饲料中67%高乳糖浓度可作为产生乳糖不耐受症状的合适乳糖剂量。
2.2 摄入牛、羊乳粉对高乳糖诱导的乳糖不耐受影响
2.2.1 幼鼠日常表现
如表6所示,实验期间,空白组一切正常,而67%高乳糖-模型组出现严重腹泻。与67%高乳糖-模型组相比,67%高乳糖-牛乳粉组与羊乳粉组的腹泻级均显著降低;与牛乳粉组比,羊乳粉组呈现更低趋势,但无显著性差异。具体地,牛乳粉组有1只幼鼠出现活动减少现象,而羊乳粉组幼鼠均未出现活动减少现象,精神状态良好。
表6 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后各组幼鼠腹泻情况
Table 6 Diarrhea of rat pups in each group after 3 days and 7 days of intake of 67% high lactose diet containing cow and goat milk powder

组别摄入3 d后腹泻率/%摄入3 d后的腹泻级摄入7 d后的腹泻率/%摄入7 d后的腹泻级空白组0.000.00±0.00c0.000.00±0.00c67%高乳糖-模型组1001.51±0.39a1001.23±0.27a67%高乳糖-(牛乳粉组)1001.14±0.26b800.82±0.23b67%高乳糖-(羊乳粉组)1000.96±0.25b800.70±0.15b
2.2.2 幼鼠体重
由表7可知,在喂养7 d后,67%高乳糖-模型组与牛乳粉组间无显著差异;相比这2组,羊乳粉组幼鼠体重出现显著增加(P<0.05)。吴桐等[17]通过建立营养不良大鼠模型,发现山羊乳调制乳粉对营养不良大鼠模型有明显的改善作用,尤其是在体重上显著增加,羊乳可以促进动物生长发育和营养吸收。
表7 摄入含牛、羊乳粉的67%高乳糖饲料0 d与7 d后各组幼鼠体重对比 单位:g
Table 7 Comparison of body weight of rat pups in each group after 0 day and 7 days after intake of 67% high lactose diet containing cow and goat milk powder
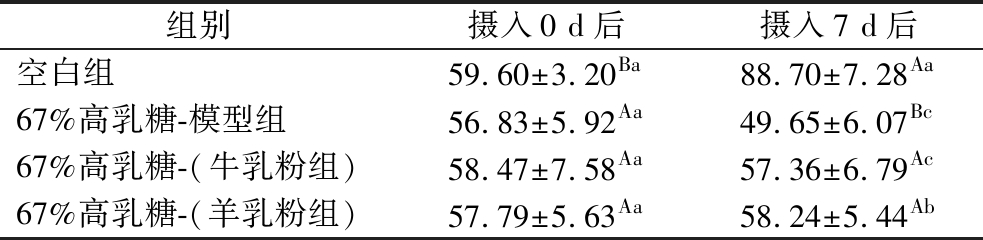
组别摄入0 d后摄入7 d后空白组59.60±3.20Ba88.70±7.28Aa67%高乳糖-模型组56.83±5.92Aa49.65±6.07Bc67%高乳糖-(牛乳粉组)58.47±7.58Aa57.36±6.79Ac67%高乳糖-(羊乳粉组)57.79±5.63Aa58.24±5.44Ab
2.2.3 幼鼠器官质量及指数
由表8可知,相对于67%高乳糖-模型组与牛乳粉组,羊乳粉组的脾脏质量与脾脏指数均显著增加,在脾脏指数上达到与健康的空白组无显著差异(P<0.05)。脾脏作为体内最大的免疫器官,其正常发育与免疫系统的健康有直接联系,一般情况下如果脾脏的质量下降,免疫力会受损。这提示羊乳组脾脏免疫器官发育良好,能起到增强保障机体免疫功能的作用。对于肝脏,羊乳粉组的肝脏质量均显著高于牛乳粉组与模型组,但显著低于空白组;除了模型组外,牛、羊乳粉组与空白组相比,肝脏指数无显著差异。
表8 摄入含牛、羊乳粉的67%高乳糖饲料7 d后各组幼鼠脾脏与肝脏质量及指数
Table 8 Spleen and liver weight and index of rat pups in each group after 7 days of intake of 67% high lactose diet containing cow and goat milk powder
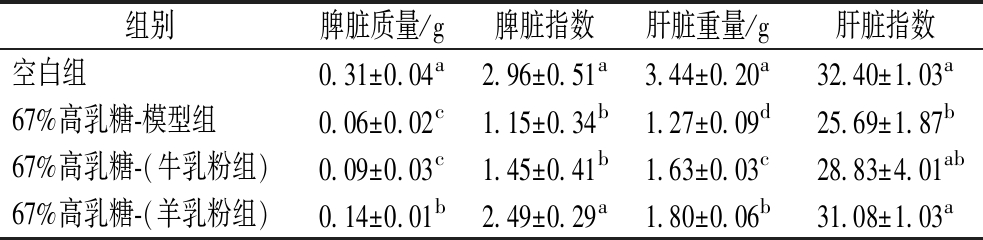
组别脾脏质量/g脾脏指数肝脏重量/g肝脏指数空白组0.31±0.04a2.96±0.51a3.44±0.20a32.40±1.03a67%高乳糖-模型组0.06±0.02c1.15±0.34b1.27±0.09d25.69±1.87b67%高乳糖-(牛乳粉组)0.09±0.03c1.45±0.41b1.63±0.03c28.83±4.01ab67%高乳糖-(羊乳粉组)0.14±0.01b2.49±0.29a1.80±0.06b31.08±1.03a
2.2.4 幼鼠血清乳糖酶活性对比
如图3所示,对每组自身分别摄入3 d与7 d后乳糖酶活性进行对比,首先,空白组从断奶到固体饲料自由摄入3 d与7 d后,在不接触乳糖的情况下,机体中乳糖酶活性出现极显著下降现象,符合正常,有许多研究表明,大鼠在断奶前后会出现酶活性的急剧下降,直至一个较低的水平。此时,67%高乳糖-模型组同前面造模结果图1相一致,摄入3 d与7 d后乳糖酶活性无显著差异;与牛乳粉组的血清乳糖酶前后无显著性差异相比,羊乳粉组的乳糖酶活性从3~7 d出现了极显著的增长(P<0.001),这表明,羊乳粉组在提高乳糖酶活性的表现上优于牛乳粉。
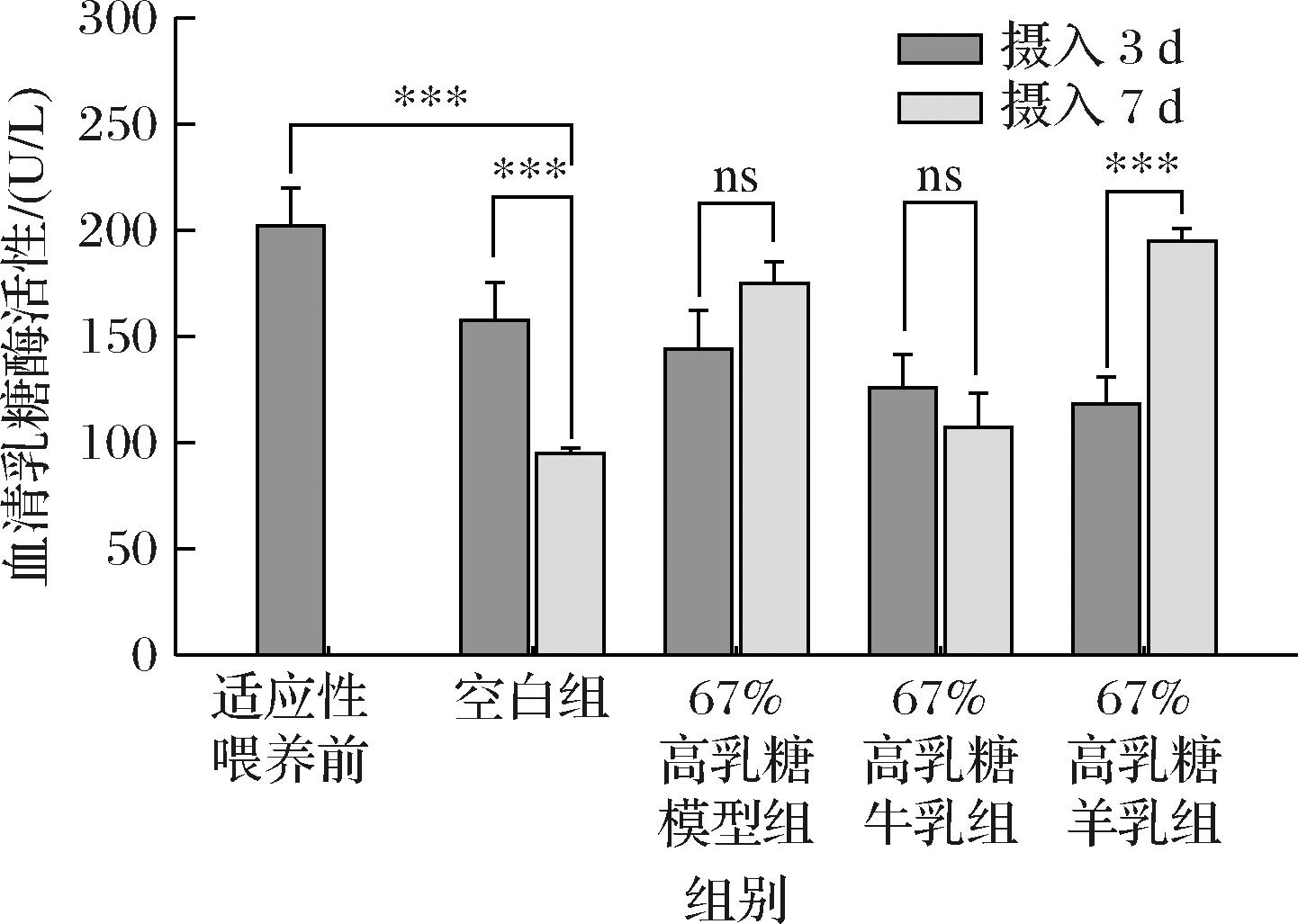
图3 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后幼鼠血清糖酶活性自身对比
Fig.3 Comparison of serum glucokinase activity itself in young rats after 3 days and 7 days of intake of 67% high-lactose diet containing cow and goat milk powder
随后对摄入3 d与7 d后的3组间乳糖酶活性进行了对比。如表9所示,摄入3 d后,各组中,空白组、模型组和牛乳粉组三者间均无显著差异(P>0.05),牛、羊乳粉组之间同样无显著差异(P>0.05),但此时羊乳粉组显著低于模型组和空白组。而到了喂养7 d后,羊乳粉组显著高于其他3组,比牛乳组高81.74%。
表9 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后组间幼鼠糖酶活性对比 单位:U/L
Table 9 Comparison of glycogens activity in rat pups after 3 days and 7 days of intake of 67% high lactose diet containing cow and goat milk powder
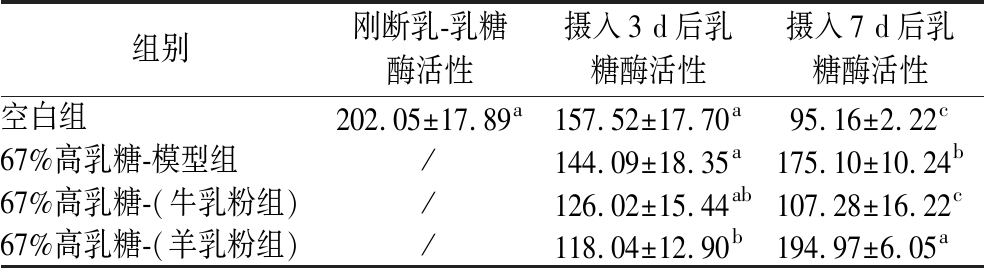
组别刚断乳-乳糖酶活性摄入3 d后乳糖酶活性摄入7 d后乳糖酶活性空白组202.05±17.89a157.52±17.70a95.16±2.22c67%高乳糖-模型组/144.09±18.35a175.10±10.24b67%高乳糖-(牛乳粉组)/126.02±15.44ab107.28±16.22c67%高乳糖-(羊乳粉组)/118.04±12.90b194.97±6.05a
2.2.5 幼鼠血清DAO含量对比
DAO是在哺乳动物小肠黏膜上层绒毛中一种具有高度活性的细胞内酶,当肠黏膜细胞受损坏死后,DAO会释放入血,从而导致血清中DAO含量增多。因此,血清中DAO含量可以特异性地反映肠壁组织结构的完整性,从而提示肠道机械屏障的完整性和受损程度[18]。
如图4所示,对每组自身3 d与7 d后的DAO含量对比可知,牛乳粉组与羊乳粉组均呈现极显著下降(P<0.001),说明这2组在7 d后出现了肠黏膜屏障的恢复,其中,羊乳粉组降低幅度较大;这证明,与牛乳粉组相比,羊乳粉组对乳糖不耐受幼鼠的肠黏膜屏障恢复作用相对更好,显示了一个较快、较强的恢复能力,也有研究表明,羊乳粉可降低肠黏膜通透性,从而改善肠黏膜屏障功能[19]。与之相反,67%高乳糖-模型组血清中DAO含量呈现极显著增加(P<0.01),表明其肠黏膜损伤产生了持续性恶化,未见其出现恢复趋势。
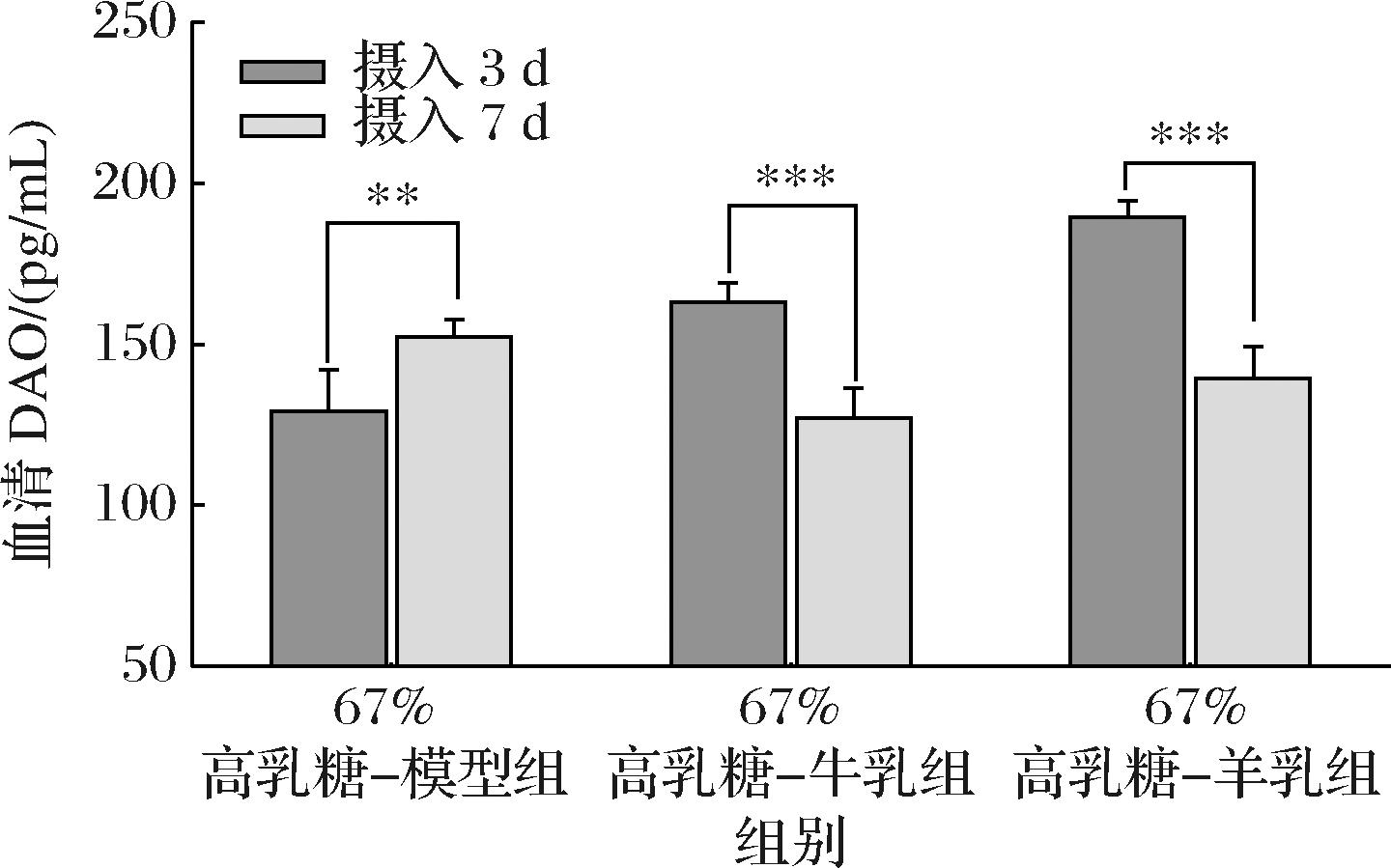
图4 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后幼鼠血清DAO含量自身对比
Fig.4 Comparison of serum DAO content of rat pups after 3 days and 7 days after intake of 67% high lactose diet containing cow and goat milk powder
随后对摄入3 d与7 d后的3组间DAO含量进行对比。由表10可知,摄入3 d后,67%高乳糖-模型组DAO含量最低,其次是牛乳粉组,而羊乳粉组最高;但到了摄入7 d后,67%高乳糖-模型组DAO含量3组间最高,而牛、羊乳粉组间无显著差异(P<0.05)。这表明,虽然起初羊乳粉组肠黏膜受损最严重,而通过不断摄入后,其恢复能力最强,7 d后能达到与牛乳粉一致的水平。反之,67%高乳糖-模型组是3组中肠黏膜屏障恢复能力最弱的。
表10 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后组间幼鼠DAO含量对比 单位:pg/mL
Table 10 Comparison of the content of DAO in rat pups after 3 days and 7 days of intake of 67% high lactose diet containing cow and goat milk powder

组别摄入3 d摄入7 d67%高乳糖-模型组129.00±13.11c152.27±5.39a67%高乳糖-(牛乳粉组)163.14±5.91b127.12±9.17b67%高乳糖-(羊乳粉组)189.42±5.17a139.44±9.67b
2.2.6 幼鼠血清MTL含量对比
MTL属于胃肠激素,其分泌增加能促进胃肠黏膜损伤后的修复和营养物质消化吸收,主要生理功能是调节胃肠道蠕动,促进胃平滑肌的收缩[20]。如图5所示,对每组摄入3 d与7 d后的MTL含量对比,发现3组中,羊乳粉组中血清MTL含量出现极显著增加(P<0.001),增加幅度最高,增加了32.77%;其次是牛乳粉组,出现显著增加(P<0.05),增加了24.58%;而67%高乳糖-模型组未出现显著性变化。这表明,67%-高乳糖模型组胃肠动力不足,无法充分消化乳糖,而羊乳粉组幼鼠血清MTL含量极显著提高,较牛乳组可以更好地消化乳糖。
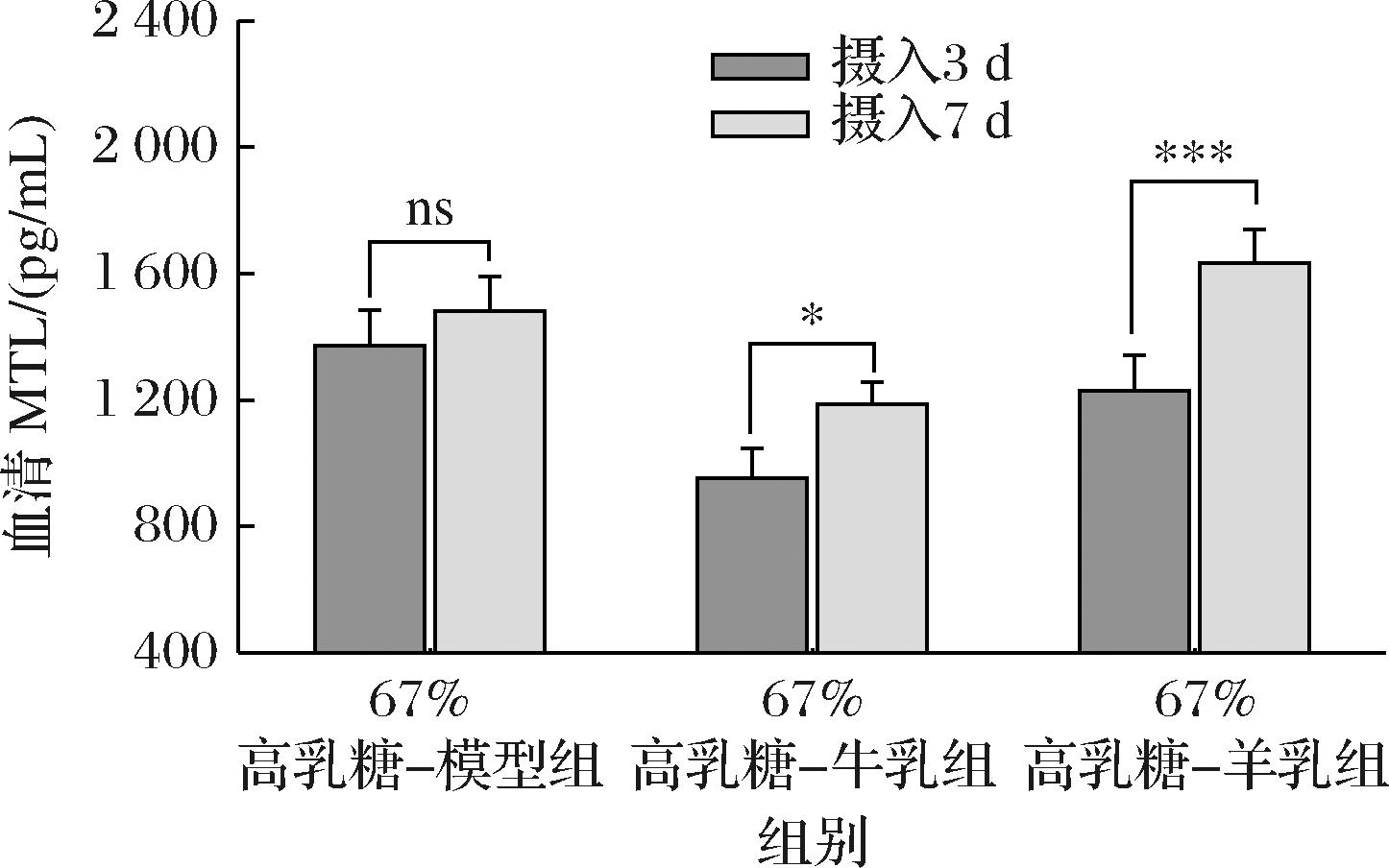
图5 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后幼鼠血清胃动素含量自身对比
Fig.5 Comparison of serum motility content of rat pups after 3 days and 7 days after ingestion of 67% high-lactose diet containing cow and goat milk powder
随后对摄入3 d与7 d后的3组间MTL含量对比。由表11可知,摄入3 d后,羊乳粉组与67%高乳糖-模型组的MTL含量均最高,而牛乳粉组较低;到了摄入7 d后,羊乳粉组的MTL含量仍然最高,而牛乳粉组与67%高乳糖-模型组则较低。说明羊乳粉组的胃肠消化运动功能上明显优于牛乳粉组。
表11 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后组间幼鼠血清胃动素含量对比 单位:pg/mL
Table 11 Comparison of serum motilin content of rat pups after 3 days and 7 days after intake of 67% high lactose diet containing cow and goat milk powder

组别摄入3 d后摄入7 d后67%高乳糖-模型组1 372.42±111.59a1 480.54±109.88b67%高乳糖-(牛乳粉组)952.83±92.82b1 187.04±68.40b67%高乳糖-(羊乳粉组)1 229.55±113.74a1 632.45±106.65a
2.2.7 幼鼠血清SS含量对比
SS的分泌可以促进肠胃道血管收缩,降低局部炎症反应,促进营养吸收,从而改善胃肠道功能[21]。如图6所示,通过对每组摄入3 d与7 d后的SS含量对比,发现3组中,羊乳粉组中血清SS含量出现极显著增加(P<0.001),增加了74.53%;但牛乳粉组出现了相反变化,牛乳粉组中SS含量出现了极显著降低(P<0.001),降低了35.06%;67%高乳糖-模型组未出现显著性变化。有报道称,羊乳粉相比于牛乳粉,具有高消化率,可以抑制胃酸的分泌,保护胃肠黏膜,也更有利于胃溃疡的治疗,推测这些功能与羊乳组中SS显著增加有关。
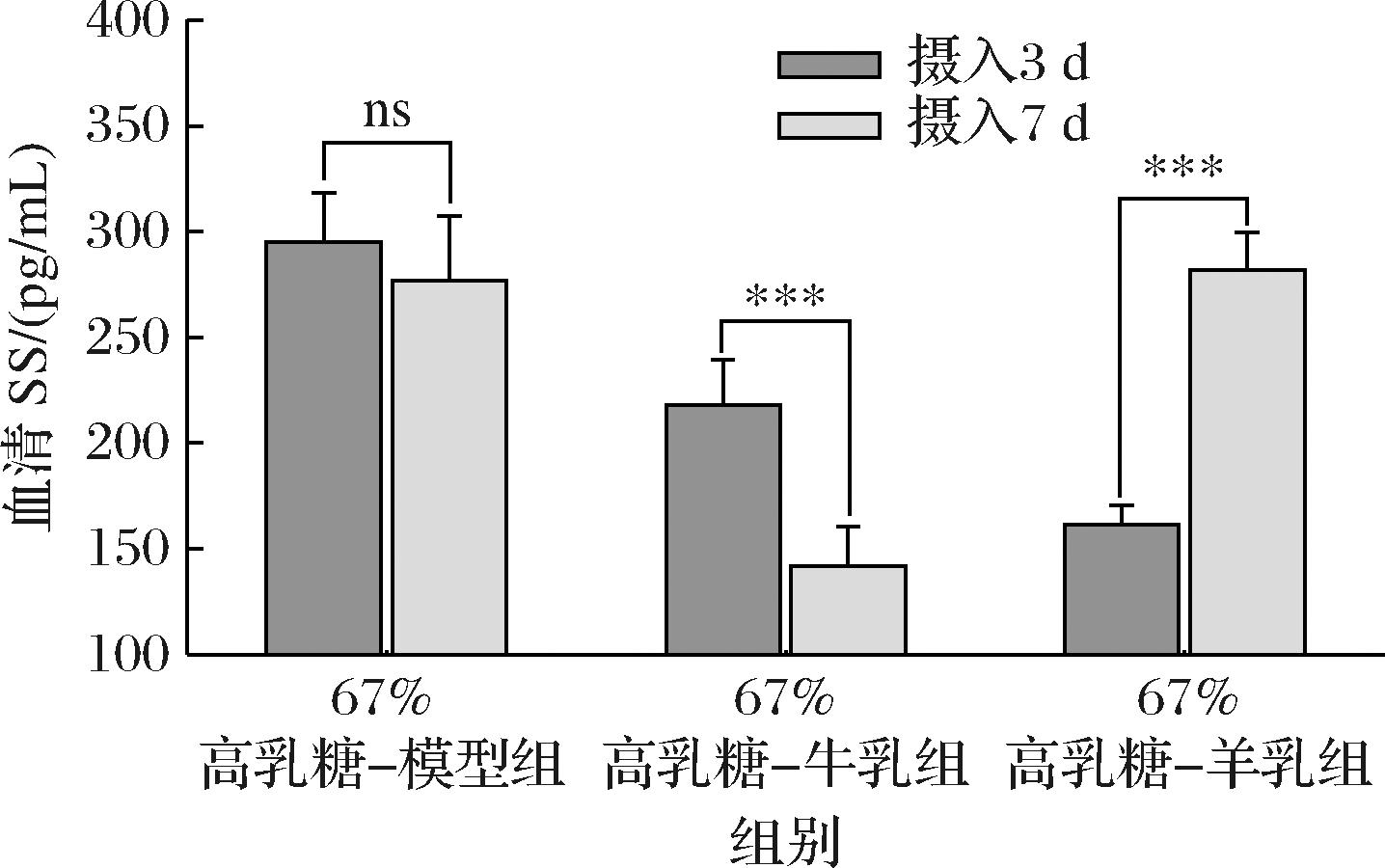
图6 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后幼鼠血清生长抑素含量自身对比
Fig.6 Comparison of somatostatin content in serum of rat pups after 3 days and 7 days after ingestion of 67% high-lactose diet containing cow and goat milk powder
随后对摄入3 d与7 d后的3组间SS含量对比。由表12可知,摄入3 d后,67%高乳糖-模型组的SS含量最高,其次是牛乳粉组,而羊乳粉组最低。而到了摄入7 d后,羊乳粉与67%高乳糖-模型组的含量较高,牛乳粉最低。这说明,长时间摄入羊乳粉,可以促进机体分泌SS,SS的提升可以减少胃酸对胃黏膜的腐蚀作用,从而增强黏膜的防御功能[22]。
表12 摄入含牛、羊乳粉的67%高乳糖饲料3 d与7 d后组间幼鼠血清生长抑素含量对比 单位:pg/mL
Table 12 Comparison of somatostatin content in serum of rat pups after 3 days and 7 days after intake of 67% high lactose diet containing cow and goat milk powder

组别摄入3 d后摄入7 d后67%高乳糖-模型组295.02±23.36a276.62±30.75a67%高乳糖-(牛乳粉组)218.22±21.16b141.71±18.87b67%高乳糖-(羊乳粉组)161.44±9.14c281.77±17.80a
2.2.8 血清乳糖酶活性与其他血清指标的相关性分析
将67%高乳糖-模型组、牛乳粉组和羊乳粉3组大鼠样本的血清乳糖酶活性值,分别与其DAO、MTL、SS指标值进行相关性分析,得到相关系数和显著性情况如图7所示。结果表明,血清乳糖酶活性与MTL和SS值均呈极显著正相关(P<0.001),与DAO值呈负相关,表明,对于乳糖不耐受大鼠来说,血清乳糖酶活性越高,血清中胃动素含量和生长抑制素含量越高,而DAO含量越低。
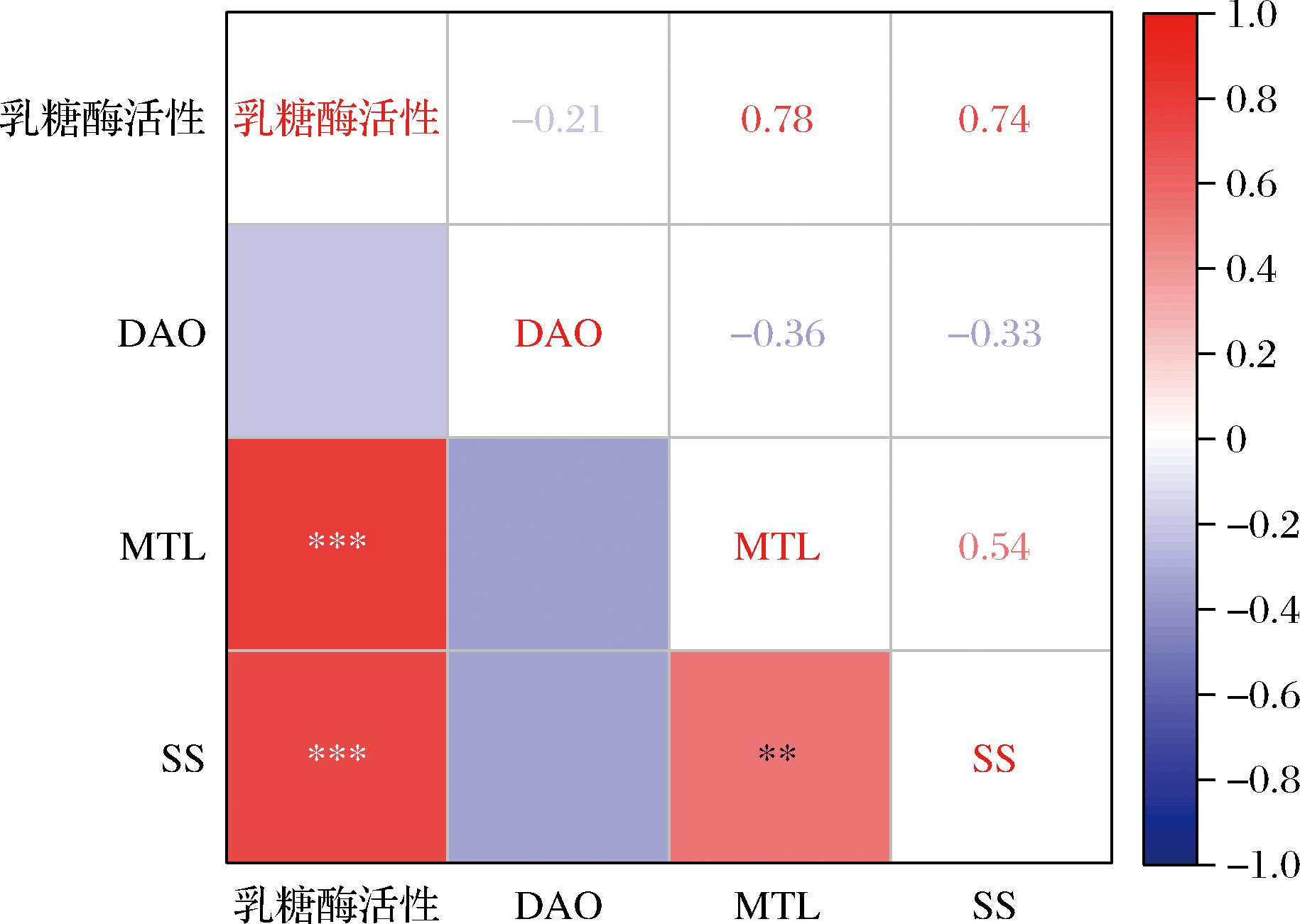
图7 三组大鼠中血清乳糖酶活性与血清MTL、SS、DAO含量的相关性分析
Fig.7 Correlation analysis of serum lactase activity with serum MTL, SS, and DAO levels in three groups of rats
2.2.9 幼鼠胃组织切片分析
有研究表明,乳糖不耐受会导致机体胃肠胀气,出现的长期腹泻会导致肠黏膜损伤[23]。由于各组中均有正常与异常的胃组织切片。因此,图8中分别给出了摄入含有牛、羊乳粉的67%高乳糖饲料7 d后幼鼠具有代表性的正常与异常的胃组织切片图。其中,图8-a是幼鼠正常的胃部结构,可见胃黏膜排列整齐,未见水肿及炎症细胞浸润;图8-b是幼鼠出现的胃黏膜下层水肿现象。经过统计,空白组5只幼鼠胃组织均正常,而67%高乳糖-模型组全部出现胃黏膜水肿,牛乳粉组出现2只,羊乳粉组出现1只。上述结果表明,高乳糖摄入会导致胃肠出现水肿、胀气现象,而羊乳粉对于胃肠胀气后产生的水肿现象具有一定缓解作用。
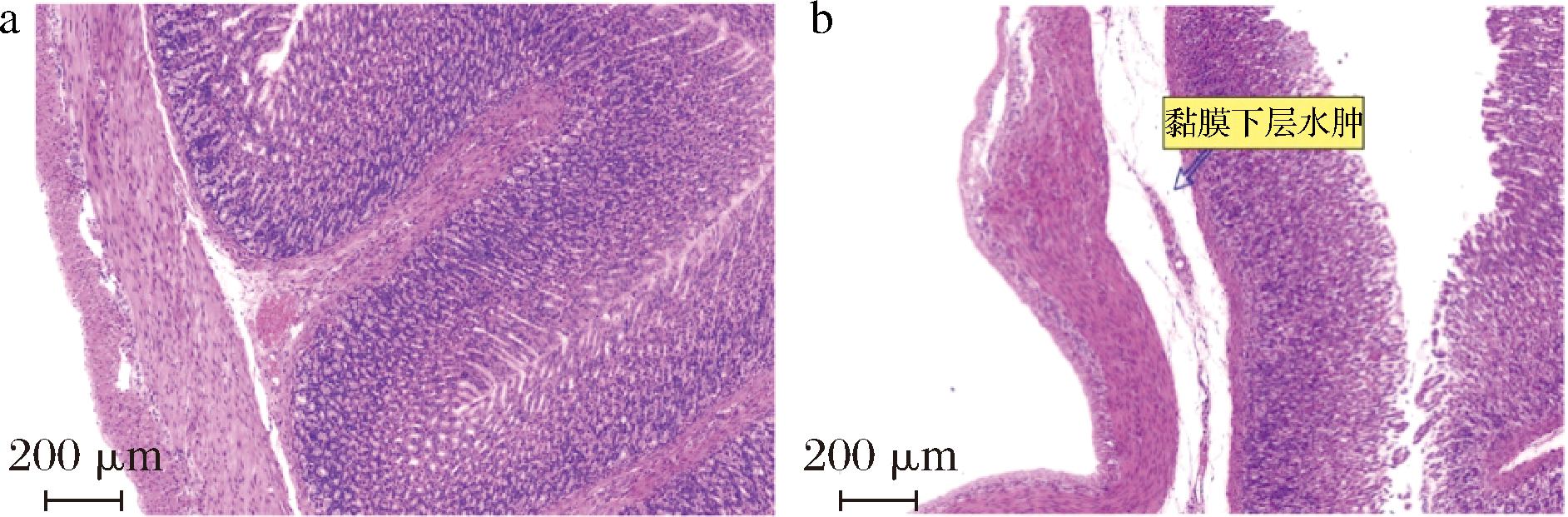
a-正常胃结构;b-胃固有层炎症细胞浸润
图8 幼鼠胃组织正常与出现胃黏膜下层水肿异常现象的切片HE染色图
Fig.8 HE staining of sections of normal gastric tissue of rat pups with abnormal appearance of edema in the submucosa of the stomach
2.2.10 幼鼠小肠组织切片分析
图9中分别给出了幼鼠代表性的正常与2种异常的小肠组织切片图。其中,图9-a是幼鼠正常的小肠结构,可见,其肠上皮组织结构完整,无水肿,绒毛呈指状样突起,绒毛较长无脱落且形态正常;图9-b是小肠异常状态时固有层内炎症细胞浸润现象;图9-c是小肠异常状态中肠黏膜固有层轻度水肿现象。
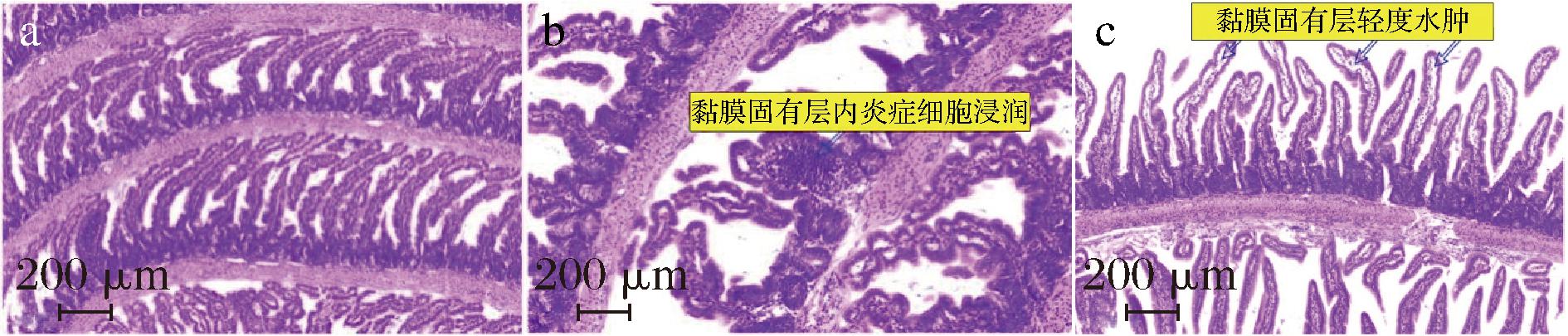
a-正常小肠结构;b-小肠固有层炎症细胞浸润;c-黏膜固有层水肿
图9 幼鼠小肠组织正常与异常现象的切片HE染色图
Fig.9 HE staining of sections of normal and abnormal phenomena of small intestinal tissues of rat pups
表13是具体各组中小肠组织切片病理统计结果,羊乳粉组依然最少,仅有1只出现炎症浸润和黏膜水肿。牛、羊乳粉均能减轻乳糖不耐受幼鼠的小肠炎症和水肿,但羊乳粉表现更佳。有研究表明,饲喂山羊奶可以缓解小鼠小肠的炎症反应,尤其能在小鼠肠道中富集到具有肠道屏障修复和糖脂代谢平衡改善功能的菌群,对维持小鼠体内糖脂代谢稳态发挥着重要作用[24]。
表13 摄入含牛、羊乳粉的67%高乳糖饲料7 d后组间幼鼠小肠组织切片病理统计结果对比
Table 13 Comparison of pathological statistical results of small intestine sections of rat pups between groups after 7 days of intake of 67% high-lactose diet containing cow and goat milk powder
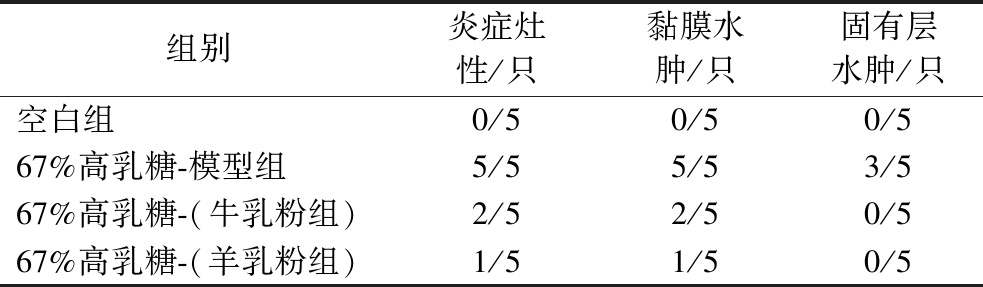
组别炎症灶性/只黏膜水肿/只固有层水肿/只空白组0/50/50/567%高乳糖-模型组5/55/53/567%高乳糖-(牛乳粉组)2/52/50/567%高乳糖-(羊乳粉组)1/51/50/5
3 结论与讨论
由于自然生长、疾病、膳食等多种因素的影响,国内外不同年龄阶段人群均会出现较高的乳糖不耐受发生率,特别是利用乳品作为主要食物来源的婴幼儿。因此,建立乳糖不耐受动物模型有利于评价和筛选适用于乳糖不耐受人群的食物来源。
本研究首先通过Wistar幼鼠定量摄入不同乳糖含量饲料,评价了3 d和7 d的日常表现、体重情况、腹泻程度、脏器指数、血清及空肠乳糖酶活性,对比摄入不同乳糖含量对Wistar幼鼠产生乳糖不耐受的影响,研究结果显示,7 d实验周期内,与其他乳糖含量摄入组相比,67%高乳糖-模型组血清乳糖酶活性上未出现显著增长,空肠乳糖酶活性显著降低,体重下降并持续性腹泻,这说明饲料中“67%乳糖含量”能抑制或降低乳糖酶活性,可以用于诱导产生乳糖不耐受。
为了进一步探讨牛羊乳粉对乳糖不耐受幼鼠产生的差异影响,在饲料中添加等量的牛、羊乳粉并使饲料中含有67%高乳糖,结果显示,相比于牛乳粉组,羊乳粉组表现出更佳的精神活动状态,幼鼠体重、器官质量和指数呈增长趋势,腹泻程度呈现下降趋势。更重要的是,羊乳粉在后期能极显著增加血清乳糖酶活性,推测可能的原因,是由于牛羊乳粉中的成分组成存在差异。从碳水化合物角度,羊乳中的低聚糖更接近母乳,且含有丰富ATP,可以促进乳糖的分解转化利用;从肠道微生物角度,摄入羊乳后,改善了鼠的肠道菌群丰度,肠道中乳酸菌、双歧杆菌、芽孢杆菌、大肠杆菌均能产生乳糖酶[25],有益菌的产生代偿了宿主中降低的乳糖酶活性;从生物活性成分角度,羊乳中富含环核苷酸,可诱导乳糖酶活性的增加,这样就会提高机体对乳糖的耐受性或适应性。近年来,羊乳的免疫特性也已被阐明,它能在体外人体系统中触发先天性和适应性免疫反应,诱导细胞因子产生,抑制内毒素诱导的单核细胞活化,会使人类肠道微生物群正常化,在肠道黏膜部位产生级联保护作用,触发肠道T调节细胞对肠黏膜的保护作用;就细胞因子释放而言,羊奶能够在ELISA试验中筛选的广谱细胞因子中诱导肿瘤坏死因子、IL-10等的释放,有助于维持宿主的免疫稳态并增强免疫力[26]。
此外,通过检测血清中DAO、MTL以及SS含量,发现羊乳粉组可以显著降低DAO含量并提高MTL和SS含量。从消化角度,MTL的主要生理功能是增加移行性复合运动,促进胃肠运动,同时会促进SS的释放[27]。进入机体的大量乳糖,会导致乳糖消化不良和pH的下降,MTL的提高可以加快胃肠蠕动,生长抑素的分泌可以提高胃肠pH值并增强黏膜防御功能,由于羊乳粉呈弱碱性,在胃肠消化及舒适性上会更加优异。从腹泻角度,乳糖不耐受所引起的渗透性腹泻,长时间会使肠黏膜屏障受损,DAO广泛存在于小肠绒毛,肠道受损会导致机体内DAO升高,通透性增强,短链脂肪酸(short chain fatty acids,SCFAs)、低聚糖均对肠道屏障完整性起关键作用[28-29],羊乳中的短链脂肪酸及低聚糖含量较牛乳高,因此,更有助于改善肠道屏障功能。进一步相关性分析表示,血清Lac活性与MTL和SS值均呈极显著正相关(P<0.001),与DAO值呈负相关。通过观察各组胃肠组织HE染色切片,发现羊乳粉组出现异常情况最少,这证明羊乳组幼鼠机体正在积极进行调节和修复。
综上所述,从乳糖酶活性、胃肠功能角度,长期摄入羊乳粉有望提高机体对乳糖的耐受性,逐渐缓解乳糖不耐受产生的症状,对于乳糖不耐受机体摄入乳源的选择具有积极的意义。
[1] FACIONI M S, RASPINI B, PIVARI F, et al.Nutritional management of lactose intolerance:The importance of diet and food labelling[J].Journal of Translational Medicine, 2020, 18(1):260.
[2] CATANZARO R, SCIUTO M, MAROTTA F.Lactose intolerance:an update on its pathogenesis, diagnosis, and treatment[J].Nutrition Research, 2021, 89:23-34.
[3] 向雪松, 韩军花.乳糖不耐受与科学饮奶专家共识[J].卫生研究, 2024, 53(5):689-693.
XIANG X S, HAN J H.Lactose intolerance and expert consensus on scientific milk drinking[J].Journal of Hygiene Research, 2024, 53(5):689-693.
[4] 郝淑苹, 李静, 李静芸, 等.羊乳粉与牛乳粉引起乳糖不耐反应的比较[J].中国全科医学, 2019, 22(4):438-441;446.
HAO S P, LI J, LI J Y, et al.Comparative analysis of lactose intolerance caused by drinking goat and cow milk powder solutions[J].Chinese General Practice, 2019, 22(4):438-441;446.
[5] BAHBAH W A, ELHODHOD M, SALAH M, et al.A survey to identify the current management of cow’s milk disorders and the role of goat milk-based formulas in the middle east and north Africa Region[J].Nutrients, 2022, 14(5):1067.
[6] ALEXANDRE V, EVEN P C, LARUE-ACHAGIOTIS C, et al.Lactose malabsorption and colonic fermentations alter host metabolism in rats[J].British Journal of Nutrition, 2013, 110(4):625-631.
[7] LIUZZI J P, CIOCCIA A M, HEVIA P.In well-fed young rats, lactose-induced chronic diarrhea reduces the apparent absorption of vitamins A and E and affects preferentially vitamin E status[J].The Journal of Nutrition, 1998, 128(12):2467-2472.
[8] CAIN G D, MOORE P Jr, PATTERSON M, et al.The stimulation of lactase by feeding lactose[J].Scandinavian Journal of Gastroenterology, 1969, 4(6):545-550.
[9] 薛红, 王凤云, 张敏, 等.脾虚证高乳糖腹泻模型建立和评价[J].中国中西医结合杂志, 2020, 40(10):1220-1224.
XUE H, WANG F Y, ZHANG M, et al.Establishment and evaluation of high-lactose diarrhea model with pi deficiency syndrome[J].Chinese Journal of Integrated Traditional and Western Medicine, 2020, 40(10):1220-1224.
[10] TEICHENNÉ J, CATAL N
N  , MARINÉ-CASAD
, MARINÉ-CASAD R, et al.Bacillus coagulans GBI-30, 6086 (BC30) improves lactose digestion in rats exposed to a high-lactose meal[J].European Journal of Nutrition, 2023, 62(6):2649-2659.
R, et al.Bacillus coagulans GBI-30, 6086 (BC30) improves lactose digestion in rats exposed to a high-lactose meal[J].European Journal of Nutrition, 2023, 62(6):2649-2659.
[11] 卡丽比奴尔·艾尔肯, 徐志伟, 马建宝, 等.低乳糖发酵马乳的制备工艺研究及其对乳糖不耐受模型小鼠的影响[J].中国食品添加剂, 2024, 35(6):50-60.
KALIBINUER Aierken, XU Z W, MA J B, et al.Optimization of preparation process of low-lactose fermented mare’s milk and its effect on lactose intolerance model mice[J].China Food Additives, 2024, 35(6):50-60.
[12] 卢梦雄, 黄金科, 王一帆, 等.高乳糖饮食叠加水平台法脾虚证模型研究与评价[J].世界中医药, 2022, 17(21):3033-3038.
LU M X, HUANG J K, WANG Y F, et al.Study and evaluation on spleen deficiency model induced by high lactose diet and water platform method[J].World Chinese Medicine, 2022, 17(21):3033-3038.
[13] 王翼天, 陈婷, 薛红, 等.乳糖不耐受肝郁脾虚证模型的建立和评价[J].中国中西医结合消化杂志, 2022, 30(6):394-401.
WANG Y T, CHEN T, XUE H, et al.Establishment and evaluation of lactose intolerance model with liver depression and spleen deficiency syndrome[J].Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2022, 30(6):394-401.
[14] 黄小明, 曾莉, 许航, 等.不同量乳糖摄入对成年BALB/c小鼠小肠乳糖酶活性的影响[J].现代预防医学, 2008, 35(16):3071-3072.
HUANG X M, ZENG L, XU H, et al.Effect of different dosage of lactose intakes on lactase activity in small intestine of adult BALB/c mice[J].Modern Preventive Medicine, 2008, 35(16):3071-3072.
[15] 张梦媚. 继发性乳糖不耐受婴儿的肠道菌群及乳糖酵解代谢研究[D].苏州:苏州大学, 2022.
ZHANG M M.Study on intestinal flora and lactose glycolysis metabolism of infants with secondary lactose intolerance[D].Suzhou:Soochow University, 2022.
[16] 马杰, 唐小懿, 陈清华, 等.乳糖酶及其在动物体内活性变化的影响因素研究进展[J].饲料工业, 2017, 38(8):15-17.
MA J, TANG X Y, CHEN Q H, et al.Advances in research on lactase and its influencing factors in animal[J].Feed Industry, 2017, 38(8):15-17.
[17] 吴桐, 杨鹏飞, 聂晶, 等.山羊乳调制乳粉对营养不良大鼠生长发育的影响[C].中国营养学会第十五届全国营养科学大会论文汇编.北京:中国营养学会, 2022:740.
WU T, YANG P F, NIE J, et al.Effects of goat milk powder on growth and development of malnourished rats[C].Compilation of papers of the 15th National Nutrition Science Conference of Chinese Nutrition Society.Beijing:Chinese Society of Nutrition, 2022:740.
[18] 王秋晓, 吴容, 张智彬, 等.甘草泻心汤联合美沙拉秦缓释颗粒对急性期溃疡性结肠炎大鼠肠黏膜屏障的作用研究[J].中国现代医学杂志, 2023, 33(13):46-52.
WANG Q X, WU R, ZHANG Z B, et al.Experimental research of Gancao Xiexin decoction combined with Mesalachin slow-release granules on intestinal mucosal barrier of ulcerative colitis rats in acute phase[J].China Journal of Modern Medicine, 2023, 33(13):46-52.
[19] PROSSER C, STELWAGEN K, CUMMINS R, et al.Reduction in heat-induced gastrointestinal hyperpermeability in rats by bovine colostrum and goat milk powders[J].Journal of Applied Physiology, 2004, 96(2):650-654.
[20] 卞理, 窦志华.大黄水提物对食积症模型小鼠胃肠运动及血清胃动素、胃泌素水平的影响[J].甘肃中医药大学学报, 2018, 35(5):20-23.
BIAN L, DOU Z H.Effect of aqueous extract from Dahuang(Rhei Radix et Rhizoma) on gastrointestinal movement, serum motilin and gastrin levels of dyspepsia mice model[J].Journal of Gansu University of Chinese Medicine, 2018, 35(5):20-23.
[21] 王静喆, 刘红秀, 卢晓霞.雷贝拉唑联合生长抑素对功能性消化不良患者胃动力及血清PG、G-17水平的影响[J].吉林医学, 2023, 44(8):2300-2302.
WANG J Z, LIU H X, LU X X.Effects of rabeprazole combined with somatostatin on gastric motility and serum PG and G-17 levels in patients with functional dyspepsia[J].Jilin Medical Journal, 2023, 44(8):2300-2302.
[22] 陈新贵, 许勋良, 段礼兴, 等.生长抑素及凝血酶在上消化道溃疡出血治疗中的应用及安全性分析[J].中国普通外科杂志, 2016, 25(2):307-310.
CHEN X G, XU X L, DUAN L X, et al.Application and safety analysis of somatostatin and thrombin in the treatment of upper gastrointestinal ulcer bleeding[J].China Journal of General Surgery, 2016, 25(2):307-310.
[23] 刘舒, 高媛, 肖露, 等.两种慢性渗透性腹泻大鼠模型建立方法的比较[J].中国病理生理杂志, 2016, 32(8):1484-1491.
LIU S, GAO Y, XIAO L, et al.Comparison of 2 methods for establishing rat model of chronic osmotic diarrhea[J].Chinese Journal of Pathophysiology, 2016, 32(8):1484-1491.
[24] 陈筱影. 山羊奶对2型糖尿病小鼠糖脂代谢的调控作用研究[D].杨凌:西北农林科技大学, 2023.
CHEN X Y.Regulation of goat milk on glycolipid metabolism in type 2 diabetic mice[D].Yangling:Northwest Agriculture and Forestry University, 2023.
[25] BUTTS C A, PATURI G, HEDDERLEY D I, et al.Goat and cow milk differ in altering microbiota composition and fermentation products in rats with gut dysbiosis induced by amoxicillin[J].Food &Function, 2021, 12(7):3104-3119.
[26] JIRILLO F, MAGRONE T.Anti-inflammatory and anti-allergic properties of donkey’s and goat’s milk[J].Endocrine, Metabolic &Immune Disorders Drug Targets, 2014, 14(1):27-37.
[27] 谭康联, 陈志强.胃动素用于胃肠功能评价的研究进展[J].世界华人消化杂志, 2011, 19(2):156-160.
TAN K L, CHEN Z Q.Motilin levels and evaluation of gastrointestinal function[J].World Chinese Journal of Digestology, 2011, 19(2):156-160.
[28] CHEN Q X, YANG L, XIANG F Q, et al.2′-Fucosyllactose modulates the function of intestinal microbiota to reduce intestinal permeability in mice colonized by feces from healthy infants[J].Food Science and Human Wellness, 2025, 14(1):9250021.
[29] HAYS K E, PFAFFINGER J M, RYZNAR R.The interplay between gut microbiota, short-chain fatty acids, and implications for host health and disease[J].Gut Microbes, 2024, 16(1):2393270.