肠道黏膜构成了一个关键的屏障,在机体健康和疾病中起着重要作用[1]。这一层屏障由肠道上皮细胞、内层免疫、外黏液层及肠道菌群组成。肠道屏障具有重要的生理作用,作为半透性屏障,允许营养物质吸收和免疫调节,同时限制潜在有害物质和肠道菌群与机体细胞接触[2]。研究报道,肠道屏障缺陷与多种疾病有关,包括胃肠道疾病(如炎症性肠病、结肠癌)和肠外疾病(如慢性肝病、糖尿病、肥胖)[3-4]。目前,调节肠道屏障已经成为许多疾病调控的靶点。因此,开发具有屏障调节作用的功能成分具有重要意义。
低聚半乳糖(galactooligosaccharides,GOS)是由3~10个半乳糖和葡萄糖分子通过 β-半乳糖苷酶介导的转半乳糖基化反应形成的低聚糖[5]。GOS是一种典型的益生元,常被添加在婴儿配方粉中。已有研究报道了GOS调节菌群、改善免疫及增强肠道屏障的功能[5]。两歧双歧杆菌(Bifidobacterium bifidum)是一种常见的益生菌,也是婴儿时期肠道内主要的菌群之一。机体内B. bifidum能够利用膳食摄入的低聚糖,将其分解为有益代谢物,并促进自身生长。而研究也发现,外源补充B. bifidum能够调节宿主健康[6]。近期,有研究提出将双歧杆菌与益生元协同使用,这可能会放大两者单独使用的价值。BUTTON等[7]发现母乳低聚糖能够促进双歧杆菌在成人体内可逆性定植。研究人员还发现同时灌胃母乳低聚糖与双歧杆菌改善了抗生素使用引起的肠道菌群失调,这一作用与产生的短链脂肪酸有关[8]。总之,低聚糖与双歧杆菌具有协同增效的作用。然而,目前关于GOS与B. bifidum对肠道屏障功能协同作用的影响研究较少。
本研究使用脂多糖(lipopolysaccharide,LPS)构建了肠道屏障损伤小鼠模型,灌胃基于GOS与B. bifidum的合生制剂,分析了小鼠肠道通透性的变化,评估了合生制剂对小鼠机械屏障、免疫屏障、化学屏障及生物屏障的作用。同时,分析了肠道内短链脂肪酸产生的变化。最后,验证了短链脂肪酸与屏障改善的关系。
1 材料与方法
1.1 材料与仪器
LPS、异硫氰酸荧光素,美国Sigma公司;TNF-α、IL-6、IL-1β酶联免疫吸附试剂盒,南京建成生物工程研究所;RNA反转录试剂盒,天根生化科技有限公司;实时荧光定量 PCR扩增试剂盒,北京普洛麦格生物技术有限公司。GOS,上海麦克林生化科技股份有限公司。
雌性BALB/c小鼠36只,体重(17.0±21.0) g,购自北京维通利华有限公司,质量许可证号:SCXK 2021-0006,所有程序严格遵守中华人民共和国法律和伦理标准,并由哈尔滨维科生物技术有限公司实验动物管理及伦理委员会批准,批准号为 JL-SD-0191-202417。
B. bifidum购自中国工业微生物菌种保藏管理中心,菌株编号为CICC®10395。人体结肠癌细胞系Caco-2细胞株和巨噬细胞RAW264.7细胞株购买于中国科学院典型培养物保藏委员会细胞库。
1.2 实验方法
1.2.1 菌株培养
从-80 ℃冰箱取出保藏的菌株,以2%接种量接种于L-MRS培养基中,于37 ℃恒温厌氧培养,活化3代。将已活化的菌株接种于L-MRS培养基中,在37 ℃恒温培养箱培养18 h后,以3 000×g离心10 min,去掉上清液,加入生理盐水洗涤2次并重悬,调整菌液浓度为5×109 CFU/mL。
1.2.2 动物分组、造模及给药
将小鼠随机分为正常对照组(NC组)、模型组(MC组)和GOS+B.bifidum CICC®10395组,每组12只小鼠,每3只饲养在一笼中。根据先前的研究[9-10],GOS灌胃剂量设定为0.5 g/kg·BW,B.bifidum CICC®10395灌胃剂量设定为0.2 mL 菌悬液(5×109 CFU/mL),其中GOS在灌胃前溶解在菌悬液中。GOS+B.bifidum CICC®10395组每日灌胃1次,持续21 d,NC组和MC组灌胃0.2 mL生理盐水。在第21天,MC组和GOS+ B.bifidum CICC®10395组腹腔注射10 mg/kg·BW的LPS。注射LPS 3 h后,采集小鼠血液、肠道组织和肠道内容物。
1.2.3 肠道通透性检测
在第21天,各组随机取3只小鼠,禁食2 h后,以0.6 g/kg·BW的异硫氰酸荧光素标记的葡聚糖分子(fluorescrin isothiocyanate-conjugated dextran,FITC-dextean)灌胃小鼠,1 h后取小鼠眼球血,并离心为血清,用荧光分光光度计测定血清中的荧光,激发波长为485 nm,发射波长为535 nm。血清中FITC-dextean 浓度越高代表肠道通透性越高。
1.2.4 促炎细胞因子及髓过氧化物酶(myeloperoxidase, MPO)活性测定
使用TNF-α、IL-1β和IL-6酶联免疫吸附试剂盒检测促炎细胞因子水平。结肠组织MPO的活性采用MPO生化试剂盒测定。
1.2.5 血清D-乳酸和二胺氧化酶(diamine oxidase,DAO)测定
血清中D-乳酸和DAO含量是肠道通透性的2个标识物,采用酶联免疫吸附试剂盒检测小鼠血清中D-乳酸和DAO含量。
1.2.6 RT-qPCR检测肠道紧密连接蛋白
采用RNA提取试剂盒,从小鼠结肠组织中提取RNA,使用反转录试剂盒将RNA反转录为cDNA,根据表1 中引物进行PCR扩展,采用 2-ΔΔCT法分析ZO-1、ZO-2和Claudin-1基因的相对表达量。
表1 RT-qPCR引物设计
Table 1 RT-qPCR primer design
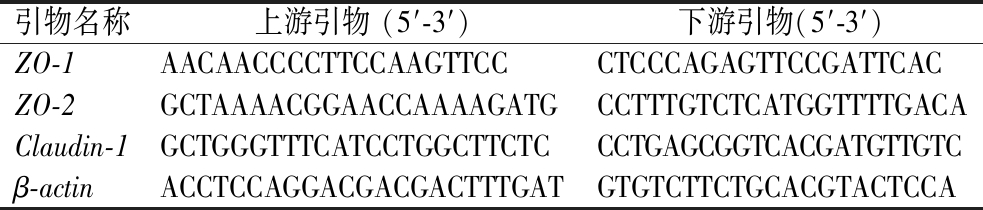
引物名称上游引物 (5′-3′)下游引物(5′-3′)ZO-1AACAACCCCTTCCAAGTTCCCTCCCAGAGTTCCGATTCACZO-2GCTAAAACGGAACCAAAAGATGCCTTTGTCTCATGGTTTTGACAClaudin-1GCTGGGTTTCATCCTGGCTTCTCCCTGAGCGGTCACGATGTTGTCβ-actinACCTCCAGGACGACGACTTTGATGTGTCTTCTGCACGTACTCCA
1.2.7 RT-qPCR检测结肠黏蛋白基因表达水平
采用1.2.6节相同的程序进行PCR反应,MUC2、MUC1、MUC4、MUC13和MUC17的引物如表2所示。
表2 RT-qPCR引物设计
Table 2 RT-qPCR primer design

引物名称上游引物 (5′-3′)下游引物(5′-3′)MUC1GACATCTTTCCAACCCAGGACAAAGAGAGACTGCTACTGCCATTACMUC2ATGCCCACCTCCTCAAAGACGTAGTTTCCGTTGGAACAGTGAAMUC4CTGTGTCTGAGCTGCCTGTATTGGGTGTCTGTGTTGATGTTGTTGMUC13CCCTCATCCTCATCTTGCTGATTCTCTGCTCTTCTCCATCCTTCTTTMUC17CCGACACATTGCTGCTGAGAATGCTGTCGTCTTGGGTGCTATTTRPL19GAAGGTCAAAGGGAATGTGTTCACCTGTTGCTCACTTGT
1.2.8 免疫荧光与原位杂交
使用原位杂交固定液将结肠组织固定,经过石蜡包埋后切成4 μm的切片。采用MUC2抗孵育过夜,清洗后加入对应的荧光素标记的二抗,再次孵育后,加入4′,6-二脒基-2-苯基吲哚染液(4′,6-diamidino-2-phenylindole,DAPI)并孵育,使用正置荧光显微镜观察并采集图像。
向石蜡切片中滴加预杂交液,于40 ℃孵育1 h。随后,使用合成的双歧杆菌特异性荧光探针进行杂交,恒温过夜,双歧杆菌特异性引物为探针序列(5′-3′:CATCCGGCATTACCACCC)。洗去杂交液后,使用入DAPI复染,使用正置荧光显微镜观察并采集图像。
1.2.9 短链脂肪酸检测
参照文献[11]的方法,使用配备了 Agilent DB-FA TWAX(UI)毛细管柱(30 m×0.25 mm×0.25 μm)和火焰离子化检测器的 Fuli 9720气相色谱仪测定肠道内容物中短链脂肪酸含量。
1.2.10 跨膜电阻值(transepithelial electrical resistance,TEER)测定
在含有完全培养基的培养板上接种0.1 mL浓度为1.0×105 cells/mL的Caco-2细胞,并在乙酸组中预先加入适量的乙酸。向培养板中加入LPS(100 μg/mL),24 h后测定TEER。
1.2.11 细胞单层通透性检测
LPS诱导细胞屏障损伤模型如1.2.10节所述, 乙酸干预的Caco-2细胞培养在transwell小室上层,随后加入浓度为1 mg/mL的FITC-dextean,培养2 h后,收集基底侧的液体,用荧光分光光度计测定血清中的荧光,激发波长为485 nm,发射波长为535 nm。
1.2.12 紧密连接蛋白检测
采用1.2.6节所述的方法检测细胞中ZO-1、ZO-2和Claudin-1基因的相对表达量。
1.2.13 乙酸干预巨噬细胞RAW264.7促炎因子分泌的研究
将对数生长期的细胞培养在6孔板中,细胞贴壁后加入乙酸,培养1 h后,用1 μg/mL的LPS刺激细胞后,培养24 h,随后采用酶联免疫吸附试剂盒检测细胞中TNF-α、IL-1β和IL-6含量。
1.3 数据分析
所有实验重复3次,数据以“平均值±标准差”表示。使用 SPSS 22软件的配对样本方差t检验进行显著性统计。*代表P<0.05,**代表P<0.01,***代表P<0.001,ns代表P>0.05。Pearson相关性分析采用Origin 2021中内嵌软件进行,P<0.05表示具有显著性。其余图使用GraphPad Prism 8.0进行。
2 结果与分析
2.1 基于GOS和B. bifidum的合生制剂降低肠道通透性
FITC-dextean法是体内衡量肠道通透性常用的手段[12]。由图1-a可知,MC组小鼠血液中FITC-dextean浓度显著升高(P<0.001),灌胃GOS+B.bifidum CICC®10395后,FITC浓度降低了31.15%。D-乳酸是肠道细菌代谢的产物,DAO是肠道内细胞分泌的降解二胺的酶,当肠道屏障受损时,它们会大量跨过肠道屏障进入血液[13-14]。因此,血清D-乳酸和DAO也是肠道屏障功能的指示物。与NC组相比,MC组小鼠血清D-乳酸和DAO含量显著升高(P≤0.002),而GOS+ B.bifidum CICC®10395干预则显著降低了血清中D-乳酸和DAO含量(P≤0.006)。
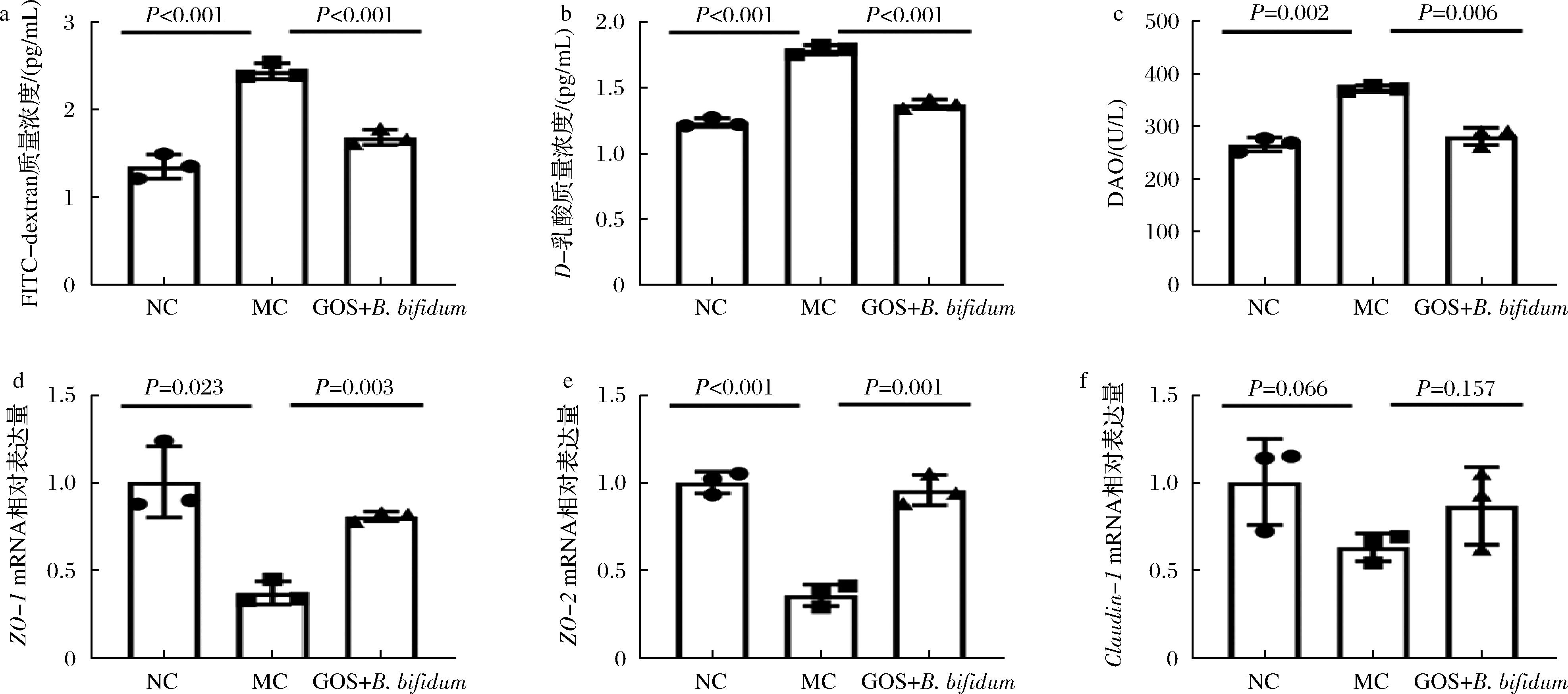
a-血清FITC-dextean浓度;b-血清D-乳酸浓度;c-血清DAO浓度;d-ZO-1 mRNA相对表达量;e-ZO-2 mRNA相对表达量;f-Claudin-1 mRNA相对表达量
图1 GOS协同B. bifidum改善肠道通透性
Fig.1 GOS synergizes with B.bifidum to improve intestinal permeability
由图1-d和图1-e可以,与NC组相比,LPS诱导的肠道屏障损伤模型小鼠的紧密连接蛋白表达显著降低(P≤0.023),包括ZO-1和ZO-2。GOS+B.bifidum CICC®10395处理后,小鼠肠道ZO-1和ZO-2表达水平分别增加了1.19倍和1.67倍。然而,Claudin-1的表达水平在3组之间没有显著差异(P>0.05)。由此可见,GOS协同两歧双歧杆菌能够增加肠道机械屏障,降低肠道通透性。
2.2 基于GOS和B. bifidum的合生制剂改善肠道免疫
由图2-a~图2-c可知,与NC组相比,MC组小鼠肠道TNF-α、IL-1β和IL-6含量显著升高(P≤0.001)。GOS+ B.bifidum CICC®10395处理后,TNF-α、IL-1β和IL-6含量分别降低了49.07%、54.18%和38.36%。MPO是中性粒细胞活化的标志物,其水平和活性代表着中性粒细胞的功能和状态。当机体处于炎症时,则会导致氧化应激和氧化性的组织损伤[15]。与NC组相比,MC组MPO活性显著升高(P=0.001),GOS+B.bifidum CICC®10395处理后,MPO活性降低了34.69%(图2-d)。以上结果表明,GOS+B.bifidum CICC®10395降低了LPS诱导的肠道炎症及进一步肠道损伤。
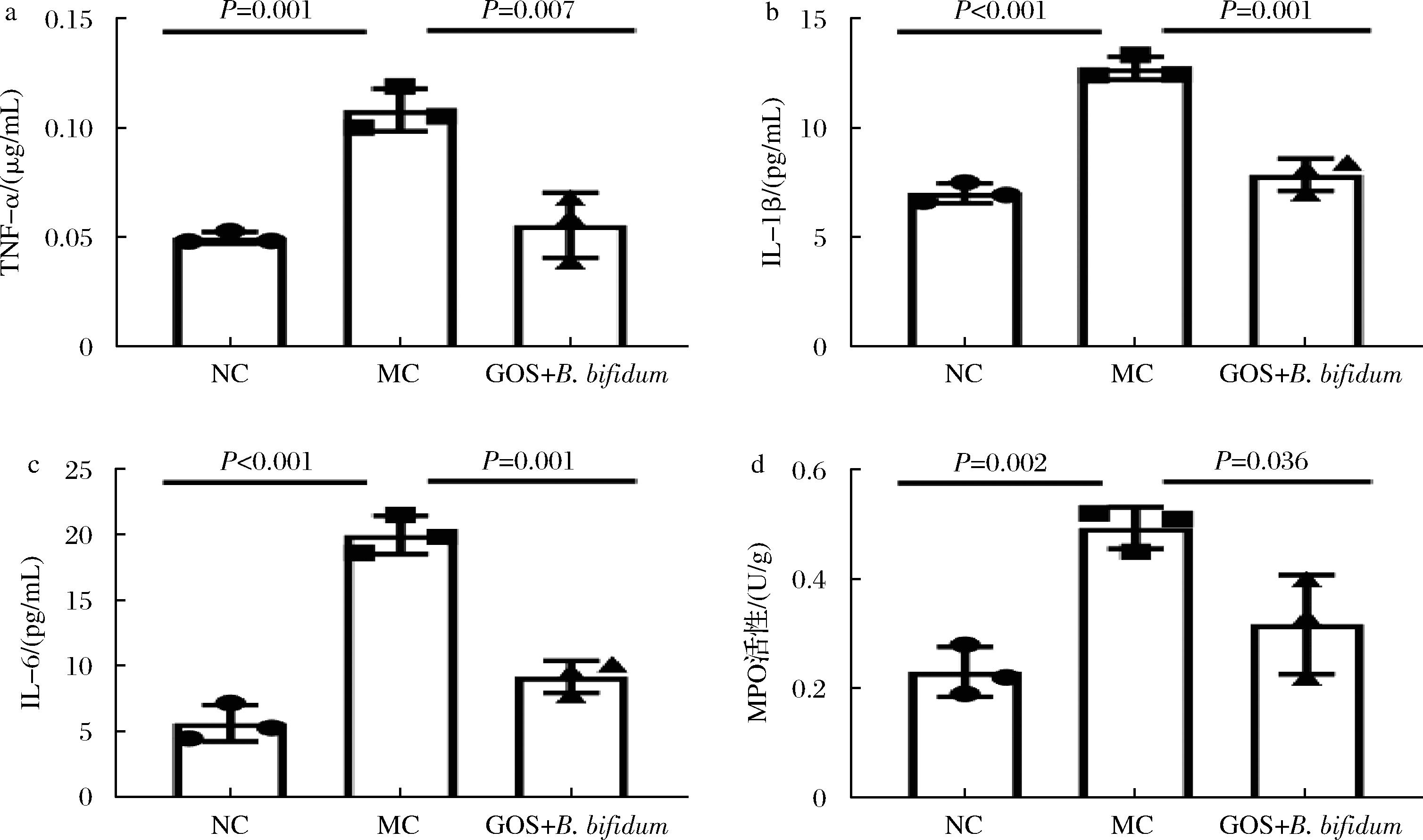
a-TNF-α含量;b-IL-1β含量;c-IL-6含量;d-MPO活性
图2 GOS协同B. bifidum改善肠道免疫
Fig.2 GOS synergizes with B.bifidum to improve intestinal immunity
2.3 基于GOS和B. bifidum的合生制剂改善肠道化学屏障
肠道化学屏障是由肠上皮细胞所分泌的黏液组成,连续分布于肠黏膜表面。黏液的主要成分是黏蛋白,包括分泌型黏蛋白和结合型黏蛋白。MUC2是分泌型黏蛋白,也是肠道内含量最丰富的黏蛋白。由图3-a可知,与NC组相比,MC组MUC2表达量显著降低(P=0.016),灌胃GOS+B.bifidum CICC®10395后,MUC2表达量升高了8.1倍。MUC1、MUC4、MUC13和MUC17是常见的结合型黏蛋白,其中MUC1、MUC4和MUC17表达量在MC组中显著低于NC组(P≤0.020)。与MC组相比,GOS+B.bifidum CICC®10395处理使MUC1、MUC4和MUC17表达量分别增加1.55~3.39倍。然而,MUC13的表达水平在3组之间没有显著差异(P>0.05)。以上结果表明,GOS+B.bifidum CICC®10395能够促进肠道黏蛋白分泌,来增强肠道化学屏障功能。
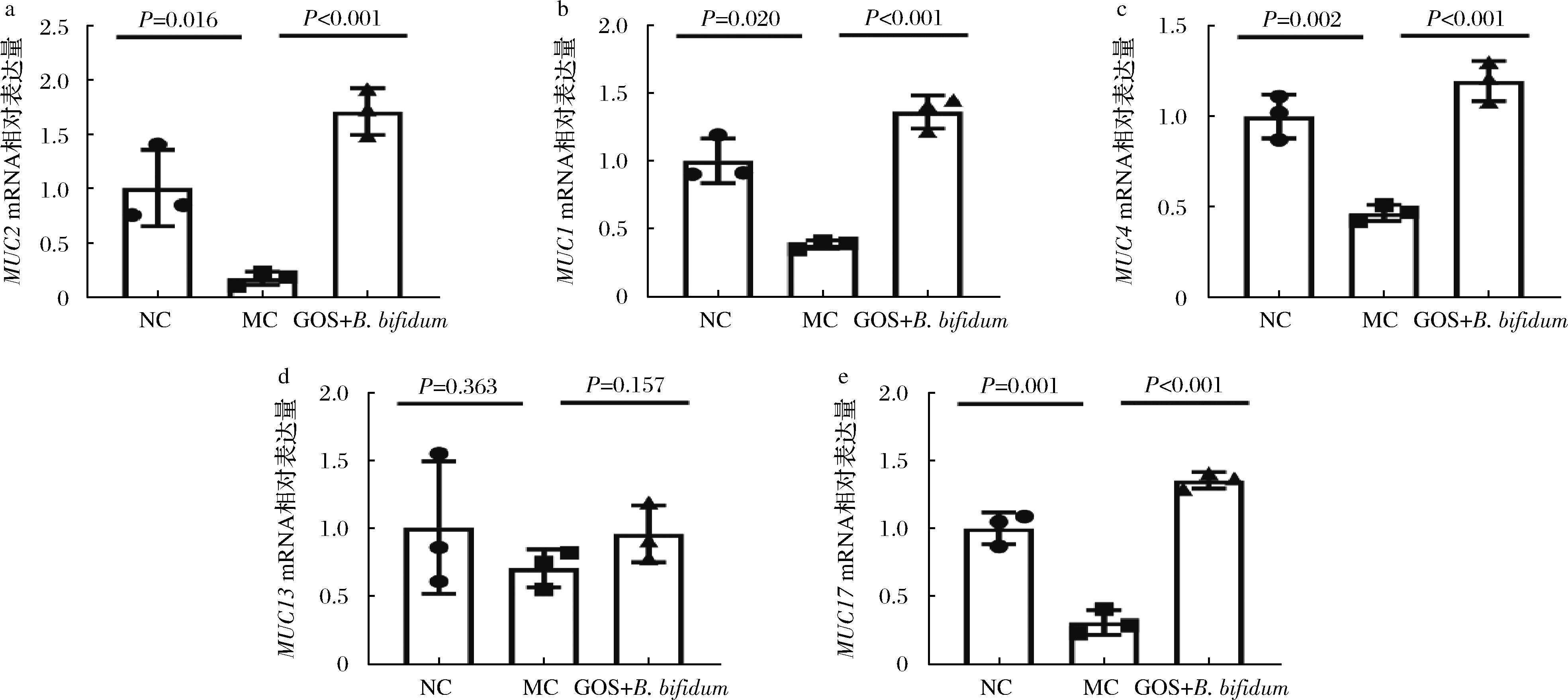
a-MUC2 mRNA相对表达量;b-MUC1 mRNA相对表达量;c-MUC4 mRNA相对表达量;d-MUC13 mRNA相对表达量;e-MUC17 mRNA相对表达量
图3 GOS协同B. bifidum改善肠道化学屏障
Fig.3 GOS synergizes with B.bifidum to improve the intestinal chemical barrier
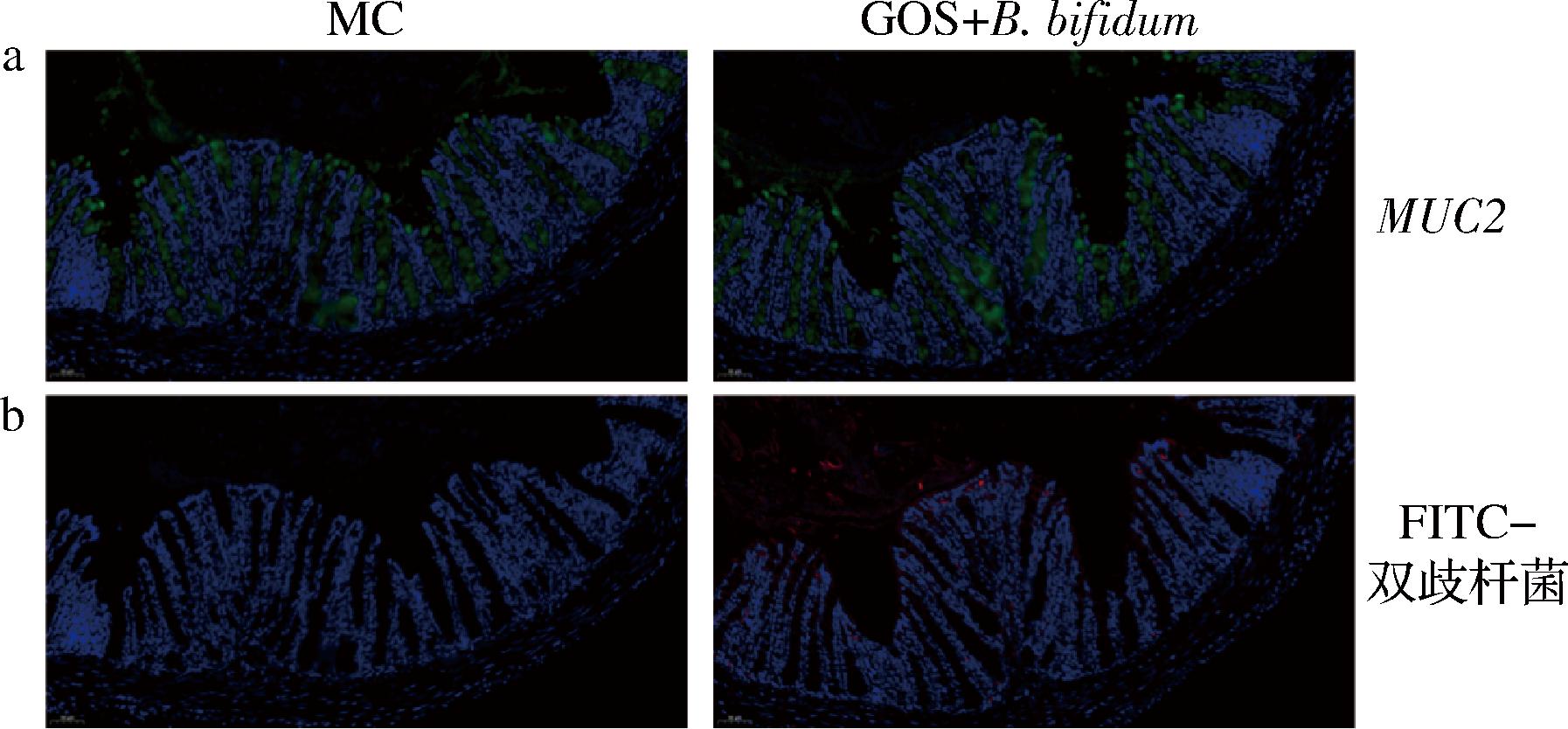
a-MUC2荧光表达量(绿色);b-双歧杆菌荧光表达量(红色)
图4 GOS促进双歧杆菌定植障
Fig.4 GOS promotes Bifidobacterium colonization
2.4 基于GOS和B. bifidum的合生制剂促进双歧杆菌在肠道定植
与2.3节结果相一致,免疫荧光显示,与MC组相比,灌胃GOS+B.bifidum CICC®10395的小鼠肠道MUC2荧光强度更大(图4-a)。本研究设计了双歧杆菌探针,它在免疫荧光中呈红色。由图4-b可知,MC组小鼠肠道无红色荧光,而在GOS+ B.bifidum CICC®10395组小鼠肠道内观察到红色荧光。这些荧光主要分布在肠腔内,紧邻着肠道上皮细胞(肠道上皮细胞由DAPI成像为蓝色)的位置。因此,GOS能够促进外源的B.bifidum在肠道内定植,进而发挥益处。
2.5 基于GOS和B. bifidum的合生制剂促进肠道乙酸产生
短链脂肪酸是肠道菌群代谢膳食纤维产生的一类有益代谢产物。由图5-a可知,小鼠肠道主要由乙酸、丙酸和丁酸组成,占总短链脂肪酸的92%~95%。此外,还包含一些微量短链脂肪酸,如异丁酸、戊酸和异戊酸。NC组和GOS+B.bifidum CICC®10395组小鼠短链脂肪酸总量高于MC组。这一差异主要来自于乙酸的差异,与NC组相比,MC组乙酸含量显著降低(P=0.001)。GOS+B.bifidum CICC®10395灌胃后,乙酸含量升高了62.43%,平均水平达到了NC组的82.41%(图5-b)。将乙酸、丙酸和丁酸的含量与肠道屏障指标进行相关性分析,如图5-c所示。乙酸与ZO-1、ZO-2、MUC2、MUC1、MUC4、MUC13和MUC17呈显著正相关(P<0.05),而与TNF-α、IL-1β、IL-6、MPO、FITC-dextean、D-乳酸和DAO呈显著负相关(P<0.05)。丙酸与FITC-dextean含量呈显著负相关(P<0.05),与其他指标无显著相关性(P>0.05)。丁酸与所有指标均无显著相关性(P>0.05)。以上结果表明,基于GOS和B. bifidum的合生制剂促进了肠道内乙酸的产生,可能是改善肠道屏障的机制。
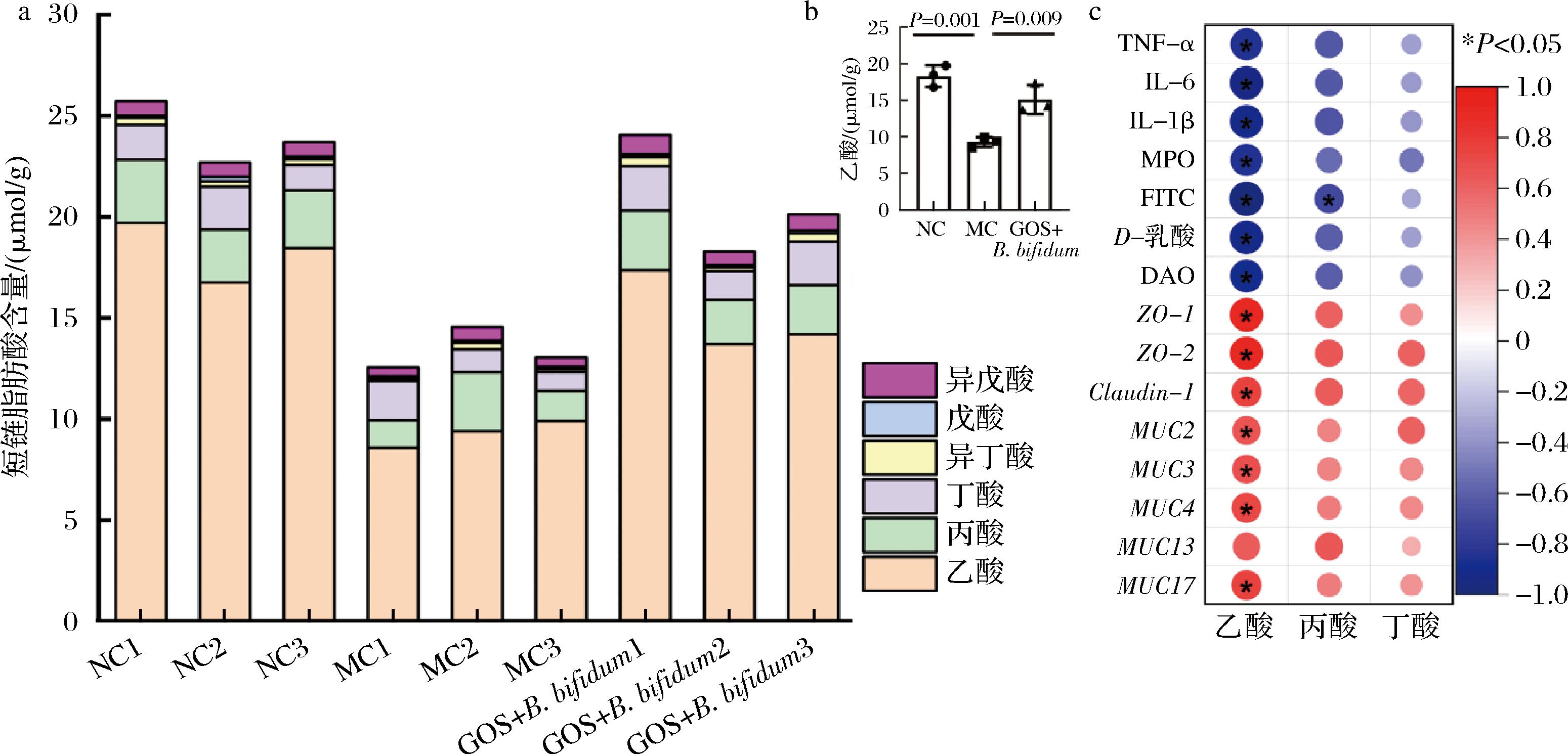
a-短链脂肪酸组成堆积柱状图;b-乙酸浓度;c-相关性分析
图5 GOS协同B. bifidum促进乙酸产生
Fig.5 GOS synergizes with B.bifidum to promote acetic acid production
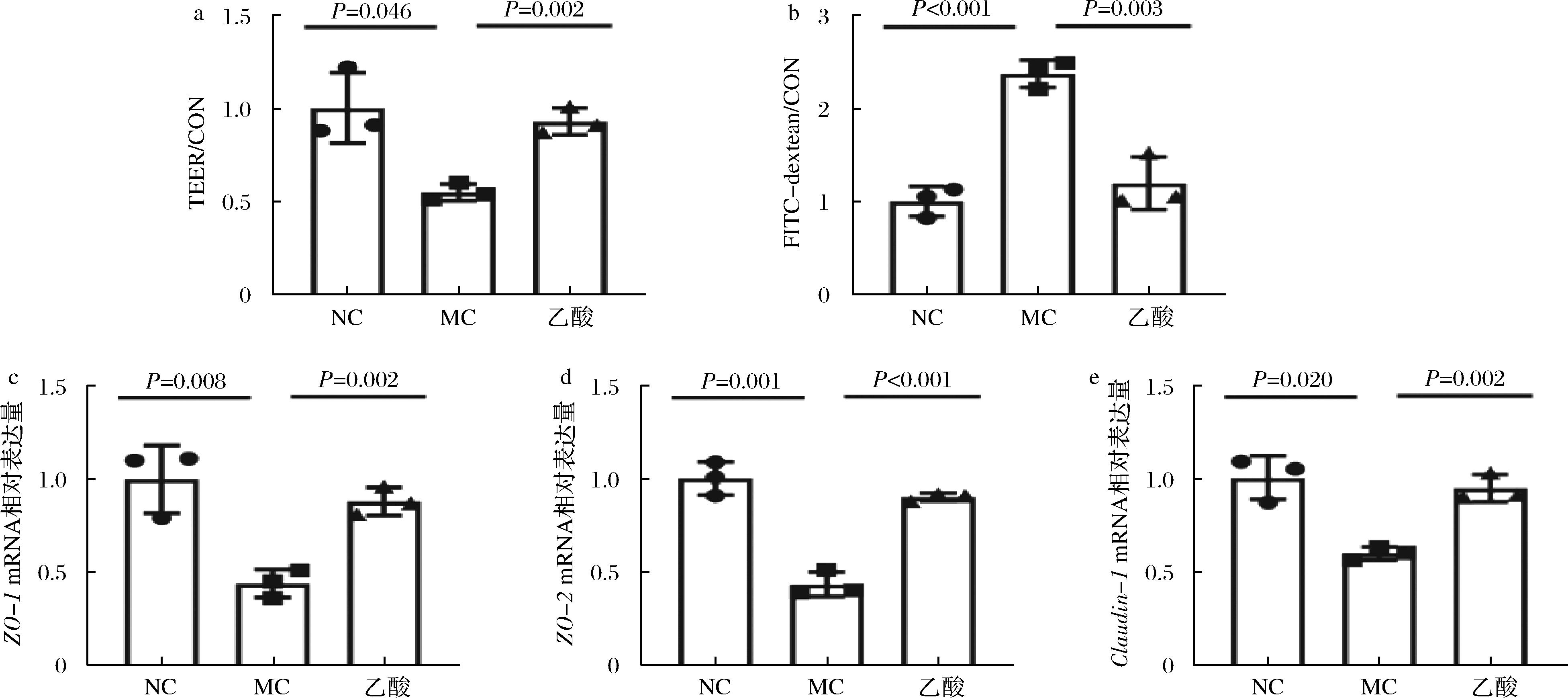
a-TEER值;b-FITC-dextean浓度;c-ZO-1 mRNA相对表达量;d-ZO-2 mRNA相对表达量;e-Claudin-1 mRNA相对表达量
图6 乙酸调节肠道通透性
Fig.6 Acetate regulates intestinal permeability
2.6 乙酸改善了Caco-2细胞通透性
TEER值反映了Caco-2细胞单层结构的完整性。如图6所示,与NC组相比,MC组TEER值显著降低(P=0.046),乙酸干预后,TEER值升高到NC组水平。FITC-dextean反映了相似的结果,MC组Caco-2细胞通透性增加,因为MC组FITC-dextean浓度是NC组的2.37倍。与MC组相比,乙酸干预后,FITC-dextean浓度降低了49.79%。本研究还探究了乙酸干预对ZO-1、ZO-2和Claudin-1表达的影响。与NC组相比,MC组ZO-1、ZO-2和Claudin-1表达显著降低(P ≤ 0.020)。乙酸处理后,ZO-1、ZO-2和Claudin-1表达水平分别增加了1.00倍、1.09倍和0.58倍。以上结果表明,GOS+ B.bifidum CICC®10395介导肠道产生的乙酸能够改善Caco-2细胞通透性。
2.7 乙酸降低了巨噬细胞RAW264.7炎症细胞因子分泌
由图7可知,与NC组相比,LPS处理导致巨噬细胞RAW264.7分泌的促炎细胞因子TNF-α、IL-1β和IL-6含量(P≤0.001)。GOS+B.bifidum CICC®10395处理后,TNF-α、IL-1β和IL-6含量分别降低了44.99%、55.36%和42.73%。因此,GOS+B.bifidum CICC®10395介导肠道产生的乙酸能够降低巨噬细胞RAW264.7产生的促炎细胞因子含量,改善肠道炎症功能。
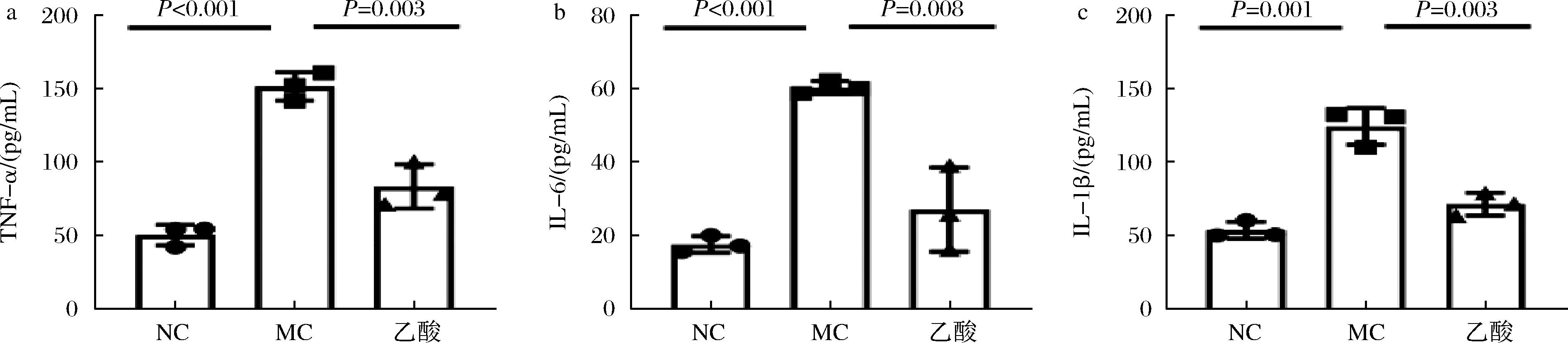
a-TNF-α;b-IL-1β;c-IL-6
图7 乙酸调节肠道免疫
Fig.7 Acetate regulates intestinal immunity
3 结论与讨论
GOS是婴儿配方食品中常见的益生元成分,具有多元化的生物活性特征[5]。B. bifidum是典型的益生菌,作为婴幼儿肠道内有益的菌群,能够利用益生元,促进自身生长,产生有益代谢产物,维持机体的健康[16]。益生元与益生菌被证明在改善肠道屏障功能、缓解炎症及增强免疫方面具有协同作用[17]。因此,本研究利用LPS诱导的肠道屏障损伤模型,探究基于GOS和B. bifidum的合生制剂对肠道屏障损伤的缓解作用。结果表明,合生制剂降低了模型小鼠肠道通透性、增加了紧密连接蛋白表达、降低了肠道炎症、改善了肠道化学屏障,表明GOS协同B. bifidum能够改善肠道屏障损伤。
肠道膜屏障由机械屏障、化学屏障、免疫屏障和生物屏障组成[18]。机械屏障是由肠道上皮细胞与上皮细胞之间的紧密连接蛋白组成。紧密连接的功能决定了物质的通过性,主要包括ZO家族和Claudin家族[19]。本研究发现,GOS协同B. bifidum能够促进ZO家族(ZO-1和ZO-2)的基因表达。化学屏障是指覆盖在肠上皮细胞上的一层胶状黏蛋白层,其主要成分是由杯状细胞分泌的黏蛋白组成[20]。化学屏障在隔离肠道内外环境、润滑肠道黏膜、抑制有害物质进入肠腔等方面发挥着重要作用[21]。其中,MUC1、MUC4、MUC13和MUC17作为结合型黏蛋白,也称为跨膜黏蛋白,主要功能是保护肠道细胞[22]。另外,它们还能作为肠道环境的传感器,参与机体与肠道菌群的相互作用[22]。除了结合型黏蛋白外,肠道内还含有大量的分泌型黏蛋白,它们是肠道黏液的主要组成成分,主要的结构是MUC2。MUC2由杯状细胞合成修饰,并分泌到肠道内,与水结合形成保护性屏障[23]。本研究表明,GOS协同B. bifidum主要增加了MUC2、MUC1、MUC4和MUC17表达量,来增加肠道结合型黏蛋白和分泌型黏蛋白表达。有研究表明,肠道屏障受损的机体往往伴随着肠道炎症的发生[24]。这是因为肠道屏障受损后,有害物质侵袭上皮细胞,激活先天免疫,产生大量的促炎细胞因子,如TNF-α、IL-6和IL-1β[25]。本研究证明,LPS诱导的模型小鼠免疫屏障受损,GOS协同B. bifidum处理后,炎症因子水平降低,免疫屏障增加。微生物屏障指的是肠道菌群的组成及其代谢功能对肠道的影响。本研究发现GOS促进了B. bifidum在肠道内的定植。此外,GOS协同B. bifidum灌胃的小鼠,血清中肠道通透性标志物D-乳酸和DAO减少,这些物质是由肠道菌群代谢产生,间接反映了肠道微生物屏障的调节。总之,GOS和B. bifidum的合生制剂可以通过调节肠道机械屏障、化学屏障、免疫屏障和生物屏障来改善肠道健康。
本研究还发现GOS和B. bifidum的合生制剂促进了小鼠肠道乙酸产生。乙酸是肠道菌群代谢产生的有益代谢物,与肠道健康密切相关[26]。据报道,肠道双歧杆菌是乙酸产生的主要肠道菌群之一[27]。包括双歧杆菌在内的肠道菌群能够利用低聚糖、多糖等益生元成分,促进自身生长,并将其代谢为短链脂肪酸[28]。DIFILIPPO等[29]利用仔猪粪便发酵GOS,发现产生了大量的乙酸和丁酸。HUANG等[30]发现富含乙酸的荔枝发酵物能够降低结肠炎小鼠的TNF-α分泌,来改善结肠炎。有研究还表明,纯品乙酸在体外能够促进细胞抗炎作用和屏障保护作用[31]。因此,GOS协同B. bifidum可能是通过产生乙酸来改善小鼠肠道屏障功能的。本研究通过乙酸干预的Caco-2细胞屏障模型和巨噬细胞RAW264.7免疫模型证明,乙酸能够降低细胞通透性,增加紧密连接表达,并抑制细胞分泌促炎细胞因子。
综上所述,基于GOS和B. bifidum的合生制剂能够改善小鼠机械屏障、化学屏障、免疫屏障和生物屏障,从而降低肠道通透性,其作用机制与肠道内乙酸的产生有关。本研究为GOS和B. bifidum在食品保健开发与肠道屏障临床调节上提供了借鉴意义。
[1] VANCAMELBEKE M, VERMEIRE S.The intestinal barrier:A fundamental role in health and disease[J].Expert Review of Gastroenterology &Hepatology, 2017, 11(9):821-834.
[2] ROMERO E S, COTONER C A, CAMACHO C P, et al.The intestinal barrier function and its involvement in digestive disease[J].Revista Espanola de Enfermedades Digestivas, 2015, 107(11):686-696.
[3] MOGILEVSKI T, NGUYEN A L, AJAMIAN M, et al.Intestinal barrier biomarkers in clinical evaluation of patients with inflammatory bowel disease[J].European Journal of Gastroenterology &Hepatology, 2024, 36(3):271-280.
[4] SONG J Z, ZHAO X, BO J Q, et al.A polysaccharide from Alhagi honey protects the intestinal barrier and regulates the Nrf2/HO-1-TLR4/MAPK signaling pathway to treat alcoholic liver disease in mice[J].Journal of Ethnopharmacology, 2024, 321:117552.
[5] LAMSAL B P.Production, health aspects and potential food uses of dairy prebiotic galactooligosaccharides[J].Journal of the Science of Food and Agriculture, 2012, 92(10):2020-2028.
[6] DURANTI S, GAIANI F, MANCABELLI L, et al.Elucidating the gut microbiome of ulcerative colitis:Bifidobacteria as novel microbial biomarkers[J].FEMS Microbiology Ecology, 2016, 92(12):fiw191.
[7] BUTTON J E, AUTRAN C A, REENS A L, et al.Dosing a synbiotic of human milk oligosaccharides and B.infantis leads to reversible engraftment in healthy adult microbiomes without antibiotics[J].Cell Host &Microbe, 2022, 30(5):712-725.
[8] BUTTON J E, COSETTA C M, REENS A L, et al.Precision modulation of dysbiotic adult microbiomes with a human-milk-derived synbiotic reshapes gut microbial composition and metabolites[J].Cell Host &Microbe, 2023, 31(9):1523-1538.
[9] 张童, 卢慧敏, 程婷, 等.两歧双歧杆菌B1通过提高乙酸水平调节宿主胃肠递质水平及抗氧化能力缓解便秘[J].食品与发酵工业, 2025, 51(2):110-117.
ZHANG T, LU H M, CHENG T, et al.Alleviating effects of Bifidobacterium bifidum B1 on constipation by increasing acetic acid levels to regulate host gastrointestinal neurotransmitter levels and antioxidant capacity[J].Food and Fermentation Industries, 2025, 51(2):110-117.
[10] 潘雅, 沈飞, 陈鸣, 等.低聚半乳糖对便秘小鼠的缓解作用及机制[J].食品工业科技.2025,46(9):1-11.
PAN Y, SHEN F, CHEN M, et al.Relieving effect and mechanism of oligogalactose on constipated mice[J].Food and Fermentation Industries.2025,46(9):1-11.
[11] CHEN Q X, YIN Q L, XIE Q G, et al.2′-fucosyllactose promotes the production of short-chain fatty acids and improves immune function in human-microbiota-associated mice by regulating gut microbiota[J].Journal of Agricultural and Food Chemistry, 2022, 70(42):13615-13625.
[12] HANSEN C H F, LARSEN C S, PETERSSON H O, et al.Targeting gut microbiota and barrier function with prebiotics to alleviate autoimmune manifestations in NOD mice[J].Diabetologia, 2019, 62(9):1689-1700.
[13] 侯玥, 宫平, 杨羽, 等.血清二胺氧化酶测定的临床应用进展[J].中国实验诊断学, 2015, 19(11):1985-1987.
HOU Y, GONG P, YANG Y, et al.Progress in clinical application of serum diamine oxidase determination[J].Chinese Journal of Laboratory Diagnosis, 2015, 19(11):1985-1987.
[14] 王峰, 赵瑛.D-乳酸与肠道屏障功能[J].临床和实验医学杂志, 2006, 5(4):423-424.
WANG F, ZHAO Y.D-lactic acid and intestinal barrier function[J].Journal of Clinical and Experimental Medicine, 2006, 5(4):423-424.
[15] LIN W, CHEN H L, CHEN X J, et al.The roles of neutrophil-derived myeloperoxidase (MPO) in diseases:The new progress[J].Antioxidants, 2024, 13(1):132.
[16] HAN M Z, LIANG J J, HOU M X, et al.Bifidobacterium bifidum ameliorates DSS-induced colitis in mice by regulating microbial metabolome and targeting gut microbiota[J].Journal of Agricultural and Food Chemistry,2024,72(42):38838169.
[17] LARKE J A, HEISS B E, EHRLICH A M, et al.Milk oligosaccharide-driven persistence of Bifidobacterium pseudocatenulatum modulates local and systemic microbial metabolites upon synbiotic treatment in conventionally colonized mice[J].Microbiome, 2023, 11(1):194.
[18] WU Y Q, JHA R, LI A, et al.Probiotics (Lactobacillus plantarum HNU082) supplementation relieves ulcerative colitis by affecting intestinal barrier functions, immunity-related gene expression, gut microbiota, and metabolic pathways in mice[J].Microbiology Spectrum, 2022, 10(6):e0165122.
[19] LI Y, WU L Y, YONG Y H, et al.Enhancing gut barrier integrity:Upregulation of tight junction proteins by chitosan oligosaccharide through the ERK1/2 signaling pathway[J].Nutrition, 2024, 124:112428.
[20] LI X X, WEI B, GOODGLICK L, et al.Investigating therapeutic approach of IBD using recombinant glycoprotein Mucin2[J].The FASEB Journal, 2009, 23(S1):23.
[21] WANG Y M, LI C X, LI J P, et al.Abelmoschus manihot polysaccharide fortifies intestinal mucus barrier to alleviate intestinal inflammation by modulating Akkermansia muciniphila abundance[J].Acta Pharmaceutica Sinica B, 2024, 14(9):3901-3915.
[22] PAONE P, CANI P D.Mucus barrier, mucins and gut microbiota:The expected slimy partners?[J].Gut, 2020, 69(12):2232-2243.
[23] HUANG S W, YE Q J, WANG A J, et al.Paeoniae decoction restores intestinal barrier dysfunction by promoting the interaction between ILC3 and gut flora[J].Phytomedicine, 2024, 132:155873.
[24] MO C Y, LOU X R, XUE J F, et al.The influence of Akkermansia muciniphila on intestinal barrier function[J].Gut Pathogens, 2024, 16(1):41.
[25] DEBNATH T, KIM D H, LIM B O.Natural products as a source of anti-inflammatory agents associated with inflammatory bowel disease[J].Molecules, 2013, 18(6):7253-7270.
[26] JUGDER B E, KAMAREDDINE L, WATNICK P I.Microbiota-derived acetate activates intestinal innate immunity via the Tip60 histone acetyltransferase complex[J].Immunity, 2021, 54(8):1683-1697.
[27] FUKUDA S, TOH H, HASE K, et al.Bifidobacteria can protect from enteropathogenic infection through production of acetate[J].Nature, 2011, 469(7331):543-547.
[28] FERRO L E, CROWLEY L N, BITTINGER K, et al.Effects of prebiotics, probiotics, and synbiotics on the infant gut microbiota and other health outcomes:A systematic review[J].Critical Reviews in Food Science and Nutrition, 2023, 63(22):5620-5642.
[29] DIFILIPPO E, PAN F P, LOGTENBERG M, et al.In vitro fermentation of porcine milk oligosaccharides and galacto-oligosaccharides using piglet fecal inoculum[J].Journal of Agricultural and Food Chemistry, 2016, 64(10):2127-2133.
[30] HUANG R, YAO H, JI S Y, et al.A lychee fermentate with enriched acetate but lowered GABA attenuates DSS-induced colitis by reinforcing gut barrier function and modulating intestinal microbiota[J].Food Bioscience, 2024, 59:104089.
[31] DELEU S, ARNAUTS K, DEPREZ L, et al.High acetate concentration protects intestinal barrier and exerts anti-inflammatory effects in organoid-derived epithelial monolayer cultures from patients with ulcerative colitis[J].International Journal of Molecular Sciences, 2023, 24(1):768.