脂质是母乳中仅次于乳糖的第二大成分,其中磷脂化合物大约占总脂质的0.2%~2.0%[1]。与生物体的主要能量来源甘油三酯相比,磷脂具有更高的生物学活性[2]。磷脂参与人体内代谢、免疫和消化等过程,对维持机体的正常生理功能有着重要的作用[3-5]。婴幼儿配方乳粉是婴幼儿除母乳外主要的营养来源,婴幼儿配方乳粉中磷脂化合物的添加在一定程度上弥补了婴幼儿配方乳粉与母乳之间磷脂成分之间的差异。因此,有必要测定婴幼儿配方乳粉中磷脂的含量,建立相应的检测方法。
磷脂主要分为甘油磷脂和鞘磷脂(sphingomyelin,SM)两大类。甘油磷脂的主结构是一个甘油骨架、其sn-1和sn-2位置通过酯键连接2个脂肪酸,形成疏水尾部;同时,在sn-3位置上连接1个磷酸残基,构成亲水极性头基。亲水极性头基包括乙醇胺、胆碱、甘油、肌醇和丝氨酸,形成了磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂酰肌醇(phosphatidylinositol,PI)和磷脂酰甘油(phosphatidylglycerol,PG)等几种主要的甘油磷脂[6-8]。SM由鞘氨醇骨架构成,一分子脂肪酸通过与鞘氨醇C2位的氨基形成酰胺键相连接。磷酸胆碱取代鞘氨醇外侧的羟基并连接,构成SM[9]。
测定磷脂化合物的检测方法主要有薄层色谱法、核磁共振法、高效液相色谱-蒸发光检测器法及液相色谱-串联质谱法等[10-11]。高效液相色谱-蒸发光检测器法[12-14]是目前测定磷脂化合物应用最广泛的检测技术之一,具有适用范围广、基线稳定、分辨率高等优点。GB 5009.272—2016《食品安全国家标准 食品中磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇的测定》就是采用高效液相色谱-蒸发光检测器法测定了PC、PE、PI的含量,其方法仅适用于测定部分油脂中3种磷脂组分的含量,具有一定的技术局限性。薄层色谱法[15]是用于磷脂的定性定量分析最早的检测手段之一,其灵敏度和自动化程度较低,近些年逐渐被更精准高效的技术所代替。核磁共振法[16-18]是一种非破坏性的定性和定量方法,原理是利用磷脂分子中磷原子不同的化学位移来测定不同组分,其缺点是仪器设备价格贵、仪器普及率低、实验人员能力要求高。液相色谱-串联质谱法因其同时具有色谱的良好分离能力与质谱的高选择性,在磷脂分析中得到了广泛的应用。WANG等[19]利用超高效液相色谱-四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry ,UHPLC-QTOF-MS)研究了不同泌乳期母乳中磷脂含量和组成的动态变化,并比较了母乳与6种家畜乳中的磷脂特征,为婴儿配方乳粉的母乳化模拟和原料选择提供了依据。GAO等[20]利用UHPLC-QTOF-MS对五味子油中的磷脂进行了定性和定量分析,在正负离子的模式下鉴定出49种和39种磷脂化合物。ZHOU等[21]通过液相色谱串联质谱法得到了蛋黄、牛脑、牛肝以及磷虾油中鞘磷脂的含量分布和亚类组成。FONG等[22]建立了高效液相色谱-串联质谱法并对市售的8种婴幼儿配方乳粉中PC、PI、PS、PE以及SM进行了定性和定量,分析了不同配方奶粉磷脂组成的差异性。朱丽等[23]通过超高效液相色谱联用质谱的多反应监测扫描模式实现了对大米、婴幼儿乳粉、豆乳中PC、PE、PI进行了定量分析。由此可见液相色谱-串联质谱法可以实现磷脂的种类和结构分析,在磷脂组学的研究中具有广泛的应用前景。但在结果准确度与方法普及性方面,高效液相色谱串联三重四级杆质谱法比高效液相色谱串联飞行时间质谱法更有优势,目前的文献方法尚无婴幼儿配方乳粉中6种磷脂组分定量分析的研究。
本实验采用超高效液相色谱-串联质谱法对婴幼儿配方乳粉中的磷脂类化合物进行了定性和定量分析,旨在建立一种结果准确、分析速度快、样品处理简单的检测方法,为磷脂检测提供可靠方法。
1 材料与方法
1.1 材料与试剂
婴幼儿配方乳粉样品(样品1~样品12),购自当地商超。
PC标准品(CAS号:97281-47-5,纯度≥98.5%)、PS标准品(CAS号:383908-63-2,纯度≥99.0%),上海源叶生物科技有限公司;PI标准品(CAS号:383907-36-6,纯度≥99.0%),美国Avanti公司;PE(CAS号:39382-08-6,纯度≥99.0%)、PG(CAS号:322647-44-9,纯度≥99.0%)、SM(CAS号:475662-40-9,纯度≥98.0%)、甲酸铵(色谱纯),美国Sigma公司;乙腈、甲醇、二氯甲烷、异丙醇(均为色谱纯),美国Fisher公司。
1.2 主要仪器与设备
8060NX超高效液相色谱-串联质谱联用仪,日本株式会社岛津制作所;ME204E分析天平,梅特勒-托利多仪器(上海)有限公司;SW22振荡恒温水浴槽,优莱博技术(北京)有限公司;DC-24-RT氮吹仪,上海安谱实验科技股份有限公司;AS20608超声波清洗仪,天津奥特赛恩斯仪器有限公司;CR21N离心机,日本日立公司。
1.3 实验方法
1.3.1 标准溶液的配制
磷脂标准储备溶液:分别称取适量的PC、PI、PS、PE、PG、SM标准品,用二氯甲烷-甲醇(体积比9∶1)溶解,分别定容至不同的5 mL容量瓶中,配制成质量浓度为1 mg/mL标准储备溶液,-20 ℃密封储存。
磷脂标准中间液:准确吸取各磷脂标准储备溶液1.0 mL至10 mL容量瓶中,用二氯甲烷-甲醇(体积比9∶1)定容。
磷脂标准工作液:分别吸取0.05、0.1、0.25、0.5、1.0 mL磷脂标准中间液至10 mL容量瓶中,用二氯甲烷-甲醇(体积比9∶1)定容。质量浓度分别为0.5、1.0、2.5、5.0、10.0 μg/mL,现用现配。
1.3.2 试样制备
称取试样2.0 g于50 mL离心管中,加水20 mL溶解,记录样品的质量以及样品和水的总质量。将样品溶液放在40 ℃恒温振荡水浴锅中加热30 min,混匀,使样品溶液溶解完全。
1.3.3 样品前处理
称取0.5 g样品溶液于15 mL离心管中,加入0.9 mL水和5 mL二氯甲烷-甲醇(体积比2∶1)溶液,混匀,40 ℃超声波处理10 min,8 000 r/min离心10 min,收集下层提取液。上层液继续加入5 mL二氯甲烷-甲醇(体积比2∶1)溶液,混匀,40 ℃超声波处理10 min,8 000 r/min离心10 min,收集下层提取液,合并提取液,在40 ℃下用N2吹干,准确加入5 mL的二氯甲烷-甲醇(体积比9∶1)溶解定容,过0.22 μm微孔滤膜,供仪器测定。
1.3.4 色谱和质谱条件
1.3.4.1 色谱条件
色谱柱:Agilent C8柱(50 mm×4.6 mm,1.8 μm);流速0.3 mL/min;柱温50 ℃;进样量5 μL;流动相A异丙醇-乙腈(体积比1∶1);流动相B 20 mmol/L甲酸铵水溶液。梯度洗脱程序为:0~1.0 min,20%A;1.0~2.0 min,20%A升至40%A;2.0~25.0 min,40%A升至92.5%A;25.0~26.0 min,92.5%A升至100%A;26.0~35.0 min,100%A;35.0~35.1 min,100%A降至20%A;35.1~38.0 min,20%A。
1.3.4.2 质谱条件
离子源为电喷雾离子源正/负离子模式(ESI+/ESI-);扫描方式为多反应监测扫描(multi-reaction monitoring mode, MRM);接口电压1 000 V;检测器电压1 920 V;DL温度250 ℃;接口温度400 ℃;加热块温度400 ℃;脱溶剂温度650 ℃;干燥气流量15 L/min;加热器流量10 L/min;雾化气流量2 L/min,质谱参数如表1所示。
表1 六种磷脂化合物测定方法的质谱条件
Table 1 Instrumental parameters for the determination of six phospholipid compounds
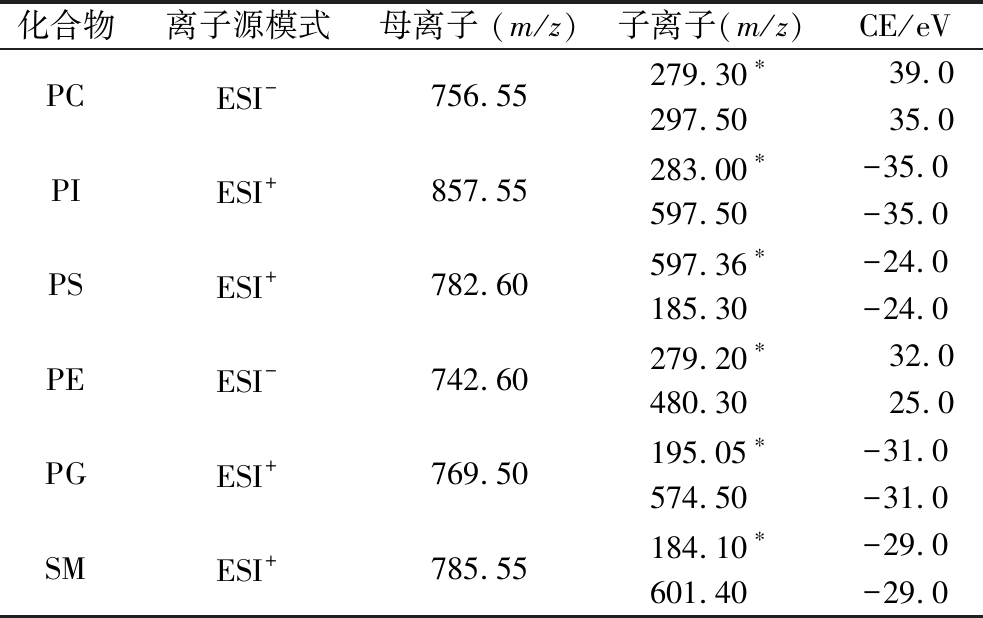
化合物离子源模式母离子 (m/z)子离子(m/z)CE/eVPCESI-756.55279.30∗ 39.0297.5035.0PIESI+857.55283.00∗-35.0597.50-35.0PSESI+782.60597.36∗-24.0185.30-24.0PEESI-742.60279.20∗ 32.0480.3025.0PGESI+769.50195.05∗-31.0574.50-31.0SMESI+785.55184.10∗-29.0601.40-29.0
注:*为定量离子。
2 结果与分析
2.1 色谱条件优化
流动相选择方面评估了2种反相色谱流动相体系对6种磷脂化合物的色谱行为及分离效能的影响。流动相Ⅰ组采用异丙醇-乙腈(体积比1∶1)作为流动相A,20 mmol/L甲酸铵水溶液作为流动相B;流动相Ⅱ组则选用异丙醇-甲醇(体积比1∶1)作为流动相A,同浓度甲酸铵水溶液作为流动相B。通过梯度洗脱对比实验发现,2种流动相体系均能实现目标化合物的基线分离,进一步对比发现,流动相Ⅰ组展现出显著增强的色谱响应及更优的峰形。这可能是由于乙腈较甲醇具有更强的洗脱能力和更低的黏度特性,有利于改善磷脂类化合物的溶解性和传质效率。基于色谱性能综合评价,最终选定异丙醇-乙腈/甲酸铵水溶液体系作为最优流动相组合。
2.2 质谱条件优化
在正离子和负离子模式下分别优化6种磷脂化合物的质谱参数,通过离子对强度确定了PC、PE的最佳电离模式为ESI负离子模式,PI、PS、PG、SM的最佳电离模式为ESI正离子模式。实验中使用5 μg/mL标准溶液直接注入质谱仪,在最佳离子模式下进行母离子和子离子扫描,通过优化质谱采集参数和特征碎片离子,得到各化合物的母离子、子离子及碰撞电压,最终得到6种磷脂化合物的最佳质谱参数,如表1所示,其MRM 色谱图见图1。
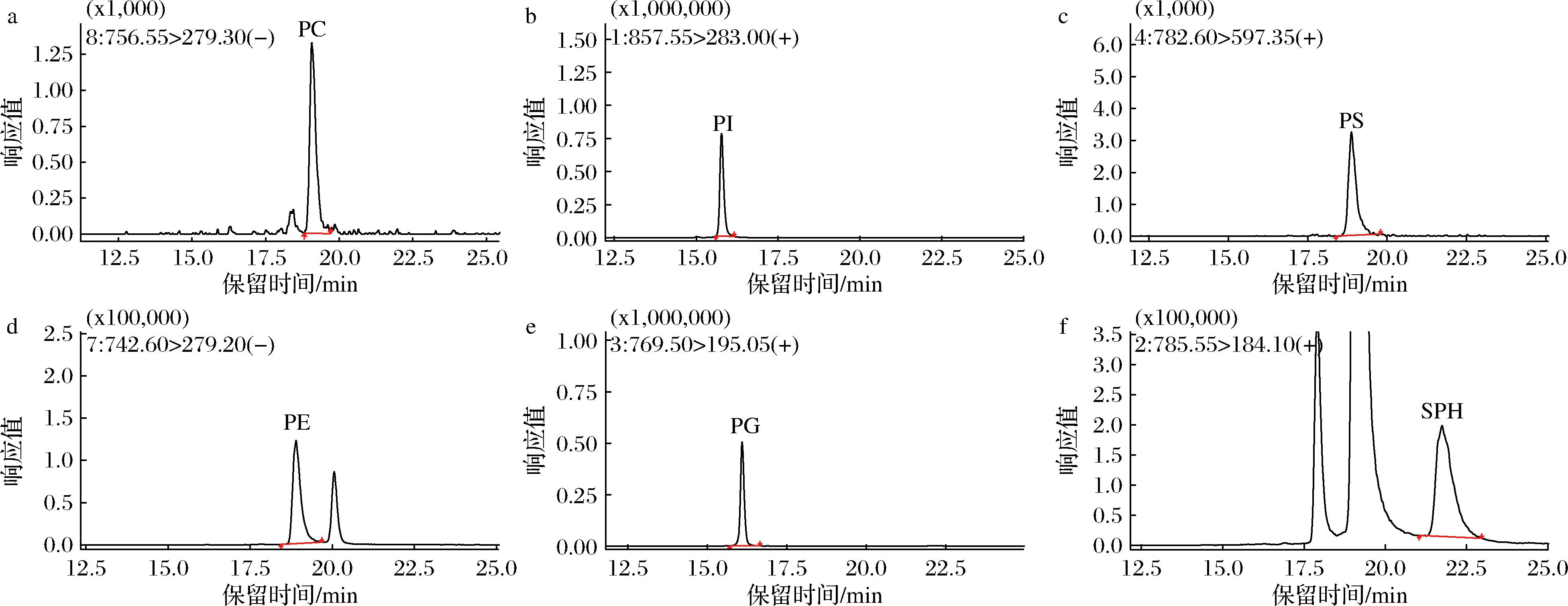
a-PC;b-PI;c-PS;d-PE;e-PG;f-SPH
图1 六种磷脂化合物的MRM色谱图
Fig.1 MRM chromatograms of six phospholipids
2.3 样品前处理条件优化
2.3.1 萃取试剂选择
3种萃取试剂对样品中的磷脂化合物萃取效果的差异如图2所示。不同的提取试剂对磷脂化合物的提取效率存在差异,对于PC、SM和PE,二氯甲烷-甲醇(体积比2∶1)提取效率>氯仿-甲醇(体积比2∶1)提取效率>乙醚提取效率;PI和PG,二氯甲烷-甲醇(2∶1)和乙醚提取效率差异不大,两者提取效率高于氯仿-甲醇(体积比2∶1);而对于PS,二氯甲烷-甲醇(体积比2∶1)和氯仿-甲醇(2∶1)提取效率高于乙醚。考虑到6种磷脂化合物的提取效果,选择了二氯甲烷-甲醇(体积比2∶1)溶液作为磷脂化合物的萃取试剂。
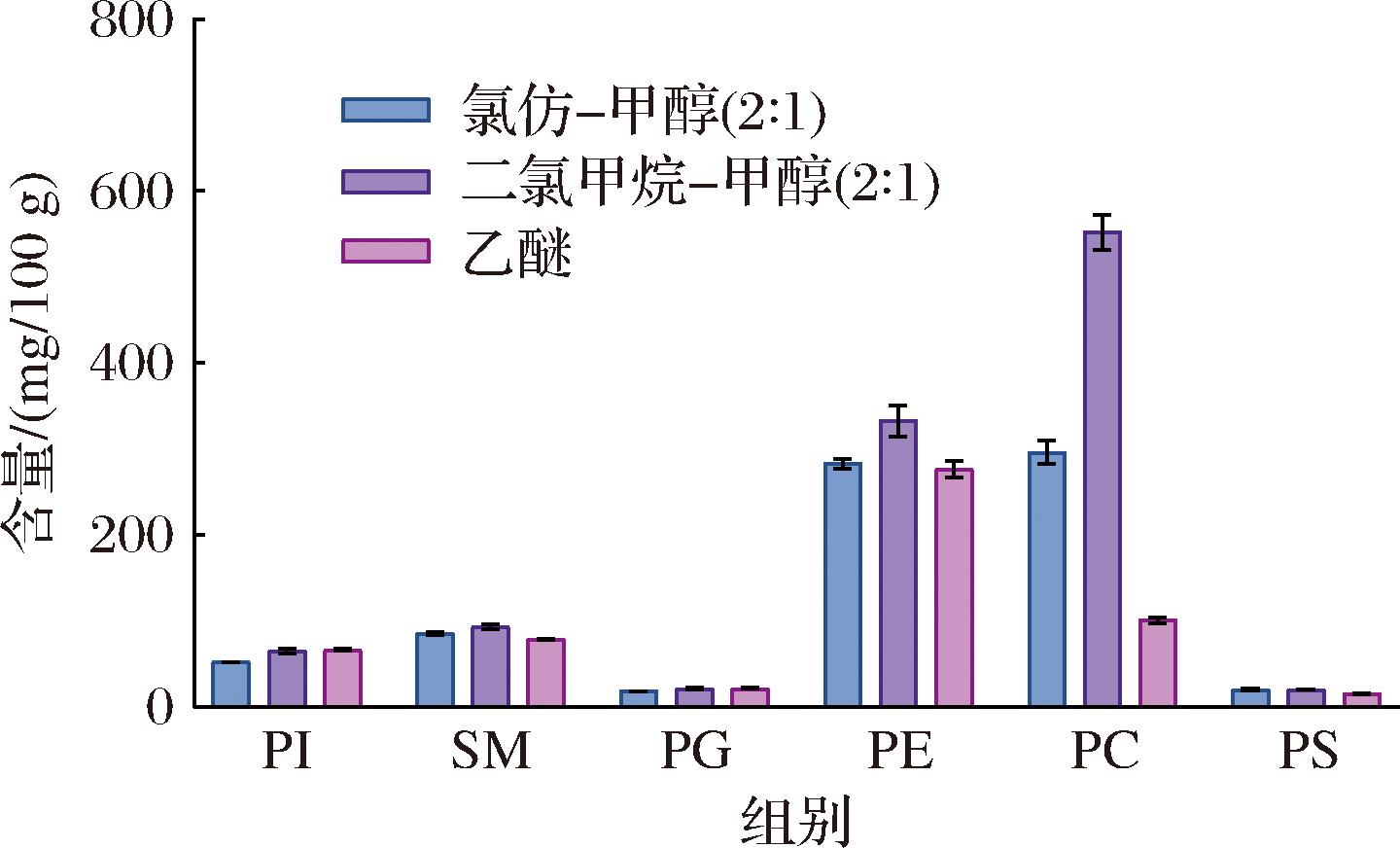
图2 不同萃取试剂提取婴幼儿配方乳粉中磷脂含量的测定结果
Fig.2 Determination results of phospholipids content in infant formula milk powder extracted with different extraction reagents
2.3.2 萃取次数选择
萃取次数对磷脂化合物测定结果的差异见图3。对于含量较高的磷脂化合物,萃取2次的效果要优于萃取1次,萃取3次的测定结果与萃取2次相比,没有明显增长,提示相应的磷脂化合物萃取完全;而对于含量较少的磷脂化合物,提取次数的增加并未使测定含量明显提高,综合考虑成本及安全性,选择使用二氯甲烷-甲醇(体积比2∶1)溶液对磷脂化合物萃取2次。
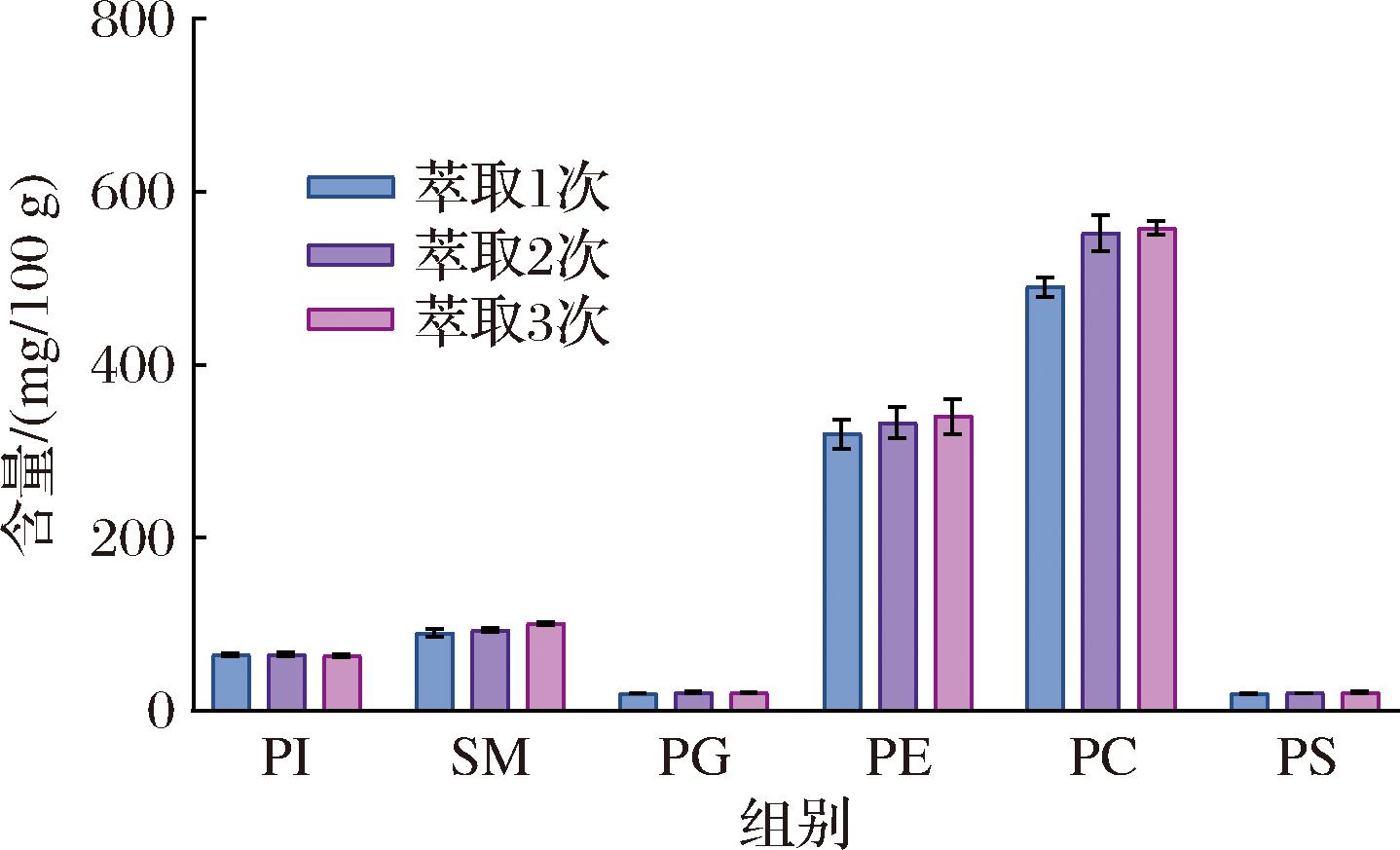
图3 不同萃取次数提取婴幼儿配方乳粉中磷脂含量的测定结果
Fig.3 Determination results of phospholipids content in infant formula milk powder extracted by different extraction times
2.4 方法学验证
2.4.1 线性关系
准确吸取PC、PI、PS、PE、PG、SM各标准储备溶液,配制浓度为0.5、1.0、2.5、5.0、10.0 μg/mL的混合标准工作溶液进样分析,以各化合物峰面积为纵坐标,浓度为横坐标,绘制标准曲线,求得线性回归方程和相关系数。6种磷脂化合物的线性范围、回归方程及相关系数见表2。6种磷脂化合物线性关系良好,相关系数r均大于0.999。
表2 六种磷脂化合物测定方法的线性范围、回归方程及相关系数
Table 2 The linear ranges, linear equation and correlation coefficient for the determination of six phospholipid compounds

化合物线性范围/(μg/mL)线性方程相关系数PC0.55~11.05y=1 502.2x+17.0330.999 1PI0.40~8.10 y=826 560x-229 6670.999 8PS0.55~11.05y=5 085.5x-1 313.50.999 9PE0.51~10.20y=208 847x-28 6740.999 7PG0.54~10.77y=402 926x-121 6570.999 7SM0.52~10.50y=513 040x-126 8860.999 9
2.4.2 基质效应
基质效应是由于基质中存在使目标物电离效率发生改变的其他组分而形成的,包括基质抑制和基质增强2种效应[24]。每种成分的基质效应不同,会影响定量结果的准确性。在本实验中,基质效应通过提取后添加法来进行评价,提取后添加法是通过比对标准溶液中目标物响应和样品前处理后加标溶液中目标物的响应来评估基质效应[24]。评价方式为:样品前处理后加标溶液中目标物的响应/标准溶液中目标物响应。如果两者比值小于100%,表现为基质抑制效应,反之,则为基质增强效应[9-10]。6种磷脂化合物的基质效应见表3。结果表明,PC和PI表现为基质抑制效应,SM、PS、PE、PG则表现为基质增强效应。一般认为,两者比值在80%~120%,基质效应可以忽略。结果表明本方法处理后基质对6种磷脂化合物的检测无明显影响。
表3 六种磷脂化合物基质效应
Table 3 Matrix effects of six phospholipid compounds in infant formula milk powder
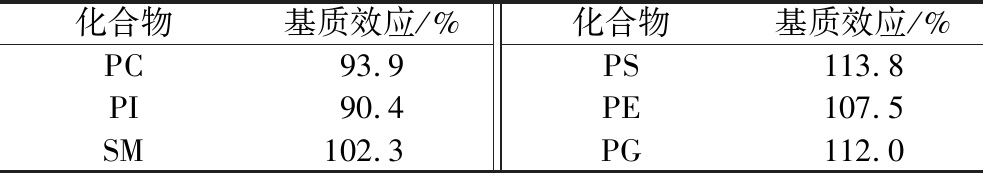
化合物基质效应/%化合物基质效应/%PC93.9PS113.8PI90.4PE107.5SM102.3PG112.0
2.4.3 检出限与定量限
用加标方式确认方法检出限和定量限。在空白样品中加入一定量的标准溶液,按照样品前处理后上机。当样品中PG、PI、PE的加标含量为2.0 mg/100 g,PC、PS、SM的加标含量为10 mg/100 g时,目标峰谱图信噪比均大于3,确定此时的加标含量为检出限;当样品中PG、PI、PE的加标含量为6.0 mg/100 g,PC、PS、SM的加标含量为30 mg/100 g时,目标峰谱图信噪比均大于10,且回收率介于80%~120%,确定此时的加标含量为定量限。定量限水平加标测定结果详见表4,检出限和定量限水平加标谱见图4和图5。

a-PC;b-PI;c-PS;d-PE;e-PG;f-SPH
图4 空白样品中检出限水平加标测定6种磷脂化合物的色谱图
Fig.4 Chromatograms of six phospholipid compounds fortified at limit of detection levels in blank matrix
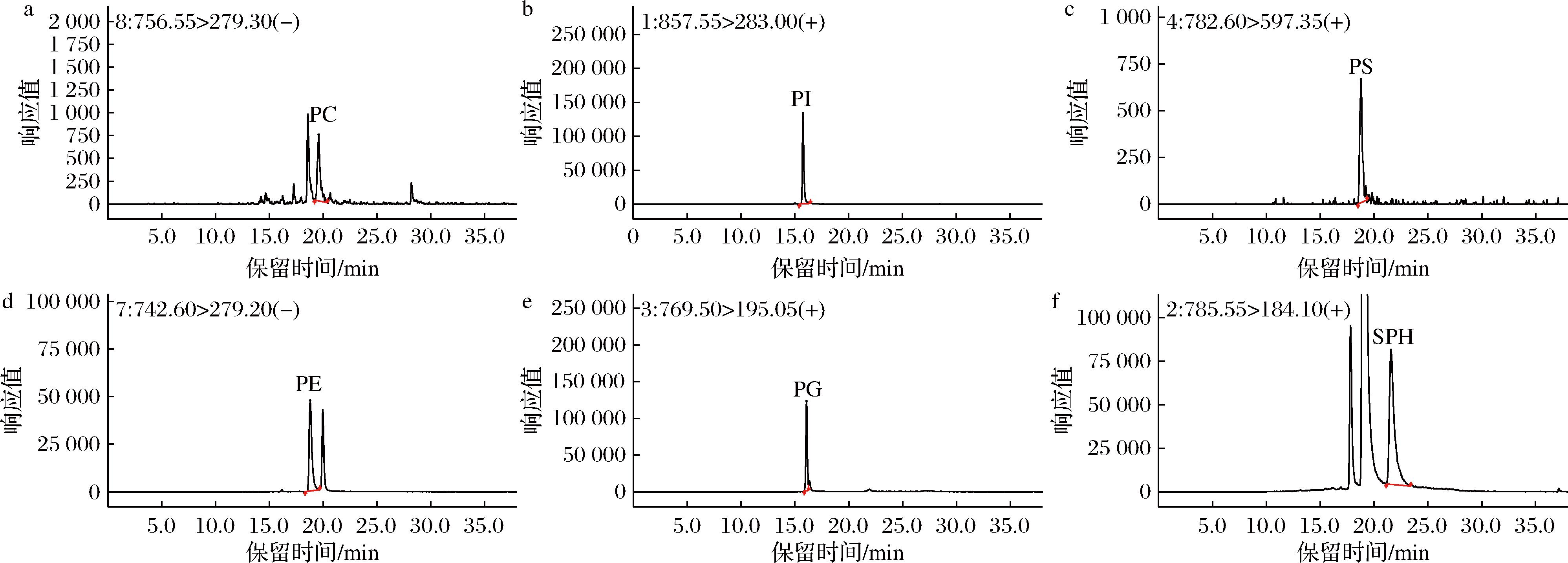
a-PC;b-PI;c-PS;d-PE;e-PG;f-SPH
图5 空白样品中定量限水平加标测定6种磷脂化合物的色谱图
Fig.5 Chromatograms of six phospholipid compounds fortified at limit of quantification levels in blank matrix
表4 空白样品中6种磷脂化合物定量限水平加标测定结果
Table 4 Results of six phospholipid compounds fortified at limit of quantification levels in blank matrix
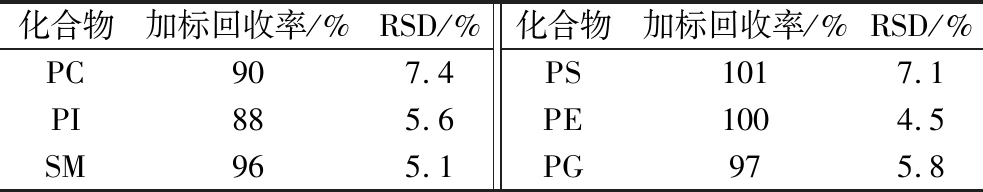
化合物加标回收率/%RSD/%化合物加标回收率/%RSD/%PC907.4PS1017.1PI885.6PE1004.5SM965.1PG975.8
2.4.4 精密度和回收率
向已知磷脂含量的乳粉样品中分别添加高、中、低3个不同质量浓度的标准溶液进行回收率试验,分别平行测定6次,计算加标回收率和精密度。
PC三个水平的加标回收率在86%~93%,相对标准偏差(relative standard deviations,RSD)在2.7%~7.7%;PI三个水平的加标回收率在90%~102%,RSD在4.8%~9.0%;PS三个水平的加标回收率在102%~106%,RSD在2.8%~7.1%;PE三个水平的加标回收率在97%~104%,RSD在3.1%~3.4%;PG三个水平的加标回收率在87%~107%,RSD在1.4%~5.1%;SM三个水平的加标回收率在88%~97%,RSD在5.3%~8.7%。详见表5。结果表明该方法比较准确,可用于婴幼儿配方乳粉中6种磷脂化合物素的定性定量分析。
表5 婴幼儿配方乳粉中6种磷脂化合物不同浓度水平的加标回收率和精密度
Table 5 Recovery and precision of six phospholipid compounds in infant formula milk powder fortified at multiple concentration levels
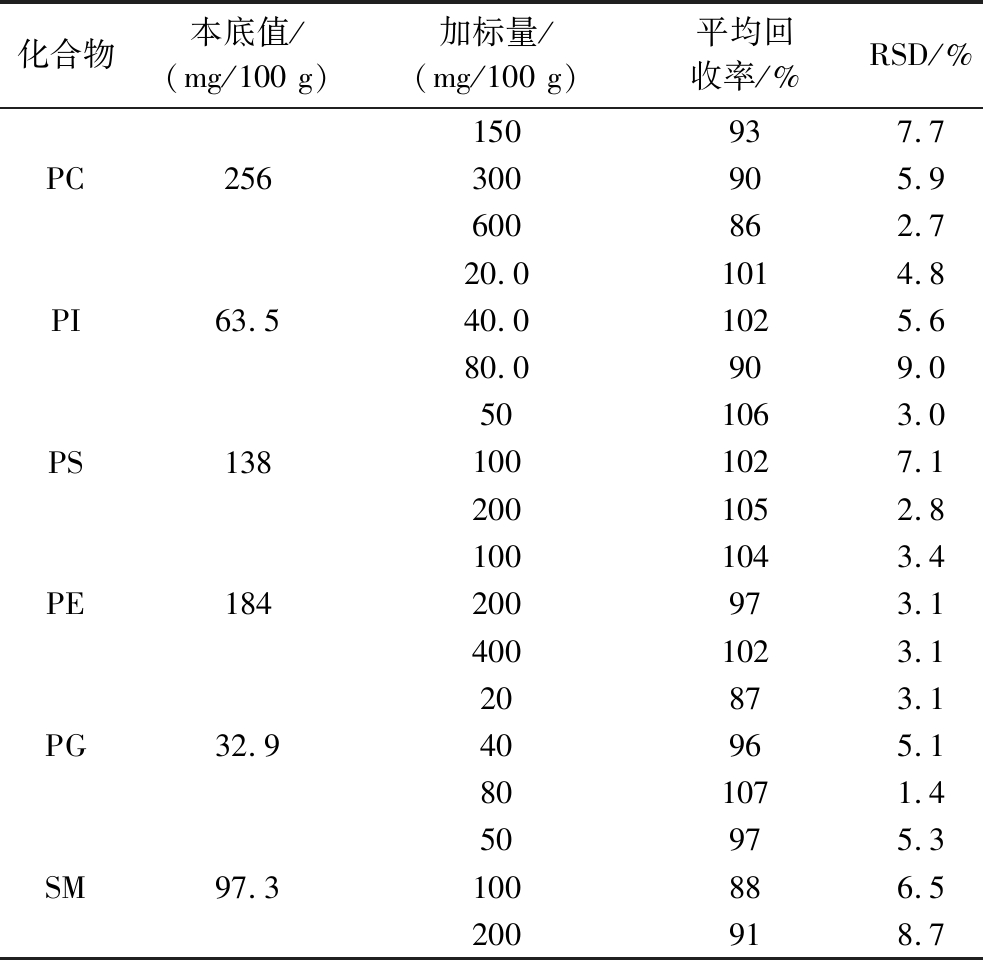
化合物本底值/(mg/100 g)加标量/(mg/100 g)平均回收率/%RSD/%PC256150937.7300905.9600862.7PI63.520.01014.840.01025.680.0909.0PS138501063.01001027.12001052.8PE1841001043.4200973.14001023.1PG32.920873.140965.1801071.4SM97.350975.3100886.5200918.7
2.5 实际样品分析
采集市售的12种婴幼儿配方乳粉(样品1~12),乳粉包含婴儿配方乳粉、较大婴儿配方乳粉和幼儿配方乳粉,乳来源包括羊乳和牛乳。利用所建立的方法对样品进行测定,结果见表6。
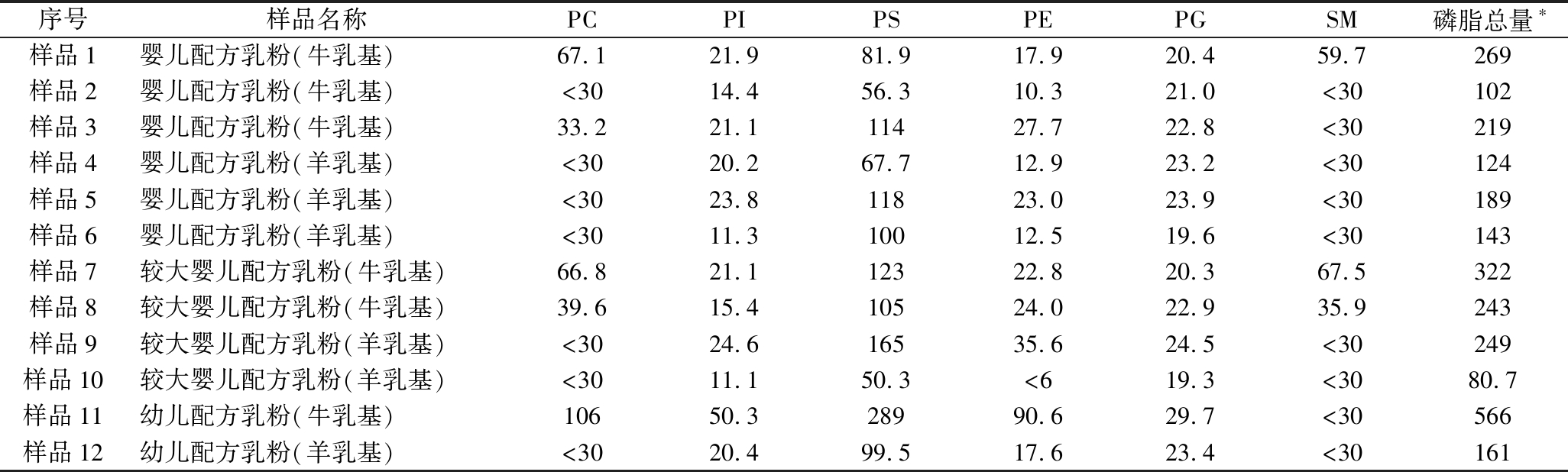
表6 婴幼儿配方乳粉中磷脂化合物测定结果 单位:mg/100 g
Table 6 Results of phospholipid compounds in infant formula milk powder
序号样品名称PCPIPSPEPGSM磷脂总量∗样品1婴儿配方乳粉(牛乳基)67.121.9 81.9 17.9 20.4 59.7269 样品2婴儿配方乳粉(牛乳基)<3014.4 56.3 10.3 21.0 <30102 样品3婴儿配方乳粉(牛乳基)33.221.1 114 27.7 22.8 <30219 样品4婴儿配方乳粉(羊乳基)<3020.2 67.7 12.9 23.2 <30124 样品5婴儿配方乳粉(羊乳基)<3023.8 118 23.0 23.9 <30189 样品6婴儿配方乳粉(羊乳基)<3011.3 100 12.5 19.6 <30143 样品7较大婴儿配方乳粉(牛乳基)66.821.1 123 22.8 20.3 67.5322 样品8较大婴儿配方乳粉(牛乳基)39.615.4 105 24.0 22.9 35.9243 样品9较大婴儿配方乳粉(羊乳基)<3024.6 165 35.6 24.5 <30249 样品10较大婴儿配方乳粉(羊乳基)<3011.1 50.3 <619.3 <3080.7 样品11幼儿配方乳粉(牛乳基)10650.3 289 90.6 29.7 <30566 样品12幼儿配方乳粉(羊乳基)<3020.4 99.5 17.6 23.4 <30161
注:*磷脂总量=PC+PI+PS+PE+PG+SM。
根据文献研究[25],乳粉中磷脂的主要来源包括牛乳(粉)或羊乳(粉)、额外添加的乳清蛋白粉、浓缩乳清蛋白粉、植物调和油、脱盐乳清粉等。原料来源和配方设计的不同导致婴儿配方乳粉中磷脂组分的含量存在差异。测定的12份婴幼儿配方乳粉中磷脂总含量在80.7~566 mg/100 g,差异较大。11号样品的磷脂总量最高,显著高于另外11个样品。PS是含量最高的磷脂化合物,范围从50.3~289 mg/100 g,占磷脂总含量的30.4%~69.9%,11号样品的PS含量最高,10号样品的PS含量最低。PG含量在19.3~29.7 mg/100 g之间,占磷脂总含量的5.2%~23.9%,含量差异相对较小。除10号样品外,其他样品中PE的含量在10.3~90.6 mg/100 g,占磷脂总含量的6.7%~16.0%;PI的含量介于11.1~50.3 mg/100 g,占磷脂总含量的6.3%~16.3%。所有样品中,9份样品的SM含量低于定量限,1号、7号、8号乳粉中SM含量高于定量限。1号、3号、7号、8号、11号样品中PC的含量均高于定量限。11号样品中PE的含量高于其他样品2倍以上,PC和PI的含量高于其他样品1倍以上,根据其配料表分析,该样品中强化的大豆磷脂可能是导致PE、PC和PI含量较高的原因。此次采集的羊乳基样品中SM和PC含量均小于定量限,多数牛乳基样品中SM和PC含量高于定量限,显示牛乳中的SM和PC含量可能高于羊乳。
3 结论
本研究针对婴幼儿配方乳粉的复杂基质特性,建立了超高效液相色谱-串联质谱的磷脂化合物检测方法,实现了6种磷脂化合物组分(PC、PI、PS、PE、PG、SM)的高效分离。通过优化流动相组成、离子化模式及质谱参数,结合样品前处理中提取溶剂配比与提取次数的实验筛选,实现了目标物的精准定量。方法操作过程简单,分析周期短,灵敏度高,重复性好,为婴幼儿配方乳粉中磷脂的定量分析提供了可靠的技术保障。同时在应用层面上,揭示了市售12款婴幼儿配方乳粉的磷脂分布特征,证实原料乳类型(牛乳基/羊乳基)和配方对磷脂的调控作用,为配方优化、功能性脂质强化及生产过程质量控制提供了科学依据。
[1] ZHAO J Y, LIU Q, LIU Y, et al.Quantitative profiling of glycerides, glycerophosphatides and sphingolipids in Chinese human milk with ultra-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry[J].Food Chemistry, 2021, 346:128857.
[2] WEI W, LI D, JIANG C Y, et al.Phospholipid composition and fat globule structure II:Comparison of mammalian milk from five different species[J].Food Chemistry, 2022, 388:132939.
[3] ANTO L, WARYKAS S W, TORRES-GONZALEZ M, et al.Milk polar lipids:Underappreciated lipids with emerging health benefits[J].Nutrients, 2020, 12(4):1001.
[4] SAITO H, ISHIHARA K.Antioxidant activity and active sites of phospholipids as antioxidants[J].Journal of the American Oil Chemists’ Society, 1997, 74(12):1531-1536.
[5] 胡小中. 磷脂酰胆碱的生理功能和作用机理[J].粮油食品科技, 2011, 19(4):42-44.
HU X Z.Physiological function of phosphatidylcholine and its possible mechanism of action[J].Science and Technology of Cereals, Oils and Foods, 2011, 19(4):42-44.
[6] CONTARINI G, POVOLO M.Phospholipids in milk fat:Composition, biological and technological significance, and analytical strategies[J].International Journal of Molecular Sciences, 2013, 14(2):2808-2831.
[7] 杨洁, 杨丹, 张雪, 等.人乳的磷脂组成与脂肪球结构[J].中国油脂, 2018, 43(10):134-139.
YANG J, YANG D, ZHANG X, et al.Phospholipid composition and fat globule structure of human milk[J].China Oils and Fats, 2018, 43(10):134-139.
[8] HATZAKIS E, KOIDIS A, BOSKOU D, et al.Determination of phospholipids in olive oil by 31P NMR spectroscopy[J].Journal of Agricultural and Food Chemistry, 2008, 56(15):6232-6240.
[9] BLAAS N, SCHÜÜRMANN C, BARTKE N, et al.Structural profiling and quantification of sphingomyelin in human breast milk by HPLC-MS/MS[J].Journal of Agricultural and Food Chemistry, 2011, 59(11):6018-6024.
[10] 胡雪, 段国霞, 刘丽君, 等.乳及乳制品中磷脂的含量、功能、分离及检测技术研究进展[J].食品科学, 2021, 42(19):350-361.
HU X, DUAN G X, LIU L J, et al.Progress in contents, functional evaluation, isolation and quantification of phospholipids from milk and milk products[J].Food Science, 2021, 42(19):350-361.
[11] 李七雄, 陈希, 曹利岗, 等.油脂加工中磷脂检测方法研究进展[J].食品安全质量检测学报, 2024, 15(14):125-132.
LI Q X, CHEN X, CAO L G, et al.Advance of phospholipid detection methods of edible oil processing[J].Journal of Food Safety &Quality, 2024, 15(14):125-132.
[12] RESTUCCIA D, SPIZZIRRI U G, PUOCI F, et al.Determination of phospholipids in food samples[J].Food Reviews International, 2012, 28(1):1-46.
[13] 赵新楠, 彭吉星, 吴海燕, 等.水产品中5种磷脂含量的HPLC-ELSD检测分析[J].中国渔业质量与标准, 2022, 12(4):10-17.
ZHAO X N, PENG J X, WU H Y, et al.Determination and analysis for contents of five phospholipids in aquatic products by HPLC-ELSD method[J].Chinese Fishery Quality and Standards, 2022, 12(4):10-17.
[14] 李博群, 宋戈, 孙立庆, 等.高效液相色谱—蒸发光散射法同时测定乳清蛋白粉中5种磷脂[J].中国乳品工业, 2023, 51(1):47-52.
LI B Q, SONG G, SUN L Q, et al.Determination of five phospholipids in whey protein products by high performance liquid chromatography with a evaporative light-scattering detector[J].China Dairy Industry, 2023, 51(1):47-52.
[15] DY SKA-KUKULSKA K, CIESIELSKI W, ZAKRZEWSKI R.The use of a new, modified Dittmer-Lester spray reagent for phospholipid determination by the TLC image analysis technique[J].Biomedical Chromatography, 2013, 27(4):458-465.
SKA-KUKULSKA K, CIESIELSKI W, ZAKRZEWSKI R.The use of a new, modified Dittmer-Lester spray reagent for phospholipid determination by the TLC image analysis technique[J].Biomedical Chromatography, 2013, 27(4):458-465.
[16] HELMERICH G, KOEHLER P.Comparison of methods for the quantitative determination of phospholipids in lecithins and flour improvers[J].Journal of Agricultural and Food Chemistry, 2003, 51(23):6645-6651.
[17] 刘纯友, 马美湖, 王庆玲, 等.核磁共振技术在食品脂质研究中的应用新进展[J].食品工业科技, 2017, 38(12):342-346.
LIU C Y, MA M H, WANG Q L, et al.New advances of application of nuclear magnetic resonance technology in food lipid research[J].Science and Technology of Food Industry, 2017, 38(12):342-346.
[18] 林瑞雪, 李峰, 韦伟, 等.核磁共振磷谱法测定乳制品中的磷脂含量[J].中国油脂, 2022, 47(9):129-135.
LIN R X, LI F, WEI W, et al.Analysis of phospholipids content in dairy products by31P NMR[J].China Oils and Fats, 2022, 47(9):129-135.
[19] WANG M Y, ZHANG F X, FAN J, et al.Quantitative phospholipidomics and screening for significantly different phospholipids in human colostrum and milk, and dairy animal colostrum[J].International Dairy Journal, 2023, 146:105741.
[20] GAO Y, WU S M.Comprehensive analysis of the phospholipids and phytosterols in Schisandra chinensis oil by UPLC-Q/TOF- MSE[J].Chemistry and Physics of Lipids, 2019, 221:15-23.
[21] ZHOU L, ZHAO M J, ENNAHAR S, et al.Liquid chromatography-tandem mass spectrometry for the determination of sphingomyelin species from calf brain, ox liver, egg yolk, and krill oil[J].Journal of Agricultural and Food Chemistry, 2012, 60(1):293-298.
[22] FONG B, MA L, NORRIS C.Analysis of phospholipids in infant formulas using high performance liquid chromatography-tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2013, 61(4):858-865.
[23] 朱丽, 杨世添, 邓梦雅, 等.超高效液相色谱联用质谱测定食品中磷脂酰胆碱、磷脂酰乙醇胺及磷脂酰肌醇[J].食品科技, 2018, 43(11):330-335.
ZHU L, YANG S T, DENG M Y, et al.Simultaneous determination of phosphatidylcholine, phosphatidyl ethanolamine and phosphatidylinositol in food by UPLC-MS/MS[J].Food Science and Technology, 2018, 43(11):330-335.
[24] 冯媛媛, 田冶, 尹利辉, 等.液质联用分析技术中的基质效应[J].中国新药杂志, 2024, 33(10):1009-1020.
FENG Y Y, TIAN Y, YIN L H, et al.Matrix effects in liquid chromatography-mass spectrometry analysis techniques[J].Chinese Journal of New Drugs, 2024, 33(10):1009-1020.
[25] 王梦雨.乳及乳制品中乳铁蛋白和磷脂分析及婴幼儿配方乳粉的母乳化研究[D].北京:北京化工大学,2023.
WANG M Y.Analysis of lactoferrin and phospholipids in milk and dairy products and research on humanization of infant formula[D].Beijing:Beijing University of Chemical Technology, 2023.