花色苷是一类具有多种功能活性的天然产物,广泛用于抗氧化、抗炎及肠道菌群调节等[1]。但花色苷母核和糖苷结构中含有多个酚羟基,在自然界中易受到pH、光照及温度等因素的影响并发生降解[2]。例如,当花色苷暴露在光照之下,会吸收光能并激发花色苷发生自旋转换、电荷转移和氧化反应,导致其分解生成C4羟基中间体、查尔酮和2,4,6-三羟基苯甲醛等物质[3]。然而,在酶催化作用下花色苷结构中的羟基与有机酸会发生酰基化反应生成酰基化花色苷,水分子不易攻击,从而有效提高了花色苷的稳定性。这一过程使—OH及C![]() O数量增多,增强了花色苷的抗氧化活性及对α-葡萄糖苷酶和α-淀粉酶等消化酶的抑制活性,降血糖作用显著提高[4]。因此,本文重点总结了花色苷的酰基化结构并分析了酰基化花色苷的稳定性以及降血糖作用,以期为花色苷的开发利用提供科学依据。
O数量增多,增强了花色苷的抗氧化活性及对α-葡萄糖苷酶和α-淀粉酶等消化酶的抑制活性,降血糖作用显著提高[4]。因此,本文重点总结了花色苷的酰基化结构并分析了酰基化花色苷的稳定性以及降血糖作用,以期为花色苷的开发利用提供科学依据。
1 花色苷的酰基化
花色苷的化学本质是糖基化的花青素。自然界中,常见的花青素有天竺葵色素(pelargonidin)、矢车菊色素(cyanidin)、矮牵牛色素(petunidin)、飞燕草色素(delphinidin)、锦葵色素(malvidin)和芍药色素(peonidin)6种[5]。它们是2-苯并芘或黄烊盐离子的多羟基以及甲氧基衍生物,拥有典型的C6(A环)-C3(C环)-C6(B环)型黄酮骨架,即2个芳香环和1个含氧杂环,其结构及颜色特征见表1[6]。需要注意的是,花青素的稳定性较差,通常不单独存在自然界中,而是在其生物合成过程中进一步与糖苷、有机酸等基团发生结合,形成结构更加稳定、颜色更加丰富的花色苷。
表1 天然花青素的结构和颜色特征
Table 1 Structures and chromatic features of natural anthocyanin aglycones
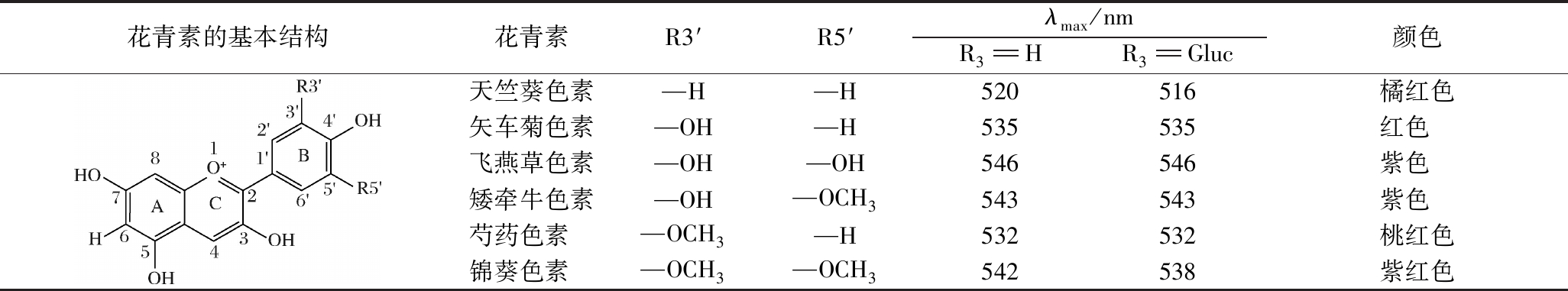
花青素的基本结构花青素R3′R5′λmax/nmR3HR3Gluc颜色天竺葵色素—H—H520516橘红色矢车菊色素—OH—H535535红色 飞燕草色素—OH—OH546546紫色 矮牵牛色素—OH—OCH3543543紫色 芍药色素—OCH3—H532532桃红色锦葵色素—OCH3—OCH3542538紫红色
注:λmax为最大吸收波长。
糖基化是花青素转化为花色苷的重要生物合成过程,它是指将糖苷通过O键和分子间作用力连接在花青素上,连接的位点包括花青素结构中的C3、C5、C7、C3′或C5′位点[7]。目前,已知的天然花色苷的种类有700余种,存在于27个科,73个属的植物中[8],其中尤以黑果枸杞、红菜薹和马铃薯等植物中含量较为丰富[9]。花青素的糖基化会通过露出疏水面、减少电子离域和增强链阻等方式提高花青素的稳定性和水溶性,大多数发生在A环的C3和C5位点及C环的C3位点[7]。在C3的糖苷上还能链接苹果酸、阿魏酸、咖啡酸和香豆酸等有机酸,为花色苷的进步一修饰(如酰基化)提供可能。
酰基化是花色苷生物合成过程的最后一步,它是指在酶催化作用下糖苷通过酯键与脂肪族酰基(乙酸、琥珀酸、苹果酸、丙二酸和草酸)和(或)芳香族酰基(咖啡酸、p-羟基苯甲酸、阿魏酸、芥子酸和香豆酸)两类有机酸反应形成酰基化花色苷的过程[10](酰基单位和酰基基本结构见图1和图2)。
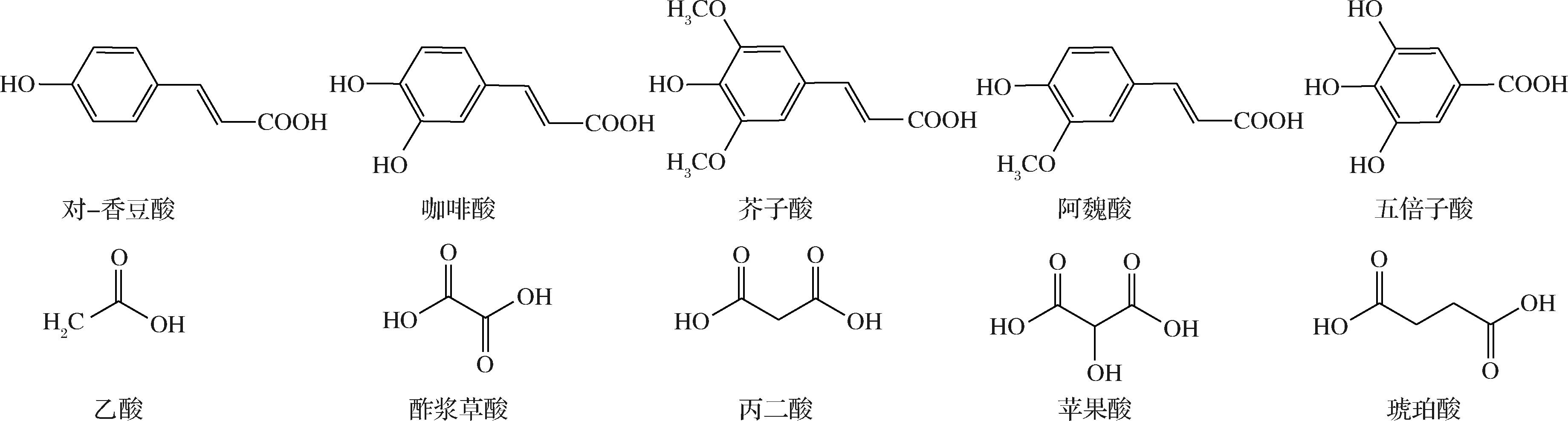
图1 可形成酰基化花色苷的酰基单位
Fig.1 Acyl units that can form acylated anthocyanins
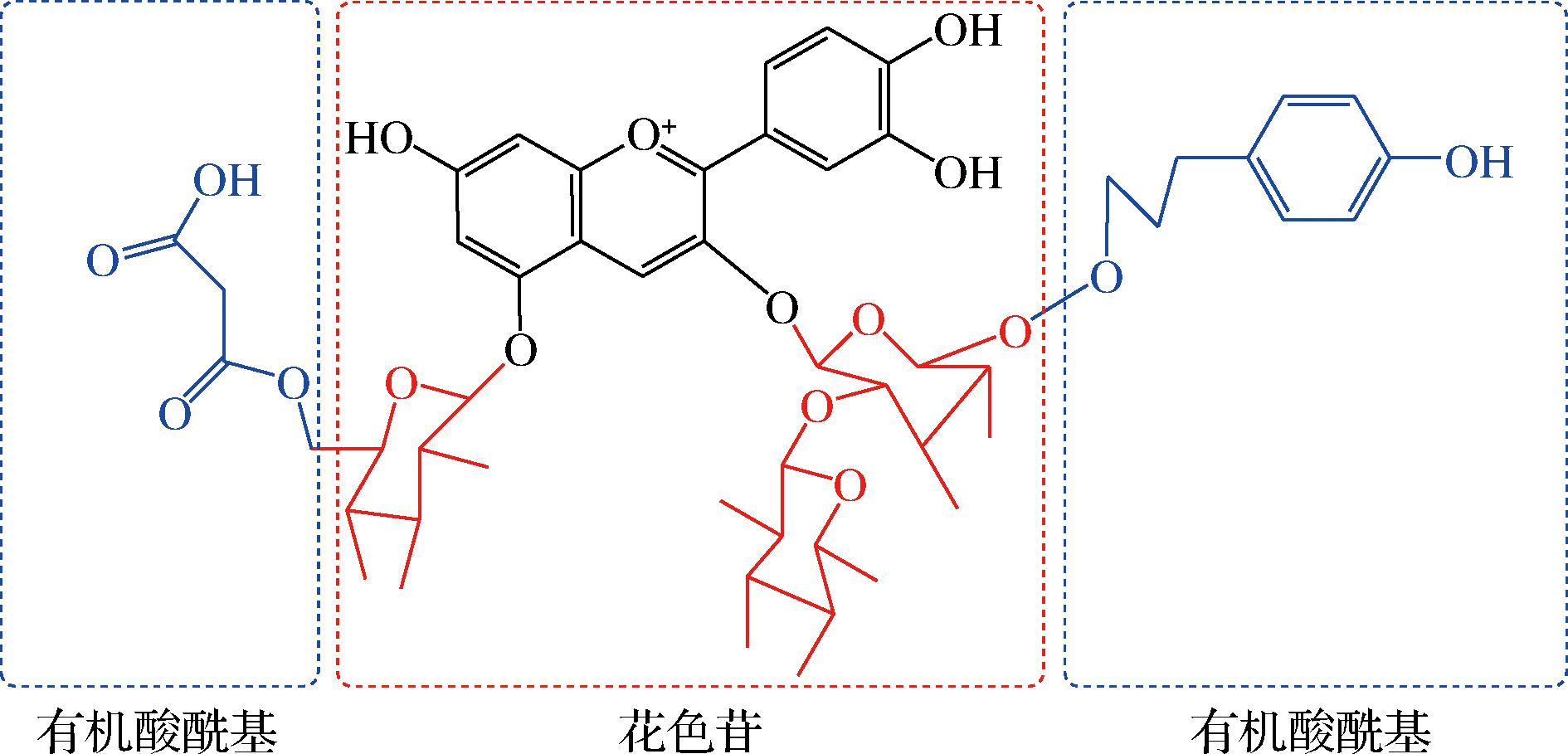
图2 花色苷酰基化结构示意图
Fig.2 Schematic structure of anthocyanin acylation
酰基基团一般结合在C3、C5和C6位点。单酰化的花色苷酰基经常连接在单糖的C6—OH处,其次易连接在C3—OH[11]。如在酰化形式中对羟基甲苯酸、丙二酸、苹果酸、乙酸、草酸等一般与3号位上的6—OH发生酯化反应,也存在于单糖的2—OH、3—OH 和4—OH发生酯化反应的花色苷,而芥子酸、阿魏酸、咖啡酸等通常结合在花色苷糖分子3号位上(也称花青素-3-糖苷),除此之外丙酮酸可以通过缩合连接在C4和C5处[12]。另一方面,多个有机酸可同时连接在一个位点形成多酰基结构[13]。如2个有机酸结合在花色苷糖分子3,5号位上(也称花青素-3,5-二糖苷)。上述花色苷具有较糖基化花色苷更高的稳定性[2]。主要原因是花色苷与有机酸结合的过程中形成了一个类似“三明治”的可折叠长链结构(图2),该结构能有效防止花色苷的水解,从而增强其稳定性[14]。该结构在红菜薹、紫山药和黑果枸杞等植物资源中比较常见(表2)。综上,花色苷的生物合成是花青素先糖基化、再酰基化的过程。以矢车菊为例,其生物合成途径首先是在糖基转移酶作用下转化为矢车菊-3-O-葡萄糖苷,再经过酰基转移酶变成矢车菊-3-O-(6″-丙二酰)-葡萄糖苷(图3)[15]。
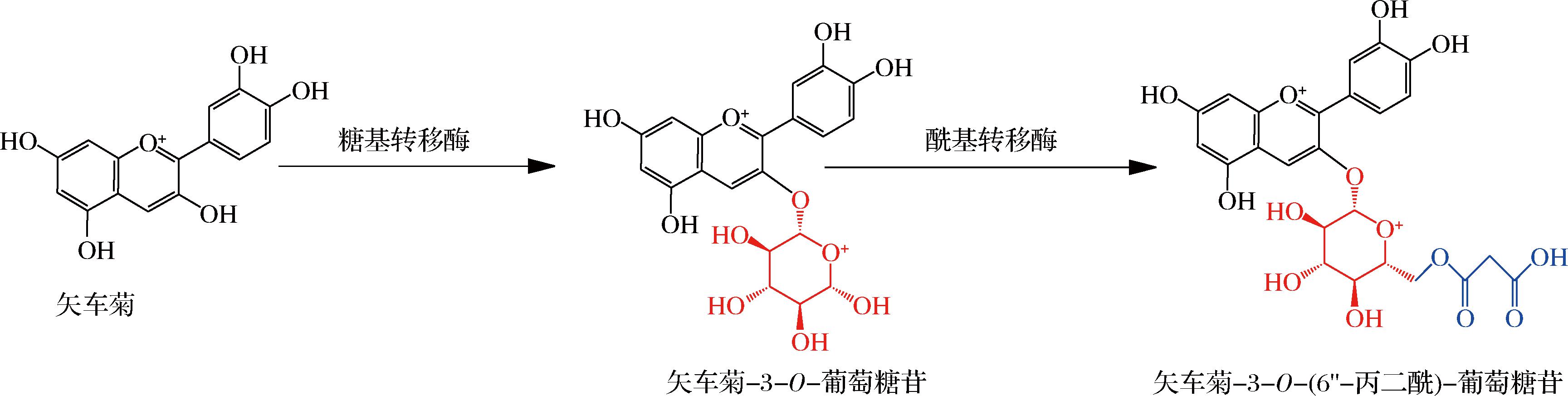
图3 矢车菊色素的糖基化和酰基化
Fig.3 Glycosylation and acylation of cyanidins
表2 五种植物中酰基化花色苷及含量
Table 2 Five acylated anthocyanosides and their contents

名称酰基化花色苷占总花色苷含量/%参考文献红菜薹矢车菊-3-丙二酰-槐糖苷-5-葡萄糖苷矢车菊-3-对香豆酰-丙二酰-葡萄糖苷-5-葡萄糖苷矢车菊-3-阿魏酰-丙二酰-槐糖苷-5-葡萄糖苷矢车菊-3-芥子酰-阿魏酸-槐糖苷-5-丙二酰-葡萄糖苷矢车菊-3-对香豆酰-芥子酰-槐糖苷-5-丙二酰-5-葡萄糖苷矢车菊-3-对香豆酰-丙二酰-葡萄糖苷-5-葡萄糖苷4.5045.2528.728.799.488.95[16]
续表2

名称酰基化花色苷占总花色苷含量/%参考文献紫山药矢车菊-3-芥子酰-葡萄糖苷-5-葡萄糖苷矢车菊-3-芥子酰-葡萄糖苷矢车菊-3-阿魏酸-葡萄糖苷-5-葡萄糖苷36.6753.932.61[17]紫色马铃薯芍药-3-对香豆酰-芸香糖苷-5-葡萄糖苷矮牵牛-3-咖啡酰-芸香糖苷-5-葡萄糖苷矮牵牛-3-对香豆酰-芸香糖苷-5-葡萄糖苷22.003.0061.90[18]黑果枸杞矮牵牛-3-(6-对香豆酰-芸香糖苷)-5-葡萄糖苷矮牵牛-3-顺式香豆酸-芸香糖苷-5-葡萄糖苷矮牵牛-3-反式香豆酸-芸香糖苷-5-葡萄糖苷锦葵-3-(6-对香豆酰)-葡糖糖苷锦葵-3-(6-对香豆酰-3-乙酰)-5-二葡萄糖苷飞燕草-3-反式香豆酸-芸香糖苷-5-葡萄糖苷11.795.7864.085.2468.353.68[4]紫包菜矢车菊-3-芥子酸-葡萄糖苷-5-葡萄糖苷矢车菊-3-芥子酸-槐糖苷-5-葡萄糖苷矢车菊-3-香豆酸-槐糖苷-5-葡萄糖苷矢车菊-3-二芥子酸-葡萄糖苷-5-葡萄糖苷矢车菊-3-咖啡酸-对香豆酸-槐糖苷-5-葡萄糖苷矢车菊-3-阿魏酸-芥子酸-槐糖苷-5-葡萄糖苷矢车菊-3-芥子酸-香豆酸-槐糖苷-5-葡萄糖苷矢车菊-3-二芥子酸-槐糖苷-5-葡萄糖苷12.0020.778.255.253.558.939.4616.82[19]
2 酰基化花色苷的稳定性
前期研究发现酰基化花色苷稳定性较强,对pH值、光照、温度以及金属离子等外部因素都具有较强抵抗力[13],而酰基结构的结合位置、数目和种类又会影响花色苷的稳定性。其中,C位上的酰基基团允许分子折叠和分子内堆积以及自由旋转,能提高花色苷的稳定性,丙二酸酰基结合在花色苷C3′位时比C6′位更稳定[20]。酰基的数量对其稳定性也有影响,多酰基花色苷稳定性好于单酰基花色苷,其原因可能是疏水作用使花色苷母核和酰基的平面形成了层状结构,更好地保护了2个有机酸中间的花色苷母核[13]。此外,不同的酰基种类对花色苷稳定性也会有影响,如脂肪族酰基具有疏水性和空间位阻效应,芳香族酰基能够促进花色苷分子内复合物的形成,二者均能提高花色苷分子的稳定性,但芳香族酰基稳定能力比脂肪族酰基强[21]。研究还发现咖啡酸能提高花色苷的稳定性,其次为香豆酸、阿魏酸。除稳定性外酰基基团对花色苷颜色也有影响,其影响大小分别为:酰基化的花色苷>未酰基化花色苷;香豆酰化花色苷>乙酰化花色苷;顺式香豆酰化花色苷>反式香豆酰化花色苷[22]。这对花色苷的广泛使用(例如作为天然色素以及用于治疗心血管疾病、癌症及糖尿病等疾病的天然药物)具有重要的现实意义。因此,讨论上述因素对酰基化花色苷稳定性的影响可为其开发利用提供科学依据。
2.1 pH值对酰基化花色苷稳定性的影响
花色苷在不同的pH值下会呈现出不同的颜色以及吸光度值(图4)[23-24]。而酰基化花色苷在广泛的pH值范围内均表现出较强的稳定性,尤其是在微酸性至中性条件下,其稳定性更加显著[25]。例如,蒋希芝等[26]研究发现随pH值从2至8,桑葚花色苷浓度发生显著变化,桑葚花色苷浓度从接近酰基化花色苷的2倍到基本没有变化再到约为酰基化花色苷的2倍,相反酰基化花色苷浓度整个过程几乎没有受到pH变化的影响,尤其在强酸性和强碱性环境下更稳定。这是由于在中性或弱酸性条件下花色苷吡喃环的酰基堆积减少了花色苷对水亲核攻击的敏感、防止了花色苷形成查尔酮或甲碱结构而失色[25]。另一方面,酰基化花色苷会通过分子内共色和空间位阻的作用保护黄嘌呤发色团不受水的亲核攻击,从而呈现较好的稳定性[27]。相反地,非酰基化花色苷在该条件下则会快速裂解并脱色。因此,花色苷在不同pH下呈现不同颜色可作为食品中的着色剂。例如,紫色茴香叶经鉴定后显示酰基化花色苷含量较高,而未经过酰基化修饰的花色苷含量较少,因此在食品工业中可作为天然色素加以利用[28]。此外,胡萝卜中也含有大量用于食品着色剂的单酰基化花色苷[29]。同时,前期研究也发现在相同的pH值条件下,聚酰化反应(即多个芳香取代基发生结合)会使花色苷的稳定性提高,还会使其色调偏向蓝色,这能改善天然色素中蓝色色调比较欠缺的现实,对食品、化妆品等行业具有积极意义。需要注意的是,其他的因素(如纯度)也会影响到酰基化花色苷在不同pH值条件下的呈色效果。
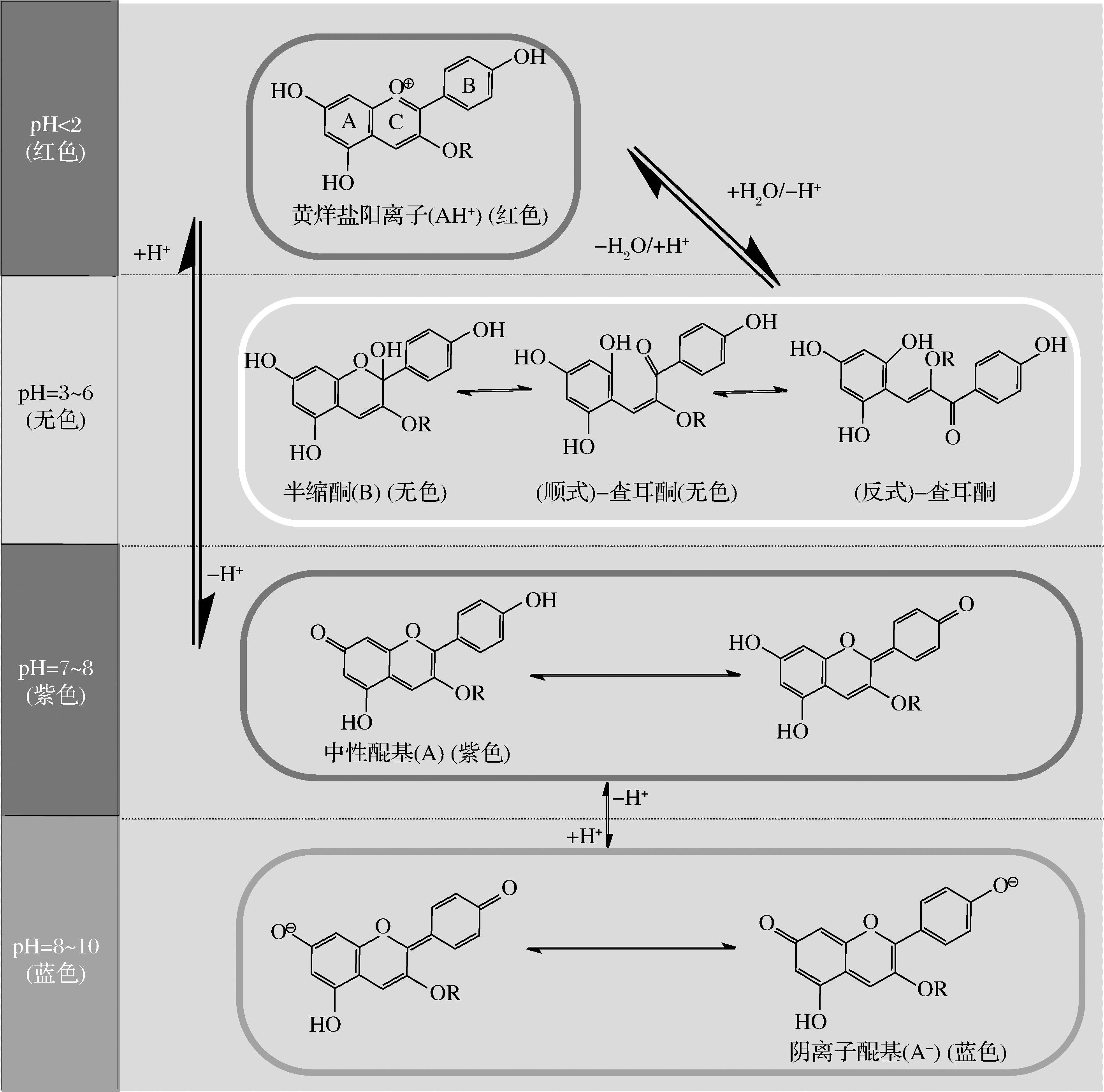
图4 花青素在不同pH值下的结构转变
Fig.4 Structural transformation of anthocyanins at different pH values
2.2 温度对酰基化花色苷稳定性的影响
随着温度的升高花色苷稳定性逐渐降低,花色苷转变为无色甲醇假碱和查尔酮[30],而当温度降低时,甲醇假碱和醌型碱会快速变成花色苷苷元正离子,维持花色苷色泽,但查尔酮却无法恢复为花色苷苷元正离子,而是被快速氧化并导致颜色的改变(褪色)[31]。而酰基化花色苷在一定程度上能提高其稳定性。例如,在60、80、90、100 ℃下研究蓝莓果渣花色苷和酰基化蓝莓果渣花色苷热降解过程,发现酰基化蓝莓果渣花色苷比蓝莓果渣花色苷有较低的速率常数和更长的半衰期[32]。此外,张俊俊等[33]发现将玫瑰茄花色苷乙酰化后可有效提高花色苷对光照和温度的稳定性。需要注意的是,天然花色苷并非全是酰基化的花色苷,这会使得酰基化花色苷对温度的抗性优势在食品加工及储存等过程中无法发挥,而花色苷的酰基化改性则是很好的解决途径。这为天然花色苷的应用提供了参考方法。
2.3 光照对酰基化花色苷稳定性的影响
光照对花色苷稳定性的影响最为显著,因为光照会诱导花色苷的碳骨架发生改变,破坏其结构。然而,当花色苷上的碳骨架被有机酸等占据,即被酰基化之后,其碳骨架的破坏进程则会被终止或延缓,会增加其稳定性[34]。前期研究显示经紫外光照射后的酰基化花色苷较未酰基化花色苷的残留率更高[35]。此外,在相同光照作用下,乙酰化玫瑰茄花色苷比玫瑰茄花色苷呈现了更高的保存率[33]。主要原因是乙酰化花色苷的酰基是通过酰化反应与花色苷分子上的羟基原子连接,形成一个相对稳定的化学酯键;而未乙酰化的花色苷结构上的羟基原子则暴露在外,易发生光降解。另外,相同光照条件下,内源性酰基化花色苷的降解速率最慢,残留率最高,其次是酶促酰化的花色苷,而二者对光照的稳定性均强于未酰基化的花色苷[35]。原因可能是酶促酰化反应的效率达不到内源性酰基化花色苷的水平,导致形成的化学酯键数量较少,即对花色苷结构上羟基原子的保护不够。
2.4 金属离子对酰基化花色苷稳定性的影响
由于花色苷结构中具有邻位羟基,易与金属离子(如Ca2+、Fe3+、Cu2+等)结合,从而对花色苷的稳定性和辅色效果起到增强作用,而金属离子的不同对花色苷的影响也有差异[36]。据报道,Na+、Mg2+和K+加入后彩色马铃薯花色苷保留率能达到95%以上,但对其颜色几乎无影响[37]。而Fe3+的加入使紫甘蓝花色苷颜色由红、蓝变为黄、绿,其保留率24 h后仅有18.764%。保留率的降低可能是由于Fe3+本身具有氧化性,两者共存时,花色苷B环上的二羟基基团会与Fe3+发生络合作用而破坏花色苷结构中的酚羟基[38]。也有研究展示添加Fe2+实际上对二酰基化花色苷有保护作用,二酰基化花色苷能强烈结合铁(可能是π-堆积相互作用的结果),但对非酰基化和单酰基化花色苷却出乎意料地有害[39]。因此,鉴于金属离子对花色苷的影响,在花色苷的加工处理过程中应避免与有特殊金属离子的包装或材料接触。
3 酰基化花色苷的降血糖作用
2型糖尿病(type 2 diabetes mellitus, T2DM)是一种由多因素导致系统代谢紊乱的疾病,可能由胰岛β细胞的胰岛素分泌缺陷、肝糖原输出量增加和脂代谢紊乱等造成[40]。目前,采用植物性来源的降血糖制剂(例如植物多酚)来进行T2DM的预防和治疗是热点研究之一,它可以避免阿卡波糖和伏格列波糖等化学性药物在使用过程中带来的副作用,例如胃肠道剧烈反应、细胞耐药性增强等[41]。前期研究表明植物多酚调控血糖主要是通过以下途径进行(图5):1)作为α-葡萄糖苷酶等消化酶的抑制剂;2)通过调节葡萄糖转运载体-2(glucose transport protein-2, GLUT-2)和钠-葡萄糖共转运体-1(sodium-glucose co-transporter-1, SGLT-1)的信使核糖核酸(messenger RNA, mRNA)表达量,以延缓葡萄糖进入血液;3)通过抗氧化、清除自由基等作用保护调节血糖的肝脏组织;4)通过对胰腺的保护发挥降血糖作用;5)通过对肝细胞组织基因进行干预,改变基因的表达效果、促进糖原合成调节血糖[42]。因此,从上述5个方面来分析酰基化花色苷的降血糖潜力,为深入开发酰基化花色苷作为安全、有效的降血糖制剂提供科学依据。
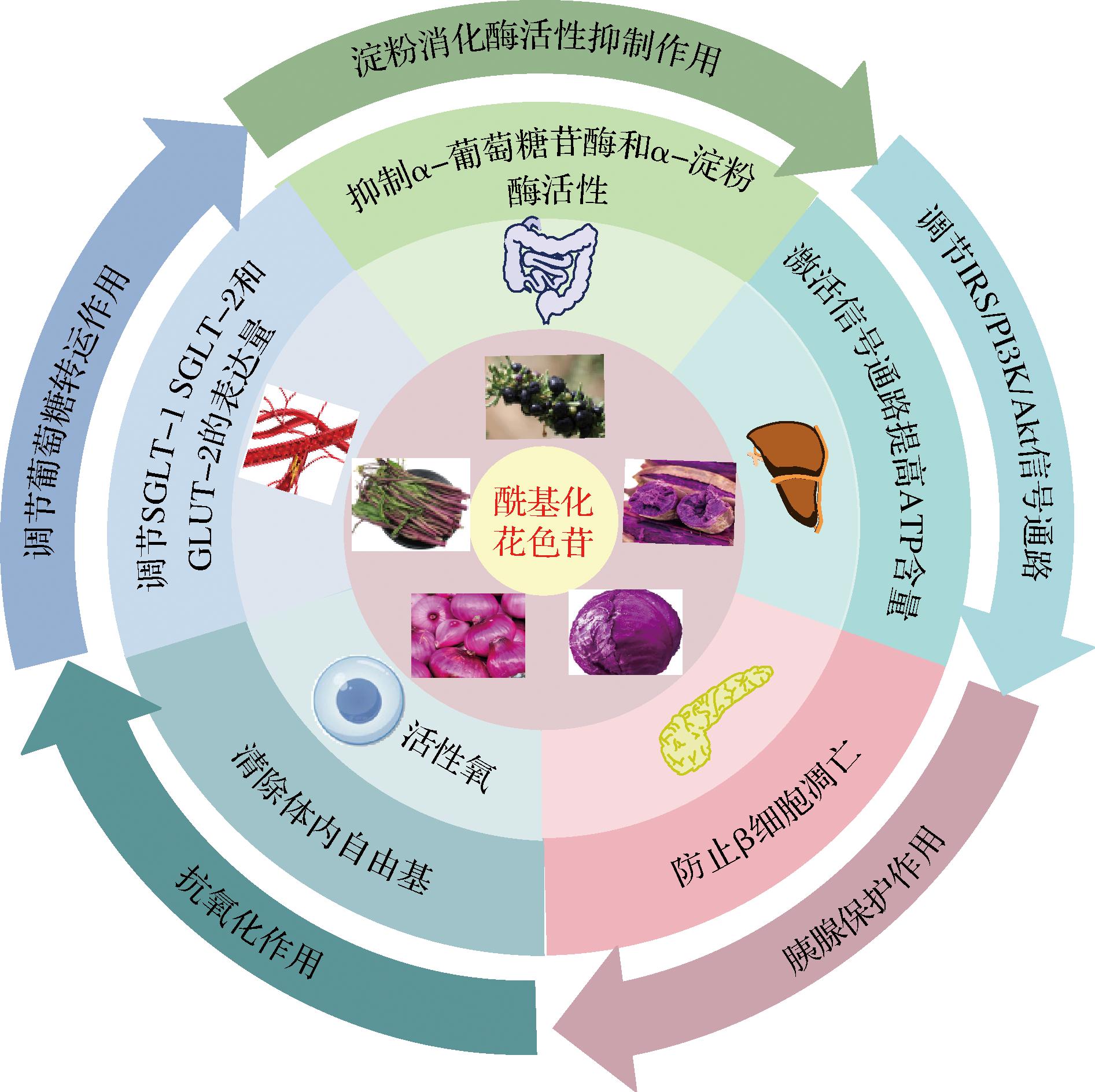
图5 酰基化花色苷降血糖途径
Fig.5 Hypoglycemic pathway of acylated anthocyanins
3.1 淀粉消化酶活性抑制作用
α-葡萄糖苷酶和α-淀粉酶是碳水化合物消化过程中必不可少的2种淀粉消化关键酶。具体地,α-淀粉酶作为内水解酶,会以淀粉作为底物,将其内部的α-1,4葡萄糖苷键切割成低聚糖,从而分解淀粉[43]。紧接着α-葡萄糖苷酶会切开低聚糖非还原末端的α-1,4糖苷键产生单糖,并被人体吸收[44]。因此,对糖尿病治疗可以通过抑制淀粉消化关键酶的活性[45]。花色苷A环C3和C环C5、C7位置通常会链接不同的糖苷基团,这些基团上也会链接不同的有机酸形成酰基化结构。前期研究表明,拥有酰基化结构的花色苷能较好地抑制α-淀粉酶和α-葡萄糖苷酶的活性[46]。此外,杨扬[47]研究了紫薯中单酰基花色苷和双酰基花色苷对2种淀粉消化关键酶的抑制效果,发现紫薯双酰基花色苷对2种酶的抑制作用要强于紫薯单酰基花色苷,并表现出“剂量-效应”关系,属于优良的淀粉消化关键酶抑制剂。
此外,王自超[4]也研究了以酰基化花色苷为主的黑果枸杞花色苷对α-葡萄糖苷酶的抑制作用,结果显示消化前后该花色苷抑制α-葡萄糖苷酶活性的IC50值分别为1.35、0.83 μg/mL,说明消化后黑果枸杞花色苷对α-葡萄糖苷酶活性抑制作用明显强于消化前的,且抑制效果随花色苷浓度升高而增强。原因可能是:C4、C7、C3、C4′和C5′位置为黑果枸杞花色苷与α-葡萄糖苷酶结合的潜在位点,上述位置—OH和C![]() O数目越多,结合α-葡萄糖苷酶的强度越大。花色苷在酸性条件下十分稳定,但在小肠(碱性)和其他条件的共同作用下C3和C5位置上的糖苷键易被打断,从而释放出稳定性较差的花色苷苷元,易与—OH、—OCH3等基团链接成新的花青素,—OH数量增多。此外,酰基化花色苷稳定性较强,部分能顺利到达小肠环境,且较糖基化花青素上—OH和C
O数目越多,结合α-葡萄糖苷酶的强度越大。花色苷在酸性条件下十分稳定,但在小肠(碱性)和其他条件的共同作用下C3和C5位置上的糖苷键易被打断,从而释放出稳定性较差的花色苷苷元,易与—OH、—OCH3等基团链接成新的花青素,—OH数量增多。此外,酰基化花色苷稳定性较强,部分能顺利到达小肠环境,且较糖基化花青素上—OH和C![]() O数量更多,能更好地抑制消化酶活性。ZHANG等[48]研究结果发现,花青素比糖基化花青素表现出更强的α-葡萄糖苷酶抑制活性,原因可能是糖苷去除后,花青素多出一个—OH(位于C环C3位),该结果与先前报道一致。因此,酰基化花色苷的稳定性确保其顺利到达小肠,加之其—OH和C
O数量更多,能更好地抑制消化酶活性。ZHANG等[48]研究结果发现,花青素比糖基化花青素表现出更强的α-葡萄糖苷酶抑制活性,原因可能是糖苷去除后,花青素多出一个—OH(位于C环C3位),该结果与先前报道一致。因此,酰基化花色苷的稳定性确保其顺利到达小肠,加之其—OH和C![]() O的数量较多,释放出花色苷苷元后也能使—OH数量增多,从而达到更好的抑制效果。
O的数量较多,释放出花色苷苷元后也能使—OH数量增多,从而达到更好的抑制效果。
3.2 调节葡萄糖转运作用
钠葡萄糖共转运蛋白主要负责肾近端小管葡萄糖的重吸收来维持血糖的稳定。该蛋白主要包括SGLT-1、SGLT-2两类。其中,近端小管3段10%的葡萄糖由SGLT-1受体负责吸收,而近端小管1段和2段90%的葡萄糖主要靠SGLT-2受体的重吸收[49]。因此,钠葡萄糖共转运蛋白-2抑制剂(SGLT-2i)的研发能够阻止葡萄糖的重吸收,使体内多余的糖分通过尿液的形式排出,缓解机体的血糖压力进而达到降血糖的目的(如达格列净)[50]。前期研究发现,在消化过程中酰基化花色苷比未酰基化花色苷更能降低糖尿病风险[51]。原因可能是酰基化花色苷具有益生菌的特性,当肠道微生物群对其进行代谢时,葡萄糖转运蛋白参与了花色苷的吸收;花色苷酰基基团与Na+竞争SGLT上活性位点,改变了SGLT结构使葡萄糖无法链接到SGLT上,葡萄糖以尿液排出。
此外,SGLT-1能将葡萄糖通过主动运输转运到细胞中,然后再通过GLUT-2经被动运输转运到血液中,而GLUT-2 mRNA表达量的减少会导致胰岛素对葡萄糖的敏感性减弱,引发糖尿病[52]。综上所述,酰基化花色苷可通过调节SGLT-1、SGLT-2和GLUT-2的表达量来缓解T2DM。
3.3 抗氧化作用
抗氧化是花色苷重要的生物活性之一。花色苷可以通过清除体内过剩的自由基来避免身体过氧化损伤,并利用自身的酚羟基中和细胞内过多的过氧化分子,防止自由基损伤和继发性胰岛素抵抗的发生,达到降血糖的作用[53]。但是,如前文所述,酰基化花色苷是由花青素经糖基化和酰基化最终形成的,不同的酰基基团对花色苷的抗氧化活性的影响也不同。有研究表明酰基化会增强花色苷的抗氧化能力。例如,将玫瑰茄花色苷通过脂肪酶酰化后,酰化的花色苷比未酰化花色苷抗氧化能力要强,其中清除DPPH自由基的IC50值分别为22.917、4.451 μg/mL;ABTS阳离子自由基的IC50值分别为19.443、7.76 μg/mL,说明酰基化显著提高了花色苷的抗氧化活性[36]。LIU等[10]也发现酰基化的蓝莓花色苷不仅具有较强的稳定性,还表现了强于未酰基化花色苷的抗氧化活性。洪森辉等[54]的研究结果也是如此。原因可能是对香豆酸和咖啡酸等有机酸的引入,使得原有花青素结构中的羟基数量未减少,甚至增多,这也提示在进行酰基化处理的时候应该采用对香豆酸和咖啡酸等有机酸。
相反,在酰基化花色苷合成过程中,花青素结构中的酚羟基等活性部分被糖苷以及有机酸等取代,会形成长链从而增加花色苷结构的复杂性,导致其抗氧化活性的降低,即花色苷的抗氧化能力是随其结构复杂程度的增加而降低的[19,55]。例如,李敏[19]对紫心甘薯(84.67%)、紫包菜(72.29%)、黑莓(1.8%)、蓝莓和黑米麸皮(未检出)中酰基化花色苷含量、DPPH自由基清除能力和铁氧还原力进行测定发现它们对2种自由基的清除能力依次为:黑莓>黑米麸皮>蓝莓>紫心甘薯>紫包菜。这种现象的原因可能是:1)不同形态的花色苷其抗氧化活性不同,其中抗氧化活性依次为游离的花色苷苷元>花色苷>酰基化花色苷;2)酰基化花色苷中,矢车菊基抗氧化活性大于芍药基,咖啡酸酰化的芍药基抗氧化活性是糖基化的芍药基的3.5倍,但酰基化的矢车菊基花色苷与糖基化的矢车菊基花色苷却具有相同的活性。此外,栾浩[32]研究了酰基化和未酰基化的蓝莓果渣花色苷的抗氧化能力,结果与上述论断一致。因此,酰基化是影响花色苷抗氧化活性的主要原因之一。
3.4 胰腺保护作用
胰岛素分泌异常与胰腺细胞的损伤或胰岛β细胞凋亡有关。而胰岛β细胞凋亡主要受内源性途径(线粒体凋亡信号途径)、外源性途径(死亡受体介导的信号途径)以及颗粒酶B途径调控[56]。这些途径的共同特征是能释放特定的信号来激活半胱天冬蛋白酶,以此破坏该细胞的结构并影响其代谢,从而导致该细胞具有特有的形态和生化条件,并使该细胞凋亡[57]。除此之外,TNF-α、γ-干扰素(interferon-γ,IFN-γ)和IL-1β等细胞因子可通过激活各种核转录因子来调节诱导β细胞的凋亡[58]。SHEN等[59]利用紫薯双酰基花色苷研究其对高血糖症小鼠的缓解机制,结果显示该花色苷能够恢复小鼠肾脏中与糖类代谢有关的mRNA水平,既促进了糖类的代谢还能缓解肾脏的炎症和损伤,对胰腺起到有效保护。另外,酰基化花色苷还能通过减缓氧化应激、下调促凋亡蛋白的表达来减少β细胞凋亡[60]。
另外,糖尿病患者往往会伴有炎症的发生,而炎症因子水平的紊乱会导致胰腺促凋亡蛋白表达的增加,也会使β细胞凋亡。如,高血糖水平会诱发硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)的表达并进一步促使NOD-样受体蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)的激活,从而使IL-1β释放并导致β细胞凋亡,而TXNIP蛋白介导的炎症反应和氧化应激会诱导胰岛β细胞凋亡和胰岛的功能下降[56]。因此,通过减少TXNIP等促凋亡蛋白的表达能有效保护胰腺功能。
3.5 调节IRS/PI3K/Akt信号通路作用
糖尿病的发生与胰腺分泌胰岛素障碍及胰岛素抵抗(insulin resistance,IR)有关。胰岛素受体底物(insulin receptor substrate,IRS)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B磷酸化(IRS/PI3K/Akt)是肝脏细胞中与胰岛素抵抗相关的重要信号传递通路,能够调节肝脏细胞对糖分的摄取和利用,维持机体内葡萄糖水平的稳态[61]。综上所述,激活IRS/PI3K/Akt信号通路能达到缓解胰岛素抵抗的目的。前期研究发现Pt3R5G能有效促进Hep-G2细胞(由高糖和棕榈酸诱导的胰岛素抵抗模型)对糖的消耗,与二甲双胍效果无明显区别,这与Pt3R5G使IRS2磷酸化,激活PI3K让Akt磷酸化,最终激活IRS/PI3K/Akt信号通路有关,该信号通路的激活促进了肝脏细胞的糖代谢[62]。此外,Akt被激活之后,促使下游的糖原合成酶激酶3β(GSK3β)和FOXO1蛋白的磷酸化,从而加速葡萄糖分解和利用,增加糖原合成。
此外,线粒体是细胞的“能量工厂”,参与了细胞的代谢与调控,线粒体的损伤与否与胰岛素敏感性有密不可分的联系。前期研究发现,主要成分为酰基化花色苷的黑果枸杞花色苷能够缓解线粒体氧化应激的压力,使其ATP含量回升并提高其膜电位(membrane potential,MMP)水平,从而有效防止其损伤,进而改善其功能并增强其对葡萄糖的利用[63]。因此,激活IRS/PI3K/Akt通路并改善线粒体功能是酰基化花色苷有效缓解胰岛素抵抗的主要途径。
4 总结与展望
酰基化花色苷的消化始于口腔中的β-葡萄糖苷酶,随后部分在胃部被胆汁酸转运酶分解,由于酰基化使花色苷稳定性增强,大部分能顺利到达小肠被分解为苷元,通过葡萄糖转运蛋白吸收。小肠作为葡萄糖的主要吸收地,花色苷与微生物的相互作用能丰富肠道菌群,增强肠道屏蔽的完整性。此外,酰基化花色苷除稳定性有所提高外,对pH值、光照以及温度的抵抗力也有所提升,故酰基化花色苷的摄入对人体不仅安全无害,还有助于人体消化、抗氧化和降血糖等。因而具有开发成为辅助降血糖的功能性食品和保健品的潜力。例如富含酰基化花色苷的枸杞被开发为灵芝枸杞袋泡茶保健品、以蓝莓渣和刺梨渣为原料研制的蓝莓刺梨复合口服液,均具有降血糖功效,但目前酰基化花色苷开发仍比较缺乏。同市面上以苦瓜和桑叶为主的降血糖产品相比,酰基化花色苷产品稳定性更强能发挥更大功效,不需添加其他药物实现了安全有效的治疗效果;并且酰基化花色苷来源广泛,能提高对其他植物资源的利用率;最后,经试验证明酰基化花色苷同治疗药物如达格列净、阿卡波糖和伏格列波糖相比,其降血糖效果明显。但在膳食体系中,酰基化花色苷并非单独存在,开发成降血糖药物仍需要更多研究探索。因此,在后期的研究中应该强化对酰基化花色苷与其他膳食成分(如蛋白质、膳食纤维等)之间的相互作用及该作用对二者功能活性影响的研究。
[1] WU T, ZHU W Y, CHEN L Y, et al.A review of natural plant extracts in beverages:Extraction process, nutritional function, and safety evaluation[J].Food Research International, 2023, 172:113185.
[2] 陈曦, 仝争, 王渝, 等.花色苷的功能及其稳态化保持技术研究进展[J].农产品加工, 2021(22):57-60;65.
CHEN X, TONG Z, WANG Y, et al.Research progress of the health functions of anthocyanin and its stable maintenance technology[J].Farm Products Processing, 2021(22):57-60;65.
[3] 赵文鹏, 赵昌玉, 单洪雁, 等.花色苷在不同环境因素和食品基质中的降解规律[J].轻工学报, 2023, 38(2):41-47.
ZHAO W P, ZHAO C Y, SHAN H Y, et al.Degradation rules of anthocyanin in different environmental factors and food matrices[J].Journal of Light Industry, 2023, 38(2):41-47.
[4] 王自超. 黑果枸杞产地溯源及其花色苷降血糖机理[D].西安:陕西师范大学, 2020.
WANG Z C.Tracing the origin of black fruit wolfberry and its anthocyanin hypoglycemic mechanism[D].Xi’an:Shaanxi Normal University, 2020.
[5] QI Q Q, CHU M J, YU X T, et al.Anthocyanins and proanthocyanidins:Chemical structures, food sources, bioactivities, and product development[J].Food Reviews International, 2023, 39(7):4581-4609.
[6] LIU Y, TIKUNOV Y, SCHOUTEN R E, et al.Anthocyanin biosynthesis and degradation mechanisms in Solanaceous vegetables:A review[J].Frontiers in Chemistry, 2018, 6:52.
[7] ZHAO C L, CHEN Z J, BAI X S, et al.Structure-activity relationships of anthocyanidin glycosylation[J].Molecular Diversity, 2014, 18(3):687-700.
[8] CHEN X Q, LI Z H, WANG Z J, et al.Ultrasound-assisted extraction of total anthocyanins from Rubia sylvatica Nakai fruit and radical scavenging activity of the extract[J].Industrial Crops and Products, 2020, 150:112420.
[9] 闫亚美, 代彦满, 冉林武, 等.黑果枸杞与5种果蔬中花色苷组成及体外抗氧化活性比较[J].食品工业科技, 2014, 35(16):133-136.
YAN Y M, DAI Y M, RAN L W, et al.Composition and in vitro antioxidant activity of anthocyanins extracted from Lycium ruthenicum Murr., different fruits and vegetables[J].Science and Technology of Food Industry, 2014, 35(16):133-136.
[10] LIU J N, ZHUANG Y H, HU Y H, et al.Improving the color stability and antioxidation activity of blueberry anthocyanins by enzymatic acylation with p-coumaric acid and caffeic acid[J].LWT, 2020, 130:109673.
[11] ZHAO C L, YU Y Q, CHEN Z J, et al.Stability-increasing effects of anthocyanin glycosyl acylation[J].Food Chemistry, 2017, 214:119-128.
[12] MOLONEY M, ROBBINS R J, COLLINS T M, et al.Red cabbage anthocyanins:The influence of D-glucose acylation by hydroxycinnamic acids on their structural transformations in acidic to mildly alkaline conditions and on the resulting color[J].Dyes and Pigments, 2018, 158:342-352.
[13] VIDANA GAMAGE G C, LIM Y Y, CHOO W S.Sources and relative stabilities of acylated and nonacylated anthocyanins in beverage systems[J].Journal of Food Science and Technology, 2022, 59(3):831-845.
[14] 蓓. 桑椹花青素的酰基化和甲基化修饰及其生物学特性研究[D].镇江:江苏科技大学, 2020.
ZHANG B.Studies on the acylation and methylation modification and biological characters of anthocyanin from mulberry[D].Zhenjiang:Jiangsu University of Science and Technology, 2020.
[15] 王海歌, 鲍梦圆, 徐心雨, 等.植物食材花青素结构特性及对其功效机制研究进展[J].中国食品添加剂, 2024, 35(2):299-307.
WANG H G, BAO M Y, XU X Y, et al.Research progress on the structural characteristics of anthocyanins in plant food and their efficacy mechanism[J].China Food Additives, 2024, 35(2):299-307.
[16] 宋亚, 方佳宁, 朱祝军, 等.鲜切红菜薹中有机酸和花青苷在货架贮藏过程中的变化[J].食品工业科技, 2016, 37(20):300-305.
SONG Y, FANG J N, ZHU Z J, et al.Changes in organic acids and anthocyanins contents during shelf storage of fresh-cut Purple Caitai (Brassica campestris L.ssp.chinensis L.var.purpurea Bailey)[J].Science and Technology of Food Industry, 2016, 37(20):300-305.
[17] 薛瑾. 基于花青素的三文鱼新鲜度指示型包装材料研究[D].镇江:江苏大学, 2019.
XUE J.Research on freshness indicator packaging material of salmon based on anthocyanin[D].Zhenjiang:Jiangsu University, 2019.
[18] 李华伟, 罗文彬, 李国良, 等.4个彩色马铃薯品种花青素组分和含量比较分析[J].现代食品科技, 2024, 40(7):44-52.
LI H W, LUO W B, LI G L, et al.Comparative analysis of the anthocyanin composition and contents of four potato varieties with colored flesh[J].Modern Food Science and Technology, 2024, 40(7):44-52.
[19] 李敏. 不同花青素提取物的组成、稳定性及抗氧化性比较研究[D].南京:南京财经大学, 2013.
LI M.Study on component analysis, stability and oxidation resistance of different anthocyanins[D].Nanjing:Nanjing University of Finance and Economics, 2013.
[20] CHARRON C S, KURILICH A C, CLEVIDENCE B A, et al.Bioavailability of anthocyanins from purple carrot juice:Effects of acylation and plant matrix[J].Journal of Agricultural and Food Chemistry, 2009, 57(4):1226-1230.
[21] LI Z Y, TENG W, XIE X, et al.Enzymatic acylation of cyanidin-3-O-glucoside with aromatic and aliphatic acid methyl ester:Structure-stability relationships of acylated derivatives[J].Food Research International, 2024, 192:114824.
[22] HAN F L, JIANG S P, HE J J, et al.Anthocyanins in ‘cabernet gernischet’ (Vitis vinifera L.cv.) aged red wine and their color in aqueous solution analyzed by partial least square regression[J].Food Science and Biotechnology:Food Science and Biotechnology, 2009, 18(3):724-731.
[23] 滕威. 甲酯物酶法酰化对花色苷稳定性及其活性的影响研究[D].沈阳:沈阳农业大学, 2022.
TENG W.Enzymatic acylation of cyanidin-3-O-glucoside with methyl ester as donor:Stability and activity of the acylated derivatives[D].Shenyang:Shenyang Agricultural, 2022.
[24] YAN Y Z, NISAR T, FANG Z X, et al.Current developments on chemical compositions, biosynthesis, color properties and health benefits of black goji anthocyanins:An updated review[J].Horticulturae, 2022, 8(11):1033.
[25] B![]() KOWSKA A, KUCHARSKA A Z, OSZMIA
KOWSKA A, KUCHARSKA A Z, OSZMIA SKI J.The effects of heating, UV irradiation, and storage on stability of the anthocyanin-polyphenol copigment complex[J].Food Chemistry, 2003, 81(3):349-355.
SKI J.The effects of heating, UV irradiation, and storage on stability of the anthocyanin-polyphenol copigment complex[J].Food Chemistry, 2003, 81(3):349-355.
[26] 蒋希芝, 徐磊, 张蓓, 等.基于生物酶法的酰基化桑椹花青素的制备与特性[J].农业工程学报, 2021, 37(3):294-301.
JIANG X Z, XU L, ZHANG B, et al.Preparation and characterization of acylated mulberry anthocyanins using biological enzyme method[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(3):294-301.
[27] LUO X E, WANG R Y, WANG J H, et al.Acylation of anthocyanins and their applications in the food industry:Mechanisms and recent research advances[J].Foods, 2022, 11(14):2166.
[28] 董远航. 茴香叶花色苷生物合成与香气物质积累的分子调控机理[D].郑州:郑州大学, 2022.
DONG Y H.Molecular regulation mechanism of anthocyanin accumulation and aroma formation in fennel leaf[D].Zhengzhou:Zhengzhou University, 2022.
[29] IORIZZO M, CURABA J, POTTORFF M, et al.Carrot anthocyanins genetics and genomics:Status and perspectives to improve its application for the food colorant industry[J].Genes, 2020, 11(8):906.
[30] 潘颖, 梁颖, 马蓉, 等.紫甘蓝花色昔稳定性及热降解动力学研究[J].食品工业科技, 2021, 42(5):51-59.
PAN Y, LIANG Y, MA R, et al.Stability and degradation kinetics of anthocyanins from red cabbage[J].Science and Technology of Food Industry, 2021, 42(5):51-59.
[31] LI B, WANG L, BAI W B, et al. Modification and stabilization of anthocyanins[M]//Anthocyanins. Singapore: Springer Nature Singapore, 2021:115-140.
[32] 栾浩. 蓝莓果渣花色苷酶法酰基化修饰及其活性研究[D].无锡:江南大学, 2022.
LUAN H.Enzymatic acylation of blueberry pomace anthocyanins and its activity[D].Wuxi:Jiangnan University, 2022.
[33] 张俊俊, 邹小波, 宋文君, 等.基于酰基化花青素的高稳定性新鲜度可视化指示膜及其应用[J].食品科学, 2023, 44(3):194-200.
ZHANG J J, ZOU X B, SONG W J, et al.Development and application of visual freshness indicator film with high stability based on acylated anthocyanins[J].Food Science, 2023, 44(3):194-200.
[34] MA Y Y, MA X, GAO X, et al.Light induced regulation pathway of anthocyanin biosynthesis in plants[J].International Journal of Molecular Sciences, 2021, 22(20):11116.
[35] 杨体园, 黄名勇, 方镇洲, 等.酶促酰化对刺葡萄锦葵啶花色苷光稳定性的影响[J].中国食品添加剂, 2024, 35(3):96-102.
YANG T Y, HUANG M Y, FANG Z Z, et al.Effect of enzymatic acylation on the photostability of anthocyanins from Vitis davidii[J].China Food Additives, 2024, 35(3):96-102.
[36] 李彬. 玫瑰茄花色苷稳定性优化及性质研究[D].天津:天津商业大学, 2022.
LI B.Stability optimization and properties of roselle (Hibiscus sabdariffa Linn.) anthocyanins[D].Tianjin:Tianjin Commercial University, 2022.
[37] 袁婷婷. 彩色马铃薯花色苷提取物降脂作用研究[D].重庆:西南大学, 2023.
YUAN T T.Study on lipid-lowering effect of anthocyanin extracts from color potato[D].Chongqing:Southwest University, 2023.
[38] 郭思杙, 张薇, 吕远平.金属离子对紫甘蓝花青素颜色稳定性的影响[J].中国调味品, 2017, 42(6):152-158.
GUO S Y, ZHANG W, LYU Y P.Effect of metal ions on the color stability of anthocyanins from purple cabbage[J].China Condiment, 2017, 42(6):152-158.
[39] FENGER J A, ROBBINS R J, COLLINS T M, et al.The fate of acylated anthocyanins in mildly heated neutral solution[J].Dyes and Pigments, 2020, 178:108326.
[40] ZAHARUDIN N, STAERK D, DRAGSTED L O.Inhibition of α-glucosidase activity by selected edible seaweeds and fucoxanthin[J].Food Chemistry, 2019, 270:481-486.
[41] BLAHOVA J, MARTINIAKOVA M, BABIKOVA M, et al.Pharmaceutical drugs and natural therapeutic products for the treatment of type 2 diabetes mellitus[J].Pharmaceuticals, 2021, 14(8):806.
[42] DE PAULO FARIAS D, DE ARA JO F F, NERI-NUMA I A, et al.Antidiabetic potential of dietary polyphenols:A mechanistic review[J].Food Research International, 2021, 145:110383.
JO F F, NERI-NUMA I A, et al.Antidiabetic potential of dietary polyphenols:A mechanistic review[J].Food Research International, 2021, 145:110383.
[43] SOHANI, SMRUTI.Review on microbial α-amylasetypes &their industrial application[J].UGC Care Group-1 Journal, 2020, 23(4):105-112.
[44] TRINH B T D, STAERK D, J GER A K.Screening for potential α-glucosidase and α-amylase inhibitory constituents from selected Vietnamese plants used to treat type 2 diabetes[J].Journal of Ethnopharmacology, 2016, 186:189-195.
GER A K.Screening for potential α-glucosidase and α-amylase inhibitory constituents from selected Vietnamese plants used to treat type 2 diabetes[J].Journal of Ethnopharmacology, 2016, 186:189-195.
[45] ESATBEYOGLU T, RODR GUEZ-WERNER M, SCHLÖSSER A, et al.Fractionation, enzyme inhibitory and cellular antioxidant activity of bioactives from purple sweet potato (Ipomoea batatas)[J].Food Chemistry, 2017, 221:447-456.
GUEZ-WERNER M, SCHLÖSSER A, et al.Fractionation, enzyme inhibitory and cellular antioxidant activity of bioactives from purple sweet potato (Ipomoea batatas)[J].Food Chemistry, 2017, 221:447-456.
[46] YA EZ APAM J, HERRERA-GONZ
EZ APAM J, HERRERA-GONZ LEZ A, DOM
LEZ A, DOM NGUEZ USCANGA A, et al.Effect of the enzymatic treatment of phenolic-rich pigments from purple corn (Zea mays L.):Evaluation of thermal stability and alpha-glucosidase inhibition[J].Food and Bioprocess Technology, 2023, 16(9):2055-2069.
NGUEZ USCANGA A, et al.Effect of the enzymatic treatment of phenolic-rich pigments from purple corn (Zea mays L.):Evaluation of thermal stability and alpha-glucosidase inhibition[J].Food and Bioprocess Technology, 2023, 16(9):2055-2069.
[47] 杨扬. 紫薯花色苷干预淀粉消化与改善高果糖高脂诱导代谢综合征的机制研究[D].武汉:华中农业大学, 2021.
YANG Y.Mechanism of anthocyanins from purple sweet potato in slowing starch digestion and alleviating high-fructose/high-fat induced metabolic syndrome[D].Wuhan:Huazhong Agricultural University, 2021.
[48] ZHANG J T, SUN L J, DONG Y S, et al.Chemical compositions and α-glucosidase inhibitory effects of anthocyanidins from blueberry, blackcurrant and blue honeysuckle fruits[J].Food Chemistry, 2019, 299:125102.
[49] 盛尔达. 钠-葡萄糖协同转运蛋白2抑制剂作用机制概述[J].糖尿病新世界, 2021, 24(24):190-193.
SHENG E D.Overview of the mechanism of action of sodium-glucose cotransporter 2 inhibitors[J].Diabetes New World, 2021, 24(24):190-193.
[50] RAJASEKAR R, SUNDARAM S M, RAJ C P, et al.Analysing uric acid levels to assess the effectiveness of dapagliflozin[J].Clinical Nutrition ESPEN, 2024, 59:81-88.
[51] WANG Y, JULIAN MCCLEMENTS D, CHEN L, et al.Progress on molecular modification and functional applications of anthocyanins[J].Critical Reviews in Food Science and Nutrition, 2024, 64(31):11409-11427.
[52] YOSHIKAWA T, INOUE R, MATSUMOTO M, et al.Comparative expression of hexose transporters (SGLT1, GLUT1, GLUT2 and GLUT5) throughout the mouse gastrointestinal tract[J].Histochemistry and Cell Biology, 2011, 135(2):183-194.
[53] KRAWCZYK M, BURZYNSKA-PEDZIWIATR I, WOZNIAK L A, et al.Impact of polyphenols on inflammatory and oxidative stress factors in diabetes mellitus:Nutritional antioxidants and their application in improving antidiabetic therapy[J].Biomolecules, 2023, 13(9):1402.
[54] 洪森辉, 杨秀雯, 黄晓雪, 等.蓝莓花色苷的酶法酰化修饰及其疏水性改善研究[J].食品工业科技, 2021, 42(19):78-83.
HONG S H, YANG X W, HUANG X X, et al.Improving the hydrophobicity of blueberry anthocyanins through enzymatic acylation modification[J].Science and Technology of Food Industry, 2021, 42(19):78-83.
[55] ZHANG P L, LIU S, ZHAO Z G, et al.Enzymatic acylation of cyanidin-3-glucoside with fatty acid methyl esters improves stability and antioxidant activity[J].Food Chemistry, 2021, 343:128482.
[56] 郭江凡, 王晓萌, 张秋娥, 等.中药基于NF-κB信号通路干预改善糖尿病肾病的研究进展[J].中国实验方剂学杂志, 2024, 30(20):241-251.
GUO J F, WANG X M, ZHANG Q E, et al.Research progress on traditional Chinese medicine interventions targeting NF-κB signaling pathway to improve diabetic nephropathy[J].Chinese Journal of Experimental Traditional Medical Formulae, 2024, 30(20):241-251.
[57] LI F Y, LI Y D, YAN Y W, et al.Petroleum ether extract of Derris eriocarpa how.(PEEDEH) investigate antidiabetic nephropathy effect and mechanism through TLR4/NF-κB/caspase-3 pathways[J].Chinese Journal of Pharmacology and Toxicology, 2019, 33(10):826-827.
[58] 查宇喆, 赵彦.有氧运动改善2型糖尿病肝脏胰岛素抵抗的研究进展[C].第十三届全国体育科学大会论文摘要集——墙报交流(运动生理与生物化学分会)(二), 2023:409-411.
CHA Y C, ZHAO Y.Research progress of aerobic exercise to improve hepatic insulin resistance in type 2 diabetes mellitus[C].Abstracts of the 13th National Sports Science Congress-Wall Communication (Exercise Physiology and Biochemistry Division) (II).Nanjing Institute of Physical Education, 2023:409-411.
[59] SHEN L H, YANG Y, ZHANG J L, et al.Diacylated anthocyanins from purple sweet potato (Ipomoea batatas L.) attenuate hyperglycemia and hyperuricemia in mice induced by a high-fructose/high-fat diet[J].Journal of Zhejiang University.Science.B, 2023, 24(7):587-601.
[60] MAGA A CERINO J, PENICHE PAV
A CERINO J, PENICHE PAV A H, TIESSEN A, et al.Pigmented maize (Zea mays L.) contains anthocyanins with potential therapeutic action against oxidative stress - a review[J].Polish Journal of Food and Nutrition Sciences, 2019:85-99.
A H, TIESSEN A, et al.Pigmented maize (Zea mays L.) contains anthocyanins with potential therapeutic action against oxidative stress - a review[J].Polish Journal of Food and Nutrition Sciences, 2019:85-99.
[61] VERMA A, AGGARWAL K, AGRAWAL R, et al.Molecular mechanisms regulating the pharmacological actions of icariin with special focus on PI3K-AKT and Nrf-2 signaling pathways[J].Molecular Biology Reports, 2022, 49(9):9023-9032.
[62] REN Z H, XIE Z F, CAO D N, et al.C-Phycocyanin inhibits hepatic gluconeogenesis and increases glycogen synthesis via activating Akt and AMPK in insulin resistance hepatocytes[J].Food &Function, 2018, 9(5):2829-2839.
[63] SCHULTZ J, WARKUS J, WOLKE C, et al.MiD51 is important for maintaining mitochondrial health in pancreatic islet and MIN6 cells[J].Frontiers in Endocrinology, 2020, 11:232.