痔疮是肛门周围静脉的异常扩张,形成静脉团块,会导致患者不适和痛苦,严重时会造成肛门周围区域的细菌感染,引发肛周脓肿等并发症,进而引发其他疾病,影响生活质量。造成痔疮的原因包括不健康的饮食(如缺乏纤维素)、便秘、腹泻等[1]。痔疮在我国成年人群中的发病率超过50%,占到所有肛肠疾病的近90%,是我国发病率最高的肛肠疾病[2]。肠易激综合征(irritable bowel syndrome,IBS)是一种较为常见的消化系统疾病,主要表现为反复出现的腹痛、腹胀、便秘或腹泻等症状,IBS虽然不是危险疾病,但是同样会造成生活质量下降[3]。痔疮和IBS之间虽还没有被证实有直接关联,但在临床上显示出一定相关性。首先,IBS患者常常会出现排便习惯的变化,例如便秘或腹泻,这可能会导致排便时的过度用力,从而增加了痔疮的风险;其次,IBS引起的不适和疼痛可能使患者在排便时过于紧张,也会加重肛门部位的压力,进一步促使痔疮的形成;临床数据也显示有较多的IBS患者伴随有痔疮症状[4-5],有临床调研显示职业驾驶员中有IBS相关表现者占到42.37%,痔疮患者占到45.53%,在特殊职业者中2种疾病的患病比例十分接近,提示有相关性[6];另有研究显示便秘患者中有41.73%表现为IBS,而通过回归分析,痔疮是便秘的主要诱因,比值比达到4.062[7]。因此,尽管IBS和痔疮是不同的疾病,但是前者的症状可能会间接影响后者的发生。了解这一关系,有助于患者采取更好的管理和治疗措施,从而缓解不适,改善生活质量。
腹泻和便秘都是痔疮的重要诱因,肠道菌群的健康与排便的规律性密切相关。研究显示肠道菌群的失调均可以引发腹泻和便秘,造成IBS,也可能进一步引发痔疮[8]。同时,IBS会引发肠道内的有害菌增加,从而促进肠道内的有害菌或病原体引发炎症反应,导致肠道黏膜损伤和血管扩张,从而增加痔疮的风险[9]。肠道中的有益微生物通过代谢作用产生的包括短链脂肪酸(如丁酸盐)等活性产物,有助于维护肠道的屏障功能和抗炎作用。这些物质对肠道健康至关重要,并可能在预防痔疮方面发挥积极作用[10]。研究显示乳酸菌可以促进肠上皮细胞的紧密连接蛋白(如Occludin、Claudin)的表达,增强肠道屏障的完整性,肠道屏障功能增强会减少病原体和免疫原性物质进入血液循环的机会,从而降低全身性炎症反应[11]。还有研究显示乳酸菌通过调节肠道菌群和免疫反应,改善IBS患者的腹痛、腹胀和排便异常,具有很好的肠道免疫调节作用[12]。基于肠道菌群在肠道健康中的重要作用,可以认为调节肠道菌群对调节IBS,从而预防和干预痔疮可能存在重要意义。
酸鱼是广西侗族人民经常食用的特色食品,是由鱼肉和糯米经过长时间发酵而成的1种自然发酵食品。有研究显示广西发酵酸鱼中含有乳酸菌,且经过体外验证其中的乳酸菌具有较强的体外耐热、耐酸和耐胆盐能力[13]。本研究团队从广西侗族村庄居民自然发酵酸鱼中分离鉴定出多株食品可用微生物,其中1株命名为植物乳植杆菌GXFF202402(Lactiplantibacillus plantarum GXFF202402,LP-GXFF202402)的菌株具有较强的体外抗性,体外pH 3.0胃酸下的存活率达到92.3%,在人工胆盐中的存活率达60.5%,具备益生菌潜质,因此被筛选出作为本研究的对象,观察其在实验性小鼠痔疮模型中对痔疮的干预效果及其干预过程中调节IBS的作用,研究将为进一步发掘我国少数民族自然发酵中的微生物资源积累理论依据和实现优质菌种的产业化打下基础。
1 材料与方法
1.1 材料与试剂
LP-GXFF202402由本团队从广西柳州市三江侗族自治县八江镇岩脚村村民自制自然发酵酸鱼中分离鉴定,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏中心登记入册编号为CGMCC No.32257。
本研究中实验小鼠为雌性无特定病原体(specific pathogen free,SPF)昆明小鼠[6周龄,(22±2)g],购自于湖南斯莱克景达实验动物有限公司[许可证号:SYXK(湘)2024-0019],动物实验经重庆第二师范学院重庆市功能性食品协同创新中心实验动物伦理委员会批准(实验动物伦理审查号:202408012B),按按国家标准GB/T 35892—2018《实验动物 福利伦理审查指南》和赫尔辛基宣言的各项要求实施操作。
痔速宁片,江西药都仁和制药有限公司;巴豆油,上海麦克林生物科技股份有限公司;IL-2、IL-4、IL-6、IL-10、IL-1β、TNF-α、血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子(epidermal growth factor,EGF)、前列腺素 E2(prostaglandin E2,PGE2)、紧密连接蛋白(Occludin)、蛋白酶激活受体2(protease activated receptor 2,PAR-2)、肥大细胞类胰蛋白酶(mast cell tryptase,MCT)、皮质酮(corticosterone,CORT)酶联免疫分析试剂盒,上海酶联生物科技有限公司;NO检测试剂盒,北京盒子生工科技有限公司;Hieff® qPCR SYBR Green Master Mix (High Rox Plus),翌圣生物科技(上海)股份有限公司;Hifair® Ⅲ 1 st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus) TRI Reagent,武汉爱博泰克生物科技有限公司;PCR引物、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、SDS-PAGE、一抗、二抗,美国Thermo fisher公司;苯甲磺酰氟(phenyl methane sulfonyl fluoride,PMSF),柏奥易杰(北京)科技有限公司。
1.2 仪器与设备
Vavioskan多功能酶标仪、Stepone Plus实时荧光定量pcr仪、FL1500多功能成像仪,Thermo fisher公司;BX43显微镜,日本奥林巴斯公司。
1.3 方法
1.3.1 动物实验
将50只雌性小鼠适应性喂养1周后,小鼠随机分为5个实验小组,每组10只小鼠,分别为正常组、模型组、痔速宁片组(药物阳性对照组),LP-GXFF202402高浓度组和LP-GXFF202402低浓度组。除正常组外,将0.05 mL巴豆油混合液(由蒸馏水、吡啶、乙醚和6%巴豆油(体积分数)按体积比为1∶4∶5∶10的比例混合而成)注入小鼠肛门0.5 cm处,10 s后抽出,建立痔疮模型。建模处理后第2天痔速宁片组小鼠每天按剂量600 mg/kg被灌胃痔速宁片粉末,LP-GXFF202402高浓度组和低浓度组小鼠每天被分别灌胃浓度为1×109 CFU/kg和1×108 CFU/kg的LP-GXFF202402活菌液,持续14 d[14]。灌胃样品处理后 6 h观察小鼠肛门肿胀、发红、出血、溃疡形成、溃疡大小、颜色变化等情况。然后将小鼠放入小动物安乐死箱内,向箱中注入CO2,CO2充入率保持在每分钟占箱体积的10%~30%,从而迅速使小鼠失去意识。将小鼠从箱中取出后,采集眼眶血,采血完成后使用颈椎脱位使小鼠最终死亡,解剖取组织进行检查。
1.3.2 小鼠肛门直肠肿胀系数的测定
解剖小鼠分离其肛门直肠组织进行测量。按公式(1)计算小鼠肛门直肠肿胀系数:
小鼠肛门直肠肿胀系数=肛门直肠组织质量(mg)/动物质量(g)
(1)
1.3.3 小鼠血清细胞因子水平测定
将采集到的血液样品置于4 ℃冷藏约2 h,随后在4 ℃、3 000 r/min下离心10 min。离心后取上层血清按试剂盒说明书测定小鼠血清IL-2、IL-4、IL-6、IL-1β、TNF-α和CORT水平。
1.3.4 小鼠直肠组织细胞因子水平测定
解剖后收集100 mg左右小鼠直肠组织样本,切碎并转移至匀浆管中。测定直肠组织质量,按料液比1∶9(g∶mL)加入生理盐水后在4 ℃下进行匀浆处理,然后再4 ℃、3 000 r/min离心15 min,取上层提取液按试剂盒说明书测定小鼠直肠组织IL-1β、IL-6、IL-10、TNF-α、Occludin、PAR-2和MCT水平。
1.3.5 小鼠结肠和直肠组织病理切片
分别取约0.5 cm长的结肠和直肠组织在组织固定液中放置48 h,包埋在石蜡中后切成2~3 μm厚的切片。用苏木精和伊红(hematoxylin-eosin staining,HE)对切片进行染色,使用倒置显微镜观察组织病理学变化。
1.3.6 小鼠组织的mRNA表达测定
分别取约50 mg小鼠肛缘和结肠组织,按1.3.4节方法匀浆后,加入三氯甲烷,充分混匀后在4 ℃、3 000 r/min下冷冻离心15 min,取上层清液加入等体积异丙醇,混匀,再在4 ℃、3 000 r/min下冷冻离心20 min。弃去上清液后,用75%(体积分数)乙醇洗涤,在4 ℃、3 000 r/min下冷冻离心15 min后弃去上层水相,静置3~5 min,加入20 μL的无核糖核酸酶水,备用。RNA原液和的无核糖核酸酶水以1∶49(体积比)稀释混匀,用微量分光光度计测定RNA的浓度和纯度。测定的A260∶A280的比值在1.8~2.0间表示纯度符合要求,可进行后续实验步骤。根据翌圣Hifair® Ⅲ 1 st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)合成试剂盒说明书将RNA反转录成cDNA,并调整cDNA质量浓度为1 000 ng/mL。接着按10 μL Master mix、0.4 μL上游引物(表1)、0.4 μL下游引物、1 μL模板(cNDA,1 000 ng/mL) 和8.2 μL无菌超纯水的扩增体系混匀后,低速离心后于PCR仪上进行扩增,扩增条件为95 ℃初始变性5 min后,在95 ℃、10 s,60 ℃、20 s,72 ℃、20 s下进行40个循环。最后以β-actin为内参基因,通过公式2-ΔΔCT计算各目的基因的mRNA相对表达量[15]。
表1 本研究中使用的PCR引物序列
Table 1 PCR primer sequences used in this study

表达上游引物序列下游引物序列Occludin5′-TGAAAGTCCACCTCCTTACAGA-3′5′-CCGGATAAAAAGAGTACGCTGG-3′PAR-25′-TGTACGTAGCCATCCAGGCT-3′5′-TTCTCCAGGGAGGAAGAGGA-3′IL-65′-ATGAAGTTCCTCTCTGCAA-3′5′-AGTGGTATCCTCTGTGAAG-3′TNF-α5′-ATGGGGGGCTTCCAGAA-35′-CCTTTGGGGACCGATCA-3′β-actin5′-CATGTACGTTGCTATCCAGGC-3′5′-CTCCTTAATGTCACGCACGAT-3′总菌5′-ACTCCTACGGGAGGCAGCAGT-3′5′-ATTACCGCGGCTGCTGGC-3′厚壁菌门5′-GCGTGAGTGAAGAAGT-3′5′-CTACGCTCCCTTTACAC-3′拟杆菌门5′-ACGCTAGCTACAGGCTTAACA-3′5′-ACGCTACTTGGCTGGTTCA-3′乳酸杆菌5′-CACCGCTACACATGGAG-3′5′-AGCAGTAGGGAATCTTCCA-3′双歧杆菌5′-TCGCGTCYGGTGTGAAAG-3′5′-CCACATCCAGCRTCCAC-3′
1.3.7 小鼠肠道内容物中微生物的mRNA表达测定
称取1.0 g小鼠的肠道内容物与无菌生理盐水充分振荡混合(1∶9,g∶g),使微生物均匀分散。先后使用100 μm和200 μm无菌滤网去除肠道内容物中的大颗粒杂质。接着在4 500 r/min转速下离心10 min,弃去上层液,根据1.3.6节测定小鼠组织中mRNA表达的方法进行操作,以检测肠道内容物中微生物的mRNA表达。
1.3.8 小鼠肛缘组织的蛋白表达测定
称取约100 mg小鼠肛缘组织并加入1 mL的RIPA和10 μL的PMSF进行裂解,然后在4 ℃下离心分离(12 000 r/min、4 min)用以除去中间蛋白层溶液,然后用BCA蛋白定量试剂盒对蛋白进行定量并将蛋白稀释到50 μg/mL。按4∶1的比例将稀释的蛋白液与缓冲液混合后在100 ℃下保温5 min,接着将混合液加入预制胶中进行垂直凝胶电泳,持续50 min后开始转膜。转膜完成后用含TBST的5%脱脂牛乳对PVDF膜进行1 h封闭,封闭完成后用TBST溶液洗膜。处理后的PVDF膜在25 ℃下浸泡,在1∶500稀释的一抗下进行孵育后,再在1∶1 000稀释的二抗下进行孵育,时间分别是2 h和1 g。最后用Supersignal West Pico PLUS对PVDF膜进行填充后置于成像系统中观察IL-6和TNF-α表达变化[16]。
1.4 统计学分析
所有实验均进行3次平行测定,实验结果以“平均值±标准差”的形式呈现。同时,采用单因素方差分析来评估各组数据之间差异显著性(P<0.05)。
2 结果与分析
2.1 小鼠肛门直肠肿胀系数
正常组具有最低的肛门直肠肿胀率(表2),模型组小鼠具有最高的肛门直肠肿胀率(P<0.05),LP-GXFF202402可以降低模型小鼠肛门直肠肿胀率,且LP-GXFF202402高浓度降低肛门直肠肿胀率的效果更好,接近药物痔速宁片,且不存在显著差异(P>0.05)。
表2 实验小鼠肛门直肠肿胀系数
Table 2 Swelling coefficient of anus and rectum in experimental mice
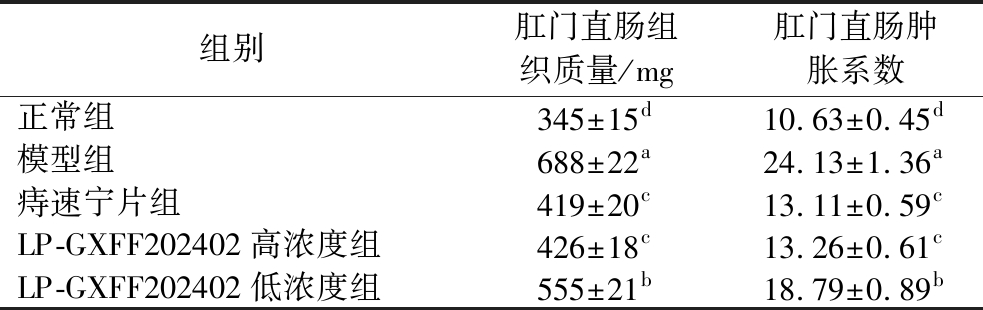
组别肛门直肠组织质量/mg肛门直肠肿胀系数正常组345±15d10.63±0.45d模型组688±22a24.13±1.36a痔速宁片组419±20c13.11±0.59cLP-GXFF202402高浓度组426±18c13.26±0.61cLP-GXFF202402低浓度组555±21b18.79±0.89b
注:不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)(下同)。
2.2 小鼠血清IL-2、IL-4、IL-6、IL-1β、TNF-α和CORT水平
由表3可见正常组小鼠血清中的IL-4、IL-6、IL-1β、TNF-α和CORT水平显著低于其他各组,而模型组则显著高于其他各组;同时正常组小鼠血清中的IL-2则显著高于其他各组,模型组则显著低于其他各组(P<0.05)。痔速宁片和LP-GXFF202402均可以使模型小鼠血清生物IL-2、IL-4、IL-6、IL-1β、TNF-α和CORT水平更接近正常组,但仍与正常组存在显著差异(P<0.05),且LP-GXFF202402高浓度和痔速宁片的效果不存在显著差异(P>0.05),但显著强于LP-GXFF202402低浓度。
表3 小鼠血清IL-2、IL-4、IL-6、IL-1β、TNF-α和CORT水平
Table 3 Serum levels of IL-2, IL-4, IL-6, IL-1 β, TNF - α, and CORT in mice

组别IL-2/(pg/mL)IL-4/(pg/mL)IL-6/(pg/mL)IL-1β/(pg/mL)TNF-α/(pg/mL)CORT/(ng/mL)正常组69.71±4.51a202.36±12.36d52.69±3.31d84.69±5.56d142.69±11.05d415.24±24.89d模型组32.64±2.15d879.52±30.56a245.69±10.56a312.05±12.06a475.65±18.91a899.51±25.68a痔速宁片组52.59±3.49b389.78±30.12c76.77±6.12c110.68±8.09c177.25±10.52c501.15±26.91cLP-GXFF202402高浓度组51.89±4.04b397.65±25.03c79.69±6.89c115.68±9.21c179.36±9.88c507.80±22.60cLP-GXFF202402低浓度组41.06±3.32c575.69±22.89b142.36±8.82b202.32±8.90b302.37±14.58b705.36±24.18b
2.3 小鼠直肠组织IL-1β、IL-6、IL-10、TNF-α、Occludin、PAR-2和MCT水平
由表4可见正常组小鼠直肠组织中的IL-1β、IL-6、TNF-α、PAR-2、MCT水平在所有组最低,而IL-10和Occludin水平最高;模型组则相反,IL-1β、IL-6、TNF-α、PAR-2、MCT水平最高,而IL-10和Occludin水平最低(P<0.05)。相比模型组,痔速宁片和LP-GXFF202402均可以将直肠组织中的IL-1β、IL-6、TNF-α、PAR-2、MCT水平显著下降和将IL-10和Occludin水平显著提高(P<0.05),且痔速宁片和LP-GXFF202402高浓度组具有相似的效力,两组之间无显著差异(P>0.05),且效力均显著强于LP-GXFF202402低浓度(P<0.05)。
表4 鼠直肠组织IL-1β、IL-6、IL-10、TNF-α、Occludin、PAR-2和MCT水平
Table 4 Levels of IL-1 β, IL-6, IL-10, TNF - α, Occludin, PAR-2, and MCT in mouse rectal tissue
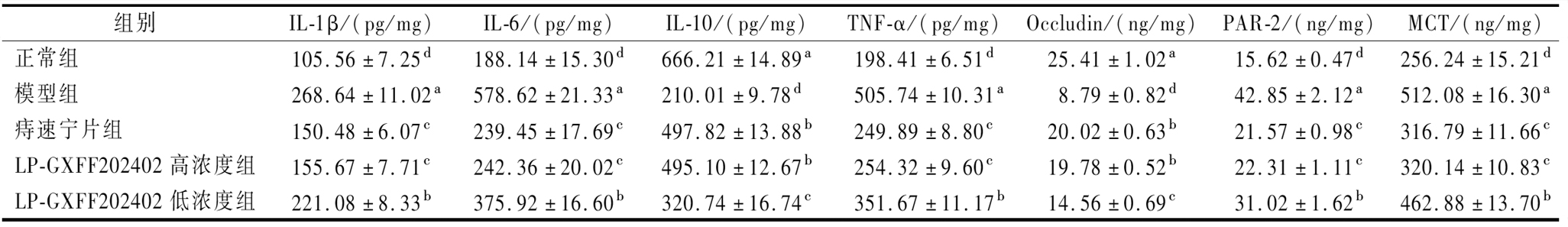
组别IL-1β/(pg/mg)IL-6/(pg/mg)IL-10/(pg/mg)TNF-α/(pg/mg)Occludin/(ng/mg)PAR-2/(ng/mg)MCT/(ng/mg)正常组105.56±7.25d188.14±15.30d666.21±14.89a198.41±6.51d25.41±1.02a15.62±0.47d256.24±15.21d模型组268.64±11.02a578.62±21.33a210.01±9.78d505.74±10.31a8.79±0.82d42.85±2.12a512.08±16.30a痔速宁片组150.48±6.07c239.45±17.69c497.82±13.88b249.89±8.80c20.02±0.63b21.57±0.98c316.79±11.66cLP-GXFF202402高浓度组155.67±7.71c242.36±20.02c495.10±12.67b254.32±9.60c19.78±0.52b22.31±1.11c320.14±10.83cLP-GXFF202402低浓度组221.08±8.33b375.92±16.60b320.74±16.74c351.67±11.17b14.56±0.69c31.02±1.62b462.88±13.70b
2.4 小鼠结肠和直肠组织的病理学观察
由图1可见正常组小鼠结肠组织结构完整,无炎症或损伤的迹象。而造模后,模型组小鼠结肠组织表现出明显的病理学变化,包括上皮细胞损伤、隐窝结构异常、炎症细胞浸润和黏膜下水肿,提示肠道处于炎症和功能障碍状态。痔速宁片组的小鼠结肠炎症和损伤程度显著减轻,组织结构逐渐恢复。LP-GXFF202402高浓度组的小鼠肠黏膜屏障功能显著改善,炎症反应减轻,且痔速宁片LP-GXFF202402高浓度缓解结肠损伤及修复肠道黏膜的作用强于LP-GXFF202402低浓度。
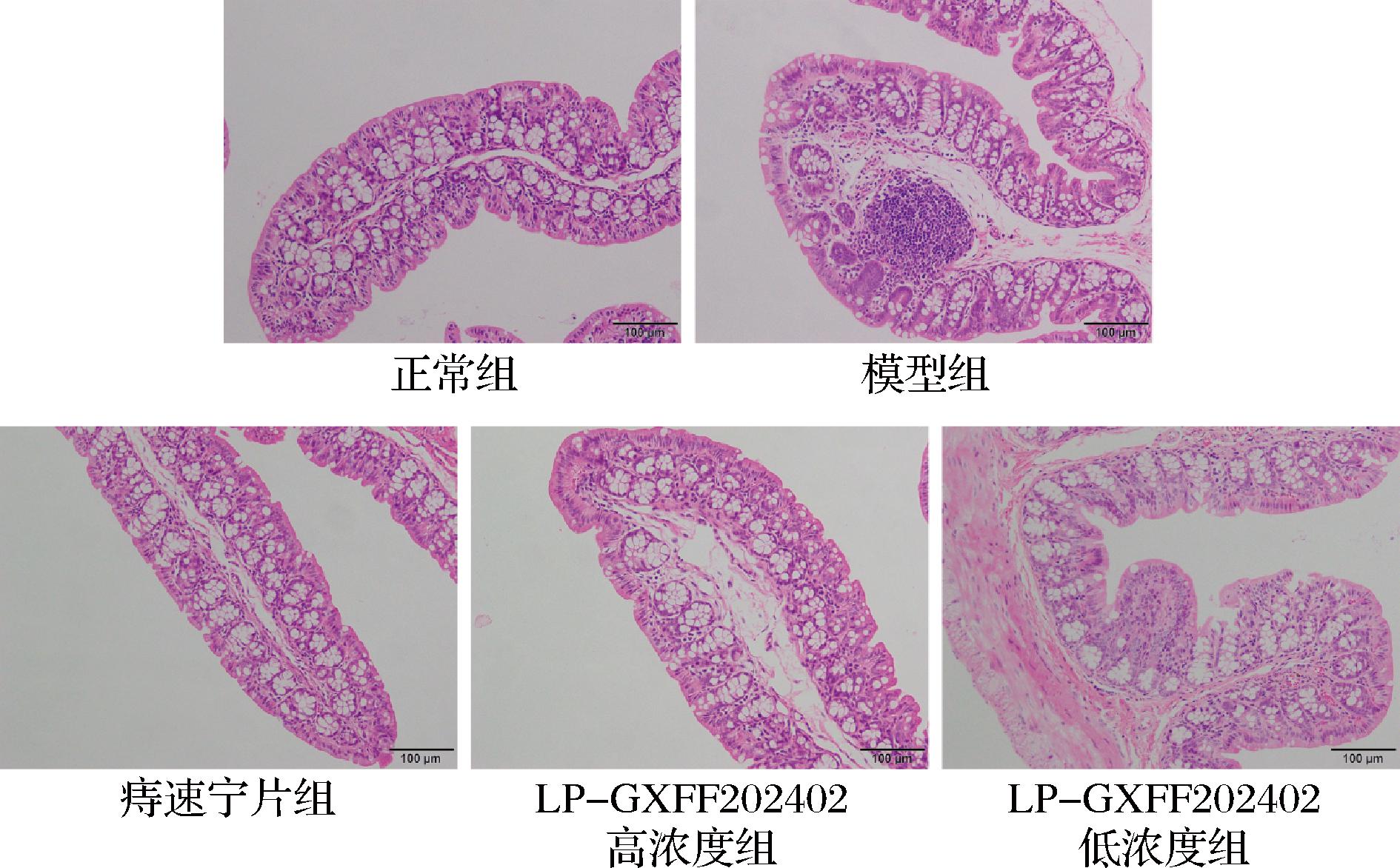
图1 小鼠结肠组织的H&E病理学切片
Fig.1 H&E pathological sections of mouse colon tissue
如图2所示,正常组小鼠肛门黏膜上皮组织完整,结构正常。模型组直肠黏膜上皮组织局部坏死,炎性细胞浸润,黏膜下层严重水肿,炎性细胞浸润,血管扩张充血。痔速宁片组和LP-GXFF202402高浓度组情况明显改善,黏膜层结构基本完整,黏膜出血减少,边较界清晰,炎性细胞明显减少。相较于模型组,LP-GXFF202402低浓度组小鼠的组织病变也一定程度的减轻,但是组织病变比痔速宁片组和LP-GXFF202402高浓度组更严重。
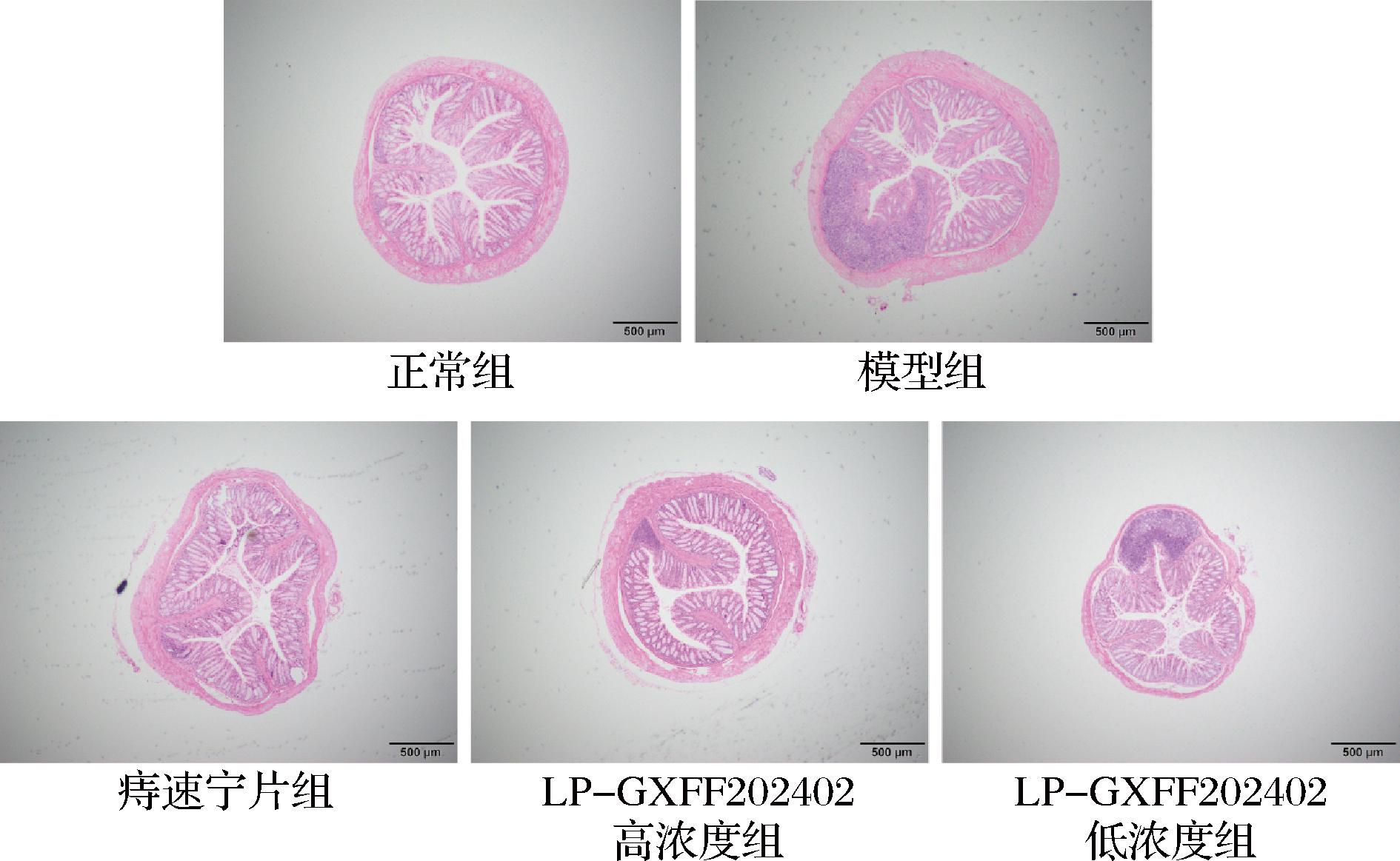
图2 小鼠直肠组织的H&E病理学切片
Fig.2 H&E pathological sections of mouse rectal tissue
2.5 小鼠结肠组织的Occludin和PAR-2 mRNA表达
由图3可见正常组小鼠结肠组织的Occludin mRNA表达最强,模型组小鼠表达最弱,痔速宁片组和LP-GXFF202402高浓度组表达强度显著低于正常组,但显著高于LP-GXFF202402低浓度组(P<0.05)。同时,正常组小鼠的PAR-2表达最弱,模型组最强,痔速宁片组和LP-GXFF202402高浓度组表达强度则显著高于正常组,但显著低于LP-GXFF202402低浓度组(P<0.05)。
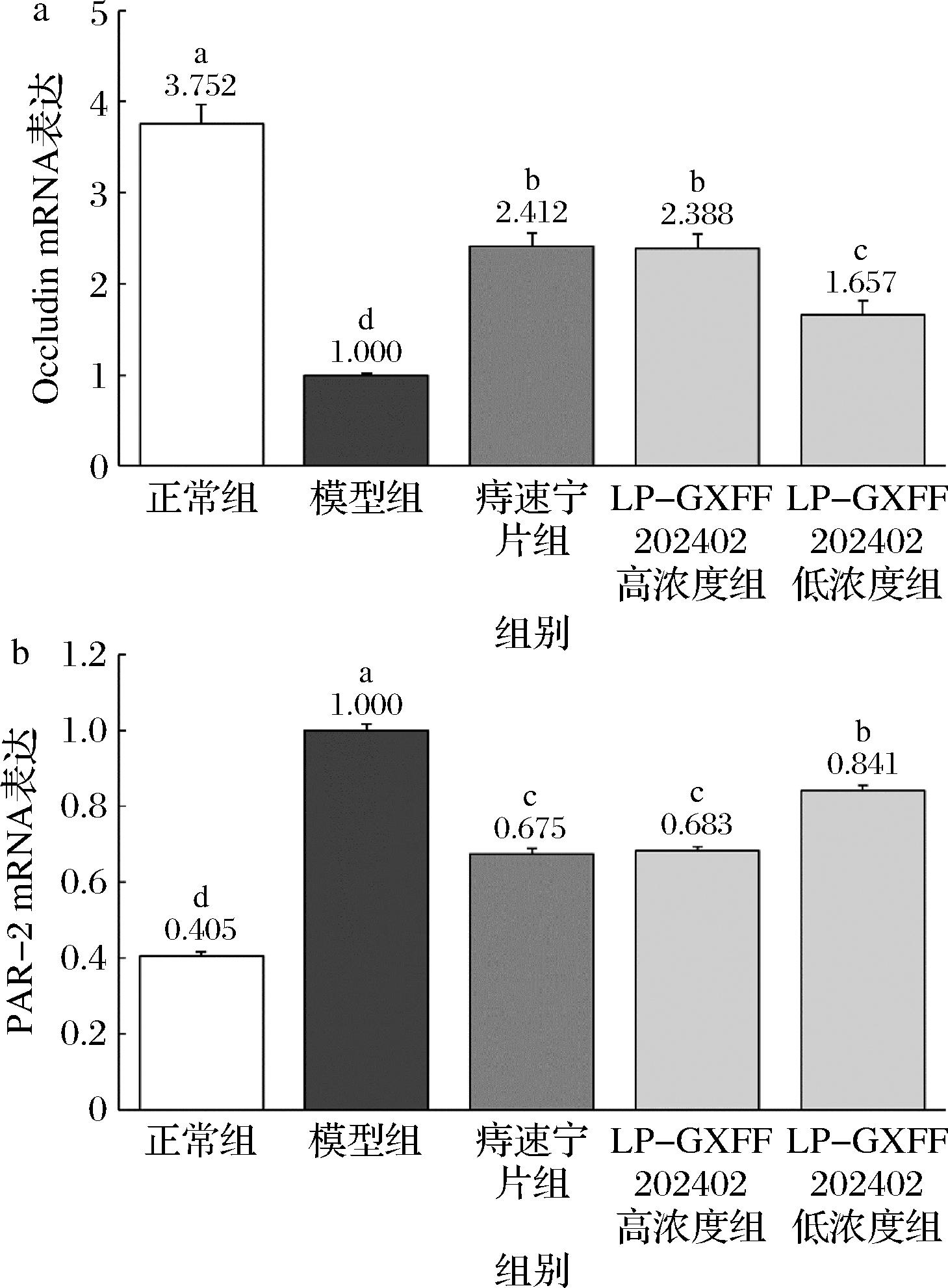
a-Occludin;b-PAR-2
图3 小鼠结肠组织的Occludin和PAR-2 mRNA表达
Fig.3 Occludin and PAR-2 mRNA expression in mouse colon tissue
2.6 小鼠直肠组织的IL-6和TNF-α mRNA和蛋白表达
由图4可见正常组小鼠直肠组织的IL-6和TNF-α表达显著低于其他各组(P<0.05),痔速宁片组和LP-GXFF202402高浓度组表达强度显著高于正常组但低于LP-GXFF202402低浓度组(P<0.05),模型组则显示出最高的IL-6和TNF-α mRNA和蛋白表达。
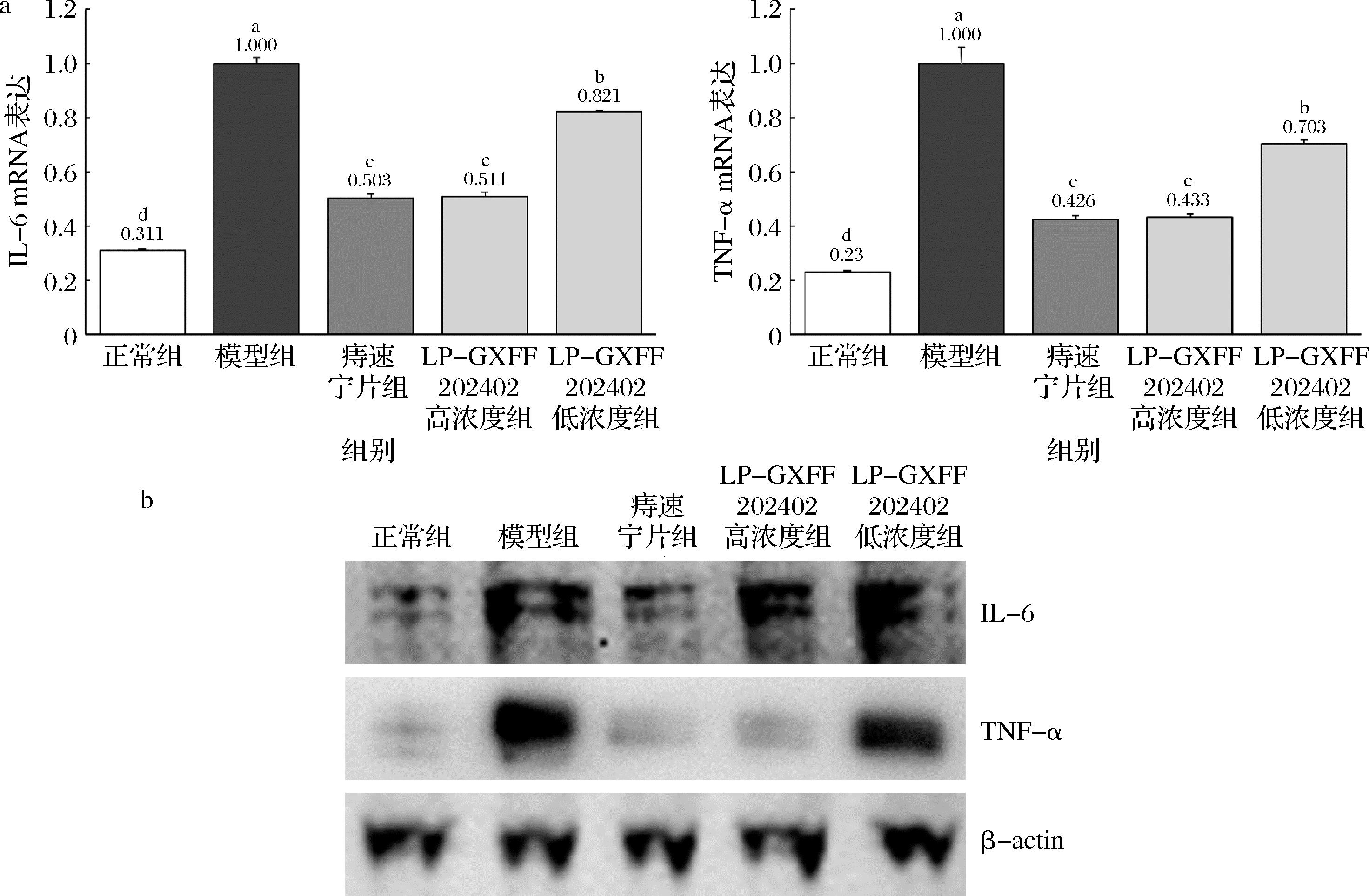
a-mRNA表达;b-蛋白表达
图4 小鼠直肠组织的IL-6和TNF-α mRNA和蛋白表达
Fig.4 IL-6 and TNF-α mRNA and protein expression in mouse rectal tissue
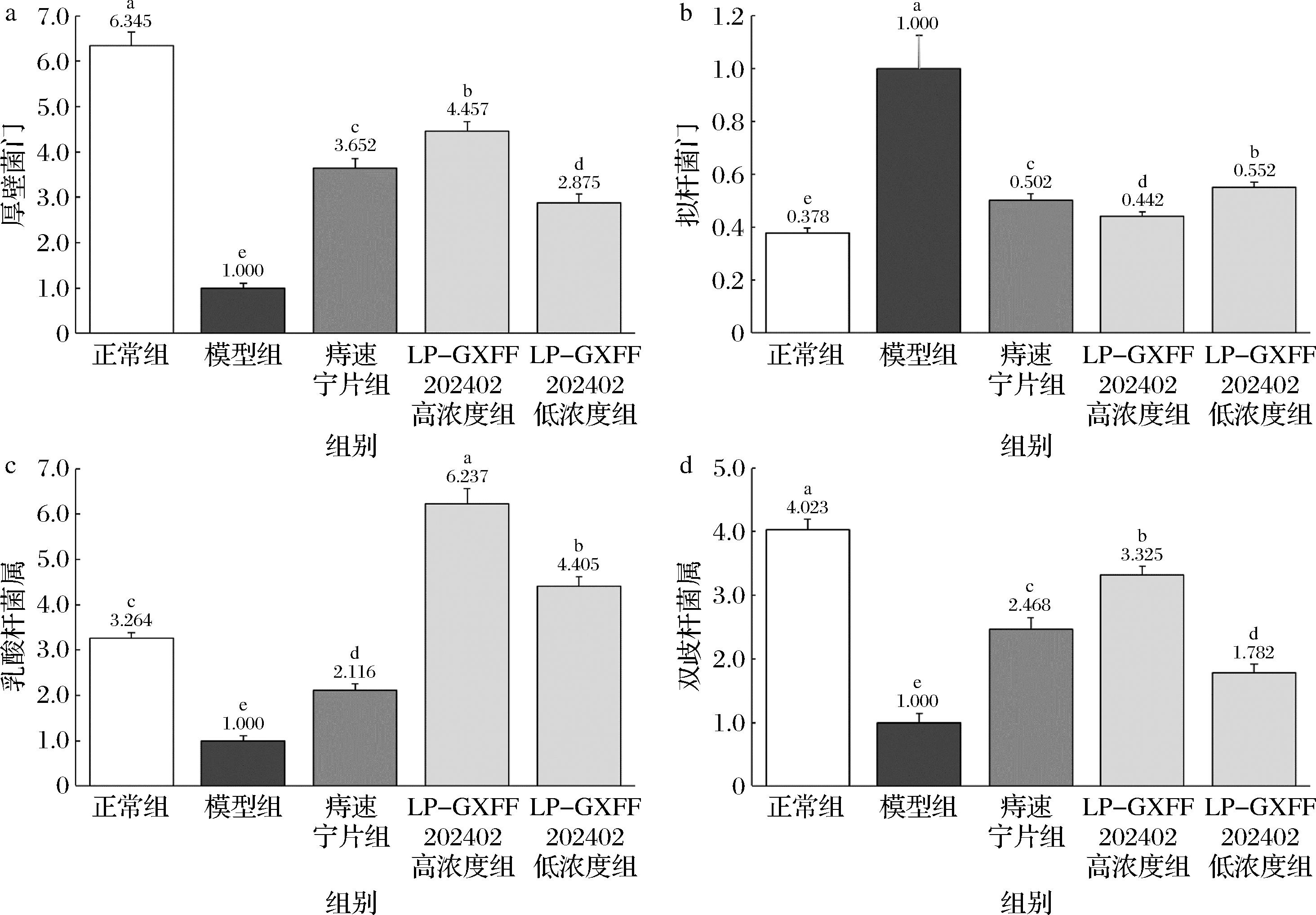
a-厚壁菌门;b-拟杆菌门;c-乳酸杆菌;d-双歧杆菌
图5 小鼠肠道内容物中微生物的mRNA表达
Fig.5 mRNA expression of microbes in mouse gut contents
2.7 小鼠肠道内容物中微生物的mRNA表达
正常组小鼠肠道内容物中拟杆菌门的mRNA表达量显著低于其他各组(P<0.05)(图5),相比之下,厚壁菌门和双歧杆菌的水平则显著高于其他各组(P<0.05)。在给LP-GXFF202402实施(低浓度和高浓度组)干预后,模型小鼠肠道菌群结构均发生显著改变,其中厚壁菌门和双歧杆菌的强度显著上升,而拟杆菌门的强度则显著下降(P<0.05)。值得注意的是,在LP-GXFF202402干预组中,无论是低浓度组还是高浓度组,其乳酸杆菌的强度均呈现显著上升,不仅超过了痔速宁片组和模型组,还显著高于正常组(P<0.05)。
3 讨论与结论
肠道菌群对人体的消化、免疫和整体健康都有重要影响,健康的菌群可以帮助维持肠道平衡,而菌群失调则可能导致一系列消化问题[17]。IBS常表现出腹痛、腹胀、便秘或腹泻等症状,会增加患痔疮的风险。而肠道菌群失调不仅可能影响IBS的发生,也可能通过加重便秘或腹泻,进而影响痔疮的形成[18]。在IBS患者中,肠道菌群的改变可能导致便秘,长期便秘又可能加重痔疮[19]。保持健康的饮食维护肠道健康,避免肠道菌群失调,成为预防痔疮的一个重要观点。
痔速宁片是一种由多种天然中草药制成的针对痔疮的药物,副作用较少,且其作用温和,对胃肠道的刺激较小,适合长期使用和对西药不耐受的患者。但是痔速宁片主要缓解痔疮的症状但难以完全根治痔疮,同时还存在见效较慢的缺点[20]。但是痔速宁片作为常用临床药物已经使用广泛,且因为是中成药更适于长期使用,本研究中的LP-GXFF202402可作为益生菌长期使用,两者均具备长期使用的安全性,因此痔速宁片被本研究作为阳性对照使用。小鼠肛门直肠肿胀系数可以作为实验检测肠道病变的一个指标[21],本研究也证实巴豆油诱导建模后,模型组和正常组小鼠肛门直肠肿胀系数出现明显差异,LP-GXFF202402可以有效的减轻巴豆油造成的小鼠肛门直肠肿胀系数异常,且高浓度的LP-GXFF202402效果达到了常用痔疮药物痔速宁片的药效。
IL-2参与调节免疫反应从而调控痔疮的形成,尤其参与持续的炎症反应和新生血管的形成有关的免疫反应,从而对痔疮涉及的到肛门区域血管的扩张和肿胀产生影响[22]。IL-4、IL-6、IL-1β是促炎因子,痔疮的形成与局部的炎症反应密切相关,通过抑制这些促炎因子减轻机体炎症反应,有助于缓解IBS和痔疮[23-25]。有研究还显示肠道微生物群是黏膜和全身免疫的重要因素,微生物调控结肠免疫细胞释放的介质能调节肠道功能,释放出的IL-1β、IL-6 和TNF-α与肠炎密切相关[26],同时肠道中一些微生物也能调控IL-10的产生并促进 T细胞发育,调控肠道的免疫应答,肠道免疫的破坏将直接影响肠道运动障碍,从而引起便秘等机体异常反应,进而可能诱发痔疮[27]。IL-6和TNF-α还能够改变血管的通透性,通过增强血管通透性,IL-6和TNF-α可以导致肛周组织的水肿和炎症,使得痔疮的状态加重[28-29];IL-6和TNF-α还通过与痛觉神经元的相互作用,增强疼痛的感知,IL-6和TNF-α水平的上升也意味着痛楚的加剧[30]。CORT在肠道应激反应中也扮演关键角色,能够调节肠动力和肠道的敏感性,并与免疫系统的活性也有直接联系[31]。MCT在肠道中可以通过多种不同方式促使炎症发生,破坏肠黏膜的完整性,从而对IBS和痔疮的形成产生积极的作用[32]。Occludin是一种重要的跨膜蛋白,主要在紧密连接中发挥关键作用,紧密连接是肠道上皮细胞之间的结构,负责维持肠道屏障的完整性和选择通透性。Occludin有助于构建肠道细胞之间的物理屏障,它通过控制细胞之间的间隙,防止有害物质、病原体和毒素进入血液,从而保护肠道的免疫调控正常,抑制IBS以及肠道感染疾病[33]。PAR-2可以增强炎症细胞的迁移和活性,对IBS和痔疮的发展能起到促进作用;另外,PAR-2还可能通过其在血管平滑肌中的作用,影响肛门区域的血流,从而在痔疮的发生和发展中起到作用[34]。本研究中的结果也显示出LP-GXFF202402提高痔疮小鼠IL-2、IL-10水平和降低IL-1β、IL-4、IL-6、IL-1β、TNF-α、CORT、PAR-2、MCT水平,同时上调痔疮小鼠组织的Occludin和下调PAR-2、IL-6、TNF-α表达,从而调节IBS,进而抑制痔疮。
关于肠道菌群的研究显示在炎症或免疫失调状态下,人体肠道菌群会发生显著改变,主要表现为厚壁菌门与拟杆菌门相对丰度的动态变化,处于炎症或免疫失调状态的个体其肠道菌群中拟杆菌门的比例呈现上升趋势,而厚壁菌门的丰度则相对降低[35-36]。值得注意的是,作为厚壁菌门中的重要成员,乳酸杆菌因其独特的生物学特性而备受关注。该菌种不仅能够调节机体免疫功能,还具有显著的抗氧化应激能力[37]。双歧杆菌作为肠道中重要的有益微生物,其在肠道菌群中比例的减少也意味着肠道菌群失调,对机体的免疫调控也随之发生异常[38]。临床研究也显示调控肠道菌群,保持肠道健康与痔疮的形成存在密切的相关[39]。本研究可证实,通过LP-GXFF202402可以明显地调节肠道菌群,使痔疮小鼠肠道菌群趋于正常,起到了缓解痔疮的作用。
乳酸菌能够通过代谢产物短链脂肪酸(short-chain fatty acids,SCFAs,如乙酸、丙酸和丁酸)发挥调节免疫和抑制炎症的作用[40]。SCFAs(尤其是丁酸)能够加强肠道上皮细胞中包括Occludin在内的紧密连接蛋白的表达,增强肠道屏障功能,减少病原体和有害物质的渗透[41]。SCFAs还能够通过抑制组蛋白去乙酰化酶活性,促进调节性T细胞的分化,从而抑制过度的免疫反应,维持免疫稳态[42]。另外SCFAs能够调节巨噬细胞和树突状细胞的功能,促进抗炎表型的形成,例如增加IL-10等抗炎细胞因子的分泌[43]。同时,SCFAs还能够通过抑制NF-κB等信号通路,减少TNF-α、IL-6、IL-1β等促炎细胞因子的产生,调节机体炎症平衡[44]。SCFAs在调节机体整体机能上还可通过血液循环到达远端器官(如肝脏、肺、大脑等),调节系统性免疫和炎症反应[45]。本研究中的乳酸菌LP-GXFF202402也可能通过代谢产物SCFAs发挥调节免疫和抑制炎症,深入的机制有待后续进一步研究。
综上所述,LP-GXFF202402对痔疮小鼠血清和结直肠组织的炎症和免疫相关指标具有调控作用,同时对肠道菌群也发挥了明显的调节作用,从而有效地干预了IBS和抑制了痔疮的发展。由此可见,LP-GXFF202402是一株对调节肠道健康和抑制痔疮有效的菌株,对体外实验动物的效果达到了常用痔疮药物的效果,具有显著的益生菌潜质。但是LP-GXFF202402菌株作用人体的具体机制还需更深入的临床研究。
[1] 申孟兰, 李明程, 郭强, 等.中西医联合干预在痔疮术后便秘患者治疗中的研究进展[J].现代医学与健康研究电子杂志, 2024, 8(19):135-138.
SHEN M L, LI M C, GUO Q, et al.Research progress of integrated traditional Chinese and western medicine intervention in the treatment of constipation after hemorrhoid operation[J].Modern Medicine and Health Research Electronic Journal, 2024, 8(19):135-138.
[2] 敖锋. 关于痔疮的科普[J].养生保健指南, 2023, 2023(12):31-33.
AO F.Science popularization about hemorrhoids[J].Health Guide, 2023, 2023(12):31-33.
[3] 刘骁, 马玉侠.肠易激综合征非药物疗法与中医疗法综述[J].世界中西医结合杂志, 2015, 10(3):432-435.
LIU X, MA Y X.Summary of non-drug therapy and traditional Chinese medicine therapy for irritable bowel syndrome[J].World Journal of Integrated Traditional and Western Medicine, 2015, 10(3):432-435.
[4] 陈恩, 黄喆, 石远苹.利那洛肽联合马应龙痔疮膏在肠易激综合征便秘痔疮手术患者中的应用[J].实用中西医结合临床, 2021, 21(24):70-71.
CHEN E, HUANG Z, SHI Y P.Application of linalootide combined with ma yinglong hemorrhoids ointment in hemorrhoids surgery patients with irritable bowel syndrome constipation[J].Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine, 2021, 21(24):70-71.
[5] 冯子轩, 黄凌云, 孙玉财.栀子金花汤保留灌肠治疗实证肛窦炎60例[J].中国中西医结合外科杂志, 2015, 21(6):619-620.
FENG Z X, HUANG L Y, SUN Y C.Treatment of 60 cases of anosinusitis with Zhizi Jinhua decoction by retention enema[J].Chinese Journal of Surgery of Integrated Traditional and Western Medicine, 2015, 21(6):619-620.
[6] 姜志文, 秦江峰, 卢康, 等.安徽省合肥市公交车驾驶员慢性疾病的现况调查[J].上海预防医学, 2021, 33(12):1154-1158.
JIANG Z W, QIN J F, LU K, et al.Prevalence of chronic diseases among bus drivers in Hefei, Anhui[J].Shanghai Journal of Preventive Medicine, 2021, 33(12):1154-1158.
[7] 唐伟, 王巧民, 李明忠, 等.六安市慢性便秘流行病学调查[J].安徽医药, 2008, 12(5):426-429.
TANG W, WANG Q M, LI M Z, et al.A community population-based epidemiologic investigation of chronic constipation in Lu’an city[J].Anhui Medical and Pharmaceutical Journal, 2008, 12(5):426-429.
[8] LIANG J W, BAI W J, CHI L L.Clinical study on Jiawei lichang decoction in treatment of irritable bowel syndrome with diarrhea of liver depression and spleen deficiency type[J].Shandong Journal of Traditional Chinese Medicine, 2024, 43(10):1084-1091.
梁峻尉, 白文筠, 迟莉丽.加味理肠饮治疗肝郁脾虚型腹泻型肠易激综合征临床研究[J].山东中医杂志, 2024, 43(10):1084-1091.
[9] 徐振, 袁菲, 王育平.肠道屏障和肠道菌群与肠易激综合征[J].中国处方药, 2024, 22(12):204-206.
XU Z, YUAN F, WANG Y P.Intestinal barrier, intestinal flora and irritable bowel syndrome[J].Journal of China Prescription Drug, 2024, 22(12):204-206.
[10] 何裕智, 李俊.自动痔疮套扎术对直肠内脱垂合并便秘患者肠黏膜屏障功能及黏膜TRPV1、5-HT表达的影响[J].现代消化及介入诊疗, 2021, 26(5):607-610.
HE Y Z, LI J.Effect of automatic hemorrhoid ligation on intestinal mucosal barrier function and expression of TRPV1 and 5-HT in patients with rectal prolapse complicated with constipation[J].Modern Digestion &Intervention, 2021, 26(5):607-610.
[11] LAVAL L, MARTIN R, NATIVIDAD J, et al.Lactobacillus rhamnosus CNCM I-3690 and the commensal bacterium Faecalibacterium prausnitzii A2-165 exhibit similar protective effects to induced barrier hyper-permeability in mice[J].Gut Microbes, 2015, 6(1):1-9.
[12] 张芳芹, 徐桂芳, 邹晓平.益生菌和肠易激综合征[J].国际消化病杂志, 2012, 32(1):21-23;29.
ZHANG F Q, XU G F, ZOU X P.Probiotics and irritable bowel syndrome[J].International Journal of Digestive Diseases, 2012, 32(1):21-23;29.
[13] 孙海鑫, 李志勇, 陈智慧, 等.传统发酵酸鱼中乳酸菌的分离筛选及其表型分析[J].中国食品学报, 2024, 24(6):380-391.
SUN H X, LI Z Y, CHEN Z H, et al.Isolation, screening and phenotypic analysis of lactic acid bacteria from traditional fermented Suanyu[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(6):380-391.
[14] 余迪飞, 武连博, 康明慧, 等.荔枝草提取物对巴豆油诱导小鼠痔疮样特征和炎症的影响[J].山西医科大学学报, 2024, 55(12):1509-1515.
YU D F, WU L B, KANG M H, et al.Effect of litchi herb extract on hemorrhoid-like features and inflammation in croton oil-induced mice[J].Journal of Shanxi Medical University, 2024, 55(12):1509-1515.
[15] 刘笑含, 李天歌, 高婧昕, 等.低聚糖对小鼠脾淋巴细胞免疫平衡的调节作用[J].食品科学技术学报, 2024, 42(6):45-53.
LIU X H, LI T G, GAO J X, et al.Immunomodulatory effects of oligosaccharides on splenic lymphocytes in mice[J].Journal of Food Science and Technology, 2024, 42(6):45-53.
[16] 张露婷, 刘榉元, 孔淑文, 等.植物乳杆菌脂磷壁酸对小鼠肠炎的作用及其机制[J].食品科学技术学报, 2025, 43(1):44-54.
ZHANG L T, LIU J Y, KONG S W, et al.Effects of lipoteichoic acid from Lactobacillus plantarum on inflammatory bowel disease in mice and its mechanism[J].Journal of Food Science and Technology, 2025, 43(1):44-54.
[17] UBEDA C, LIPUMA L, GOBOURNE A, et al.Familial transmission rather than defective innate immunity shapes the distinct intestinal microbiota of TLR-deficient mice[J].The Journal of Experimental Medicine, 2012, 209(8):1445-1456.
[18] MATTANA C, MARIA G, PESCATORI M.Rubber band ligation of hemorrhoids and rectal mucosal prolapse in constipated patients[J].Diseases of the Colon and Rectum, 1989, 32(5):372-375.
[19] 陈孝红, 方昀, 赖忠红, 等.黄芪汤加减联合腧穴热敏化治疗老年气虚型便秘的临床研究[J].中国医学创新, 2025, 22(3):22-25.
CHEN X H, FANG Y, LAI Z H, et al.Clinical study of Huangqi decoction modified combined with heat sensitization of acupoints in the treatment of constipation with qi deficiency in the elderly[J].Medical Innovation of China, 2025, 22(3):22-25.
[20] 谢健进. 痔速宁对Ⅱ度内痔急性期的疗效[J].中国临床药理学杂志, 2013, 29(11):818-820.
XIE J J.Effect of Zhisuning tablets on the prognosis of patients with Ⅱ internal hemorrhoids[J].The Chinese Journal of Clinical Pharmacology, 2013, 29(11):818-820.
[21] CHEN Y, CHANG K J, HWANG L H, et al.Establishment and characterization of a rectal cancer model in mice:Application to cytokine gene therapy[J].International Journal of Colorectal Disease, 2002, 17(6):388-395.
[22] 连少雄. 亚甲蓝注射联合痔瘘祛毒熏洗剂坐浴用于环状混合痔术后的疗效观察[J].中国肛肠病杂志, 2023, 43(12):16-18.
LIAN S X.Clinical efficacy of methylene blue injection combined with Zhilou qudu formula for fumigation and washing sitz bath in postoperative annular mixed hemorrhoids[J].Chinese Journal of Coloproctology, 2023, 43(12):16-18.
[23] SCHAERLI P, EBERT L, WILLIMANN K, et al.A skin-selective homing mechanism for human immune surveillance T cells[J].Journal of Experimental Medicine, 2004, 199(9):1265-1275.
[24] HANG C H, SHI J X, TIAN J, et al.Effect of systemic LPS injection on cortical NF-kappaB activity and inflammatory response following traumatic brain injury in rats[J].Brain Research, 2004, 1026(1):23-32.
[25] SHI J S, AONO S, LU W Y, et al.A novel role for defensins in intestinal homeostasis:Regulation of IL-1beta secretion[J].Journal of Immunology, 2007, 179(2):1245-1253.
[26] CHIU Y H, HSIEH Y J, LIAO K W, et al.Preferential promotion of apoptosis of monocytes by Lactobacillus casei rhamnosus soluble factors[J].Clinical Nutrition, 2010, 29(1):131-140.
[27] YANABA K, YOSHIZAKI A, ASANO Y, et al.IL-10-producing regulatory B10 cells inhibit intestinal injury in a mouse model[J].The American Journal of Pathology, 2011, 178(2):735-743.
[28] 王玉含. 复方黄柏液涂剂联合中药熏洗治疗对肛周脓肿患者创面愈合及炎症因子的影响[J].中国医学创新, 2025, 22(2):46-50.
WANG Y H.Effect of compound huangbaiye pigmentum combined with traditional Chinese medicine fumigation and washing treatment on wound healing and inflammatory factors in patients with perianal abscess[J].Medical Innovation of China, 2025, 22(2):46-50.
[29] 李晓洁, 杨会举.中医护场理论指导下如意金黄散外敷对肛周脓肿术后创面的影响分析[J].医药论坛杂志, 2024, 45(23):2546-2550.
LI X J, YANG H J.Influence of external application of Ruyi Jinhuang powder under guidance of traditional Chinese medicine nursing field theory on wounds after perianal abscess surgery[J].Journal of Medical Forum, 2024, 45(23):2546-2550.
[30] 徐成木, 杜美萱, 朱维娜, 等.基于网络药理学和分子对接法探讨乙字汤治疗痔病的作用机制[J].湖南中医杂志, 2021, 37(12):152-157;177.
XU C M, DU M X, ZHU W N, et al.Mechanism of action of Yizi decoction in treatment of hemorrhoid based on network pharmacology and molecular docking[J].Hunan Journal of Traditional Chinese Medicine, 2021, 37(12):152-157;177.
[31] BOURGEON S, RACLOT T.Corticosterone selectively decreases humoral immunity in female eiders during incubation[J].Journal of Experimental Biology, 2006, 209(24):4957-4965.
[32] PAYNE V, KAM P C A.Mast cell tryptase:A review of its physiology and clinical significance[J].Anaesthesia, 2004, 59(7):695-703.
[33] 胡旭光, 廖淑莉, 王颖芳, 等.痛泻要方中配伍“风药” 对PI-IBS模型大鼠PAR2 mRNA表达及炎症介质的影响[J].中药新药与临床药理, 2013, 24(1):5-9.
HU X G, LIAO S L, WANG Y F, et al.Effect of Radix saposhnikoviae in Tongxie Yaofang on PAR2 mRNA expression and inflammatory mediators in the colon of rats with postinfection irritable bowel syndrome[J].Traditional Chinese Drug Research and Clinical Pharmacology, 2013, 24(1):5-9.
[34] 吕红英, 侯明双, 贾冠军, 等.TRPV1在心血管疾病中的作用及相关中医药研究进展[J].中国现代应用药学, 2024, 41(4):556-566.
LYU H Y, HOU M S, JIA G J, et al.Role of TRPV1 in cardiovascular disease and the related progress of traditional Chinese medicine research[J].Chinese Journal of Modern Applied Pharmacy, 2024, 41(4):556-566.
[35] MACHIELS K, JOOSSENS M, SABINO J, et al.A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis[J].Gut, 2014, 63(8):1275-1283.
[36] KELLY D, MULDER I E.Microbiome and immunological interactions[J].Nutrition Reviews, 2012, 70(1):S18-S30.
[37] SCHIFFRIN E J, BLUM S.Interactions between the microbiota and the intestinal mucosa[J].European Journal of Clinical Nutrition, 2002, 56(3):S60-S64.
[38] 董思思. 双歧杆菌乳杆菌三联活菌片联合乳果糖治疗老年2型糖尿病合并便秘患者的疗效分析[J].系统医学, 2024, 9(20):51-54.
DONG S S.Analysis of the efficacy of Bifidobacterium and Lactobacillus triple viable tablets combined with lactulose in the treatment of constipation in elderly patients with type 2 diabetes mellitus[J].Systems Medicine, 2024, 9(20):51-54.
[39] YU M Z, SHANG Y, HAN L L, et al.Bowel habits, obesity, intestinal microbiota and their influence on hemorrhoidal disease:A mendelian randomization study[J].Clinical and Experimental Gastroenterology, 2024, 17:157-164.
[40] KIM H J, JEON H J, KIM D G, et al.Lacticaseibacillus paracsei HY7207 alleviates hepatic steatosis, inflammation, and liver fibrosis in mice with non-alcoholic fatty liver disease[J].International Journal of Molecular Sciences, 2024, 25(18):9870.
[41] 李雪莉, 虞徳夫, 王超, 等.植物乳杆菌制剂对断奶仔猪肠道黏膜功能和微生物菌群及短链脂肪酸的影响[J].南京农业大学学报, 2018, 41(3):504-510.
LI X L, YU D F, WANG C, et al.Effects of Lactobacillus plantarum on intestinal mucosa function, microbial community and short chain fatty acids in weaning piglets[J].Journal of Nanjing Agricultural University, 2018, 41(3):504-510.
[42] KESPOHL M, VACHHARAJANI N, LUU M, et al.The microbial metabolite butyrate induces expression of Th1-associated factors in CD4+ T cells[J].Frontiers in Immunology, 2017, 8:1036.
[43] ZHENG L, KELLY C J, BATTISTA K D, et al.Microbial-derived butyrate promotes epithelial barrier function through IL-10 receptor-dependent repression of claudin-2[J].Journal of Immunology, 2017, 199(8):2976-2984.
[44] ESLICK S, WILLIAMS E J, BERTHON B S, et al.Weight loss and short-chain fatty acids reduce systemic inflammation in monocytes and adipose tissue macrophages from obese subjects[J].Nutrients, 2022, 14(4):765.
[45] SPILJAR M, MERKLER D, TRAJKOVSKI M.The immune system bridges the gut microbiota with systemic energy homeostasis:Focus on TLRs, mucosal barrier, and SCFAs[J].Frontiers in Immunology, 2017, 8:1353.