急性肾损伤(acute kidney injury, AKI)是一种由多种病因引起的临床综合征,主要表现为肾功能的急速衰减,同时也是导致慢性肾衰竭的关键因素之一。全球范围内,每年新增AKI病例约1 300万例,且在住院患者中的发病率高达13%~18%,使其成为全球公共卫生领域面临的重大挑战之一[1]。目前用于AKI的药物主要包括利尿剂、血管活性药物、肾素抑制剂等[2],这些药物在治疗AKI中发挥着重要作用,但也会造成电解质失衡、血压过低、肾功能恶化等潜在的风险[3]。
炎症在AKI的发病机制中扮演着重要角色[4]。在致病因素作用下,肾脏组织遭受刺激,导致机体内高迁移率族蛋白B1(high mobility group protein B1,HMGB1)的表达水平显著升高。HMGB1与Toll样受体(Toll-like receptors,TLR)相互作用,活化了NLRP3炎性小体并激活NF-κB信号通路,从而催化了炎症因子和趋化因子的生成。这一系列反应加剧了炎症损伤和细胞凋亡,最终导致肾脏组织的受损[5]。此外,肾小管上皮细胞因损伤和炎症反应而诱发的成纤维细胞活化,进一步加剧了肾脏的损伤程度。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)作为肌成纤维细胞的标志物,Ⅰ型胶原蛋白α1(collagen type Ⅰ,Colla1)是其合成的主要胶原蛋白。它们表达的增加表明肾纤维化启动,从而加重AKI的程度[6]。在AKI的发生过程中,G偶联蛋白受体43(G protein-coupled receptor 43,GPR43)的表达水平显著降低。通过提高GPR43的表达,可以有效调控巨噬细胞的表型转变,抑制炎症因子的产生,并阻止中性粒细胞内晶体的释放,从而在一定程度上延缓肾纤维化的发展[7]。
已有研究报道,一株脆弱拟杆菌具有抑制炎症因子生成,调控巨噬细胞表型的功能,其代谢物还能调节转运蛋白,从而改善顺铂引起的炎症和肾纤维化症状[8]。另一方面,研究者从婴儿粪便样本中分离出来的2种双歧杆菌,即FL228.1和FL276.1,能够通过肠-肾轴途径,有效地缓解由腺嘌呤引发的AKI症状[9]。肠道菌群产生的丁酸盐通过与G蛋白偶联受体GPR41及GPR43的结合作用,能够有效调控肠道激素的释放,进而在小鼠肾脏组织中显著提高抗炎因子的表达水平,降低氧化应激及细胞凋亡的发生率,从而有效减轻肾脏组织的损害[10]。
顺铂被广泛应用于构建小鼠AKI的模型中[11]。本研究通过细胞实验筛选出一种能够缓解细胞炎症的罗伊氏粘液乳杆菌DYNDL56M17,并使用顺铂诱导构建小鼠AKI模型,深入探究罗伊氏粘液乳杆菌DYNDL56M17活菌、菌体裂解物和发酵上清液对AKI小鼠的缓解功效。通过分析肾脏炎症反应和氧化应激等生理变化,尝试解析缓解AKI的作用机制。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、细胞和实验动物
罗伊氏粘液乳杆菌DYNDL56M17,分离自健康成人粪便,保存于江南大学食品学院生物技术中心;小鼠巨噬细胞RAW264.7,中国科学院上海细胞研究所;6周龄无特定病原体(specific pathogen free,SPF)级雄性C57BL/6J小鼠,浙江维通利华实验动物技术有限公司。
1.1.2 试剂
葡萄糖、胰蛋白胨、酵母粉、牛肉膏、无水乙酸钠、柠檬酸氢二铵、小檗碱、K2HPO4、MgSO4·7H2O、MnSO4· H2O、吐温-80、NaCl、乳酸钠水溶液,国药集团化学试剂有限公司;大豆蛋白胨FP410、牛骨蛋白胨FP326、鱼骨蛋白胨FP351,安琪酵母股份有限公司;葡萄糖试剂盒,上海荣盛生物药业有限公司。
1.2 仪器与设备
Multiscan Go多功能酶标仪、ZHJH_C1115B超净工作台,上海智诚有限公司;HWS-150恒温恒湿培养箱,上海森信有限公司;UV-1800紫外分光光度器,苏州岛津公司;EL3002分析天平、FE- 20pH计,上海梅特勒公司;542R高速离心机,德国艾本德公司;MLS-3750蒸汽灭菌锅,日本三洋公司;高通量组织研磨机,宁波新芝生物科技股份有限公司;切片电子扫描仪,匈牙利3DHISTECH公司;T100 PCR扩增仪、实时荧光定量PCR仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 菌株样品制备
罗伊氏粘液乳杆菌DYNDL56M17于MRS培养基中厌氧培养24 h,取样进行活菌计数。随后在4 ℃、8 000×g的条件下离心20 min,收集菌泥和发酵上清液。一部分菌泥,按1∶1(g∶mL)的比例用10%脱脂牛奶重悬后冻干,获得活菌组样品;另一部分菌泥,按1∶5(g∶mL)的比例用无菌生理盐水重悬,于65 ℃灭活30 min后经过高压均质机均质(800~1 200 MPa)10次,得到菌体裂解物。发酵上清液在经过冻干处理后,得到发酵上清液冻干粉。所有样品在细胞实验前均经0.22 μm水系滤膜过滤。
1.3.2 小鼠RAW264.7细胞中细胞因子含量及GPR43表达水平的测定
将对数生长期的小鼠巨噬细胞(RAW264.7 细胞)以1×104个细胞/孔的浓度接种于96孔板,每孔加入100 μL,培养24 h待其贴壁后,设置对照组和菌株样品处理组,菌株样品处理组为用细胞完全培养基重悬的菌体裂解物和发酵上清液(菌体裂解物和发酵上清液的量由1.0×107 CFU/mL的活菌发酵制得),每组设置6个复孔。24 h后收集细胞上清液,按照ELISA试剂盒说明书检测上清液中白细胞介素10(interleukin-10,IL-10)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量。TNF-α实验多设置1组造模组,造模组为加入含6%脂多糖的细胞培养液。
在6孔细胞培养板中加入2×105个细胞/孔,于37 ℃、5% CO2的孵育条件下培养24 h。实验组别设置对照组、模型组和菌株样品处理组,对照组加入6%体积的PBS;模型组加入6%体积的造模剂(200 pg/mL的GPR43抑制剂溶液);菌株样品处理组的细胞培养液分别加入6%体积的菌体裂解物和发酵上清液的溶液(菌体裂解物和发酵上清液的量由1.0×108CFU/mL的活菌发酵制得),每组设置3个复孔,培养24 h。培养完成后,弃掉培养基上清液,收集皿底细胞。按照RNA提取试剂盒(RC101-01,50 rxn)说明书进行细胞的RNA提取,使用RNA反转录试剂盒将RNA逆转录为cDNA并以cDNA为模板进行扩增。通过实时荧光定量法检测RAW264.7细胞中基因的表达情况,以GAPDH作为内参,利用2-ΔΔCt公式计算GPR43 mRNA的相对表达量,所述的引物如表1所示。
表1 基因引物序列
Table 1 Primer sequence of genes

基因上游引物序列下游引物序列GPR43CCGTGCAGTACAAGCTCTCCCTGCTCAGTCGTGTTCAAGTATT GAPDHGCAAAGTGGAGATTGTTGCCATCCTTGACTGTGCCGTTGAATTT
1.3.3 动物实验
本实验方案已获得江南大学实验动物实验伦理委员会批准(伦理编号:JN.No20240315c1620515[089])。选取36只6周龄SPF级C57BL/6J雄性小鼠饲养在室温(23±2) ℃、湿度(50±10)%、12 h光暗交替循环的环境中。所有小鼠适应饲养1周后,随机分为空白组、模型组、阳性组和实验组(包括活菌组、菌体裂解物组和发酵上清液组)。参照THOMPSON等[12]的实验方法,在每次灌胃前将活菌、菌体裂解物和发酵上清液的冻干粉用生理盐水复溶,活菌浓度为5×109 CFU/mL,菌体裂解物和发酵上清液均由等浓度活菌制得;用生理盐水配置75 mg/mL的小檗碱溶液。在1~14 d,实验组小鼠每日灌胃0.2 mL的对应样品溶液,阳性组小鼠每日灌胃0.2 mL的小檗碱溶液,空白组和模型组小鼠每日则灌胃0.2 mL的生理盐水。在实验第8天,除空白组外,其余小鼠连续7 d(8~14 d)腹腔注射20 mg/kg顺铂,空白对照组小鼠注射等体积生理盐水。具体动物实验设计及流程如图1所示。实验第15天,对小鼠进行眼部采血并辅以脱颈处死,随后收集肾脏样本。左肾固定在4%多聚甲醛溶液中,而右肾迅速液氮冷冻保存。血液样本静置30 min后,在4 ℃条件下,以3 500×g 离心15 min,收集上清液在-20 ℃低温下保存。在造模过程中,记录小鼠的每日体重和进食量。
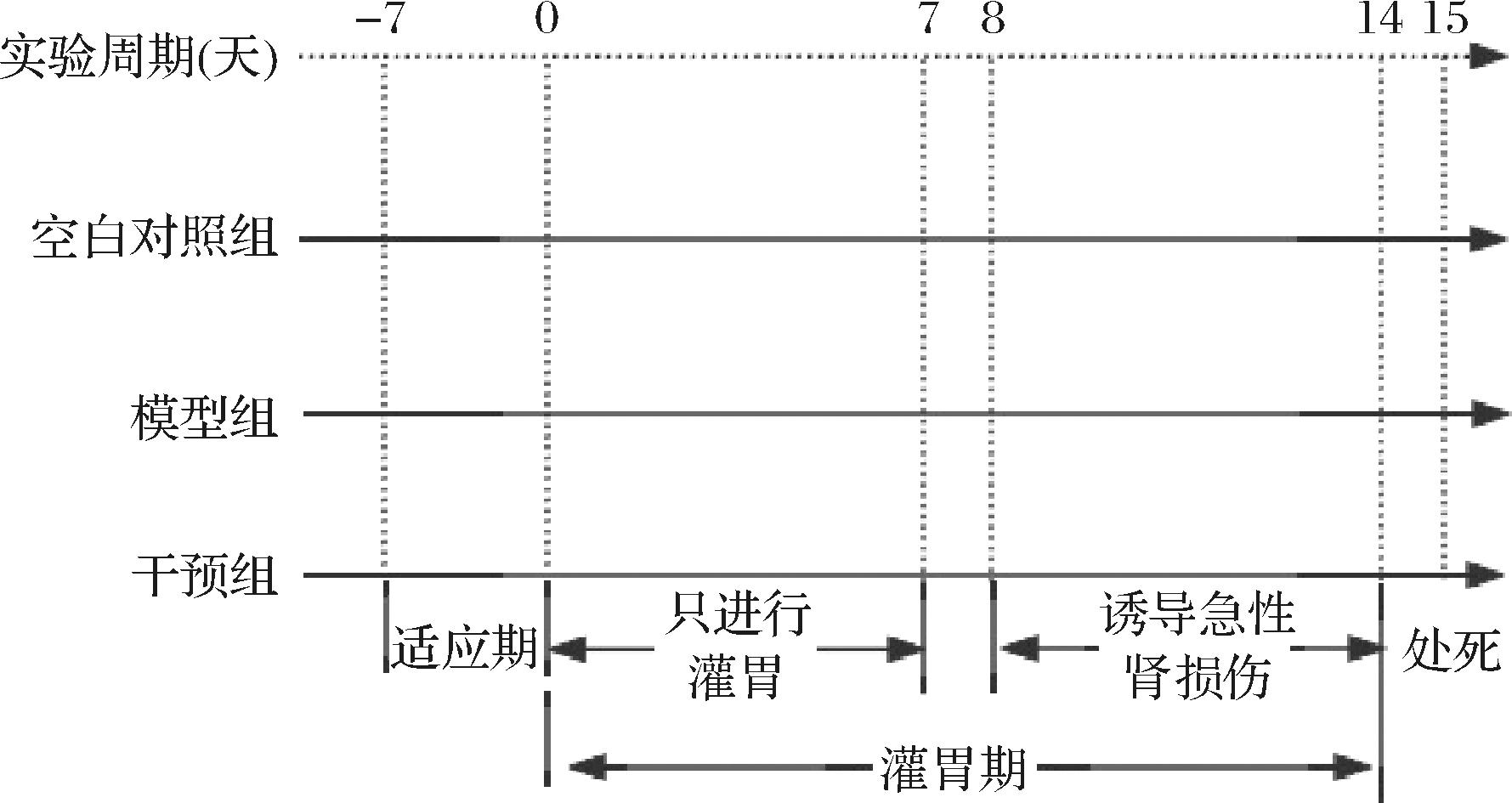
图1 动物实验设计方案流程图
Fig.1 Flow chart illustrating the animal experimental design scheme
1.3.4 肾脏病理学切片
解剖获得的左肾送至武汉赛维尔生物科技有限公司进行肾脏HE染色切片制备。随后用切片扫描仪进行扫描,观测病理情况。
1.3.5 小鼠血清中肌酐和尿素氮含量的测定
使用生化分析仪检测小鼠血清中肌酐和尿素氮含量。
1.3.6 肾脏组织的炎症和氧化应激水平
取20 mg肾脏组织与180 μL PBS于1.5 mL离心管中,使用高通量组织研磨机进行研磨。随后将研磨后的组织匀浆以12 000×g、4 ℃下离心15 min,收集上清液。根据试剂盒说明书,测定肾脏组织中的IL-10、TNF-α、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平。
1.3.7 实时荧光定量PCR
以GAPDH为内参,检测肾脏组织中GPR43、HMGB1、Colla1和α-SMA的mRNA表达水平。使用TRIzol试剂盒提取肾脏组织RNA,用RT-PCR反转录试剂盒将其逆转录为cDNA,通过实时荧光定量PCR检测相关基因表达,使用2-ΔΔCt 公式计算结果。相关基因的引物详见表2。
表2 基因引物序列
Table 2 Primer sequence of genes
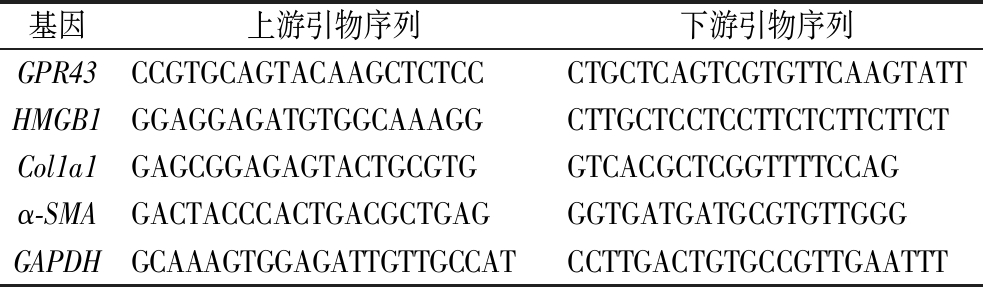
基因上游引物序列下游引物序列GPR43CCGTGCAGTACAAGCTCTCCCTGCTCAGTCGTGTTCAAGTATT HMGB1GGAGGAGATGTGGCAAAGGCTTGCTCCTCCTTCTCTTCTTCTCol1a1GAGCGGAGAGTACTGCGTGGTCACGCTCGGTTTTCCAGα-SMAGACTACCCACTGACGCTGAGGGTGATGATGCGTGTTGGGGAPDHGCAAAGTGGAGATTGTTGCCATCCTTGACTGTGCCGTTGAATTT
1.3.8 数据分析
2组以上的差异采用单因素方差分析。利用GraphPad Prism 9.0软件进行数据统计分析做图。本文中不同字母表示与模型组间有显著差异(P<0.05)。
2 结果与分析
2.1 罗伊氏粘液乳杆菌对RAW264.7细胞炎症因子和抑炎因子表达水平的测定
本研究评估了罗伊氏粘液乳杆菌DYNDL56M17制备的菌体裂解物和发酵上清液对RAW264.7细胞中IL-10含量、TNF-α含量及GPR43基因表达的影响。如图2-a所示,罗伊氏粘液乳杆菌DYNDL56M17的菌体裂解物和发酵上清液显著提高了IL-10的含量(P<0.05),与对照组相比,从65 pg/mL分别增加至87、92 pg/mL。如图2-b所示,LPS干预细胞后,显著上调了TNF-α含量(模型组为95 pg/mL),表明模型建立成功。与LPS组相比,菌体裂解物组和发酵上清液组显著降低了TNF-α水平(P<0.05),分别降至57、52 pg/mL。此外,DYNDL56M17的菌体裂解物和发酵上清液显著上调了GPR43基因的表达(P<0.05),较模型组分别增加87.5%和125%。这些结果表明,罗伊氏粘液乳杆菌DYNDL56M17的菌体裂解物和发酵上清液通过降低TNF-α水平、提高IL-10水平及上调GPR43基因表达,发挥了显著的抗炎作用,尤其是发酵上清液在调节这些炎症相关指标方面效果更加突出,为其在炎症干预中的应用提供了潜在支持。
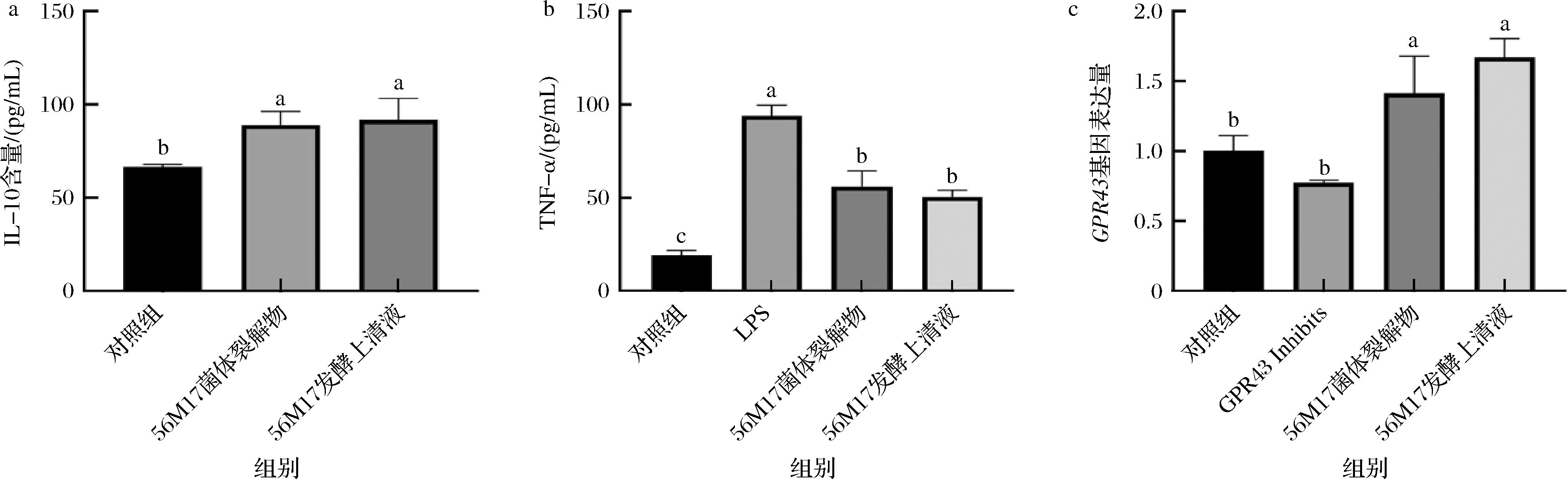
a-IL-10含量;b-TNF-α含量;c-GPR43基因表达量
图2 罗伊氏粘液乳杆菌DYNDL56M17对RAW264.7细胞细胞因子及基因表达的影响
Fig.2 Effects of Limosilactobacillus reuteri DYNDL56M17 on cytokine production and gene expression in RAW264.7 cells
注:不同小写字母表示差异显著(P<0.05)(下同)。
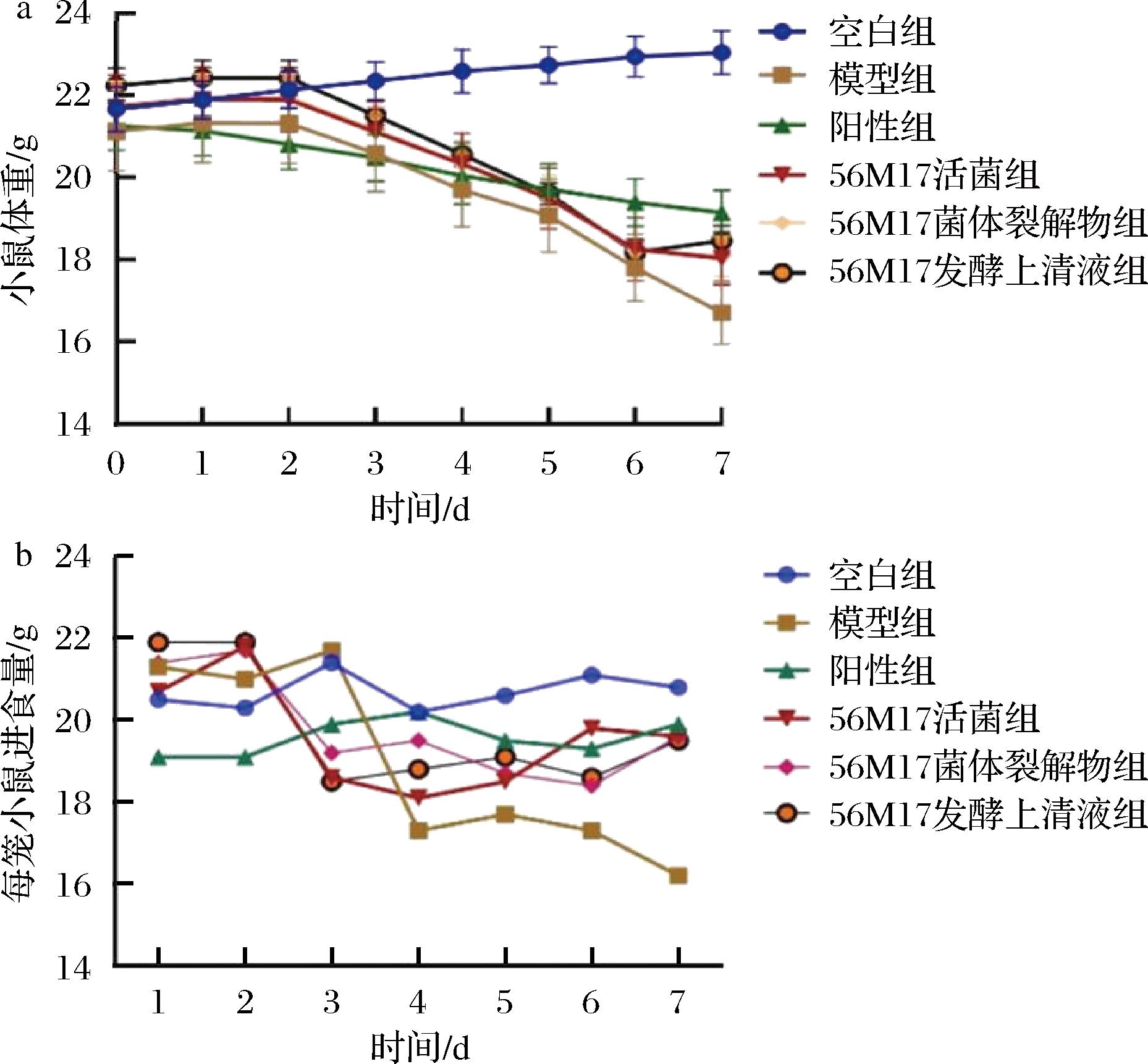
a-小鼠体重;b-小鼠进食量
图3 造模期间小鼠体重和进食量变化
Fig.3 Changes in mouse body weight and food intake during modeling
2.2 罗伊氏粘液乳杆菌改善AKI小鼠的体重和进食量
顺铂诱导的AKI会使小鼠产生厌食反应,导致进食量减少及体重急剧下降。因此,体重和进食量是实验过程中间接评判小鼠肾脏损伤的重要指标[13]。如图3-a所示模型组小鼠的体重迅速下降至16.2 g,而小檗碱干预缓解了体重下降的趋势,这与以往文献的报道相一致[14]。与模型组相比,灌胃3组菌株样品(罗伊氏粘液乳杆菌活菌、菌体裂解物和发酵上清液)后,小鼠体重的下降幅度均有效减缓。尤其是发酵上清液组,其效果与阳性组相当。如图3-b所示,模型组小鼠第7天的每笼进食量为16.5 g,比空白组下降18.7%。在实验组(罗伊氏粘液乳杆菌活菌组、菌体裂解物组和发酵上清液组)中,各组的进食量相较于模型组分别提升了15.8%、16.3%和17.6%,改善了小鼠进食量减少的症状,其效果均与阳性组相当。
2.3 罗伊氏粘液乳杆菌DYNDL56M17对AKI小鼠肾脏组织的影响
HE染色切片是观察组织病理最直观的方法,能够有效反映肾小管、肾小球、肾间质的损伤情况。观察小鼠肾脏组织的横向切片(图4),发现正常小鼠肾脏组织中,肾小管排列整齐,肾小球轮廓完整平滑,肾间质无炎症细胞浸润,各部分界限清晰,未见病理学损伤。模型组则显示肾小管明显扩张和变形,肾间质被大量炎症细胞浸润,胞质染色加深,呈现出典型的病理变化。罗伊氏粘液乳杆菌DYNDL56M17活菌、菌体裂解物和发酵上清液干预后,小鼠肾脏组织的病理切片相较于模型组显示出明显的改善,表现为肾小管由粗糙变平滑,肾间质炎症细胞数量减少,病理损伤有所恢复。结果表明,罗伊氏粘液乳杆菌DYNDL56M17的活菌、菌体裂解物和发酵上清液均能够有效缓解肾脏损伤,并在一定程度上减少顺铂对机体的伤害。
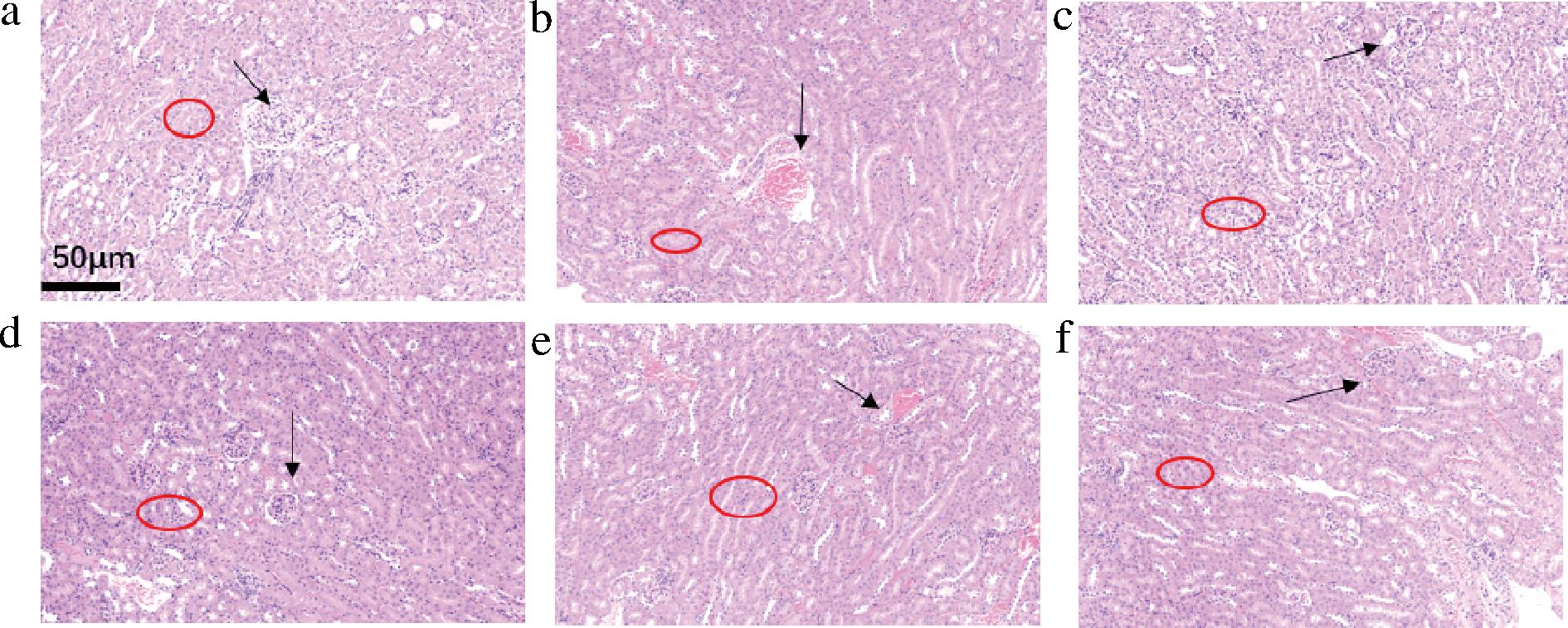
a-空白组;b-模型组;c-阳性组;d-活菌组;e-菌体裂解物组;f-发酵上清液组
图4 肾脏HE染色
Fig.4 HE staining of the kidneys
注:黑色箭头指示肾小球;红色圆圈指示肾间质。
2.4 罗伊氏粘液乳杆菌有效降低AKI小鼠血清中肌酐和尿素氮的含量
血清中肌酐与尿素氮作为机体代谢产物,在肾脏功能受损时,其代谢过程会遭受阻碍,导致这些代谢物在血清中的含量增加。因此,肌酐与尿素氮是评估肾功能损伤程度的重要生化指标[15]。如图5所示,模型组小鼠血清肌酐含量较空白组小鼠显著升高,尿素氮含量从12.3 mmol/L升高至36.7 mmol/L,表明AKI模型建立成功。与模型组小鼠相比,阳性组、活菌组、菌体裂解物组和发酵上清液组分别使AKI小鼠血清肌酐水平显著降低了52.2%、18.6%、21.1%和27.9% (图5-a)。其中,发酵上清液降低肌酐含量的能力优于活菌和菌体裂解物。如图5-b所示,与模型组相比,阳性组、活菌组、菌体裂解物组和发酵上清液组使模型小鼠血清中尿素氮含量显著减少了60.51%、20.3%、10.1%和16.7%。相较于菌体裂解物,活菌和发酵上清液在降低尿素氮浓度方面展示出更为显著的效果。总之,发酵上清液在降低小鼠血清肌酐和尿素氮水平的综合能力方面,明显优于活菌和菌体裂解物。
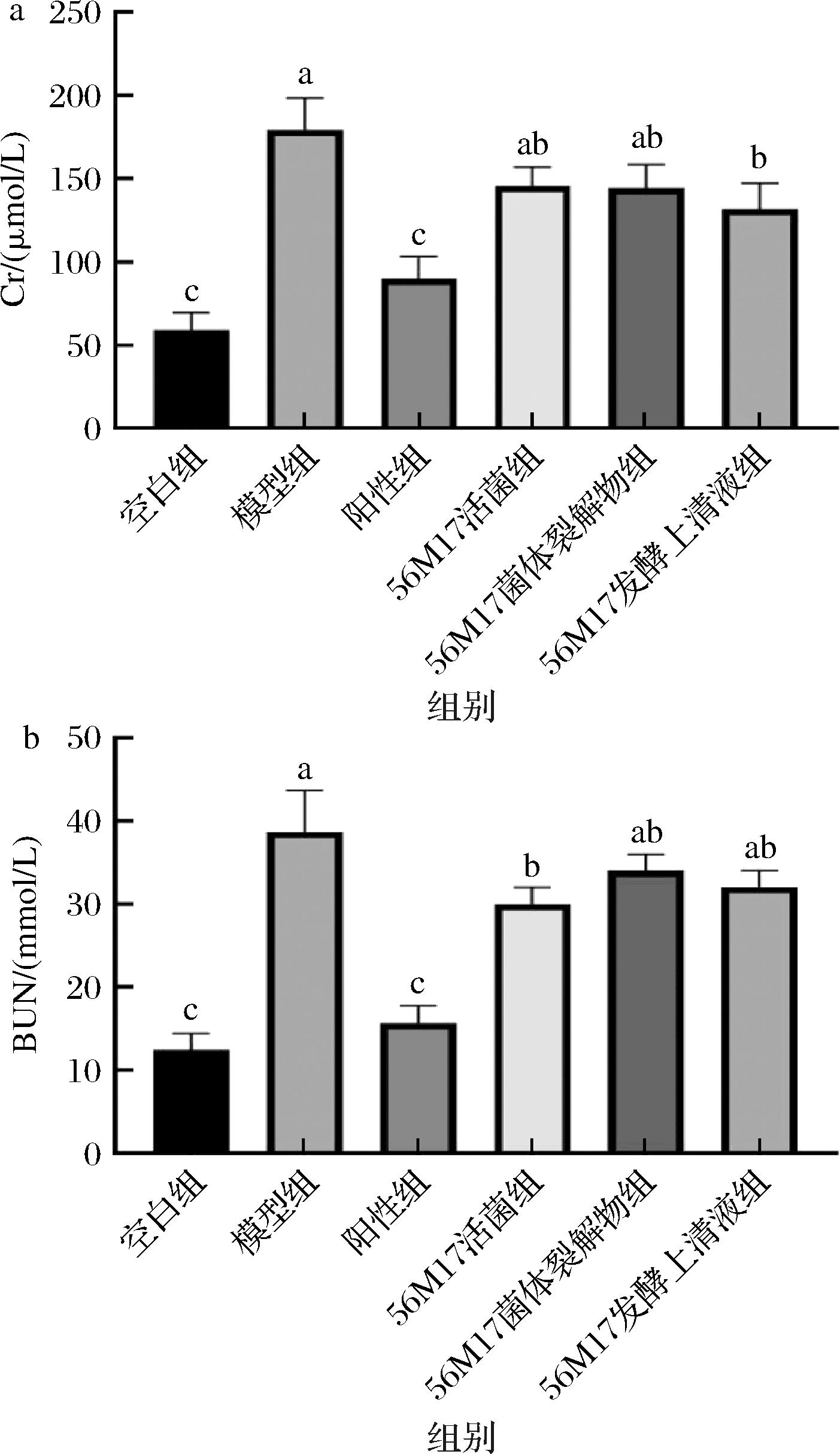
a-小鼠血清肌酐水平;b-小鼠血清尿素氮水平
图5 小鼠血清肌酐和尿素氮表达水平
Fig.5 Serum creatinine and blood urea nitrogen expression levels AKI model mice
2.5 罗伊氏粘液乳杆菌对AKI小鼠肾脏组织炎症因子含量的影响
AKI与炎症反应密切相关[16]。顺铂诱导的AKI激活肾脏内的炎症信号通路,导致肾小管上皮细胞及免疫细胞受损,促进TNF-α释放并抑制IL-10分泌。这些细胞因子经信号传导级联反应,进而激活巨噬细胞、单核细胞以及中性粒细胞,引发更为剧烈的炎症反应。随着免疫细胞浸润肾脏组织,局部炎症加剧,更多炎症介质被释放,形成恶性循环,进一步加重肾脏损伤。此外,持续的炎症反应不仅可能导致AKI,还有进展至慢性肾脏疾病的潜在风险。
如图6所示,与空白组相比,模型组小鼠肾脏组织中炎症因子TNF-α的含量显著升高,抑炎因子IL-10的含量明显降低。相较于模型组,小檗碱的改善效果较为明显,其炎症因子和抑炎因子的水平接近于空白组,与过往文献表现相同[17]。与模型组相比较,活菌组、菌体裂解物组和发酵上清液组在TNF-α指标上分别下降了14.2%、27.7%和31.9%。与此同时,活菌组、菌体裂解物组和发酵上清液组小鼠的IL-10相较于模型组分别提升了31.2%、30.8%和44.4%。因此,罗伊氏粘液乳杆菌DYNDL56M17的活菌、菌体裂解物和发酵上清液均具备抑制炎症因子TNF-α分泌、提升抑炎因子IL-10含量的能力,从而有效地缓解小鼠的炎症损害。
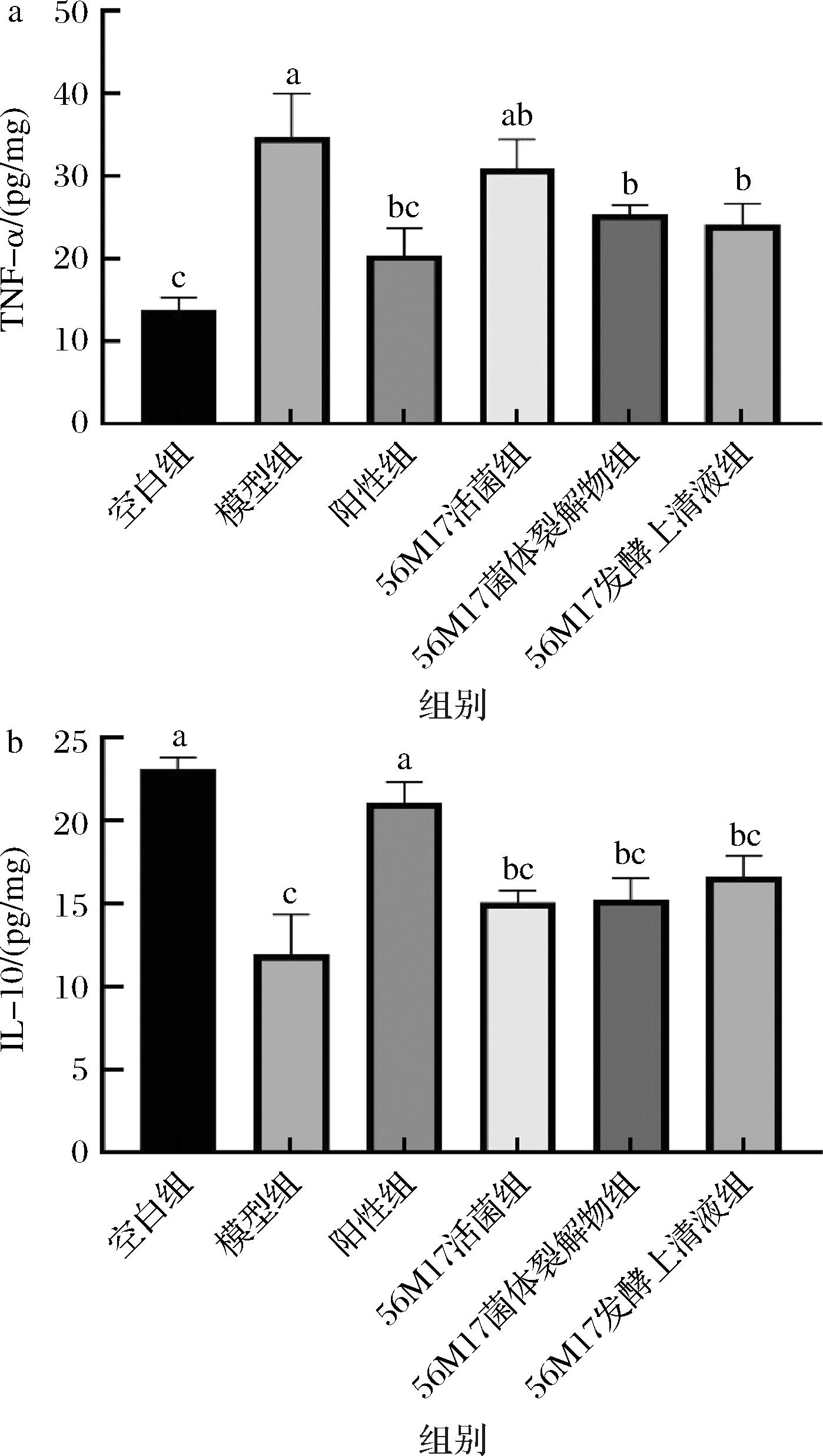
a-肾脏组织TNF-α水平;b-肾脏组织IL-10水平
图6 小鼠肾脏组织细胞因子表达水平
Fig.6 Cytokines expression levels in mouse kidney tissues
2.6 罗伊氏粘液乳杆菌对AKI小鼠肾脏组织氧化应激的影响
在AKI过程中,氧化应激是关键的病理机制之一,尤其是在顺铂诱导的AKI模型中。顺铂会导致肾细胞的线粒体功能受损,从而产生过量的活性氧(reactive oxygen species,ROS),进一步加剧氧化损伤。当ROS生成过量时,细胞膜上的多不饱和脂肪酸会发生脂质过氧化反应,生成更多的脂质过氧化产物MDA。与此同时,抗氧化系统中的SOD和GSH-Px的活性显著降低,削弱了机体清除ROS的能力。这种失衡导致细胞损伤和炎症反应加剧,最终造成肾脏功能障碍[18]。
如图7所示,与空白组相比,模型组小鼠肾脏组织中MDA含量显著升高137.9%,而SOD和GSH-Px抗氧化酶活性分别降低65.1%、68.7%,表明模型组小鼠肾脏抗氧化能力减弱。与模型组相比,阳性药物组的MDA含量显著降低,而SOD和GSH-Px的酶活性分别升高了103.2%、166.7%。与模型组相比,活菌组、菌体裂解物组和发酵上清液组均降低了MDA的含量,但是效果不显著。同时,SOD和GSH-PX的活性在干预后均有所提高。其中,SOD活性从模型组的18.75 U/mg分别升高至活菌组的31.68 U/mg、菌体裂解物组的33.82 U/mg和发酵上清液组的27.96 U/mg,GSH-Px活性则从模型组的98.79 U/mg分别升高至活菌组的223.78 U/mg、菌体裂解物组的186.46 U/mg和发酵上清液组的181.49 U/mg。上述结果说明,罗伊氏粘液乳杆菌DYNDL56M17会增加AKI小鼠抗氧化能力,同时降低顺铂诱导的脂质氧化产物MDA的含量,减少氧化损伤,其中发酵上清液在抑制氧化应激方面效果优于活菌和菌体裂解物。
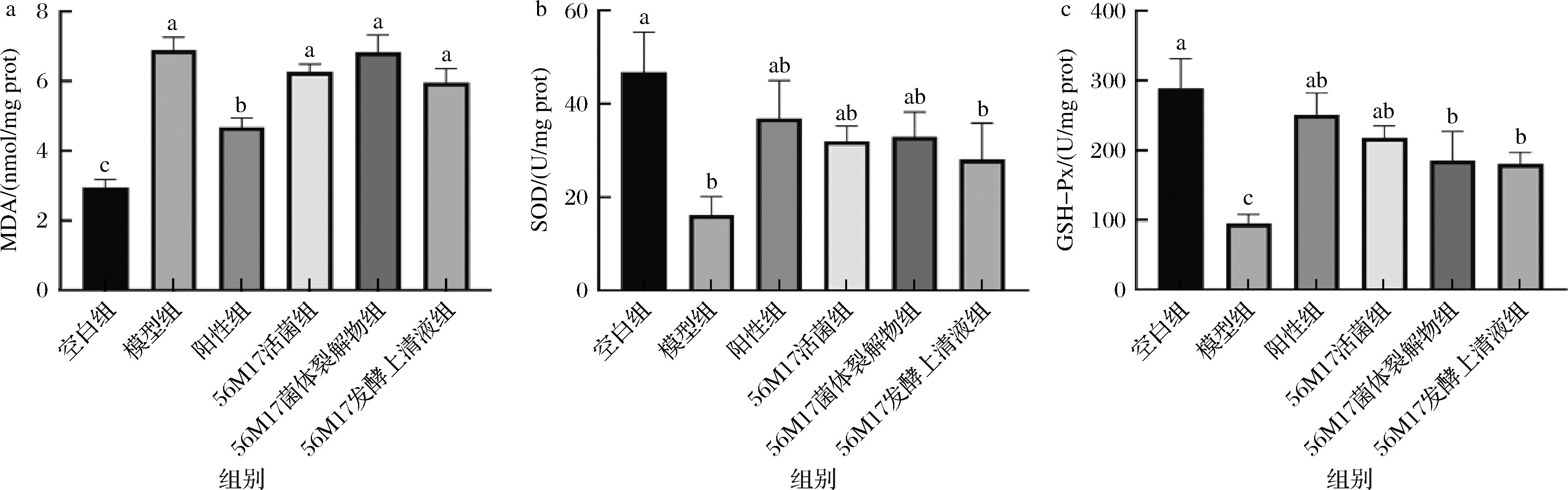
a-MDA;b-SOD;c-GSH-Px
图7 小鼠肾脏组织MDA、SOD、GSH-Px表达水平
Fig.7 Expression levels of MDA, SOD, and GSH-Px in mouse kidney tissues
2.7 罗伊氏粘液乳杆菌抑制小鼠肾脏炎症损伤和纤维化相关基因的表达
GPR43作为一种G蛋白偶联受体通过与短链脂肪酸结合能有效地抑制炎症因子的释放,并促进抗炎因子的产生,进而降低机体炎症反应。此外,研究表明,在AKI的过程中,GPR43具有调节免疫细胞表型的能力,进而减轻肾脏的炎症损伤[19]。HMGB1作为机体炎症状态的关键指标之一,抑制其表达能够显著改善炎症性损害[18]。Colla1是纤维化的重要标志物,当它的表达水平上升,可能预示着肾脏纤维化的进行,并引发不可逆转的肾功能损害。此外,α-SMA被视为肌成纤维细胞的标志,其在AKI后的表达上调,象征着肌成纤维细胞的激活以及肾纤维化的启动。在AKI恢复阶段,α-SMA和Colla1的持续高表达暗示了肾脏修复过程可能倾向于纤维化,而非正常组织的恢复,这可能最终诱发慢性肾病的发生。因此,α-SMA和Colla1在AKI中的表达升高被视为肾纤维化的重要指标[20]。
根据图8的结果,与对照组相比,模型组中GPR43基因的表达量显著下降,而HMGB1、Colla1和α-SMA基因的表达水平则明显增加。通过灌胃罗伊氏粘液乳杆菌可以调节这些基因在小鼠体内的表达。相对于模型组,活菌组、菌体裂解物组以及发酵上清液组都能在不同程度上降低HMGB1、Colla1和α-SMA基因的表达水平。如图8-a所示,相较于空白对照组,模型组GPR43的表达降低了52.3%。与模型组相比,56M17活菌、56M17菌体裂解物和56M17发酵上清液显著增加GPR43的表达。如图8-b所示,与空白对照组相比,模型组HMGB1的表达显著增加2.0倍。活菌、菌体裂解物和发酵上清液干预显著下调了HMGB1的表达,与模型组相比分别下调了40.0%、37.6%和47.6%。如图8-c所示,与空白对照组相比,模型组Colla1基因的表达量上调了4.2倍,与模型组相比,干预后分别下调了56.0%、53.1%和56.4%;如图8-d所示,模型组α-SMA的表达显著上升了4.8倍。经过菌株样品干预后显著下调了HMGB1的表达,与模型组相比分别下调了34.5%、35.6%和28.1%。研究结果表明,罗伊氏粘液乳杆菌能够有效地抑制肾炎和肾纤维化相关基因的表达,从而有效缓解了急性肾损伤的病理过程。
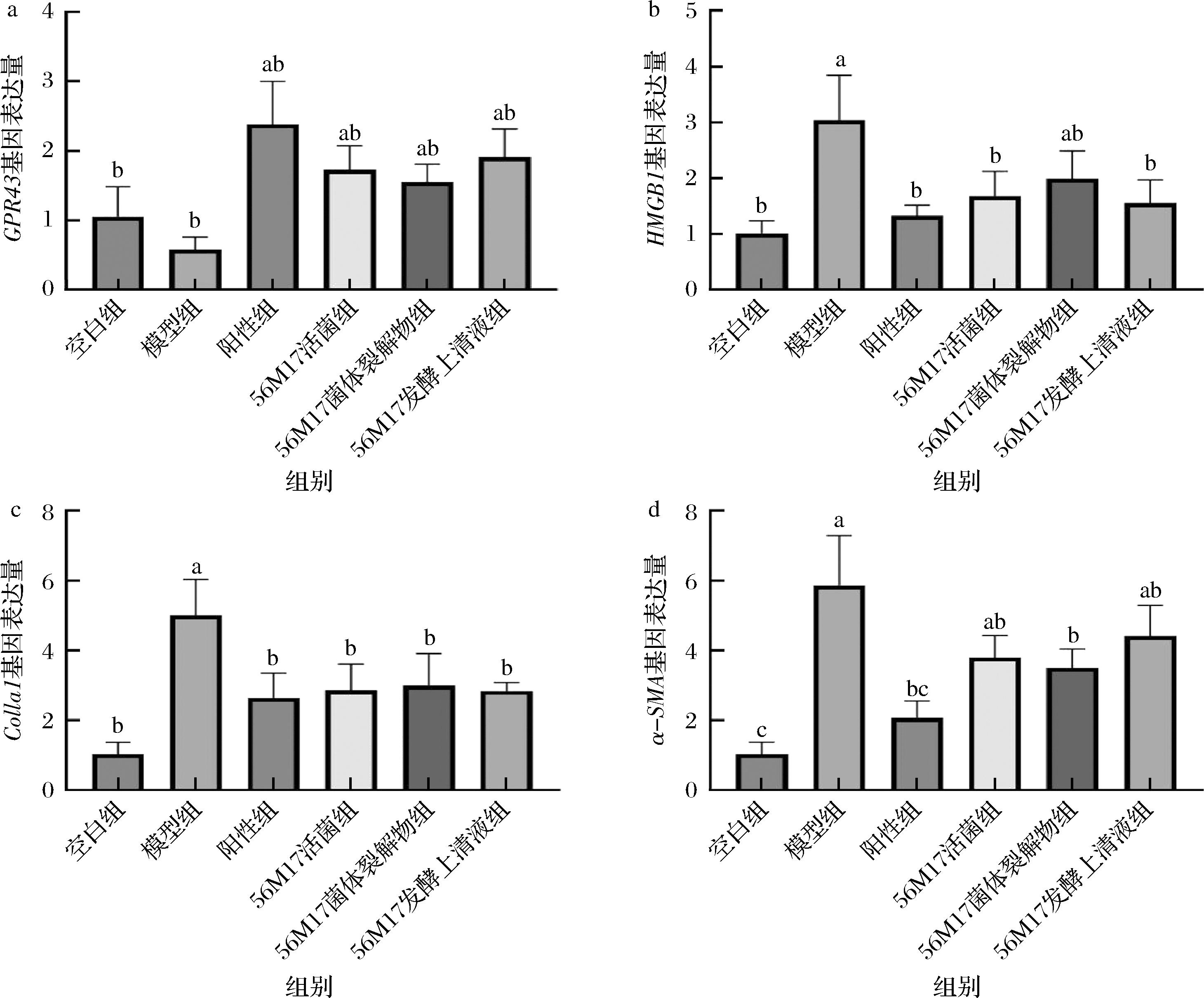
a-GPR43;b-HMGB1;c-Colla1;d-α-SMA
图8 小鼠肾脏组织中GPR43、HMGB1、Colla1和α-SMA基因的表达水平
Fig.8 Expression levels of GPR43, HMGB1, Colla1, and α-SMA genes in mouse kidney tissues
3 结论
综上所述,罗伊氏粘液乳杆菌DYNDL56M17通过提高小鼠血清中肌酐和尿素氮含量,降低肾脏组织中炎症因子的水平,增强SOD和GSH-Px等抗氧化酶的活性,有效改善顺铂诱导的小鼠AKI。其中,罗伊氏粘液乳杆菌DYNDL56M17发酵上清液的抗炎和抗氧化能力优于活菌和菌体裂解物,展现出更优的缓解效果。
[1] 闫薛, 缪扣荣.急性白血病患者NF-κB1基因单核苷酸多态性与异基因造血干细胞移植后急性肾损伤的相关性分析[J].药物生物技术, 2023, 30(1):7-11.
YAN X, MIAO K R.The association of single nucleotide polymorphisms in NF-κB1 gene with the risk of acute kidney injury in acute leukemia patients receiving allogeneic hematopoietic stem cell transplantation[J].Pharmaceutical Biotechnology, 2023, 30(1):7-11.
[2] KHWAJA A.KDIGO clinical practice guidelines for acute kidney injury[J].Nephron.Clinical Practice, 2012, 120(4):c179-c184.
[3] PEERAPORNRATANA S, MANRIQUE-CABALLERO C L, G MEZ H, et al.Acute kidney injury from sepsis:Current concepts, epidemiology, pathophysiology, prevention and treatment[J].Kidney International, 2019, 96(5):1083-1099.
MEZ H, et al.Acute kidney injury from sepsis:Current concepts, epidemiology, pathophysiology, prevention and treatment[J].Kidney International, 2019, 96(5):1083-1099.
[4] ANDRADE-OLIVEIRA V, AMANO M T, CORREA-COSTA M, et al.Gut bacteria products prevent AKI induced by ischemia-reperfusion[J].Journal of the American Society of Nephrology, 2015, 26(8):1877-1888.
[5] HU Y M, PAI M H, YEH C L, et al.Glutamine administration ameliorates sepsis-induced kidney injury by downregulating the high-mobility group box protein-1-mediated pathway in mice[J].American Journal of Physiology.Renal Physiology, 2012, 302(1):F150-F158.
[6] LIU Y H.Cellular and molecular mechanisms of renal fibrosis[J].Nature Reviews.Nephrology, 2011, 7(12):684-696.
[7] LIU Y Z, LI Y J, LOH Y W, et al.Fiber derived microbial metabolites prevent acute kidney injury through G-protein coupled receptors and HDAC inhibition[J].Frontiers in Cell and Developmental Biology, 2021, 9:648639.
[8] RAMESH G, RANGANATHAN P.Mouse models and methods for studying human disease, acute kidney injury (AKI)[J].Methods in Molecular Biology, 2014, 1194:421-436.
[9] OZKOK A, EDELSTEIN C L.Pathophysiology of cisplatin-induced acute kidney injury[J].BioMed Research International, 2014, 2014(1):967826.
[10] YANG J, JI G E, PARK M S, et al.Probiotics partially attenuate the severity of acute kidney injury through an immunomodulatory effect[J].Kidney Research and Clinical Practice, 2021, 40(4):620-633.
[11] MENG Y, ZHAO M Z, MA Q Y, et al.Bifidobacterium bifidum alleviates adenine-induced acute kidney injury in mice by improving intestinal barrier function[J].Food &Function, 2024, 15(15):8030-8042.
[12] THOMPSON L E, MCGINNIS C D, EDELSTEIN C L, et al.Cisplatin-induced AKI cancer mouse model refinement[J].Journal of the American Society of Nephrology, 2021, 32(10S):578.
[13] 邱赛红, 李飞艳, 尹健康, 等.9味苦寒药对小鼠胃肠运动与肝肾功能影响的实验研究[J].湖南中医学院学报, 2004, 24(5):1-3;6.
QIU S H, LI F Y, YIN J K, et al.An experimental study on the effects of nine medicinal herbs with the properties of bitterness and cold on gastrointestinal movement and hepatorenal function of mice[J].Journal of Hunan Traditional Chinese Medicine University of Hunan, 2004, 24(5):1-3;6.
[14] MOMBEINI M A, KALANTAR H, SADEGHI E, et al.Protective effects of berberine as a natural antioxidant and anti-inflammatory agent against nephrotoxicity induced by cyclophosphamide in mice[J].Naunyn-Schmiedeberg’s Archives of Pharmacology, 2022, 395(2):187-194.
[15] VILLEGAS C V, GORMAN E, LIU F M, et al.Acute kidney injury in the acute care surgery patient:What you need to know[J].The Journal of Trauma and Acute Care Surgery, 2024.
[16] REWA O, BAGSHAW S M.Acute kidney injury-epidemiology, outcomes and economics[J].Nature Reviews.Nephrology, 2014, 10(4):193-207.
[17] HUO A J, WANG F M.Berberine alleviates ischemia reperfusion injury induced AKI by regulation of intestinal microbiota and reducing intestinal inflammation[J].BMC Complementary Medicine and Therapies, 2024, 24(1):66.
[18] FOELSCH K, PELCZAR P, ZIERZ E, et al.Intestinal epithelia and myeloid immune cells shape colitis severity and colorectal carcinogenesis via high-mobility group box protein 1[J].Journal of Crohn’s &Colitis, 2024, 18(7):1122-1133.
[19] 孙键. 短链脂肪酸乙酸在脓毒症诱导急性肾损伤中的保护作用及机制研究[D].长春:吉林大学, 2022.
SUN J.Study on the protective effect and mechanism of short-chain fatty acid acetic acid in sepsis-induced acute kidney injury[D].Changchun:Jilin University, 2022.
[20] 虞亘明, 王鑫玮, 骆金光, 等.SPP1在肾缺血再灌注诱导的急性肾损伤中的作用及机制[J].南方医科大学学报, 2023, 43(11):1947-1954.
YU G M, WANG X W, LUO J G, et al.Role of SPP1 in acute kidney injury induced by renal ischemia-reperfusion in rats[J].Journal of Southern Medical University, 2023, 43(11):1947-1954.