高脂血症从心血管、脑血管、血糖、血压以及肝功能等多方面影响人体健康,更是导致心脑血管疾病的元凶[1]。目前国内外常用的调脂药物有4类:他汀类、树脂类、贝特类和烟酸类,但均存在副作用[2]。因此,研发新型绿色降血脂产品,减少高脂血症治疗过程中的副作用,必将为高脂血症的治疗带来新思路,为高脂血症患者带来福音。
哈士蟆,《本草纲目》中称之“山哈”,别名雪哈,为药、食两用的蛙种,现被命名为中国林蛙(Rana chensinensis),千百年来广为人们应用[3]。林蛙卵是林蛙胚胎物质,作为林蛙油生产过程中的副产物之一,仅在长白山地区年产量达35 t以上[4],预计全国范围内年产量可达400 t以上,因其年产量大且未能充分开发逐渐受到关注[5],具有可观的开发前景,提取林蛙卵中的脂溶性成分即为林蛙卵油(Rana chensinensis ovum oil, RCOO)[6]。
RCOO主要成分为不饱和脂肪酸,如多烯不饱和脂肪酸等[7],同时富含氨基酸、微量元素、维生素、雌激素、孕激素等。不饱和脂肪酸是合成前列腺素所必需的前体,前列腺素有降低血小板聚集,抑制血栓形成的作用,而且多烯不饱和脂肪酸具有降低血浆胆固醇及甘油三酯的作用[8],由此可知RCOO能够在调节血脂、抗氧化、保护肝脏、抗菌等多方面发挥作用[9]。
本研究首先通过喂食高脂饲料4周建立大鼠高脂血症模型,然后以辛伐他汀(Simvastain)为对照,比较低、中、高剂量RCOO灌胃给药至8周后,对受试大鼠血清胰岛素、血脂水平、炎症因子水平、肝功能指标、抗氧化因子水平的影响,并对受试大鼠进行体重跟踪测定、主要脏器指数测算与肝脏组织病理学观察,从而探究RCOO的降血脂活性[10],为RCOO深层次利用及开发新型、绿色的降血脂产品提供理论和试验基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
RCOO为贵州中医药大学药学院实验室通过超临界CO2萃取法自制[6-7];SPF级大鼠购自贵州中医药大学[实验动物生产许可证号SCXK(黔)2021-0003、实验动物使用许可证号SYXK(黔)2021-0005]。
1.1.2 主要试剂
高脂饲料部分配制原料(胆固醇、蛋黄粉、胆盐),上海源叶生物科技有限公司;猪油自制于贵州中医药大学药学院实验室;Simvastain,山德士(中国)制药有限公司;总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白(low density lipoprotein cholesterol, LDL-C)、谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、总超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、丙二醛(malondialdehyde, MDA)测定试剂盒,上海信裕生物科技有限公司;胰岛素(insulin, INS)、IL-6、IL-1β、TNF-α测定试剂盒,武汉吉立德生物科技有限公司;其他化学试剂为国产分析纯。
1.2 仪器设备
HSY-16电子恒温水浴锅,上海跃进医疗器械厂;Bio-rad酶标仪,美国伯乐公司;H1650R台式高速离心机,湘仪离心机仪器有限公司;EasyScan 6数字切片扫描与应用系统,麦克奥迪实业集团有限公司;FA2104电子天平,上海方瑞仪器有限公司。
1.3 实验方法
1.3.1 受试大鼠分组
雄性大鼠60只,随机分为空白对照组(BC)、高脂模型组(HFD)、Simvastain组(Simvastain)及RCOO低(RCOO-L)、中(RCOO-M)、高(RCOO-H)剂量组,每组10只[11]。
1.3.2 大鼠高脂血症模型构建
首先配制高脂饲料,大鼠生长繁殖饲料78%、胆固醇1%、猪油10%、蛋黄粉10%、胆盐1%(均为质量分数),在猪油50 ℃时快速混合,搅拌均匀,形成均匀的由以上物质包裹的固态大鼠高脂饲料。试验开始即对大鼠进行剪尾采血,试验期间,BC组以普通饲料喂养,其他各组均以高脂饲料喂养,喂食高脂饲料至4周,再次进行剪尾采血,以大鼠血清中的TC、TG、HDL-C、LDL-C含量作为指标,验证是否成功建立大鼠高脂血症模型[6]。
1.3.3 受试大鼠体重跟踪测定与给药治疗
每天定时称体质量(称重前禁食不禁水4 h),各组受试大鼠定时灌胃、投料,自由饮水,BC及HFD组以纯水灌胃[10 mL/(kg·d)],Simvastain组灌胃量为3 mg/(kg·d)[研磨后制备水溶液,10 mL/(kg·d)],RCOO-L、RCOO-M、RCOO-H组分别灌胃5、10、20 mL/(kg·d),连续给药至8周[12]。
1.3.4 受试大鼠血清生化指标分析
大鼠末次给药后,禁食不禁水4 h,断尾取血,分离血清,按照相应试剂盒方法分别测定INS、TC、TG、HDL-C、LDL-C、IL、IL-1β、TNF-α、AST、ALT、SOD、GSH-Px、MDA的表达水平[13-14]。
1.3.5 受试大鼠脏器指数测定
试验周期结束后,各组大鼠深度麻醉处死,分离肝脏、心脏、脾脏、肾脏、肺,用生理盐水冲洗干净,计算脏器指数[15]。
1.3.6 受试大鼠肝脏样本病理观察
多聚甲醛中固定受试大鼠肝脏组织,经脱水与透明处理后,用石蜡包埋,进行切片,苏木精-伊红(hematoxylin-eosin,HE)染色后显微观察[16]。
1.4 数据处理
所有试验均重复3次,用“平均值±标准偏差”表示,P<0.05表示具有显著性差异。数据处理采用IBM SPSS Statistics 22软件,通过单因素方差分析(ANOVA)和Duncan多重检验确定显著性差异(P<0.05)。采用GraphPad 8.0软件及Origin 2024软件进行图片绘制。
2 结果与分析
2.1 受试大鼠高脂血症建模及给药期间体重跟踪
由图1可知,在建立大鼠高脂血症模型过程,大鼠体重增长快,喂食高脂饲料4周,高脂血症模型大鼠体重较初始体重显著升高(P<0.05),增长区间为38.49%~42.23%,采用RCOO、Simvastain自第5周干预至8周,体重有所减轻,但较正常大鼠相比,差异仍显著(P<0.05)。而RCOO本身及Simvastain并未显示有减重的功效,受试大鼠体重能够下降可能是由于INS抵抗的改善,因此进一步探究了RCOO对受试大鼠血清INS含量的影响。
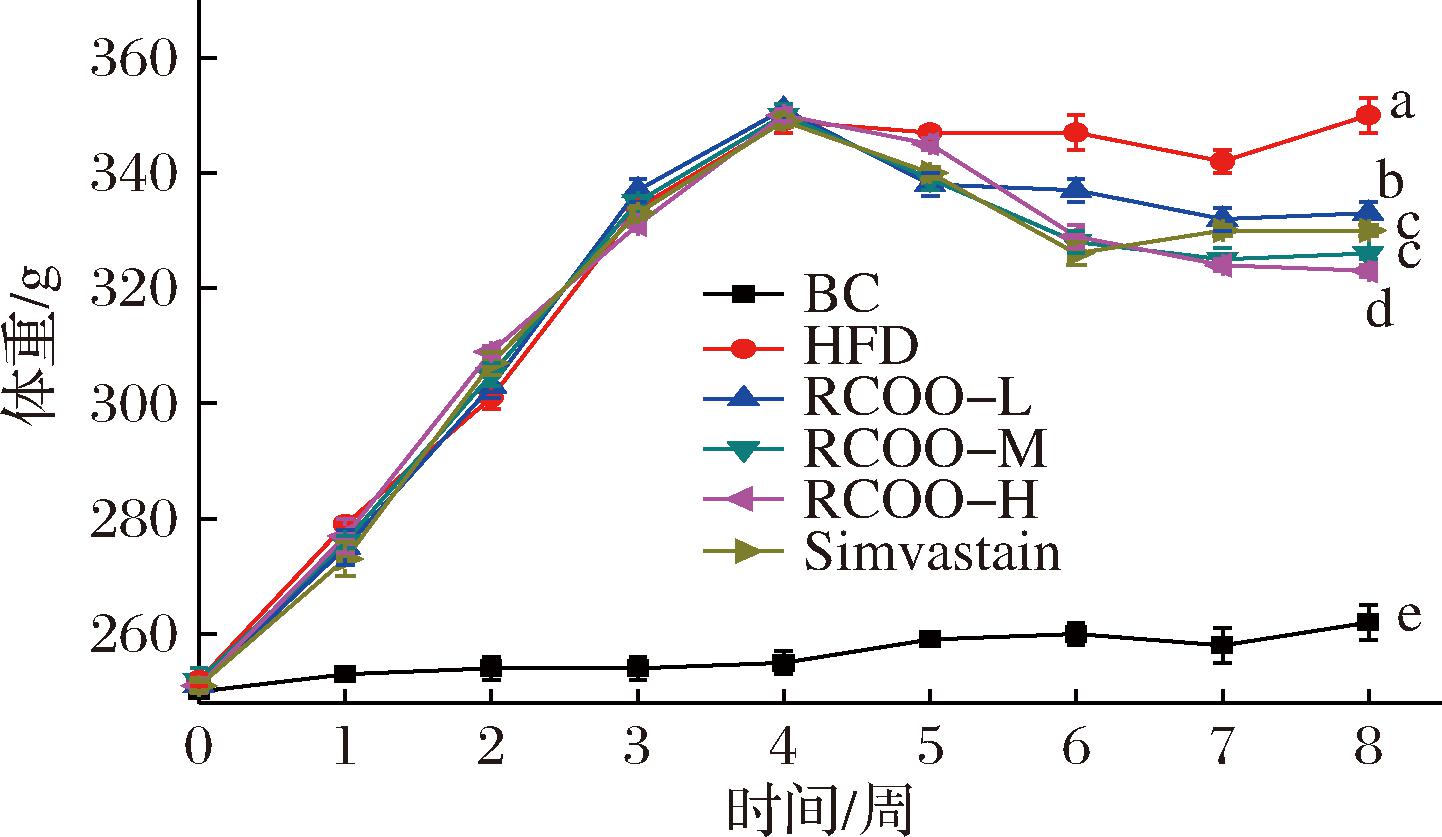
图1 受试大鼠体重分析
Fig.1 Body weight analysis of test rats
注:不同小写字母表示组间差异显著(P<0.05)(下同)。
2.2 受试大鼠血清INS含量测定
如图2所示,与BC组(21.94 mU/L)相较,HFD组显著提高大鼠血清INS含量(23.46 mU/L)(P<0.05);采用RCOO、Simvastain干预后受试大鼠血清INS含量较HFD组显著降低(P<0.05),且RCOO-L组(22.35 mU/L)与BC组大鼠血清INS含量差异不显著(P>0.05)。RCOO中富含脂肪酸与氨基酸,袁雪薇等[17]研究发现亮氨酸能够改善非酒精性脂肪性肝病,同时具有改善胰岛素抵抗和瘦素抵抗、提高机体抗氧化能力、降低炎性因子等作用,这一结论解释了为什么RCOO可以通过改善INS抵抗,对大鼠的体重进行干预。
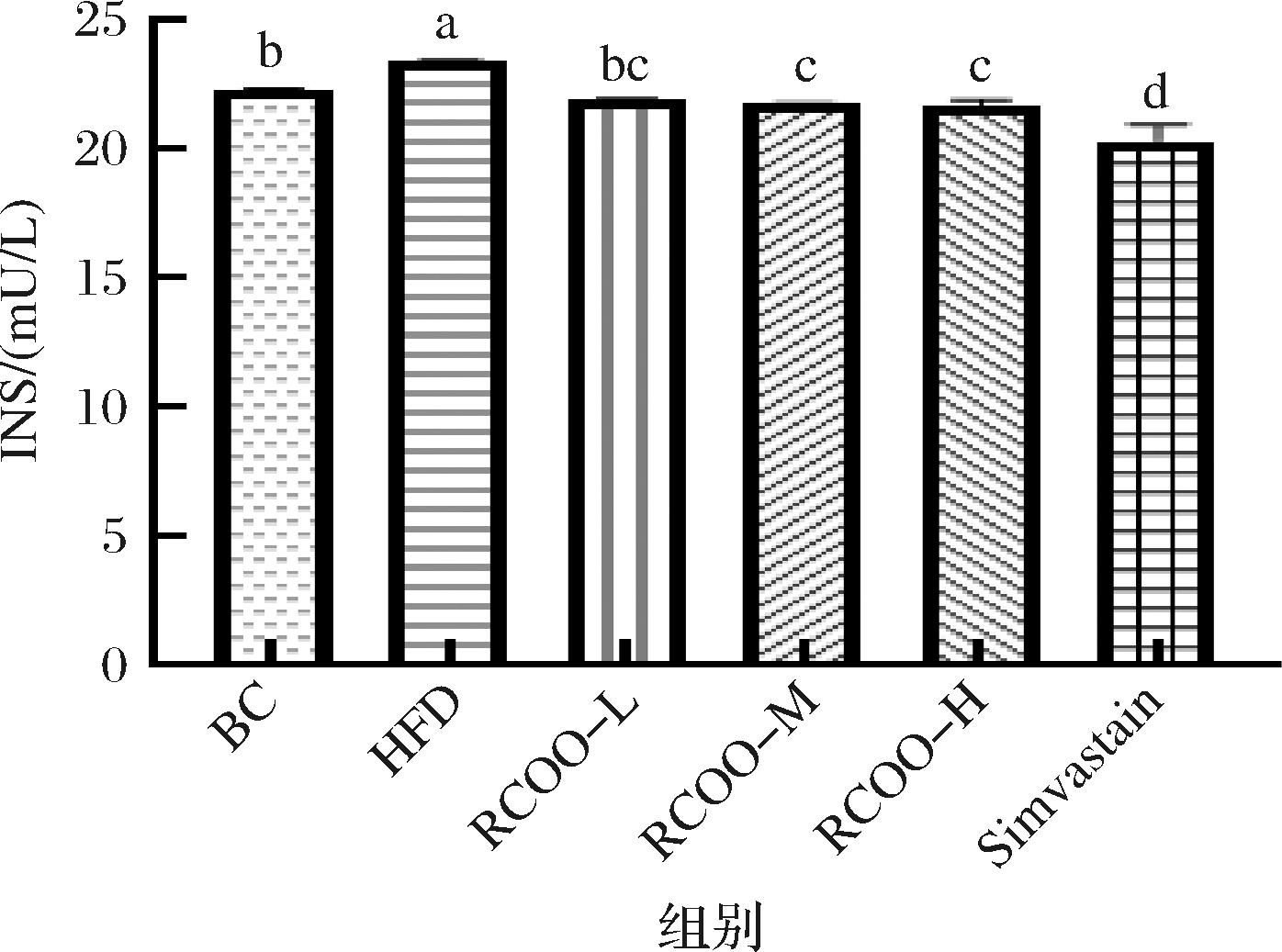
图2 受试大鼠血清INS含量分析
Fig.2 Analysis of serum insulin level of test rats
2.3 林蛙卵油对受试大鼠血脂含量的影响
通过喂食高脂饲料4周构建高脂血症大鼠模型,高脂血症大鼠模型建立成功后,自第5周分别以RCOO(L、M、H剂量)、Simvastain及水进行灌胃,至8周。实验结果表明,与BC组相比,HFD组大鼠血清中TG、TC、LDL-C含量均显著升高(图3-a~图3-c,P<0.05),HDL-C含量显著降低(图3-d,P<0.05),3种不同剂量的RCOO和Simvastain给药至8周,大鼠血清TC、TG、LDL-C含量均较HFD组大鼠显著降低(P<0.05),且RCOO-H对TC的降低水平(63.14%)及RCOO-M对HDL-C的升高水平(110.63%)与Simvastain相较差异不显著(图3-b、图3-d,P>0.05),但降低TG(56.67%)和LDL-C(75.31%)的水平不及Simvastain(62.17%、80.41%,图3-a、图3-c,P<0.05)。由此可知,RCOO可有效调控高脂血症大鼠血清中TG、TC、LDL-C及HDL-C的含量。RCOO降血脂功效同样被彭飞等[18]证实,相较其高剂量下受试大鼠血清TG降低54%、TC降低51%、LDL-C降低48%、HDL-C升高37%,本研究中的RCOO降血脂效果更佳,可能是由于本研究中的RCOO经过多次萃取,不饱和脂肪酸含量更高;翟磊等[19]探讨了亚麻籽油磷虾油软胶囊对高脂血症大鼠模型的降血脂功效,同为脂肪酸类物质,在其高剂量下,相较其TC(14.79%)、LDL-C(41.85%)的降低水平,本研究中的RCOO调控血脂的功效同样具有明显优势,虽然效果不及Simvastain药物,但RCOO为药食两用物质,对人体无毒副作用。

a-TG;b-TC;c-LDL-C;d-HDL-C
图3 林蛙卵油对高脂血症大鼠血脂含量的影响
Fig.3 Effect of R. chensinensis ovum oil on blood lipid level of hyperlipidemia rats
2.4 林蛙卵油对受试大鼠血清炎症因子表达水平的影响
考虑到高脂血症会增加肝脏炎症反应,因此对受试大鼠血清炎症因子进行了测定。如图4所示,与BC组相比,HFD组大鼠血清炎症因子IL-6、IL-1β及TNF-α表达水平显著升高(P<0.05),而RCOO给药后受试大鼠血清IL-6、IL-1β及TNF-α表达水平显著降低(P<0.05),且RCOO-H组(73.33、110.67、2.93 pg/mL)与Simvastain组炎症因子表达水平差异不显著。这再一次验证RCOO对高脂血症模型大鼠的血脂调节具有重要作用,同时可能对受试大鼠肝脏功能具有调节作用,继而本研究探究了林蛙卵油对受试大鼠血清转氨酶表达水平的影响。
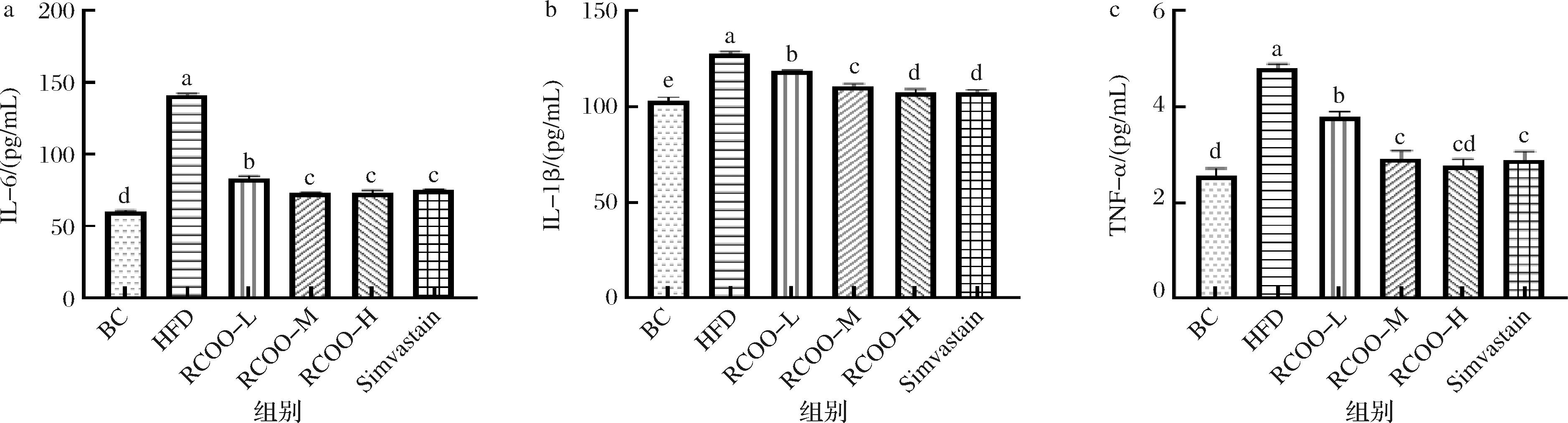
a-IL-6;b-IL-1β;c-TNF-α
图4 林蛙卵油对受试大鼠血清炎症因子指数的影响
Fig.4 Effect of R. chensinensis ovum oil on serum inflammatory cytokine index of test rats
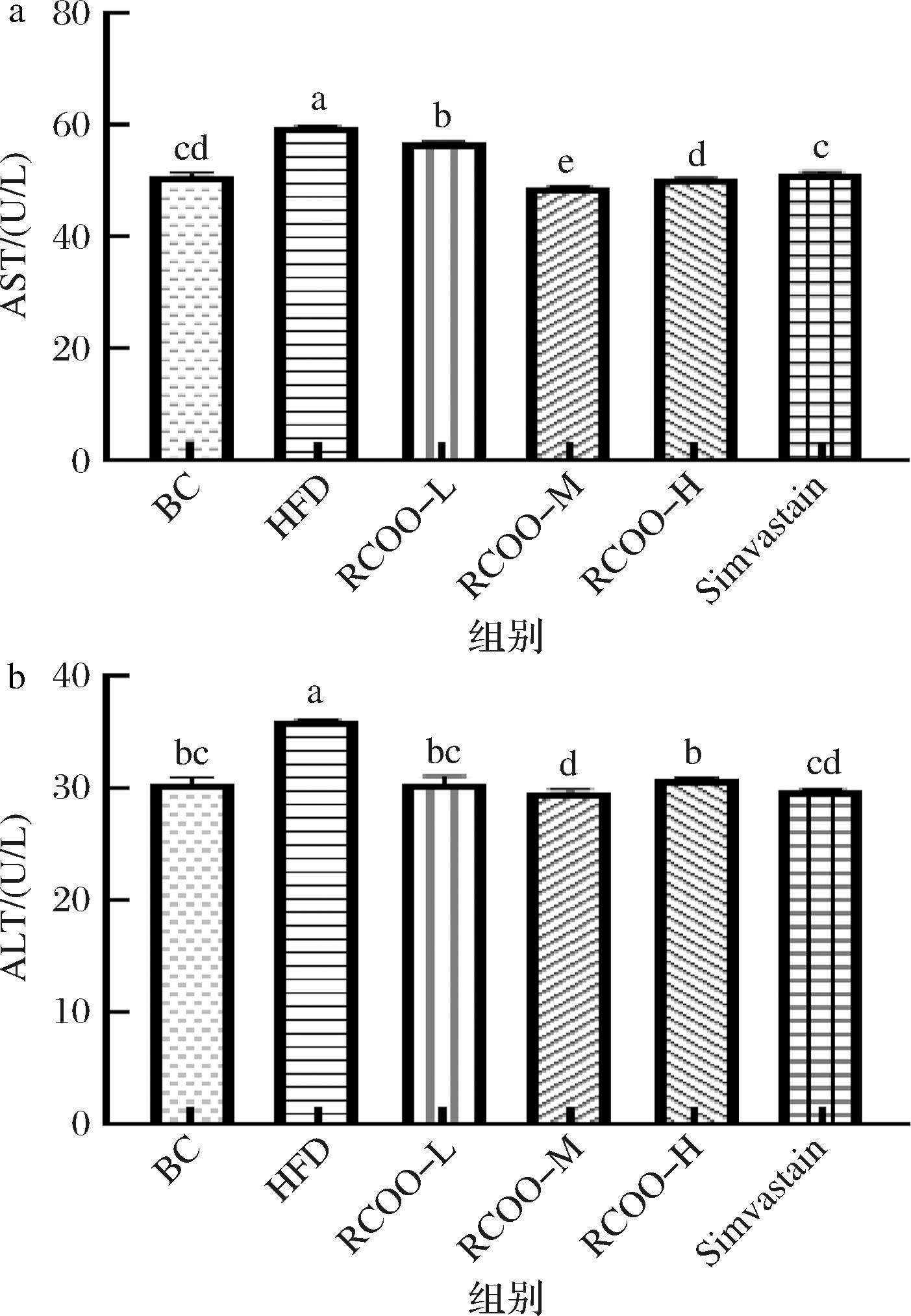
a-AST;b-ALT
图5 受试大鼠血清转氨酶表达水平分析
Fig.5 Analysis of serum transaminase expression level of test rats
2.5 林蛙卵油对受试大鼠血清转氨酶表达水平的影响
肝脏是脂代谢的重要器官,而AST、ALT是评估肝功能的重要生化指标,因此检测了受试大鼠血清AST、ALT表达水平。如图5所示,HFD组AST、ALT表达水平显著升高(P<0.05),RCOO和Simvastain干预后,AST、ALT表达水平显著降低(P<0.05),RCOO-H组AST(50.47 U/L)、ALT(30.90 U/L)表达水平与BC组差异不显著(P>0.05)。RCOO中富含脂肪酸和氨基酸,在降血脂的同时,能有效地调节肝脏代谢功能,对肝脏起到保护作用,与袁雪薇等[17]的研究结果(亮氨酸可以降低高脂血症大鼠ALT、AST的水平)相切合。
2.6 林蛙卵油对受试大鼠血清抗氧化因子表达水平的影响
高脂血症还会抑制内源性抗氧化酶系的活力,进一步加剧肝脏的损伤。因此检测了受试大鼠血清中SOD、GSH-Px和MDA的表达水平。从图6中可以看出,与BC组相比,HFD组血清中SOD、GSH-Px的表达水平显著降低(P<0.05),而MDA的表达水平则显著升高(P<0.05)。RCOO和Simvastain干预后,SOD、GSH-Px的表达水平显著升高(P<0.05)。RCOO-M组SOD表达水平(148.67 U/mL)与BC组差异不显著(图6-a,P>0.05),RCOO-H组GSH-Px(834.67 U/mL)、MDA(7.37 nmol/L)表达水平与Simvastain组差异不显著(图6-b、图6-c,P>0.05)。林蛙卵提取物的体外抗氧化活性已被苏玉春等[20]、韩子晗等[21]及陈大勇等[22]证实,本研究通过对受试大鼠血清抗氧化指标检测进一步验证了RCOO的体内抗氧化活性,并由此推测RCOO可以通过调控体内抗氧化酶活力抑制因高脂饮食引起的氧化应激,进而对高脂血症进行干预。

a-SOD;b-GSH-Px;c-MDA
图6 受试大鼠血清抗氧化因子表达水平分析
Fig.6 Expression level analysis of serum antioxidant factor of test rats
2.7 受试大鼠脂主要脏器指数检测
给药至8周后,对各组受试大鼠进行解剖,考察RCOO对高脂血症模型大鼠主要脏器指数的影响。从表1可以看出,与BC组大鼠相比,HFD组大鼠肝脏和肾脏指数显著升高(P<0.05),而脾脏、心脏和肺指数无显著差异。与HFD组大鼠相比,RCOO组大鼠肝脏和肾脏指数显著降低(P<0.05),而脾脏、心脏和肺指数无显著差异。实验结果表明,RCOO对高脂血症大鼠肝、肾指数具有调控作用,而肝作为重要的脂类代谢器官,再一次印证了RCOO对脂代谢有重要调控作用。
表1 林蛙卵油对高脂血症大鼠主要脏器指数的影响 单位:%
Table 1 Effect of R. chensinensis ovum oil on main organ index of hyperlipidemia rats
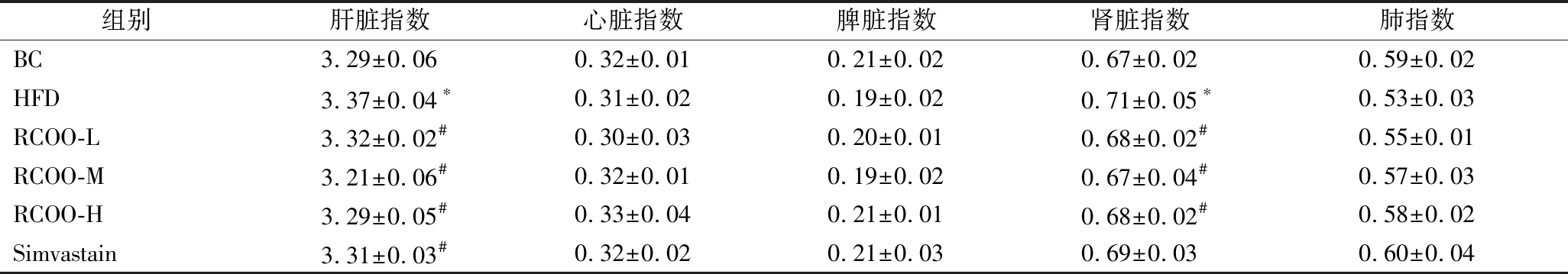
组别肝脏指数心脏指数脾脏指数肾脏指数肺指数BC3.29±0.060.32±0.010.21±0.020.67±0.020.59±0.02HFD3.37±0.04∗0.31±0.020.19±0.020.71±0.05∗0.53±0.03RCOO-L3.32±0.02#0.30±0.030.20±0.010.68±0.02#0.55±0.01RCOO-M3.21±0.06#0.32±0.010.19±0.020.67±0.04#0.57±0.03RCOO-H3.29±0.05#0.33±0.040.21±0.010.68±0.02#0.58±0.02Simvastain3.31±0.03#0.32±0.020.21±0.030.69±0.030.60±0.04
注:*表示与BC组相较差异显著(P<0.05);#表示与HFD组相较差异显著(P<0.05)。
2.8 受试大鼠肝脏病理学观察
如图7所示,BC组大鼠肝脏细胞排列整齐有序,轮廓清晰,胞浆丰富,细胞内少见脂滴出现(图7-a)。HFD组肝脏组织结构重度异常,呈现弥散性脂肪变性,部分细胞核挤压偏移(图7-b)。通过RCOO与Simvastain干预后肝脏脂肪变性现象有所改善,RCOO-L组肝脏组织结构中度异常,部分肝细胞呈现脂肪变性,脂肪空泡有不同程度的改善(图7-c)。RCOO-M组肝脏组织结构呈现轻微的肝细胞脂肪变性,脂肪空泡有所减少,脂滴变少,形态较正常(图7-d)。RCOO-H与组肝脏组织结构基本恢复正常,肝细胞排列较为有序,偶见脂肪空泡(图7-e),脂肪变性程度较HFD组明显减少,与Simvastain组肝脏组织结构相似(图7-f),但与BC组相较,仍有较大差异。受试大鼠肝脏病理学观察与孙嘉莉等[23]对高脂血症鼠肝脏组织病理学观察的结果相符,表明RCOO对肝脏细胞脂肪含量调控作用显著。

a-BC;b-HFD;c-RCOO-L;d-RCOO-M;e-RCOO-H;f-Simvastain
图7 各组大鼠肝脏组织病理学观察
Fig.7 Histopathological observation of rats liver in each group
3 结论
本研究探讨了RCOO对高脂血症模型大鼠的血脂调控作用,采用RCOO对高脂血症模型大鼠干预8周后,可有效改善大鼠体重,调节血清胰岛素水平。在脂质代谢层面,显著降低TC、TG及LDL-C表达水平,提升HDL-C表达水平,部分功效与辛伐他汀相当。同时,RCOO能够抑制炎症因子表达,修复肝功能,增强抗氧化酶活性,降低氧化应激损伤。通过脏器指数分析与肝脏病理观察证实,RCOO可减轻肝脏和肾脏负担,显著改善肝细胞脂肪变性状态,高剂量组肝脏组织结构近乎恢复正常。作为食品成分,RCOO在高效调控血脂的同时,避免了药物潜在的毒副作用风险,充分彰显出天然健康产品在代谢性疾病干预领域的独特优势与应用潜力。
综上,本研究为研制RCOO降血脂产品提供了新的思路,同时奠定了理论和实验基础。但在RCOO降血脂作用机制领域,尚未见相关报道,这为RCOO未来的研究指明了方向,本研究后续将深入挖掘林蛙卵油的降血脂作用机制,进一步为林蛙卵油开发与利用提供扎实的理论依据。
[1] LOU J Y, LIU Y, XU N, et al.Arctium lappa L.root extract improved hyperlipidemia by regulating the esterase activity and gut microbiota of rats on a high-fat diet[J].Journal of Functional Foods, 2024, 120:106348.
[2] 薛俊莉, 司艳红, 秦树存.老年动脉粥样硬化性心血管疾病患者长期使用他汀类药物和阿司匹林的安全隐患[J].山东第一医科大学(山东省医学科学院)学报, 2022, 43(11):870-875.
XUE J L, SI Y H, QIN S C.Safety hazards of long-term use of statins and aspirin and solutions for elderly patients with atherosclerotic cardiovascular diseases[J].Journal of Shandong First Medical University &Shandong Academy of Medical Sciences, 2022, 43(11):870-875.
[3] 陈宁宁, 常雷, 岑欣桉, 等.东北林蛙卵油脂肪酸成分分析及其氧化稳定性研究[J].吉林农业大学学报, 2020, 42(1):96-102.
CHEN N N, CHANG L, CENG X A, et al.Research on fatty acid composition and oxidation stability from ovum oil of Rana dybowskii[J].Journal of Jilin Agricultural University, 2020, 42(1):96-102.
[4] 刘俊梅, 吴世玉, 王丹洋, 等.林蛙卵营养成分和保健功能的研究进展[J].食品研究与开发, 2018, 39(11):220-224.
LIU J M, WU S Y, WANG D Y, et al.Advances in research of the nutritional value and health function of ovum of Rana chensinensis[J].Food Research and Development, 2018, 39(11):220-224.
[5] 张学义. CO2超临界萃取技术提取中国林蛙卵油的研究[J].中国林副特产, 2006(5):17-18.
ZHANG X Y.Study on extraction of egg oil of Chinese forest frog by CO2 supercritical extraction[J].Forest By-product and Speciality in China, 2006(5):17-18.
[6] ZHAO W X, JU Z G, ZHENG Y Q, et al.Extraction, Composition Analysis and Blood Lipid Lowering Activity of Rana chensinensis Ovum Oil[C].Springer Nature:Lecture Notes in Computer Science, 2023, 13637:45-55.
[7] ZHAO W X, ZHAO F G, CHEN G.Optimization of extraction conditions on the yield of Rana chensinensis egg oil by statistical experimental designs[J].Advance Journal of Food Science and Technology, 2015, 9(5):367-371.
[8] SHIROUCHI B, NAGAO K, FURUYA K, et al.Physiological functions of iso-type short-chain fatty acid and omega 3 polyunsaturated fatty acids containing oil in obese OLETF rats[J].Journal of Oleo Science, 2010, 59(6):299-305.
[9] 廖振林, 李倩滢, 陈俊杰, 等.亚麻籽油组分的功能活性研究进展[J].现代食品科技, 2021, 37(11):379-389;337.
LIAO Z L, LI Q Y, CHEN J J, et al.Research progress on the functional activity of flaxseed oil components[J].Modern Food Science and Technology, 2021, 37(11):379-389;337.
[10] LI L, XIAO Y, ZHOU J H, et al.Effects of Berberine on glucolipid metabolism among dehydroepiandrosterone-induced rats of polycystic ovary syndrome with insulin-resistance[J].Heliyon, 2024, 10(2):e24338.
[11] 刘殊凡, 迟晓星, 王鹤霖, 等.玉米、荞麦复配粉对高脂血症大鼠的降血脂作用[J].食品工业科技, 2024, 45(19):337-345.
LIU S F, CHI X X, WANG H L, et al.Hypolipidemic effect of maize and buckwheat complex powder in hyperlipidemic rats[J].Science and Technology of Food Industry, 2024, 45(19):337-345.
[12] 潘小姣, 莫小莹, 陈晓春, 等.厚皮菜总黄酮对小鼠高脂血症的预防及作用机制[J].中国老年学杂志, 2024, 44(11):2707-2711.
PAN X J, MO X Y, CHEN X C, et al.Prevention and mechanism of total flavonoids from Ipomoea crassipes on hyperlipidemia in mice[J].Chinese Journal of Gerontology, 2024, 44(11):2707-2711.
[13] 唐子惟, 刘应, 陶鹏, 等.黄精配伍老鹰茶辅助降血脂作用[J].食品研究与开发, 2024, 45(6):48-53.
TANG Z W, LIU Y, TAO P, et al.Auxiliary hypolipidemic effect of combination of Polygonatum cyrtonema and hawk tea[J].Food Research and Development, 2024, 45(6):48-53.
[14] 李建, 温伯泉, 郭士兵, 等.辛伐他汀对肋骨骨折大鼠外周血T细胞亚型及炎症因子表达的影响[J].中国医院用药评价与分析, 2021, 21(9):1049-1052.
LI J, WEN B Q, GUO S B, et al.Effects of simvastatin on T cell subsets and expression of inflammatory factors in peripheral blood of rats with rib fracture[J].Evaluation and Analysis of Drug-Use in Hospitals of China, 2021, 21(9):1049-1052.
[15] 王荣, 王娜娜, 杨宽, 等.紫苏籽油的抗衰老作用及机制探究[J/OL].中国油脂, 2024:1-9.(2024-06-07).DOI:10.19902/j.cnki.zgyz.1003-7969.240161
WANG R, WANG N N, YANG K, et al.Study on anti-aging effect and mechanism of perilla seed oil[J/OL].China Industrial Economics, 2024:1-9.(2024-06-07).DOI:10.19902/j.cnki.zgyz.1003-7969.240161
[16] 毛静, 张洁, 孟燕, 等.芪药消渴胶囊对胰岛素抵抗大鼠糖脂代谢和肝脏组织IRS-2蛋白表达的影响[J].四川中医, 2021, 39(6):51-54.
MAO J, ZHANG J, MENG Y, et al.Effect of qiyao Xiaoke capsule on IRS-2Protein expression in liver tissue of rats with insulin resistance[J].Journal of Sichuan of Traditional Chinese Medicine, 2021, 39(6):51-54.
[17] 袁雪薇, 韩淑芬, 张建伟, 等.亮氨酸对高脂大鼠非酒精性脂肪性肝病影响[J].中国公共卫生, 2014, 30(9):1160-1162.
YUAN X W, HAN S F, ZHANG J W, et al.Effects of leucine on nonalcoholic fatty liver disease induced by high fat diet in rats[J].Chinese Journal of Public Health, 2014, 30(9):1160-1162.
[18] 彭飞, 徐峰, 刘彬, 等.中国林蛙卵油对高脂血症大鼠降脂作用的观察[J].医学理论与实践, 2003, 16(9):996-997.
PENG F, XU F, LIU B, et al.Observation of effects of Rana temporaria chensinensis David egg oil on lowering blood lipid in rats[J].The Journal of Medical Theory and Practice, 2003, 16(9):996-997.
[19] 翟磊, 陈建国, 田世民, 等.亚麻籽油磷虾油软胶囊对高血脂模型大鼠血脂的影响[J].食品与发酵工业, 2024, 50(5):54-58.
ZHAI L, CHEN J G, TIAN S M, et al.Effect of flaxseed oil krill oil soft capsule on blood lipid in hyperlipidemia rats model[J].Food and Fermentation Industries, 2024, 50(5):54-58.
[20] 苏玉春, 陈光, 郭会楠, 等.林蛙卵黑色素的提取工艺及其抗氧化活性[J].西北农林科技大学学报(自然科学版), 2017, 45(2):196-202.
SU Y C, CHEN G, GUO H N, et al.Extraction and antioxidant activities of melanin from brown frog eggs[J].Journal of Northwest A &F University (Natural Science Edition), 2017, 45(2):196-202.
[21] 韩子晗, 孙尧, 杨富雅, 等.林蛙卵油的提取、成分分析及抗氧化活性研究[J].食品工业科技, 2020, 41(11):60-65.
HAN Z H, SUN Y, YANG F Y, et al.Extraction, component analysis and antioxidant activity of Rana chensinensis egg oil[J].Science and Technology of Food Industry, 2020, 41(11):60-65.
[22] 陈大勇, 杨靖, 李硕, 等.林蛙卵多糖的提取工艺及其抗氧化作用研究[J].西北农林科技大学学报(自然科学版), 2013, 41(12):149-154.
CHEN D Y, YANG J, LI S, et al.Optimization of polysaccharides extraction from brown frog egg and the antioxidant activity of extracted polysaccharides[J].Journal of Northwest A &F University (Natural Science Edition), 2013, 41(12):149-154.
[23] 孙嘉莉, 赵文燕, 朱东亮, 等.沙棘果皮渣总黄酮体内外降血脂活性研究[J].食品工业科技, 2024, 45(24):353-363.
SUN J L, ZHAO W Y, ZHU D L, et al.Hypolipidemic activity of total flavonoids from sea buckthorn peel residue in vivo and in vitro[J].Science and Technology of Food Industry, 2024, 45(24):353-363.