目前全世界有20多亿成年人超重,其中6.5亿人为临床肥胖,肥胖会给人体带来一系列并发症,比如高脂血症、高血压等心血管疾病,目前已成为世界性的公共卫生问题[1]。肥胖的治疗方法包括饮食调节、运动干预、手术治疗和药物治疗[2],然而前2种方法周期长、见效慢,大多数人看不到效果的同时容易放弃,手术治疗费用较高并且存在一定风险,药物治疗日益成为一个可行方法。目前唯一一种临床脂肪酶抑制药物为奥利司他[3],临床实验证明,奥利司他能够显著降低体重和血浆中胆固醇、甘油三酯浓度[4],但其仍然存在轻中度胃肠道不良反应,如油性大便、粪便急症等[5],所以高效低毒的新型脂肪酶抑制剂急待研发。
脂肪在人体内的代谢主要是以甘油三酯为主的脂质被摄入后,通过胰脂肪酶水解为单酰甘油和游离脂肪酸后,形成脂质颗粒,在小肠内被吸收,重新合成三酰甘油并在脂肪组织中积累的过程[3]。人体内参与脂肪吸收与代谢过程的关键酶为胰脂肪酶,所以要想治疗肥胖,主要是从抑制胰脂肪酶的活性角度进行深入研究,减少机体对脂肪类物质的吸收[6]。微生物具有培养容易、增长快速等优点,是各种酶制剂、药物的理想生产者,从微生物中寻找高效低毒的脂肪酶抑制剂是一种可行的方法。
植物内生菌是指在其生活史的一定阶段或全部阶段生活于健康植物各种组织、器官内部的微生物[7]。相关研究发现,内生菌不仅能够参与植物次生代谢物的合成,还能够独立产生丰富的次生代谢产物,在宿主植物独特的生物活性中发挥重要作用,因此,植物内生菌是天然活性产物的重要潜在来源[8]。例如苗永美等[9]从石豆兰中筛选到了1株来自芽孢杆菌属(Bacillus)对棉花枯萎病毒有抑制活性的内生菌,其抑制率可达88.06%;崔文宁[10]从益母草叶和知母根中筛选到了对黑梨斑病菌抑制的内生菌,抑菌率最高可达60.39%;ISLAM等[11]从银杏叶中筛选到12株对食源性致病菌有抑制活性的内生菌,其中来自芽孢杆菌属(Bacillus)的枯草芽孢杆菌对5种食源性致病菌都有良好的抑制效果,可见植物内生菌的合理研发利用具有重要的生物学意义和应用价值。
生姜作为典型的药食同源植物,中医认为其性辛辣,有发汗、散寒、止呕、解毒等功效,目前,大量临床研究报道生姜具有抗氧化、降脂、抗炎及抗菌等功能[12-13]。生姜富含的姜酚、姜醇等生物活性物质可起到抑制脂质吸收、降血压、强心及预防或改善动脉粥样硬化等代谢类疾病的作用[14-15]。生姜内生菌及其代谢产物的研究将为高效低毒功效物质研究提供重要的科学依据和应用价值。目前,对生姜内生菌的研究报道较少,楚敏等[16]从生姜中筛选出14株具有微生物拮抗作用的内生菌,分别来自假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、短杆菌属(Brachybacterium)、寡养单胞菌属(Stenotrophomonas)和拉恩氏菌属(Rahnella)。徐霖等[17]从生姜中筛选到3株具有人肝癌细胞抑制作用的内生菌;B DALO等[18]从生姜内生菌中筛选到19株具有对灰霉菌和炭疽病菌体外拮抗作用的内生菌,主要是赖氨酸芽孢杆菌属(Lysinibacillus)和河生雷勒特氏菌(Lelliottia)。目前对于具有脂肪酶抑制活性生姜内生菌的筛选未见报道。
DALO等[18]从生姜内生菌中筛选到19株具有对灰霉菌和炭疽病菌体外拮抗作用的内生菌,主要是赖氨酸芽孢杆菌属(Lysinibacillus)和河生雷勒特氏菌(Lelliottia)。目前对于具有脂肪酶抑制活性生姜内生菌的筛选未见报道。
脂肪酶活性定量检测方法可基本分为3类:酸碱滴定法[19]、高效液相色谱法[20]和紫外-可见光分光光度法[21]。酸碱滴定法通常以橄榄油为底物,以酚酞为指示剂,橄榄油底物通常需要先与聚乙烯醇(polyvinyl alcohol,PVA)等乳化剂乳化,白色的乳化液易造成视觉差异,使滴定终点的颜色反应不易被察觉,从而影响实验的准确性。高效液相色谱法要求先提纯产物再进行检测,并且对于仪器要求较高。紫外-可见光分光光度法是利用脂肪酶水解一些人工合成的底物——对硝基苯酚酯类,如棕榈酸对硝基苯酯(p-nitrophenyl palmitate,p-NPP)等,水解生成物为对硝基苯酚,该物质在410 nm处有最大吸光值,可以利用紫外-可见光分光光度计快速检测,更加高效准确。
脂肪酶活性定量检测方法虽然准确度高,但耗时长、成本高,本研究拟先利用薄层色谱生物自显影法快速定性初步筛选活性菌株,再通过p-NPP法定量测定其脂肪酶抑制活性,从而从定性、定量2个方面快速高效准确从生姜中筛选出具有脂肪酶抑制活性的内生菌,以期获得高效降脂活性生产菌种,并为后续脂肪酶抑制剂的应用研究奠定基础。
1 材料与方法
1.1 材料与试剂
生姜采购自北京市海淀区某超市。
营养肉汤(nutrient broth,NB)培养基:蛋白胨10 g,牛肉浸出粉3 g,NaCl 5 g,北京奥博星生物技术有限责任公司,营养肉汤固体(nutrient agar,NA)培养基在此基础上添加20 g/L琼脂粉。
甲醇、乙醇、乙酸乙酯、石油醚(均为分析纯),北京通广精细化工公司;二氯甲烷(分析纯),国药集团化学试剂有限公司;奥利司他、p-NPP,上海麦克林生化科技有限公司;脂肪酶、琼脂粉,北京博奥拓达科技有限公司;Tris-HCl缓冲液,北京索莱宝科技有限公司。
1.2 仪器与设备
SHP-250型生化培养箱,上海精宏实验设备有限公司;VS-1300L-U型超净工作台,苏净集团苏州安泰空气技术有限公司;RE-5205型旋转蒸发器,上海亚荣生化仪器厂;HWS-11型水浴锅,上海尚道仪器制造有限公司;Allegra64r型台式高速冷冻离心机,美国Beckman Coulter公司;Infinite M 1000 Pro型全波长多功能酶标仪,瑞士TECAN公司;1260高效液相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 生姜内生菌的分离
将生姜样品冲洗干净后,切成边长约为3 cm的立方体,用无菌水冲洗备用。在超净工作台中,用75%(体积分数)乙醇浸泡5 min,用无菌水冲淋;再使用6%(体积分数)NaClO浸泡8 min,用无菌水冲淋;最后使用75%(体积分数)乙醇浸泡3 min,用无菌水冲淋。收集最后一次冲淋使用的无菌水,采用涂布法接种于NA培养基中,作为空白组。
将样品切成边长5 mm的正方形薄片,贴在NA培养基上,每个平板贴3个,平行3组,培养48 h。在贴片周围挑取单菌落,划线接种于NA培养基中,每个贴片周围接种3个平板,每个平板连续划线纯化3次,得到纯化的内生菌。
1.3.2 活性菌株的定性筛选
1.3.2.1 发酵液萃取物的制备
将待测菌株接种于装有20 mL NB液体培养基的50 mL锥形瓶中,30 ℃、180 r/min下培养24 h,得到待测菌液。将待测菌液8 000 r/min离心5 min,取上清液,加入等体积乙酸乙酯萃取2次,合并乙酸乙酯层,用旋转蒸发仪蒸干,加入3 mL甲醇定容,此为20 mL发酵液的乙酸乙酯萃取物,实验平行3次,用于后续活性检测。
1.3.2.2 薄层色谱生物自显影法定性测定
根据文献[22]的方法进行修改,将点样后的薄层色谱板在含有16 mmol/L肉豆蔻酸-2-萘酯的石油醚溶液中浸泡30 s,挥发干后,在200 U/mL的脂肪酶溶液中浸泡1 min,取出后在30 ℃培养箱中反应10 min,将反应后的薄层色谱板浸于0.5 mg/mL固蓝B盐水溶液中室温反应5 min,取出后挥干观察。若在紫色背景下出现白色或棕黄色斑点,则证明样品有脂肪酶抑制活性。
1.3.3 p-NPP法定量筛选活性菌株
根据文献[23-24]方法进行修改,向试管中加入450 μL Tris-HCl缓冲溶液(pH 8)、25 μL 2 mg/mL p-NPP溶液、25 μL 10 mg/mL脂肪酶溶液和25 μL发酵液萃取物,充分混合。以甲醇作为空白对照,以50 μL/mL奥利司他溶液作为阳性对照。充分混合后,置于37 ℃水浴锅中反应20 min后,加入50 μL 5 g/L三氯乙酸终止反应,加入50 μL 5 g/L Na2CO3溶液进行显色。在410 nm处测定吸光度,按公式(1)计算抑制率:
抑制率![]()
(1)
式中:A空白,410 nm下空白组的吸光度;A样品,410 nm下样品组的吸光度。
1.3.4 活性菌株菌种鉴定
将待测菌种接种于NB液体培养基中,在30 ℃、180 r/min摇床培养24 h。将得到的菌液按照天根细菌基因组DNA提取试剂盒操作手册提取细菌DNA,委托生工生物工程(上海)股份有限公司进行双向测序。16S rRNA基因的PCR扩增上引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′),下引物1492R(5′-TACGGTTACCTTGTTACGACTT-3′)。进行序列拼接后,将获得的16S rRNA基因序列与NCBI(http://www.ncbi.nlm.nih.gov/blast)数据库进行BLAST比对分析。
1.4 HPLC指纹图谱
1.4.1 样品制备
试管中加入450 μL Tris-HCl缓冲溶液(pH 8)、25 μL p-NPP 溶液、100 μL酶液(对照组的酶液以缓冲液替代)和25 μL发酵液萃取物。充分混合后,置于37 ℃水浴锅中反应15 min,10 000 r/min离心5 min,取上清液,等体积乙酸乙酯萃取3次,萃取完成后,使用氮吹将萃取物吹干,并加入200 μL甲醇溶解,用0.22 μm有机膜过滤,进行HPLC分析。将实验组和对照组的HPLC指纹图谱进行比对,寻找潜在的活性组分。
1.4.2 HPLC分析条件
采用Eclipse XDB-C8 色谱柱(5 μm,4.6 mm×150 mm);流动相为乙腈-水体系,梯度洗脱,乙腈5%(0~5 min),乙腈5%~100%(5~60 min),乙腈100%(60~65 min);检测波长254 nm;柱温箱28 ℃;流速0.8 mL/min;进样量10 μL。
1.5 数据处理
所有实验重复3次,实验数据以“平均值±标准差”表示,采用MEGA 11.0软件进行菌株同源性比对,采用GraphPad Prism 10.1.2软件进行绘图。
2 结果与分析
2.1 生姜内生菌的分离
图1-a为生姜内生菌在NA培养基上的生长状态,菌落围绕生姜切片扩散生长,白色菌落。空白组结果如图1-b所示,培养基中未发现菌落生长,说明生姜表面消毒完全,贴片上所生长的菌落均可认定为是内生菌。通过反复分离纯化共获得可培养的微生物21株,编号为SJ01~SJ21,经菌落、菌株形态观察发现21株微生物皆为细菌,未发现真菌。
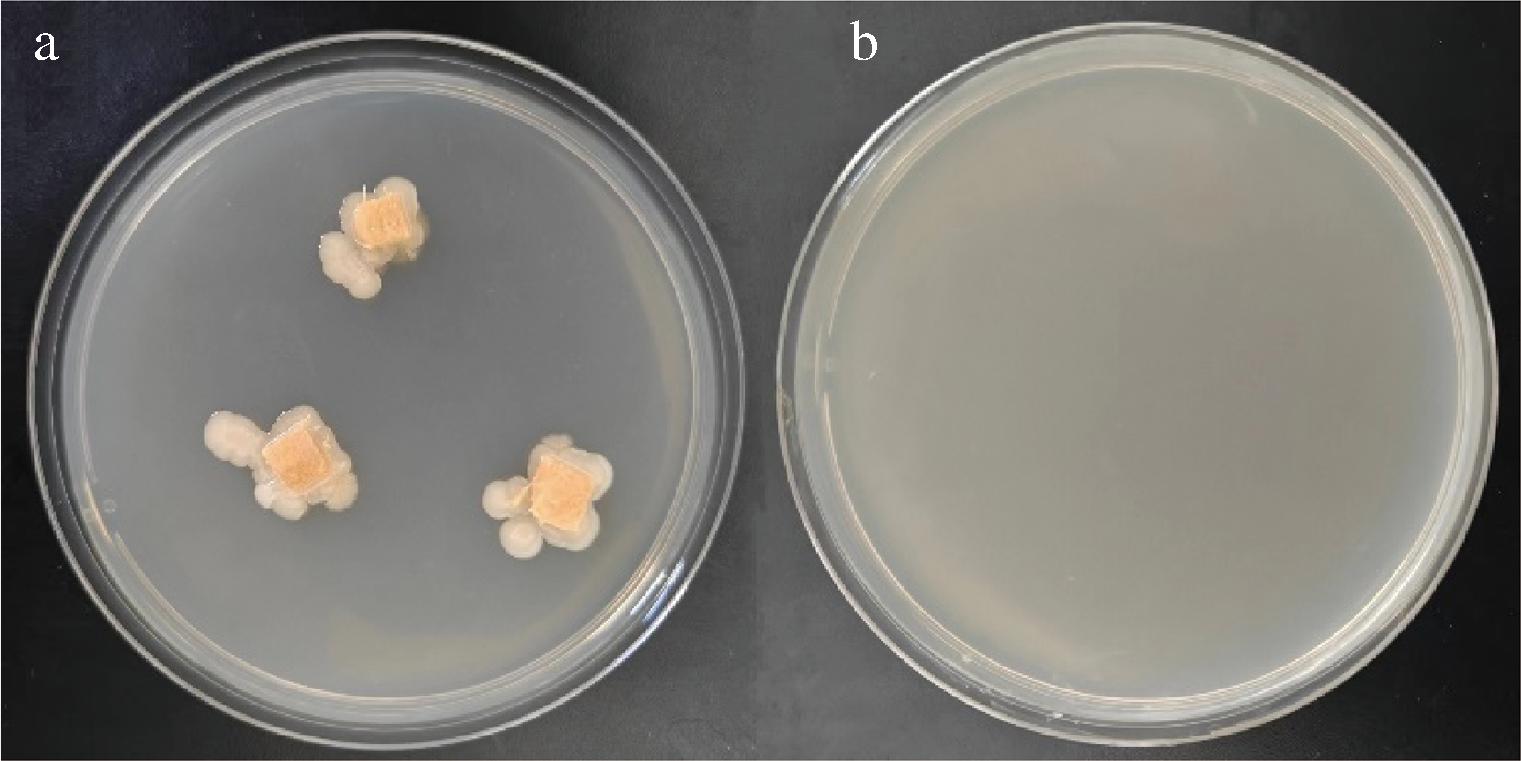
a-生姜内生菌在NA培养基上的生长状态;b-空白组
图1 生姜内生菌生长状态
Fig.1 Growth status of endophytic bacteria in ginger
2.2 定性测定内生菌脂肪酶抑制活性
薄层色谱生物自显影法是一种集鉴定、分离和活性测定为一体的提取物筛选方法,该方法不需要复杂的仪器和设备,操作简单、实验耗费低,适合一般实验室操作,并且灵敏度、专属性和直观性高于常规筛选方法。用薄层色谱生物自显影法对具有脂肪酶抑制活性的生姜内生菌进行初筛,可以大大提高实验结果的分析效率和实验结果的可信性。
对分离出的21株生姜内生菌进行初步定性筛选,发现6株菌呈阳性,如图2给出了其中4个菌株SJ11、SJ12、SJ13、SJ14萃取物的自显影结果,空白对照e只显示紫色背景,菌株SJ11、SJ12、SJ13、SJ14萃取物与阳性对照50 μg/mL奥利司他相似,都显示出白色或棕黄色斑点,定性实验结果表明了菌株SJ11、SJ12、SJ13、SJ14、SJ03、SJ08萃取物具有脂肪酶抑制活性,初步判定为活性菌株。
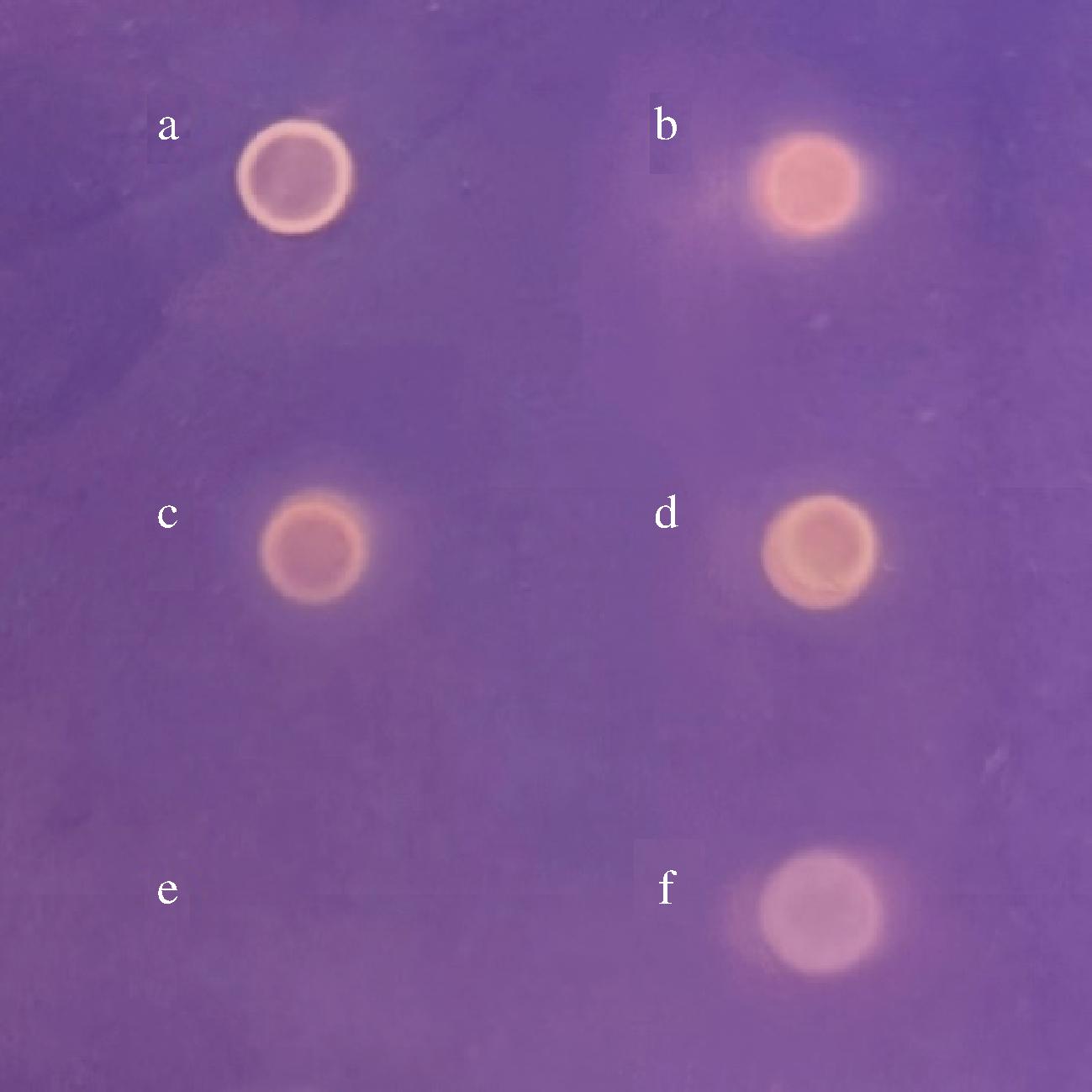
a-SJ11萃取物;b-SJ12萃取物;c-SJ13萃取物;d-SJ14萃取物;e-空白对照(甲醇);f-阳性对照(50 μg/mL奥利司他)
图2 部分菌株萃取物的生物自显影图
Fig.2 Bioautography of crude extracts of some Ginger endophytic bacteria strains
2.3 活性内生菌菌种鉴定
对6株活性菌株进行16S rRNA基因测序,将得到的序列在NCBI数据库上进行比对,使用MEGA11.0软件利用邻接法构建系统发育进化树。比对结果表明6株菌的16S rDNA序列与相似菌的相似度均在99%以上,如表1、图3所示,表明均为已知菌。其中有5株菌属于假单胞菌属(Pseudomonas),1株菌属于不动杆菌属(Acinetobacter)。
表1 具有脂肪酶抑制活性的生姜内生菌16S rRNA基因测序鉴定结果
Table 1 Sequencing results of 16S rRNA gene of endophytic ginger bacteria with lipase inhibitory activity
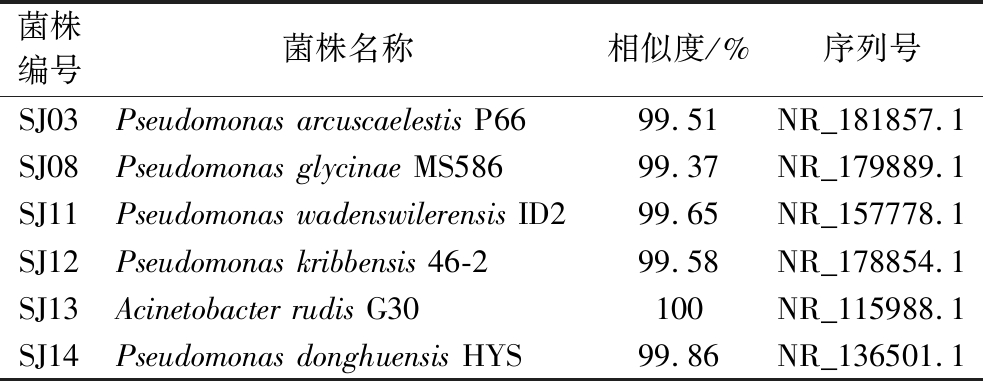
菌株编号菌株名称相似度/%序列号SJ03Pseudomonas arcuscaelestis P6699.51NR_181857.1SJ08Pseudomonas glycinae MS58699.37NR_179889.1SJ11Pseudomonas wadenswilerensis ID299.65NR_157778.1SJ12Pseudomonas kribbensis 46-299.58NR_178854.1SJ13Acinetobacter rudis G30100NR_115988.1SJ14Pseudomonas donghuensis HYS99.86NR_136501.1
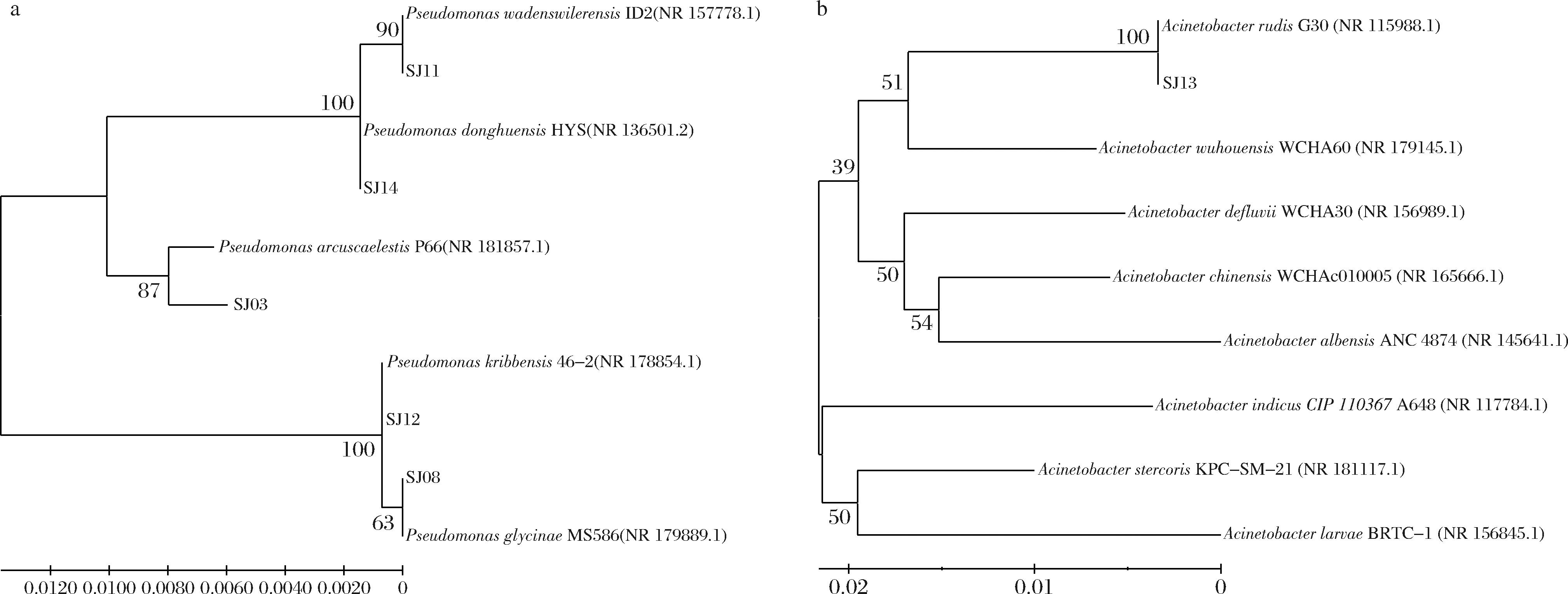
a-假单胞菌属(Pseudomonas)菌株;b-不动杆菌属(Acinetobacter)菌株
图3 基于16S rRNA基因序列的活性内生菌的邻接法系统发育树
Fig.3 Neighbor-Joining phylogenetic tree of active endophytes based on 16S rRNA gene sequence
2.4 p-NPP法定量测定内生菌脂肪酶抑制活性
p-NPP法因其方便快捷、结果稳定等优点广被青睐。JIN等[25]采用p-NPP法从山药中筛选出6个具有胰脂肪酶抑制活性的皂苷类化合物,CHANG等[26]以4-甲基伞形油酸酯为底物进行抑制剂的筛选。但由于不同化学结构的抑制剂对酶的抑制机制存在较大差异,每个实验中所用到的提取溶剂、酶促体系试剂添加顺序、酶促反应时间等也不尽相同[27-29],因此,需要建立一种高效快捷的方法来有效评价生姜内生菌对酶抑制活性。本实验从萃取剂的选择、反应物添加顺序、孵育时间、酶促反应时间4个方面对p-NPP法进行优化,以完善评价机制。
2.4.1 萃取剂的选择
将待测菌株在30 ℃、180 r/min摇床培养24 h,得到待测菌液。将待测菌液在8 000 r/min条件下离心5 min,取上清液,选用极性由低到高的石油醚、二氯甲烷、乙酸乙酯3种萃取剂对上清液分别进行萃取,后用p-NPP法检测萃取物的抑制率,如图4所示,可以看出3种萃取剂的萃取效果明显不同,6株菌抑制率最高时所对应的萃取剂为乙酸乙酯,说明乙酸乙酯为最佳萃取剂,后续实验都将采用乙酸乙酯作为萃取剂进行。选择抑制率较高的4株菌SJ11、SJ12、SJ13和SJ14测定萃取物与试剂添加顺序、孵育时间和酶促反应时间对酶抑制活性的影响。
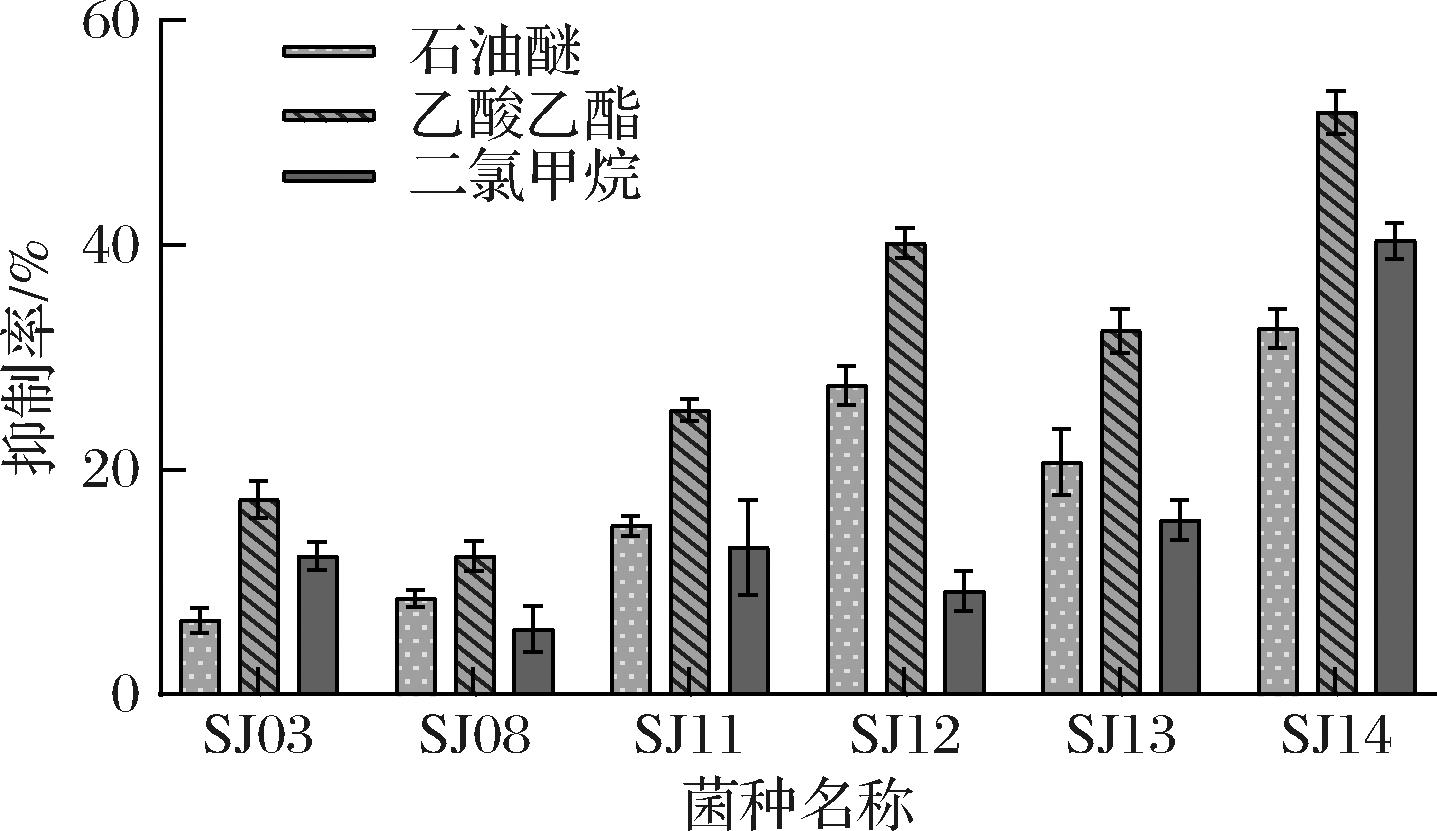
图4 不同萃取剂萃取物对脂肪酶抑制率的影响
Fig.4 Effect of different extractants on inhibition rate of lipase
2.4.2 反应物添加顺序
为了解每株菌萃取物的抑制模式,考察了酶促反应体系中各反应物的添加顺序。为此,将p-NPP、萃取物和酶反应顺序设计如下:1)将萃取物与酶孵育5 min,然后加入p-NPP继续反应20 min;2)p-NPP与酶孵育5 min,加入萃取物进一步反应20 min;3)萃取物与p-NPP孵育5 min,然后加入酶反应20 min。同时,以酶与p-NPP和甲醇的反应为空白对照。
如图5所示,不同的添加顺序对酶的抑制活性有明显的反应差异。菌株SJ11和SJ12的抑制变化规律相似,抑制率由大到小的顺序为:萃取物+p-NPP+酶>p-NPP+酶+萃取物>萃取物+酶+p-NPP。菌株SJ13和SJ14的抑制活性由大到小的顺序为:萃取物+p-NPP+酶>萃取物+酶+p-NPP>p-NPP+酶+萃取物。结果表明,先与底物p-NPP孵育的萃取物表现出更高的抑制活性,这表明p-NPP的存在可以增强萃取物对酶活性的抑制,这是因为脂肪酶作为一种典型的界面酶具有一个或多个具有两亲性结构的α-螺旋“盖”,当脂肪酶接触萃取物和p-NPP孵育后形成的油水界面时,“盖子”的疏水残留物暴露出来,脂肪酶的活性中心即被打开,与萃取物中的活性成分结合,促进酶促反应发生[30]。由此可见,萃取物与p-NPP的预反应有助于提高萃取物中活性物质对脂肪酶的抑制能力,表明萃取物+p-NPP+酶的顺序更适合于评价脂肪酶的抑制活性。
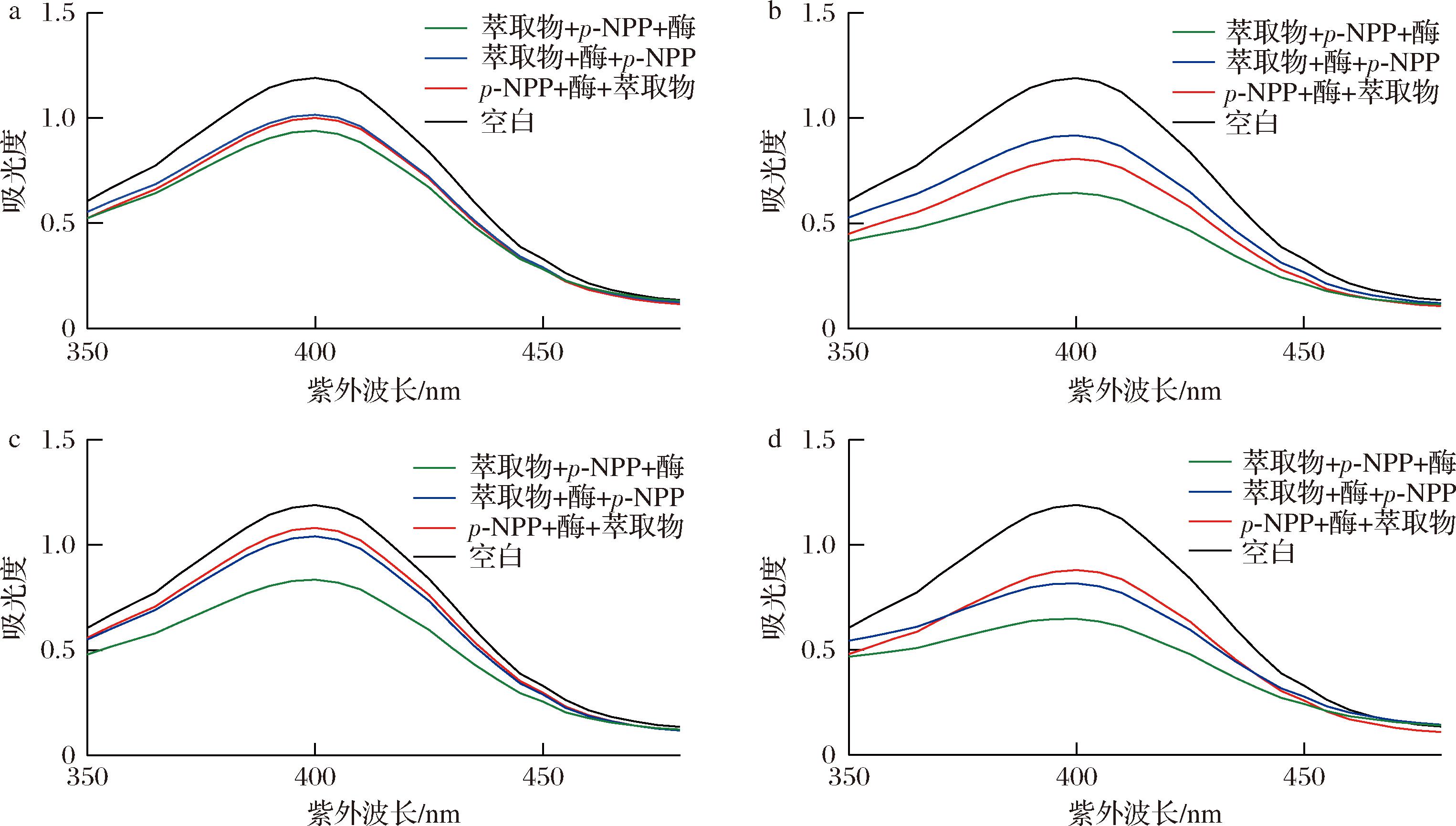
a-SJ11;b-SJ12;c-SJ13;d-SJ14
图5 反应物添加顺序对脂肪酶抑制活性的影响
Fig.5 Effect of reactant addition order on lipase inhibitory activity
2.4.3 孵育时间
为了使反应完全进行,首先分别将萃取物与p-NPP混合孵育5、10、15、20 min,然后加入酶反应20 min。如图6所示,随着孵育时间的增加,每株菌的抑制活性几乎保持不变,表明萃取物与p-NPP在5 min内可完全接触。因此,确定萃取物与p-NPP的孵育时间为5 min。
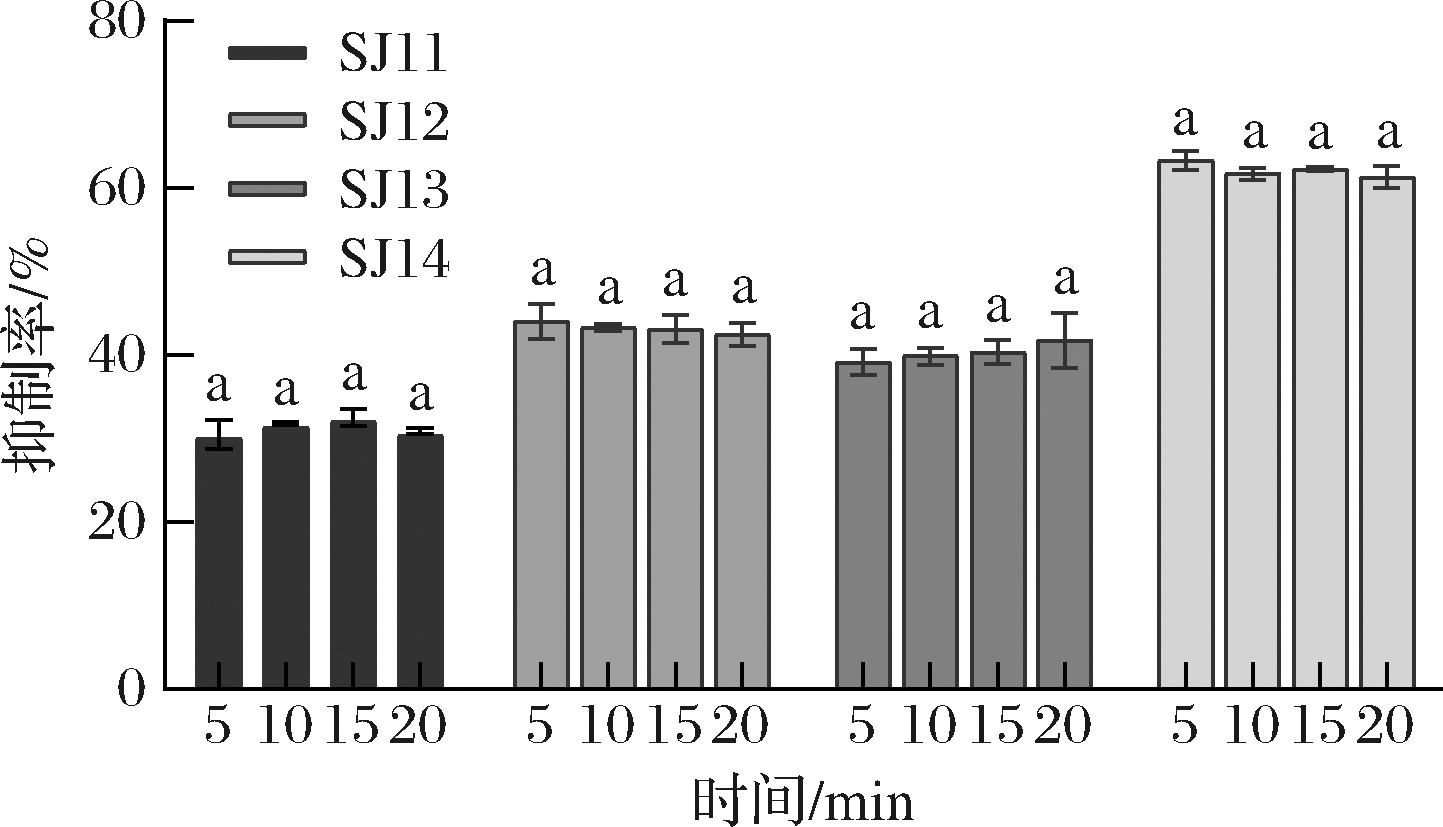
图6 孵育时间对脂肪酶抑制率的影响
Fig.6 Effect of incubation time on inhibition rate of lipase
注:图中相同字母表示不存在显著差异(P>0.05)。
2.4.4 酶促反应时间
为保证活性组分、酶、底物三者反应更加完全,进一步考察酶促反应时间与抑制率的关系,将萃取物与p-NPP混合孵育5 min后,加入脂肪酶反应5、10、15、20 min,结果如图7所示。在5、10、15 min的反应时间内,随时间增加,4株菌所对应的抑制率在不断上升,到20 min时几乎保持不变或者略微下降,结果表明,15 min的反应时间足以使萃取物中有效成分充分反应,略微下降可能是因为过量的p-NPP在37 ℃水浴过程中缓慢分解造成的。因此,最终确定酶促反应时间15 min为最佳的p-NPP反应时间。
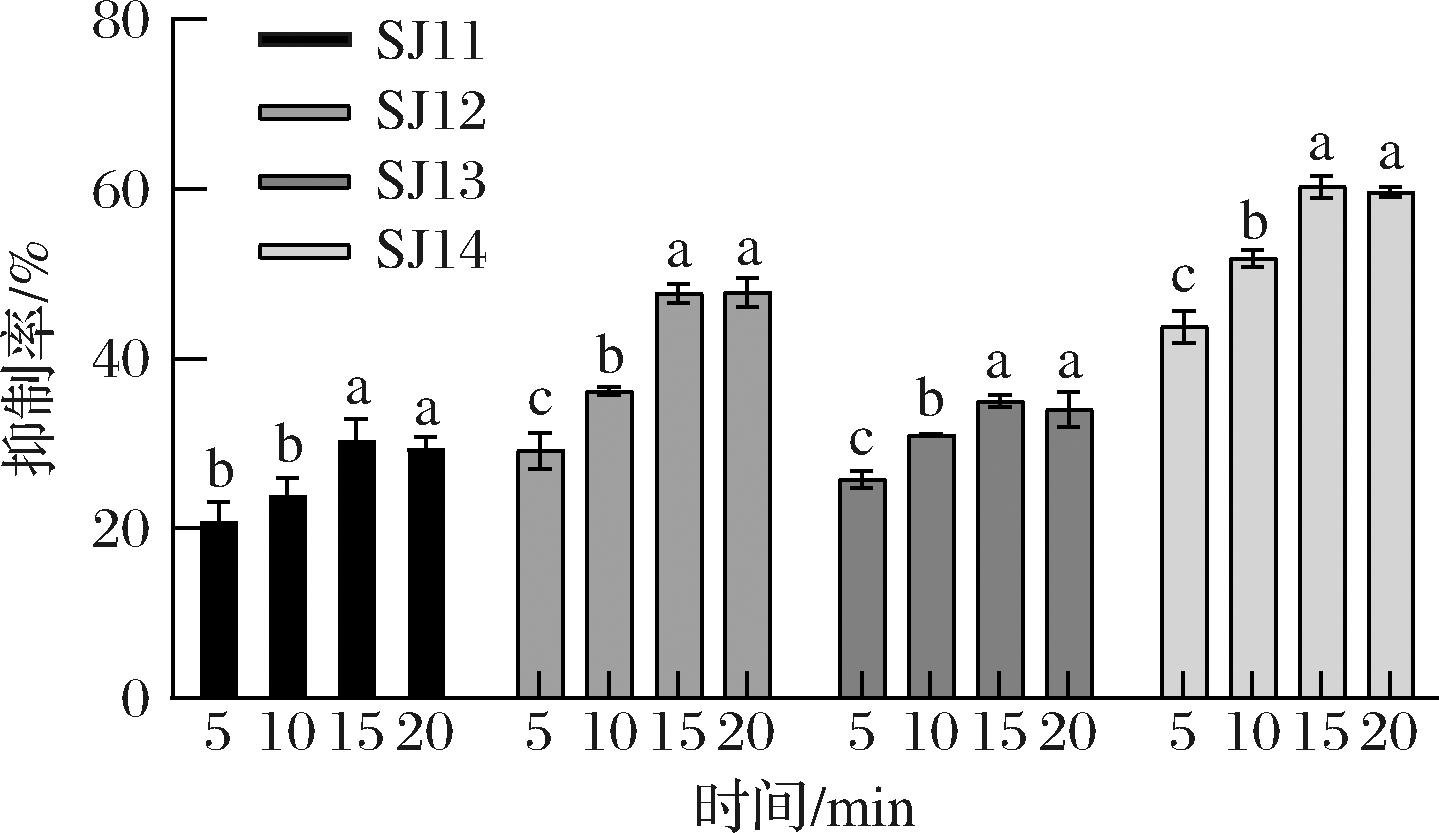
图7 酶促反应时间对脂肪酶抑制率的影响
Fig.7 Effect of enzymatic reaction time on inhibition rate of lipase
注:图中不同字母表示存在显著差异(P<0.05)。
2.4.5 优化后p-NPP法定量测定脂肪酶抑制率
用优化后的p-NPP法对6株活性菌株20 mL发酵液乙酸乙酯萃取物抑制率进行定量检测,如图8所示,菌株SJ03和SJ08的抑制率在20%以下,菌株SJ11、SJ12、SJ13、SJ14抑制率在20%以上,其中,SJ14、SJ12抑制率较高,分别达到(67.79±1.75)%、(48.28±0.73)%,表现出较强的脂肪酶抑制潜力,为后续活性成分及抑制机制研究奠定基础。
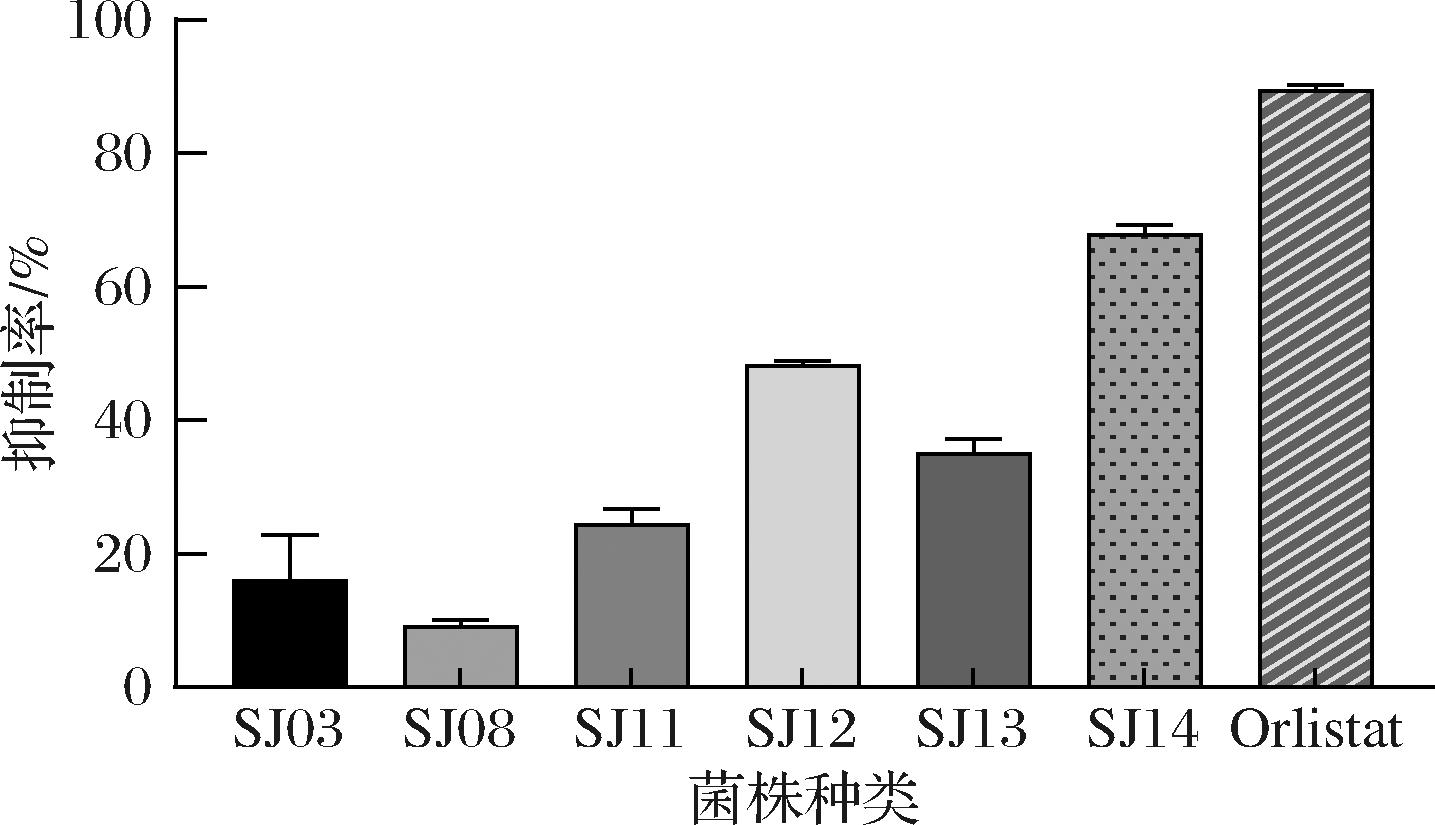
图8 p-NPP法测定活性菌株的抑制率
Fig.8 Inhibition rate of active strains determined by p-NPP method
2.5 HPLC指纹图谱分析潜在活性化合物
由于天然产物的成分复杂,建立一种快速有效的活性成分分析方法具有重要意义。当活性组分与酶相互作用形成复合物时,活性化合物的色谱峰就会减小或消失。活性越高的化合物,其与酶反应后响应值降低得越多,因此可以利用HPLC指纹图谱,通过对比酶反应前后各组分峰含量变化,筛选出活性化合物。
图9给出了菌株SJ12萃取物的HPLC指纹图谱变化情况,表2给出了酶反应前后各组分的积分信息,可以看出在波长254 nm下,酶促反应前SJ12萃取物中主要有6个组分,其中,组分2、6含量较多,保留时间分别为21.70 min和51.47 min。酶促反应后,组分1~4没有明显变化,峰高和峰面积在酶促反应前后基本保持一致,而组分5和组分6有不同程度的改变,其中,组分6的峰高和峰面积都大幅度降低,分别减少了31.98%和31.13%,组分5的峰高和峰面积也有降低,分别减少了4.59%和4.99%,表明组分5、6可能具有脂肪酶抑制活性,为后续活性化合物的获取奠定了重要基础。
表2 菌株SJ12萃取物与酶反应前后积分信息
Table 2 Integral information of SJ12 extracts before and after reaction with enzyme
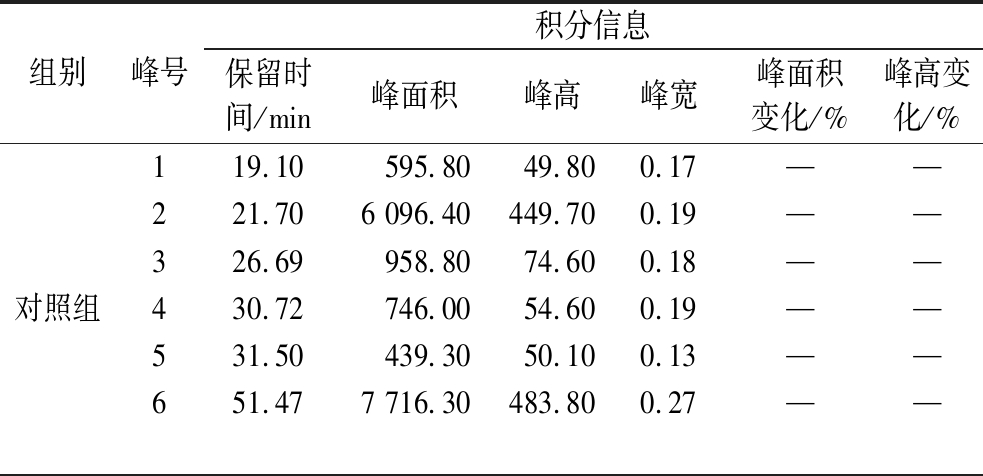
组别峰号积分信息保留时间/min峰面积峰高峰宽峰面积变化/%峰高变化/%对照组119.10 595.8049.800.17——221.706 096.40449.700.19——326.69958.8074.600.18——430.72746.0054.600.19——531.50439.3050.100.13——651.477 716.30483.800.27——
续表2
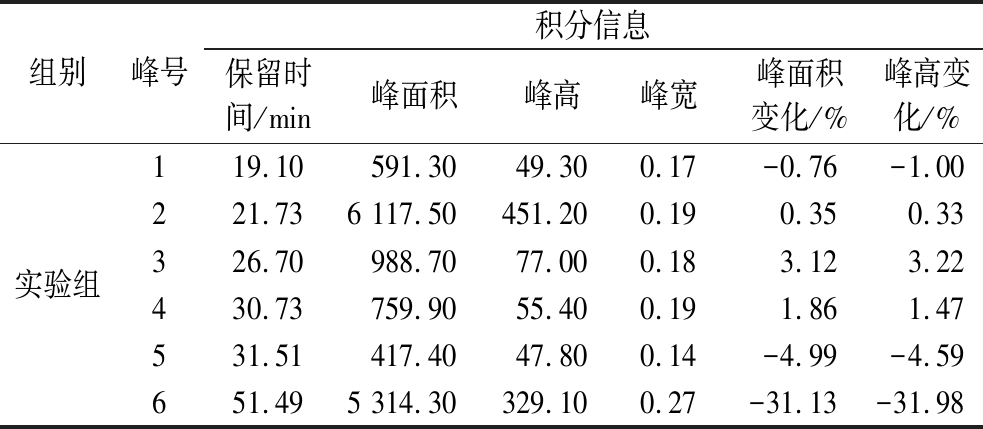
组别峰号积分信息保留时间/min峰面积峰高峰宽峰面积变化/%峰高变化/%实验组119.10591.3049.300.17-0.76-1.00221.736 117.50451.200.190.350.33326.70988.7077.000.183.123.22430.73759.9055.400.191.861.47531.51417.4047.800.14-4.99-4.59651.495 314.30329.100.27-31.13-31.98
注:—代表对照组无变化。
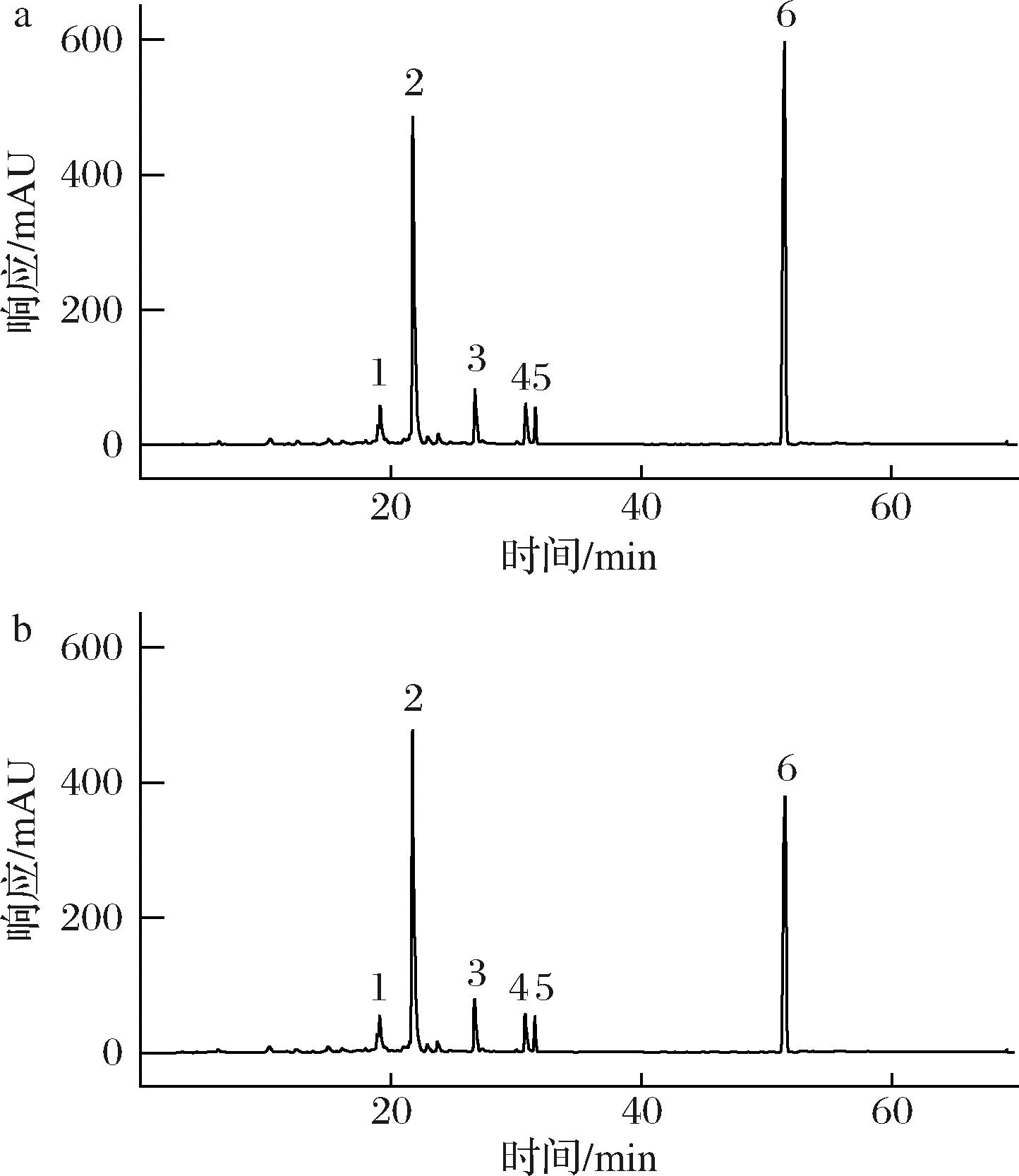
a-对照组,b-实验组
图9 菌株SJ12萃取物与酶反应前后HPLC图谱对比
Fig.9 Comparison of HPLC spectra of extracts from strain SJ12 before and after reaction with enzyme
3 结论
本研究从生姜中筛选分离出21株内生菌株,通过薄层色谱生物自显影法快速定性分析,筛选出6株具有脂肪酶抑制活性内生菌,经16S rRNA基因测序鉴定出其主要属于假单胞菌属(Pseudomonas)和不动杆菌属(Acinetobacter)。p-NPP定量测定方法优化结果显示,最佳萃取剂为乙酸乙酯,反应物最佳添加顺序为依次添加萃取物、p-NPP、酶,孵育时间5 min,酶促反应时间15 min,可有效评价生姜内生菌脂肪酶的抑制活性;采用优化后的p-NPP法对6株活性菌定量分析发现,4株菌萃取物的脂肪酶抑制活性达到20%以上,其中,菌株SJ14、SJ12萃取物抑制活性较高,分别为(67.79±1.75)%、(48.28±0.73)%,利用HPLC指纹图谱找到SJ12中可能的活性组分。
本实验提供了定性、定量测定生姜内生菌脂肪酶抑制活性的综合方法,为活性菌株和活性化合物的高效准确筛选提供新思路,有望为高效低毒脂肪酶抑制剂提供活性生产菌种,也将为抑制活性机制研究奠定基础。同时,也丰富了生姜内生菌资源及其在脂肪酶抑制活性的应用,对微生物来源的脂肪酶抑制剂开发利用提供了科学依据。
[1] DI BONITO P, PACIFICO L, LICENZIATI M R, et al.Elevated blood pressure, cardiometabolic risk and target organ damage in youth with overweight and obesity[J].Nutrition, Metabolism and Cardiovascular Diseases, 2020, 30(10):1840-1847.
[2] LIU T T, LIU X T, CHEN Q X, et al.Lipase inhibitors for obesity:A review[J].Biomedicine &Pharmacotherapy, 2020, 128:110314.
[3] 杨志秋, 詹莉莉, 傅正伟.脂肪酶抑制剂应用于抗肥胖的研究进展[J].现代生物医学进展, 2011, 11(21):4178-4181.
YANG Z Q, ZHAN L L, FU Z W.Recent advances of lipase inhibitor in the application of anti-obesity[J].Progress in Modern Biomedicine, 2011, 11(21):4178-4181.
[4] SAHEBKAR A, SIMENTAL-MEND A L E, REINER Ž, et al.Effect of orlistat on plasma lipids and body weight:A systematic review and meta-analysis of 33 randomized controlled trials[J].Pharmacological Research, 2017, 122:53-65.
A L E, REINER Ž, et al.Effect of orlistat on plasma lipids and body weight:A systematic review and meta-analysis of 33 randomized controlled trials[J].Pharmacological Research, 2017, 122:53-65.
[5] RUCKER D, PADWAL R, LI S K, et al.Long term pharmacotherapy for obesity and overweight:Updated meta-analysis[J].BMJ, 2007, 335(7631):1194-1199.
[6] 李玲, 过证核, 杨子婵, 等.天然来源减肥用脂肪酶抑制剂的研究进展[J].现代化工, 2023, 43(2):51-55.
LI L, GUO Z H, YANG Z C, et al.Research progress on lipase inhibitors for weight loss from natural sources[J].Modern Chemical Industry, 2023, 43(2):51-55.
[7] 徐源清, 朱越, 韩佳妮, 等.药用植物内生菌促生与生防作用研究进展[J].农业灾害研究, 2024, 14(2):28-30.
XU Y Q, ZHU Y, HAN J N, et al.Research progress on growth promotion and biocontrol of endophytic bacteria in medicinal plants[J].Journal of Agricultural Catastrophology, 2024, 14(2):28-30.
[8] GUHA T, MANDAL BISWAS S.Recent progress in the role of seed endophytic bacteria as plant growth-promoting microorganisms and biocontrol agents[J].World Journal of Microbiology &Biotechnology, 2024, 40(7):218.
[9] 苗永美, 韩朔, 苗翠苹, 等.石豆兰内生细菌分离鉴定、发酵条件优化及对棉花枯萎病菌的抑制[J].天然产物研究与开发, 2022, 34(4):656-664.
MIAO Y M, HAN S, MIAO C P, et al.Isolation, identification and fermentation conditions optimization of endophytes from Bulbophyllum sp.and its inhibitory effect on Fusarium oxysporum f.sp.vasinfectum[J].Natural Product Research and Development, 2022, 34(4):656-664.
[10] 崔文宁. 几种中药内生菌对梨黑斑病菌的抑制作用研究[J].现代农村科技, 2022(3):70-71.
CUI W N.Study on the inhibitory effect of endophytic bacteria of several traditional Chinese medicines on the pathogen of pear black spot[J].Modern Rural Science and Technology, 2022(3):70-71.
[11] ISLAM M N, CHOI J, BAEK K H.Control of foodborne pathogenic bacteria by endophytic bacteria isolated from Ginkgo biloba L.[J].Foodborne Pathogens and Disease, 2019, 16(10):661-670.
[12] SHIDFAR F, RAJAB A, RAHIDEH T, et al.The effect of ginger (Zingiber officinale) on glycemic markers in patients with type 2 diabetes[J].Journal of Complementary &Integrative Medicine, 2015, 12(2):165-170.
[13] GHASEMZADEH A, JAAFAR H Z E, BAGHDADI A, et al.Formation of 6-, 8- and 10-shogaol in ginger through application of different drying methods:Altered antioxidant and antimicrobial activity[J].Molecules, 2018, 23(7):1646.
[14] 吴英智, 傅强, 严全能, 等.姜酚在心血管疾病中的药理作用研究进展[J].中国临床药理学杂志, 2017, 33(18):1824-1827.
WU Y Z, FU Q, YAN Q N, et al.Research progress on pharmacological actions of gingerols in cardiovasular disease[J].The Chinese Journal of Clinical Pharmacology, 2017, 33(18):1824-1827.
[15] 李娅雯, 李旭升, 袁洋冰, 等.姜酚减肥降脂机制研究进展[J].食品科学, 2022, 43(5):356-362.
LI Y W, LI X S, YUAN Y B, et al.Progress in understanding the antiobesity and lipid-lowering mechanism of gingerol[J].Food Science, 2022, 43(5):356-362.
[16] 楚敏, 张志东, 王玮, 等.生姜内生菌多样性及微生物拮抗作用的初步研究[J].新疆农业科学, 2011, 48(11):2061-2066.
CHU M, ZHANG Z D, WANG W, et al.The diversity of endophytes in ginger and screening of the antagonism[J].Xinjiang Agricultural Sciences, 2011, 48(11):2061-2066.
[17] 徐霖, 罗华, 杨印.生姜内生菌抑癌活性菌株筛选[J].河南农业大学学报, 2013, 47(4):457-460.
XU L, LUO H, YANG Y.Selection of Ginger endophyte tumor suppressor activity strains[J].Journal of Henan Agricultural University, 2013, 47(4):457-460.
[18] B DALO A, BORREGO R, GARRIDO C, et al.In vitro studies of endophytic bacteria isolated from ginger (Zingiber officinale) as potential plant-growth-promoting and biocontrol agents against Botrytis cinerea and Colletotrichum acutatum[J].Plants, 2023, 12(23):4032.
DALO A, BORREGO R, GARRIDO C, et al.In vitro studies of endophytic bacteria isolated from ginger (Zingiber officinale) as potential plant-growth-promoting and biocontrol agents against Botrytis cinerea and Colletotrichum acutatum[J].Plants, 2023, 12(23):4032.
[19] BROCKMAN H L.Triglyceride lipase from porcine pancreas[J].Methods in Enzymology, 1981, 71:619-627.
[20] 江慧芳, 王雅琴, 刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程, 2007, 24(8):72-75.
JIANG H F, WANG Y Q, LIU C G.Comparison and improvement of three determination methods for lipase activity[J].Chemistry &Bioengineering, 2007, 24(8):72-75.
[21] MCDOUGALL G J, KULKARNI N N, STEWART D.Berry polyphenols inhibit pancreatic lipase activity in vitro[J].Food Chemistry, 2009, 115(1):193-199.
[22] YANG F, GU L H, HAN Z Z, et al.Rapid screening for natural lipase inhibitors from Alisma orientale combining high-performance thin-layer chromatography-bioautography with mass spectrometry[J].Journal of Chromatography B, 2021, 1170:122599.
[23] 朱珺, 吴石金.胰脂肪酶抑制剂产生菌的筛选和鉴定[J].发酵科技通讯, 2015, 44(4):10-14.
ZHU J, WU S J.Screening and identification of pancreatic lipase inhibitor-producing strain[J].Bulletin of Fermentation Science and Technology, 2015, 44(4):10-14.
[24] CAMACHO-RUIZ M A, ORDAZ E, KIRCHMAYR M R, et al.Screening of gastrointestinal lipase inhibitors produced by microorganisms isolated from soil and lake sediments[J].International Microbiology, 2020, 23(2):335-343.
[25] JIN P Y, CHEN L Z, ZHONG J J, et al.Screening and identification of lipase inhibitors extracted from Dioscorea nipponica Makino by UV-vis and HPLC coupled to UPLC-Q-TOF-MS/MS[J].International Journal of Biological Macromolecules, 2023, 230:123427.
[26] CHANG Y X, GE A H, JIANG Y, et al.A bioactivity-based method for screening, identification of lipase inhibitors, and clarifying the effects of processing time on lipase inhibitory activity of Polygonum multiflorum[J].Evidence-Based Complementary and Alternative Medicine, 2016, 2016:5965067.
[27] WANG H, DU Y J, SONG H C.α-Glucosidase and α-amylase inhibitory activities of guava leaves[J].Food Chemistry, 2010, 123(1):6-13.
[28] DONG H Q, LI M, ZHU F, et al.Inhibitory potential of trilobatin from Lithocarpus polystachyus Rehd against α-glucosidase and α-amylase linked to type 2 diabetes[J].Food Chemistry, 2012, 130(2):261-266.
[29] TAN Y Q, CHANG S K C, ZHANG Y.Comparison of α-amylase, α-glucosidase and lipase inhibitory activity of the phenolic substances in two black legumes of different Genera[J].Food Chemistry, 2017, 214:259-268.
[30] RODRIGUES R C, VIRGEN-ORT Z J J, DOS SANTOS J C S, et al.Immobilization of lipases on hydrophobic supports:Immobilization mechanism, advantages, problems, and solutions[J].Biotechnology Advances, 2019, 37(5):746-770.
Z J J, DOS SANTOS J C S, et al.Immobilization of lipases on hydrophobic supports:Immobilization mechanism, advantages, problems, and solutions[J].Biotechnology Advances, 2019, 37(5):746-770.