作为一种天然高分子多糖,果胶在植物细胞壁中广泛分布,其核心结构由α-1,4-糖苷键连接的半乳糖醛酸单元组成。此外,果胶还可能包含其他糖类成分,如鼠李糖和阿拉伯糖,这些成分赋予果胶多样化的功能特性,其部分羧基可能被甲酯化或形成盐,影响其溶解性和凝胶特性。果胶具有凝胶形成、增稠稳定、水溶性及生物活性等功能。主要从柑橘类水果和苹果中提取,通过酸或酶处理纯化后得到成品。近年来,果胶在食品包装领域的研究日益增多。其能够改善食品的质构特性,提升产品稳定性,并通过形成凝胶网络有效减少水分流失,有效延缓食品变质,延长保质期。尽管果胶具有多种理化优势,但其抗氧化和抑菌能力相对有限,而这两种特性对食品保鲜至关重要。在食品包装储存过程中,氧化反应会引发脂质氧化,影响食品的风味,微生物会导致食品腐败变质,控制微生物生长对延长食品保质期至关重要。因此,如果能有效利用果胶的抗氧化性和抑菌性能于食品包装膜上,有望推动食品保鲜膜领域的发展[1]。
姜黄素作为一种天然酚类化合物,因其分子结构中富含酚羟基,表现出优异的抗氧化和抑菌能力,在食品防腐与保鲜中起到重要作用。近年来,随着对姜黄素研究的不断深入,其在食品工业中的应用范围逐渐扩大,不仅作为天然色素用于食品着色,还因其抗氧化和抑菌特性被广泛应用于食品防腐。将姜黄素成功接枝至果胶分子骨架上,是一种创新的材料改性策略。果胶本身是一种广泛应用于食品工业的天然高分子多糖,具有良好的增稠和凝胶特性。通过接枝姜黄素,果胶不仅保留了其原有的物理化学性质,还被赋予了抗氧化和抑菌功能。这种改性后的果胶基材料在食品保鲜中的应用潜力显著提升,能够有效延长食品的保质期,同时减少化学防腐剂的使用。此外,姜黄素的抗氧化能力可与维生素C和维生素E相当,其通过提高过氧化氢酶和超氧化物歧化酶的活性,或抑制氧自由基的释放,从而发挥抗氧化功效。在抑菌方面,姜黄素对多种细菌和真菌具有抑制作用,且不易产生耐药性。这种双重功能的结合,使得接枝姜黄素的果胶基材料在食品保鲜中表现出更广泛的应用前景。姜黄素与果胶的结合不仅丰富了果胶的功能特性,还为食品保鲜提供了一种天然、高效的解决方案,有望在食品工业中得到更广泛的应用[1-4]。
本研究利用漆酶催化策略,在温和条件下实现了姜黄素对果胶的高效分子修饰[5-8]。通过系统分析改性后果胶的结构变化,评估其抗氧化和抑菌性能,并探讨其在食品包装中的应用潜力。本研究为功能性食品保鲜材料的开发提供了新的技术路径和理论支持,尤其在提升食品安全性和延长货架期方面具有重要的潜在应用价值[1]。
1 材料与方法
1.1 材料与仪器
LB肉汤培养基、LB琼脂培养基,杭州百思生物技术有限公司;金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)菌株,中国普通微生物菌种保藏管理中心;漆酶(≥120 U/g),源叶生物科技有限公司;果胶、姜黄素、β-胡萝卜素、DPPH、亚油酸,上海麦克林生化科技有限公司;二氯甲烷、无水乙醇,西陇化工股份有限公司。除特别说明外,所有试剂均为分析纯。
T9紫外可见光谱仪,北京普析通用仪器有限责任公司;EscaLab 250Xi X射线光电子能谱仪、NICOLET iS10傅里叶红外光谱仪,美国赛默飞世尔有限责任公司。
1.2 实验方法
1.2.1 姜黄素-果胶共聚物样品的制备
0.5 g姜黄素溶于100 mL无水乙醇中,加入0.5 g漆酶溶解。将10 g果胶与10 mL无水乙醇混合后,加入300 mL去离子水中搅拌30 min至溶解。将果胶溶液与姜黄素/漆酶溶液混合,通氧气,在35 ℃下搅拌2 h。加入300 mL 95%(体积分数)乙醇后离心,重复2次清洗操作,去除姜黄素,得到沉淀物,进行冷冻干燥,得到姜黄素-果胶共聚物(Cu-Pe)[9-10]。制备过程中姜黄素的添加量分别为0.25、0.5、1.0 g时,产物命名分别为Cu-Pe0.25、Cu-Pe0.5、Cu-Pe1。
1.2.2 果胶中姜黄素接枝率的测定
本研究运用分光光度法,旨在测定改性果胶中姜黄素的接枝率,以此作为评估其修饰效果的关键指标[1]。首先,配制10 g/L的姜黄素-果胶共聚物溶液,稀释至适当浓度,测定其在424 nm处吸光度,并代入姜黄素标准曲线方程,计算共聚物中姜黄素的质量,再按照公式(1)计算接枝率:
接枝率![]()
(1)
式中:m1,姜黄素-果胶共聚物中姜黄素的质量,g;m0,黄素-果胶共聚物的质量,g。
1.2.3 姜黄素-果胶共聚物的结构表征
傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)分析,样品经KBr压片法制备,扫描范围设定为4 000~400 cm-1,分辨率16 cm-1[11]。
X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)分析,样品涂布于支架,并以C1s(284.80 eV)校正。使用Al Kα射线(HV=1 486.6 eV)激发,并对C1s谱进行分析。
1.2.4 姜黄素-果胶共聚物的DPPH自由基清除率
把无水乙醇配制的DPPH溶液稀释至其在最大吸收波长处的吸光度于0.8,取4 mL该溶液置于10 mL离心管中,随后加入200 μL 1%的样品溶液。作为对照,空白组则以等体积的无水乙醇替代样品溶液。所有样品在避光条件下静置30 min,以确保反应充分进行,分光光度计测吸光度[12]。DPPH自由基清除率按公式(2)计算:
DPPH自由基清除率![]()
(2)
式中:A0、A1,参照样、样品的吸光度值。
1.2.5 姜黄素-果胶共聚物的β-胡萝卜素漂白抑制率
制备乳化液:将10 mg β-胡萝卜素加入10 mL二氯甲烷溶液,再加入400 μL亚油酸和4 mL吐温-80于梨形瓶中,在40 ℃利用旋转蒸发减压操作,把二氯甲烷除去,再加入100 mL蒸馏水,混匀形成乳化液。制备乳化稀释液:取乳化液10 mL,用水定容至100 mL,吸光度控制在0.8~1。添加果胶溶液:向5 mL乳化稀释液加入30 μL 1%果胶溶液,混匀后测定吸光度。恒温反应与测定:将所有试管置于50 ℃恒温水浴120 min,测470 nm的吸光度值。对照样不含果胶,以去离子水代替[13]。根据吸光度值,按照公式(3)计算β-胡萝卜素漂白的抑制率:
β-胡萝卜素漂白抑制率![]()
(3)
式中:![]() 和
和![]() 空白样和样品在加热前后的吸光度(460 nm)。
空白样和样品在加热前后的吸光度(460 nm)。
1.2.6 抑菌活性测定
采用抑菌圈法评估姜黄素-果胶共聚物对大肠杆菌和金黄色葡萄球菌的抑菌活性。从-80 ℃冰箱取出菌液,离心管消毒后化冻,将菌液接种到液体培养基,放入37 ℃培养箱振摇培养过夜(12 h),必要时延长培养时间以激活菌种,获得活化菌液。取100 μL活化菌液接种于平板培养基(菌浓度106~107 CFU/mL),置入空白药敏纸片,并分别添加100 μL 4%样品溶液。于4 ℃静置2~3 h扩散后,在37 ℃培养12 h,测量抑菌圈直径,按照公式(4)计算抑菌率。抑菌率越高,抑菌活性越强[14]。
抑菌率![]()
(4)
式中:D0,空白药敏纸片的直径,6 mm;D1,抑菌圈直径,mm。
1.3 数据处理
所有实验均独立重复3次,结果以“平均值±标准差”的形式呈现。采用SPSS 22.0统计软件对实验数据进行处理和分析,组间差异通过单因素方差分析进行比较,显著性水平设定为P<0.05。
2 结果与分析
2.1 UV-Vis分析
图1展示了天然果胶(native pectin,Na-Pe)与Cu-Pe的UV-Vis光谱(350~500 nm)。在图1-a中,Na-Pe未显示出明显的吸收峰,而Cu-Pe在424 nm处出现了显著的吸收峰,结果表明姜黄素已成功接枝到果胶分子上,其特有的π-π*跃迁吸收峰进一步证实了姜黄素的引入。
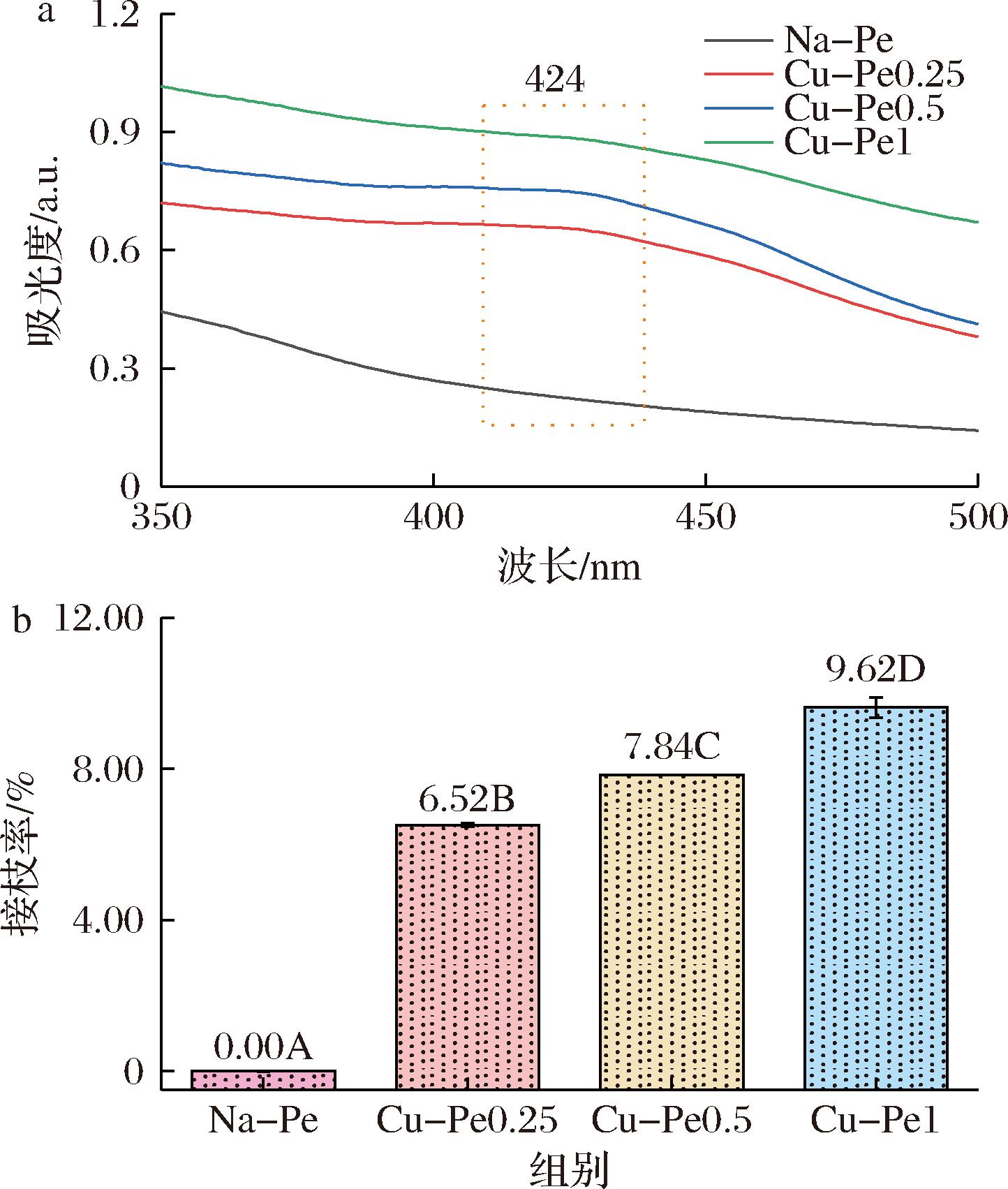
a-UV-Vis光谱;b-接枝率
图1 天然果胶及姜黄素-果胶共聚物的紫外光谱
Fig.1 UV-Vis spectra of native pectin and curcumin-pectin copolymer
注:不同大写字母表示存在显著性差异(P<0.05)(下同)。
图1-b中显示,随着姜黄素添加剂量的上升,Cu-Pe系列的接枝率逐渐提高,分别为6.52%、7.84%和9.62%,与吸光度的变化一致,表明姜黄素的接枝量与接枝率呈正相关。综上,UV-Vis分析证实姜黄素通过漆酶催化成功接枝到果胶分子上,并且接枝量与姜黄素的添加量呈正相关关系。
2.2 FTIR分析
为进一步确认姜黄素是否成功接枝到果胶分子上,并探讨姜黄素接枝对果胶结构的影响,进行了FTIR分析。图2展示了Na-Pe与Cu-Pe的FTIR光谱。在图2-a中,Na-Pe与3种Cu-Pe均在3 388 cm-1处有宽而强的吸收峰,这可能主要由羟基及氢键的伸缩振动引起。与Na-Pe的吸收峰相比,Cu-Pe的吸收峰更为宽且平,这可能是由于姜黄素引入后酚羟基的影响所致。此外,Na-Pe及Cu-Pe均在2 940 cm-1处出现吸收峰,这与—CH3, —CH2及—CH的伸缩振动相关。
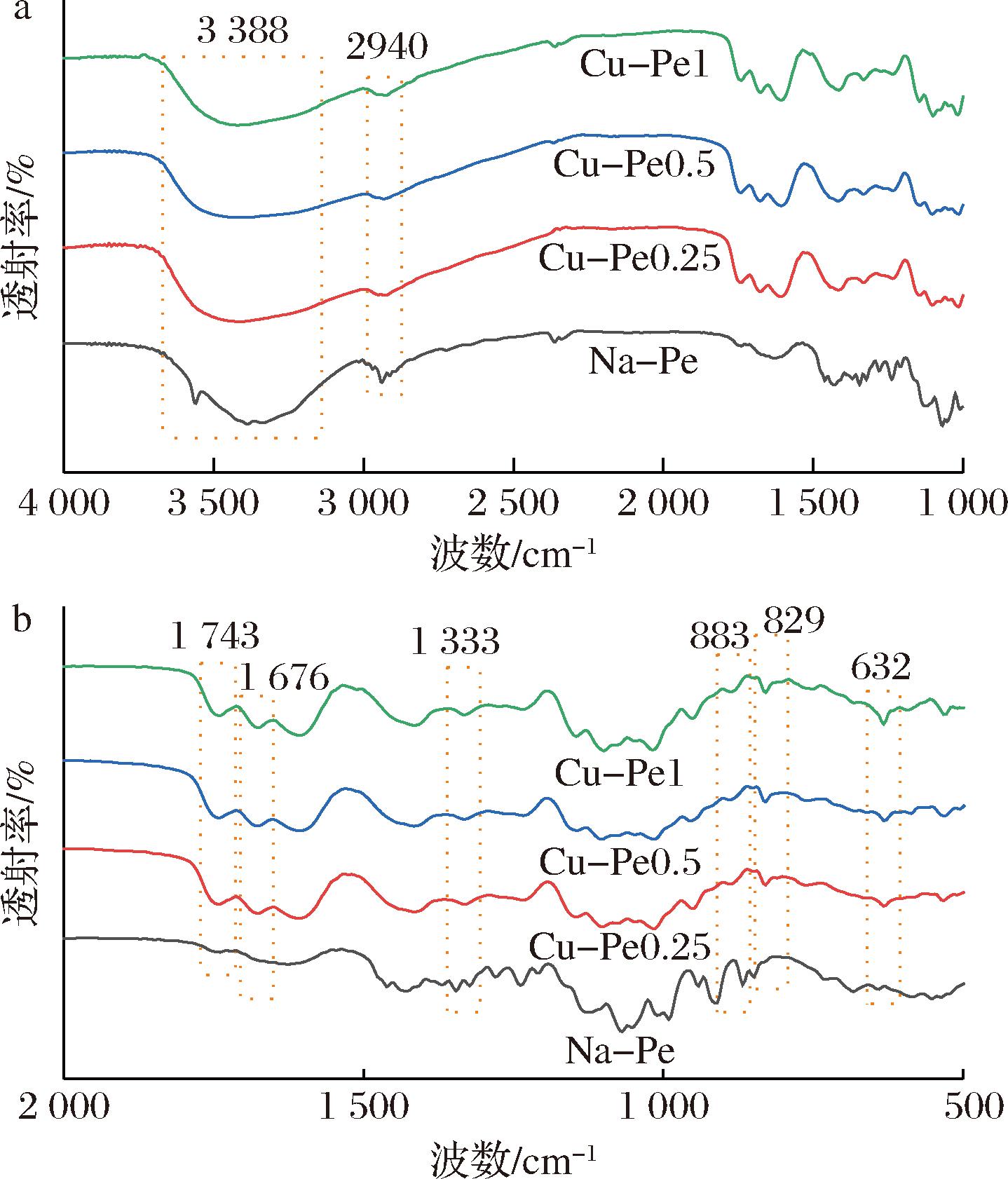
a-4 000~500 cm-1;b-2 000~500 cm-1
图2 天然果胶及姜黄素-果胶共聚物的红外光谱
Fig.2 FTIR spectra of native pectin and curcumin-pectin copolymer
在图2-b中,Na-Pe的FTIR图谱在1 743 cm-1和1 650 cm-1处分别出现酯基和羧基上C![]() O的伸缩振动峰,表明果胶分子中的半乳糖醛酸上的羧基及其甲酯化产物的特征吸收。对于Cu-Pe,除了上述2个特征峰外,还在1 676 cm-1附近处出现了一个新吸收峰,这可能是—COOAr中C
O的伸缩振动峰,表明果胶分子中的半乳糖醛酸上的羧基及其甲酯化产物的特征吸收。对于Cu-Pe,除了上述2个特征峰外,还在1 676 cm-1附近处出现了一个新吸收峰,这可能是—COOAr中C![]() O的伸缩振动引起的,说明姜黄素分子上的—OH与果胶的—COOH发生了酯化反应,从而实现了共价接枝。此外,与Na-Pe的FTIR图谱相比,Cu-Pe在1 333 cm-1处出现了新的特征峰,这可能是姜黄素接枝到果胶上的C—O—C弯曲振动峰,进一步证明姜黄素成功引入到果胶分子中。更进一步的证据是,Cu-Pe的图谱在883、829、632 cm-1处出现了3个新的特征峰,这些峰与苯环上的C—H弯曲振动相关,进一步确认姜黄素已成功接枝到果胶分子上。
O的伸缩振动引起的,说明姜黄素分子上的—OH与果胶的—COOH发生了酯化反应,从而实现了共价接枝。此外,与Na-Pe的FTIR图谱相比,Cu-Pe在1 333 cm-1处出现了新的特征峰,这可能是姜黄素接枝到果胶上的C—O—C弯曲振动峰,进一步证明姜黄素成功引入到果胶分子中。更进一步的证据是,Cu-Pe的图谱在883、829、632 cm-1处出现了3个新的特征峰,这些峰与苯环上的C—H弯曲振动相关,进一步确认姜黄素已成功接枝到果胶分子上。
综上所述,FTIR分析验证了姜黄素通过漆酶催化与果胶发生酯化反应,成功接枝到果胶分子上,并且随着姜黄素接枝率的增加,相应的特征吸收峰逐步增多,进一步证明了姜黄素的有效接入。
2.3 XPS分析
图3展示了Na-Pe与Cu-Pe的XPS光谱。Na-Pe和Cu-Pe的XPS全谱图显示,C和O是果胶及姜黄素-果胶共聚物中最主要的元素,符合果胶的酸性多糖特性及姜黄素分子中C、H、O三种元素的组成。
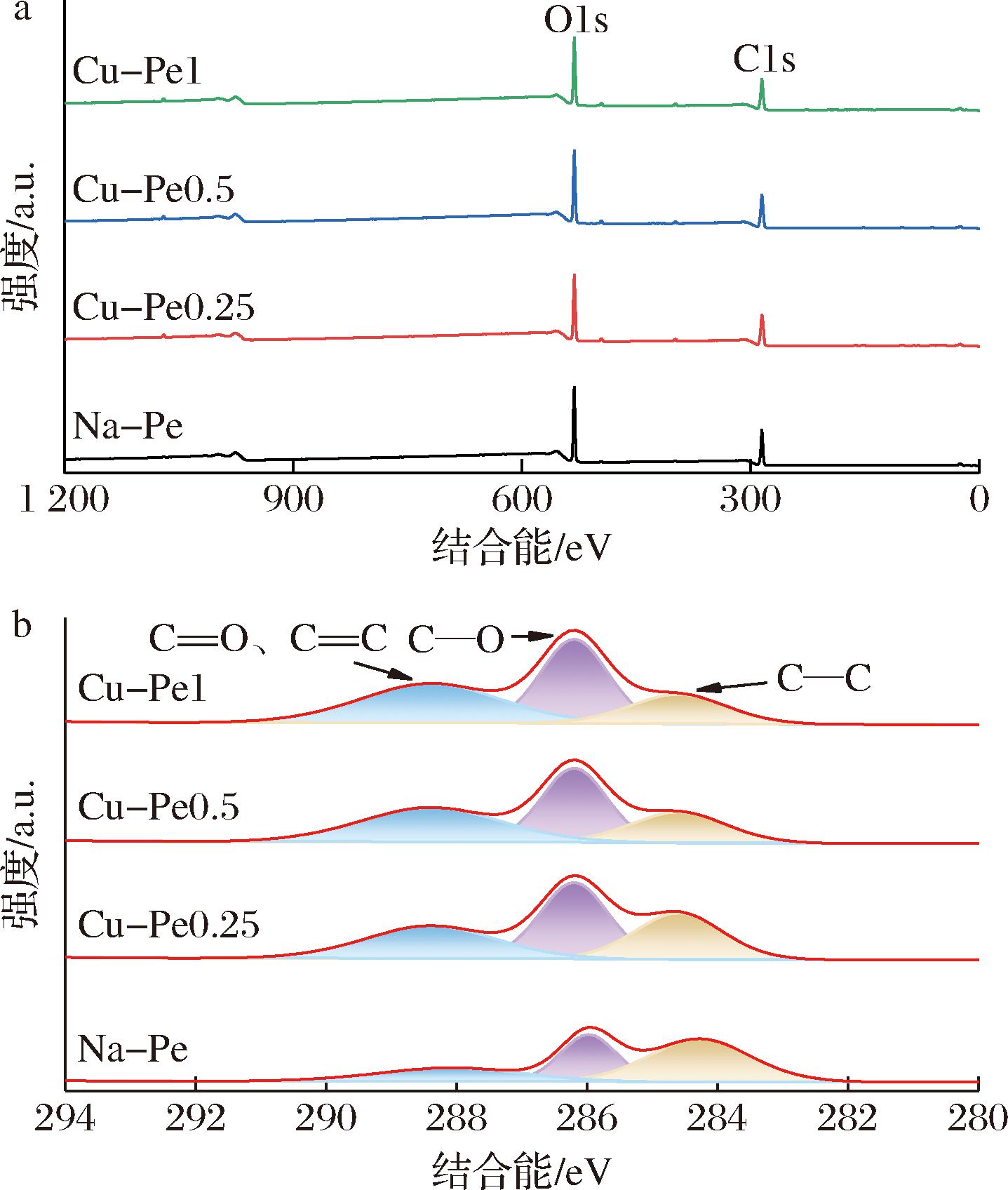
a-XPS光谱;b-C1s谱图
图3 天然果胶和姜黄素-果胶共聚物的X射线光电子能谱
Fig.3 XPS spectra of native pectin and curcumin-pectin copolymer
图3-b 中,C1s谱图的精细扫描表明,Na-Pe和Cu-Pe的C1s峰由3个子峰组成,分别对应C![]() O、C—O和C—C。在Cu-Pe中,C—C峰的相对含量显著下降,而C—O、C
O、C—O和C—C。在Cu-Pe中,C—C峰的相对含量显著下降,而C—O、C![]() O和C
O和C![]() C峰的相对含量明显增加,表明姜黄素中的C
C峰的相对含量明显增加,表明姜黄素中的C![]() O和C
O和C![]() C键在接枝过程中与果胶分子中的基团发生了反应,增强了果胶中的碳双键含量,降低了碳单键的相对含量,进一步验证了姜黄素的有效接入。
C键在接枝过程中与果胶分子中的基团发生了反应,增强了果胶中的碳双键含量,降低了碳单键的相对含量,进一步验证了姜黄素的有效接入。
2.4 姜黄素接枝对果胶抗氧化特性影响的分析
为了研究姜黄素接枝对果胶抗氧化性能的影响,进行了DPPH自由基清除率和β-胡萝卜素漂白抑制率的测试[15],图4展示了Na-Pe与Cu-Pe的抗氧化特性。图4-a中,Na-Pe的DPPH自由基清除率为4.48%,随着姜黄素接枝量的增加,接枝姜黄素的果胶(Cu-Pe0.25、Cu-Pe0.5、Cu-Pe1)的DPPH自由基清除率分别升高至15.89%、24.06%和56.01%。姜黄素的酚羟基有效清除自由基,显著提高了果胶的抗氧化活性,且清除率与姜黄素接枝率呈正相关。
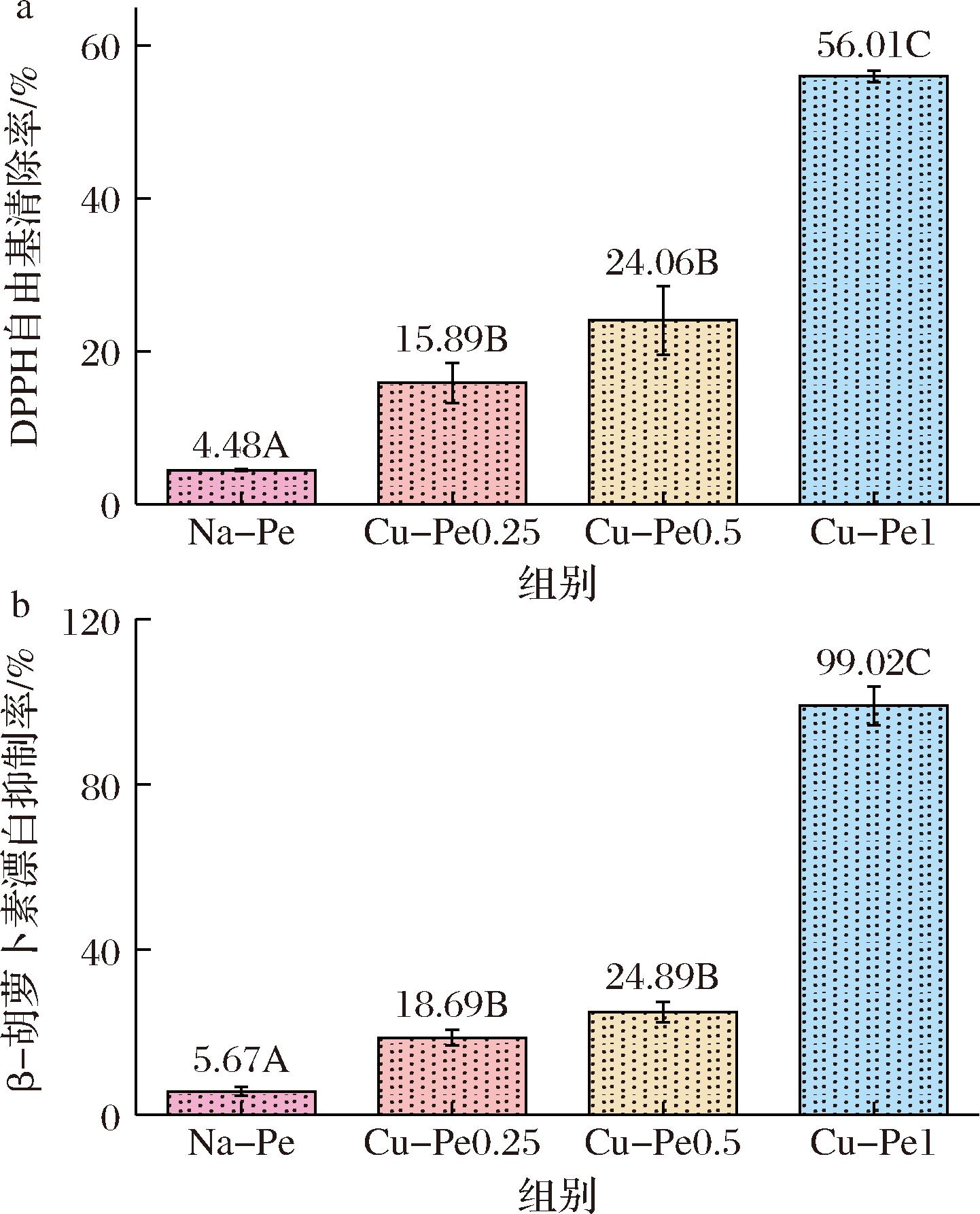
a-DPPH自由基清除率;b-β胡萝卜素漂白抑制率
图4 天然果胶及姜黄素-果胶共聚物抗氧化特性
Fig.4 Antioxidant properties of native pectin and curcumin-pectin copolymers
图4-b中,Na-Pe的β-胡萝卜素漂白抑制率为5.67%,接枝姜黄素后,该值分别上升至18.69%、24.89%和99.02%。姜黄素的酚羟基能够有效清除由油酸生成的自由基,抑制β-胡萝卜素褪色,漂白抑制率与姜黄素接枝率呈正相关,进一步证实了姜黄素接枝后对果胶抗氧化性能的显著提升[16-19]。
2.5 姜黄素接枝对果胶抑菌特性分析
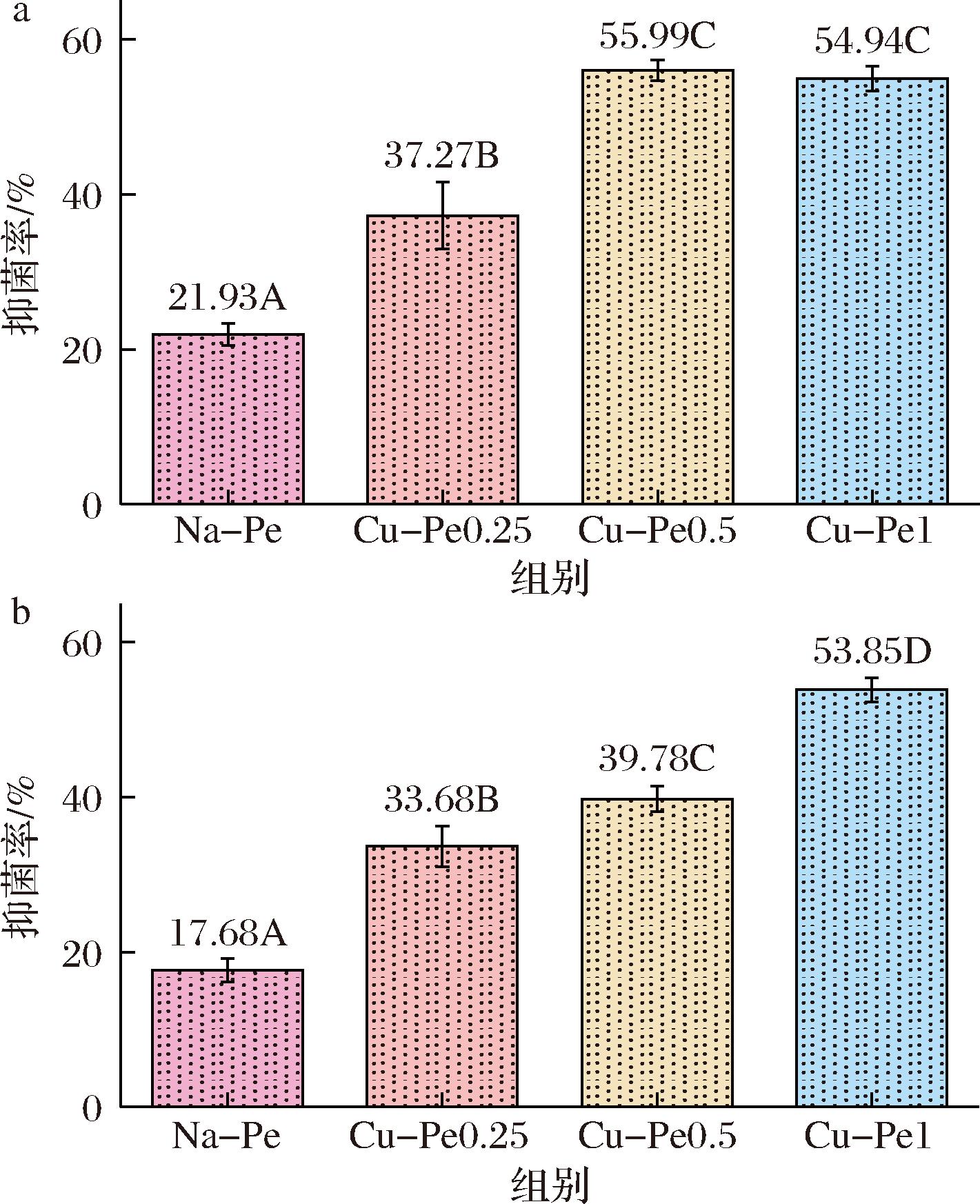
为了初步探讨姜黄素接枝对果胶抑菌性能的影响,采用抑菌圈法评估了果胶对金黄色葡萄球菌和大肠杆菌的抑制效果[20-23]。图5显示了Na-Pe与Cu-Pe对金黄色葡萄球菌和大肠杆菌的抑菌效果对比。结果表明,姜黄素的接枝显著增强了果胶的抑菌活性。对于大肠杆菌,天然果胶的抑菌率为21.93%,接枝姜黄素后的Cu-Pe0.25、Cu-Pe0.5和Cu-Pe1分别提升至37.27%、55.99%和54.94%。对于金黄色葡萄球菌,天然果胶的抑菌率为17.68%,而姜黄素接枝后分别提升至33.68%、39.78%和53.85%。结果表明,姜黄素的接枝有效提高了果胶对金黄色葡萄球菌和大肠杆菌的抑菌能力,可能通过破坏细菌细胞膜和抑制细菌酶活性发挥作用,从而为改性果胶在食品包装和保鲜中的应用提供了更大的潜力。
a-E.coli;b-S.aureus
图5 天然果胶及姜黄素-果胶共聚物抑菌特性
Fig.5 Antibacterial properties of native pectin and curcumin-pectin copolymers
3 结论
本研究通过UV-Vis光谱、FTIR、XPS、抗氧化及抑菌特性分析,系统研究了姜黄素接枝对果胶结构和功能特性的影响。UV-Vis光谱确认姜黄素接枝成功,且接枝量随添加量增加而增加。FTIR分析进一步验证了酯化反应的发生,XPS结果显示果胶中碳双键含量上升,可能与改性后抗氧化与抑菌性能的提升密切相关。
抗氧化测试表明,姜黄素接枝果胶显著提高了DPPH自由基清除率与β-胡萝卜素漂白抑制率,且接枝量与抗氧化活性正相关。在抑菌实验中,姜黄素接枝后的果胶对金黄色葡萄球菌和大肠杆菌的抑菌能力显著增强,尤其对金黄色葡萄球菌效果更佳[24]。结果表明,姜黄素接枝果胶在食品包装与保鲜领域具有潜在应用价值,可有效提升食品抗氧化与抑菌能力,延长保质期。与传统化学改性方法相比,漆酶催化接枝技术具有显著优势,避免环境污染,实现可持续发展。本研究系统探讨了姜黄素与果胶的接枝反应,深入分析了接枝对果胶的影响。研究结果表明,漆酶催化接枝技术能够高效实现姜黄素与果胶的共价结合,显著提升了果胶的抗氧化和抑菌性能。这一发现为果胶的功能化改性提供了一种新策略。此外,姜黄素接枝后果胶的抗氧化和抑菌性能显著增强,使其有可能在食品保鲜、防腐以及功能性包装材料领域存在良好的发展空间。
[1] 张泽宏, 厥质一, 费鹏.酚酸-果胶的酶法制备及其抗氧化与抑菌活性[J].食品工业科技, 2024, 45(16):146-151.
ZHANG Z H, JUE Z Y, FEI P.Enzymatic preparation of phenolic acid-pectin and its antioxidant and antibacterial activities[J].Science and Technology of Food Industry, 2024, 45(16):146-151.
[2] CHAINOGLOU E, HADJIPAVLOU-LITINA D.Curcumin in health and diseases:Alzheimer’s disease and curcumin analogues, derivatives, and hybrids[J].International Journal of Molecular Sciences, 2020, 21(6):1975.
[3] FENG J Y, LIU Z Q.Phenolic and enolic hydroxyl groups in curcumin:Which plays the major role in scavenging radicals?[J].Journal of Agricultural and Food Chemistry, 2009, 57(22):11041-11046.
[4] MURSALEEN L, SOMAVARAPU S, ZARIWALA M G.Deferoxamine and curcumin loaded nanocarriers protect against rotenone-induced neurotoxicity[J].Journal of Parkinson’s Disease, 2020, 10(1):99-111.
[5] GONZ LEZ-GONZ
LEZ-GONZ LEZ P, G
LEZ P, G MEZ-MANZO S, TOMASINI A, et al.Laccase production from Agrocybe pediades:Purification and functional characterization of a consistent laccase isoenzyme in liquid culture[J].Microorganisms, 2023, 11(3):568.
MEZ-MANZO S, TOMASINI A, et al.Laccase production from Agrocybe pediades:Purification and functional characterization of a consistent laccase isoenzyme in liquid culture[J].Microorganisms, 2023, 11(3):568.
[6] LI A X, LI H X, MA Y, et al.Bioinspired laccase-mimicking catalyst for on-site monitoring of thiram in paper-based colorimetric platform[J].Biosensors and Bioelectronics, 2022, 207:114199.
[7] LIU Y, LUO G, NGO H H, et al.Advances in thermostable laccase and its current application in lignin-first biorefinery:A review[J].Bioresource Technology, 2020, 298:122511.
[8] ZHOU M, FAKAYODE O A, REN M N, et al.Laccase-catalyzed lignin depolymerization in deep eutectic solvents:Challenges and prospects[J].Bioresources and Bioprocessing, 2023, 10(1):21.
[9] LIN J W, JIANG G L, LIANG C X, et al.Laccase-induced gelation of sugar beet pectin-curcumin nano complexes enhanced by genipin crosslinking[J].Foods, 2023, 12(14):2771.
[10] PAN Y, LI X M, MENG R, et al.Investigation of the formation mechanism and curcumin bioaccessibility of emulsion gels based on sugar beet pectin and laccase catalysis[J].Journal of Agricultural and Food Chemistry, 2021, 69(8):2557-2563.
[11] 吕明泽. 改性PAN纳米纤维生长Fe3O4光热光催化性能研究[D].天津:天津工业大学, 2023.
LYU M Z.Study on photothermal photocatalytic properties of Fe3O4 for growth of modified PAN nanofibers[D].Tianjin:Tianjin University of Technology, 2023.
[12] TATARCZAK-MICHALEWSKA M, FLIEGER J.Application of high-performance liquid chromatography with diode array detection to simultaneous analysis of reference antioxidants and 1, 1-diphenyl-2-picrylhydrazyl (DPPH) in free radical scavenging test[J].International Journal of Environmental Research and Public Health, 2022, 19(14):8288.
[13] ALI S M, KHAN M R, KHAN R.Green synthesized AgNPs from Periploca hydaspidis Falc.and its biological activities[J].Microscopy Research and Technique, 2021, 84(10):2268-2285.
[14] 程伟贤, 陈鸿雁, 张义平, 等.迷迭香提取物抑菌作用研究[J].中国食品卫生杂志, 2006, 18(5):406-408.
CHENG W X, CHEN H Y, ZHANG Y P, et al.Study on bacteriostatic activity of rosemary[J].Chinese Journal of Food Hygiene, 2006, 18(5):406-408.
[15] 洪森辉, 杨秀雯, 黄晓雪, 等.蓝莓花色苷的酶法酰化修饰及其疏水性改善研究[J].食品工业科技, 2021, 42(19):78-83.
HONG S H, YANG X W, HUANG X X, et al.Improving the hydrophobicity of blueberry anthocyanins through enzymatic acylation modification[J].Science and Technology of Food Industry, 2021, 42(19):78-83.
[16] IBRAGIC S, BARBINI S, OBERLERCHNER J T, et al.Antioxidant properties and qualitative analysis of phenolic constituents in Ephedra spp.by HPTLC together with injection port derivatization GC-MS[J].Journal of Chromatography B, 2021, 1180:122877.
[17] SILVA S, OLIVEIRA A I, CRUZ A, et al.Physicochemical properties and antioxidant activity of Portuguese craft beers and raw materials[J].Molecules, 2022, 27(22):8007.
[18] SUMMPUNN P, PANPIPAT W, MANURAKCHINAKORN S, et al.Comparative analysis of antioxidant compounds and antioxidative properties of Thai indigenous rice:Effects of rice variety and processing condition[J].Molecules, 2022, 27(16):5180.
[19] ZHANG K, HAN M, ZHAO X, et al.Hypoglycemic and antioxidant properties of extracts and fractions from polygoni avicularis herba[J].Molecules, 2022, 27(11):3381.
[20] LI J Q, JIN X Q, JIAO Z, et al.Designing antibacterial materials through simulation and theory[J].Journal of Materials Chemistry.B, 2024, 12(37):9155-9172.
[21] LIU C H, CHUANG Y L, GURUNATHAN R, et al.Riverine antibacterial resistance gradient determined by environmental factors[J].Environmental Science and Pollution Research International, 2023, 30(18):53685-53701.
[22] THEURETZBACHER U, BARALDI E, CIABUSCHI F, et al.Challenges and shortcomings of antibacterial discovery projects[J].Clinical Microbiology and Infection, 2023, 29(5):610-615.
[23] WUSHOUER H, ZHOU Y, ZHANG W M, et al.Inpatient antibacterial use trends and patterns, China, 2013-2021[J].Bulletin of the World Health Organization, 2023, 101(4):248-261B.
[24] 陈萍. 功能化果胶的制备、性能及其对脆肉皖鱼保鲜效果研究[D].湛江:广东海洋大学, 2023.
CHEN P.Study on the preparation and properties of functionalized pectin and its effect on the preservation of crispy fish[D].Zhanjiang:Guangdong Ocean University, 2023.