腐败希瓦氏菌(Shewanella putrefaciens)是一种革兰氏阴性菌,是海洋陆源排污口的优势菌,也是冷藏鱼类等海鲜产品的主要腐败菌。该菌生长过程中能把氧化三甲胺(trimethylamine oxide,TMAO)还原为三甲胺(trimethylamine,TMA),产生挥发性硫,是硫化氢味或酸臭味的主要影响因素之一,从而影响食品品质和货架期。目前国内外关于S.putrefaciens的抑制研究报道有很多,HE等[1]研究发现,壳聚糖对S.putrefaciens生物被膜有抑制和清除作用。此外,复配保鲜剂如聚乳酸、茶多酚和肉桂醛复配对S.putrefaciens也有显著的抑制效果[2]。LI等[3]研究表明茶多酚对S.putrefaciens的抑菌和杀菌效果显著,其机理可能与胞外上清中Na+/K+-ATP酶和AKP酶活性上升有关,更多的研究致力于保证水产品安全。
苯乳酸(phenyl lactic acid,PLA)作为一种安全、稳定性好的新型天然小分子抑菌物质,能够抑制和杀死多种致病菌、腐败菌等微生物[4]。PLA被证实对食源性致病菌如铜绿假单胞菌[5-6]、大肠杆菌、单核细胞增生李斯特菌[7]、肠炎沙门氏菌和金黄色葡萄球菌[8]有很强的抑制作用。对PLA抑菌机理的探讨也有相关报道,宁亚维等[9]发现PLA多作用于细胞壁、细胞膜,通过改变细胞壁、膜的完整性和通透性,抑制胞内大分子合成及代谢,从而达到抑制效果,并构建了基于多糖代谢抑制的作用机理。宁亚维等[10]还研究发现将PLA与苯甲酸钠和山梨酸钾分别复配联用,对单核细胞增生李斯特菌和大肠杆菌的抑菌作用有所增强,然而对于具体的联合抑菌效应及机制尚不明确。关于将PLA应用于水产领域,并且复配联用于S.putrefaciens的抑制效果及其作用机制的相关报道较少。
肉桂醛(cinnamaldehyde,CIN),CNS号17.012,作为GB 2760—2024《食品安全国家标准 食品添加剂使用标准》批准使用的防腐剂,目前可应用于鲜水果表面,近年来的国内外研究发现CIN对多种细菌[11-13]和真菌[14]具有不同程度的抑制作用。HUANG等[11]研究发现,肉桂精油对S.putrefaciens有很好的抑菌效果。吕飞等[15]发现,γ射线联合肉桂精油对S.putrefaciens具有较好的抑制效果,并发现其抑菌机制可能是通过破坏细胞膜结构来抑制S.putrefaciens的生长。韩乾杰等[16]研究发现CIN与香兰素或丁酸钠复配联用时,对大肠杆菌、沙门氏菌、产气荚膜梭菌的抑菌效果优于单独使用,但并未探讨联合抑菌的作用机理。关于CIN对S.putrefaciens核酸作用和其他抑菌物质协同抑菌的研究还罕见报道。CIN还可作为香料用于水产品加工,因此本研究意在选择双功能的CIN与PLA复配联用,作为水产品加工的潜在应用防腐剂,探讨其对S.putrefaciens的协同抑菌机制。
1 材料与方法
1.1 材料与试剂
腐败希瓦氏菌(Shewanella putrefaciens SP22),由渤海大学食品科学与工程学院实验室赠予;苯乳酸、肉桂醛、碘化丙啶、小牛胸腺DNA(calf thymus DNA,ct-DNA),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
F-7000-FL 220荧光分光光度计,日本日立公司;激光共聚焦显微镜,日本奥林巴斯株式会社;DNM-9602G VarioskanFlashT多功能酶标仪,山东普朗新技术有限公司;蔡司SIGMA HD场发射扫描电子显微镜(scanning electron microscopy,SEM),德国卡尔蔡司公司;Nicolet iS5 FT-IR傅里叶变换红外光谱仪,美国赛默飞世尔有限公司。
1.3 实验方法
1.3.1 液体培养基的配制与菌种活化
称取0.5 g NaCl、1 g蛋白胨、0.3 g牛肉膏,溶于100 mL蒸馏水中,121 ℃灭菌15 min。作为液体培养基冷却备用。
接种环灼烧晾干后取斜面培养基菌落S.putrefaciens SP22,于液体培养基中,28 ℃下培养24 h,得到第一代菌液。取100 μL接种到50 mL液体培养基中,于28 ℃下培养8 h,获得第二代菌液对数期,将菌液与培养基混合,调整OD600到0.2,相当于菌浓度为1×108 CFU/mL,备用。
1.3.2 PLA、CIN对S. putrefaciens SP22最小抑菌浓度(minimum inhibitory concentration,MIC)的测定
MIC是指征物质对微生物抑制效果的最佳参数,测定方法参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)指南中描述的微量稀释方法。配制质量浓度分别为8、4、2和1 mg/mL的PLA溶液;质量浓度分别为2、1、0.5和0.25 μL/mL的CIN溶液。准备9个菌液浓度为108 CFU/mL,2 mL的菌悬液试管,每个试管依次添加上述实验浓度溶液2 mL,1∶1混匀。将上述空白对照组、实验组放入培养箱,28 ℃培养24 h。每组实验平行3次,观察菌液的透明度,拍照记录。并将CK组、实验组进行菌落计数,对MIC进行计数验证。
1.3.3 PLA-CIN复配液对S. putrefaciens SP22联合抑菌指数(fractional inhibitory concentration index,FICI)的测定
FICI是用于评估2种或2种以上抗菌物质的联合作用效果。根据FRATINI等[17]的研究方法稍作改善,制备1/4~8 MIC的PLA和CIN溶液备用。在96孔板上第1列、第12列、第1行和第8行加入200 μL蒸馏水。在第2~7列依次加入1/4~8 MIC的PLA。在第2~7行一次加入1/4~8 MIC的CIN。最后在每个孔洞中加入100 μL的108 CFU/mL菌悬液,以未加入抑菌剂的孔洞作为空白对照组。在28 ℃培养箱中培养12 h,观察透明度。判定条件见1.3.2节,计算如公式(1)~公式(3)所示。
FICI=FICCIN+FICPLA
(1)
(2)
(3)
式中:MICCIN,单一组分CIN的MIC,μL/mL;MICPLA,单一组分PLA的MIC,mg/mL;CCIN,CIN在组合中的有效浓度,μL/mL;CPLA,PLA在组合中的有效浓度,mg/mL;FICPLA和FICCIN分别代表PLA和CIN的部分抑菌浓度指数。
结果判定标准:当0 1.3.4 PLA-CIN复配液对S. putrefaciens SP22细胞表面结构的影响测定 取1.3.1节的菌液进行离心弃去上清液,使用PBS对菌体进行重悬,以调整菌液的最终浓度至108 CFU/mL。分成1~6组,每组10 mL菌液,1~3组添加等体积的PBS为空白对照组,4~6组加入等体积的2倍浓度的PLA-CIN复配液,混匀置于28 ℃下恒温培养4 h。培养结束后,取出菌悬液,4 000 r/min离心10 min收集菌体。使用PBS离心清洗菌体3次。在25 g/L戊二醛溶液中固定菌体12 h,然后再次离心并用PBS清洗3次。使用体积分数为 30%、50%、70%、90%、100%的乙醇溶液进行梯度脱水,每个浓度脱水2次,每次10 min。使用真空冷冻干燥器将标本干燥至完全无水状态。在标本表面喷涂一层金膜,以提高图像的对比度和分辨率。将样品放入扫描电镜中进行成像与分析。 1.3.5 PLA-CIN复配液对S. putrefaciens SP22 AKP活力的影响测定 依据AKP试剂盒使用说明,取1.3.1节中指示菌菌液与空白对照组、PLA-CIN复配液组等体积混合,在分别作用0、3、6、9 h后取样,超声破碎菌体,4 ℃、4 000 r/min离心10 min,取上清液,采用紫外分光光度计测定520 nm下的吸光度,测定AKP活力。 1.3.6 PLA-CIN复配液对S. putrefaciens SP22细胞膜完整性的影响测定 参考ZHONG等[18]方法,分别取1 mL 1.3.1节中二代菌液置于6个2 mL离心管中,编号1~6;1~3为空白对照组,加入等体积的培养基,4~6中分别加入等体积2倍浓度的PLA-CIN复配液。混匀后置于28 ℃恒温培养箱培养1 h,1~6组中加入PI(10 μL/mL)在4 ℃下低温沾染20 min,将1~6号离心管4 000 r/min离心10 min,弃去上清液,离心清洗2次,溶于200 μL PBS中。最后吸取10 μL试验菌液于载玻片上,室温半干后盖上载玻片,置于激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)下观察,分别得到白光、phase-contrast、546 nm激发下的图像。 1.3.7 PLA-CIN复配液对S. putrefaciens SP22细胞膜结构的影响测定 取1.3.1节的菌液加入PLA-CIN复配液培养24 h,以PBS作为对照,4 000 r/min离心10 min收集菌体。用25 g/L戊二醛溶液在4 ℃下固定菌体12 h。使用体积分数为 30%、50%、70%、90%、100%的乙醇溶液进行梯度脱水,每个浓度脱水2次,每次10 min。使用真空冷冻干燥器将标本干燥至完全无水状态。将样品与KBr粉末混合均匀压制成透明薄片,使用红外光谱仪在3 500~500 cm-1波数下,4 cm-1最高分辨率下扫描32次,测定透过率。 1.3.8 PLA-CIN复配液对体外核酸(ct-DNA)相互作用的测定 制备ct-DNA(128 μmol/L)溶液6组,1~3组加入等体积PBS,4~6组与2倍FICI浓度的PLA-CIN复配液等体积混合,吹打混匀,在37 ℃下作用30 min,采用荧光光谱仪,测定激发波长180 nm,发射波长200~600 nm处的荧光光谱。 制备ct-DNA(128 μmol/L)溶液1~12组,1~6组制备KI终浓度分别为0、0.002、0.004、0.006、0.008、0.01 mol/L,制备2倍FICI浓度的PLA-CIN复配液1~6组,实验组将其1∶1∶1(体积比)混合,7~12空白对照组加入等体积PBS,平行3次实验;充分混合5 min后,在37 ℃下作用30 min,测定荧光光谱仪激发波长180 nm处,发射波长200~600 nm的荧光光谱。 1.3.9 数据统计与分析 所有数据均以“平均数±标准差”及方差分析表示。每个参数的测量重复3次。通过SPSS 26软件用单因素方差分析(one-way analysis of variance,ANOVA)进行显著性差异分析,置信水平为P<0.05。用Origin 2021软件进行数据处理和图表绘制。 如图1所示,采用液体培养法[19]测定MIC,通过观察透明度分界线,透明度越低,抑制效果越差,MIC即介于透明与浑浊的临界点处。当混合后的PLA质量浓度低于2 mg/mL、CIN质量浓度低于0.5 μL/mL时,试管开始浑浊,高于该浓度时,试管呈澄清状态;平板涂布在上述浓度下,指示菌未见生长,与液体培养法结果一致,结果表明PLA的MIC为2 mg/mL;CIN的MIC为0.5 μL/mL。PLA与CIN单独作用于指示菌,表现良好的抑菌效果,是复配联用研究的前提。 a-苯乳酸组;b-肉桂醛组 图1 苯乳酸和肉桂醛的MIC的测定 Fig.1 MIC determination of phenyllactic acid and cinnamaldehyde 采用微量棋盘法[20],观察PLA-CIN的联合抑菌作用,结果见表1,低于1/4 MIC浓度的组合表现出无关作用,1/2 MIC+1/4 MIC组合与1/4 MIC+1/2 MIC组合表现出相加作用,同时MIC+MIC也表现相加作用,并未形成协同作用,这说明在高浓度混合时,PLA提供的酸性条件催化醛基与醛基发生醛缩合反应,产生β-羟醛,消耗醛基与氢质子,降低了抑菌效果,本实验综合成本与效果考虑,选择1/2 MIC(PLA)+1/4 MIC(CIN)为最佳联合抑菌浓度,简称PLA-CIN复配液,以便探讨该浓度对指示菌的抑菌机制。目前联合抑菌能够降本增效,是保鲜防腐的研究热点,计晴阳等[21]探究多种有机酸联合效果结果表明3种酸的联合效果强于2种有机酸联合效果,苯乳酸也属于小分子有机酸,与肉桂醛联合抑菌,表现相加作用,进而深入探讨抑菌机制,具有深入探讨价值。 表1 PLA-CIN复配液对S. putrefaciens SP22的FICI Table 1 FICI of PLA-CIN complex solution on S. putrefaciens SP22 抑菌物质及单用MICPLA-CIN中PLA浓度PLA-CIN中CIN浓度FICI相互关系PLA (2 mg/mL);CIN (0.5 μL/mL)1/8 MIC1/8 MIC—无关1/8 MIC1/4 MIC—无关1/4 MIC1/8 MIC—无关1/4 MIC1/4 MIC—无关1/4 MIC1/2 MIC0.75相加1/2 MIC1/4 MIC0.75相加1/2 MIC1/2 MIC1相加 注:—代表无。 扫描电镜观察经PLA-CIN复配液处理4 h后,对指示菌细胞结构的影响。结果如图2-a所示,用生理盐水处理的空白对照组,S. putrefaciens SP22菌体形态饱满且完好,表面光滑,菌体独立无黏连。由图2-b、图2-c可以看出,PLA-CIN复配组菌体呈现出表面粗糙、凹陷的外观,样品表面出现明显孔洞且内容物大量流出,菌体断裂严重;由图2-d可以看出,经PLA-CIN复配液处理过后的菌体相互连接、聚集,形成了不同程度的黏连结构。结合2.4节、2.6节结果,说明细胞壁作为PLA-CIN的结合位点,首先发生完整性破坏,伴随细胞膜完整性破坏,内容物在渗透压作用下外泄,同时荧光标记物进入菌体,完成标记(2.5节中结论),实现抑菌目的,从细胞结构层面证实细胞壁作为作用位点的抑菌作用机制。 a-空白组;b-PLA-CIN复配组;c-PLA-CIN复配组;d-PLA-CIN复配组 图2 S. putrefaciens SP22扫描电镜图 Fig.2 SEM of S. putrefaciens SP22 AKP酶是一种胞内酶,存在于细胞壁与细胞膜之间,正常情况下不会在细胞外分泌。然而当细胞壁受损时,AKP会流出,导致细胞外AKP酶活力增加[22]。本研究通过测定PLA-CIN复配液对细胞外AKP酶活力的影响,分析其对指示菌细胞壁完整性的作用效果。如图3所示,随着处理时间的延长,S.putrefaciens SP22体外AKP酶活力随之增强。培养至3 h,处理组AKP活力高于对照组,且具有显著性差异(P<0.05);培养9 h后,对照组AKP活力仍处于一个较低水平,PLA-CIN复配液处理组的AKP活力是对照组的11.13倍,显著高于对照组;12 h后,PLA-CIN复配液处理组的AKP活力趋于稳定。结果表明细胞壁的完整性遭到破坏,推测作用机制是PLA的苯环扁平结构增强侧链羧基的键能、CIN结构中双键与醛基相连,增强醛基的键能,两者同时存在(酸性环境)首先与细胞壁脂多糖层作用,暴露细胞壁中的肽聚糖,而后破坏N-乙酰葡萄糖胺(N-acetylglucosamine,NAG)与乙酰胞壁酸(N-acetylmuramic acid,NAM)之间的β-1,4糖苷键,导致细胞壁裂解而醛基能与水解后产生的N-乙酰葡萄糖胺中的羟基与醛基迅速缩合,生成酮基,而影响细胞壁的完整性,结合2.3节中SEM结果,细胞壁的孔洞与断裂,相互印证。细胞壁的结构与PLA-CIN复配后的分子结构具有结合的可行性,作用位点主要存在于糖苷键,这与溶菌酶的抑菌机制相似[23]。 图3 对腐败希瓦氏菌AKP泄露的影响 Fig.3 Influence on AKP leakage of S. putrefaciens SP22 碘化丙啶(propidium iodide,PI)是一种常见荧光标定素,它不能进入细胞膜完整的细胞内,当细胞膜受到一定程度损伤后,PI可通过缺损的细胞膜渗入细胞,与细胞内的DNA结合在特定激发波长(546 nm)下发出红色荧光[24]。PLA-CIN复配液处理后,如图4,暗场可观察到一定比例的红色菌体形态,表明细胞膜的完整性被破坏,对照组TritionX-100处理后菌体红色荧光沾染率明显高于PLA-CIN组和空白对照组,这与宁亚维等[9]研究一致。即细胞膜成为PLA-CIN复配液抑菌作用位点之一,结合2.6节的结果,膜蛋白及肽聚糖结构改变,达到抑制指示菌正常生理代谢功能,起到防腐抑菌作用。 a-明场下空白对照组;b-明场下TritionX-100组;c-明场下PLA-CIN组;d-暗场下空白对照组;e-暗场下TritionX-100组;f-暗场下PLA-CIN组 图4 苯乳酸-肉桂醛复配处理腐败希瓦氏菌激光共聚焦显微镜图 Fig.4 Confocal laser microscopy of the treatment of S. putrefaciens SP22 by the combination of phenyllactate and cinnamaldehyde 通过分析微生物在抑菌剂作用前后的红外光谱变化,可了解抑菌剂对微生物细胞结构的影响。由图5可以看出,1 077.66~1 539.37 cm-1有多个吸收峰,这部分吸收峰的变化可归因于磷脂中P—O的伸缩振动、肽聚糖中C—O—C和氨基酸和脂肪酸链羧酸酯基团C 图5 对腐败希瓦氏菌细胞膜成分的影响 Fig.5 Effect on cell membrane components of S. putrefaciens SP22 由6-a可以看出,ct-DNA在305 nm处存在荧光发射峰,在与不同浓度PLA-CIN复配液混合后,浓度为1/2 MIC PLA+1/4 MIC CIN的PLA-CIN复配液,荧光强度由255.5降低至46.96,发生荧光猝灭效应的效果最为明显。KI作为一种阴离子猝灭剂,在DNA存在的情况下对荧光分子的猝灭作用会受到影响。这是由于DNA磷酸主链的负电荷会排斥碘离子等带负电荷的分子,同时双链DNA可以在一定程度上保护与其结合的小分子免受猝灭剂的影响。然而,如果小分子与DNA通过静电或沟槽作用结合,它们就不会受到DNA双螺旋结构的保护,因此会受到阴离子猝灭剂的影响[27]。根据Stern-Volmer方程F0/F=1+Ksv[Q](其中[Q]为猝灭剂碘化钾的浓度),Ksv值即Stern-Volmer猝灭常数,可以用于证明与DNA的结合方式,反映了荧光物质与DNA相互作用时荧光猝灭程度。通过对散点图进行线性拟合得到直线方程,在直线方程的斜率即为Ksv值。由图6-b中看出,PLA-CIN复配液与ct-DNA结合组的斜率与游离PLA-CIN复配液组的斜率即Ksv值相差不大,分别为3.11和3.26,说明PLA-CIN与ct-DNA结合后,依旧受到了KI的猝灭,结合方式表现为沟槽结合。 a-荧光光谱图;b-Stern-Volmer拟合曲线 图6 苯乳酸-肉桂醛复配液与ct-DNA相互作用后的荧光光谱图与Stern-Volmer拟合曲线 Fig.6 The fluorescence spectra of the mixture of phenyllactate and cinnamaldehyde after interaction with ct-DNA were fitted with Stern-Volmer curve 纵坐标方向F0/F值有差距,这是由于ct-DNA的双螺旋结构虽然并未保护PLA-CIN复配液免受阴离子猝灭剂的猝灭,但通过静电与疏水作用影响了荧光强度的变化。根据上述结果推测出,PLA和CIN可以通过与DNA结合,从而影响DNA复制、转录等一系列过程,达到抑菌目的。 本研究通过PLA-CIN复配液与S. putrefaciens SP22指示菌相互作用,探求其防腐保鲜效果,结果表明PLA对S. putrefaciens SP22的MIC为2 mg/mL;CIN对S. putrefaciens SP22的MIC为0.5 μL/mL;1 mg/mL PLA与0.125 μL/mL CIN复配处理对S. putrefaciens SP22具有相加抑菌作用,使PLA和CIN的使用量分别降低了50%和75%,苯乳酸和肉桂醛在使用时可同时发挥抑菌、风味调节和降低单一抑菌剂用量的作用。目前关于苯乳酸和肉桂醛单一抑菌的报道较多,抑菌机制主要集中在细胞壁、细胞膜等靶位[5,7,9,11]。对于腐败希瓦氏菌的抑菌研究,大多停留在化学合成抑菌剂的研究,多种天然生物活性物质联合使用的抑菌研究鲜有报道。本研究通过扫描电镜、测定胞外AKP酶活力、激光共聚焦显微镜观察和傅里叶红外光谱绘制一系列实验,构建了以细胞壁膜为靶点的协同抑菌机制研究思路。通过荧光光谱实验,确定了PLA-CIN复配液与ct-DNA的结合模式,说明了PLA-CIN复配液能与DNA结合,进而可能影响DNA的复制和转录。如图7所示,本研究发现PLA-CIN复配液通过破坏细胞壁上的脂多糖、蛋白质和肽聚糖,破坏了S. putrefaciens SP22细胞壁、细胞膜的完整性,增加细胞膜的通透性,导致菌体形态破裂,内容物AKP外泄,进入细胞后与DNA发生相互作用,从而扰乱细胞的正常生理代谢活动。证实PLA-CIN以S. putrefaciens SP22细胞壁、细胞膜和DNA为作用位点的抑菌机制。 图7 作用机制图 Fig.7 Mechanism of action 苯乳酸作为安全高效的新型天然有机酸小分子的抑菌物质,随着社会对食品保鲜和抗菌领域研究的不断深入,苯乳酸与其他抑菌物质协同作用的研究具有科研价值水产领域一直是国民经济支柱之一,然而多年来困扰于保质期短、鱼腥味重等问题,制约发展。一方面,可以进一步拓展协同作用的抑菌物质种类。不仅仅局限于目前常见的天然抑菌剂或化学合成抑菌剂,还可以探索与新型生物活性物质或物理法的协同效应,如具有独特抗菌机制的多肽类、酶类物质等,以期发现更高效、更广泛的抗菌组合。未来也将进一步通过分子生物学、生物化学、代谢组学等多学科交叉的方法,揭示苯乳酸与其他抑菌物质在分子水平上的相互作用方式,如对细菌细胞膜结构和功能的影响、对细菌代谢途径的干扰等,为合理设计协同抗菌体系提供理论依据。 [1] HE M, GUO Q Y, SONG W, et al.Inhibitory effects of chitosan combined with nisin on Shewanella spp.isolated from Pseudosciaena crocea[J].Food Control, 2017, 79:349-355. [2] HAN Y, DING J, ZHANG J T, et al.Fabrication and characterization of polylactic acid coaxial antibacterial nanofibers embedded with cinnamaldehyde/tea polyphenol with food packaging potential[J].International Journal of Biological Macromolecules, 2021, 184:739-749. [3] LI Y, LEI Y T, TAN Y Q, et al.Efficacy of freeze-chilled storage combined with tea polyphenol for controlling melanosis, quality deterioration, and spoilage bacterial growth of Pacific white shrimp (Litopenaeus vannamei)[J].Food Chemistry, 2022, 370:130924. [4] 贾以泽, 舒泉先, 丛瑞涛, 等.苯乳酸与DNA相互作用及其抑菌机制研究[J].食品与发酵工业, 2024, 50(5):67-75. [5] CHATTERJEE M, D’MORRIS S, PAUL V, et al.Mechanistic understanding of phenyllactic acid mediated inhibition of quorum sensing and biofilm development in Pseudomonas aeruginosa[J].Applied Microbiology and Biotechnology, 2017, 101(22):8223-8236. [6] SHARIFF M, CHATTERJEE M, MORRIS S D, et al.Enhanced inhibition of Pseudomonas aeruginosa virulence factor production and biofilm development by sublethal concentrations of eugenol and phenyllactic acid[J].Letters in Applied Microbiology, 2022, 75(5):1336-1345. [7] NING Y W, YAN A H, YANG K, et al.Antibacterial activity of phenyllactic acid against Listeria monocytogenes and Escherichia coli by dual mechanisms[J].Food Chemistry, 2017, 228:533-540. [8] ZHANG J J, WANG D B, SUN J Y, et al.Synergistic antibiofilm effects of ultrasound and phenyllactic acid against Staphylococcus aureus and Salmonella enteritidis[J].Foods, 2021, 10(9):2171. [9] 宁亚维, 侯琳琳, 李明蕊, 等.苯乳酸对荧光假单胞菌基于细胞膜损伤和DNA破坏的双靶位抑菌机制[J].食品科学, 2021, 42(7):60-67. [10] 宁亚维, 闫爱红, 王世杰, 等.苯乳酸与食品防腐剂联合抑菌效果[J].食品与机械, 2017, 33(9):117-120. [11] HUANG Z, LIU X C, JIA S L, et al.Antimicrobial effects of cinnamon bark oil on microbial composition and quality of grass carp (Ctenopharyngodon idellus) fillets during chilled storage[J].Food Control, 2017, 82:316-324. [12] SILVA E SILVA FIGUEIREDO C S, DE OLIVEIRA P V, DOS REIS FERREIRA L, et al.Cinnamaldehyde for the treatment of microbial infections:Evidence obtained from experimental models[J].Current Medicinal Chemistry, 2023, 30(31):3506-3526. [13] PANG D R, HUANG Z X, LI Q, et al.Antibacterial mechanism of cinnamaldehyde:Modulation of biosynthesis of phosphatidylethanolamine and phosphatidylglycerol in Staphylococcus aureus and Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2021, 69(45):13628-13636. [14] SHREAZ S, WANI W A, BEHBEHANI J M, et al.Cinnamaldehyde and its derivatives, a novel class of antifungal agents[J].Fitoterapia, 2016, 112:116-131. [15] 吕飞, 徐静, 魏倩倩, 等.γ射线联合肉桂精油对腐败希瓦氏菌的抑制机制[J].食品科学, 2017, 38(17):14-19. [16] 韩乾杰, 张玲玲, 陈敏, 等.植物精油与丁酸钠的体外协同抑菌效果研究[J].动物营养学报, 2017, 29(2):712-718. [17] FRATINI F, MANCINI S, TURCHI B, et al.A novel interpretation of the fractional inhibitory concentration index:The case Origanum vulgare L.and Leptospermum scoparium J.R.et G.forst essential oils against Staphylococcus aureus strains[J].Microbiological Research, 2017, 195:11-17. [18] ZHONG C, ZHU Y W, ZHU N Y, et al.Synthesis and anti-pseudomonal activity of new β-Ala modified analogues of the antimicrobial peptide anoplin[J].International Journal of Medical Microbiology, 2020, 310(5):151433. [19] MILLER R A, WALKER R D, CARSON J, et al.Standardization of a broth microdilution susceptibility testing method to determine minimum inhibitory concentrations of aquatic bacteria[J].Diseases of Aquatic Organisms, 2005, 64(3):211-222. [20] KONATÉ K, MAVOUNGOU J F, LEPENGUÉ A N, et al.Antibacterial activity against β-lactamase producing methicillin and ampicillin-resistants Staphylococcus aureus:Fractional inhibitory concentration index (FICI) determination[J].Annals of Clinical Microbiology and Antimicrobials, 2012, 11:18. [21] 计晴阳, 王文琼, 钱易, 等.不同有机酸联用对大肠杆菌的抑制作用[J].食品与发酵工业, 2024, 50(8):42-47. [22] DIAO M M, QI D P, XU M M, et al.Antibacterial activity and mechanism of monolauroyl-galactosylglycerol against Bacillus cereus[J].Food Control, 2018, 85:339-344. [23] DAI P C, LI Q.Research progress in the application of lysozyme in food and medicine field[J].E3S Web of Conferences, 2021, 251:02048. [24] WU Y P, BAI J R, ZHONG K, et al.A dual antibacterial mechanism involved in membrane disruption and DNA binding of 2R, 3R-dihydromyricetin from pine needles of Cedrus deodara against Staphylococcus aureus[J].Food Chemistry, 2017, 218:463-470. [25] 谷恒梅, 马鑫敏, 赵宇, 等.副干酪乳杆菌Z17-壳聚糖复配对大肠杆菌O157:H7的抑菌效果及作用机制[J].食品科学, 2022, 43(23):57-62. [26] 赵雪梅, 伍时华, 龙秀锋, 等.丁香醛对酿酒酵母乙醇发酵过程和理化特性的影响[J].食品与发酵工业, 2022, 48(16):188-195. [27] REHMAN S U, SARWAR T, HUSAIN M A, et al.Studying non-covalent drug-DNA interactions[J].Archives of Biochemistry and Biophysics, 2015, 576:49-60.2 结果与分析
2.1 液体培养法测定PLA、CIN对S. putrefaciens SP22的MIC

2.2 PLA-CIN对S. putrefaciens SP22的联合抑菌作用
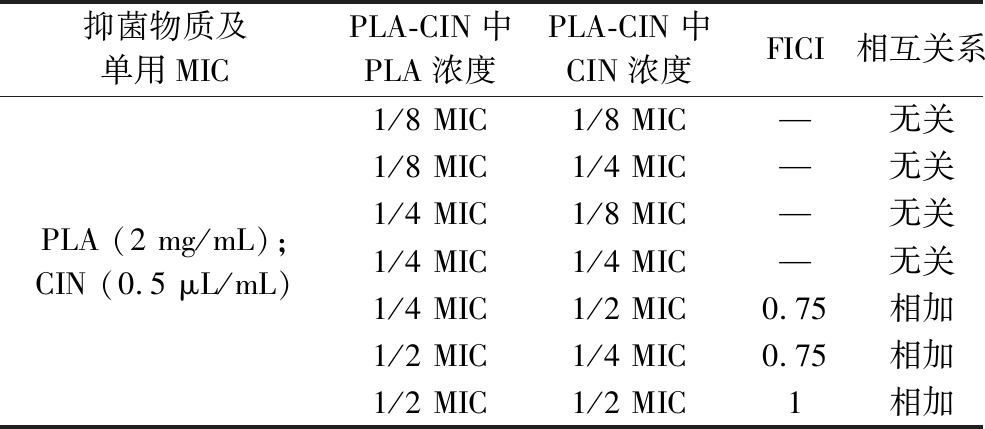
2.3 PLA-CIN复配液对S. putrefaciens SP22细胞表面结构的影响
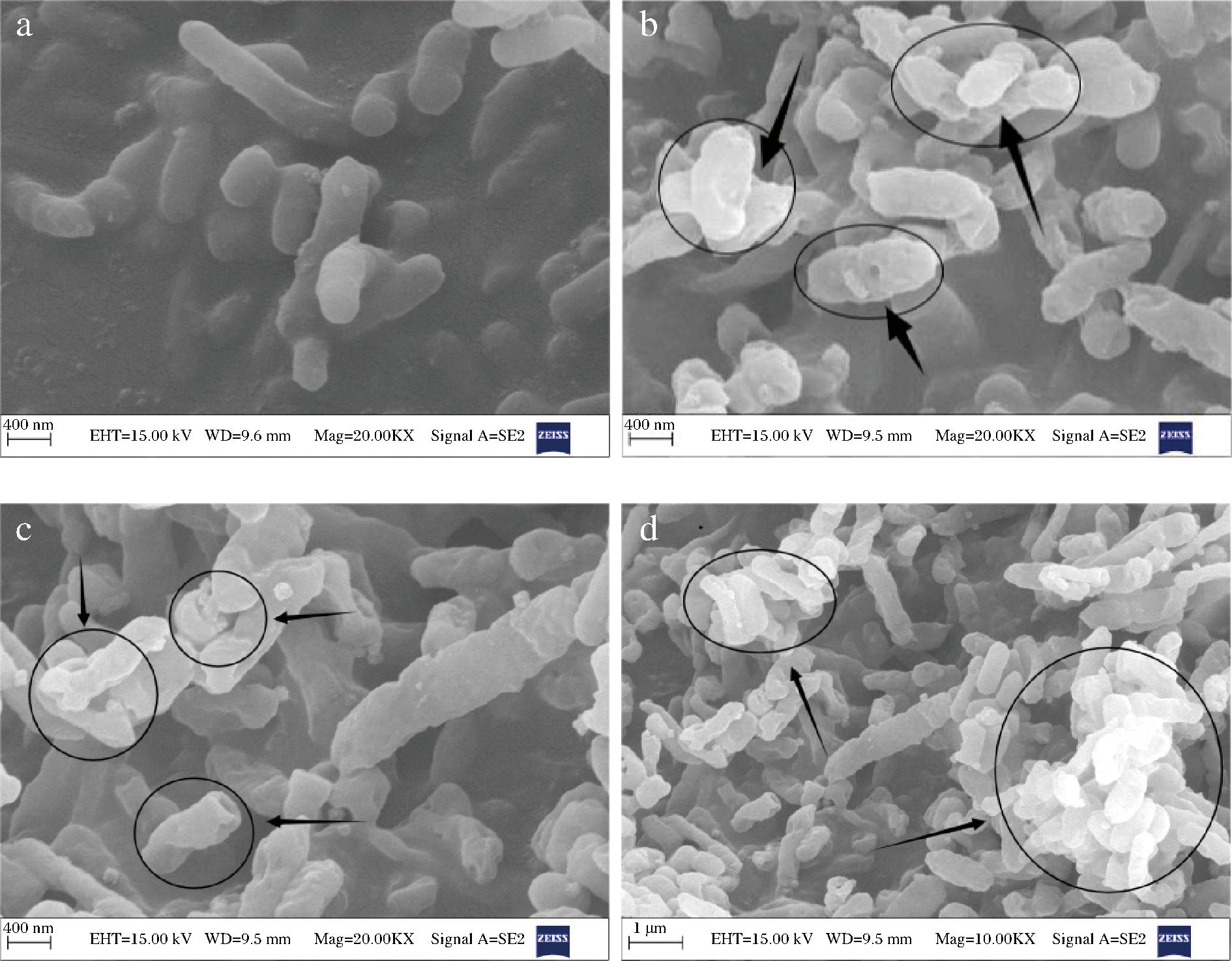
2.4 PLA-CIN复配液对S. putrefaciens SP22 AKP酶活力的影响
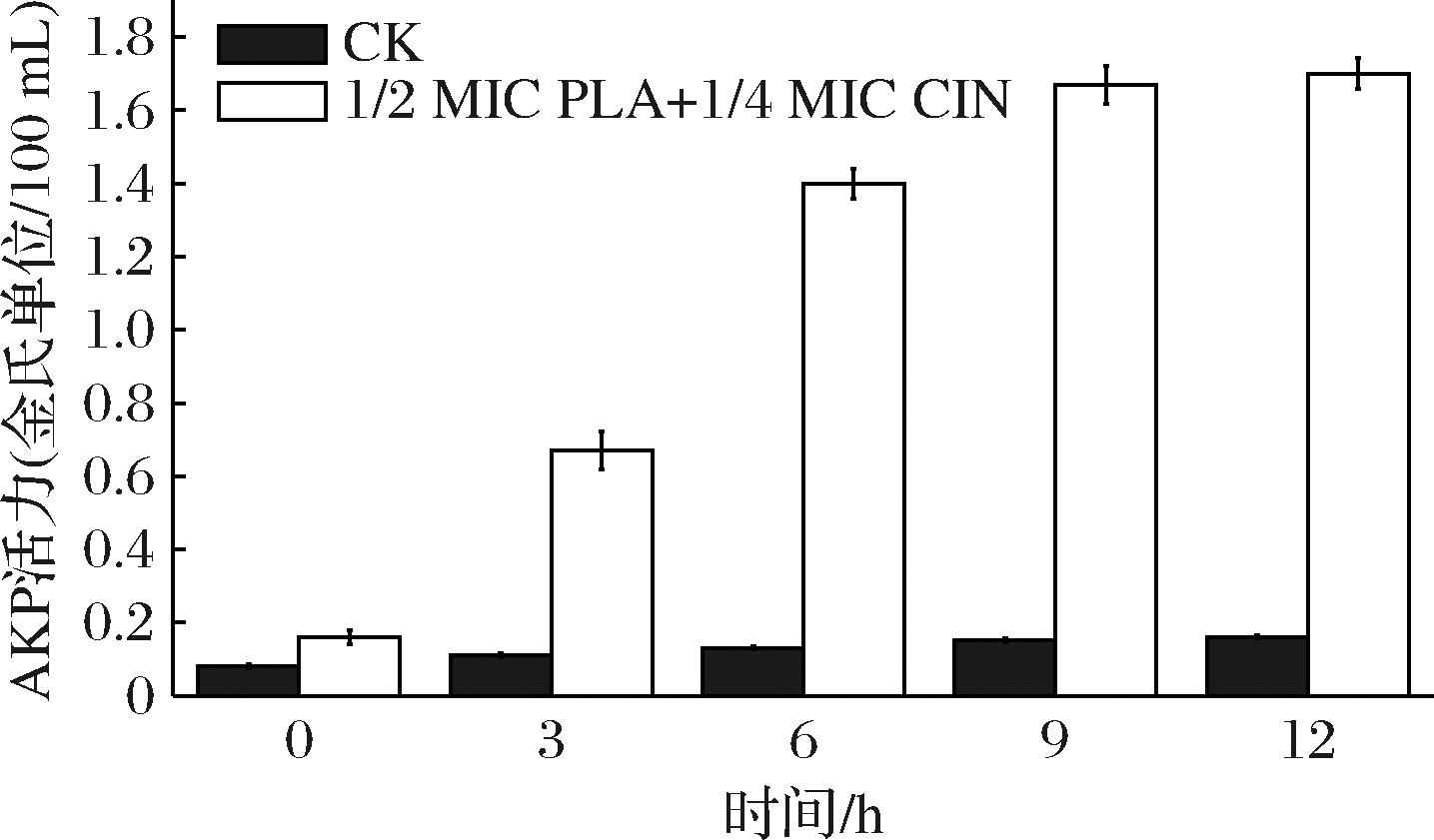
2.5 PLA-CIN复配液对S. putrefaciens SP22细胞膜完整性的影响
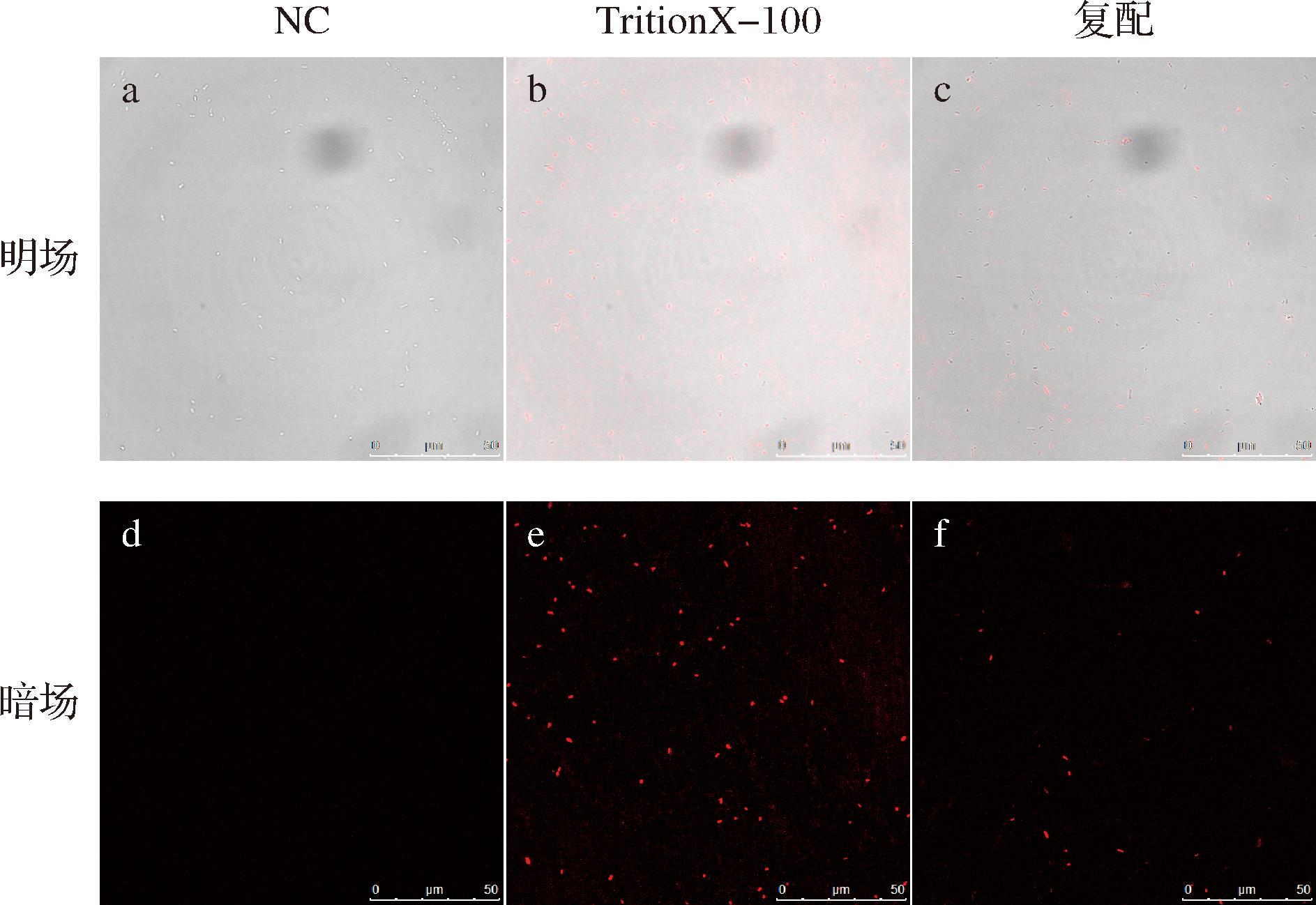
2.6 PLA-CIN复配液对S. putrefaciens SP22细胞膜结构的影响
![]() O键的伸缩振动,经PLA-CIN处理后,吸收峰强度增强,这表明PLA-CIN破坏了S.putrefaciens SP22细胞壁上的磷脂、肽聚糖和蛋白质;2 800~3 000 cm-1附近吸收峰的变化可归因于脂肪酸和酯类中C—H的伸缩振动[25],PLA-CIN处理组此基团的吸收峰位置发生偏移,由2 926.63 cm-1红移至2 915.89 cm-1,表明脂肪酸和酯类中的C—H振动频率降低,化学键强度减弱;3 500~3 000 cm-1有一个强而宽的吸收峰,这是基团N—H变形振动和分子内或分子间氢键O—H伸缩振动产生的,经PLA-CIN处理后,3 306.72 cm-1处的强宽峰蓝移至3 317.46 cm-1,说明S.putrefaciens SP22细胞膜上的多糖、脂肪酸及蛋白质的O—H和N—H振动频率增高,表明基团相互作用减弱或者被破坏[26];综上所述,可以证明PLA-CIN复配处理,首先破坏了S.putrefaciens SP22细胞壁最外侧的脂多糖,其次进一步破坏了内侧的脂蛋白、磷脂双分子层和肽聚糖层。
O键的伸缩振动,经PLA-CIN处理后,吸收峰强度增强,这表明PLA-CIN破坏了S.putrefaciens SP22细胞壁上的磷脂、肽聚糖和蛋白质;2 800~3 000 cm-1附近吸收峰的变化可归因于脂肪酸和酯类中C—H的伸缩振动[25],PLA-CIN处理组此基团的吸收峰位置发生偏移,由2 926.63 cm-1红移至2 915.89 cm-1,表明脂肪酸和酯类中的C—H振动频率降低,化学键强度减弱;3 500~3 000 cm-1有一个强而宽的吸收峰,这是基团N—H变形振动和分子内或分子间氢键O—H伸缩振动产生的,经PLA-CIN处理后,3 306.72 cm-1处的强宽峰蓝移至3 317.46 cm-1,说明S.putrefaciens SP22细胞膜上的多糖、脂肪酸及蛋白质的O—H和N—H振动频率增高,表明基团相互作用减弱或者被破坏[26];综上所述,可以证明PLA-CIN复配处理,首先破坏了S.putrefaciens SP22细胞壁最外侧的脂多糖,其次进一步破坏了内侧的脂蛋白、磷脂双分子层和肽聚糖层。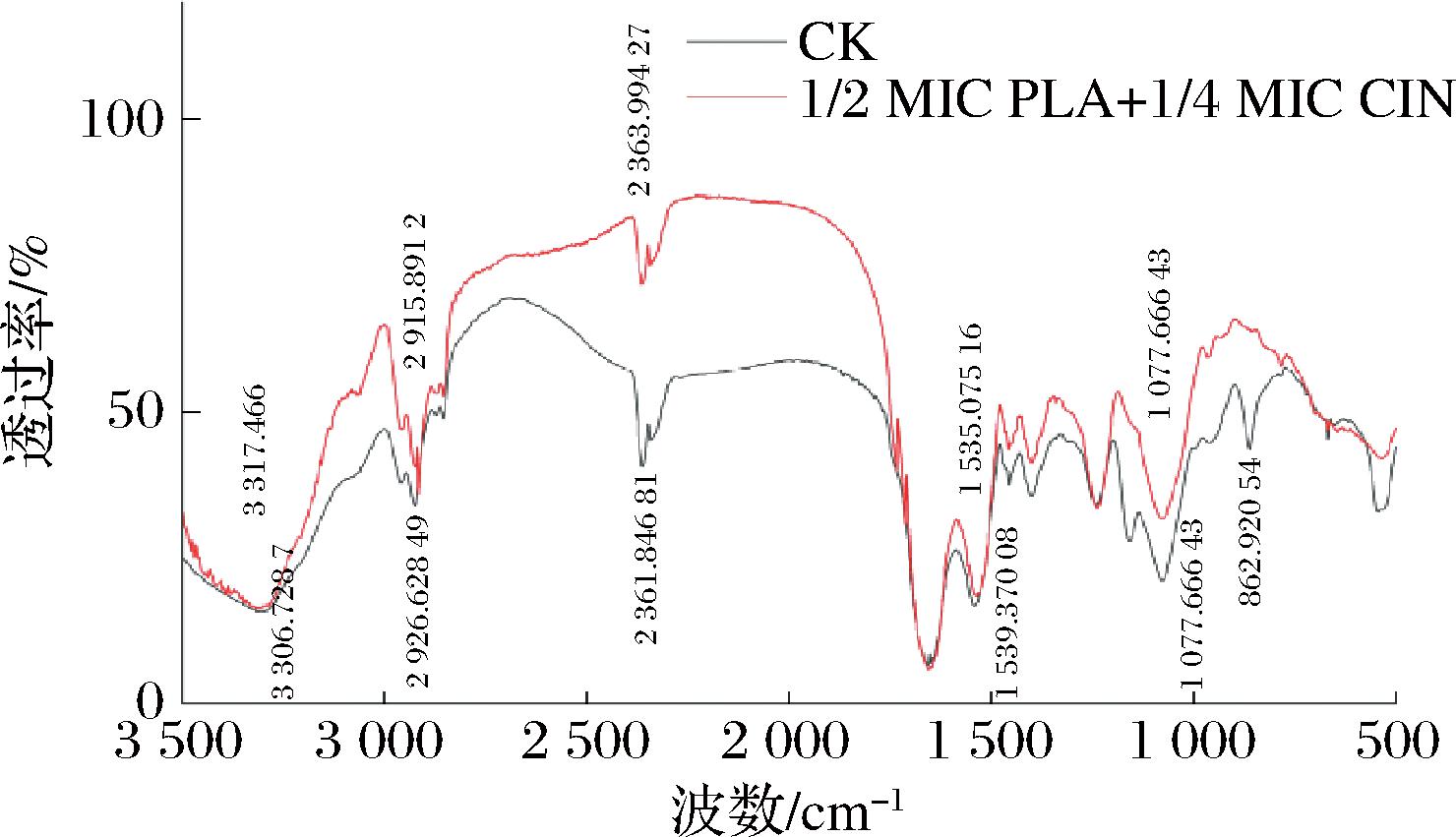
2.7 PLA-CIN复配液与ct-DNA的体外相互作用机制
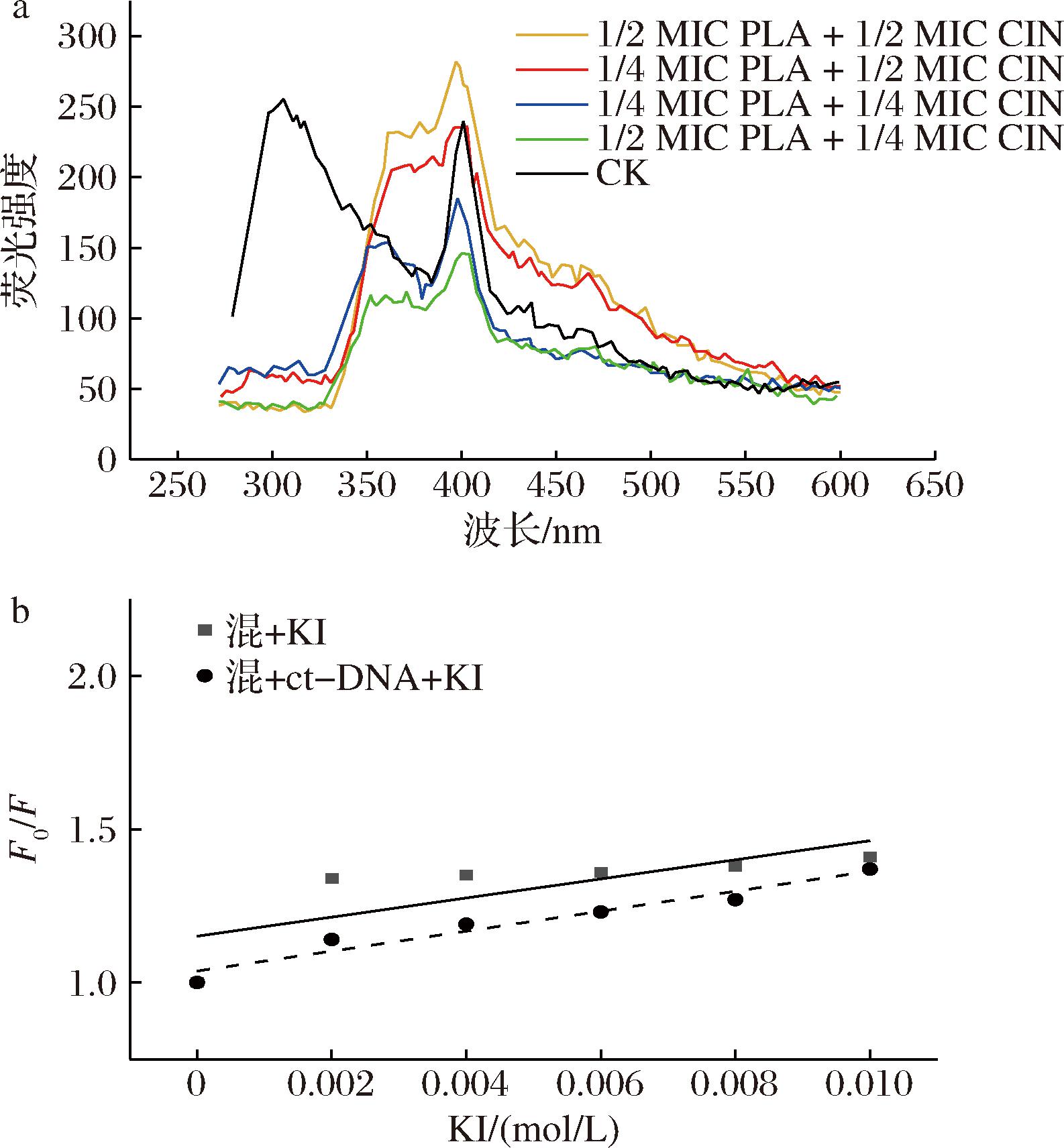
3 结论与讨论

JIA Y Z, SHU Q X, CONG R T, et al.Interaction between phenyllactic acid and DNA and its antibacterial mechanism[J].Food and Fermentation Industries, 2024, 50(5):67-75.
NING Y W, HOU L L, LI M R, et al.Dual-target antibacterial mechanism of phenyllactic acid against Pseudomonas fluorescens based on cell membrane and DNA damage[J].Food Science, 2021, 42(7):60-67.
NING Y W, YAN A H, WANG S J, et al.Study on antibacterial activity of phenyllactic acid combined with food preservatives[J].Food &Machinery, 2017, 33(9):117-120.
LYU F, XU J, WEI Q Q, et al.Antimicrobial mechanism of combination of γ irradiation and cinnamon essential oil against Shewanella putrefaciens[J].Food Science, 2017, 38(17):14-19.
HAN Q J, ZHANG L L, CHEN M, et al.Synergistic bacteriostatic effect of plant essential oils and sodium butyrate in vitro[J].Chinese Journal of Animal Nutrition, 2017, 29(2):712-718.
JI Q Y, WANG W Q, QIAN Y, et al.Inhibitory of different organic acid combinations against Escherichia coli[J].Food and Fermentation Industries, 2024, 50(8):42-47.
GU H M, MA X M, ZHAO Y, et al.Antibacterial effect and mechanism of mixture of culture supernatant of Lactobacillus paracasei Z17 with chitosan against Escherichia coli O157:H7[J].Food Science, 2022, 43(23):57-62.
ZHAO X M, WU S H, LONG X F, et al.Effects of syringaldehyde on ethanol fermentation and physicochemical properties of Saccharomyces cerevisiae[J].Food and Fermentation Industries, 2022, 48(16):188-195.