自2020年以来,中国预制菜发展迅猛[1],《2024年水产预制菜产业发展白皮书》(红餐产业研究院发布)中指出:2024年预制菜市场规模或超5 600亿元,其中位居第二位的水产预制菜销售额占总量的27.6%,相较2023年的27%增长2.2%;结合生产端、消费端的时代特点,珠海、广东、江苏、舟山、滨州、福州、烟台等沿海城市的水产预制产业也在迅速发展[2],带动水产经济的同时,引发水产预制菜的质量监管与控制风险,因此水产安全与保鲜技术随之受到重视。在水产加工、运输、贮存中的内源和外源性腐败菌严重威胁水产品的质量与安全,毛青秀等[3]研究表明将鲜活甲鱼切块,分装并加入热汤料封罐后样品中假单胞菌属、嗜冷杆菌属相对丰度明显增加。荧光假单胞菌(Pseudomonas fluorescens)是一种广泛存在于海水鱼类的革兰氏阴性腐败菌之一,由于其具有很强的低温适应性,分泌的蛋白酶、脂肪酶等导致低温冷链运输环境的水产品腐败变质,能够把氧化三甲胺还原为三甲胺,产生挥发性硫,是硫化氢味或酸臭味的主要原因之一。
GB 2760—2024《食品安全国家标准 食品添加剂使用标准》中,ε-聚赖氨酸(ε-polylysine,ε-PL)、ε-聚赖氨酸盐酸盐(ε-poly-L-lysine hydrochloride,ε-PLH)作为防腐剂被广泛应用于焙烤、熟肉、杂粮、饮料等制品当中,对各种细菌、真菌及部分病原体等有广谱抑菌效果[4],同时LIU等[5]研究表明ε-PL的阳离子会增强抗菌活性。近年来发现ε-PL与其他防腐剂复配效果有明显增强作用[6],ε-PL的加入降低了溶液的黏度[7]。壳聚糖(chitosan,CS)是甲壳素的脱乙酰产物,在酸性条件下,其抗菌性能更为显著[8]。在CS中加入ε-PL可以提高CS的抗菌能力或影响CS的理化性质[9]。目前对CS的抑菌性能研究已有数篇报道,王雪芹等[10]研究发现CS与抗菌肽复配使用对安康鱼具有延长保鲜的作用,当CS1号为质量浓度为0.716 mg/mL,2号为0.389 mg/mL,可延长货架期5 d;LI等[11]研究CS-庆大霉素偶联物对弧菌的抑菌效果时发现,50 mg/kg能够起到良好的抑菌效果,减少肠道功能障碍。连欢等[12]研究CS、阿拉伯胶及植物精油复配使用可延长蓝莓的贮藏期至20 d。尽管CS本身具有较好的抗菌特性,但成分单一的CS包装膜存在力学性能差、耐水性差,抗菌谱窄等不足[13]。将CS与其他类型的防腐剂结合使用,可以形成复合型保鲜剂,从而发挥出协同抗菌作用[14]。
本文研究ε-PL-CS复合保鲜液对P.fluorescens PF08抑菌活性,通过观察酶类、核酸等大分子的作用变化、体外壁、膜的通透性与完整性变化,探究ε-PL-CS复合保鲜液体外协同作用,以期为水产品预制菜的安全与防腐保鲜提供了科学依据,也为未来在水产保鲜领域应用和研究其协同抑菌机制提供一定的理论应用参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
荧光假单胞菌(P. fluorescens)PF08,广东省微生物菌种中心。
ε-PL(食品级,含量≥99.8%),陕西晨明生物科技有限公司;CS(脱乙酰度≥95%,黏度100~200 MPa·s),上海阿拉丁科技有限公司;超微量ATP酶(Na+、K+)测试盒、碱性磷酸酶(alkaline phosphatase,AKP)测试盒、总蛋白定量测定试剂盒,南京建成生物工程研究所。
1.1.2 仪器与设备
SU8220扫描电子显微镜,日本日立公司;Readmax1900光吸收全波长酶标仪,上海闪谱生物科技有限公司;Nicolet iS5傅里叶变换红外光谱仪,美国赛默飞世尔有限公司。
1.2 实验方法
1.2.1 ε-PL-CS复合保鲜液的制备
ε-PL的制备方法:分别称取1.2、0.6、0.3、0.15、0.075 g的ε-PL溶解于100 mL的去离子水中,制成不同配比溶液,备用。
CS的制备方法:分别称取2、1、0.5、0.25、0.125 g的CS溶于1%(体积分数,下同)冰醋酸水溶液100 mL中,磁力搅拌150 W超声波处理15~20 min直至完全溶解,制成不同配比溶液,备用。
1.2.2 菌种的培养与复壮
完全培养基斜面上挑取P.fluorescens PF08接种于NB液体培养基中,28 ℃、150 r/min培养24 h,采用麦氏比浊法[15]配制成菌浓度为1×106 CFU/mL的菌悬液作为指示菌液,现配现用。
1.2.3 ε-PL、CS对指示菌最小抑菌浓度(minimun inhibitory concentration, MIC)的测定
根据MELLEGÅRD等[16]的方法并略作修改,取96孔板并标记行1~8,列A~G,平行添加菌液100 μL,在每列的连续3行做浓度平行加入100 μL的ε-PL和CS,从左向右浓度依次递减(如1.2.1节浓度),以无菌培养基为对照。混匀于28 ℃培养24 h,通过酶标仪测定吸光度,同时取混合液进行涂板菌落计数,验证结果,以能够明显抑制细菌生长的浓度为MIC。
1.2.4 联合抑菌指数(fractional inhibitory concentration index,FICI)的测定
采用二维棋盘法[17]测定ε-PL、CS对P.fluorescens PF08的联合抑菌性,培养条件及判定MIC条件同1.2.3节,96孔板中棋盘格中先平行加入1.2.3节中菌液100 μL,横向和竖向分别加入ε-PL和CS溶液,终浓度分别为1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC,28 ℃ 恒温培养箱中孵育24 h后测定OD600,同时取混合液进行涂板菌落计数,验证结果。
根据公式(1)计算FICI,当FICI≤0.5时,为协同效应;0.5
FICI=MICA联用/MICA+MICB联用/MICB
(1)
式中:FICI,联合抑菌浓度指数;MICA联用,A和B联用时A对应的MIC,mg/mL;MICB联用,A和B联用时B对应的MIC,mg/mL;MICA,A单独使用时的MIC,mg/mL;MICB,B单独使用时的MIC,mg/mL。
1.2.5 时间-抑菌曲线的绘制
参考宁亚维等[18]的方法并略作修改,分别将P.fluorescens PF08与ε-PL和CS等体积混合,终浓度分别为0(空白组)、ε-PL(MIC组)、CS(MIC组)、ε-PL(1/4 MIC组)、CS(1/4 MIC组)、ε-PL-CS(FICI组),按照1.2.2节的方式进行培养,分别在0、2、4、6、8、10、12、24 h取样,并采用稀释涂布平板法测定混合液中的菌落总数,绘制时间-抑菌曲线。
1.2.6 ε-PL-CS复合保鲜液对P.fluorescens PF08细胞壁完整性的影响
1.2.6.1 ε-PL-CS复合保鲜液对P.fluorescens PF08 AKP酶活力的测定
参照ZHAO等[19]的方法并做适当修改。将P.fluorescens PF08与ε-PL和CS混合,制备成0(空白组)、ε-PL(MIC组、1/4 MIC组)、CS(MIC组、1/4 MIC组)、ε-PL-CS(FICI组)的混合液并以PBS作为空白,于28 ℃下培养12 h。于6 000 r/min下离心5 min弃上清液收集菌体,离心并洗涤3次。菌悬液在冰水浴中超声波破碎菌体。功率400 W,破碎时间2 min,每次超声波时间5 s,间隔10 s。采用AKP试剂盒,在520 nm处测定吸光度。
1.2.6.2 ε-PL-CS复合保鲜液对P.fluorescens PF08的 Na+、K+-ATP酶活力的测定
参考舒慧珍等[20]的方法,实验设计同1.2.6.1节,28 ℃培养12 h后,采用超微量Na+、K+-ATP酶试剂盒说明处理样品,每组做3次平行实验,在636 nm处测定吸光度。
1.2.7 ε-PL-CS复合保鲜液对P.fluorescens PF08微观形态的观察
参考WEI等[21]的方法并略作修改,取P.fluorescens PF08菌液,5 000 r/min离心10 min,取上清液后加入终剂量为0(空白组)、ε-PL(MIC组、1/4 MIC组)、CS(MIC组、1/4 MIC组)、ε-PL-CS(FICI组),以PBS做空白对照,于摇床中培养6 h。以5 000 r/min离心10 min,吸取上清液,用PBS重悬洗涤3次后,以8 000 r/min离心10 min。添加25 g/L的戊二醛溶液,-4 ℃固定12 h,依次用30%、50%、70%、80%、90%和100%的无水乙醇溶液梯度洗脱,干燥,喷金后观察菌落形态。
1.2.8 ε-PL-CS复合保鲜液对P.fluorescens PF08细胞结构完整性的影响
1.2.8.1 ε-PL-CS复合保鲜液对P.fluorescens PF08核酸泄露的测定
参考SU等[22]实验方法略作改动,将P.fluorescens PF08的菌液,与保鲜液为0(空白组)、ε-PL(MIC组、1/4 MIC组)、CS(MIC组、1/4 MIC组)、ε-PL-CS(FICI组)等体积混合,每组做3次平行实验,置于28 ℃培养,每2 h取样,以4 000 r/min离心10 min,于260 nm处测定上清液的紫外吸光值。
1.2.8.2 ε-PL-CS复合保鲜液对P.fluorescens PF08蛋白含量的测定
参照STE 等[23]的方法并做适当修改。取P.fluorescens PF08浓度为1×106 CFU/mL的菌液,加入ε-PL和CS,使菌悬液终浓度分别为ε-PL(MIC组、1/4 MIC组)、CS(MIC组、1/4 MIC组)、ε-PL-CS(FICI组),以PBS做空白,28 ℃下培养12 h,每2 h用总蛋白定量测定试剂盒得到各组样品的蛋白质量浓度。
等[23]的方法并做适当修改。取P.fluorescens PF08浓度为1×106 CFU/mL的菌液,加入ε-PL和CS,使菌悬液终浓度分别为ε-PL(MIC组、1/4 MIC组)、CS(MIC组、1/4 MIC组)、ε-PL-CS(FICI组),以PBS做空白,28 ℃下培养12 h,每2 h用总蛋白定量测定试剂盒得到各组样品的蛋白质量浓度。
1.2.8.3 傅里叶红外光谱(Fourier transform infrared spectrometer, FTIR)测定
参考SHEN等[24]的方法,取P.fluorescens PF08菌液,加入ε-PL和CS,终浓度为0(空白组)、ε-PL(MIC组、1/4 MIC组)、CS(MIC组、1/4 MIC组)、ε-PL-CS(FICI组),进行冷冻干燥,利用FTIR仪于4 000~500 cm-1进行扫描,扫描次数16次,分辨率4 cm-1,测定透射率。
1.2.9 数据统计与分析
所有数据均以“平均值±标准差”及方差分析表示。每个参数的测量重复3次。利用SPSS.22.0软件进行统计分析,用OriginPro 2021软件进行数据处理和绘图。
2 结果与分析
2.1 ε-PL和CS对P.fluorescens PF08的MIC分析
MIC是抑菌物质对指示菌起到抑菌效果的重要指标之一,如表1所示,各处理组与对照组在28 ℃培养24 h后发现:CS对P.fluorescens PF08的MIC为5 mg/mL,ε-PL对P.fluorescens PF08的MIC为3 mg/mL。CS与ε-PL都属于天然产物,对腐败菌P.fluorescens PF08良好的抑菌性为两者复配联用的抑菌作用提供理论依据。
表1 ε-PL和CS对荧光假单胞菌 PF08最小抑菌浓度
Table 1 Minimum inhibitory concentrations of ε-PL and CS on P.fluorescens PF08

〠-PL/(mg/mL)CS/(mg/mL)OD6001220-610-35-1.52.5+0.751.25+00+
注:“-”号代表未出现浑浊,“+”号代表出现浑浊。
2.2 ε-PL和CS对P.fluorescens PF08的FICI分析
抑菌物质的联合使用存在拮抗、无关、协同3种效应,FICI是目前实验室常用的联合抑菌测定方法。如表2可知,ε-PL(1/4 MIC)和CS(1/4 MIC)的复配溶液对P.fluorescens PF08的FICI为0.5,表现为协同作用,起到生产与应用的降本增效作用。其他浓度组合表现无关或拮抗作用,分析原因:1)ε-PL浓度高,酸度过高,降低CS的抑菌性;2)CS浓度过高时,其高黏度严重制约ε-PL的扩散,因此在 ε-PL(1/4 MIC)+CS(1/4 MIC)复配时抑菌效果最佳,以下简称ε-PL-CS复合保鲜液,并深入研究其协同机制。目前联合抑菌能够降本增效,是保鲜防腐的研究热点,魏奇等[25]研究了CS和ε-PL对金黄色葡萄球菌和大肠杆菌联合效果,结果表明CS和ε-PL的复配溶液的抑菌效果,改变过去单一的保鲜方式,提高CS成膜的均匀性,增加ε-PL保鲜抑菌效果,为两者在天然食品防腐剂中的配合应用提供了理论参考。
表2 ε-PL和CS对荧光假单胞菌PF08的联合抑菌指数
Table 2 Combination inhibition index of ε-PL and CS against P.fluorescens PF08
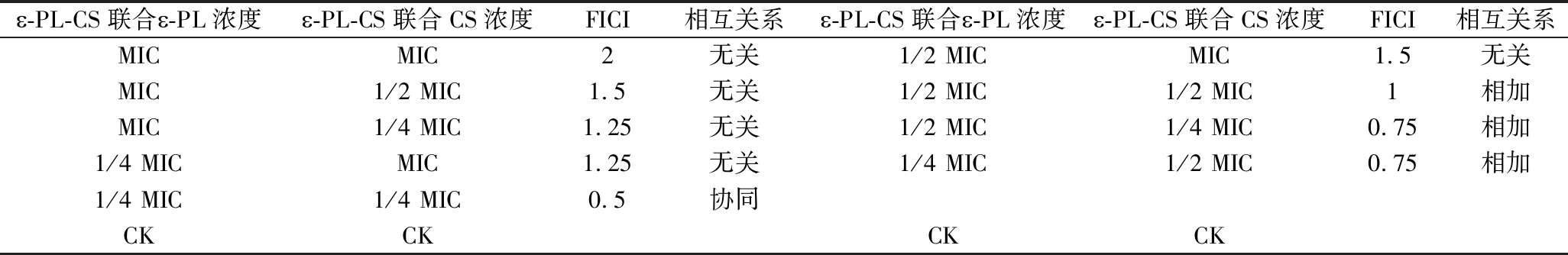
〠-PL-CS联合〠-PL浓度〠-PL-CS联合CS浓度FICI相互关系〠-PL-CS联合〠-PL浓度〠-PL-CS联合CS浓度FICI相互关系MICMIC2无关1/2 MICMIC1.5无关MIC1/2 MIC1.5无关1/2 MIC1/2 MIC1相加MIC1/4 MIC1.25无关1/2 MIC1/4 MIC0.75相加1/4 MICMIC1.25无关1/4 MIC1/2 MIC0.75相加1/4 MIC1/4 MIC0.5协同CKCKCKCK
2.3 ε-PL-CS复合保鲜液的抑菌活性
通过时间-抑菌曲线进一步研究ε-PL-CS复合保鲜液对P.fluorescens PF08的抑菌效果。由图1可知,FICI组生长曲线的抑制效率明显高于单独添加组[ε-PL(MIC、1/4 MIC)组和CS(MIC、1/4 MIC)组]及CK组,在6 h时的菌落数分别较CK组降低了0.60、5.57、1.34、6.13和6.70个单位;FICI组生长曲线的抑制效率明显高于其他组(P<0.01),说明FICI组在降低单独使用浓度的情况下,抑菌能力不变,对其生产应用具有良好的指导意义。
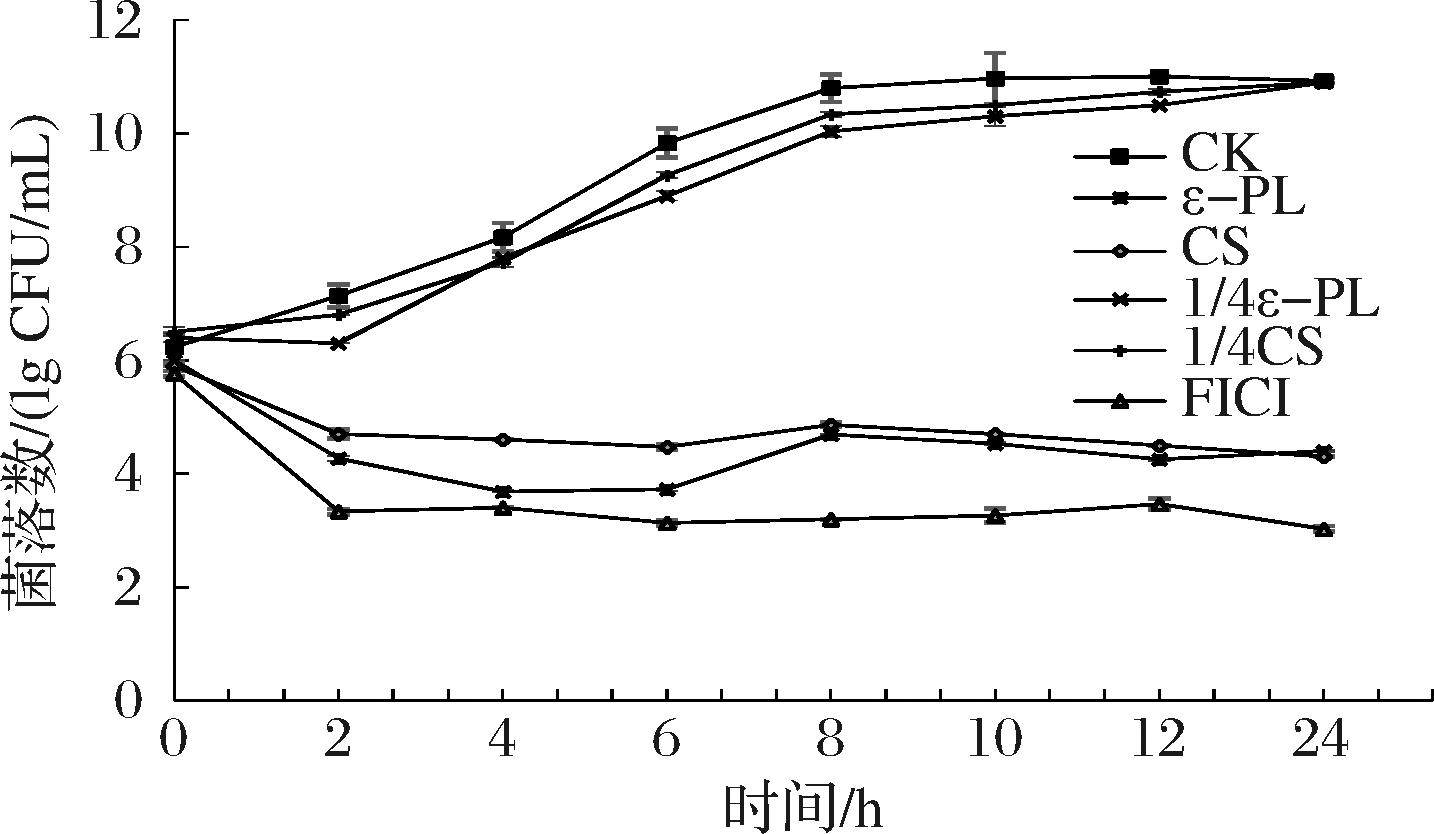
图1 ε-PL-CS复合保鲜液对荧光假单胞PF08的抑菌效果图
Fig.1 Antibacterial effect of ε-PL-CS composite preservation solution on P.fluorescens PF08
2.4 ε-PL-CS复合保鲜液对P.fluorescens PF08细胞壁的影响
2.4.1 ε-PL-CS复合保鲜液对P.fluorescens PF08AKP酶活力的影响
AKP在磷酸盐的代谢过程中起着不可替代的作用[26],AKP活性的变化与其细胞壁完整性呈负相关,细胞壁破坏越严重,AKP浓度活力越低,如图2所示,ε-PL(MIC组)、CS(MIC组)、ε-PL(1/4 MIC组)、CS(1/4 MIC组)、ε-PL-CS(FICI组)与CK组相比,AKP活力相较空白组分别下降了(20.8±0.1)%、(16.6±0.4)%、(15.4±0.1)%、(11.9±0.2)%、(21.7±0.1)%,其中FICI组效果最好,分析认为,CS带有许多正电荷的氨基基团,促使ε-PL形成阳离子,抑菌性得到增强,这与LIU等[5]研究发现ε-PL的阳离子会增强抗菌活性的结论是一致的;同时ε-PL的静电作用有利于生物膜的穿透,是AKP酶活力下降的又一因素,实验结果表明ε-PL-CS复合保鲜液能有效地破坏P.fluorescens PF08的细胞壁,起到协同增效的抑菌作用。
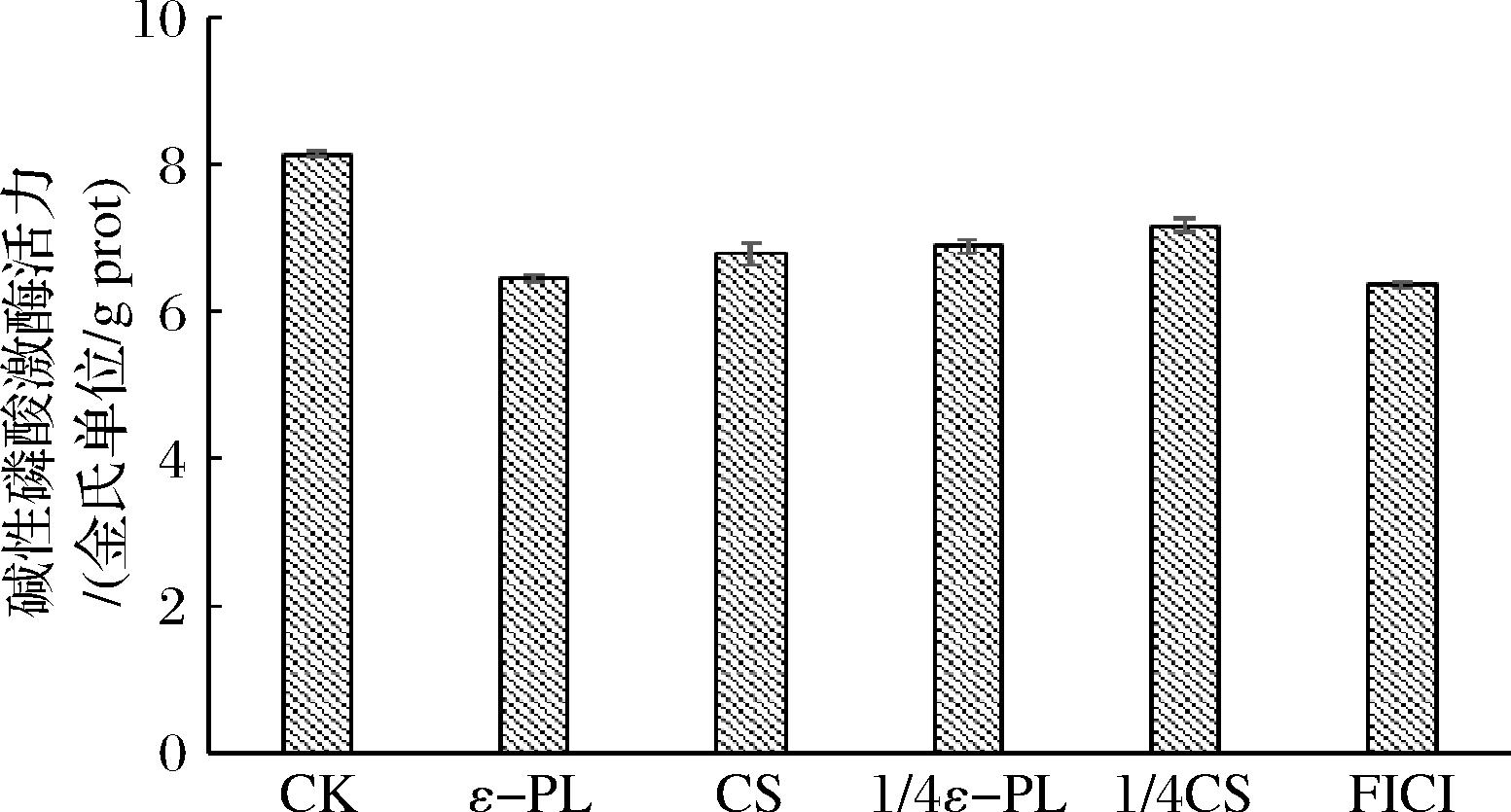
图2 ε-PL-CS复合保鲜液对荧光假单胞菌PF08AKP酶活力的影响
Fig.2 Effect of ε-PL-CS composite preservative solution on the enzymatic activity of P.fluorescens PF08AKP
2.4.2 ε-PL-CS复合保鲜液对P.fluorescens PF08 Na+、K+-ATP酶活力的影响
Na+、K+-ATP酶能够催化ATP分解,为细胞提供直接能量[27]。Na+、K+-ATP酶活力的变化与其细胞壁完整性呈负相关,细胞壁破坏越严重,Na+、K+-ATP酶活力越低,如图3所示,ε-PL(MIC组)、CS(MIC组)、ε-PL(1/4 MIC组)、CS(1/4 MIC组)、ε-PL-CS(FICI组)对P.fluorescens PF08与CK组相比Na+、K+-ATP酶活力分别下降(23.8±0.3)%、(16.3±0.1)%、(20.0±0.2)%、(12.5±0.1)%、(27.5±0.2)%,这种能量供应的中断阻碍了细菌的生长和代谢过程,最终导致菌体的死亡。此结果与AKP酶的活力结果相印证,为后续核酸、总蛋白浓度的研究提供了基础,结合2.4.1节结果,表明ε-PL-CS复合保鲜液能有效破坏P.fluorescens PF08细胞壁的完整性,细胞壁是ε-PL-CS复合保鲜液的抑菌作用靶点。这与王明等[28]研究丁香酚复合保鲜剂抑制腐败希瓦氏菌体内Na+、K+-ATPase和AKP酶活力的结果相似。然而细胞膜是否也是作用位点,需后续研究佐证。
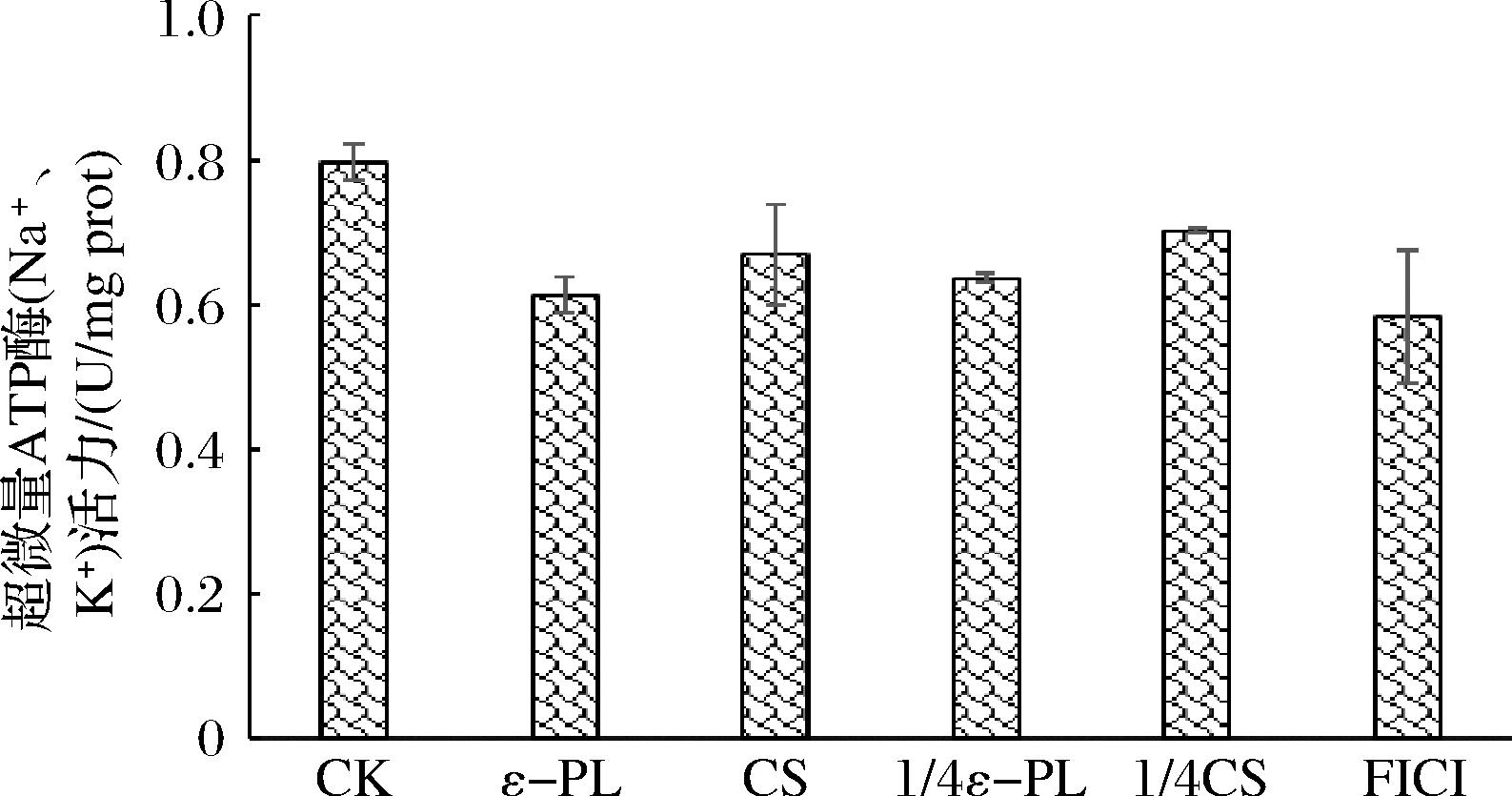
图3 ε-PL-CS复合保鲜液对荧光假单胞菌PF08的ATP酶活力的影响
Fig.3 Effect of ε-PL-CS composite preservation solution on the ATPase activity of P.fluorescens PF08
2.5 ε-PL-CS复合保鲜液对P.fluorescens PF08菌体微观形貌的影响
如图4-a所示,P.fluorescens PF08的CK组菌体形态完整且呈短杆状,实验组出现不同程度的菌体结构损伤:图4-b与图4-c相较,孔洞现象少,干瘪变型菌体较多;图4-d与图4-e相较,同图4-b与图4-c组,同时损伤的菌体数量呈现与抑菌物质浓度正相关;图4-e组除孔洞、凹陷,更有细胞断裂、呈现“口袋”状,严重变形(如4-e箭头处),进一步表明ε-PL-CS复合保鲜液的抑菌机制与细胞壁、膜的完整性有关,推测ε-PL侧链活跃的羟基与细胞壁的磷壁酸处羧基发生酯化,改变细胞壁完整性,胞膜的运输通道瓦解造成“孔洞”大分子等无选择性渗漏,结合渗透压,菌体内溶物外渗形成“凹陷”;而ε-PL-CS复合作用导致“断裂、口袋式开放”,证明抑菌效果的协同增效。这与蓝蔚青等[29]研究经CS/LZM/TP处理后菌体表面出现泡状物是由于CS黏附在细菌表面改变了细菌细胞壁和细胞膜的结构相一致。结合2.4节中大分子酶等功能也受到影响,且后续细胞内溶物(如蛋白质、核酸)的泄露研究相互佐证,从而证明ε-PL-CS(FICI组)对P.fluorescens PF08产生基于细胞壁、膜完整性破坏的抑菌机制。虽然扫描电子显微镜(scanning electron microscope, SEM)提供了细胞结构损伤的直观证据,但还需要进一步的研究来探索复合保鲜液对细菌内部结构和代谢活动的影响以及这些变化如何与抑菌效果相关联。总之,SEM图像提供了直观的证据,表明ε-PL-CS复合保鲜液通过损伤细菌细胞壁和细胞膜,导致细胞结构完整性的破坏,这是其协同抑菌的重要机制之一。

a-CK组;b-ε-PL组,c-CS组;d-1/4 ε-PL组;e-1/4 CS组;f-FICI组
图4 ε-PL-CS复合保鲜液对荧光假单胞菌PF08的扫描电镜图
Fig.4 SEM image of the effect of ε-PL-CS composite preservation solution on P.fluorescens PF08
2.6 ε-PL-CS复合保鲜液对P.fluorescens PF08细胞结构完整性的影响
2.6.1 ε-PL-CS复合保鲜液对P.fluorescens PF08核酸浓度的影响
细胞膜是细胞的保护屏障,负责调控物质进出细胞。当细胞膜受损时,其跨膜运输功能会丧失,导致细胞内部物质容易泄漏出来。其中,DNA等大分子物质在260 nm波长处具有较高的吸收值。通过测量上清液在260 nm处的吸收值变化,可以确定ε-PL-CS复合保鲜液对P.fluorescens PF08细胞结构完整性的破坏强度[30-31]。由图5可知,对照组中的OD260随着时间延长保持不变,实验组中ε-PL(MIC组)、CS(MIC组)、ε-PL(1/4 MIC组)、CS(1/4 MIC组)、ε-PL-CS(FICI组)随着时间OD260均增加,其中图6表明P.fluorescens PF08实验组在6 h后,各实验组显著高于CK组(P<0.05)。结果表明,ε-PL-CS复合保鲜液破坏P.fluorescens PF08细胞膜结构,影响胞膜的选择性渗透功能,导致细胞内的核酸物质持续外泄,影响菌体代谢和正常生理功能,起到抑菌作用;FICI组明显优于ε-PL(1/4 MIC组)、CS(1/4 MIC组),具有协同抑菌效果;FICI组的抑菌能力与ε-PL(MIC组)、CS(MIC组)相近,说明协同效果良好,与SEM结果相互印证。
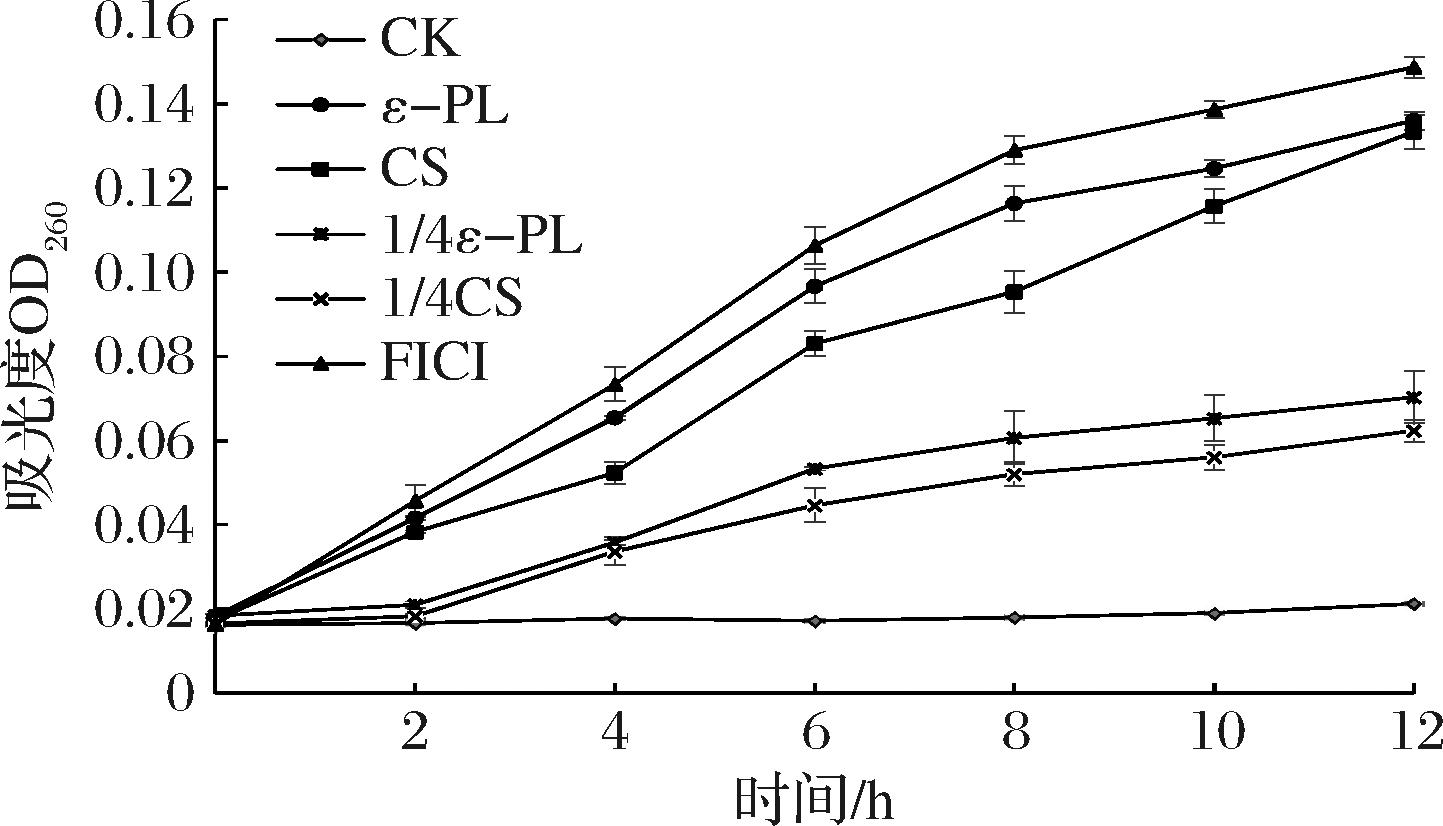
图5 ε-PL-CS复合保鲜液对荧光假单胞菌PF08核酸浓度的影响
Fig.5 Effect of ε-PL-CS composite preservation solution on the nucleic acid concentration of P.fluorescens PF08
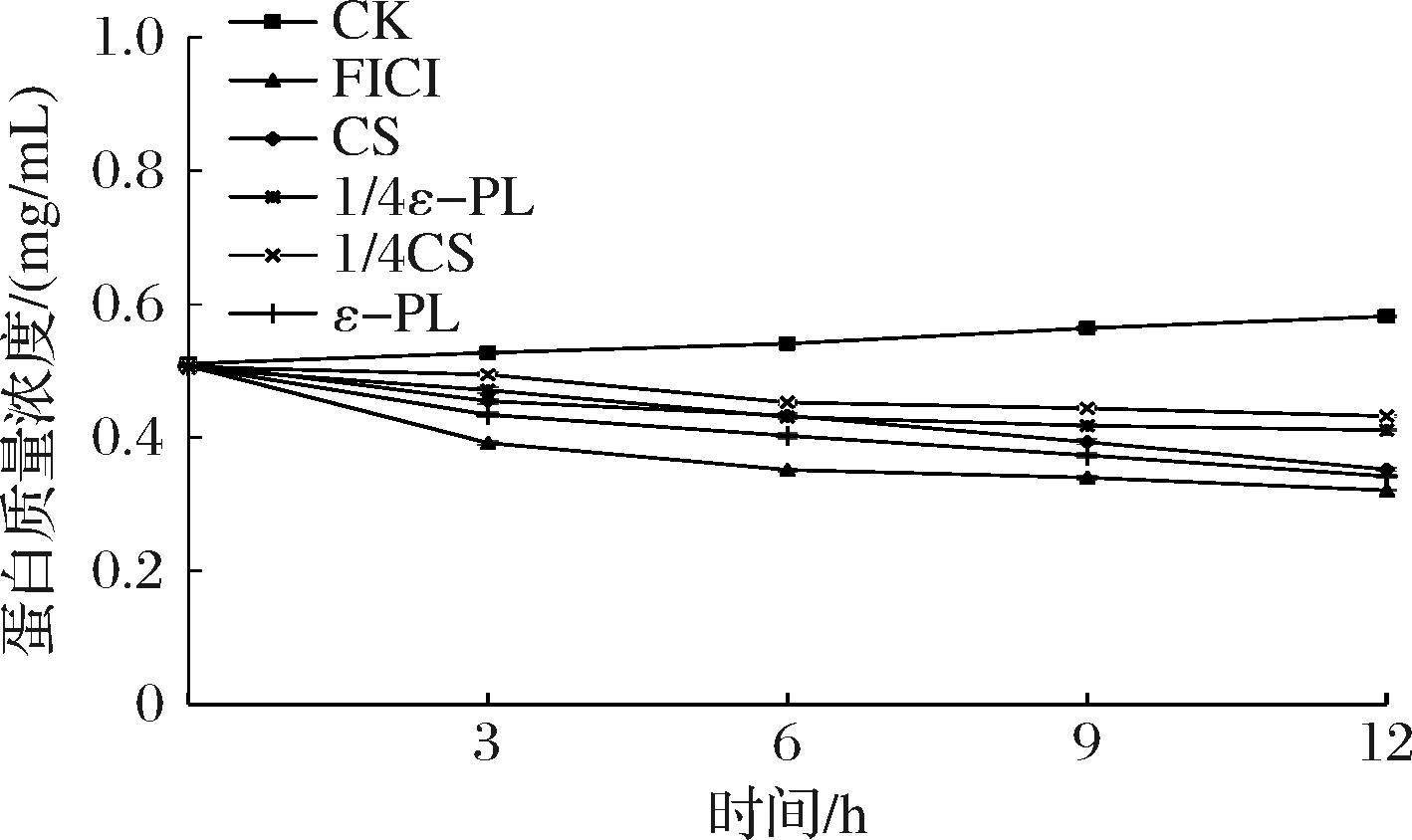
图6 ε-PL-CS复合保鲜液对荧光假单胞菌PF08蛋白质量浓度的影响
Fig.6 Effect of ε-PL-CS composite preservation solution on the protein concentration of P.fluorescens PF08
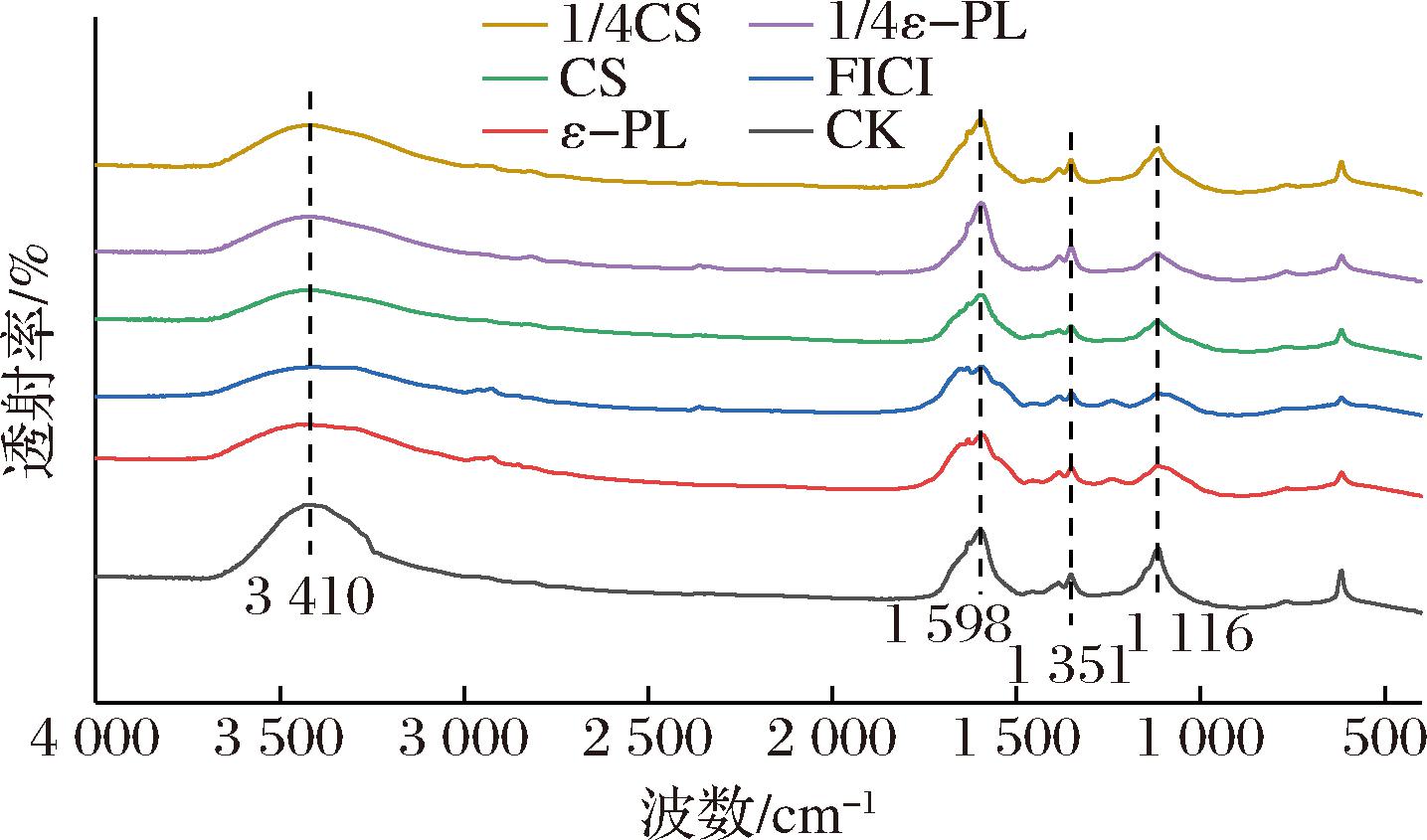
图7 ε-PL-CS复合保鲜液处理前后荧光假单胞菌PF08的FTIR谱图
Fig.7 FTIR spectra of P.fluorescens PF08 before and after treatment with ε-PL-CS composite preservative solution
2.6.2 ε-PL-CS复合保鲜液对P.fluorescens PF08蛋白质量浓度的影响
蛋白质是生命物质的基础,是构成细胞最重要的成分[32]。由图6可知,经ε-PL和CS处理0~6 h的P.fluorescens PF08,胞内蛋白质量浓度迅速降低,6~12 h处理组的蛋白质量浓度均缓慢下降,随后趋于稳定,其中ε-PL(MIC组)、CS(MIC组)、ε-PL(1/4 MIC组)、CS(1/4 MIC组)、ε-PL-CS(FICI组)与P.fluorescens PF08- CK组相比分别下降了(22.6±0.2)%、(17.0±0.1)%、(11.3±0.1)%、(15.1±0.2)%、(30.1±0.4)%,分析表明ε-PL-CS复合保鲜液能够改变细胞膜的通透性,导致大分子蛋白质泄露,与2.6.1节结果相印证,与耿一鸣等[33]研究发现随着松油烯-4-醇的剂量增大,对荧光假单胞菌细胞膜的破坏也越强,与胞内剩余的DNA含量越少的结果相似,从分子角度分析ε-PL侧链活跃的羟基与膜结构中的膜蛋白发生反应,改变通道功能,影响膜结构,使内溶物外泄,达到抑菌目的。
2.7 FTIR分析
CK组在3 410 cm-1处是细胞壁肽聚糖中O—H的伸缩振动吸收峰,1 598 cm-1处是酰胺I带的C![]() O伸缩振动吸收峰,1 351 cm-1处是细胞壁中脂质中的C—H弯曲振动吸收峰,1 116 cm-1处是细胞壁中的多糖链的C—O伸缩振动吸收峰。从P.fluorescens PF08的FTIR图可以看出经ε-PL(MIC组)、CS(MIC组)、ε-PL(1/4 MIC组)、CS(1/4 MIC组)、ε-PL-CS(FICI组)处理后的基团吸收峰均明显低于CK组,透射率逐渐降低,表明ε-PL-CS复合保鲜液破坏了细胞壁结构的完整性[34]。
O伸缩振动吸收峰,1 351 cm-1处是细胞壁中脂质中的C—H弯曲振动吸收峰,1 116 cm-1处是细胞壁中的多糖链的C—O伸缩振动吸收峰。从P.fluorescens PF08的FTIR图可以看出经ε-PL(MIC组)、CS(MIC组)、ε-PL(1/4 MIC组)、CS(1/4 MIC组)、ε-PL-CS(FICI组)处理后的基团吸收峰均明显低于CK组,透射率逐渐降低,表明ε-PL-CS复合保鲜液破坏了细胞壁结构的完整性[34]。
3 结论与展望
本研究深入探讨了ε-PL-CS复合保鲜液对P.fluorescens PF08-抑菌活性及其协同作用机制。通过对MIC测定、FICI分析、时间-抑菌曲线、酶活性测定、SEM观察以及FTIR分析,研究发现,ε-PL对P.fluorescens PF08的MIC为3 mg/mL;CS的MIC为5 mg/mL。当以1/4 MIC的ε-PL和CS混合使用时,ε-PL-CS复合保鲜液展现出协同抑菌效果,FICI为0.5。这表明ε-PL-CS复合保鲜液使用不仅提高了抑菌效果,还减少了单独ε-PL和CS的使用量,符合当前对天然、健康、环保食品添加剂的需求,也推动了其在水产预制产品中应用的可能。
ε-PL和CS对P.fluorescens PF08均显示出良好的抑菌效果,能够显著减缓细菌生长速率,损伤细菌的细胞壁、细胞膜,导致细胞内物质外泄。通过测定ε-PL-CS复合保鲜液对AKP和ATP酶的合成抑制率以及利用SEM和FTIR分析,进一步证实了复合保鲜液对细菌细胞结构的破坏作用。这些观察揭示了ε-PL-CS复合保鲜液的抑菌活性和作用机制,即通过破坏细胞壁和细胞膜的完整性,引起菌体代谢紊乱,最终导致细胞内溶物外泄和细胞形态的改变,实现抑菌效果。ε-PL-CS复合保鲜液的作用位点可能不仅限于细胞壁、膜,其是否影响核酸复制和细胞分裂过程尚需进一步研究。
在应用层面,充分发挥CS的成膜性、稳定性、抗氧化性等优势,补充如卡拉胶、魔芋胶等增稠剂,与ε-PL进一步优化复配比例,以实现在水产预制菜领域的应用。同时,探讨ε-PL和CS复合保鲜液在不同预制食品体系中的稳定性和释放特性,以优化其在实际食品加工和保鲜领域中的应用。
综上所述,本研究不仅为ε-PL和CS复合保鲜剂的开发提供了科学依据,也为未来在水产保鲜领域的应用和研究其协同抑菌机制,为进一步开发高效、安全的复合保鲜液指明了方向。评估复合保鲜液的生产成本和经济效益,以促进其在食品工业中的广泛应用。随着研究的不断深入,期待ε-PL-CS复合保鲜液能够在提升食品安全、延长食品货架期方面发挥更大的作用,以实现更广泛的商业化应用。
[1] 杨代明, 王建辉, 曾贤明, 等.从共享湘菜理论出发探讨预制菜产业健康发展的问题与对策[J].食品与机械, 2023, 39(4):1-8.
YANG D M, WANG J H, ZENG X M, et al.Analysis of problems and countermeasures on the high quality development of the prepared dishes industry based on the share theory of Hunan cuisine[J].Food &Machinery, 2023, 39(4):1-8.
[2] 红餐产业研究院. 2024水产预制菜产业发展白皮书[M]. 红餐产业研究院、联合利华饮食策划和预制菜调味产业分会联合发布,2024:53.
Red Meal Industry Research Institute. 2024 White Paper on the Development of Aquatic Prefabricated Vegetable Industry[M]. Red Meal Industry Research Institute, Unilever Food Planning and Prepared Vegetable Seasoning Industry Branch jointly released, 2024:53.
[3] 毛青秀, 彭玲, 王建辉, 等.甲鱼预制菜加工及贮藏过程中的微生物多样性分析[J].核农学报, 2024, 38(9):1734-1742.
MAO Q X, PENG L, WANG J H, et al.Analysis of microbial diversity of pre-prepared soft-shelled turtle during processing and storage[J].Journal of Nuclear Agricultural Sciences, 2024, 38(9):1734-1742.
[4] 柳芬芳, 李迎秋.ε-聚赖氨酸抗菌特性及应用研究进展[J].中国调味品, 2021, 46(4):183-186;192.
LIU F F, LI Y Q.Research progress on the antibacterial properties and application of ε-polylysine[J].China Condiment, 2021, 46(4):183-186;192.
[5] LIU J N, CHANG S L, XU P W, et al.Structural changes and antibacterial activity of Epsilon-poly-L-lysine in response to pH and phase transition and their mechanisms[J].Journal of Agricultural and Food Chemistry, 2020, 68(4):1101-1109.
[6] LIU F, LIU Y N, SUN Z L,et al.Preparation and antibacterial properties of ε-polylysine-containing gelatin/chitosan nanofiber films[J].International Journal of Biological Macromolecules, 2020, 164:3376-3387.
[7] LI Y N, YE Q Q, HOU W F,et al.Development of antibacterial ε-polylysine/chitosan hybrid films and the effect on citrus[J].International Journal of Biological Macromolecules, 2018, 118:2051-2056.
[8] 王美连, 戴凡炜, 罗政, 等.纳米肉桂醛处理对不同预冷方式荔枝低温贮藏品质的改善作用[J/OL].现代食品科技, 2024:1-10.(2024-09-09).https://link.cnki.net/doi/10.13982/j.mfst.1673-9078.2025.6.0542.
WANG M L, DAI F W, LUO Z, et al.Improvement effects of nano-cinnamaldehyde treatment on the store quality of litchi stored at low-temperature with different pre-cooling methods[J/OL].Modern Food Science and Technology, 2024:1-10.(2024-09-09).https://link.cnki.net/doi/10.13982/j.mfst.1673-9078.2025.6.0542.
[9] 张凤仪, 石建高, 张健, 等.功能性渔用材料的研究现状与展望[J].水产学报, 2024, 48(8):31-41.
ZHANG F Y, SHI J G, ZHANG J, et al.Research status and prospect of functional fishery materials[J].Journal of Fisheries of China, 2024, 48(8):31-41.
[10] 王雪芹, 李帅欣, 王兴仁, 等.鱼类抗菌肽-壳聚糖抑菌保鲜剂的制备[J].海洋科学, 2024, 48(5):72-80.
WANG X Q, LI S X, WANG X R, et al.Preparation of a fish antimicrobial peptide-chitosan bacteriostatic preservative[J].Marine Sciences, 2024, 48(5):72-80.
[11] LI L F, LIANG F Y, LI C P, et al.Antibacterial mechanism of chitosan-gentamicin and its effect on the intestinal flora of Litopenaeus vannamei infected with Vibrio parahaemolyticus[J].Marine Drugs, 2022, 20(11):702.
[12] 连欢, 孙占新, 杨相政.壳聚糖抑菌复合膜对蓝莓贮藏保鲜效果的影响[J].中国果菜, 2023, 43(9):29-34.
LIAN H, SUN Z X, YANG X Z.Effect of antibacterial chitosan composite film on storage and preservation of blueberry[J].China Fruit &Vegetable, 2023, 43(9):29-34.
[13] 黄星海, 韦建华, 钟海艺.姜黄素天然高分子智能活性包装膜研究进展[J].食品与发酵工业, 2024, 50(9):348-355.
HUANG X H, WEI J H, ZHONG H Y.Research progress of curcumin natural polymers intelligent active packaging film[J].Food and Fermentation Industries, 2024, 50(9):348-355.
[14] ZHANG X W, SHI C, LIU Z J, et al.Antibacterial activity and mode of action of ε-polylysine against Escherichia coli O157:H7[J].Journal of Medical Microbiology, 2018, 67(6):838-845.
[15] 刘梦龙, 陈聪, 陆开祥, 等.木姜子提取物对大肠杆菌的抑菌机理及其在鱼肉保鲜的应用[J].食品与发酵工业, 2025,51(12):36-43.
LIU M L, CHEN C, LU K X, et al.Antibacterial mechanism of Litsea cubeba extract against Escherichia coli and its application in fish preservation[J].Food and Fermentation Industries, 2025,51(12):36-43.
[16] MELLEGÅRD H, FROM C, CHRISTENSEN B E, et al.Inhibition of Bacillus cereus spore outgrowth and multiplication by chitosan[J].International Journal of Food Microbiology, 2011, 149(3):218-225.
[17] JIANG Y H, YANG L Y, XIN W G,et al.Combined antibacterial and antibiofilm activity of phenyllactic acid and bacteriocin XJS01 against Shigella flexneri[J].Food Bioscience, 2022,45:101512.
[18] 宁亚维, 侯琳琳, 李明蕊, 等.苯乳酸对荧光假单胞菌基于细胞膜损伤和DNA破坏的双靶位抑菌机制[J].食品科学, 2021, 42(7):60-67.
NING Y W, HOU L L, LI M R, et al.Dual-target antibacterial mechanism of phenyllactic acid against Pseudomonas fluorescens based on cell membrane and DNA damage[J].Food Science, 2021, 42(7):60-67.
[19] ZHAO X Y, LAN W Q, YANG X, et al.Inactivation effect and protective barriers damage caused to Shewanella putrefaciens by stable chlorine dioxide combined with slightly acidic electrolyzed water[J].Journal of Food Processing and Preservation, 2022,46(8):e16775.
[20] 舒慧珍, 唐志凌, 韩薇, 等.石竹烯对热杀索丝菌的抑菌机理[J].食品科学, 2020, 41(15):31-38.
SHU H Z, TANG Z L, HAN W, et al.Antibacterial activity and mechanism of caryophyllene against Brochothrix thermosphacta[J].Food Science, 2020, 41(15):31-38.
[21] WEI X Q, LI Q Y, WU C L, et al.Preparation characterization and antibacterial mechanism of the chitosan coatings modified by Ag/ZnO microspheres[J].Journal of the Science of Food and Agriculture, 2020, 100(15):5527-5538.
[22] SU R H, LI T F, FAN D M, et al.The inhibition mechanism of ε-polylysine against Bacillus cereus emerging in surimi gel during refrigerated storage[J].Journal of the Science of Food and Agriculture, 2019,99(6):2922-2930.
[23] STE A, JO
A, JO CA J, WALERON K, et al.Quality control of bacterial extracellular vesicles with total protein content assay, nanoparticles tracking analysis, and capillary electrophoresis[J].International Journal of Molecular Sciences, 2022, 23(8):4347.
CA J, WALERON K, et al.Quality control of bacterial extracellular vesicles with total protein content assay, nanoparticles tracking analysis, and capillary electrophoresis[J].International Journal of Molecular Sciences, 2022, 23(8):4347.
[24] SHEN S Y, YANG K, LIN D H.Biomacromolecular and toxicity responses of bacteria upon the nano-bio interfacial interactions with Ti3C2Tx nanosheets.[J].Environmental Science &Technology,2023,57(35):12991-13003.
[25] 魏奇, 白伟娟, 钟鑫荣, 等.Checkerboard法对ε-聚赖氨酸和壳聚糖抑菌作用的研究[J].食品研究与开发, 2021, 42(23):14-19.
WEI Q, BAI W J, ZHONG X R, et al.Antibacterial activities of ε-polylysine and chitosan analyzed using the checkerboard method[J].Food Research and Development, 2021, 42(23):14-19.
[26] 蓝蔚青, 车旭, 谢晶, 等.复合生物保鲜剂对荧光假单胞菌的抑菌活性及作用机理[J].中国食品学报, 2016, 16(8):159-165.
LAN W Q, CHE X, XIE J, et al.Antibacterial activity and mechanism of composite biological preservatives against Pseudomonas fluorescens[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(8):159-165.
[27] HAN T, NAZARENKO Y, LIOY P J, et al.Collection efficiencies of an electrostatic sampler with superhydrophobic surface for fungal bioaerosols[J].Indoor Air,2011,21(2):110-120.
[28] 王明,张家涛,周斌等.丁香酚复合保鲜剂对腐败希瓦氏菌的抗菌作用机制[J].食品科学,2021,42(13):10-16.
WANG M, ZHANG J T, ZHOU B,et al.Antibacterial mechanism of eugenol-containing composite preservatives against Shewanella putrefaciens[J].Food Science, 2021, 42 (13):10-16.
[29] 蓝蔚青, 谢晶, 毛锋, 等.复合生物保鲜剂对金黄色葡萄球菌的抑菌作用研究[J].食品与生物技术学报, 2014, 33(8):814-820.
LAN W Q, XIE J, MAO F, et al.Antibacterial effect of composite natural preservatives against Staphylococcus aureus[J].Journal of Food Science and Biotechnology, 2014, 33(8):814-820.
[30] 张璇.茶多酚缓释体系的建立及其保鲜性能和抗菌机理研究[D].锦州:渤海大学,2019.
ZHANG X.Establishment of tea polyphenol slow-release system and its preservation performance and antibacterial mechanism[D].Jinzhou:Bohai University, 2019.
[31] 倪荣, 郭雪松, 韩艳霞, 等.壳聚糖复合保鲜剂对荧光假单胞菌的抑菌活性[J].现代食品科技, 2023, 39(12):178-183.
NI R, GUO X S, HAN Y X, et al.Antibacterial activity of chitosan composite preservative against Pseudomonas fluorescens[J].Modern Food Science and Technology, 2023, 39(12):178-183.
[32] YIN L Z, CHEN J H, WANG K Y, et al.Study the antibacterial mechanism of cinnamaldehyde against drug-resistant Aeromonas hydrophila in vitro[J].Microbial Pathogenesis, 2020, 145:104208.
[33] 耿一鸣,李婷婷,励建荣,等.松油烯-4-醇对荧光假单胞菌抑菌能力及作用机理[J].食品科学,2022,43(1):30-36.
GENG Y M, LI T T, LI J R, et al.Antibacterial activity and mechanism of terpinene-4-ol against Pseudomonas fluorescens[J].Food Science, 2022, 43 (1):30-36.
[34] PADMAVATHI A R, ABINAYA B, PANDIAN S K.Phenol, 2,4-bis(1,1-dimethylethyl) of marine bacterial origin inhibits quorum sensing mediated biofilm formation in the uropathogen Serratia marcescens[J].Biofouling,2014,30(9):1111-1122.