(-)-α-红没药醇[(-)-α-bisabolol,BO],又名(-)-α-甜没药醇、左美诺醇,是一种重要的不饱和倍半萜醇类化合物,具有3个连续异戊二烯单元,巴西桉树(Eremanthus erythropappus)和德国洋甘菊(Matricariare cutita)等可以合成BO[1-3]。BO具有消炎抑菌、活血化瘀、镇静止痛、祛黑色素、舒缓皮肤、保湿等功效[4],在化妆品和食品等领域有广阔的应用价值。BREHM-STECHER等[5]研究发现BO可以通过破坏细胞质膜,非特异性地增强细菌对某些外源性抗菌化合物的渗透性,从而增强它们对抗生素的敏感性,最终达到消炎抑菌的目的。目前,BO广泛应用于功能性食品、药品、化妆品和精细香料[6]。以化妆品行业为例, BO的年需求量超过400 t,因而BO的工业制备技术具有广阔市场前景。
BO制备的传统方法是从巴西桉树中提取精油,并利用蒸汽蒸馏获得,但萃取过程需要使用有机试剂,增加了生产成本并带来了环保问题[2]。为克服这一缺陷,后来发展了化学合成法,但又会形成其他非对映异构体,如(+)-α-红没药醇以及其他副产物[3,7],因此BO化学合成未形成规模。利用微生物合成法制备BO可克服上述缺陷,因此成为主流方法。微生物宿主有大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、解脂耶氏酵母(Yarrowia lipolytica)以及酿酒酵母(Saccharomyces cerevisiae)。如图1所示,当添加甘油作为唯一碳源时,BO的生物合成途径主要有3步。首先,葡萄糖生成乙酰辅酶A,并进入甲羟戊酸途径,该途径积累异戊烯基二磷酸(isopentenyl pyrophosphate,IPP)及其烯丙基异构体二甲基烯丙基二磷酸(dimethylallyl pyrophosphate,DMAPP)作为终产物[8]。随后,IPP和DMAPP结合生产法尼基焦磷酸(farnesyl pyrophosphate,FPP)[9],FPP被认为是倍半萜的直接前体。最后,FPP在MrBBs的催化下转化为BO。
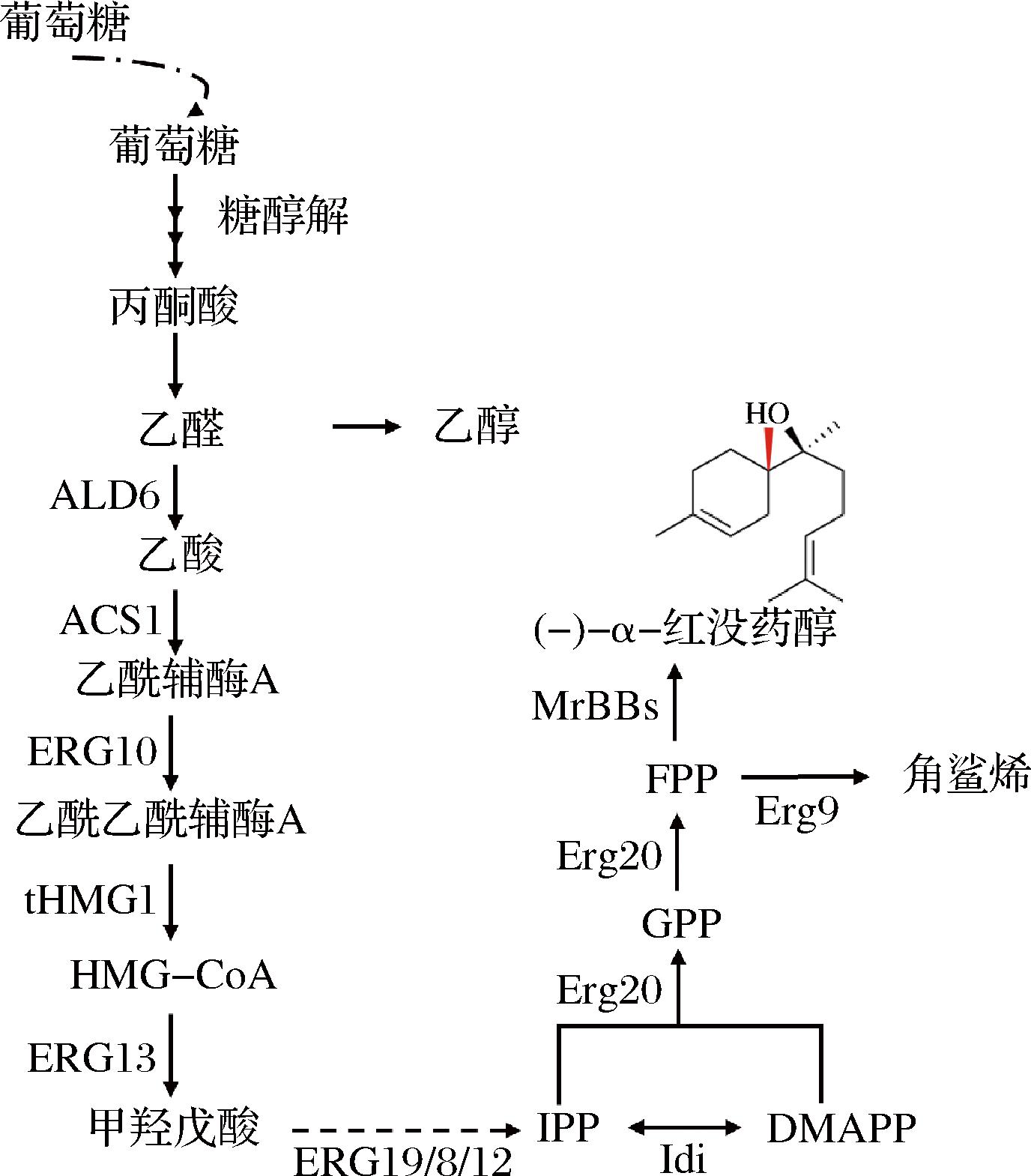
图1 BO的合成路径
Fig.1 The synthetic pathway of BO
为提升BO的生物合成,多种代谢工程策略被报道,首先是过量表达MrBBs合成BO,KIM等[2]在大肠杆菌中表达MrBBs将IPP和DMAPP用于合成BO,在发酵罐中BO提高了69.84%;其次,过量表达BO合成前体也能促进BO合成,HAN等[1]引入表达内源性ispA基因编码的法尼醇焦磷酸合酶,将大肠杆菌BO水平提高了25.61倍;MU OZ-PÉREZ等[4]在酿酒酵母中通过增加乙酰辅酶A表达量,BO产量为124 mg/L,提高了50.67%;MA等[3]在解脂耶氏酵母中通过强化β-氧化途径,平衡内源脂质与BO合成之间共同前体乙酰辅酶A的分布,BO合成量提高了21.82倍;此外,削弱调控因子也能提高BO合成水平,JIANG等[10]在酿酒酵母中敲除MVA途径中的Rox1和Ypl062w两个负调控因子,弱化竞争途径基因,BO提高幅度达30.62倍。
OZ-PÉREZ等[4]在酿酒酵母中通过增加乙酰辅酶A表达量,BO产量为124 mg/L,提高了50.67%;MA等[3]在解脂耶氏酵母中通过强化β-氧化途径,平衡内源脂质与BO合成之间共同前体乙酰辅酶A的分布,BO合成量提高了21.82倍;此外,削弱调控因子也能提高BO合成水平,JIANG等[10]在酿酒酵母中敲除MVA途径中的Rox1和Ypl062w两个负调控因子,弱化竞争途径基因,BO提高幅度达30.62倍。
但目前尚未有文献报道利用毕赤酵母(Pichia pastoris)来合成BO。P.pastoris是目前工业生物技术领域用以蛋白表达和生物催化的常用宿主之一,具有表达强度高、翻译后修饰能力强、细胞密度高等优点。因此,本研究首次研究了P.pastoris合成BO的潜力,拟利用P.pastoris GS115作为宿主,通过异源表达MrBBs基因进行BO合成。
为进一步通过基因工程策略提升BO合成量,本论文拟对Ku70基因进行敲除,Ku70编码非同源末端连接(non-homologous end joining,NHEJ)的DNA修复。在P.pastoris中,NHEJ是修复DNA双链断裂的主要机制[11],这极大地削弱了同源重组,从而降低了基因敲入和敲除的效率。据报道,P.pastoris中Ku70缺失株在基因靶向整合时效率显著提高[12]。为了提高菌株代谢工程改造的成功率,抑制P.pastoris中的非同源修复成为了一个有效的策略。本研究借助敲除质粒pPpT4[13],对GS115中Ku70基因进行了敲除。本研究首次发现,Ku70的缺失对BO合成造成显著的影响,可作为代谢工程改造新策略,为下一步进行BO生产的改造奠定基础。
1 材料与方法
1.1 菌株、质粒与引物
菌株:P.pastoris GS115为实验宿主菌株,大肠杆菌(Escherichia coli)JM109用于质粒的构建。质粒:pPpT4质粒,pPICZ A载体质粒。本研究中所使用的引物如表1所示。
表1 本研究中所使用的引物
Table 1 Primers used in this study
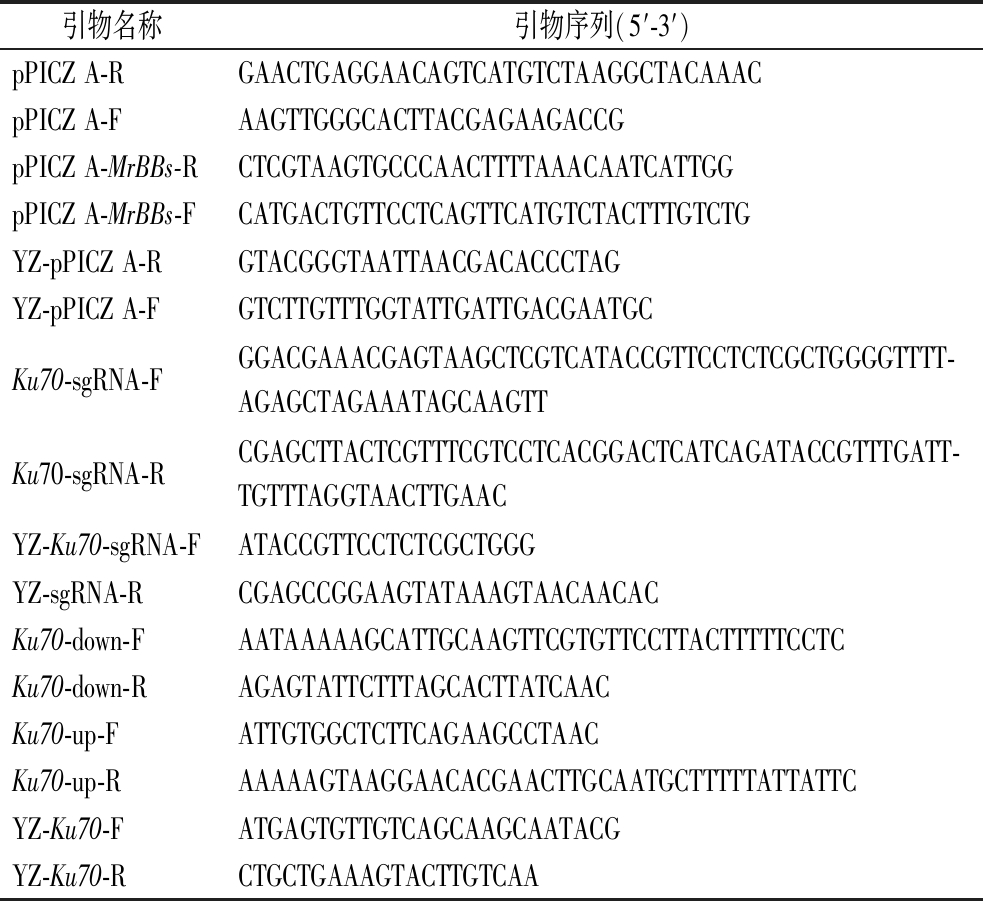
引物名称引物序列(5′-3′)pPICZ A-RGAACTGAGGAACAGTCATGTCTAAGGCTACAAACpPICZ A-FAAGTTGGGCACTTACGAGAAGACCGpPICZ A-MrBBs-RCTCGTAAGTGCCCAACTTTTAAACAATCATTGGpPICZ A-MrBBs-FCATGACTGTTCCTCAGTTCATGTCTACTTTGTCTGYZ-pPICZ A-RGTACGGGTAATTAACGACACCCTAGYZ-pPICZ A-FGTCTTGTTTGGTATTGATTGACGAATGCKu70-sgRNA-FGGACGAAACGAGTAAGCTCGTCATACCGTTCCTCTCGCTGGGGTTTT-AGAGCTAGAAATAGCAAGTTKu70-sgRNA-RCGAGCTTACTCGTTTCGTCCTCACGGACTCATCAGATACCGTTTGATT-TGTTTAGGTAACTTGAACYZ-Ku70-sgRNA-FATACCGTTCCTCTCGCTGGGYZ-sgRNA-RCGAGCCGGAAGTATAAAGTAACAACACKu70-down-FAATAAAAAGCATTGCAAGTTCGTGTTCCTTACTTTTTCCTCKu70-down-RAGAGTATTCTTTAGCACTTATCAACKu70-up-FATTGTGGCTCTTCAGAAGCCTAACKu70-up-RAAAAAGTAAGGAACACGAACTTGCAATGCTTTTTATTATTCYZ-Ku70-FATGAGTGTTGTCAGCAAGCAATACGYZ-Ku70-RCTGCTGAAAGTACTTGTCAA
1.2 培养基与试剂
大肠杆菌JM109接种于LB在37 ℃下培养。根据质粒要求添加合适的抗生素。P.pastoris接种于YPD或诱导表达培养基(buffered methanol-complex medium, BMMY)或甘油缓冲复合培养基(buffered glycerol-complex medium, BMGY)在30 ℃下培养。为了提高BO的积累,将20%(体积分数)正十二烷添加到培养基中,具体方法参照文献[14]。
试剂:蛋白胨、酵母粉,英国Oxoid公司;甲醇、无水葡萄糖、NaCl、K2HPO4、KH2PO4、D-山梨醇,国药集团化学试剂有限公司;博来霉素、酵母氮源基础(yeast nitrogen base,YNB),北京索莱宝生物工程有限公司。一步克隆和胶回收试剂盒,南京诺唯赞生物科技股份有限公司;质粒小提试剂盒,北京天根生化科技公司。
培养基:LB培养基(g/L):蛋白胨10,酵母提取物5,NaCl 10。
YPD培养基(g/L):酵母提取物10,蛋白胨20,无水葡萄糖20。
BMGY培养基:甘油10 g/L,酵母提取物10 g/L,蛋白胨20 g/L,YNB 13.4 g/L,K3PO4缓冲液100 mmol/L,(NH4)2SO4 5 g/L,400 μg/L生物素,pH 6.0。
BMMY培养基:甲醇10 g/L,酵母提取物10 g/L,蛋白胨20 g/L,YNB 13.4 g/L,K3PO4缓冲液100 mmol/L,(NH4)2SO4 5 g/L,400 μg/L生物素,pH 6.0。
固体培养基添加20 g/L的琼脂粉。
1.3 实验方法
1.3.1 敲除质粒构建
为了构建敲除质粒,基于P.pastoris的基因组序列利用网站(https://chopchop.cbu.uib.no/)设计了一个20 bp的sgRNA序列,在SnapGene软件设计引物,以pPpT4为质粒模板PCR线性化扩增质粒。随后,使用ClonExpress Ⅱ一步克隆试剂盒组装质粒,连接并转移到大肠杆菌JM109感受态。通过PCR、DNA电泳和基因测序证实基因敲除的准确性。
1.3.2 P.pastoris基因组提取
参照文献[15]报道的方法进行。
1.3.3 P.pastoris基因敲除
基于P.pastoris的基因组序列,选取目的基因上下游各1 000 bp左右的同源区段分别扩增,通过融合PCR将上下游同源臂进行连接,构建敲除重叠臂。将装有100 μL的P.pastoris感受态细胞的EP管置于冰上解冻,加入100 ng敲除质粒和2 000 ng重叠臂片段,吹吸混合均匀,转移到预冷后的电击杯中,电击后,立刻加入预冷的YPD培养基500 μL和1 mol/L D-山梨醇500 μL,吹吸混合均匀后,转移到EP管中,于30 ℃和220 r/min中复苏2 h后,涂布于博来霉素的抗性平板中,筛选阳性转化子。
1.3.4 P.pastoris摇瓶培养
将菌株在YPD平板上划线,于30 ℃恒温培养箱中培养活化,挑取单菌落接种于3 mL的YPD试管中,于30 ℃恒温摇床中220 r/min培养过夜。取50 μL接种与5 mL的YPD试管中第二次活化。以初始OD=0.2的种子培养液接种于BMGY培养基进行发酵培养。培养48 h以后,菌体转移到50 mL的BMMY培养基中,每隔24 h添加500 μL的纯甲醇进行诱导表达。
1.3.5 P.pastoris生长曲线测定
参照文献[16]的方法进行。
1.3.6 P.pastoris GS115/pPICZ A-MrBBs发酵产物的提取及分析
将培养物以12 000 r/min转速离心10 min,弃菌体沉淀;将分离的上清液与10%(体积分数)正十二烷混合,30 ℃、220 r/min孵育30 min,12 000 r/min 离心10 min。分离有机层用于BO分析。
通过GC-MS分析了正十二烷有机相中的BO,基于前期报道的定性和定量方法[17],并略作修改如下:采用配备HP-5MS色谱柱(30 m×0.250 mm×0.25 μm)的GC-MS。进样口温度保持在250 ℃,进样体积1 μL。柱流速1 mL/min。烘箱温度最初保持在150 ℃下60 s,然后以10 ℃/min的速度加热到230 ℃并保持在230 ℃下6 min。载气为He,入口压力5.58 psi,电子能量70 eV。单个样品的分析时间13 min。
BO标准液检测限为7.69×10-9,用正十二烷作溶剂。BO标准液配置成5、10、20、40、80、160、320 mg/L不同浓度,绘制标准曲线。
2 结果与分析
2.1 P.pastoris GS115合成BO
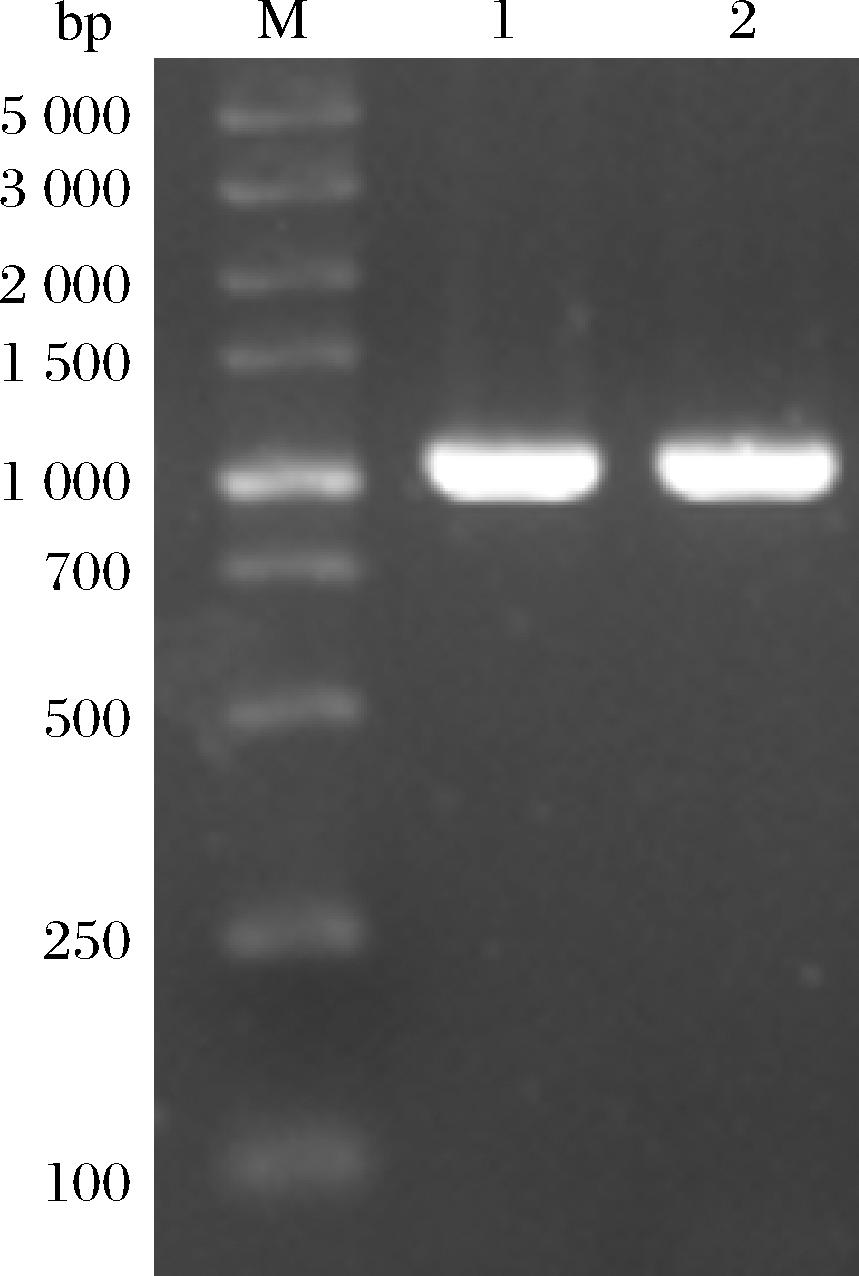
根据P.pastoris密码子偏好性,优化MrBBs基因,构建质粒pPICZ A-MrBBs。pPICZ A-MrBBs表达质粒酶切线性化后,电转导入GS115,得到GS115/pPICZ A-MrBBs。随后进行MrBBs基因验证,理论长度约为1 700 bp。根据核酸电泳图,结合基因测序可知pPICZ A-MrBBs和GS115/pPICZ A-MrBBs构建正确(图2)。
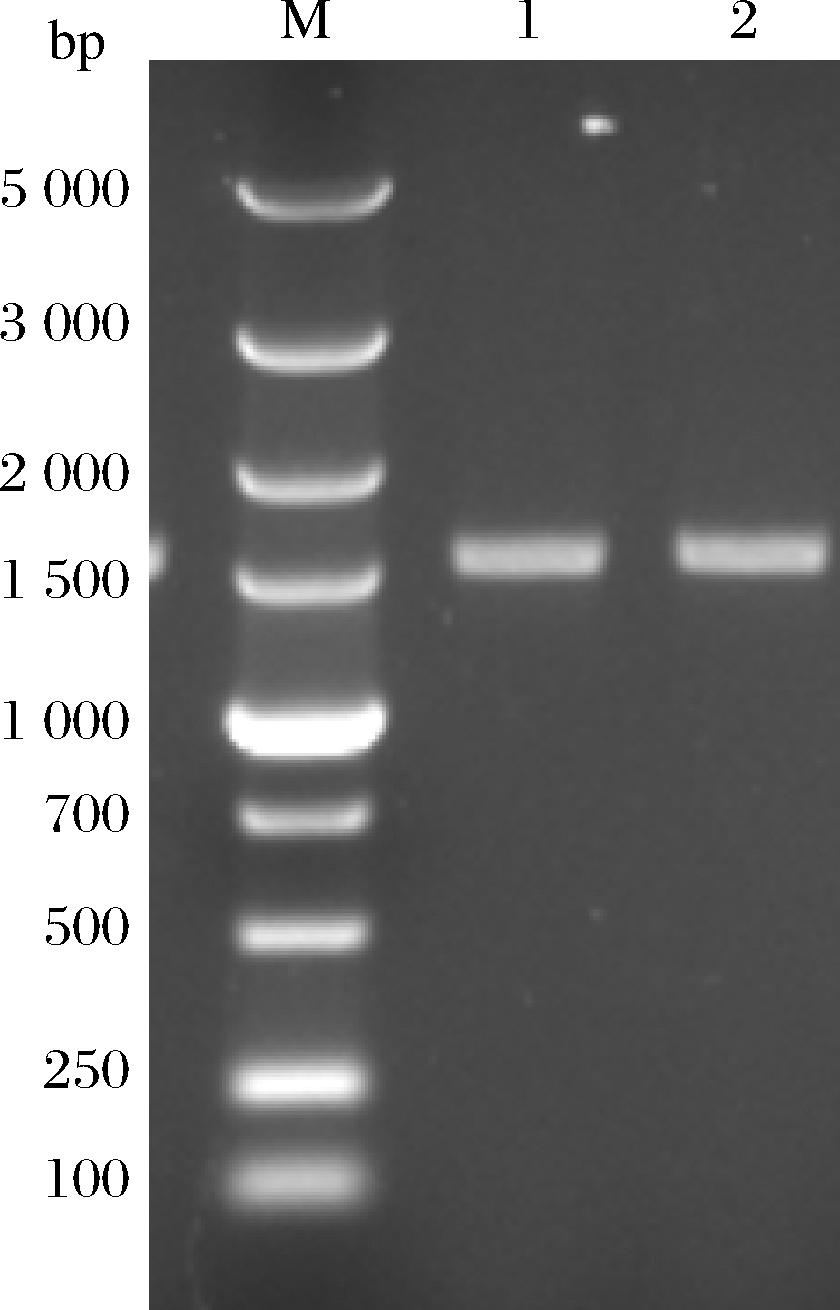
M-DNA Marker;泳道1-pPICZ A-MrBBs;泳道2-GS115/pPICZ A-MrBBs。
图2 pPICZ A-MrBBs质粒构建的PCR验证
Fig.2 Verification of deletion strain by PCR
通过GC-MS分析不同浓度的BO标准品可知,BO浓度范围在10~160 mg/L时,线性关系良好。回归方程为y=1.96×108x+1.4×109,R2=0.994,其中x表示BO浓度,y表示峰面积。
将菌株进行摇瓶培养,在培养132 h后,对发酵液进行处理,完成后进行GC-MS检测和分析。如图3所示,经检测GS115/pPICZ A-MrBBs的BO产量为3.11 mg/L(图4-b)。
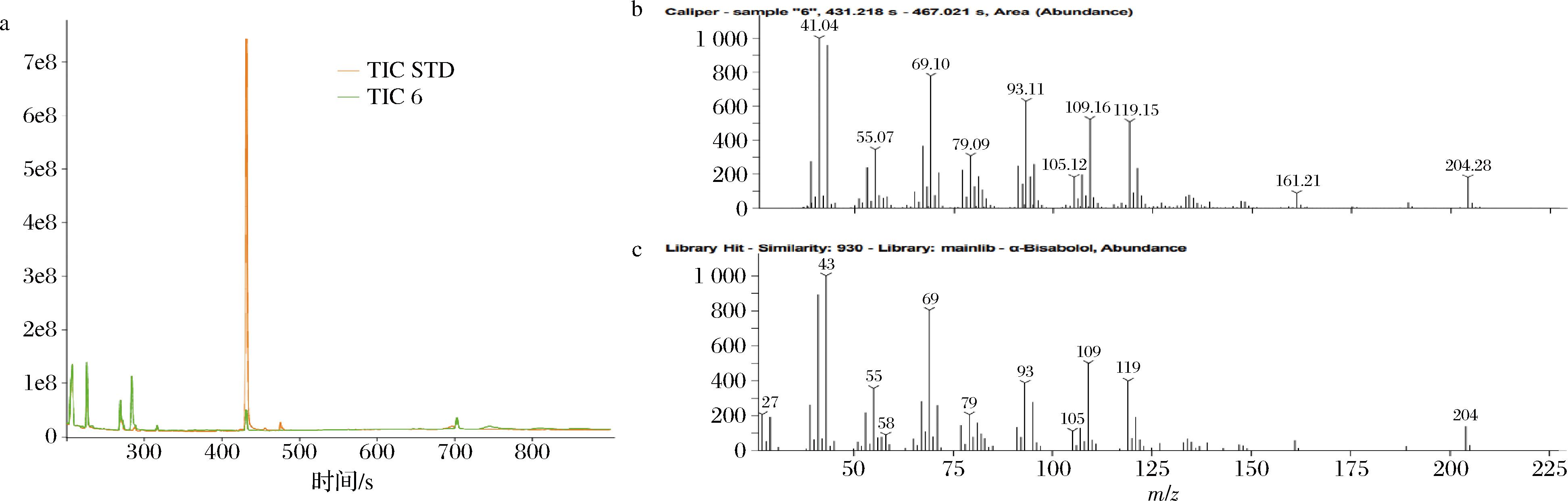
a-GC图;b-样品MS图;c-数据库BO标品MS图
图3 BO提取物的GC-MS图谱
Fig.3 GS-MS chromatogram of BO extract
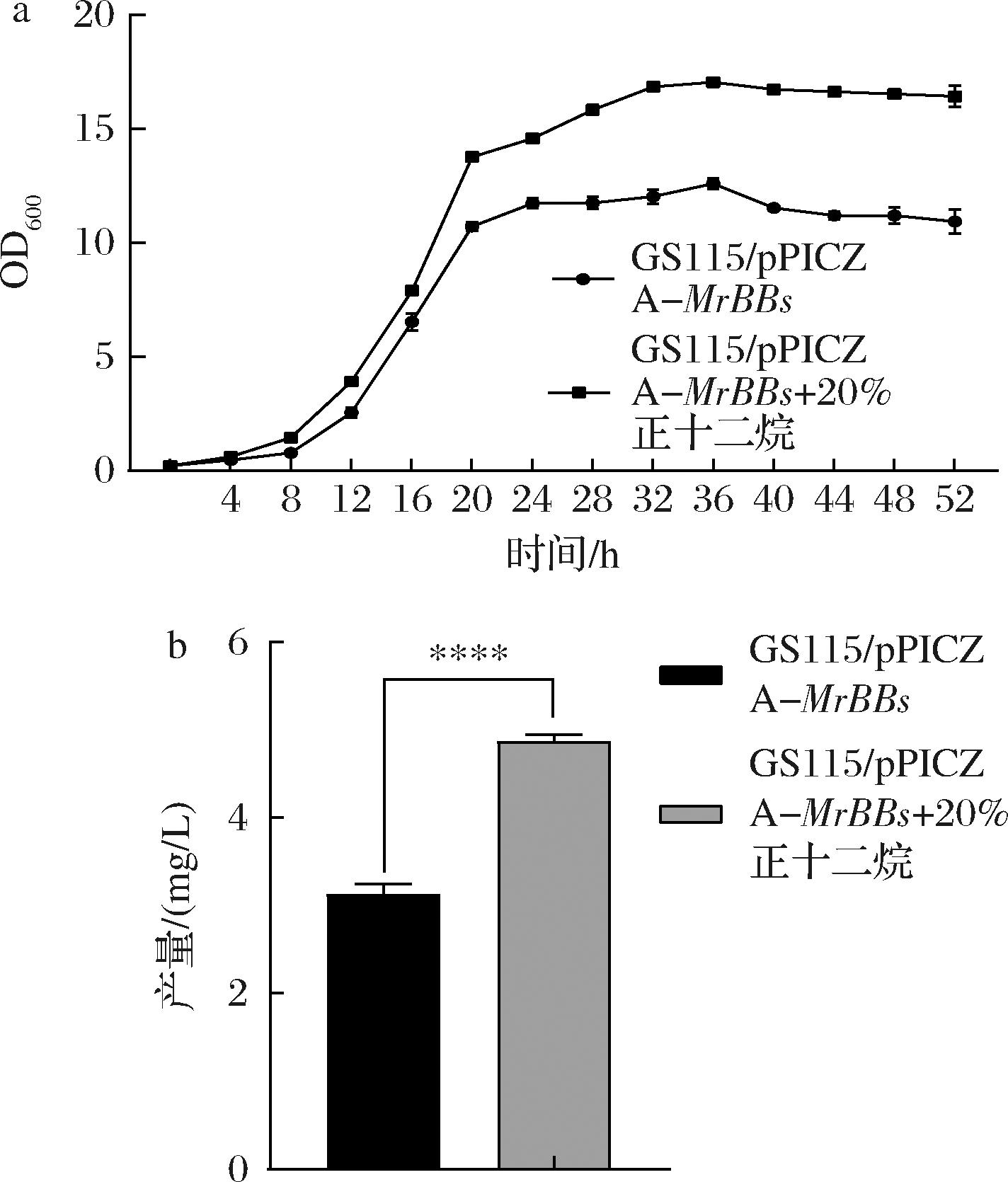
a-生长曲线;b-BO产量
图4 添加正十二烷对GS115/pPICZ A-MrBBs生长曲线及BO产量的影响
Fig.4 The growth curve of mutant strain adding growth n-dodecane and the yield of BO
注:****表示P<0.000 1(下同)。
2.2 添加正十二烷对菌株生长及BO合成的影响
为提高BO合成量,首先要考虑的是减少有毒BO对P.pastoris生长的抑制。据报道,添加正十二烷的两相培养有利于基因工程大肠杆菌中的BO生产[14]。因此,本研究还优化了P.pastoris培养方法,向培养液中添加了20%(体积分数)的正十二烷,并研究了其对生长曲线的影响。如图4-a所示,正十二烷的添加促进了GS115/pPICZ A-MrBBs的生长,其最大OD600值达17.04,相较不添加条件下最大OD600(12.58)提高35.45%。此外,添加20%正十二烷还提高了BO水平,培养132 h后,BO含量升高到4.91 mg/L(图4-b)。究其原因,一方面,正十二烷层可吸收发酵液中的BO,减轻其对P.pastoris生长的抑制;另一方面,P.pastoris生长的改善又促进了BO的生物合成。
2.3 Ku70缺失对BO合成的影响
为进一步提高GS115/pPICZ A-MrBBs的BO产量,利用CRISPR/Cas9基因编辑技术对Ku70基因进行敲除,获得GS115ΔKu70。为了验证这一基因缺失,对缺失株进行PCR检测,根据验证引物的长度进行判断,如未敲除约为2 800 bp,已敲除则约为1 000 bp,电泳结果显示Ku70基因已缺失(图5)。
M-DNA Marker;泳道1、2-GS115ΔKu70。
图5 GS115ΔKu70的PCR验证
Fig.5 Verification of deletion strain by PCR
为验证基因缺失对菌株的生长是否产生影响,将突变株与野生菌株进行生长曲线比较。如图6-a所示,在BMMY培养基中,2个菌株在12 h进入对数生长期,GS115和GS115ΔKu70在48 h进入稳定生长期。与GS115相比,GS115ΔKu70的趋势相似,生长速率和生物量相似,表明缺失Ku70对菌株生长没有显著影响。
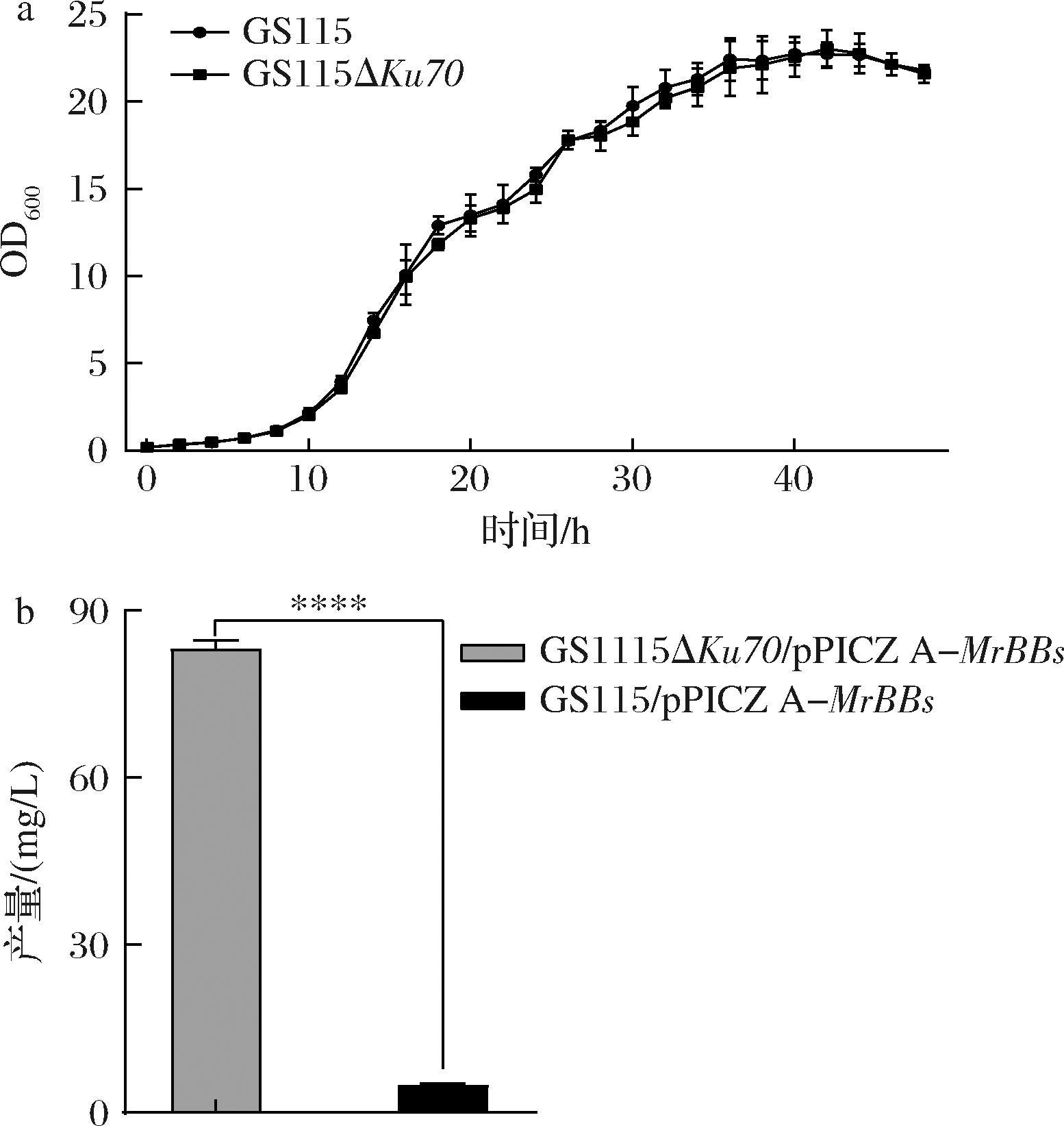
a-生长曲线;b-BO产量
图6 不同宿主的生长曲线及BO产量
Fig.6 The growth curve and BO yield of different hosts
将构建好的质粒线性化后,电转GS115ΔKu70,获得GS115ΔKu70/pPICZ A-MrBBs,接入BMMY培养基中进行摇瓶培养。如图6-b所示,GS115ΔKu70/pPICZ A-MrBBs的BO最高水平为83.22 mg/L,比GS115/pPICZ A-MrBBs的BO产率提高显著(P<0.000 1),增幅达15.95倍,这是首次发现Ku70缺失可作为提高BO合成。
Ku70是生物体内含量丰富的一种核蛋白,广泛存在于人类、哺乳动物、植物、昆虫、酵母和原核生物体内[18]。据目前报道,Ku70突变失活能够提高同源重组的频率,减少NHEJ的修复,这使得外源基因更容易插入到基因组中,能避免不利的基因插入位点[12]。此外,Ku70作为转录因子调节多个基因的表达参与了细胞内多条信号转导途径和转录调控,以及端粒结构的维持等[18]。以转录调控为例,据报道,Ku70蛋白参与了HeLa细胞增殖和迁移过程;其还可能调节部分微小RNA的表达[19],此外,Ku70等参与预防人黑色素瘤坏死、凋亡和凋亡的细胞死亡过程的转录调控网络形成[20],因此,本研究Ku70缺失引起BO的大幅提升,推测也可能与Ku70缺失株中转录组变化有关,其最终引发BO合成增强。目前本团队正借助差异转录组学和代谢组学进行验证,以阐述其调控机理,为后续代谢工程改造进一步提升BO合成奠定基础。
3 结论
由于BO对细胞有一定毒害作用,因此添加正十二烷进行两相培养,缓解BO积累对细胞生长的影响。本研究针对GS115菌株,通过敲除Ku70得到GS115ΔKu70菌株,该菌株作为基因改造的优良出宿主菌株。GS115ΔKu70合成BO的水平大幅提高,与GS115相比,GS115ΔKu70中BO相对含量提升了15.95倍,达到83.22 mg/L,为进一步优化代谢工程改造奠定基础。
[1] HAN G H, KIM S K, YOON P K, et al.Fermentative production and direct extraction of (-)-α-bisabolol in metabolically engineered Escherichia coli[J].Microbial Cell Factories, 2016, 15(1):185.
[2] KIM S J, KIM S K, SEONG W, et al.Enhanced (-)-α-bisabolol productivity by efficient conversion of mevalonate in Escherichia coli[J].Catalysts, 2019, 9(5):432.
[3] MA Y R, LI W J, MAI J, et al.Engineering Yarrowia lipolytica for sustainable production of the chamomile sesquiterpene (-)-α-bisabolol[J].Green Chemistry, 2021, 23(2):780-787.
[4] MU OZ-PÉREZ V M, ORTIZ M I, PONCE-MONTER H A, et al.Anti-inflammatory and utero-relaxant effect of α-bisabolol on the pregnant human uterus[J].The Korean Journal of Physiology &Pharmacology, 2018, 22(4):391-398.
OZ-PÉREZ V M, ORTIZ M I, PONCE-MONTER H A, et al.Anti-inflammatory and utero-relaxant effect of α-bisabolol on the pregnant human uterus[J].The Korean Journal of Physiology &Pharmacology, 2018, 22(4):391-398.
[5] BREHM-STECHER B F, JOHNSON E A.Sensitization of Staphylococcus aureus and Escherichia coli to antibiotics by the sesquiterpenoids nerolidol, farnesol, bisabolol, and apritone[J].Antimicrobial Agents and Chemotherapy, 2003, 47(10):3357-3360.
[6] KIM T Y, PARK H, KIM S K, et al.Production of (-)-α-bisabolol in metabolically engineered Saccharomyces cerevisiae[J].Journal of Biotechnology, 2021, 340:13-21.
[7] ALVES GOMES ALBERTTI L, DELATTE T L, SOUZA DE FARIAS K, et al.Identification of the bisabolol synthase in the endangered candeia tree (Eremanthus erythropappus (DC) McLeisch)[J].Frontiers in Plant Science, 2018, 9:1340.
[8] SUN W T, QIN L, XUE H J, et al.Novel trends for producing plant triterpenoids in yeast[J].Critical Reviews in Biotechnology, 2019, 39(5):618-632.
[9] ZHAO Y J, LI C.Biosynthesis of plant triterpenoid saponins in microbial cell factories[J].Journal of Agricultural and Food Chemistry, 2018, 66(46):12155-12165.
[10] JIANG Y K, XIA L, GAO S, et al.Engineering Saccharomyces cerevisiae for enhanced (-)-α-bisabolol production[J].Synthetic and Systems Biotechnology, 2023, 8(2):187-195.
[11] ANISENKO A, SHADRINA O, GARANINA I, et al.Transcriptome dataset of HEK293T cells depleted of one of the subunits of the DNA-PK complex:Ku70, Ku80 or DNA-PKcs[J].Data in Brief, 2021, 39:107596.
[12] CAI P, DUAN X P, WU X Y, et al.Recombination machinery engineering facilitates metabolic engineering of the industrial yeast Pichia pastoris[J].Nucleic Acids Research, 2021, 49(13):7791-7805.
[13] WENINGER A, HATZL A M, SCHMID C, et al.Combinatorial optimization of CRISPR/Cas9 expression enables precision genome engineering in the methylotrophic yeast Pichia pastoris[J].Journal of Biotechnology, 2016, 235:139-149.
[14] 厉晓波, 毛巧利, 代嘉懿, 等.一种产(-)-α-红没药醇的重组基因工程菌及其制备方法和用途:中国,CN115094015A[P].2022-09-23.
LI X B, MAO Q L, DAI J Y, et al. A recombinant genetic engineering bacterium producing (-)-α-bisabolol, its preparation method and use: China, CN115094015A[P]. 2022-09-23.
[15] L OKE M, KRISTJUHAN K, KRISTJUHAN A.Extraction of genomic DNA from yeasts for PCR-based applications[J].BioTechniques, 2017, 62(1):325-328.
OKE M, KRISTJUHAN K, KRISTJUHAN A.Extraction of genomic DNA from yeasts for PCR-based applications[J].BioTechniques, 2017, 62(1):325-328.
[16] CHENG B J, YU K Y, WENG X, et al.Impact of cell wall polysaccharide modifications on the performance of Pichia pastoris:Novel mutants with enhanced fitness and functionality for bioproduction applications[J].Microbial Cell Factories, 2024, 23(1):55.
[17] MORA-MONTES H M, BATES S, NETEA M G, et al.Endoplasmic reticulum alpha-glycosidases of Candida albicans are required for N glycosylation, cell wall integrity, and normal host-fungus interaction[J].Eukaryotic Cell, 2007, 6(12):2184-2193.
[18] 张懿玮, 徐明.Ku70的多样性功能及研究展望[J].国外医学.遗传学分册, 2004, 27(5):282-285;326.
ZHANG Y W, XU M.Diversity function and research prospect of Ku70[J].Foreign Medical Sciences, 2004, 27(5):282-285;326.
[19] DING L, WEN Y L, ZHANG X, et al.Transcriptional network constituted of CBP, Ku70, NOX2, and BAX prevents the cell death of necrosis, paraptosis, and apoptosis in human melanoma[J].Cell Death Discovery, 2021, 7(1):40.
[20] 李达, 沈雪莲, 李少华, 等.Ku70基因稳定敲除HeLa细胞株的建立及其生物学功能研究[J].生物技术通讯, 2018, 29(2):155-161.
LI D, SHEN X L, LI S H, et al.Establishment and biological function of Ku70 gene stably knockout HeLa cell lines[J].Letters in Biotechnology, 2018, 29(2):155-161.