食用受食源性致病菌污染的食物引起的食物中毒或疾病,严重危害着人类的健康,每年造成大量的经济损失和医疗负担[1]。大肠杆菌O157∶H7是一种常见的食源性胃肠道病原体,感染症状表现为腹泻、呕吐、肠出血,严重者影响肾脏,造成溶血性尿毒症。大肠杆菌O157∶H7是欧盟/欧洲经济区第三大最常报告的食源性人畜共患疾病,主要是通过人们接触或食用被污染水源灌溉的农产品、未彻底消毒的畜产品及乳制品等方式,造成多起食源性疾病爆发事件[2]。因此,迫切需要有效的杀菌技术控制食源性致病菌,尤其是大肠杆菌O157∶H7,以降低食品安全风险。
近年来,光动力疗法(photodynamic therapy,PDT)作为一种广谱、高效、环保、不易使细菌产生耐药性的冷杀菌技术受到食品行业关注[3]。PDT的机制是光敏剂经过特定波长光激发,由基态光敏剂转化为三重态光敏剂,根据活性氧(reactive oxygen species,ROS)产生方式分为2种类型,Ⅰ型机制是三重态光敏剂参与氢和/或电子转移产生自由基[例如羟自由基(·OH)和超氧阴离子自由基![]() 型机制是三重态光敏剂将能量转移到基态氧而产生单线态氧(1O2),ROS通过氧化作用破坏核酸、蛋白质及脂质等生物分子,从而达到灭活微生物的作用[3-4]。
型机制是三重态光敏剂将能量转移到基态氧而产生单线态氧(1O2),ROS通过氧化作用破坏核酸、蛋白质及脂质等生物分子,从而达到灭活微生物的作用[3-4]。
一般来说,医用光敏剂化合物是不可食用的,因此迫切需要寻找可食用光敏剂发挥PDT作用并将其应用于食品行业[1]。赤藓红,别名赤藓红B钠盐(erythrosine B,EB),是一种美国食品药品监督管理局和我国批准的食品着色剂,可用于光动力杀菌[5]。JIANG等[5]利用赤藓红的光动力杀菌用于口罩消毒;LIU等[6]将赤藓红置于弱酸性条件下从而质子化产生更多ROS,用于水净化。虽然赤藓红具有优异的光动力学特性,但亲水性阻碍了其对细胞的渗透[7],对细菌的吸附性较差。
噬菌体作为一种常见的天然抗菌剂,对特定的细菌具有高度特异性,能水解细菌细胞壁,对抗食品细菌腐败,同时不影响食品风味,在新鲜果蔬、乳制品、肉制品和食品包装材料中得到广泛研究和应用[8-9]。
利用噬菌体的特异性吸附和杀菌特性,可增加光敏剂对细菌的识别与吸附,增强杀菌效果。GANDRAN等[10]利用光敏剂和噬菌体偶联用于靶向杀灭癌细胞, ZHANG等[11]将具有聚集诱导发射效应(aggregation-induced emission, AIE)的AIE光敏剂偶联噬菌体纳米复合物用于加速愈合细菌感染伤口。应用于医药领域的光敏剂是否能食用并不明确,因此本文选择可食用光敏剂EB和噬菌体ZCFSTP4(P4)通过1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide,EDC]/N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)法制成偶联物(EBP),探究不同光照时间和EBP浓度对大肠杆菌O157∶H7的杀菌效果,研究其杀菌机制。旨在为新型非热杀菌技术在食品微生物安全领域的应用提供新的选择。
1 材料与方法
1.1 材料与试剂
大肠杆菌O157∶H7(NCTC12900),英国菌种保藏中心;恶臭假单胞菌由本实验室筛选分离得到;噬菌体为实验室筛选分离的能裂解大肠杆菌O157∶H7的烈性噬菌体ZCFSTP4(P4)(保藏号:CCTCC NO:M 20242503)。
EB(纯度85%),上海泰坦科技股份有限公司;TSA培养基、LB肉汤培养基,青岛海博生物技术有限公司;琼脂粉、盐酸,重庆朝友生物科技有限公司;氯化钠、无水乙醇(体积分数95%),重庆市钛兴化工试剂厂;MgSO4·7H2O,成都市科龙化工试剂厂;明胶,天津市大茂化学试剂厂;二甲基亚砜(dimethyl sulfoxide,DMSO)、1,3-二苯基异苯并呋喃(1,3-diphenylisobenzofuran,DPBF),重庆金喜鹊科技发展有限责任公司;PBS磷酸盐缓冲液(干粉),北京兰杰柯科技有限公司;2%磷钨酸,飞净生物科技有限公司;碘化丙锭(propidium iodide,PI),重庆跃翔化工有限公司;GelStain 核酸染料、全式金DNA提取试剂盒,北京全式金生物技术有限公司;Tris、SDS-PAGE凝胶试剂盒,索莱宝生物技术有限公司;考马斯亮蓝 R-250,生工生物工程(上海)股份有限公司;SM缓冲液,2.32 g NaCl、0.8 g MgSO4·7H2O和20 mL Tris-HCl(1 mol/L pH 7.5)、2 mL 2%(质量分数)明胶混匀后用纯水定容至400 mL;结晶紫染色液,上海泰坦科技股份有限公司。
1.2 仪器与设备
LED绿光灯(波长520~530 nm,功率50 W),优晶光电原厂;THZ-D型恒温摇床,江苏太仓市实验设备厂;SW-CJ-FD型超净工作台,苏州安泰空气技术有限公司;Mill-Q型纯水系统,美国默克密理博公司;U410型超低温冰箱,北京普析通用仪器有限责任公司;5810R型冷冻高速离心机,艾本德生命科学公司;SQP型电子天平,德国赛多利斯有限公司;MX-F型微型涡旋混合仪、DHP-9272型恒温培养箱,上海泸西分析仪器有限公司;YX280A型高压灭菌锅,上海三申医疗器械有限公司;SYNERGY H1酶标仪,美国伯腾仪器有限公司;Spectrum Two傅里叶变换红外光谱分析仪,珀金埃尔默股份有限公司;FD-1A-50真空冷冻干燥机,北京博医康实验仪器有限公司;F-4700荧光分光光度计、HT7800透射电子显微镜,日立公司;TU-1950双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;BX43正置荧光显微镜,奥林巴斯公司;18A10734化学发光成像系统,佰思恒科技有限公司;EMXplus-9.5/12电子顺磁共振波谱仪(electron paramagnetic resonance spectrometer,EPR),布鲁克公司。
1.3 实验方法
1.3.1 细菌培养和菌悬液的制备
从-80 ℃超低温冰箱取出大肠杆菌O157∶H7划线于TSA(tryptone soy agar contact plate)琼脂平板并倒置于37 ℃培养箱孵育16 h。用接种环挑取单菌落于20 mL LB肉汤中,在摇床以37 ℃、120 r/min培养16 h。然后用PBS将培养物调整OD600值至0.6。将培养物在4 ℃条件下以8 000×g离心5 min;用PBS洗涤2次,等体积PBS缓冲液重悬菌体。最终细菌计数约为108 CFU/mL。
1.3.2 噬菌体增殖及效价检测
从-80 ℃超低温冰箱取出P4,加入1 mL SM缓冲液,随后加入4 mL过夜培养的宿主菌和15 mL LB肉汤,混匀后以37 ℃、120 r/min培养16 h,得到噬菌体增殖液。将过夜培养的噬菌体增殖液在4 ℃下以8 000×g离心10 min,用0.22 μm滤膜将上清液过滤到离心管中。用噬斑法检测噬菌体的效价,取10 μL过滤后的增殖液滴在含有宿主菌的双层板中,倒置于37 ℃培养箱中孵育16 h,调整效价约为1010 PFU/mL。
1.3.3 光敏剂和光源
EB(0.008 8 g)溶于10 mL无菌水中制成1 mmol/L储备液,4 ℃避光保存。然后用0.22 μm的滤膜对该溶液进行过滤除菌。实验当天稀释储备液至需要的浓度使用。采用发射波长为520~530 nm的灯作为光源[12]。周围套一层黑色不透明材料,以防止外部光线进入,将96孔板中的样品置于距离光源10 cm的架子上。
1.3.4 EBP的制备与条件优化
1.3.4.1 EBP的制备
将178、311.5、445、667.5 μmol/L 的EB分别和0.19、0.33、0.47、0.7 mg EDC混合后在37 ℃,180 r/min条件下孵育1 h以活化EB中的羧基,之后分别加入93、163、233、350 μL β-巯基乙醇孵育1 h终止反应,依次分别加入0.27、0.47、0.67、1 mg NHS和5 mL噬菌体偶联2 h,偶联产物在截留分子质量为14 000的透析袋中透析24 h,除去未反应的小分子物质[10]。
1.3.4.2 EBP中EB和P4含量测定
用酶标仪测定0、5、10、20、30、40、50、90、100 μmol/L的赤藓红在526 nm处[6]的吸光度,制成标准曲线。通过测定EBP在526 nm处的吸光度,计算得到EBP中EB的浓度,之后以EBP中EB的浓度代表EBP的浓度。用噬斑法测定EBP中噬菌体的含量,将EBP进行10倍梯度稀释,分别取10 μL稀释液滴在含有宿主菌的双层板中,倒置于37 ℃培养箱中孵育16 h。
1.3.4.3 EBP光照时间优化
将EB储备液配制终浓度为15 μmol/L。按上述步骤,将混合溶液加入96孔板后于37 ℃避光孵育15 min后分别进行光动力处理0、30、40、50、60、70 min,同时设置PBS对照组。
1.3.4.4 EBP中EB的浓度优化
将制备的不同浓度的EBP和菌液按各自100 μL混合后加入96孔板后于37 ℃避光孵育15 min后,进行光动力处理60 min,同时设置PBS对照组。
1.3.4.5 优化后EBP的抑菌效果
将15 μmol/L EBP和等浓度的EB以及P4分别取100 μL和100 μL菌液混合,PBS作为对照组,避光孵育15 min之后,EB和EBP组光照60 min,PBS对照组和P4组无光照处理60 min。
1.3.4.6 菌落总数测定
绿光照射结束后,立刻从96孔板中取出100 μL的样品,在棕色离心管中进行10倍梯度稀释,取10 μL 不同梯度的稀释液滴在TSA平板上,待其干燥后倒置于37 ℃的培养箱中孵育16 h。平板计数以菌落形成单位(CFU/mL)表示。
1.3.5 EBP表征
1.3.5.1 紫外可见吸收光谱和荧光光谱测定
用双光束紫外可见分光光度计分别测试EB、P4和EBP在300~700 nm波长的紫外可见吸收光谱。用荧光分光光度计测EB和EBP的荧光光谱,激发波长为490 nm[13]。
1.3.5.2 傅里叶变换红外光谱测定
将样品真空冷冻干燥24 h之后,用傅里叶红外变换光谱仪分别测试P4、EB和EBP的化学结构,检测分辨率为4 cm-1,扫描次数为16,扫描范围为4 000~600 cm-1[14]。
1.3.5.3 透射电镜(transmission electron microscope,TEM)检测EBP和P4中的噬菌体形态
通过TEM观察噬菌体的形态。参考张春芝等[15]的方法,将EBP和P4分别加入200目碳涂层铜网格中,5 min后加入2%磷钨酸(pH 7.0)负染1 min,自然风干后通过TEM观察噬菌体形态。
1.3.6 靶向性实验
1.3.6.1 EBP噬菌斑实验
先制备双层板,即第一层板是TSA板,第二层板是500 μL的菌液和4.5 mL的LB ager混合液。取经过10倍梯度稀释的EBP 10 μL滴加到双层板上,待自然风干后,倒置于培养箱中,在37 ℃下过夜培养后,计算噬菌体效价。
1.3.6.2 EBP荧光靶向实验
调整菌液浓度约108 CFU/mL,将菌液(包括大肠杆菌O157∶H7和恶臭假单菌)分别和EBP等体积混合,孵育30 min, 将混合物离心(10 000×g,4 ℃,3 min),洗涤沉淀2次并重悬于PBS中。在荧光显微镜下观察样品[16]。
1.3.7 ROS检测
1.3.7.1 ROS产生能力检测
参考YUE等[17]的方法,通过DPBF来检测EBP、EB的ROS产生能力,将DPBF溶于DMSO中,配制成330 μg/mL的DPBF溶液。将100 μL样品加入2 mL DPBF溶液中混合,混合物用520~530 nm绿光照射,每照射1 min,用酶标仪检测DPBF的吸收光谱。空白对照为PBS缓冲液。
1.3.7.2 ROS种类检测
参考沈慧颖[14]的方法,利用EPR采集P4、EB和EBP在捕获剂2,2,6,6-四甲基-4-哌啶酮(4-oxo-tempo,TEMPONE)和5,5-二甲基-1-吡咯啉-N-氧化物,5,5-dimethyl-1-pyrroline N-oxide,DMPO)溶液中产生的ROS (1O2和![]() 信号。具体操作如下:将冷冻干燥后的P4、EB和EBP粉末分别加入10 mmol/L溶剂为PBS的TEMPONE溶液(检测1O2)或100 mmol/L溶剂为二甲基亚砜的DMPO溶液(检测
信号。具体操作如下:将冷冻干燥后的P4、EB和EBP粉末分别加入10 mmol/L溶剂为PBS的TEMPONE溶液(检测1O2)或100 mmol/L溶剂为二甲基亚砜的DMPO溶液(检测![]() 中,取200 μL混合液加入96孔板中。随后,将含有EB和EBP的96孔板在绿灯下(520~530 nm,样品距离:10 cm)照射10 min,P4组做无光处理,用毛细管取少量照射后的溶液放入核磁管固定在波谱仪谐振腔中进行测试。
中,取200 μL混合液加入96孔板中。随后,将含有EB和EBP的96孔板在绿灯下(520~530 nm,样品距离:10 cm)照射10 min,P4组做无光处理,用毛细管取少量照射后的溶液放入核磁管固定在波谱仪谐振腔中进行测试。
1.3.8 细胞膜损伤研究
1.3.8.1 细胞膜通透性检测
将1.3.4.5节中4组不同方法处理后的菌液与PI染料(30 μg/mL)在4 ℃下在黑暗中孵育20 min。将混合物在4 ℃以10 000 r/min离心5 min,洗涤沉淀2次并重悬于PBS中。在荧光显微镜下观察样品。
1.3.8.2 细胞质渗漏测试
根据LAI等[18]的方法,将1.3.4.5节中4组不同方法处理后的细菌悬浮液通过孔径为0.22 μm的滤膜过滤。收集滤液,测定其在260、280 nm处的吸光度。
1.3.8.3 琼脂糖凝胶电泳
琼脂糖凝胶电泳用于评估细菌的DNA损伤。分别取1 mL 1.3.4.5节中4组不同方法处理后的菌悬液,使用全式金DNA试剂盒提取细菌DNA。提取物用1% 琼脂糖凝胶电泳分离,用GelStain核酸染料染色,用化学发光成像系统拍照记录。
1.3.8.4 SDS-PAGE
分别取1 mL 1.3.4.5节中4组不同方法处理后的菌悬液在4 ℃下以10 000×g离心1 min,将细菌沉淀收集在1.5 mL 离心管中。弃去上清液,将每个沉淀重新悬浮在40 μL的1×SDS 凝胶加载缓冲液中,然后在沸水中加热3 min。再次将样品在4 ℃下以10 000×g离心1 min,并在12% SDS-PAGE上分析上清液。电泳后,用考马斯亮蓝对凝胶进行染色[18]。
1.4 数据处理与统计分析
利用Microsoft Excel 2010对试验数据进行统计与整理,Origin 2018软件作误差图,SPSS 27.0软件对数据进行方差及显著性比较(P<0.05)。所有试验均进行3次重复。
2 结果与分析
2.1 EBP杀菌的条件优化
2.1.1 EBP中EB和P4的含量
根据EB在526 nm处的标准曲线:y=0.022 7x+0.031 5(图1),通过酶标仪测量得到不同EBP在526 nm处的吸光度分别为:0.122、0.190、0.259、0.372,可以计算得到合成的不同EBP浓度分别为4、7、10、15 μmol/L。如图2所示,不同浓度EBP中的噬菌体能存活,与原噬菌体相比,在偶联过程中减少约1 lg PFU/mL,说明偶联过程对噬菌体浓度的影响较小。
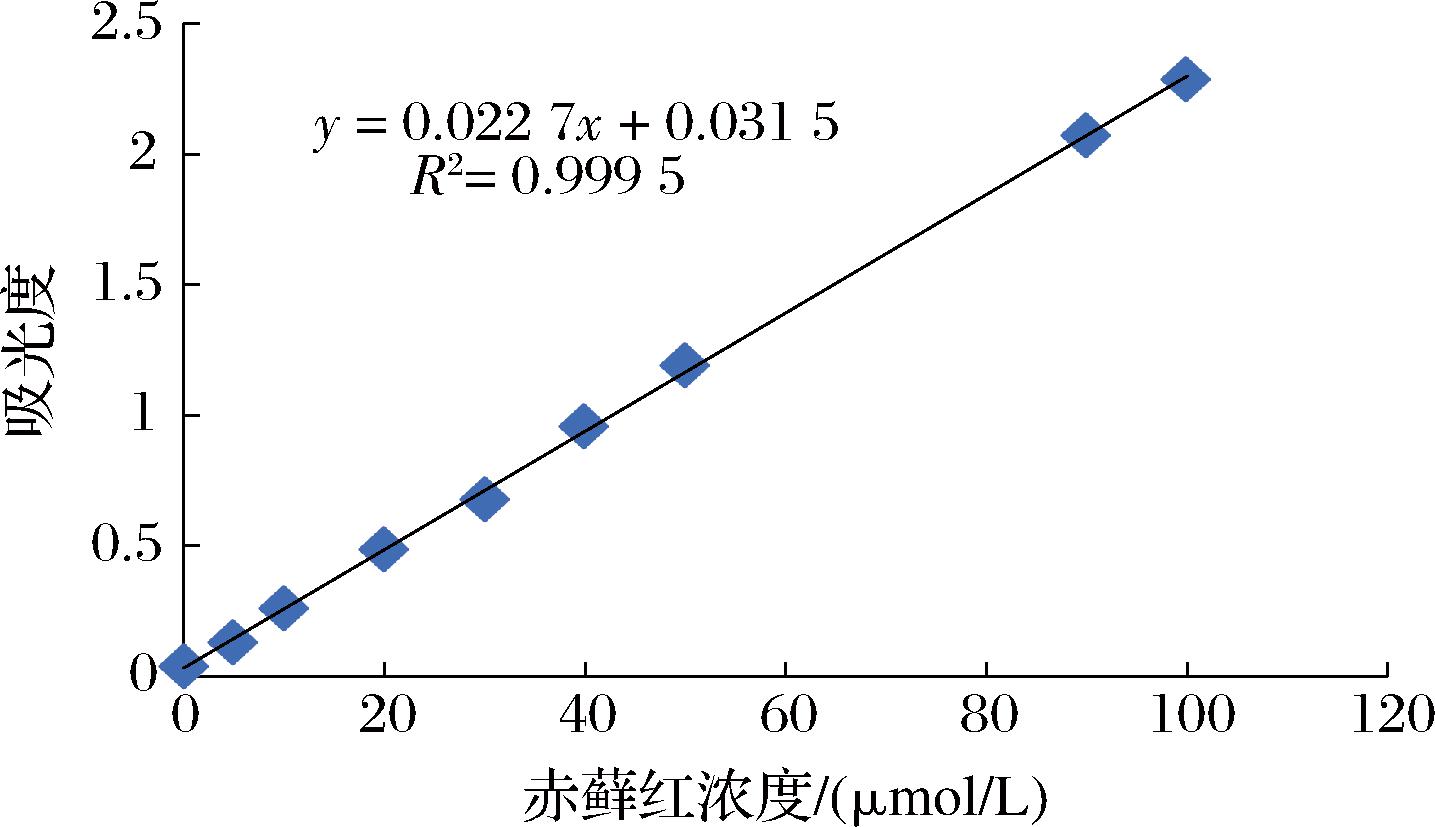
图1 EB浓度标曲图
Fig.1 Standard plot of EB concentration

图2 不同浓度EBP中噬菌体的浓度
Fig.2 The concentrations of phages in different concentrations of EBP
2.1.2 光照时间对PDT作用的影响
光敏剂在特定波长光的照射下发挥PDT作用,光照时间对PDT作用具有重要影响,评估不同光照时间对大肠杆菌O157∶H7光动力杀菌效果的影响。如图3所示,与对照组相比,当加入15 μmol/L的EB且光照时间为10~70 min时,PDT对大肠杆菌O157∶H7总菌量随着光照时间的延长而减少,表明杀菌效果随着光照时间的延长而增强,在60 min时,EB有明显的抑菌效果;但在70 min时,仅光照就会对大肠杆菌O157∶H7造成显著伤害,这可能是由于长时间光照将光能转换为热能,光热效应导致细菌总量减少[1,19]。因此选择60 min作为最佳杀菌条件。
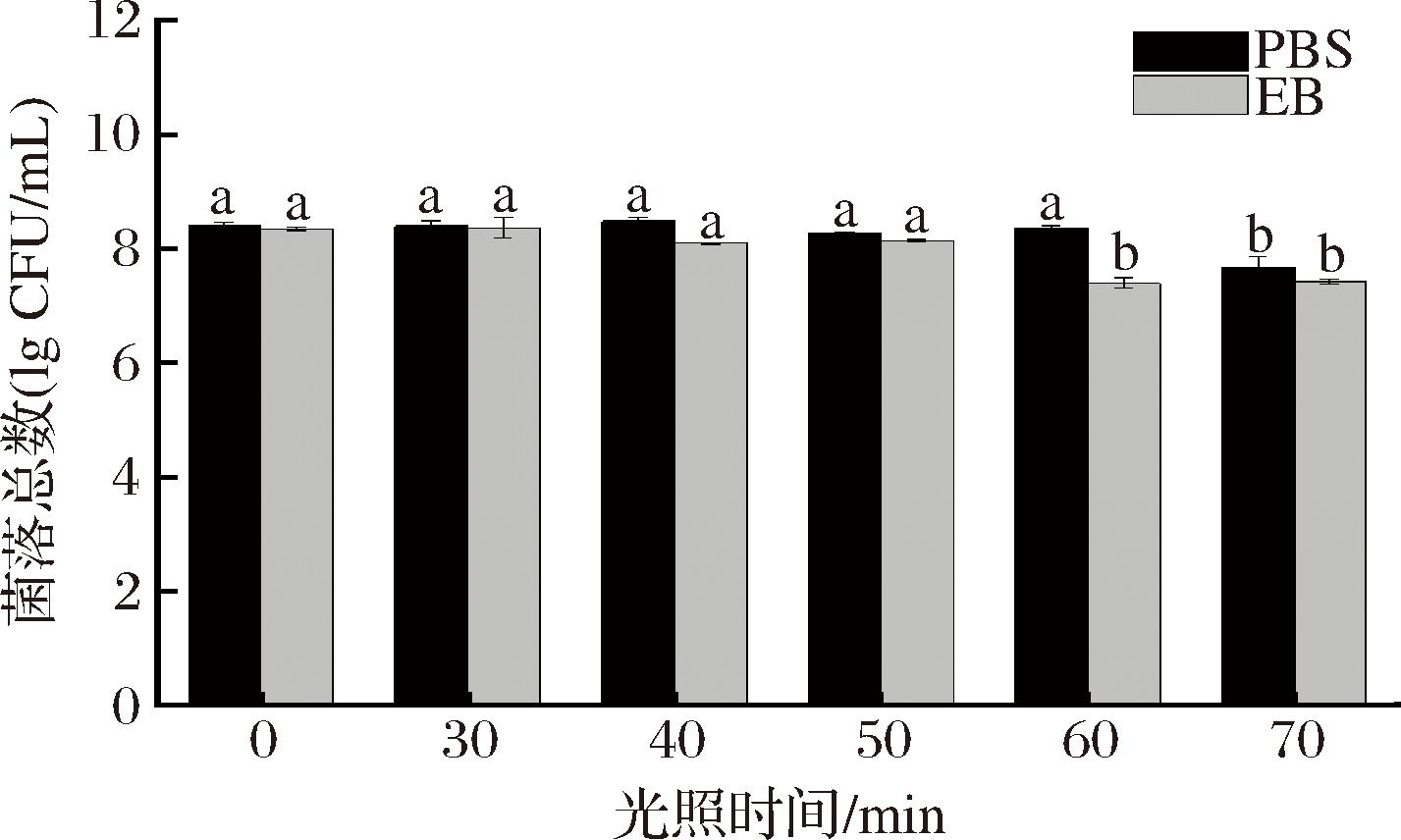
图3 不同光照时间对大肠杆菌O157∶H7 PDT作用的影响
Fig.3 Effect of different illumination time on PDT Escherichia coli O157∶H7
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.1.3 EBP中EB的浓度对PDT作用的影响
选择最佳光照时间60 min,评估了不同EBP浓度对大肠杆菌O157∶H7的光动力杀菌效果。如图4所示,大肠杆菌O157∶H7菌落总数随着EBP浓度的增加而减少,说明杀菌效果随着EBP浓度的增加而增强,其中15 μmol/L的EBP的杀菌效果最好,因此选择15 μmol/L的EBP进行后续实验。
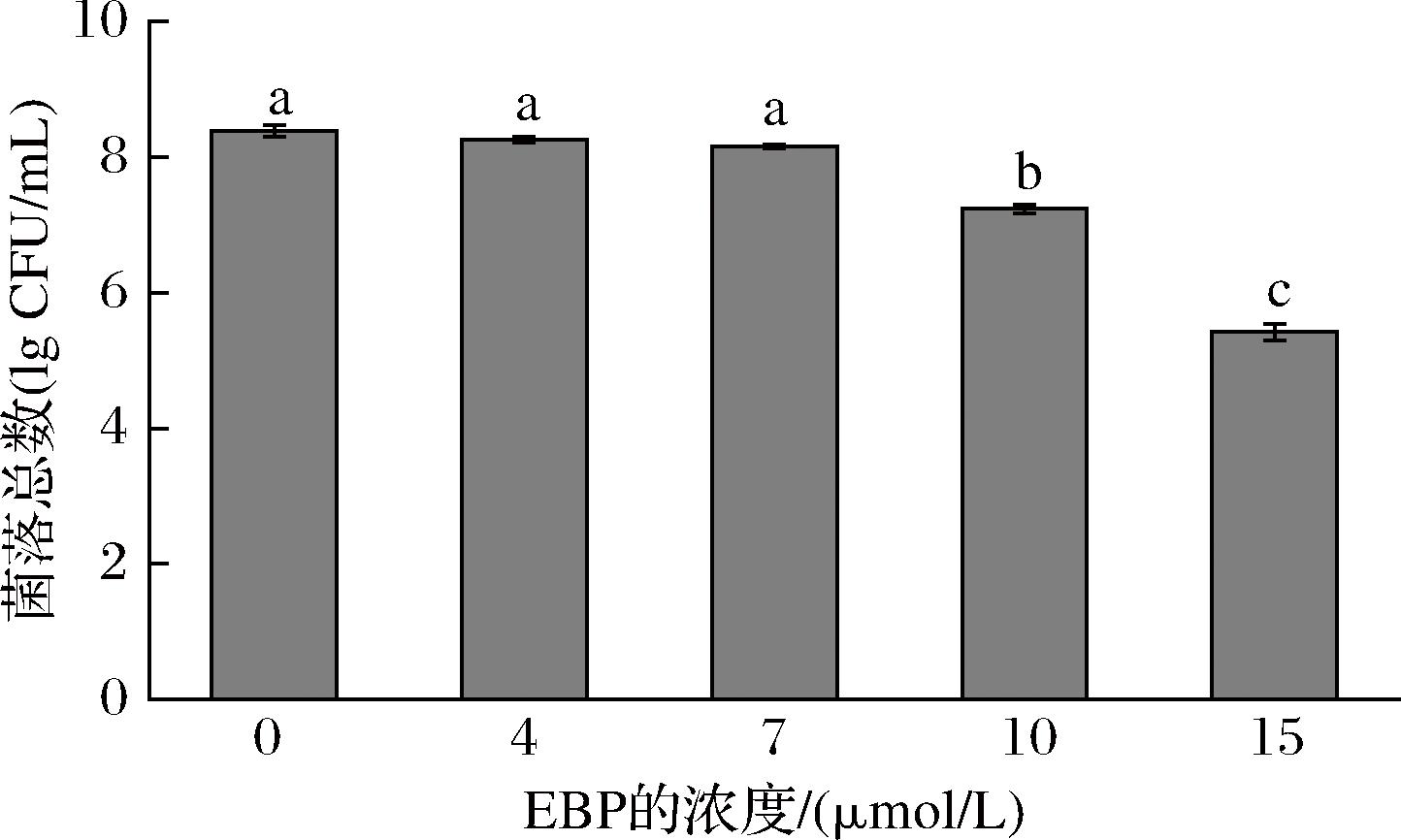
图4 不同EBP浓度对PDT作用的影响
Fig.4 Effect of different EBP concentrations on PDT
2.1.4 优化条件后的EBP杀菌效果
选择最佳杀菌条件,即15 μmol/L EBP与60 min的光照时间,对菌液进行PDT处理。如图5所示,与对照组相比,P4、EB和EBP均能使细菌总数减少。其中P4能使菌落总数减少0.7 lg CFU/mL,EB能使菌落总数减少1.04 lg CFU/mL,EBP能使菌落总数减少3.16 lg CFU/mL。菌落总数的减少可以直观反映杀菌物质的杀菌效果,实验结果表明与仅使用P4和EB的对照组相比,EBP的杀菌效果最显著,且具有协同杀菌效果。
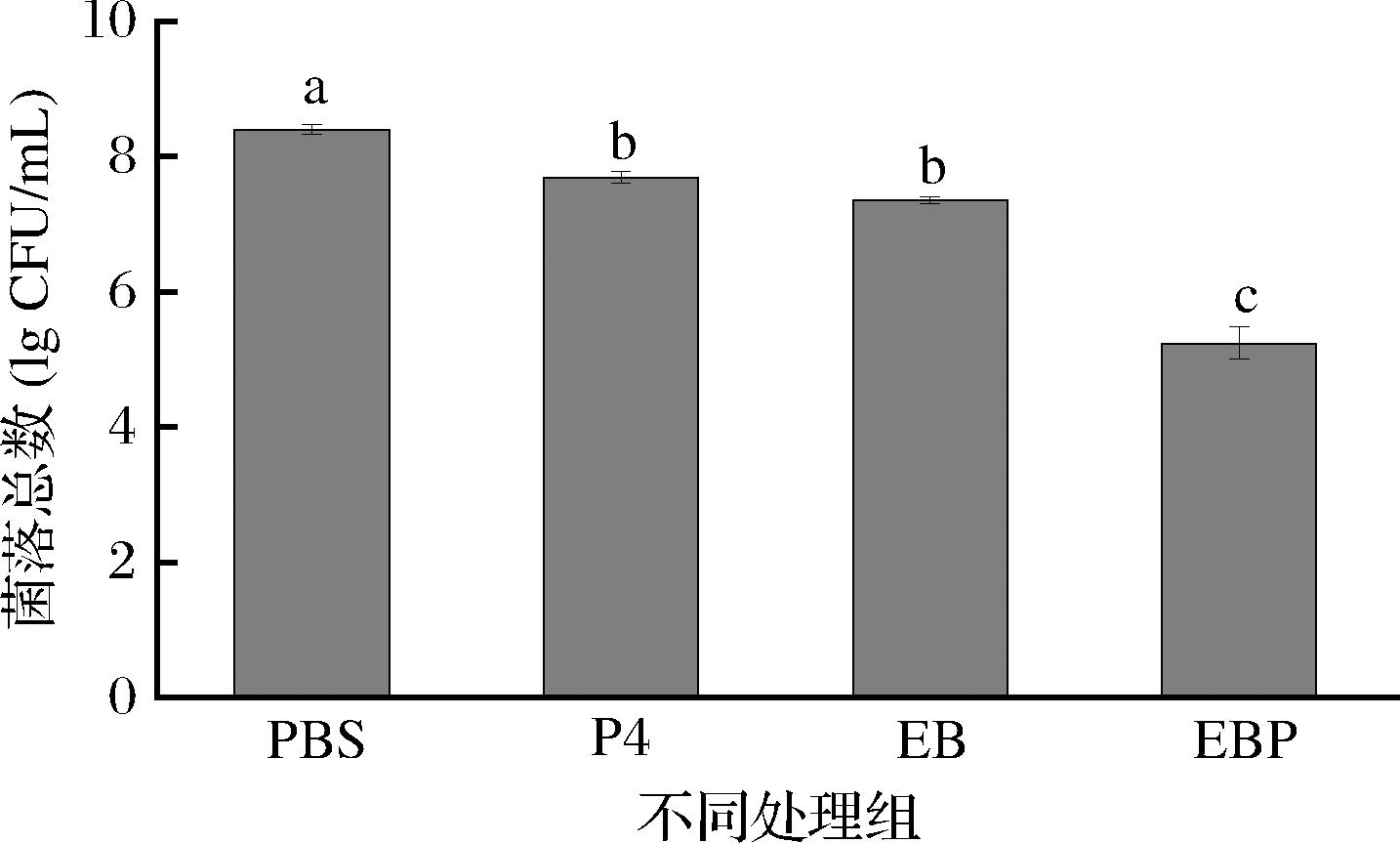
图5 不同处理组对大肠杆菌O157∶H7的杀菌效果
Fig.5 Bactericidal effect of different treatment groups on E.coli O157∶H7
2.2 EBP的表征
偶联物可以利用紫外可见吸收光谱、荧光光谱、红外光谱、透射电子显微镜等检测进行表征[10-11]。
紫外可见吸收光谱(图6-a)表明,EBP在288、526 nm处具有很强的吸收峰,这分别来自P4在288 nm处的吸收峰和EB在526 nm处的吸收峰,与GANDRAN等[10]光敏剂与纳米噬菌体偶联的紫外可见吸收光谱表征结果相似。当光发射波长范围与物质的吸收范围一致时,光敏剂能够发挥光动力杀菌作用[20],EBP与EB一样在526 nm左右具有吸收峰,其在本实验光照条件(520~530 nm)内,说明在本实验光照条件下,EBP能够发挥PDT作用。
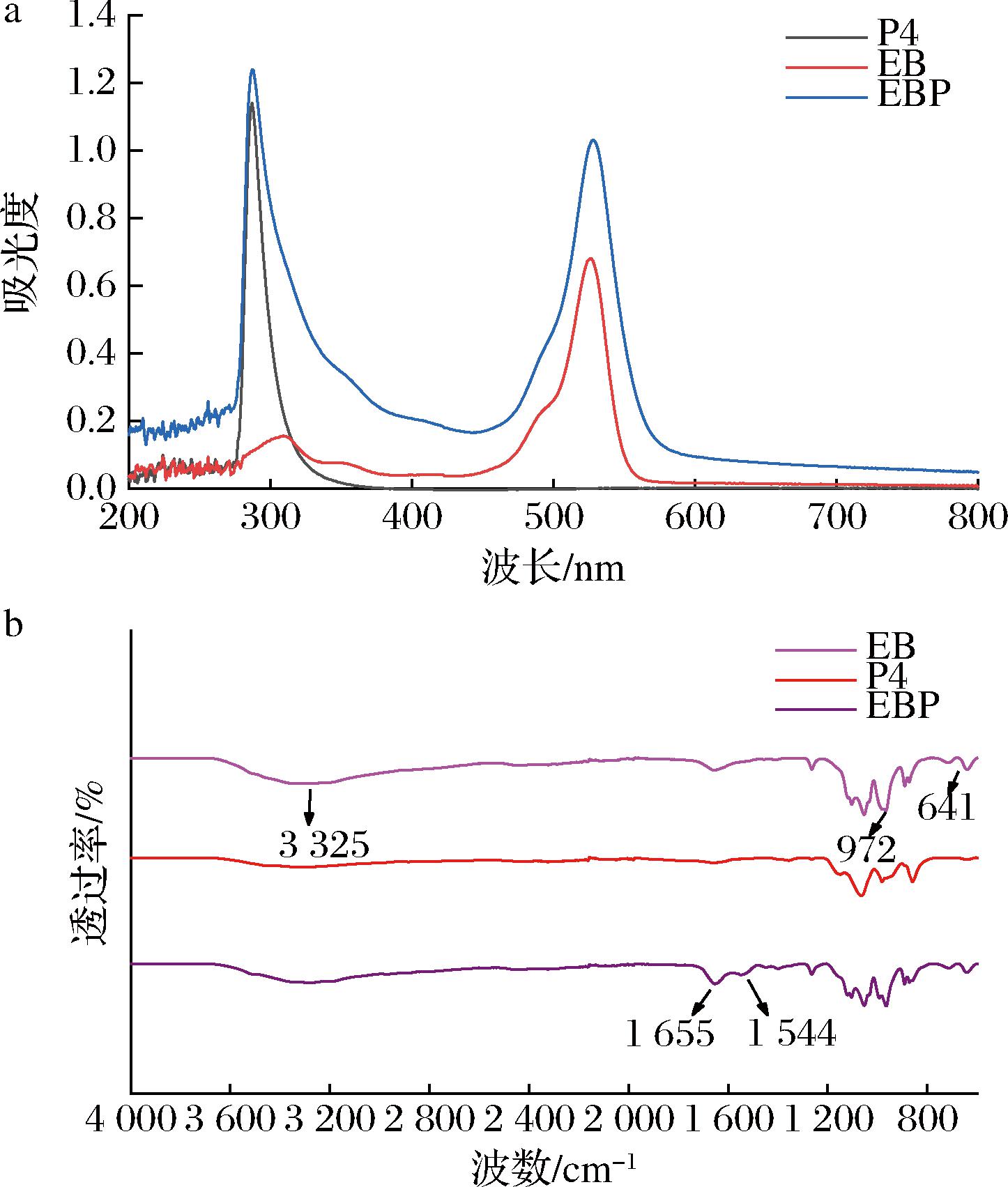
a-紫外可见吸收光谱;b-傅里叶变换红外光谱
图6 EBP、EB和P4的紫外可见吸收光谱、傅里叶变换红外光谱
Fig.6 UV-visible absorption spectra and Fourier transform infrared spectra of EBP, EB, and P4
在红外光谱中(图6-b),EB图谱具有典型的红外光谱特征峰,3 325 cm-1与分子内—OH基团振动相对应,与其亲水性有关,974、641 cm-1处的振动来自EB的C—I键[21-22];与噬菌体偶联之后,EBP出现了新的峰1 544 cm-1,1 544 cm-1处代表酰胺伸缩振动峰,且1 655 cm-1酰胺Ⅰ峰处强度增大,证明了酰胺键形成增多[23-24],这可能是EB和P4通过EDC/NHS法形成酰胺键连接在一起,导致酰胺键增多。
如图7所示,在490 nm波长光的激发下,EBP和EB都在553 nm左右具有特征峰,具有一致的荧光发射光谱,与马超群[13]研究的赤藓红荧光光谱结果一致,说明在特定光照射下EBP具有发荧光的能力。
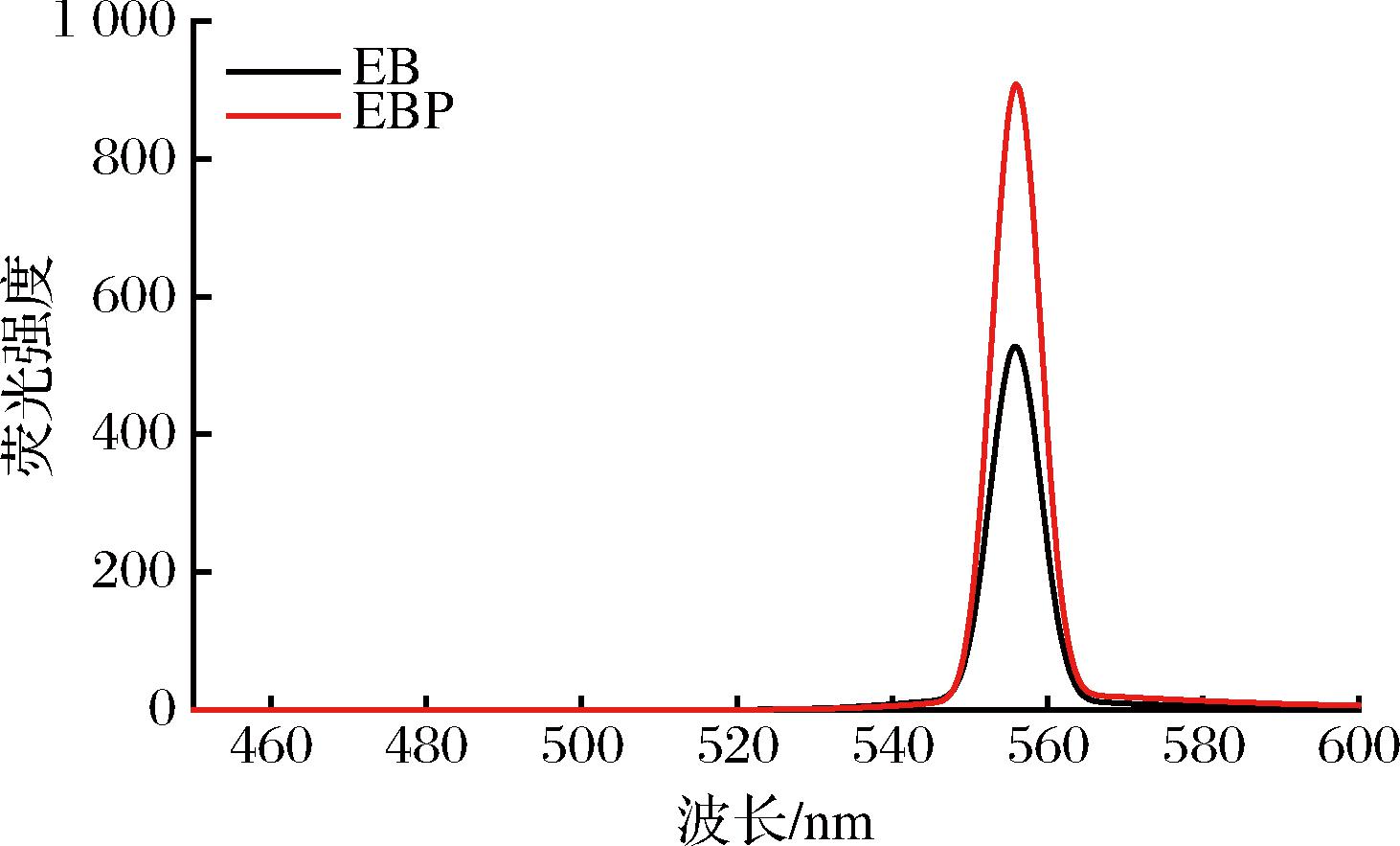
图7 EBP和EB的荧光光谱图
Fig.7 Fluorescence spectra of EBP and EB
EBP里的噬菌体(图8-a)和原始噬菌体(图8-b)的形态相似,表明合成过程对P4的伤害不大,与上述测EBP中噬菌体浓度结果一致,说明EBP保持了P4的噬菌体活性。该结果与ZHANG等[11]将AIE光敏剂偶联噬菌体纳米复合物制备的偶联物测噬菌体形态结果相似。
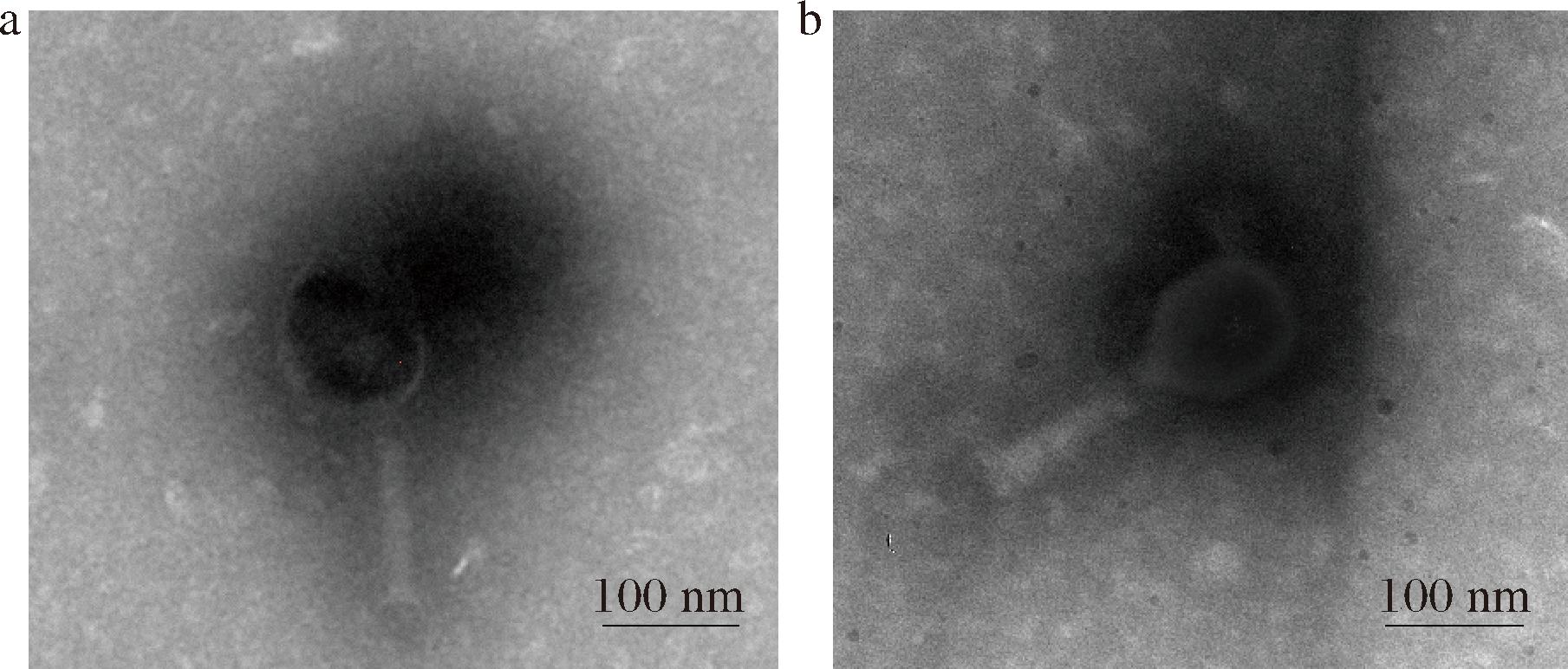
a-EBP;b-P4
图8 EBP和P4的TEM图
Fig.8 TEM images of EBP and P4
以上表征结果表明,EBP合成成功。
2.3 靶向性实验
图9双层板实验结果显示,EBP能裂解大肠杆菌O157∶H7,从而产生透亮的噬菌斑,效价约109 PFU/mL,不能对恶臭假单胞菌产生透明噬菌斑;如果是噬菌体的宿主菌,就能出现透亮的噬菌斑,说明EBP能裂解大肠杆菌O157∶H7,不能裂解恶臭假单胞菌,因此大肠杆菌O157∶H7是EBP的宿主菌。如图10所示,在荧光显微镜蓝光照射下,大肠杆菌O157∶H7能出现发出绿色荧光,而恶臭假单胞菌不能发出绿色荧光;EBP能在蓝光照射下发出绿色荧光,这与荧光光谱实验结果一致,因此能被EBP特异性识别吸附的细菌在蓝光激发下可以发出绿色荧光;说明荧光靶向实验结果表明,EBP的宿主是大肠杆菌O157∶H7,该实验结果与RAN等[16]将阳离子光敏剂和噬菌体偶联用于荧光靶向识别鲍曼不动杆菌结果类似。荧光靶向性实验和传统的双层板实验结果一致,证明了EBP能够特异性识别偶联物中的宿主菌。
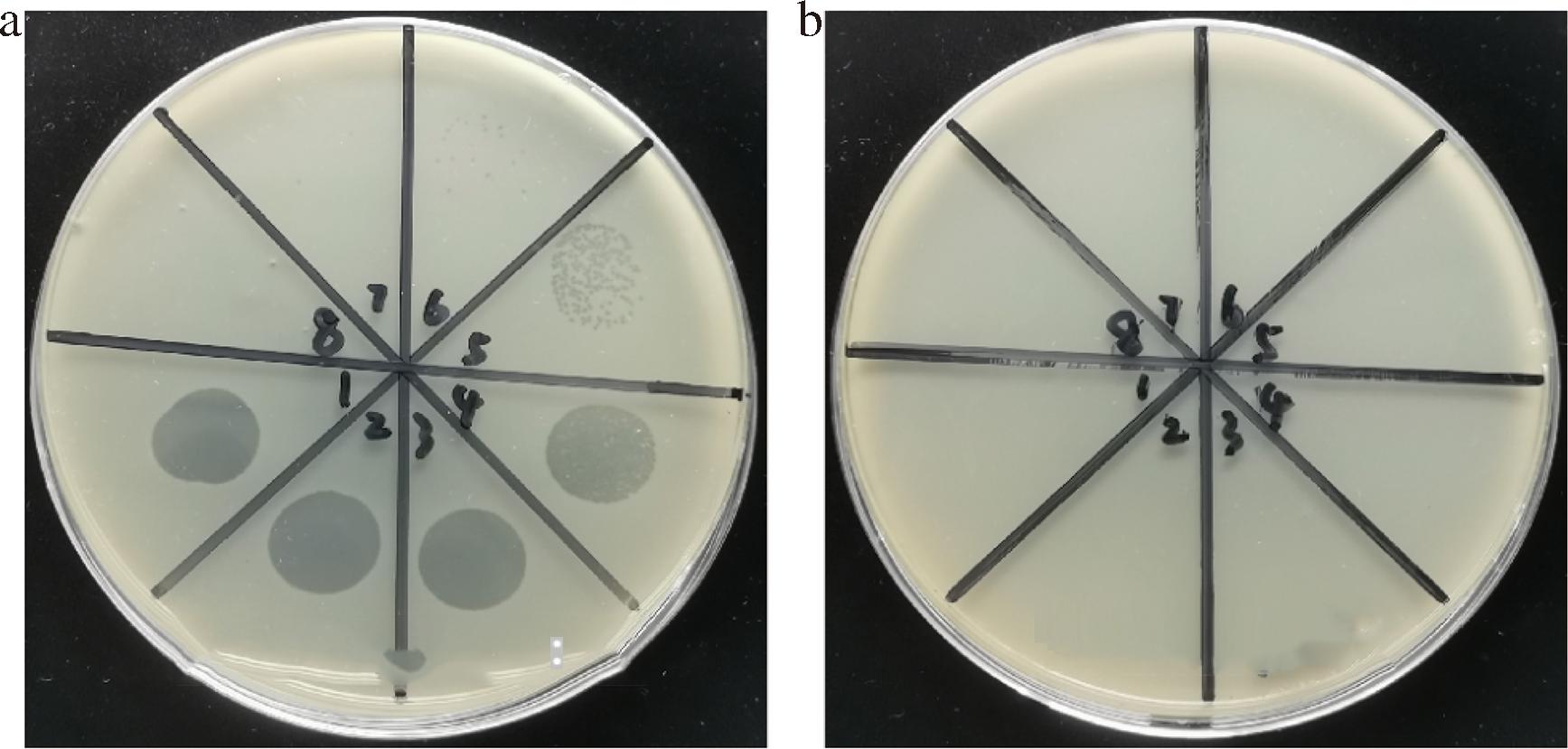
a-大肠杆菌O157∶H7;b-恶臭假单胞菌
图9 EBP分别对大肠杆菌O157∶H7和恶臭假单胞菌的噬菌体浓度测定
Fig.9 Determination of phage concentrations for EBP against E.coli O157∶H7 and Pseudomonas putida

图10 EBP荧光靶向识别细菌图
Fig.10 Diagram of the targeted recognition of bacteria by EBP fluorescence
2.4 ROS检测
2.4.1 ROS产生能力检测
PDT通过产生ROS灭活微生物,因此,EBP的ROS产生能力至关重要。DPBF与ROS结合,被不可逆氧化,在415 nm左右的吸光度降低,常被用做检测ROS的试剂[17]。在不同时间间隔的绿光照射下,与EB和EBP相比,对照组中的吸光度未见明显下降(图11-a和图11-d),说明DPBF的降解基本不受光照的影响;EB和EBP组的吸光度呈下降趋势且趋势一致(图11-b和图11-c),光照一开始,吸光度降低,随着时间的延长,进一步下降(图11-d),该结果与LU等[25]测多功能壳聚糖功能化磁性ce6纳米颗粒ROS产生能力结果相似,表明EBP在绿光照射下具有产生ROS的能力,即P4与EB偶联不会影响ROS的产生。
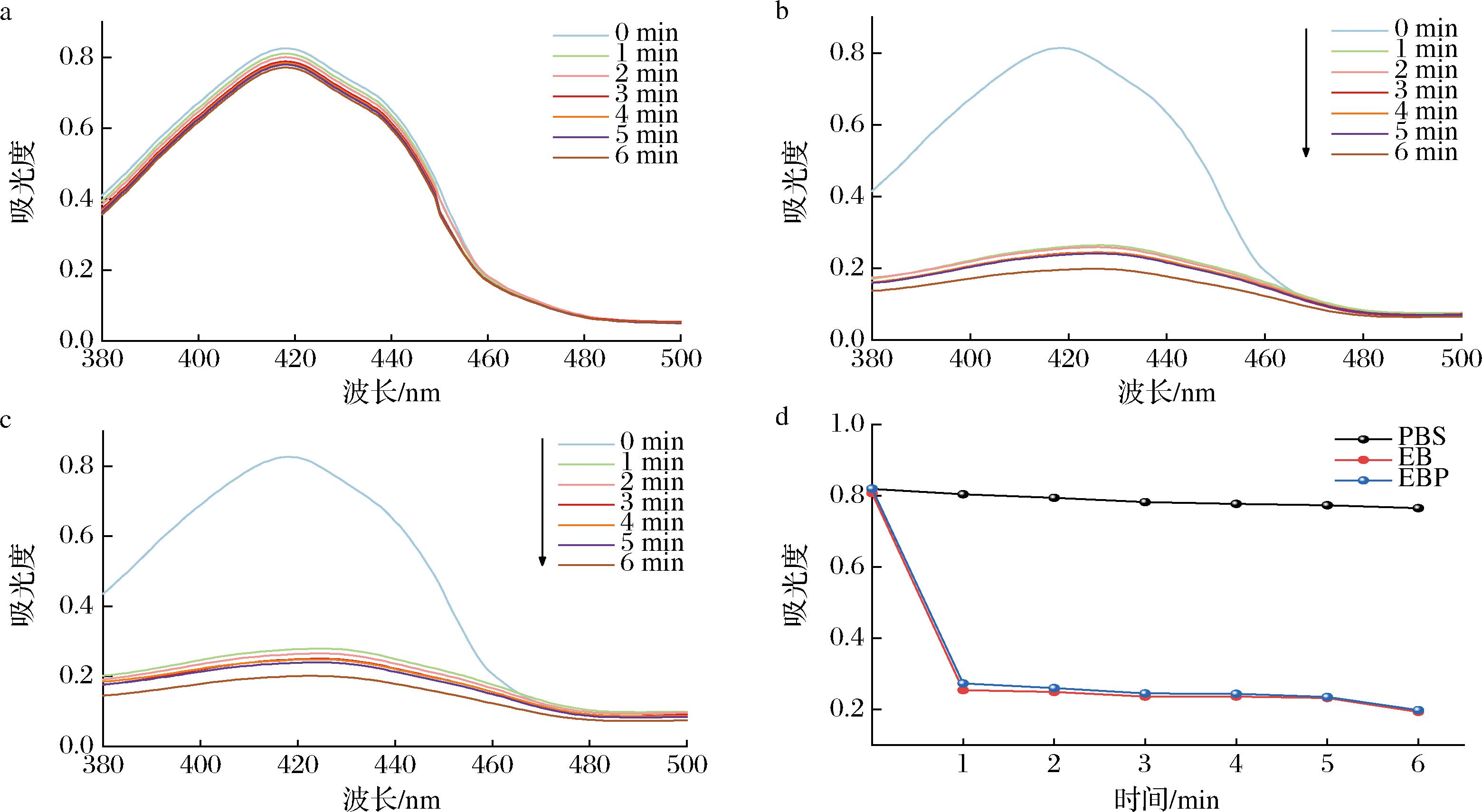
a-对照组吸收光谱;b-EB吸收光谱;c-EBP吸收光谱;d-415 nm吸光度的变化趋势
图11 光照期间EB、EBP和对照组对DPBF的影响以及其在415 nm吸光度变化曲线
Fig.11 Effect of EB, EBP, and blank on DPBF during illumination and its absorbance change curve at 415 nm
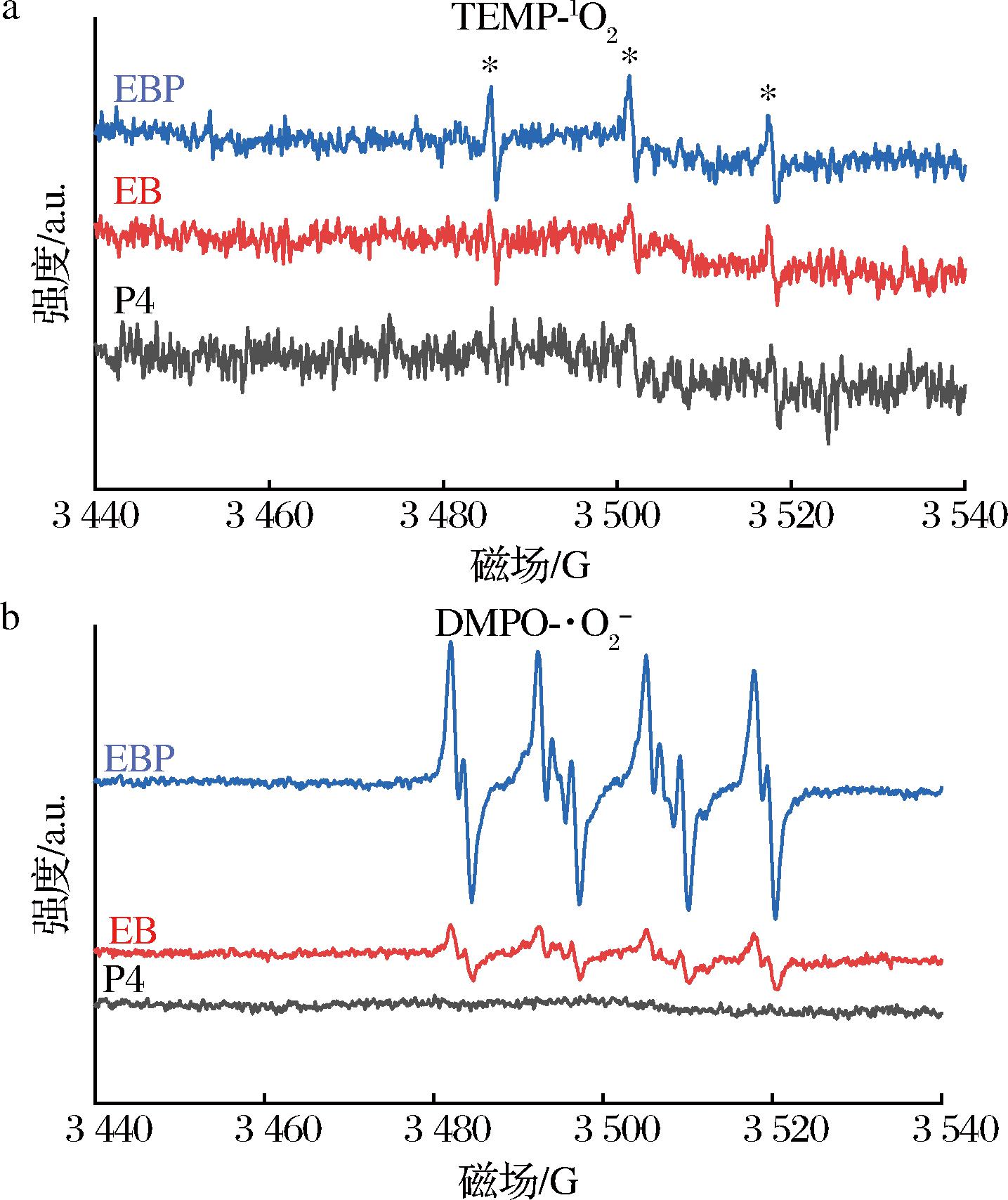
a-TEMP-1O2信号图,![]() 信号图
信号图
图12 分别以TEMPONE和DMPO为捕获剂通过EPR测定EB、EBP和P4得到的信号图
Fig.12 Signal maps obtained by EPR determination of EB, EBP, and P4 using TEMPONE and DMPO as capture agents, respectively
2.4.2 ROS种类检测
ROS的种类反映该物质主要是依靠Ⅰ或/和Ⅱ型机制产生ROS发挥PDT作用[4]。使用EPR对材料产生的自由基信号进行检测(图12)。TEMPONE可以捕获1O2产生加合物TEMP-1O2;DMPO可以捕获![]() 产生加合物
产生加合物![]() 可以通过检测 TEMP-1O2和
可以通过检测 TEMP-1O2和![]() 加合物的 EPR 信号,判断EBP、EB和P4中是否有单线态氧和
加合物的 EPR 信号,判断EBP、EB和P4中是否有单线态氧和![]() 的生成[14]。如图12-a所示,P4信号图中没有观察到明显的信号,在EB和EBP的信号图中,都产生了强度为1∶1∶1的三重EPR信号,证明了1O2的存在;而EBP的信号强度高于EB,可能是由于偶联导致的,EBP中还存在除1O2以外的其他物质氧化TEMP产生信号[26]。在图12-b中,P4信号图中没有观察到明显的信号峰,EB 和EBP的信号图中,AN为12~13 G,AHβ在10 G左右,是
的生成[14]。如图12-a所示,P4信号图中没有观察到明显的信号,在EB和EBP的信号图中,都产生了强度为1∶1∶1的三重EPR信号,证明了1O2的存在;而EBP的信号强度高于EB,可能是由于偶联导致的,EBP中还存在除1O2以外的其他物质氧化TEMP产生信号[26]。在图12-b中,P4信号图中没有观察到明显的信号峰,EB 和EBP的信号图中,AN为12~13 G,AHβ在10 G左右,是![]() 的EPR典型特征信号,与朱温平[27]检测
的EPR典型特征信号,与朱温平[27]检测![]() 观察到的信号相似,证明了
观察到的信号相似,证明了![]() 的存在;而EBP的信号强度高于EB,可能是由于EB和EBP产生
的存在;而EBP的信号强度高于EB,可能是由于EB和EBP产生![]() 信号峰的时间不同导致的[26-27]。以上结果表明,EBP和EB一样,都是同时通过 Ⅰ 型
信号峰的时间不同导致的[26-27]。以上结果表明,EBP和EB一样,都是同时通过 Ⅰ 型![]() 和Ⅱ型(1O2)2种机制产生ROS,从而发挥PDT作用。
和Ⅱ型(1O2)2种机制产生ROS,从而发挥PDT作用。
2.5 细菌细胞膜的损伤研究
2.5.1 细菌细胞膜通透性变化
PDT通过产生ROS改变细胞膜通透性,PI是一种核酸染料,可穿透受损的细胞膜,使细胞发出红色荧光,因此它反映了细胞膜的通透性[1]。如图13所示,PBS对照组没有红色荧光,EB和P4处理组各有不同程度的红色荧光出现,EBP处理的细胞能观察到的红色荧光最多。观察到的红色荧光表明细菌细胞膜受到破坏,导致PI染料进入细胞。这证实了与其他对照组相比,EBP对细胞膜的破坏最显著。与ZHANG等[1]通过叶绿素铜钠对大肠杆菌的发挥PDT作用,对细胞膜的损伤越严重,观察到的红色荧光越多的结果一致。
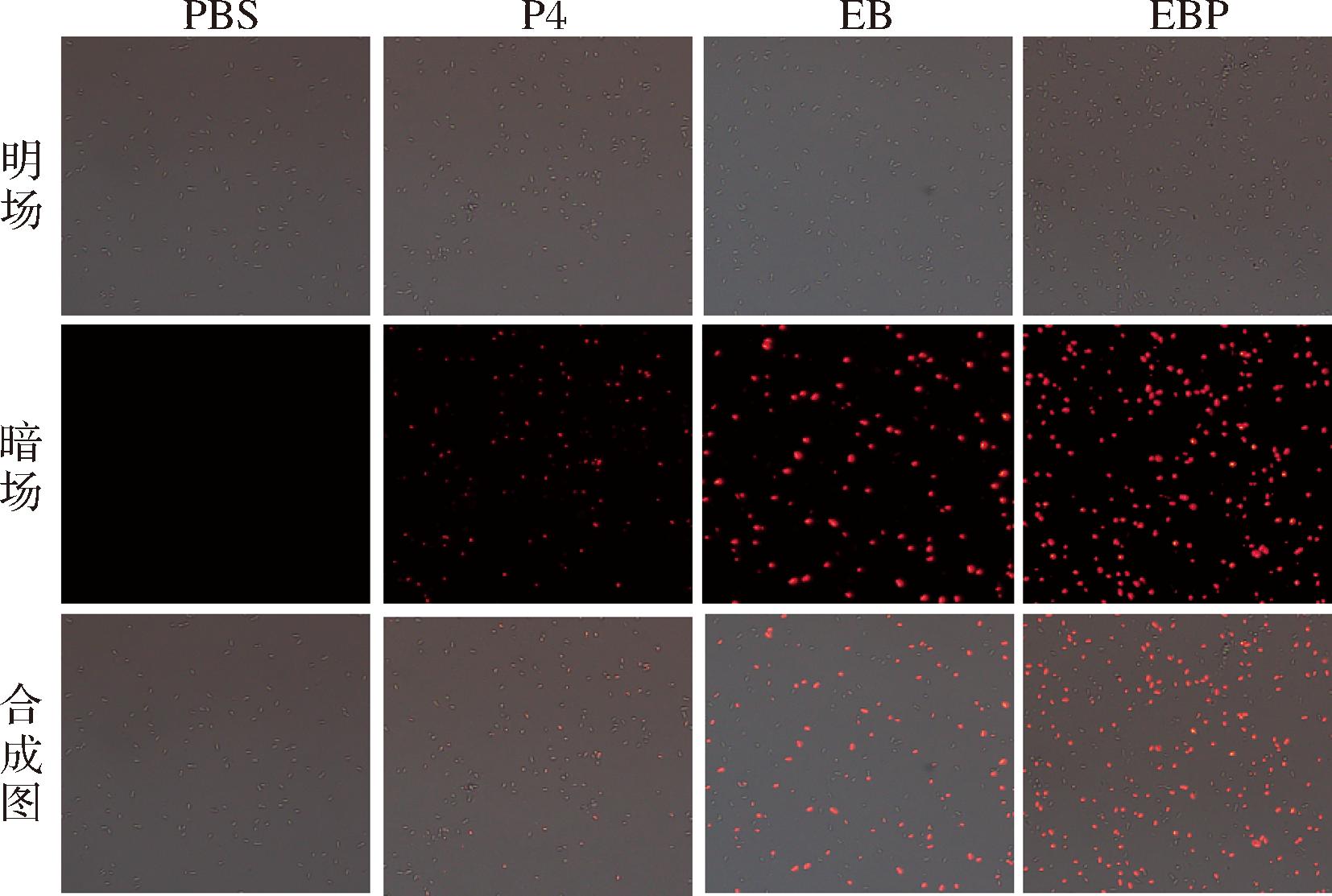
图13 荧光显微镜下显示不同对照组处理后细胞膜通透性变化
Fig.13 Changes in cell membrane permeability after treatment with different control groups under fluorescence microscopy
2.5.2 细菌细胞内容物外漏
经过光动力杀菌处理后,细胞膜完整性被破坏,导致细菌的细胞膜通透性改变,造成菌体内的DNA、蛋白等生物大分子渗漏[18],通过测定上清液中的核酸、蛋白质含量可以评估细胞膜的完整性。260 nm处的吸光度值与核酸浓度成正比,280 nm处的吸光值和蛋白质浓度成正比,如图14所示,EBP组、EB组和P4组的吸光度值均比对照组大,其中EBP组具有显著差异,表明EBP充分发挥了PDT作用,导致细菌DNA和蛋白质外漏现象明显。与YAN等[28]以姜黄素制备碳量子点光动力杀菌发挥PDT作用破坏细胞结构,导致细胞质泄露结果相似。
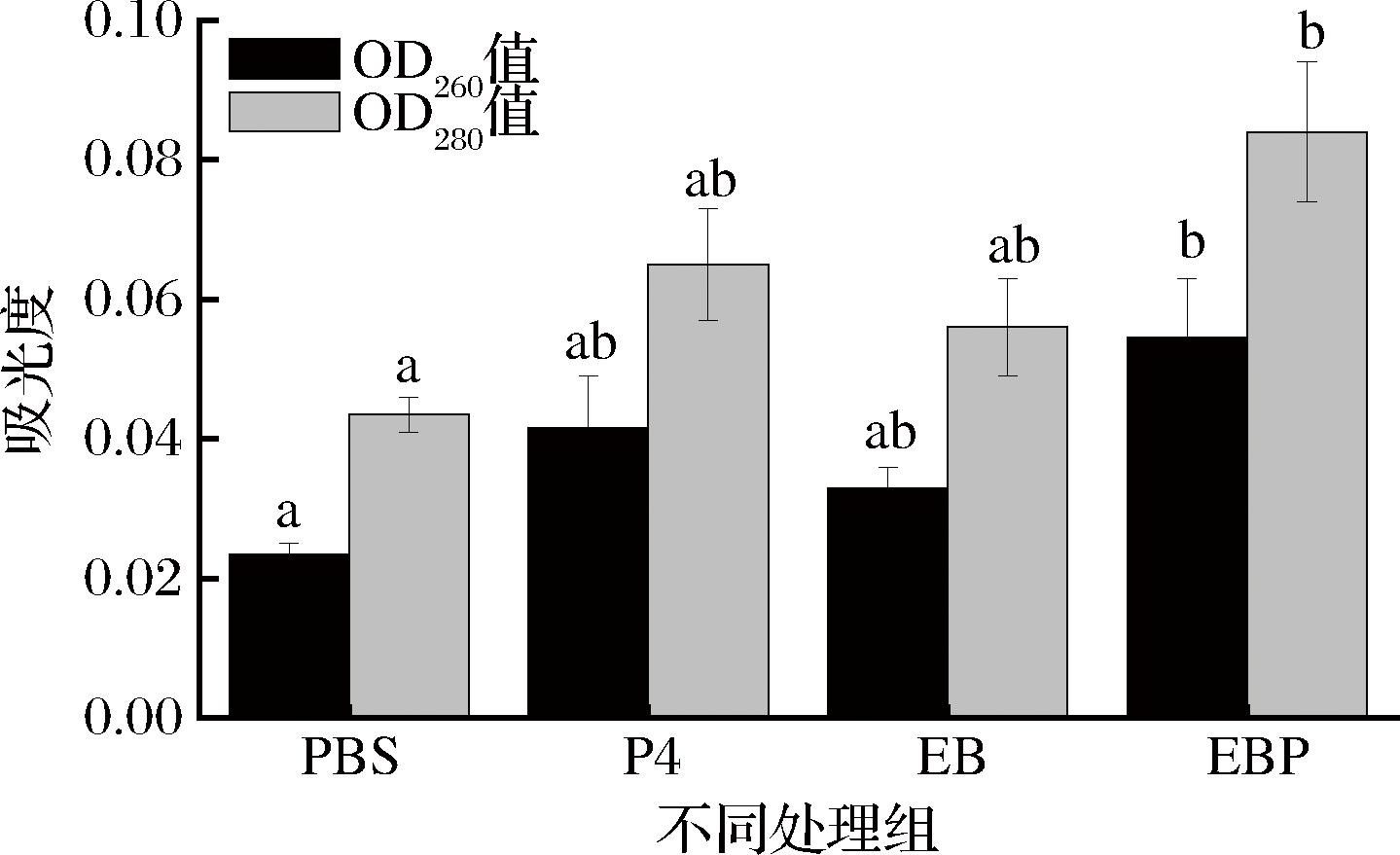
图14 细胞内DNA和蛋白质外漏分析
Fig.14 DNA and protein leakage analysis in cells
2.5.3 细菌细胞内DNA和蛋白含量测定
细胞内容物的外漏将会导致细胞内的DNA和蛋白质大幅度减少。DNA电泳条带的清晰程度与其裂解程度有关[18,29];如图15-a所示,可以观察到从其他对照组中提取的基因组DNA电泳条带亮度强烈,清晰度较高,说明DNA无明显裂解;EBP组的电泳条带亮度微弱,清晰度降低,表明其基因组DNA发生了显著降解。与杨园平等[29]利用姜黄素介导的光动力联合噬菌体处理志贺氏菌和沙门氏菌后,观察到的细菌DNA损伤结果相似。通过SDS-PAGE蛋白电泳图(图15-b)可知,相比之下,其他处理组拥有多种蛋白条带,而EBP处理后菌体蛋白条带大面积消失,仅有在约35 kDa和15~25 kDa处有浅色条带存在。蛋白条带的消失代表蛋白的降解,说明经过EBP的PDT后使大肠杆菌O157∶H7的蛋白受到大面积的降解,实验结果与LAI等[18]用改良后的姜黄素-β-环糊精介导的PDT破坏细菌蛋白结果一致。
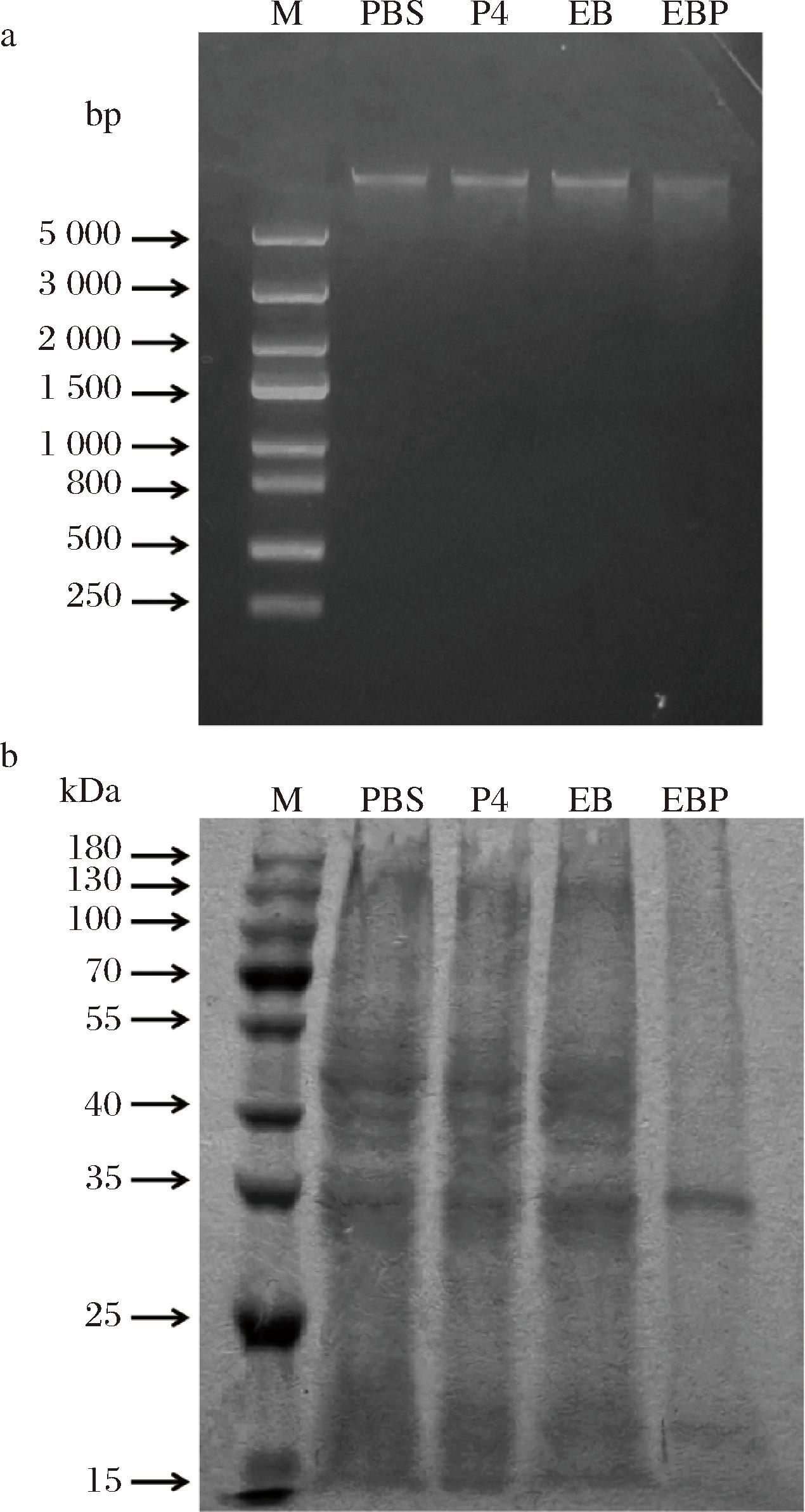
M-Marker。
a-DNA损伤;b-蛋白质降解
图15 经过不同处理后细菌的琼脂糖凝胶电泳图和SDS-PAGE图
Fig.15 Agarose gel electrophoresis and SDS-PAGE of bacteria with different treatments
3 讨论
近年来,常用的抗菌剂抗生素由于不正当或/和长期使用,出现耐药性问题,急需寻找新的有效抑菌剂。光动力疗法作为一种广谱、高效、环保、不易使细菌产生耐药性的冷杀菌技术受到食品行业关注。一般的光敏剂存在缺乏靶向性、抑菌能力较差等问题,常与其他物质联合使用来增强其杀菌效果。噬菌体作为一种生物抑菌剂区别于化学药剂而受到人们的再次关注。将噬菌体通过偶联剂与光敏剂偶联,可增强光敏剂对细菌的抑菌性和靶向性[16]。
本实验选用可食用光敏剂赤藓红B钠盐和噬菌体P4通过EDC/NHS法偶联,利用EDC/NHS法活化光敏剂上的羧基官能团,与噬菌体外壳蛋白上丰富的氨基官能团进行酰胺反应形成化学键偶联在一起,形成的偶联物能够通过噬菌体特异性识别并吸附到特定细菌上,经过光敏剂最大吸收波长光照射后,产生ROS,从而破坏细菌细胞完整性,导致蛋白质、DNA等生物大分子外漏,从而有效杀灭细菌。KALARICAL等[30]将光敏剂与噬菌体-脂质体偶联用于靶向癌细胞,HE等[31]利用AIE染料与噬菌体偶联用于抗生素敏感和多重耐药细菌的靶向识别与杀灭,加快伤口的愈合。与这些医药领域中噬菌体和光敏剂偶联的研究相比,应用于医药领域的光敏剂是否能食用并不明确,因此本实验使用的食品级光敏剂更适合噬菌体与光敏剂偶联应用于食品行业,为扩展光动力杀菌技术应用于食品领域提供新思路。
4 结论
为了促进可食用、杀菌效果优异的光敏剂在食品工业中的应用,本研究将可食用光敏剂EB和噬菌体P4偶联,合成EBP,并优化了不同光照时间和不同EBP浓度下的PDT杀菌条件,以提高其对大肠杆菌O157∶H7的杀菌效果,且通过光谱表征证明了EBP的成功合成,通过靶向性实验验证了EBP靶向识别大肠杆菌O157∶H7的能力,并探讨了EBP的杀菌机制。结果表明,15 μmol/L EBP经过60 min光照后,有优异的杀菌效果,对于单独的EB或P4而言,具有协同杀菌作用;其杀菌机制主要是通过Ⅰ型和Ⅱ型2种机制产生ROS从而改变细胞膜通透性,导致细胞质外漏,EBP进入菌体破坏DNA和蛋白质,菌体保留的DNA与蛋白质大幅度减少。可食用光敏剂EB和噬菌体P4偶联形成的EBP能靶向识别细菌,且具有协同杀菌能力,可作为增强光动力杀菌的有效途径,为PDT在食品微生物安全领域中的应用提供理论基础。
[1] ZHANG Z Q, QIN J R, WANG Z, et al.Sodium copper chlorophyll mediated photodynamic treatment inactivates Escherichia coli via oxidative damage[J].Food Research International, 2022, 157:111472.
[2] CUNNINGHAM N, JENKINS C, WILLIAMS S, et al.An outbreak of Shiga toxin-producing Escherichia coli (STEC) O157∶H7 associated with contaminated lettuce and the cascading risks from climate change, the United Kingdom, August to September 2022[J].European Communicable Disease Bulletin, 2024, 29(36):2400161.
[3] 施源, 李璟, 胡嘉淼, 等.基于Citespace的光动力杀菌技术研究进展可视化分析[J].食品工业科技, 2024, 45(10):335-352.SHI Y, LI J, HU J M, et al.Bibliometric analysis of the research progressing in photodynamic antimicrobial technology based on Citespace[J].Science and Technology of Food Industry, 2024, 45(10):335-352.
[4] NGUYEN V N, ZHAO Z, TANG B Z, et al.Organic photosensitizers for antimicrobial phototherapy[J].Chemical Society Reviews, 2022, 51(9):3324-3340.
[5] JIANG Y H, FU Y L, XU X J, et al.Production of singlet oxygen from photosensitizer erythrosine for facile inactivation of coronavirus on mask[J].Environment International, 2023, 177:107994.
[6] LIU Y, DONG W H, SHEN S Y, et al.Enhancement of E.coli inactivation by photosensitized erythrosine-based solar disinfection under weakly acidic conditions[J].Water Research, 2022, 212:118125.
[7] DA SILVA J B, DOS SANTOS R S, VECCHI C F, et al.Boosting the photodynamic activity of erythrosine B by using thermoresponsive and adhesive systems containing cellulose derivatives for topical delivery[J].International Journal of Biological Macromolecules, 2023, 245:125491.
[8] IMRAN A, SHEHZADI U, ISLAM F, et al.Bacteriophages and food safety:An updated overview[J].Food Science &Nutrition, 2023, 11(7):3621-3630.
[9] NARAYANAN K B, BHASKAR R, HAN S S.Bacteriophages:Natural antimicrobial bioadditives for food preservation in active packaging[J].International Journal of Biological Macromolecules, 2024, 276:133945.
[10] GANDRA N, ABBINENI G, QU X W, et al.Bacteriophage bionanowire as a carrier for both cancer-targeting peptides and photosensitizers and its use in selective cancer cell killing by photodynamic therapy[J].Small, 2013, 9(2):215-221.
[11] ZHANG J, HE X W, TANG B Z.Aggregation-induced emission-armored living bacteriophage-DNA nanobioconjugates for targeting, imaging, and efficient elimination of intracellular bacterial infection[J].ACS Nano, 2024, 18(4):3199-3213.
[12] SILVA A F, BORGES A, FREITAS C F, et al.Antimicrobial photodynamic inactivation mediated by rose Bengal and erythrosine is effective in the control of food-related bacteria in planktonic and biofilm states[J].Molecules, 2018, 23(9):2288.
[13] 马超群.合成食品色素赤藓红、新红和靛蓝的光谱特性研究[D].无锡:江南大学, 2011.MA C Q.Study on spectral characteristics of synthetic food colors Erythyosin, New Red and indigotine[D].Wuxi:Jiangnan University, 2011.
[14] 沈慧颖.细菌纤维素-二硫化钼基材料的制备及其光敏性能研究[D].无锡:江南大学, 2022.SHEN H Y.Preparation and photosensitive properties of bacterial cellulose-molybdenum disulfide based materials[D].Wuxi:Jiangnan University, 2022.
[15] 张春芝, 陈贝贝, 雷明瑄, 等.一株奥奈达希瓦氏菌烈性噬菌体的分离、纯化及鉴定[J].微生物学通报, 2016, 43(9):1953-1959.ZHANG C Z, CHEN B B, LEI M X, et al.Isolation, purification and identification of a Shewanella oneidensis MR-1 lytic phage[J].Microbiology China, 2016, 43(9):1953-1959.
[16] RAN B, YUAN Y Y, XIA W X, et al.A photo-sensitizable phage for multidrug-resistant Acinetobacter baumannii therapy and biofilm ablation[J].Chemical Science, 2021, 12(3):1054-1061.
[17] YUE L, ZHENG M H, KHAN I M, et al.Chlorin e6 conjugated chitosan as an efficient photoantimicrobial agent[J].International Journal of Biological Macromolecules, 2021, 183:1309-1316.
[18] LAI D N, ZHOU A R, TAN B K, et al.Preparation and photodynamic bactericidal effects of curcumin-β-cyclodextrin complex[J].Food Chemistry, 2021, 361:130117.
[19] LI X S, LEE S Y, YOON J.Supramolecular photosensitizers rejuvenate photodynamic therapy[J].Chemical Society Reviews, 2018, 47(4):1174-1188.
[20] MENG Z J, CHEN Z J, LU G W, et al.Short-wavelength aggregation-induced emission photosensitizers for solid tumor therapy:Enhanced with white-light fiber optic[J].International Journal of Nanomedicine, 2022, 17:6607-6619.
[21] ZHU S Y, UKWATTA R H, CAI X R, et al.The physiochemical and photodynamic inactivation properties of corn starch/erythrosine B composite film and its application on pork preservation[J].International Journal of Biological Macromolecules, 2023, 225:112-122.
[22] WANG Y, LANG Y H, YANG Q, et al.Breaking the photostability and pH limitation of halo-fluoresceins through chitosan conjugation[J].Advanced Materials, 2023, 35(14):2210956.
[23] 郑妹红.基于壳聚糖的二氢卟吩e6光敏剂载体的制备及性能研究[D].无锡:江南大学, 2021.ZHENG M H.Preparation and properties of carriers for chlorin e6 photosensitizer based on chitosan[D].Wuxi:Jiangnan University, 2021.
[24] 王婷婷, 细菌纤维素基光敏抗菌材料的制备及其性能研究[D].无锡:江南大学, 2021.WANG T T, Preparation and properties of bacterial cellulose-based photosensitive antibacterial materials[D].Wuxi:Jiangnan University, 2021.
[25] LU C B, SUN F F, LIU Y Y, et al.Versatile Chlorin e6-based magnetic polydopamine nanoparticles for effectively capturing and killing MRSA[J].Carbohydrate Polymers, 2019, 218:289-298.
[26] 林大港.焦磷酸钠/单过硫酸盐和碱/双氧水体系单线态氧鉴定方法初探[D].上海:华东师范大学, 2023.LIN D G.A preliminary study on the detection of singlet oxygen in the sodium pyrophosphate/monopersulfate and base-hydrogen peroxide systems[D].Shanghai:East China Normal University, 2023.
[27] 朱温平.聚集诱导发光型超分子光敏剂的构建及应用[D].北京:北京化工大学, 2023.ZHU W P.Construction and applicaitionof superamolecular photosensitizers based on aggregation-induced emission[D].Beijing:Beijing University of Chemical Technology, 2023.
[28] YAN H J, LI P Y, WEN F Z, et al.Green synthesis of carbon quantum dots from plant turmeric holds promise as novel photosensitizer for in vitro photodynamic antimicrobial activity[J].Journal of Materials Research and Technology, 2023, 22:17-34.
[29] 杨园平, 石慧.姜黄素介导的光动力联合噬菌体对食源性致病菌的杀菌效果及机理[J/OL].食品科学技术学报, 2024:1-12(2024-09-18).https://kns.cnki.net/kcms/detail/10.1151.TS.20240914.1654.019.html.YANG Y P, SHI H.Antibacterial effect and mechanism of photodynamic inactivation of curcumin combined with phage on foodborne pathogens[J/OL].Journal of Food Science and Technology, 2024:1-12(2024-09-18).https://kns.cnki.net/kcms/detail/10.1151.TS.20240914.1654.019.html.
[30] KALARICAL JANARDHANAN S, NARAYAN S, ABBINENI G, et al.Architectonics of phage-liposome nanowebs as optimized photosensitizer vehicles for photodynamic cancer therapy[J].Molecular Cancer Therapeutics, 2010, 9(9):2524-2535.
[31] HE X W, YANG Y J, GUO Y C, et al.Phage-guided targeting, discriminative imaging, and synergistic killing of bacteria by AIE bioconjugates[J].Journal of the American Chemical Society, 2020, 142(8):3959-3969.