螺旋藻又名节旋藻,属蓝藻门(Cyanophyta)、蓝藻纲(Cyanophyceae)、颤藻目(Oscillatoriales)、颤藻科(Osciallatoriaceae)、节旋藻属(Arthrospira),是一类嗜碱性光合自养蓝细菌[1]。螺旋藻是世界上产量最大的商业化生产可食用藻类,具有抗氧化、抗辐射、抗病毒、抗细菌、抗肥胖和免疫调节等生物活性,被广泛应用于食品、保健品、饲料和化妆品行业[1-2]。它还含有丰富的藻蓝蛋白、类胡萝卜素、微生素和微量元素,营养价值高,被世界卫生组织誉为“超级食物”[3]。螺旋藻光合效率高,生长速度快,环境适应力强,培养成本低,培养条件可控,是实施固碳减排和生产高附加值产品的理想藻种[1,4]。
螺旋藻的生长受多个环境因素的影响,例如光强、温度、盐度、pH、营养盐供给等[5-6]。其中营养盐缺失(缺氮、缺磷、缺硫)会导致细胞光合效率下降,生长减缓,并使细胞代谢从细胞分裂所需的蛋白质合成转变为贮存性糖类(如糖原)合成[7-11]。因此,营养盐限制是提升螺旋藻糖类生产的主要手段。AIKAWA等[12]通过高光强联合氮胁迫将螺旋藻的糖原产量提升至了1.03 g/L,达到了现有报道的最高水平。SARA等[8]发现氮限制将胞内碳水含量提升至了688 mg/g,同时胞内糖原含量也提高到了564 mg/g。然而,缺氮带来的急剧胁迫使螺旋藻固碳效率大幅降低,细胞在2~3 d内迅速死亡,导致生物质产量低;尽管糖原含量很高,其产量最终受到一定限制[10]。相对于氮限制,磷限制下螺旋藻可以利用胞内贮存性磷源部分维持细胞生长,使其能够在积累较高含量糖类的同时获得较高的生物质产量,因此更有利于糖类产量的提升[9]。螺旋藻作为蓝细菌,通常被认为其胞内的贮存性多糖为糖原[12-13]。然而,LIU等[10]报道在缺氮条件下螺旋藻积累的糖类并非完全为具有α-1,4和α-1,6糖苷键的糖原,而可能含有以其他糖苷键连接的α-葡聚糖。因此,营养限制下螺旋藻贮存性糖类的结构需要进一步研究。
碳水化合物的营养特性很大程度上决定于其对消化酶的敏感性,即消化特性。慢消化碳水化合物因其能减小餐后短时间内的血糖上升幅度、缓解机体的血糖调节负担而备受关注[14]。此外,难被人体胃肠道消化吸收的膳食纤维可以降低罹患冠心病、高血压、糖尿病、肥胖症的风险,并改善肠道健康,是功能性碳水化合物的重要组成部分[14]。不同来源的糖原因其不同的结构而具有不同的消化特性。MARTINEZ-GARCIA等[15]从红藻Galdieria sulphuraria中提取出一种分支度为17.7%的糖原,其还原糖释放速率比蜡质土豆淀粉更低,具有作为慢消化和抗性葡聚糖的潜力。螺旋藻在营养限制下积累糖类的消化特性未见报道。此外,螺旋藻多糖被报道具有免疫增强活性。LI等[16]在未经过调控的螺旋藻中分离纯化出2种高度分支化的α-葡聚糖,其均能提高巨噬细胞的吞噬能力,增强诱导型一氧化氮合酶活性,促进NO产生,增加IL-6 mRNA表达,具有免疫调节活性。不同培养工艺下获得的多糖可能具有不同的结构,其活性也可能存在差异。营养限制下螺旋藻积累的糖类是否具有免疫调节活性有待研究。
本研究旨在利用缺磷胁迫诱导螺旋藻积累贮存性葡聚糖并提升其固碳效率,并对不同培养时间(第6天和第8天)下获得的葡聚糖进行多尺度结构(分支度、分子质量、分子大小和分子构象)和功能性(体外消化特性和免疫调节活性)表征,为开发以糖类为主要成分的新型螺旋藻功能性食品提供理论和技术依据。
1 材料与方法
1.1 实验材料
实验用螺旋藻学名为钝顶节旋藻(Arthrospira platensis),系四川大学生命科学学院徐辉老师馈赠。液体培养基采用了修改后的Zarrouk培养基(MZ),1L培养基中包括:NaHCO3 16.8 g,K2HPO4 0.5 g,NaNO3 2.5 g,NaCl 1.0 g,K2SO4 1.0 g,MgSO4·7H2O 0.2 g,CaCl2 1 mg,FeSO4·7H2O 0.01 g,H3BO3 2.86 mg,MnCl2·4H2O 1.86 mg,ZnSO4·7H2O 0.22 mg, Na2MoO4·2H2O 0.39 mg,CuSO4·5H2O 0.08 mg。缺磷(-P)培养基将K2HPO4替换成等摩尔质量的NaCl,蒸汽121 ℃高压灭菌20 min备用。α-淀粉酶、淀粉葡萄糖苷酶、GOPOD试剂盒,Megazyme有限公司;胃蛋白酶,上海源叶生物科技有限公司。
1.2 仪器与设备
GY-FYQ-1922-HJ光生物反应器,上海光语生物科技有限公司;SW-CJ-1BU超净工作台,苏州安泰空气技术有限公司;LDZX-50KBS立式高压灭菌锅,上海申安医疗器械厂;Os30p+叶绿素荧光测定仪,美国Opti-sciences;UV-1800紫外分光光度计,上海美谱达仪器有限公司;Sorvall ST 16R高速冷却离心机,赛默飞世尔科技(中国)有限公司;INVENIO R傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)仪,德国Bruker;ZETASIZER NANO ZS90纳米粒度及Zeta电位分析仪,Malvern Panalytical英国;AVANCE NEO 400 M核磁共振波谱(nuclear magnetic resonance spectroscopy, NMR )仪, Bruker英国;ICS 5000+离子色谱系统,Thermo Fisher Scientific美国;U3000液相色谱,Thermo Fisher Scientific美国; Optilab T-rEX示差检测器,Wyatt Technology Corporation美国;DAWN HELEOS Ⅱ多角度激光光散射,Wyatt Technology Corporation美国。
1.3 实验方法
1.3.1 藻种培养及接种
螺旋藻种子液培养在3 L锥形瓶中,工作体积为1 L,LED荧光灯单侧连续照射,光强为40 μmol/(m2·s),25 ℃,每个月更换1次培养基。种子液的光密度OD560≥2之后,用培养基稀释,并转移0.5 L稀释液到直径为50 mm圆柱型鼓泡式光反应器中进行活化,活化条件为光强80 μmol/(m2·s),25 ℃,通气速率0.4 vvm,每3 d更换1次培养基,活化2次。活化后的藻丝用1 000目的尼龙布过滤收集,滤饼用-P培养基清洗2次,随后重悬至新鲜的-P培养基中,并控制OD560为0.7~0.8,接种至上述圆柱型鼓泡式光反应器中,培养方式及条件与活化培养保持一致。以正常培养基(+P)作为对照,每个条件设3个生物学重复。
1.3.2 生长状况监测
a)螺旋藻生长指标:紫外分光光度计测定OD560;叶绿素荧光计测定光合系统Ⅱ最大光化学量子产量Fv/Fm;pH计测定酸碱度;细胞干重参照姚长洪等[5]的方法;1 000目尼龙布过滤收集藻泥,冻干,-20 ℃下保存。
b)生物质成分测定:参照姚长洪等[5]的方法用硫酸-蒽酮法测定细胞碳水化合物;80 ℃下,用0.5 mol/L NaOH提取藻泥蛋白2次,蛋白质含量以BCA法测定[12];参照MISHRA等[17]的方法采用磷酸香兰素法测定油脂含量。
c)CO2固定效率(RCO2):参照ALMOMANI等[18]的方法,按照公式(1)计算,DWt和DW0表示t时刻和0时刻的细胞干重:
(1)
d)α-葡聚糖含量测定:用质量分数为30%的KOH溶液提取藻泥中的α-葡聚糖,95 ℃,90 min;冷却后加入3倍体积的无水乙醇,8 000 r/min离心5 min,收集沉淀;沉淀用硫酸-蒽酮法测定糖含量。
1.3.3 葡聚糖的分离纯化
以1∶30(g∶mL)混合藻粉和去离子水,80 ℃搅拌提取4 h;冷却后,8 000 r/min离心,收集上清液,上清液中按照质量浓度80 g/L添加三氯乙酸(trichloroacetic acid, TCA),4 ℃静置3 h;然后13 000 r/min,4 ℃离心10 min,上清液再用0.22 μm的滤头过滤,随后加入4倍体积的无水乙醇,4 ℃静置12 h;最后在4 ℃下8 000 r/min离心5 min,收集沉淀并冻干。采用硫酸-蒽酮法测定糖粉中总糖含量,考马斯亮蓝法测定蛋白含量,磷酸香兰素测定油脂含量。-P条件下第6天和第8天获得的葡聚糖分别记为G6和G8,其中所获葡聚糖中含有的大、中、小3种不同分子质量葡聚糖组分分别记为HMW、MMW、LMW。
1.3.4 葡聚糖的结构表征
a)FTIR:将葡聚糖与KBr混合压制成1 mm厚的薄片,测定4 000~400 cm-1吸收光谱。
b)单糖组成:葡聚糖分散在2 mol/L三氟乙酸溶液中,121 ℃水解2 h后,氮气吹干,并用甲醇清洗2~3次,然后溶解在无菌水中,采用离子色谱系统测定单糖种类及质量分数。
c)核磁共振氢谱:将冻干的糖粉溶解至D2O中,常温下利用400 MHz核磁共振仪测试。
d)分子质量、分子大小和分子构象:采用凝胶色谱-示差-多角度激光光散射(gel permeation chromatography-refractive index-multi angle laser light scattering, GPC-RI-MALS)系统测定葡聚糖分子质量,选用凝胶排阻色谱柱Ohpak SB-805 HQ (300 mm×8 mm)和Ohpak SB-803 HQ (300 mm×8 mm)串联,柱温45℃,进样量100 μL,流动相A(质量分数0.02% NaN3,0.1 mol/L NaNO3),流速0.6 mL/min,等梯度洗脱75 min。
(5)粒度:将葡聚糖分散在超纯水中,使用纳米粒度及Zeta电位分析仪的动态光散射(dynamic light scattering, DLS)测定粒度。
1.3.5 葡聚糖的膳食纤维及快速可获得葡萄糖含量测定
膳食纤维含量测定采用AOAC 2017.16的方法检测。快速可获得葡萄糖(rapidly available glucose, RAG)参照ENGLYST等[19]的方法测定20 min (G20)和120 min (G120)的葡萄糖释放量,G20即为RAG,慢速可获得葡萄糖(slowly available glucose, SAG)通过公式(2)计算得出:
SAG=G120-RAG
(2)
1.3.6 体外免疫增强活性测定
采用不同浓度的葡聚糖处理巨噬细胞RAW264.7,通过四唑盐比色(methylthiazolyldiphenyl-tetrazolium bromide, MTT)法检测葡聚糖对巨噬细胞的抑制作用,酶联免疫吸附测定法检测TNF-α和IL-6的分泌表达,格里斯试验(Griess experiment)法检测巨噬细胞NO的释放,并按照公式(3)计算活化指数:
活化指数![]()
(3)
1.4 统计学分析
使用IBM SPSS 25软件进行统计学分析。结果以3个独立实验的“平均值±标准差”表示。2组样品采用独立样本t检验,3组及以上样品采用单因素ANOVA检验。P<0.05被认为具有统计学差异。
2 结果与分析
2.1 缺磷胁迫下螺旋藻固碳与葡聚糖生产
2.1.1 光合固碳与生物质生产
如图1-a所示,缺磷胁迫(-P)下螺旋藻细胞的生长仍然持续进行,且在前4天与正常磷(+P)组无显著差别(P>0.05),这与氮胁迫环境下的细胞快速死亡有所不同[12],可能是螺旋藻体内储存的聚磷酸盐颗粒提供了前4天细胞生长所需的磷元素[6]。然而,-P下细胞密度在第4天后明显低于+P组,表明-P对细胞生长产生了一定影响。到第8天时,-P 下细胞密度达到初始密度的6倍,比+P下降低了15.7%。Fv/Fm表征光合系统Ⅱ的最大光量子产率,其数值越低,表示细胞所受的胁迫越大。如图1-b所示,-P在第2天之后对细胞造成胁迫,Fv/Fm显著低于同期+P的水平(P<0.05),表明-P降低了细胞的光合活性。+P和-P条件下,Fv/Fm均在第6天达到最大值,随后下降,表明培养后期可能由于营养消耗而导致细胞生长进入稳定期,光合活性下降。磷元素是微藻细胞生物膜(包括叶绿体光合相关膜)系统、核酸、能量载体ATP等物质的重要组成元素,P胁迫会导致光合等重要能量代谢活性的下降,细胞生长受到影响[20]。与细胞密度相反的是,-P提升了生物质产量(图1-c),细胞干重从4天开始显著高于+P组,在第8天达到最高值2.57 g/L,比+P组高26.0%。与细胞干重相对应,-P的CO2固定效率(生物质产率)在第4天之后显著高于+P组(P<0.05),第6天时达到最大值0.53 g CO2/(L·d),比+P下提高36.1%。-P下细胞生长受到抑制,但细胞干重和CO2固定效率(生物质产率)反而较+P更高,其原因可能在于磷胁迫下的生物质组成发生了变化(如糖类的积累和蛋白/油脂积累的降低)使得单位细胞的重量增加。在亚心形四爿藻和湛江等鞭金藻中,N限制导致细胞生长下降,但糖类的积累导致细胞生物质产量的提高,与本文的现象类似[21-22]。因此,-P培养是提高螺旋藻固碳效率的有效策略。
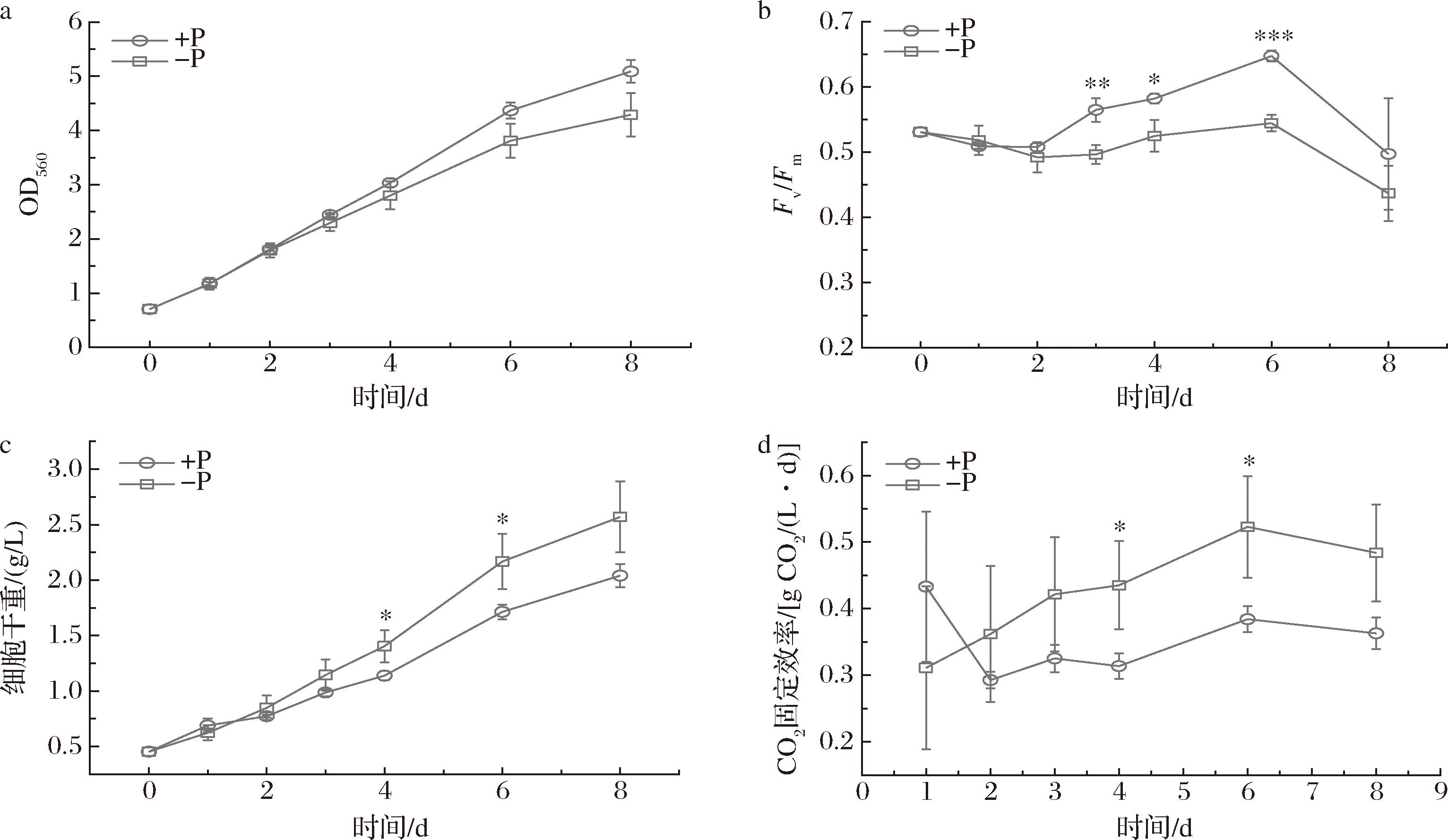
a-细胞密度;b-光合效率;c-生物质产量;d-CO2固定效率
图1 正常磷(+P)和缺磷胁迫(-P)下的螺旋藻细胞生长与光合固碳状况
Fig.1 Growth and photosynthetic carbon fixation of Arthrospira platensis under normal-phosphorus (+P) and phosphorus-starvation (-P) conditions
注:*、**和***分别代表相较于+P组在P<0.05、P<0.01和P<0.001的水平有显著差异。
2.1.2 葡聚糖生产
缺磷胁迫显著提高了可溶性总糖和葡聚糖的含量及产量。由图2-a可知,-P条件下的葡聚糖含量从第1天的10.15%持续增加至第8天的38.86%,而+P由于营养充足,从第1天开始降解葡聚糖以提供细胞分裂所需能量,其含量从13.56%持续降至第8天的2.05%。同时,-P的可溶性总糖含量在第8天达到56.72%,高出同期+P组9倍以上。相应地,-P的可溶性总糖和葡聚糖的产量持续增加,第8天分别达到了1.46 g/L和0.99 g/L,比同期对照组提升了12倍和23倍。ADP-葡萄糖焦磷酸化酶是糖原合成途径中的限速酶,无机磷能够抑制该酶的活性,因此磷元素的缺乏能够降低细胞内无机磷水平,提升ADP-葡萄糖焦磷酸化酶活性,从而将更多碳流导向葡聚糖的合成[23]。值得注意的是,可溶性总糖产量的最大增幅在6~8 d,而葡聚糖产量的最大增幅在4~6 d,并且在第6天之前两者差距不明显,这说明前6天光合作用生产的葡萄糖几乎都用于葡聚糖的合成,在6~8 d细胞光合活性下降的情况下,可能是葡聚糖发生了降解,亦或是缺磷导致ADP-葡萄糖的周转速率下降,造成糖原合成酶的催化速率降低,使得葡聚糖的合成放缓。
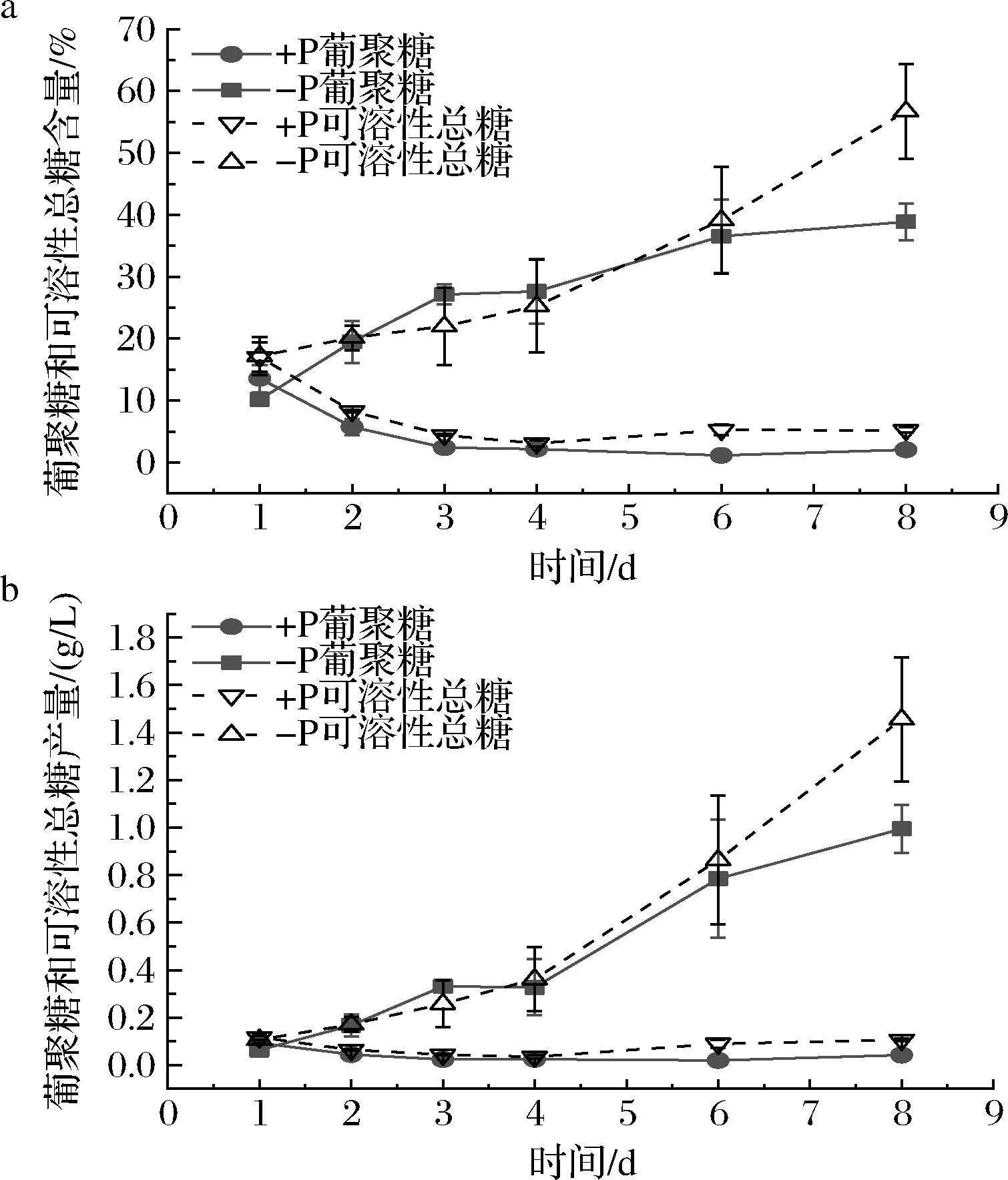
a-葡聚糖和可溶性总糖含量;b-葡聚糖和可溶性总糖产量
图2 正常磷(+P)和缺磷胁迫(-P)下螺旋藻糖类物质的积累情况
Fig.2 Accumulation of carbohydrates in Arthrospira platensis under normal-phosphorus (+P) and phosphorus-starvation (-P) conditions
进一步分析-P条件下蛋白和油脂积累情况,如表1所示。+P条件下蛋白质含量维持在40%以上,而-P的蛋白质含量从第4天的28.72%逐渐降低至第8天的19.63%,且均显著低于+P下的蛋白水平(P<0.05);-P对油脂的积累没有显著影响(P>0.05),含量都在6.24%~8.50%。综上所述,磷胁迫能够在适当降低光合活性的情况下提升固碳效率,同时将碳流从蛋白质合成转向葡聚糖合成,从而有效提升葡聚糖产量和含量。
表1 +P和-P条件下螺旋藻不同培养时间的蛋白和油脂含量
Table 1 Protein and lipid contents of Arthrospira platensis at different cultivation times under +P and-P conditions

培养条件蛋白质含量/%油脂含量/%4d6d8d4d6d8d+P40.91±1.0444.18±1.5442.79±3.486.47±0.237.44±0.727.66±0.84-P28.72±2.35∗23.66±1.53∗19.63±1.75∗6.99±0.556.93±0.757.08±0.46
注:*代表与+P相比具有显著性差异(P<0.05)。
与已报道的螺旋藻光合固碳产糖的结果相比,本文所达到的CO2固定效率[0.53 g CO2/(L·d)]和生物质产量(2.57 g/L)均高于绝大多数螺旋藻在-N、-P或-S下的水平(表2),而葡聚糖的产量(0.99 g/L)与-N下报道的最高值(1.03 g/L)相当[12],表明本研究利用-P条件能够诱导螺旋藻高效生产糖类物质并实现CO2的高效固定和生物质生产。
表2 营养盐限制或缺乏条件下螺旋藻生物质生产及糖类积累比较
Table 2 Comparison of biomass production and carbohydrate accumulation in Arthrospira under nutrient-limitation or starvation conditions
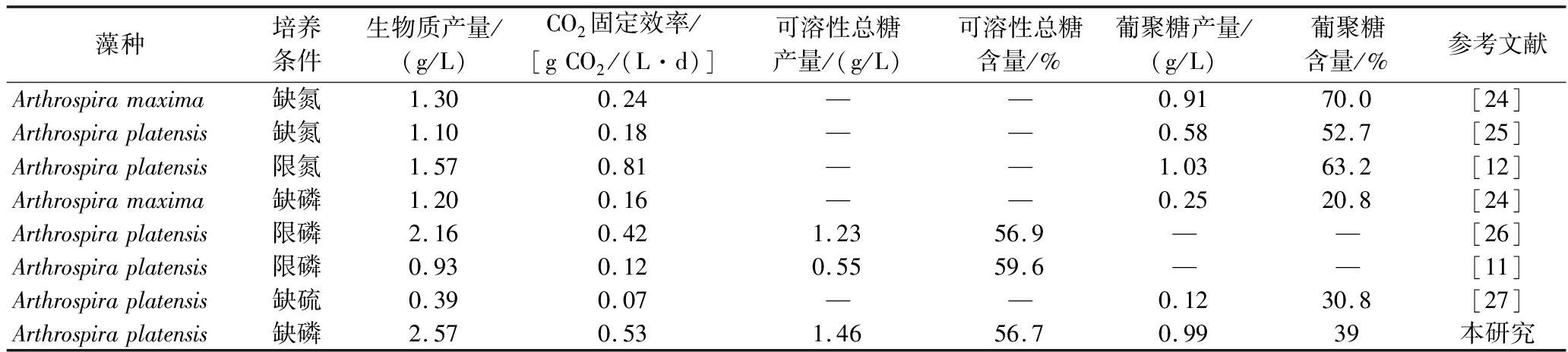
藻种培养条件生物质产量/(g/L)CO2固定效率/[gCO2/(L·d)]可溶性总糖产量/(g/L)可溶性总糖含量/%葡聚糖产量/(g/L)葡聚糖含量/%参考文献Arthrospiramaxima缺氮1.300.24——0.9170.0[24]Arthrospiraplatensis缺氮1.100.18——0.5852.7[25]Arthrospiraplatensis限氮1.570.81——1.0363.2[12]Arthrospiramaxima缺磷1.200.16——0.2520.8[24]Arthrospiraplatensis限磷2.160.421.2356.9——[26]Arthrospiraplatensis限磷0.930.120.5559.6——[11]Arthrospiraplatensis缺硫0.390.07——0.1230.8[27]Arthrospiraplatensis缺磷2.570.531.4656.70.9939本研究
注:—表示无数据(下同)。
2.2 缺磷胁迫下螺旋藻葡聚糖的提取与结构表征
2.2.1 葡聚糖的提取
利用热水浸提-TCA除蛋白-乙醇沉淀的方法提取-P条件下产量及含量均较高时[即第6天(G6)和第8天(G8)]螺旋藻细胞中的葡聚糖。如表3所示,G6和G8的纯度分别达到了89.66%和86.85%,而蛋白含量只有0.79%和1.35%,说明TCA可以有效去除蛋白杂质。G6和G8的糖回收率分别达到81.86%和70.16%。G8的糖回收率低于G6的原因可能在于第8天由于光合活性下降而产生较多短链寡糖(图2-a),从而无法被乙醇有效沉淀。
表3 -P下螺旋藻葡聚糖G6和G8的提取效率、纯度和蛋白/油脂含量
Table 3 Extraction efficiency, purity and protein/oil content of the glucans G6 and G8 obtained under-P in Arthrospira platensis
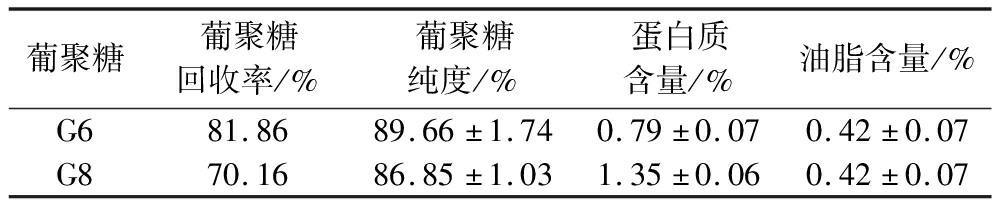
葡聚糖葡聚糖回收率/%葡聚糖纯度/%蛋白质含量/%油脂含量/%G681.8689.66±1.740.79±0.070.42±0.07G870.1686.85±1.031.35±0.060.42±0.07
2.2.2 G6和G8的结构表征
2.2.2.1 FTIR和单糖组成
利用红外光谱解析葡聚糖的官能团和糖苷键类型。如图3所示,G6和G8在3 395 cm-1、2 926 cm-1和1 414 cm-1处都具有强烈的吸收峰,3 395 cm-1表示分子内或者分子间的O—H伸缩振动,2 926 cm-1和1 414 cm-1表示吡喃环中的C—H伸缩振动。此外,1 200~1 000 cm-1是多糖典型的吸收带。G6和G8均在850 cm-1处有吸收峰,而890 cm-1无吸收峰,表明糖苷键类型为α-构型[10]。1 637 cm-1和1 240 cm-1表示COOH中的C![]() O和O—H的弯曲振动,表明分子可能存在少量的糖醛酸[28]。根据红外光谱结果初步判断G6和G8是2种成分组成类似的多糖,因此进一步对G6的单糖组成进行分析。结果显示其只含有89.38%的葡萄糖和10.62%的半乳糖醛酸(图4),与FTIR的结果吻合,表明G6为带有少量半乳糖醛酸的α-葡聚糖。
O和O—H的弯曲振动,表明分子可能存在少量的糖醛酸[28]。根据红外光谱结果初步判断G6和G8是2种成分组成类似的多糖,因此进一步对G6的单糖组成进行分析。结果显示其只含有89.38%的葡萄糖和10.62%的半乳糖醛酸(图4),与FTIR的结果吻合,表明G6为带有少量半乳糖醛酸的α-葡聚糖。
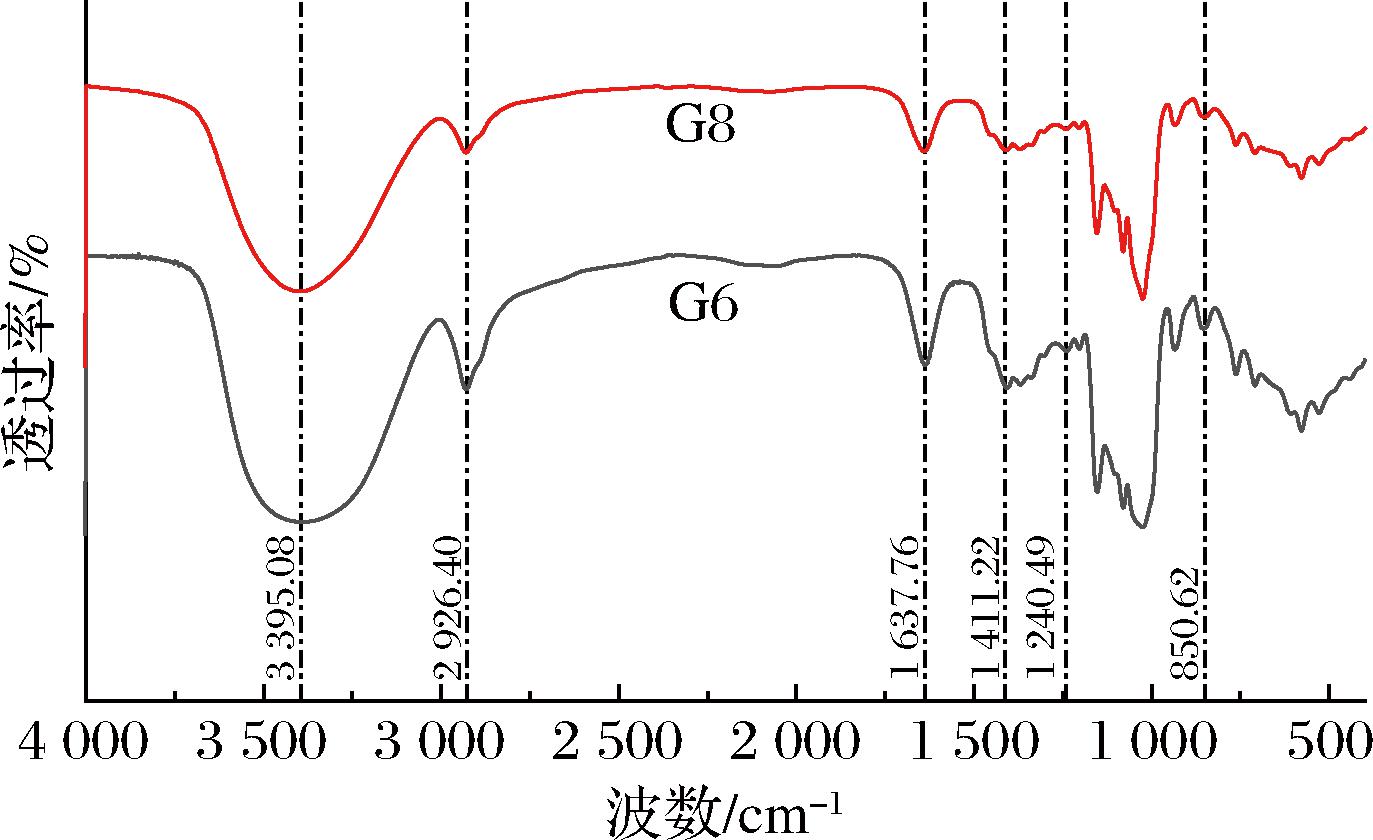
图3 -P下螺旋藻葡聚糖G6和G8红外谱图
Fig.3 The FTIR spectra of the glucans G6 and G8 obtained under-P in Arthrospira platensis
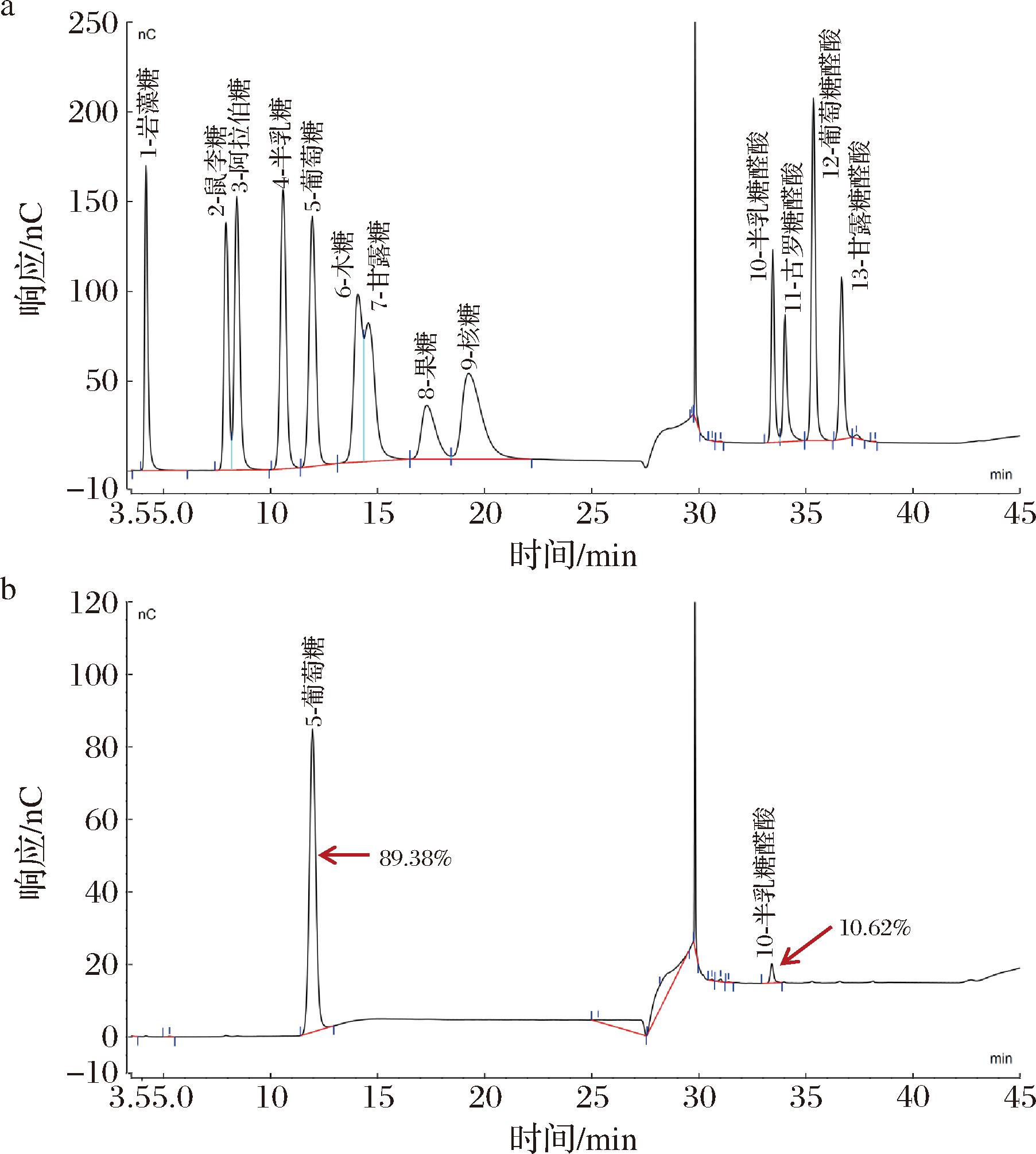
a-单糖标准品的色谱图;b-G6的单糖组成色谱图
图4 单糖标准品和-P下螺旋藻葡聚糖G6的单糖组成色谱图
Fig.4 Monosaccharide composition chromatograms of monosaccharide standards and glucan G6 obtained under-P in Arthrospira platensis
2.2.2.2 糖苷键连接和分支度
利用核磁共振氢谱(1HNMR)初步判断糖苷键的链接位点以及葡聚糖的分支度,结果如图5所示。异头碳质子在4.40~5.60 ppm的低场光谱区得到了较好分辨,亚甲基的质子重叠在3.6~4.1 ppm的信号密集区[16]。整体来看,G6和G8的1HNMR与麦芽糊精相似,表明G6和G8都是α-葡聚糖,与FTIR结果吻合。5.03 ppm表示的是α-(1→4)-Glc-α-(1→6)环境下的异头碳氢原子(C1),其峰面积能够代表α-1,6糖苷键的数量;5.45 ppm则是α-(1→4)-Glc-α-(1→4)和α-(1→4,6)-Glc-α-(1→4)环境下的异头碳氢原子(C1),其峰面积能够代表线性α-1,4糖苷键的数量。通过计算得出G6的分支度为5.82%,G8为6.33%(表4)。
表4 -P下螺旋藻葡聚糖G6和G8结构参数
Table 4 Structural parameters of the glucans G6 and G8 obtained under-P in Arthrospira platensis
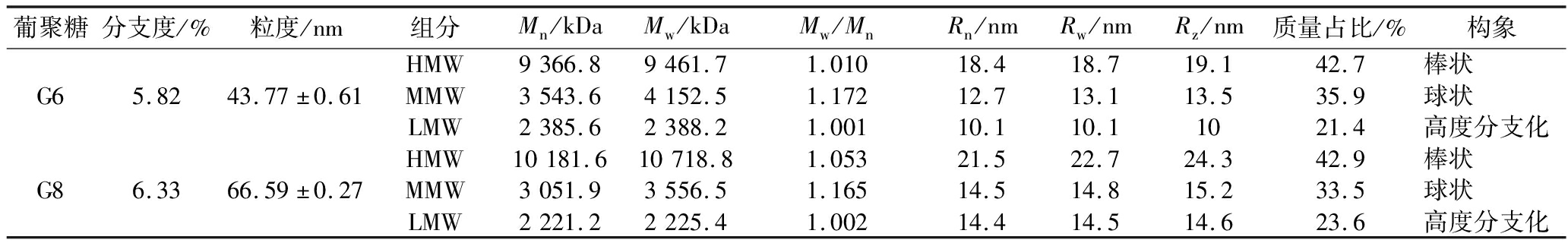
葡聚糖分支度/%粒度/nm组分Mn/kDaMw/kDaMw/MnRn/nmRw/nmRz/nm质量占比/%构象HMW9366.89461.71.01018.418.719.142.7棒状G65.8243.77±0.61MMW3543.64152.51.17212.713.113.535.9球状LMW2385.62388.21.00110.110.11021.4高度分支化HMW10181.610718.81.05321.522.724.342.9棒状G86.3366.59±0.27MMW3051.93556.51.16514.514.815.233.5球状LMW2221.22225.41.00214.414.514.623.6高度分支化
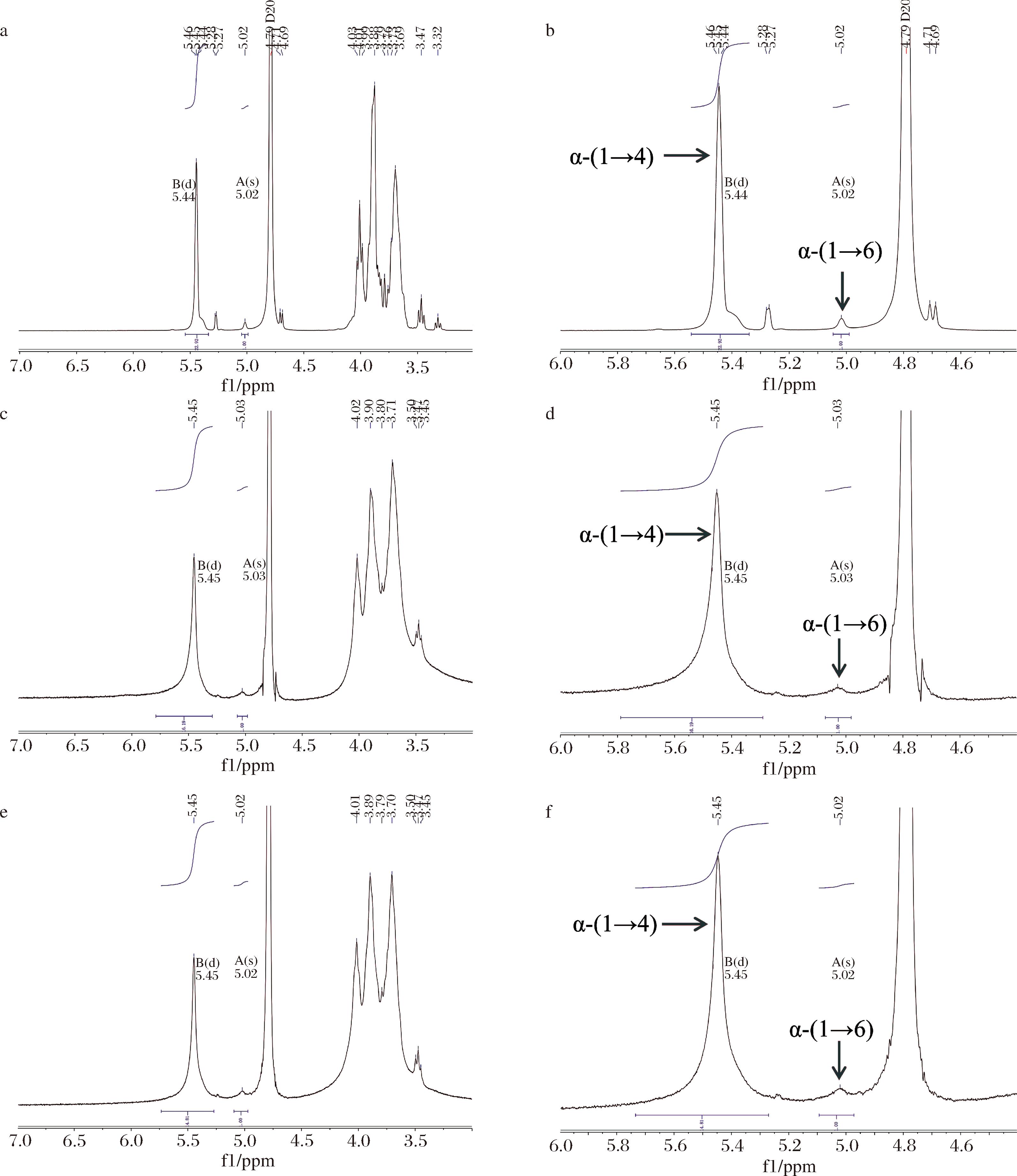
a-麦芽糊精的完整谱图;b-麦芽糊精的局部放大图;c-G6的完整谱图;d-G6的局部放大图;e-G8的完整谱图;f-G8的局部放大图
图5 -P下螺旋藻葡聚糖(G6和G8)和麦芽糊精的核磁共振氢谱图
Fig.5 The 1H NMR of the glucans (G6 and G8) obtained under-P in Arthrospira platensis and maltodextrin
2.2.2.3 分子质量、分子大小与分子构象
利用GPC-RI-MALS研究G6和G8的分子质量分布和分子构象,如图6所示。示差(refractive index, RI)检测器和光散射(light scattering, LS)检测器在20~27 min出现了2个峰,而 G6和G8的分子质量在20.0~23.3、23.3~24.5、24.5~26.5 min存在3种表现形式,表明2种α-葡聚糖可能有大小不同的3个组分,其质量比都约为4∶4∶2。G6和G8的重均分子质量(Mw)处于2 000~11 000 kDa,重均分子旋转半径(Rw)为10~23 nm。LI等分离纯化出了2种正常培养环境下的螺旋藻葡聚糖,其Mw分别为93 kDa和113 kDa;LIU等提取了氮胁迫下的螺旋藻葡聚糖,其Mw为672 kDa,表明G6和G8是2种分子质量较大的螺旋藻α-葡聚糖。G6的大分子质量组分(G6-HMW)的Mw为9 461.7 kDa,比G8的10 718.8 kDa要小,而中分子质量组分(G6-MMW)和小分子质量组分(G6-LMW)是4 152.5 kDa和2 388.2 kDa,比G8的3 556.5 kDa和2 225.4 kDa要大,这或许是因为第6天细胞处于合成α-葡聚糖的阶段,大组分还未达到最高分子质量,而中、小组分还在持续延长;而第8天细胞处于稳定期,α-葡聚糖合成和降解同时存在,大组分分子质量达到顶峰,中、小组分不断被降解用于供能。此外,分子质量分布由Mw/Mn表示:分子质量分布越窄,其Mw/Mn越小并接近1[29]。表4显示,G6和G8中3种不同分子质量的葡聚糖的Mw/Mn在1.0~1.2,表明其均为较低分散度的多糖大分子。
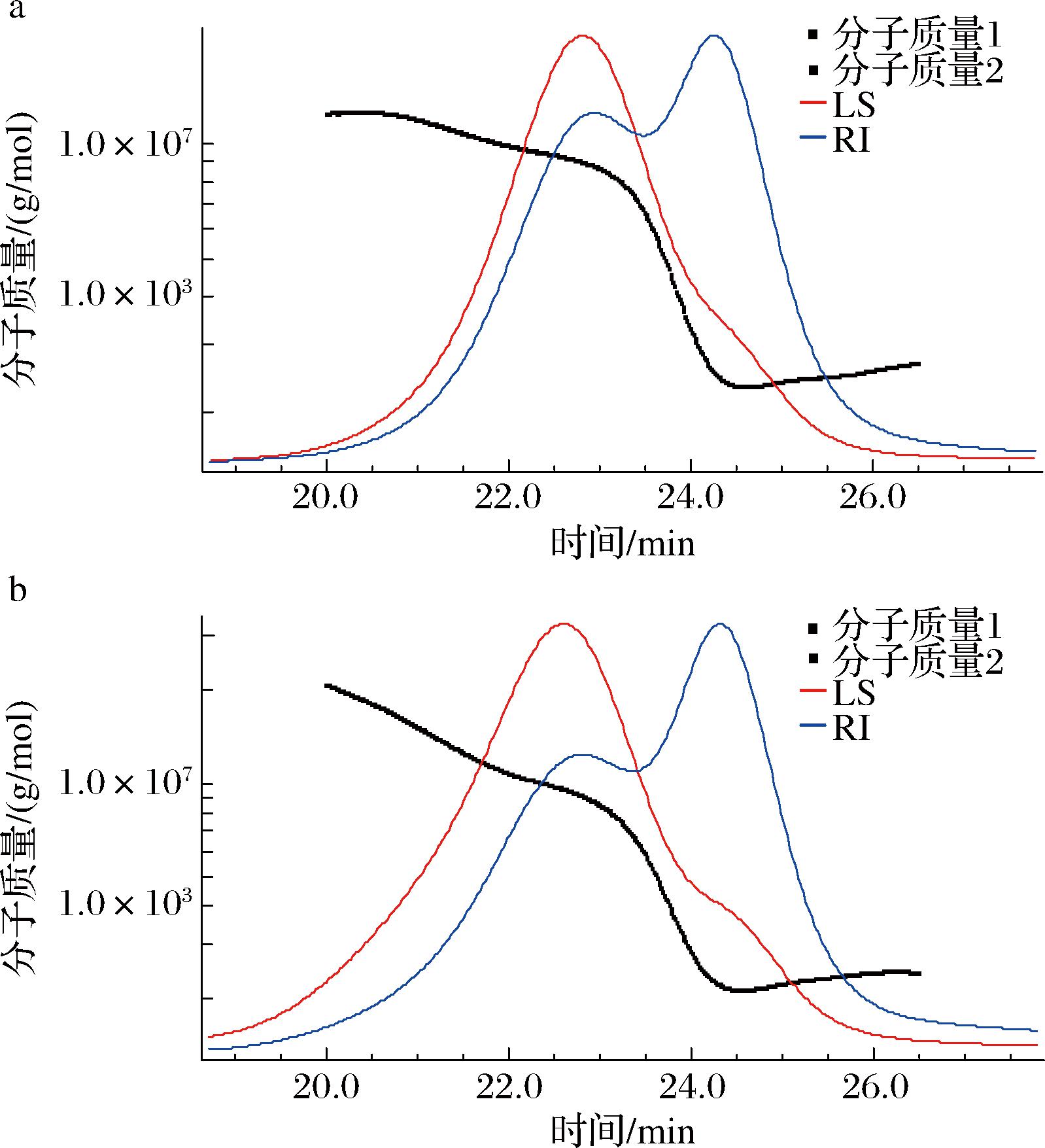
a-G6的GPC图;b-G8的GPC图
图6 -P下螺旋藻葡聚糖G6和G8的GPC图
Fig.6 The GPC of the glucans G6 and G8 obtained under-P in Arthrospira platensis
HMW的分子旋转半径(Rn、Rw、Rz)变化规律与Mw一致,即G8>G6。值得注意的是,G8-MMW和G8-LMW的Mw均比G6的对应组分要小,而旋转半径(Rn、Rw、Rz)却都更大,说明G8-MMW和G8-LMW的结构比G6-MMW和G6-LMW的结构更松散。DLS数据显示(表4),G8的平均粒度(66.59 nm)大于G6(43.77 nm),与旋转半径结果吻合,说明G8整体上结构更加松散。用对数处理后的均方根分子旋转半径(root mean square radius, RMS)与对数处理后的Mw作图,其斜率用来表征多糖链在水溶液中的构象:该斜率小于0.33表示分子链构象呈紧密均一的球状,0.5~0.6表示分子链构象为随机线圈状,接近1表示分子质量为刚体棒状构象[30-31]。由图7可知,大分子质量组分G8-HWM的斜率接近1,表明其为刚体棒状构象;G6-HWM的斜率远高于G8-HWM,说明其构象较G8-HWM松散。中分子质量组分G6-MMW和G8-MMW斜率均在0.15~0.20,表明其均为均一紧密球状。小分子质量组分G6-LMW和G8-LMW的图像呈“U”型,表明2个小分子质量的组分都是高度分支化的多糖[29]。
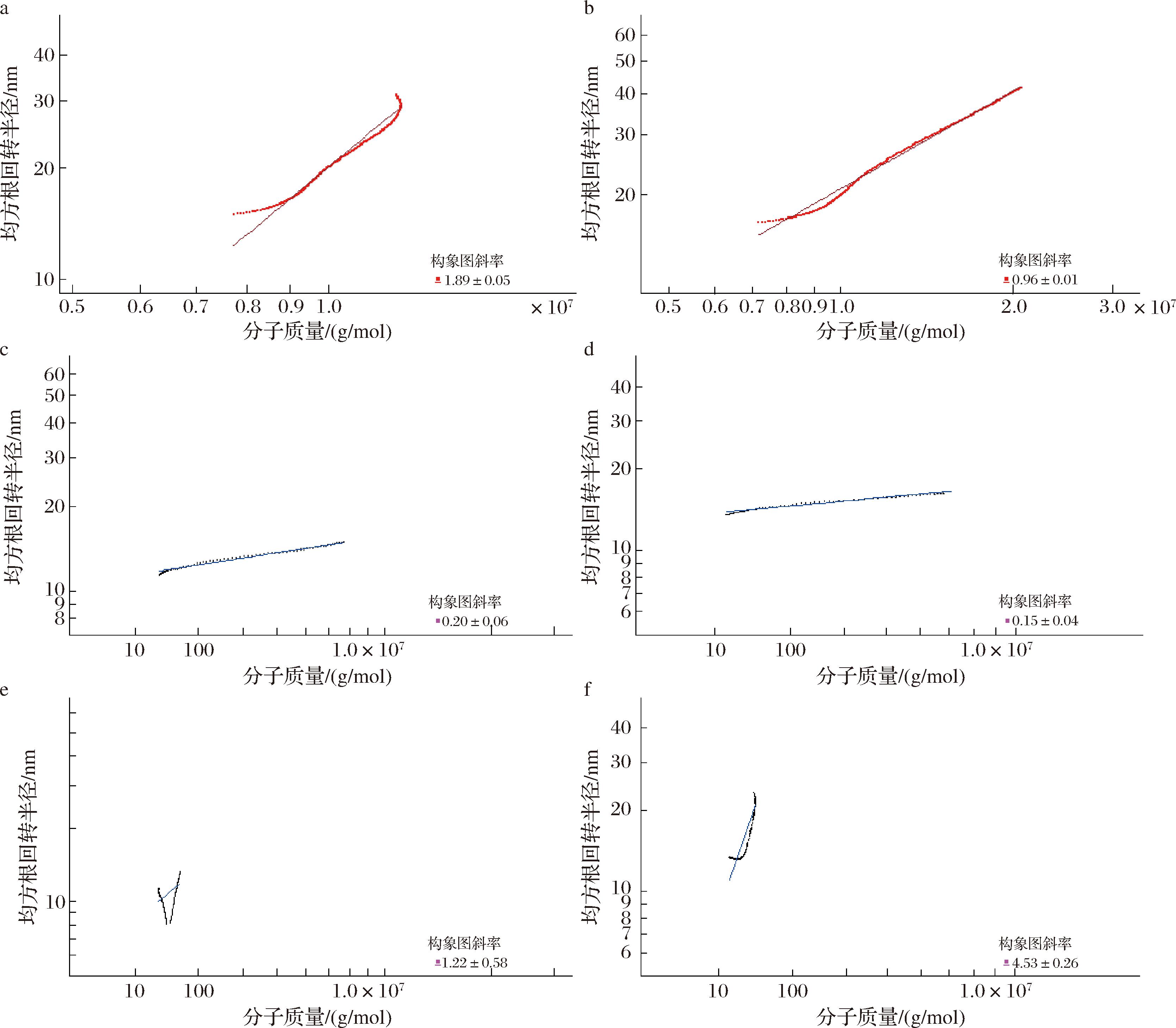
a-G6-HMW的分子链构象图;b-G8-HMW的分子链构象图;c-G6-MMW的分子链构象图;d-G8-MMW的分子链构象图;e-G6-LMW的分子链构象图;f-G8-LMW的分子链构象图
图7 -P下螺旋藻葡聚糖G6和G8的分子链构象图
Fig.7 Chain conformations of the glucans G6 and G8 obtained under-P in Arthrospira platensis
根据上述分子质量、分子大小和分子构象结果推测,在第6天α-葡聚糖合成的阶段,大分子质量葡聚糖(G6-HMW)处于中间态,其相对松散的结构有助于糖链的延长;而第8天进入稳定期后,葡聚糖进一步合成为具有更大分子质量和更加紧凑构象的葡聚糖(G8-HMW),从而有助于α-葡聚糖的贮存;而球状的中分子质量葡聚糖(G6-MMW和G8-MMW)以及高度分支化的低分子质量葡聚糖(G6-LMW和G8-LMW)可能因为较松散的构象而更易水解,可以作为细胞进入稳定期后降解供能的暂时性中转葡聚糖,有利于维持稳定期的能量代谢平衡,因此其分子质量在第8天相对于第6天均下降。
表5列出了文献报道的螺旋藻α-葡聚糖的结构特征。由表5可以看出,本研究利用-P条件在螺旋藻中获得的G6和G8具有比之前的报道更大的分子质量(2 000~11 000 kDa),而分支度则相对较低(5%~6%)。蓝藻和红藻的糖原一般分子质量在100~10 000 kDa,分支度在7%~18%,而类似的微藻支链淀粉分子质量通常大于10 000 kDa,分支度在4%~6%[32-33]。由此可见,本研究获得的G6和G8可能是结构上处于糖原与支链淀粉过渡态的新型α-葡聚糖。
表5 螺旋藻α-葡聚糖的结构特征比较
Table 5 Comparison of the structural characterizations of α-glucan from Arthrospira platensis

葡聚糖分子质量/kDa糖苷键类型分支度/%参考文献PSP-193.9α-1,4(主要)和α-1,6(少量)—[16]PSP-2113.7α-1,4(主要)和α-1,6(少量)—[16]PS-NL673和315α-1,3(主要)和α-1,2或α-1,4(少量)—[10]Glucan —α-1,4(主要)和α-1,6(少量)19.8[34]SPPA-1690α-1,4(主要)和α-1,6(少量)10.00[35]G62380~9500α-1,4(主要)和α-1,6(少量)5.82本研究G82220~10720α-1,4(主要)和α-1,6(少量)6.33本研究
2.3 缺磷胁迫下螺旋藻葡聚糖的功能性表征
2.3.1 膳食纤维和水解特性
以胃肠道最容易消化吸收的麦芽糊精作为对照,评估G6和G8的膳食纤维含量水平。如表6所示,G6和G8均含有膳食纤维,其含量分别达到25.30%和12.24%,而麦芽糊精几乎不含有膳食纤维(0.95%)。根据ENGLYST等[19]的方法评价G6和G8的消化特性,发现其RAG分别为24.02%和14.26%,显著低于麦芽糊精的33.74%(P<0.05);而G6和G8的SAG达到了33.90%和35.09%,显著高于麦芽糊精的26.26%(P<0.05)。上述结果表明,G6和G8是2种含有较多慢消化碳水化合物和膳食纤维的α-葡聚糖。其中,G8的RAG明显低于G6,表明其水解速率较慢,可能是由于其平均分子半径较大(表4),且具有较多紧密棒状结构,不利于水解酶的攻击。相较于麦芽糊精,G6和G8富含慢消化碳水化合物,可以降低食物对于血糖生成的冲击,延长了胃肠道获取葡萄糖的时间,同时能够保证人体基本的能量需求[14]。此外,G6和G8还具有麦芽糊精不具备的膳食纤维,可能作为益生元促进结肠微生物菌落的生长,改善胃肠道健康[14]。因此,G6和G8具备开发成为功能性营养食品的潜力。
表6 -P下螺旋藻葡聚糖(G6和G8)和麦芽糊精的膳食纤维含量及消化特性(RAG和SAG)
Table 5 Dietary fiber content and digestive properties (RAG and SAG) of the glucans (G6 and G8) obtained under-P in Arthrospira platensis and maltodextrin

葡聚糖膳食纤维含量/%RAG/%SAG/%G625.30±1.25a24.02±0.29b33.90±1.19aG812.24±1.80b14.26±1.44c35.09±3.46a麦芽糊精0.95±2.60c33.74±2.46a26.26±1.68b
注:不同字母代表G6、G8和麦芽糊精组间具有显著差异(P<0.05)。
2.3.2 体外免疫活性
利用MTT法检测不同浓度下G6和G8对细胞的毒性,并利用ELISA法检测G6和G8对巨噬细胞RAW264.7的TNF-α和IL-6分泌影响情况以及Griess法检测NO的释放情况,以初步考察其免疫激活效应。如图8所示,G6在100~500 mg/L的质量浓度范围内对细胞活力未产生显著影响(P>0.05);而浓度上升到1 000 mg/L后对细胞活性有轻微抑制,抑制率为6.60% (P<0.01);G8在500 mg/L抑制了5.40%的细胞活性(P<0.05),但高浓度下(1 000 mg/L)与G6没有差别,抑制率为6.83%。与高浓度麦芽糊精(1 000 mg/L)相比(抑制率3.00%),G6和G8细胞毒性无显著性差异(P>0.05),表明其毒性较低。G6对于NO、TNF-α和IL-6的分泌具有促进作用,且表现出一定的浓度依赖性,活化指数在1 000 mg/L浓度下分别达到3.17、2.46和1.70。G8对上述指标也具有明显的提升效应,对IL-6的活化指数在1 000 mg/L时达到了1.93,与G6和麦芽糊精无显著性差异(P>0.05),而NO和TNF-α的活化指数只有1.85和2.07,显著低于G6相同条件(P<0.05)。LI等[16]从螺旋藻中分离纯化了2种具有免疫活性的α-葡聚糖,质量浓度为400 μg/mL时可以将NO和IL-6的分泌量提升至2倍。本文G6的免疫活性接近此报道的水平。高浓度的麦芽糊精除了对IL-6的分泌比G6和G8略高以外,对NO和TNF-α的活化效应均较低且不如G6和G8。整体而言,G6和G8均具有一定的免疫激活活性,且G6比G8的活性更高,具有开发成免疫调节功能食品的潜力。
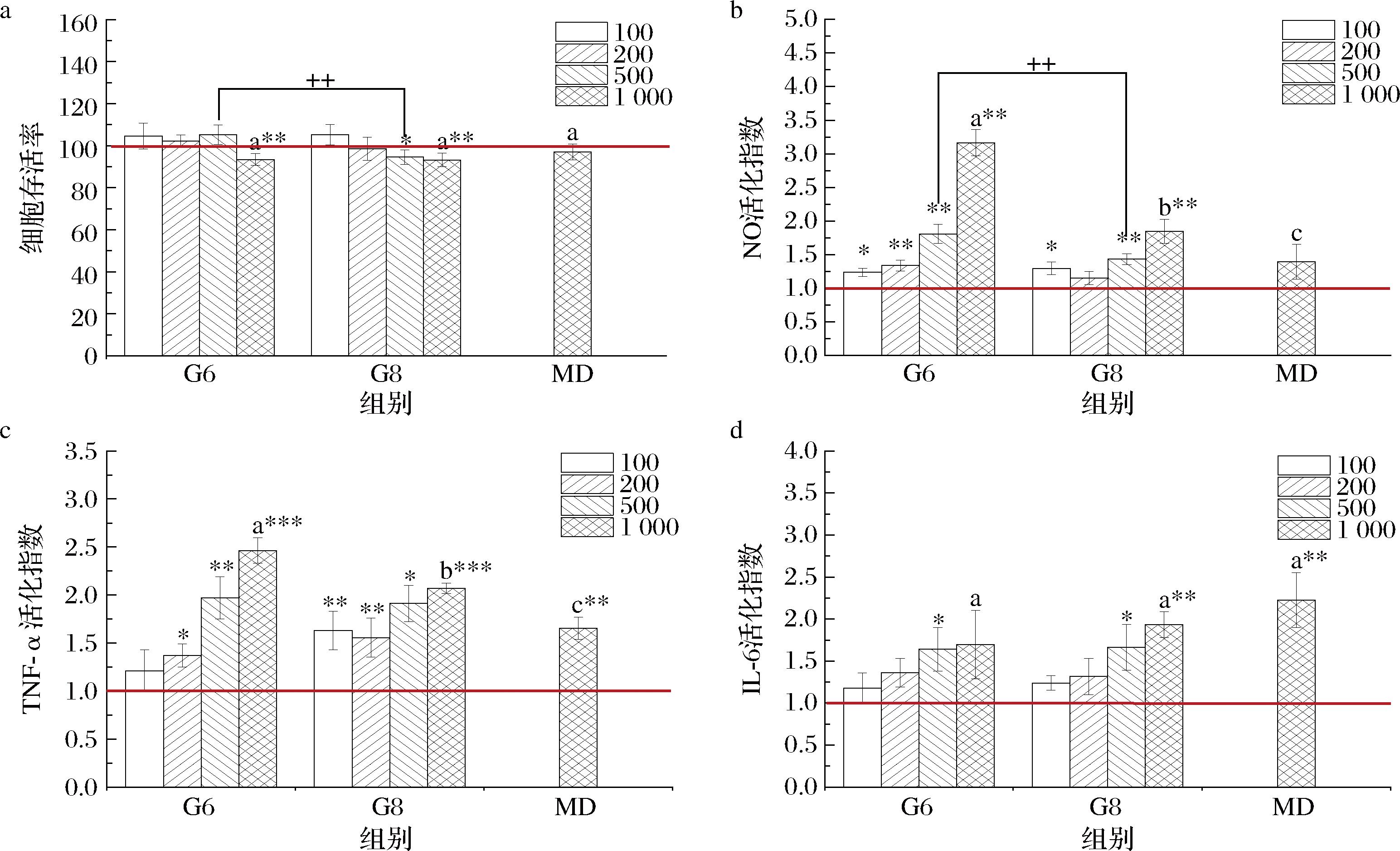
a-细胞毒性;b-NO活化指数;c-TNF-α的活化指数;d-IL-6的活化指数
图8 -P下螺旋藻葡聚糖(G6和G8)和麦芽糊精体外免疫活性评价
Fig.8 In vitro immunological activity of the glucans (G6 and G8) obtained under-P in Arthrospira platensis and maltodextrin
注:*、**和***分别代表相较于浓度为0 mg/L的对照组在P<0.05、P<0.01和P<0.001的水平有显著差异;++代表G6和G8相同浓度下比较在P<0.01的水平有显著差异;1 000 mg/L上的不同字母代表G6、G8和麦芽糊精组间具有显著差异(P<0.05)。
3 结论
利用缺磷胁迫可以同时实现螺旋藻高效光合固碳和功能性α-葡聚糖积累。缺磷(-P)下螺旋藻二氧化碳固定效率较正常磷供给下提高36.1%,α-葡聚糖产量和含量较富磷下分别提高了12倍和23倍。-P下螺旋藻可产生棒状HMW、紧密球状MMW和高度分支化LMW 3种不同分子质量和分子构象的葡聚糖,其结构以α-1→4糖苷键连接为主,为结构上处于糖原与支链淀粉过渡态的新型α-葡聚糖。不同-P培养时间可以获得具有不同结构和活性的α-葡聚糖。第8天获得的α-葡聚糖(G8)较第6天(G6)拥有更多的α-1→6糖苷键分支、更大的分子旋转半径、更紧密的HMW和更松散的MMW和LMW。-P下产生的螺旋藻α-葡聚糖具有比麦芽糊精消化缓慢且富含膳食纤维的特征,并具有一定的体外免疫增强活性;其中G6的膳食纤维含量和免疫增强活性均优于G8。-P可以作为螺旋藻高效固碳的调控策略,其调控下产生的α-葡聚糖具有开发成为具有免疫调节活性且含有益生元的慢消化功能性食品的潜力。
[1] CHANG M W, LIU K L.Arthrospira platensis as future food:A review on functional ingredients, bioactivities and application in the food industry[J].International Journal of Food Science &Technology, 2023, 59(3):1197-1212.
[2] 王丽梅, 西妮, 穆文静, 等.基于Cite Space对螺旋藻藻蓝蛋白的研究进展与热点分析[J].食品与发酵工业, 2024, 50(16):313-323.WANG L M, XI N, MU W J, et al.Research progress and focus analysis of phycocyanin from Spirulina based on Cite Space[J].Food and Fermentation Industries, 2024, 50(16):313-323.
[3] RAM REZ-RODRIGUES M M, ESTRADA-BERISTAIN C, METRI-OJEDA J, et al.Spirulina platensis protein as sustainable ingredient for nutritional food products development[J].Sustainability, 2021, 13(12):6849.
REZ-RODRIGUES M M, ESTRADA-BERISTAIN C, METRI-OJEDA J, et al.Spirulina platensis protein as sustainable ingredient for nutritional food products development[J].Sustainability, 2021, 13(12):6849.
[4] SYDNEY E B, STURM W, DE CARVALHO J C, et al.Potential carbon dioxide fixation by industrially important microalgae[J].Bioresource Technology, 2010, 101(15):5892-5896.
[5] 姚长洪, 吴佩春, 曹旭鹏, 等.两株筛自大规模生产跑道池的节旋藻性能比较研究[J].中国生物工程杂志, 2017, 37(5):28-37.YAO C H, WU P C, CAO X P, et al.Comparative characterization of two Arthrospira strains isolated from full-scale raceway pond[J].China Biotechnology, 2017, 37(5):28-37.
[6] SILI C, TORZILLO G, VONSHAK A.Ecology of Cyanobacteria II[M].New York London:Springer Dordrecht Heidelberg, 2012:677-705.
[7] CHOIX F J, PALACIOS O A, MONDRAG N-CORTEZ P, et al.Synergic association of the consortium Arthrospira maxima with the microalga growth-promoting bacterium Azospirillum cultured under the stressful biogas composition[J].Bioprocess and Biosystems Engineering, 2024, 47(2):181-193.
N-CORTEZ P, et al.Synergic association of the consortium Arthrospira maxima with the microalga growth-promoting bacterium Azospirillum cultured under the stressful biogas composition[J].Bioprocess and Biosystems Engineering, 2024, 47(2):181-193.
[8] CUELLAR-BERMUDEZ S P, STRUYF T, VERSLUYS M, et al.Quantification of extracellular and biomass carbohydrates by Arthrospira under nitrogen starvation at lab-scale[J].Algal Research, 2022, 68,102907.
[9] LAI Y H, PUSPANADAN S, LEE C K.Nutritional optimization of Arthrospira platensis for starch and total carbohydrates production[J].Biotechnology Progress, 2019, 35(3):e2798.
[10] LIU Q S, YAO C H, SUN Y X, et al.Production and structural characterization of a new type of polysaccharide from nitrogen-limited Arthrospira platensis cultivated in outdoor industrial-scale open raceway ponds[J].Biotechnology for Biofuels, 2019, 12(1):131.
[11] MARKOU G, CHATZIPAVLIDIS I, GEORGAKAKIS D.Effects of phosphorus concentration and light intensity on the biomass composition of Arthrospira (Spirulina) platensis[J].World Journal of Microbiology and Biotechnology, 2012, 28(8):2661-2670.
[12] AIKAWA S, IZUMI Y, MATSUDA F, et al.Synergistic enhancement of glycogen production in Arthrospira platensis by optimization of light intensity and nitrate supply[J].Bioresource Technology, 2012, 108:211-215.
[13] PHÉLIPPÉ M, GONÇALVES O, THOUAND G, et al.Characterization of the polysaccharides chemical diversity of the cyanobacteria Arthrospira platensis[J].Algal Research, 2019, 38, 101426.
[14] YANG Y Q, ZHAO X Q, ZHANG T, et al.Development of a novel starch-based dietary fiber using glucanotransferase[J].Food &Function, 2021, 12(13):5745-5754.
[15] MARTINEZ-GARCIA M, KORMPA A, VAN DER MAAREL M J E C.The glycogen of Galdieria sulphuraria as alternative to starch for the production of slowly digestible and resistant glucose polymers[J].Carbohydrate Polymers, 2017, 169:75-82.
[16] LI J, ZHANG Y Q, YANG S, et al.Isolation, purification, characterization, and immunomodulatory activity analysis of α-glucans from Spirulina platensis[J].ACS Omega, 2021, 6(33):21384-21394.
[17] MISHRA S K, SUH W I, FAROOQ W, et al.Rapid quantification of microalgal lipids in aqueous medium by a simple colorimetric method[J].Bioresource Technology, 2014, 155:330-333.
[18] ALMOMANI F, JUDD S, BHOSALE R R, et al.Intergraded wastewater treatment and carbon bio-fixation from flue gases using Spirulina platensis and mixed algal culture[J].Process Safety and Environmental Protection, 2019, 124:240-250.
[19] ENGLYST K N, ENGLYST H N, HUDSON G J, et al.Rapidly available glucose in foods:An in vitro measurement that reflects the glycemic response[J].The American Journal of Clinical Nutrition, 1999, 69(3):448-454.
[20] Rychter AM, Rao I Role of Phosphorus in Photosynthetic Carbon Metabolism[M].2nd edn.Florida:CRC Press,2005:123-148.
[21] WANG H-T, YAO C-H, AI J-N, et al.Identification of carbohydrates as the major carbon sink of the marine microalga Isochrysis zhangjiangensis (Haptophyta) and optimization of its productivity by nitrogen manipulation[J].Bioresource Technology, 2014, 171:298-304.
[22] YAO C H, AI J H, CAO X P, et al.Enhancing starch production of a marine green microalga Tetraselmis subcordiformis through nutrient limitation[J].Bioresource Technology, 2012, 118:438-444.
[23] G MEZ-CASATI D F, CORTASSA S, AON M A, et al.Ultrasensitive behavior in the synthesis of storage polysaccharides in cyanobacteria[J].Planta, 2003, 216(6):969-975.
MEZ-CASATI D F, CORTASSA S, AON M A, et al.Ultrasensitive behavior in the synthesis of storage polysaccharides in cyanobacteria[J].Planta, 2003, 216(6):969-975.
[24] ROBERTO DE PHILIPPIS C S, MASSIMO VINCENZINI.Glycogen and poly-β-hydroxybutyrate synthesis in Spirulina maxima[J].General Microbiology, 1992, 138:1623-1628.
[25] KATSUHIRO AOYAMA I U, JUN MIYAKE, YASUO ASADA Fermentative metabolism to produce hydrogen gas and organic compounds in a cyanobacterium, Spirulina platensis[J].Fermentation and bioengineering, 1997, 83:17-20.
[26] MARKOU G, CHATZIPAVLIDIS I, GEORGAKAKIS D.Carbohydrates production and bio-flocculation characteristics in cultures of Arthrospira (Spirulina) platensis:Improvements through phosphorus limitation process[J].BioEnergy Research, 2012, 5(4):915-925.
[27] MORSY F M.Acetate versus sulfur deprivation role in creating anaerobiosis in light for hydrogen production by Chlamydomonas reinhardtii and Spirulina platensis:Two different organisms and two different mechanisms[J].Photochemistry and Photobiology, 2011, 87(1):137-142.
[28] WEI M D, HU Y X, ZOU W S, et al.Physicochemical property and antioxidant activity of polysaccharide from the seed cakes of Camellia oleifera Abel[J].Food Science &Nutrition, 2022, 10(5):1667-1682.
[29] CHENG P F, CHANG T, WANG C, et al.High cobalt exposure facilitates bioactive exopolysaccharides production with a novel molecular structure in Botryococcus braunii[J].Chemical Engineering Journal, 2022, 442, 136294.
[30] HU T, HUANG Q L, WONG K, et al.Structure, molecular conformation, and immunomodulatory activity of four polysaccharide fractions from Lignosus rhinocerotis sclerotia[J].International Journal of Biological Macromolecules, 2017, 94:423-430.
[31] WYATT P J.Light scattering and the absolute characterization of macromolecules[J].Analytica Chimica Acta, 1993, 272(1):1-40.
[32] AIKAWA S, HO S-H, NAKANISHI A, et al.Improving polyglucan production in cyanobacteria and microalgae via cultivation design and metabolic engineering[J].Biotechnology Journal, 2015, 10(6):886-898.
[33] MARTINEZ-GARCIA M, STUART M C A, VAN DER MAAREL M J E C.Characterization of the highly branched glycogen from the thermoacidophilic red microalga Galdieria sulphuraria and comparison with other glycogens[J].International Journal of Biological Macromolecules, 2016, 89:12-18.
[34] SEKHARAM K M, VENKATARAMAN L V, SALIMATH P V.Structural studies of a glucan isolated from blue green-alga Spirulina platensis[J].Food Chemistry, 1989, 31(2):85-91.
[35] 王仲孚,彭雪梅,黄琳娟,彭志英,田庚元.钝顶螺旋藻糖缀合物SPPA-1的糖链化学结构研究[J].药学学报, 2001, 36(5):356-359.WANG ZF, PENG XMi, HUANG LJ, PENG ZY, TIAN GY.Study on the chemical structure of the sugar chain of SPPA-1, a blunt-topped glycoconjugate of Arthrospira platensis[J].Acta Pharmaceutica Sinica, 2001, 36(5):356-359.