覆盆子(Rubus idaeus Hu)是蔷薇科悬钩子属的药食同源植物,又称悬钩子、覆盆莓、树莓、野莓等,广泛分布于我国东部和东南部。研究表明,覆盆子富含黄酮、单宁等多酚类化合物,具有抗肿瘤、降血糖和抗炎等多种功能活性[1]。等离子体是由不同放电方式所产生的离子、光子、自由基和亚稳态激发粒子等物质组成的混合体,其能有效的破坏细胞壁结构,促进酚类等活性物质的溶出,从而显著提高植物体中生物活性成分的提取效率[2]。目前,等离子体技术已被广泛用于果蔬灭菌保鲜,如灭活苹果汁中病原体[3],延长柑橘[4]和杏子[5]保质期,提高食品质量。近年来,等离子体处理作为一种新兴技术逐渐应用于天然活性成分的提取,具有效率高、环境污染小等优势。赵玉娟[6]研究发现,相比于双酶法,低温等离子体技术使人参叶总多酚和总黄酮得率分别提高了5.2%和56.8%。BAO等[7]表明,等离子体技术处理能促进番茄多酚在萃取过程中的迁移,其提取率提高了接近10%,同时能提高番茄渣的抗氧化能力。因此,运用等离子体技术提取覆盆子多酚对其促进覆盆子中活性成分的利用具有重要的研究意义。
糖尿病是一种由胰岛素分泌不足所引起的慢性代谢性疾病。据统计,2021年全球糖尿病患病人数为5.4亿,预计到2045年将升至7.8亿[8],其中Ⅱ型糖尿病约占90%以上,已成为严重威胁人们的生命健康。目前,Ⅱ型糖尿病临床治疗药物有磺脲类、格列奈类、双胍类等,但其副作用显著,长期服用可能出现肠胃不适、低血糖、水肿等副作用[9]。而天然多酚因安全,高效等特点,成为天然降血糖活性成分的研究重点,如LI等[10]发现,桑树多酚具有良好的抗氧化和降血糖活性;张露等[1]发现在覆盆子中提取的天然多酚具有良好的降血糖活性。然而,提取物的降血糖活性与其原料特性、提取方法和化学组成密切相关,探究等离子体处理对覆盆子多酚提取,及提取物抗氧化和降血糖活性的影响对其在糖尿病领域的应用具有重要的指导意义。
本论文采用等离子体辅助提取技术制备覆盆子多酚,研究不同等离子体处理条件(处理时间、功率)对覆盆子多酚和黄酮提取效率的影响,并比较提取物的抗氧化、α-葡萄糖苷酶和二肽基肽酶-Ⅳ(dipeptidyl peptidase-Ⅳ, DPP-Ⅳ)酶抑制活性,最后通过质谱技术对不同等离子体处理条件下的覆盆子多酚提取物的主要化学成分进行鉴定和对比分析,旨在促进等离子体处理技术在覆盆子提取方面的应用。
1 材料与方法
1.1 材料与试剂
覆盆子,江西德兴市;没食子酸、槲皮素、对硝基苯-α-D-葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside, pNPG),源叶生物科技有限公司;DPP-Ⅳ(HPLC≥98%),Sino Biological公司;甘氨酰-脯氨酰-对硝基苯胺盐酸盐(Gly-Pro-PNA,HPLC≥98%),MeilunBio公司;α-葡萄糖苷酶(HPLC≥98%)、阿卡波糖(分析纯),美国Sigma公司;ABTS、DPPH,梯希爱(上海)化成工业发展有限公司。
1.2 仪器与设备
Q5200E超声波清洗器,昆山市超声仪器有限公司;RV10旋转蒸发仪,日本EYELA公司;Synergy H1酶标仪,美国Bio Tek公司;UPLC-TripleTOF 6600-MS/MS,美国Sciex公司;HH-4数显电子恒温水浴锅,常州国华电器有限公司;S220-K-CN精密pH计,美特斯-托利多公司。
1.3 实验方法
1.3.1 覆盆子多酚的等离子体辅助提取
称取1.0 g覆盆子粉末,采用等离子体设备在200、300 W条件下分别处理3、5 min,空白对照组不进行处理,以料液比1∶10(g∶mL)加入40%乙醇(体积分数),混匀后在400 W、50 ℃的条件下超声提取1 h[11],提取物在5 000 r/min下离心10 min,收集上清液,残渣在相同条件下重复提取2次,合并上清液并浓缩,用40%乙醇(体积分数)定容到10 mL,得到5种覆盆子提取物(原样、FPZ200-3、FPZ200-5、FPZ300-3、FPZ300-5),放于4 ℃冰箱中保存。
1.3.3 总酚含量测定
参照前期实验方法[12],采用福林酚法测定覆盆子样品中总酚含量,用蒸馏水代替反应体系中的福林酚试剂为样品空白,以没食子酸(0~50 μg/mL)作为标品绘制标准曲线,计算样品中的总酚含量,结果表示为毫克没食子酸当量每克提取物(mg GAE/g E)。
1.3.4 总黄酮含量测定
参照前期实验方法[13],采用硝酸铝显色法测定覆盆子样品的总黄酮含量。以槲皮素(0~50 μg/mL)作为标品绘制标准曲线,计算样品中的总黄酮含量,结果以毫克槲皮素当量每克提取物表示(mg QuE/g E)。
1.3.5 植物化学成分分析
采用超高效液相色谱-四极杆飞行时间质谱(ultra performance liquid chromatography with quadrupole time-of-flight mass spectrometry, UPLC-Q-TOF-MS)技术对覆盆子提取物中的主要化学成分进行定性分析。色谱条件如下:ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相A:0.1%(体积分数)甲酸-水;流动相B:0.1%(体积分数)甲酸-乙腈;梯度洗脱:0~4 min,95% A、5% B;4~32 min,76% A、24% B;32~37 min,10% A、90% B;38~48 min,96% A,4% B;柱温:45 ℃;洗脱流速:0.8 mL/min;进样体积:10 μL。质谱条件为:扫描模式:负离子;离子源:电喷雾离子源;离子源温度:550 ℃;质量扫描范围:m/z 50~1 500;离子喷雾电压:-4 500 V;一级质谱碰撞能:-10 eV;二级质谱碰撞能:-80 eV;雾化气体压力:55 psi;辅助气体压力:55 psi。通过与文献和数据库比对分子质量和特征例子碎片等鉴定覆盆子中的化合物。
1.3.6 抗氧化活性测定
参照ZHANG等[12]的方法测定覆盆子样品的DPPH自由基和ABTS阳离子自由基清除能力。取50 μL覆盆子样品或槲皮素于96孔酶标板中,加入150 μL 0.15 mmol/L DPPH自由基或ABTS阳离子自由基溶液,室温避光反应30 min或者5 min后,分别测定其在517 nm和734 nm处的吸光度(As)。用70%甲醇溶液代替样品为控制组(Ac)、用70%甲醇溶液代替样品和无水乙醇代替自由基溶液的为样品空白组(Aj)。其计算如公式(1)所示:
自由基清除率![]()
(1)
1.3.7 体外酶抑制活性测定
1.3.7.1 α-葡萄糖苷酶抑制活性测定
参照ZHANG等[14]的研究方法测定覆盆子样品的α-葡萄糖苷酶抑制活性。取50 μL适宜浓度的样品溶液与50 μL 0.1 U/mL的α-葡萄糖苷酶混匀,室温下反应6 min,加入50 μL 5.0 mmol/L的pNPG,反应30 min后加入100 μL 0.2 mol/L碳酸钠,于405 nm处测定混合物的吸光值(As)。同时,以样品溶剂代替样品的反应体系为控制组(Ac),以不加酶和样品的反应体系为空白(Aj),阿卡波糖为阳性对照,实验结果用IC50值表示。酶抑制率的计算如公式(2)所示:
抑制率![]()
(2)
1.3.7.2 DPP-Ⅳ酶抑制活性测定
参照VELARDE-SALCEDO等[13]的研究方法测定覆盆子样品的DPP-IV酶抑制活性,将50 μL覆盆子样品与40 μL DPP-IV酶于96孔酶标板上孵育10 min,加入20 μL 0.625 mg/mL Gly-Pro-PNA反应30 min,再加入100 μL 0.1 mol/L NaHCO3溶液终止反应,并于405 nm下测其吸光值(As)。以0.1 mol/L pH 8.0 Tris-HCI buffer代替酶作为样品空白,Tris-HCl buffer代替样品的反应体系的吸光值为控制组(Ac),磷酸缓冲溶液代替DPP-IV酶液的反应体系为空白组(Aj),以Sitagliptin(10 nmol/L)为标品。实验结果用IC50值表示,计算同公式(2)。
1.4 数据处理
所有实验重复3次,结果表示为“平均值±标准差”。采用方差分析和检验分析覆盆子样品间总酚含量、抗氧化和酶抑制活性的差异性。运用Origin 2021软件对数据进行作图,采用SPSS 26软件中进行相关性分析。
2 结果与分析
2.1 总酚和总黄酮含量分析
如图1所示,不同等离子体处理条件下覆盆子提取物的总酚和总黄酮含量存在显著性差异。相比于未处理的样品,等离子体处理显著提高了样品的总酚含量,其含量由高到低依次为:FPZ200-5(362.50 μg GAE/mg E)>FPZ300-5>FPZ200-3>FPZ300-3>原样。提取物中FPZ300-5的总黄酮含量最高,其值为17.41 mg QμE/g E,其次为FPZ200-5,原样的含量最低,其值为12.21 mg QμE/g E。以上结果表明,等离子体处理能显著提高覆盆子提取物中多酚和黄酮的含量,且随处理时间的延长呈现增长的趋势。徐艳阳等[15]研究发现低温等离子体处理后姜粉总黄酮的含量增加,得率为26.9 mg/g,与本研究一致。这可能是因为等离子体处理能破碎细胞壁,有助于多酚和黄酮等活性物质的溶出[6]。
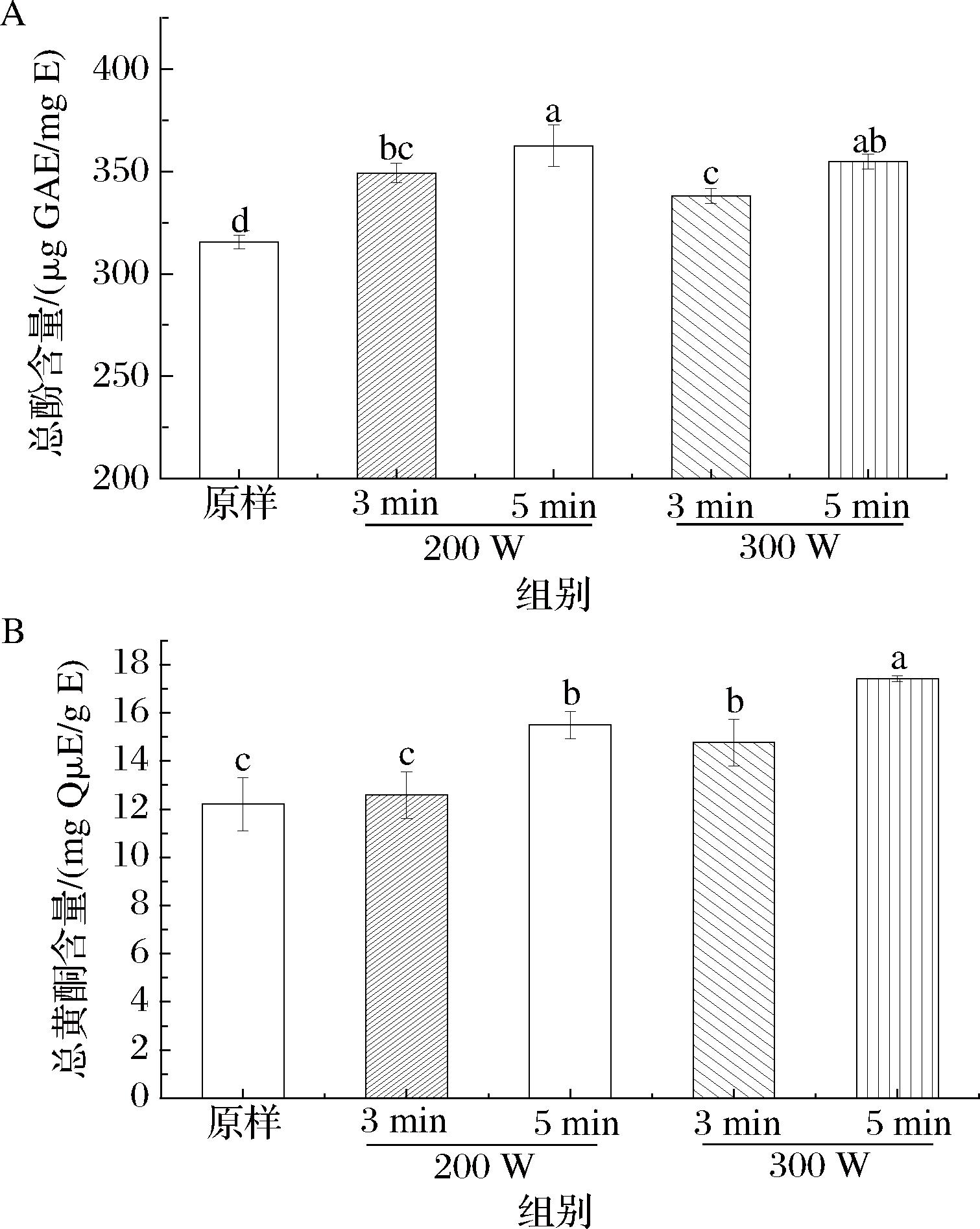
A-总酚;B-总黄酮
图1 等离子体处理时间和功率对覆盆子提取物中总酚和总黄酮含量的影响
Fig.1 Effect of plasma treatment time and power on the contents of total phenol and total flavonoid in R.chingii Hu extracts
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 化学组成分析
采用UPLC-Q-TOF-MS技术对覆盆子样品的主要化学组成进行了定量分析,其结果如图2、图3和表1所示。结合数据库和参考文献,通过比对化合物的保留时间、母离子、分子式以及二级质谱碎片等信息,从覆盆子样品中共鉴定出14种化合物,包括4种酚酸、3种黄酮、3种单宁和4种其他化合物,且这些化合物在5个覆盆子样品中均被检出。
表1 覆盆子提取物中化合物的质谱信息
Table 1 Mass spectral information of compounds in R.chingii Hu extracts
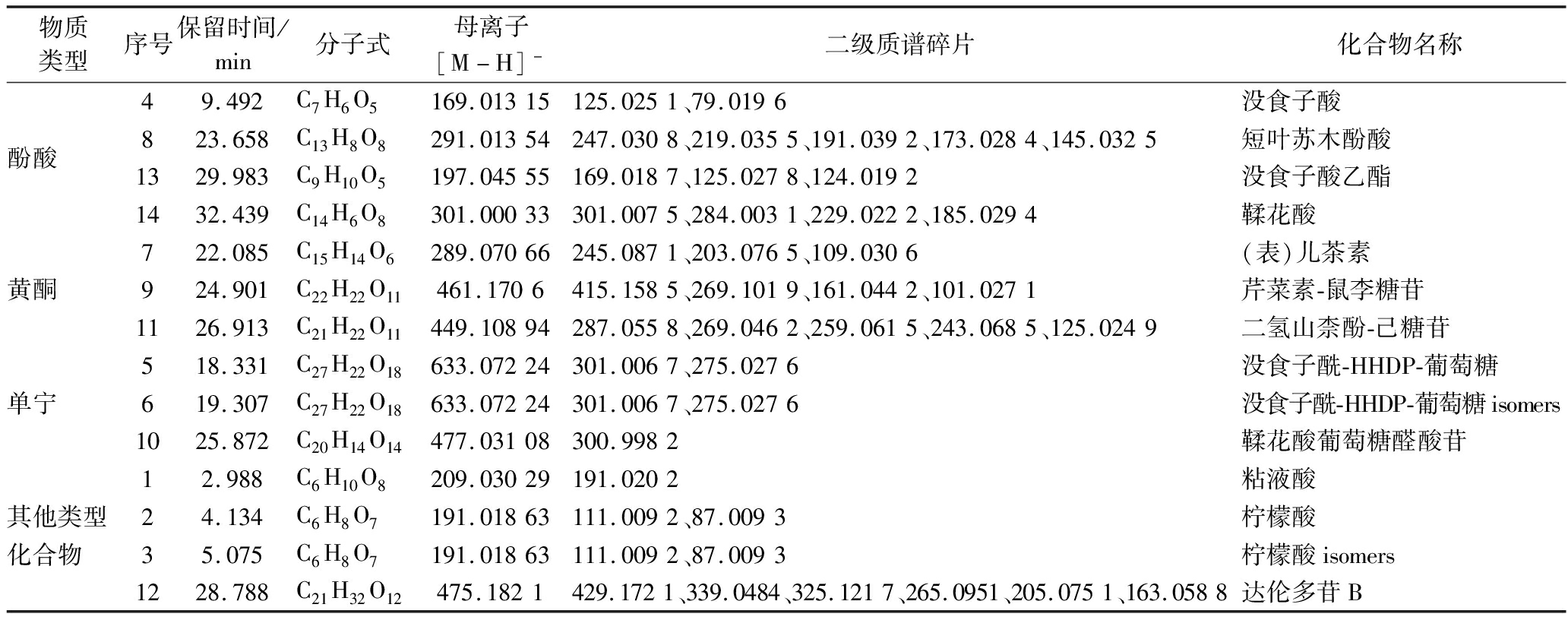
物质类型序号保留时间/min分子式母离子[M-H]-二级质谱碎片化合物名称49.492C7H6O5169.01315125.0251、79.0196没食子酸酚酸823.658C13H8O8291.01354247.0308、219.0355、191.0392、173.0284、145.0325短叶苏木酚酸1329.983C9H10O5197.04555169.0187、125.0278、124.0192没食子酸乙酯1432.439C14H6O8301.00033301.0075、284.0031、229.0222、185.0294鞣花酸722.085C15H14O6289.07066245.0871、203.0765、109.0306(表)儿茶素黄酮924.901C22H22O11461.1706415.1585、269.1019、161.0442、101.0271芹菜素-鼠李糖苷1126.913C21H22O11449.10894287.0558、269.0462、259.0615、243.0685、125.0249二氢山柰酚-己糖苷518.331C27H22O18633.07224301.0067、275.0276没食子酰-HHDP-葡萄糖单宁619.307C27H22O18633.07224301.0067、275.0276没食子酰-HHDP-葡萄糖isomers1025.872C20H14O14477.03108300.9982鞣花酸葡萄糖醛酸苷12.988C6H10O8209.03029191.0202粘液酸其他类型24.134C6H8O7191.01863111.0092、87.0093柠檬酸化合物 35.075C6H8O7191.01863111.0092、87.0093柠檬酸isomers1228.788C21H32O12475.1821429.1721、339.0484、325.1217、265.0951、205.0751、163.0588达伦多苷B
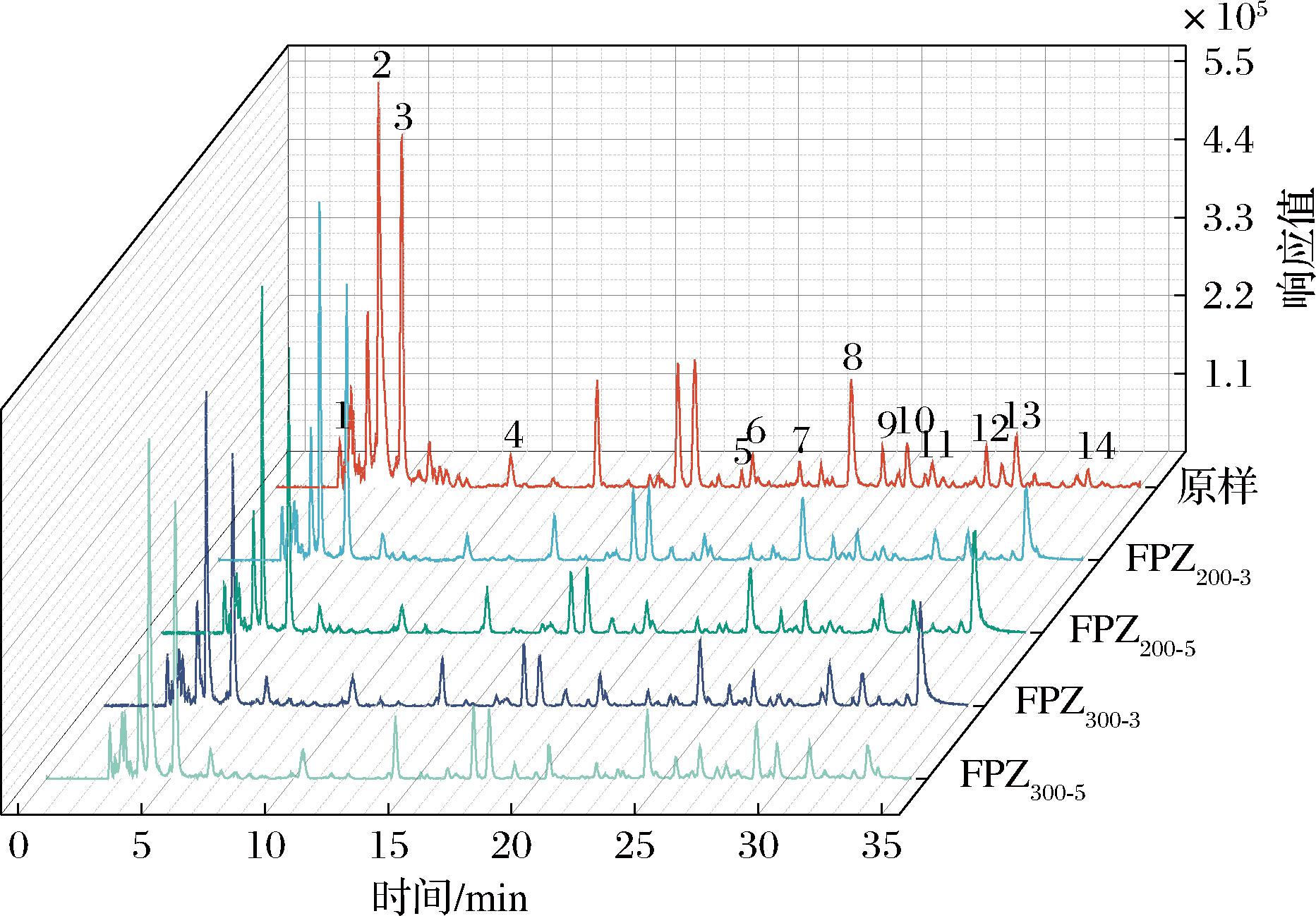
图2 覆盆子提取物的基峰色谱图
Fig.2 Base peak chromatogram of R.chingii Hu extracts
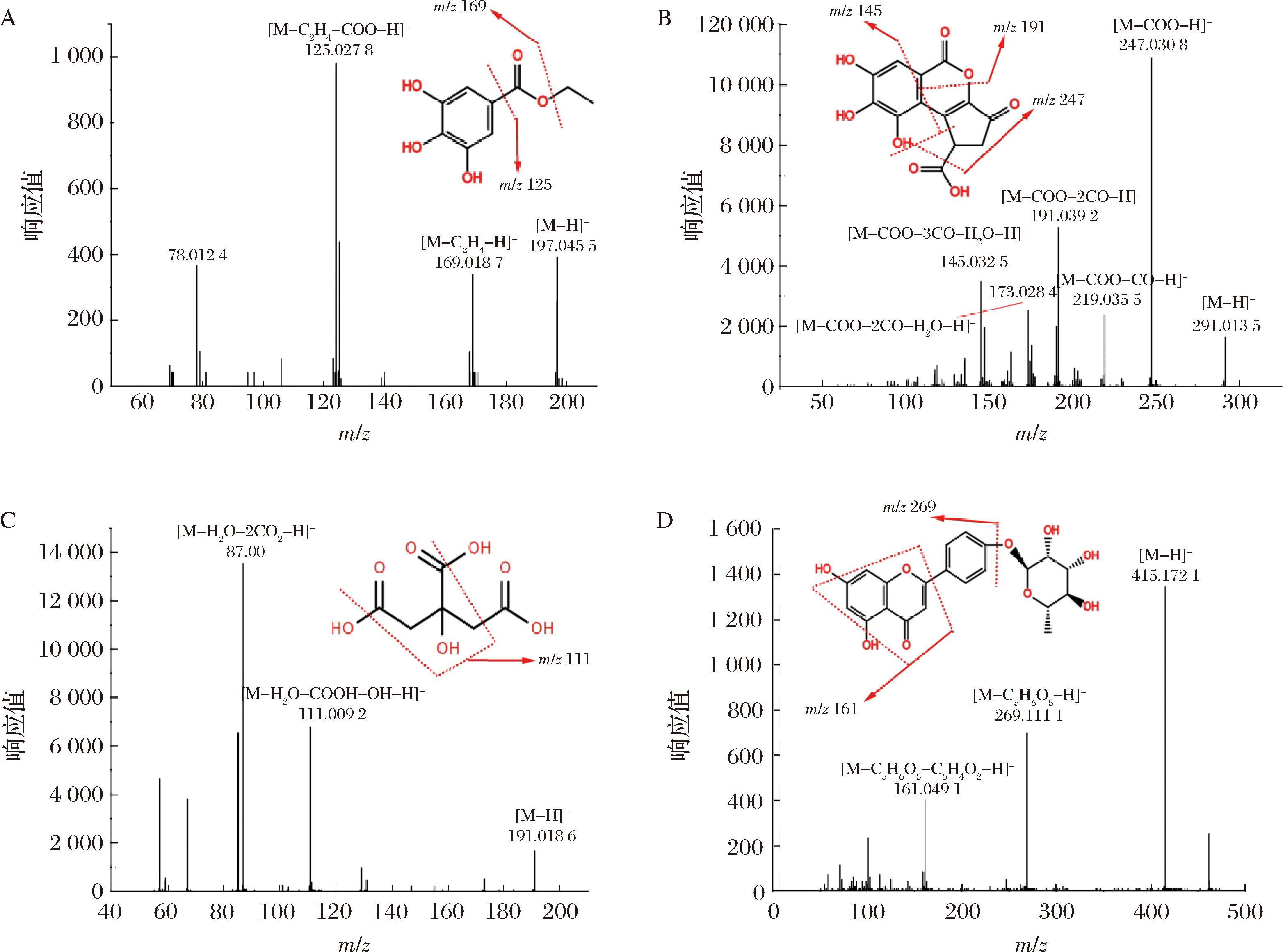
A-没食子酸乙酯;B-短叶苏木酚酸;C-柠檬酸;D-芹菜素-鼠李糖苷
图3 没食子酸乙酯、短叶苏木酚酸、柠檬酸、芹菜素-鼠李糖苷的MS/MS裂解图
Fig.3 MS/MS cleavage pattern of ethyl gallate, shortleaf thujaplicin acid, citric acid, apigenin-rhamnoside
2.2.1 酚酸
从覆盆子样品中共鉴定出4种酚酸。峰8产生的母离子为m/z 291.016 6(C13H8O8),由于含有特征离子碎片m/z 247.030 8[M-CO2-H]-、m/z 219.035 5[M-CO2-CO-H]-和m/z 191.039 2[M-CO2-2CO-H]-,通过和文献对比初步鉴定为短叶苏木酚酸[16]。峰11的母离子为m/z 197.039 5([M-H]-, C9H10O5),具有特征碎片离子m/z 169.014 3和m/z 125.024 5,说明其连续脱落了一个—CH2CH2和H2O,峰11被鉴定为没食子酸乙酯[14]。通过和标准品比对,峰4和峰14分别被鉴定为没食子酸和鞣花酸。
2.2.2 黄酮
峰11的母离子为449.109 7,其特征碎片离子287.055 8(-162 Da)表明其脱去1个六碳糖,碎片离子269.046 2和259.061 5说明其含有1个H2O和—CO,因此其被鉴定为二氢山柰酚-己糖苷。由于和参考文献有相同的特征碎片离子,峰9被认为是芹菜素-鼠李糖苷[17]。峰7的母离子脱去鼠李糖基(146 Da)可得到碎片离子m/z 269.101 9(C15H9O5—),结合特征碎片离子m/z 161.044 2(C9H5O3—),可以初步推测其为芹菜素或大黄素糖苷[18]。然而,在覆盆子果实和叶中发现了芹菜素,在果实中也发现了芹菜素苷[19],但在覆盆子中未发现大黄素。因此,排除峰7为大黄素-鼠李糖苷。通过和标准品比对,峰5([M-H]-,289.072 1,C15H14O6)被鉴定为(表)儿茶素。
2.2.3 单宁和其他化合物
单宁在负离子模式下通常具有以下特征碎片基团:葡萄糖基(162 Da)、葡萄糖醛酸基(176 Da)、没食子酰基(152 Da)、六羟基联苯二甲酰基(hexahydroxydiphenoyl,HHDP)或鞣花酸(302 Da)和没食子酸酰基-葡萄糖(332 Da)等。峰5的母离子为m/z 633.05[M-H]-(C27H22O18),其特征离子碎片为m/z 463.04[M-H-170]-和m/z 301.006 7[M-H-332]-,表明存在没食子酸和HHDP的部分,因此被鉴定为没食子酰-HHDP-葡萄糖。峰10母离子为m/z 477.034 3(C20H14O14,[M-H]-),特征碎片离子为m/z 300.998 2[M-H-176]-,被鉴定为鞣花酸葡萄糖醛酸苷。通过和参考文献比对特征碎片离子,峰1、峰2和峰12分别被鉴定为粘液酸、柠檬酸和达伦多苷B[11]。
2.2.4 提取物中不同类型化合物含量比较
通过比对质谱基峰色谱图中各类化合物的峰面积,得到不同条件下提取物中各组分含量的相对差异,如图4所示。在经过等离子体处理过后,FPZ200-5和FPZ300-3中的酚酸含量上升,而FPZ200-3与FPZ300-5中的酚酸含量减少,此外不同提取物中的黄酮与单宁的含量同样呈下降趋势,但FPZ200-5和FPZ300-3中的单宁含量仍高于FPZ200-3和FPZ300-5。比较其他类型化合物,其中最主要的物质为柠檬酸,原样的含量显著的高于其他组分,而FPZ300-5则高于其他等离子体处理样品。
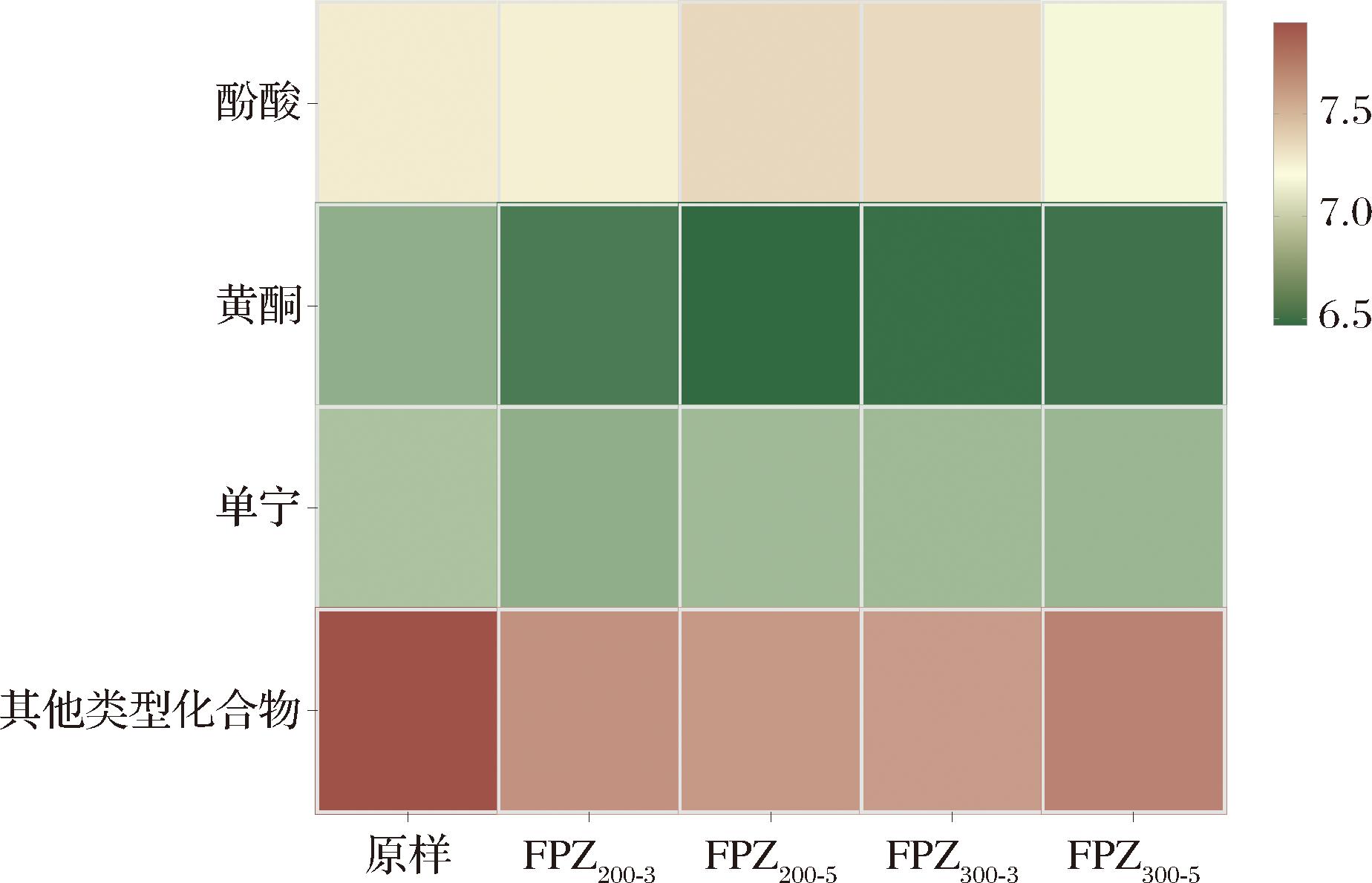
图4 不同处理条件的覆盆子提取物中各物质的含量
Fig.4 Content of each substance in raspberry extracts under different treatment conditions
2.3 抗氧化活性分析
如图5所示,与原样相比,等离子体预处理后的覆盆子样品的ABTS阳离子自由基和DPPH自由基清除能力显著增强。ABTS阳离子自由基清除能力中FPZ300-5的活性最高,其IC50为33.97 μg/mL,相比于原样(IC50=55.91 μg/mL)活性提高39.24%,清除能力显著提高。此外,FPZ200-5的DPPH自由基清除能力最高,其IC50为78.38 μg/mL,其次为FPZ200-3,FPZ300-5,FPZ300-3的最低。以上结果表明等离子体处理能提高覆盆子提取物的抗氧化能力,且长时间处理效果更好。在300 W处理条件下,样品表现出更好的清除效果,推测更高功率的等离子体处理能破坏细胞壁结构,更好的促进抗氧化物质的溶出,且延长处理时间在一定程度上也能提高其抗氧化能力。
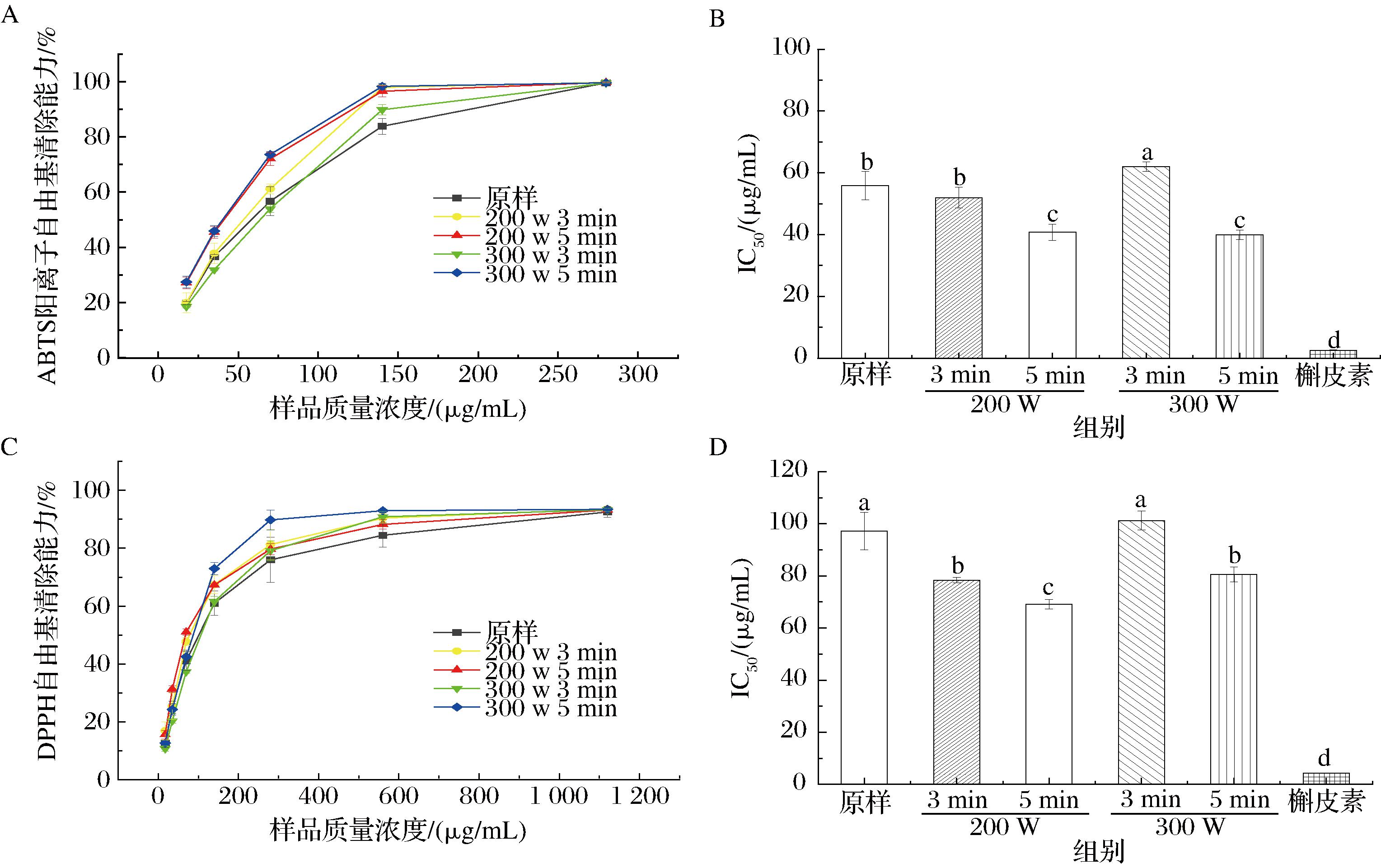
A、B-ABTS阳离子自由基的清除能力和IC50;C、D-DPPH自由基的清除能力和IC50
图5 不同等离子体处理时间和功率下覆盆子提取物的ABTS阳离子自由基和DPPH自由基清除能力
Fig.5 ABTS cation radical DPPH radical scavenging capacity of R.chingii Hu extracts prepared at different plasma treatment times and powers
BAO等[20]利用高压(60 kV)大气冷等离子体处理葡萄渣,发现在不同时间内(5、10、15 min),葡萄渣的DPPH自由基清除能力显著提高,与本论文的结果相一致。KUNGSUWAN等[21]采用冷等离子体技术处理绿咖啡豆提取物,处理35 min时,等离子体处理使其DPPH自由基清除活性显著增加了66%,而酚类分析表明绿原酸和咖啡因显著减少,2种主要的抗氧化物减少,但抗氧化性增强,与本研究中短叶苏木酚酸减少的现象相似,推测是等离子体促进缀合过程发生涉及酚类化合物,提高了化合物的活性,但其具体原因仍需进一步研究确认。
2.4 抗糖尿病活性分析
2.4.1 α-葡萄糖苷酶抑制能力
α-葡萄糖苷酶是一种碳水化合物水解酶,当其活性受到抑制时,碳水化合物的水解活动减弱,从而阻碍小肠对葡萄糖的吸收,以此改善糖尿病人的血糖水平,所以探寻高效的α-葡萄糖苷酶抑制剂对糖尿病的治疗有重要意义。如图6所示,样品的IC50为9.84~8.26 μg/mL,其中FPZ200-5抑制α-葡萄糖苷酶的效果最强(IC50=8.26 μg/mL),是阿卡波糖(IC50=350.84 μg/mL)的42.4倍,提取物原样对α-葡萄糖苷酶的抑制作用最弱,但其与FPZ200-5之间无显著性差异。与阿卡波糖相比,原样和经等离子体处理过的覆盆子提取物均能有效抑制α-葡萄糖苷酶的活性,且抑制效果与等离子体处理时间有关,等离子体处理5 min的抑制效果更好,而处理3 min的抑制效果与未经处理的效果相近。以上结果表明,长时间的等离子处理能显著增强覆盆子提取物的α-葡萄糖苷酶抑制活性,而功率对其活性影响较小。
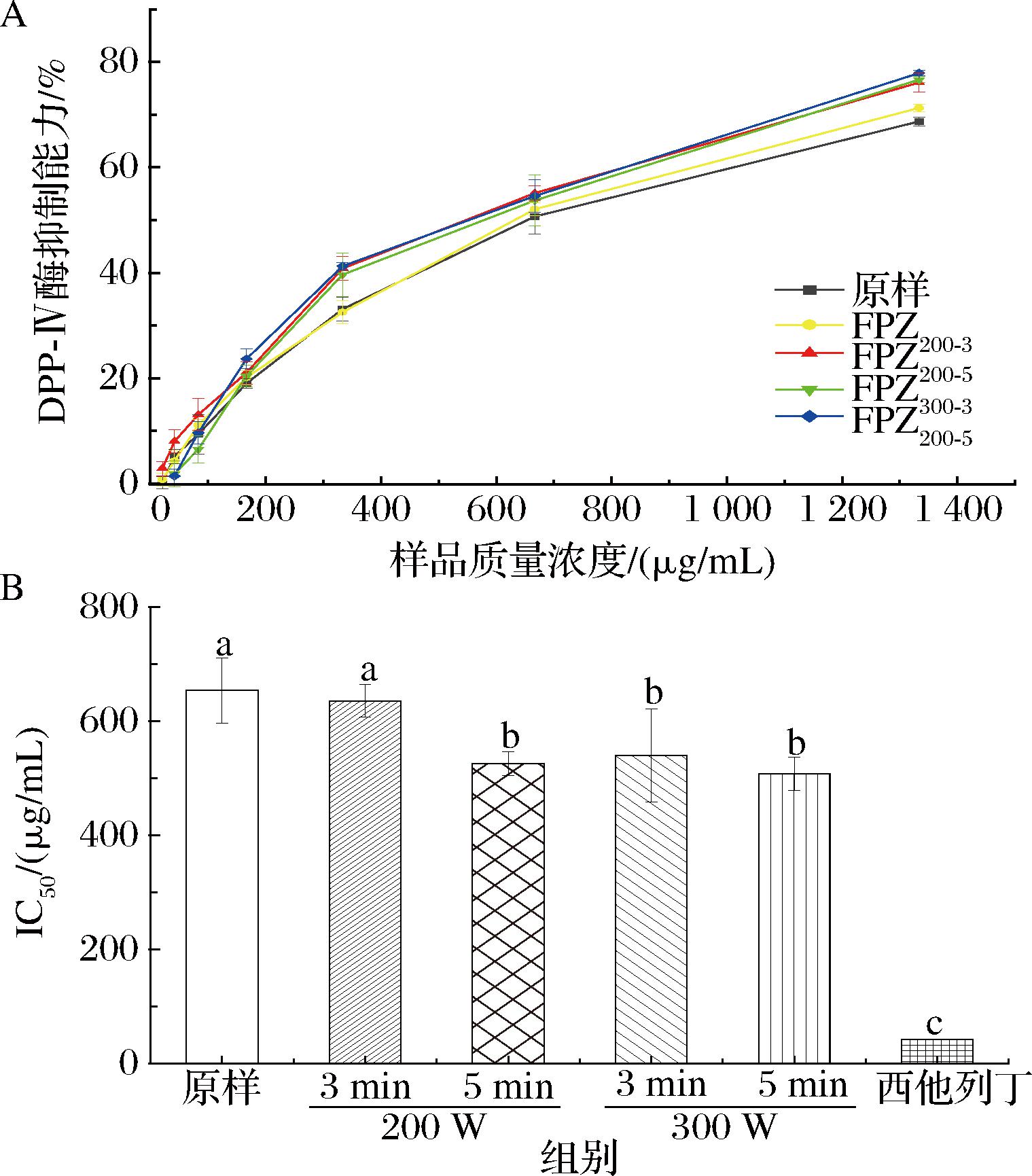
A-DPP-IV酶抑制能力;B-IC50
图6 不同等离子体处理时间和处理功率下覆盆子提取物的α-葡萄糖苷酶抑制能力
Fig.6 α-glucosidase inhibition ability of raspberry extracts under different plasma treatment times and powers
2.4.2 DPP-Ⅳ酶活性抑制能力
DPP-Ⅳ是一类丝氨酸蛋白酶,主要作用于分解葡萄糖依赖性促胰岛素释放多肽GIP和肠促胰岛素GLP-1[22],其在降低血糖方面起着重要作用,抑制DPP-Ⅳ酶能减少这2种物质的降解,从而调节血液中葡萄糖水平。如图7所示,FPZ300-5抑制DPP-Ⅳ酶的IC50值最小,为507.60 μg/mL,抑制能力最强,其次是FPZ200-5和FPZ300-3,IC50值分别为525.99 μg/mL和540.01 μg/mL。等离子处理后提取物的抑制效果显著高于原样,与α-葡萄糖苷酶等离子体预处理覆盆子得到的提取物有更好的DPP-Ⅳ酶抑制活性,且与处理时间成正比关系。

A-抑制率;B-IC50值
图7 不同等离子体处理时间和处理功率下覆盆子提取物的DPP-Ⅳ酶抑制能力
Fig.7 DPP-Ⅳ enzyme inhibition ability of R.chingii Hu extracts prepared by different plasma treatment times and powers
在等离子体处理过程中,等离子体可以帮助活性化合物从蛋白质和碳水化合物复合物中释放出来[23],促使提取物活性物质浓度增加。鞣花酸(ellagic acid,EA)是一种天然的抗糖尿病化合物具有良好的生物活性,在上述质谱分析实验结果中,等离子体处理过后样品中的鞣花酸的含量明显上升,促使样品的抗糖尿病活性增加能力增强。此外,据报道等离子体处理中产生的化学物质会改变样多糖的性质和生物活性[24],这些物质是否也会影响酚类化合物的生物活性,仍需进一步探究。
3 结论
本研究对比了不同时间和功率等离子体辅助提取的覆盆子提取物中的总酚和总黄酮含量、抗氧化和降血糖活性以及其化学组成。结果表明,等离子体预处理可提升提取物中总酚和总黄酮含量,且随处理时间的延长呈现增长的趋势,其中FPZ200-5和FPZ300-5具有最高含量的总酚和总黄酮,相比原样分别增加16.08%和42.59%。同时其抗氧化和降血糖能力也显著提高,FPZ300-5的ABTS阳离子自由基清除能力和DPP-IV酶抑制能力相比于原样显著提升(P<0.05);FPZ200-5的α-葡萄糖苷酶抑制能力增强1.2倍。共从覆盆子提取物中鉴定出了14种化合物,包括酚酸类化合物4种、黄酮类化合物3种、单宁类化合物3种、以及其他类型化合物4种,其中酚酸的含量上升,其他类型化合物如柠檬酸的含量整体降低,而天然酚酸有较强的生物活性,是覆盆子潜在的抗氧化和降血糖成分。因此,等离子体预处理可以有效的增加覆盆子多酚的溶出,从而提高覆盆子提取物的抗氧化和降血糖活性,本研究拓宽等离子体技术的应用范围,促进覆盆子的高值化利用。
[1] 张露, 王夜寒, 梅强根, 等.覆盆子不同多酚组成及抗氧化、抗糖尿病活性[J].食品科学, 2022, 43(18):192-199.ZHANG L, WANG Y H, MEI Q G, et al.Composition and antioxidant and antidiabetic activities of different polyphenol fractions from the fruits of Rubus chingii Hu[J] Food Science, 2022, 43(18):192-199.
[2] XI J, WANG Y, ZHOU X B, et al.Cold plasma pretreatment technology for enhancing the extraction of bioactive ingredients from plant materials:A review[J].Industrial Crops and Products, 2024, 209:117963.
[3] RODRIGUES PETRUS R, JOSEPH CHUREY J, WILLIAM WOROBO R.High pressure processing of apple juice:The most effective parameters to inactivate pathogens of reference[J].British Food Journal, 2020, 122(12):3969-3979.
[4] YEON W,JO L,C M.Mandarin preservation by microwave-powered cold plasma treatment[J].Innovative Food Science &Emerging Technologies, 2017, 39:25-32.
[5] HUA X W, LI T T, WU C E, et al.Novel physical treatments (Pulsed light and cold plasma) improve the quality of postharvest apricots after long-distance simulated transportation[J].Postharvest Biology and Technology, 2022, 194:112098.
[6] 赵玉娟.人参叶多酚的提取及应用研究[D].长春:吉林大学, 2020.ZHAO Y J.Studies on the extraction and application of polyphenolsfrom ginseng leaves[D].Changchun:Jilin University, 2020.
[7] BAO Y W, REDDIVARI L, HUANG J Y.Development of cold plasma pretreatment for improving phenolics extractability from tomato pomace[J].Innovative Food Science &Emerging Technologies, 2020, 65:102445.
[8] SUN H, SAEEDI P, KARURANGA S, et al.IDF Diabetes Atlas:Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J].Diabetes Research and Clinical Practice, 2022, 183:109119.
[9] DAHLÉN A D, DASHI G, MASLOV I, et al.Trends in antidiabetic drug discovery:FDA approved drugs, new drugs in clinical trials and global sales[J].Frontiers in Pharmacology, 2022, 12:807548.
[10] LI Z Z, LIU Y X, XIANG J L, et al.Diverse polyphenol components contribute to antioxidant activity and hypoglycemic potential of mulberry varieties[J].LWT, 2023, 173:114308.
[11] TAN J, WANG D S, LU Y, et al.Metabolic enzyme inhibitory abilities, in vivo hypoglycemic ability of palmleaf raspberry fruits extracts and identification of hypoglycemic compounds[J].Food Science and Human Wellness, 2023, 12(4):1232-1240.
[12] ZHANG L, TU Z C, YUAN T, et al.Solvent optimization, antioxidant activity, and chemical characterization of extracts from Artemisia selengnesis Turcz[J].Industrial Crops and Products, 2014, 56:223-230.
[13] VELARDE-SALCEDO A J, BARRERA-PACHECO A, LARA-GONZ LEZ S, et al.In vitro inhibition of dipeptidyl peptidase IV by peptides derived from the hydrolysis of amaranth (Amaranthus hypochondriacus L.) proteins[J].Food Chemistry, 2013, 136(2):758-764.
LEZ S, et al.In vitro inhibition of dipeptidyl peptidase IV by peptides derived from the hydrolysis of amaranth (Amaranthus hypochondriacus L.) proteins[J].Food Chemistry, 2013, 136(2):758-764.
[14] ZHANG L, TU Z C, XIE X, et al.Antihyperglycemic, antioxidant activities of two Acer palmatum cultivars, and identification of phenolics profile by UPLC-QTOF-MS/MS:New natural sources of functional constituents[J].Industrial Crops and Products, 2016, 89:522-532.
[15] 徐艳阳, 李雪凤, 柴雨行, 等.低温等离子体预处理对超声辅助提取姜粉总黄酮的影响及机制初探[J].食品工业科技, 2024, 45(13):159-167.XU Y Y, LI X F, CHAI Y X, et al.Effects and mechanisms of low-temperature plasma pretreatment on the ultrasound-assisted extraction process of total flavonoids from ginger powder[J].Science and Technology of Food Industry, 2024, 45(13):159-167.
[16] LI K Y, ZENG M L, LI Q L, et al.Identification of polyphenolic composition in the fruits of Rubus chingii Hu and its antioxidant and antiproliferative activity on human bladder cancer T24 cells[J].Journal of Food Measurement and Characterization, 2019, 13(1):51-60.
[17] SUN Y, QIN Y, LI H Y, et al.Rapid characterization of chemical constituents in Radix Tetrastigma, a functional herbal mixture, before and after metabolism and their antioxidant/antiproliferative activities[J].Journal of Functional Foods, 2015, 18:300-318.
[18] YAN Y, ZHANG Q Q, FENG F.HPLC-TOF-MS and HPLC-MS/MS combined with multivariate analysis for the characterization and discrimination of phenolic profiles in nonfumigated and sulfur-fumigated rhubarb[J].Journal of Separation Science, 2016, 39(14):2667-2677.
[19] SCHULZ M, SERAGLIO S K T, DELLA BETTA F, et al.Blackberry (Rubus ulmifolius Schott):Chemical composition, phenolic compounds and antioxidant capacity in two edible stages[J].Food Research International, 2019, 122:627-634.
[20] BAO Y W, REDDIVARI L, HUANG J Y.Enhancement of phenolic compounds extraction from grape pomace by high voltage atmospheric cold plasma[J].LWT, 2020, 133:109970.
[21] KUNGSUWAN K, SAWANGRAT C, OUNJAIJEAN S, et al.Enhancing bioactivity and conjugation in green coffee bean (Coffea Arabica) extract through cold plasma treatment:Insights into antioxidant activity and phenolic—protein conjugates[J].Molecules, 2023, 28(20):7066.
[22] DEACON C F, HOLST J J.Dipeptidyl peptidase IV inhibitors:A promising new therapeutic approach for the management of type 2 diabetes[J].The International Journal of Biochemistry &Cell Biology, 2006, 38(5-6):831-844.
[23] HEYDARI M, CARBONE K, GERVASI F, et al.Cold plasma-assisted extraction of phytochemicals:A review[J].Foods, 2023, 12(17):3181.
[24] HUO J H, ZHU B Y, MA C, et al.Effects of chemically reactive species generated in plasma treatment on the physico-chemical properties and biological activities of polysaccharides:An overview[J].Carbohydrate Polymers, 2024, 342:122361.