我国作为世界上最大的对虾养殖国,对虾产业在国民经济中占据着重要地位。2023年,我国对虾产量同比增长6.4%,广东产量位居全国第一,占比近四成[1]。其中,凡纳滨对虾以其优良的品质、丰富的营养和独特的风味备受消费者喜爱。然而,在以往的对虾加工过程中,虾头部位常被作为废弃物处理,这不仅造成资源浪费,而且对环境造成负担。既往研究表明,虾头也可作为制备甲壳素的原料使用[2],但在其生产过程中又会因添加强酸强碱造成虾头中丰富的蛋白质浪费以及环境污染问题,所以如何高值化利用对虾虾头,提高产品的附加值就成为当前众多学者关注的热点问题。
近年来,快节奏的和高压的现代生活,导致疲劳现象普遍发生,而抗氧化应激策略作为减轻疲劳、提升健康水平的关键手段,正逐渐成为科研探索的焦点。在此背景下,从海洋生物中所提取的活性多肽因其具有清除自由基[3]、抑制氧化应激反应[4]和抗肿瘤[5]等作用成为众多研究学者所关注的对象。如LEIVA-PORTILLA等[6]利用水提法和碱提法回收虾下脚料中的蛋白质,通过蛋白酶(alcalase和flavourzyme)得到具备抗氧化活性的水解物,并得出使用flavourzyme酶得到的酶解物具有高效的DPPH自由基清除能力;MECHRI等[7]利用丝氨酸碱性蛋白酶水解白虾的副产物(虾头、壳)得到7 kDa的F5肽,通过体外和体内实验证明F5肽具有优良的铁离子螯合能力和铁还原能力,且能够显著提高HEK293细胞的活力,防止肾细胞脂质和蛋白质发生氧化损伤。上述报道表明从虾副产品中得到的多肽具有显著的抗氧化活性,但却未深入探讨其抗氧化活性与抗疲劳效果之间的内在关系。同时,既往研究也鲜有提及虾头多肽在抗氧化应激与抗疲劳作用之间的相关性。但值得注意的是,一些学者对其他海洋生物来源的多肽进行了深入研究,如WANG等[8]通过构建力竭游泳小鼠模型,研究了带鱼肽对小鼠运动耐力和抗疲劳特性的影响,其结果表明带鱼肽能够显著延长小鼠的游泳时间,增强氧化氢酶(catalase, CAT)和超氧化物歧化酶(superoxide dismutase, SOD)的活性,可有效缓解小鼠的疲劳症状。上述研究表明海洋生物来源的多肽具有显著的抗氧化与抗疲劳能力,且两者之间关系密切。因此,通过力竭游泳小鼠模型进一步明确虾头活性多肽的抗疲劳作用,并深入探讨其抗氧化应激与抗疲劳作用之间的相关性,具有重要的学术价值和实际意义。
鉴于上述研究中的问题,本研究聚焦于利用凡纳滨对虾加工过程中产生的下脚料——废虾头作为原料,凭借废虾头自身富含的内源酶自溶特性,在环境友好(无化学试剂)且低成本(无需引入外源酶)的条件下制备蛋白质活性多肽,并结合体外实验(抗氧化能力测定)以及小鼠游泳实验,从其抗氧化应激角度来探讨该活性多肽对力竭游泳小鼠的抗疲劳作用,以期为虾头活性多肽在抗氧化和抗疲劳领域的应用提供理论依据。
1 材料与方法
1.1 原料
凡纳滨对虾虾头;湛江国联水产开发股份有限公司;SPF级雄性昆明小鼠(动物许可证号:SCXK(湘)2019-0004),5~6周龄,体质量(20±2)g,湖南斯莱克景达实验动物有限公司;CAT、SOD、钠钾三磷酸腺嘌呤核苷酸酶(sodium-potassium adenosine triphosphatase,Na+K+-ATPase)、钙镁三磷酸腺嘌呤核苷酸酶(calcium-magnesium adenosine triphosphatase,Ca2+ Mg2+-ATPase)试剂盒,苏州格锐思生物科技有限公司;DPPH、Folin-酚法试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
AUY120电子分析天平,岛津仪器有限公司;StepOnePlus实时荧光定量PCR仪,赛默飞世尔科技(苏州)有限公司;BX43正置显微镜,日本奥林巴斯仪器有限公司;H3-20KR台式高速冷冻离心机,湖南可成仪器设备有限公司;PHSJ-4F精密pH计,上海仪电科学仪器股份有限公司;WTM-1812G膜分离设备,杭州沃腾膜工程有限公司;A200梯度PCR 扩增仪,杭州朗基科学仪器有限公司。
1.3 实验方法
1.3.1 凡纳滨对虾虾头溶液及活性多肽的制备
参考彭元怀等[9]的方法,将鲜活凡纳滨对虾的虾头取下后,即放入泡沫箱并覆盖碎冰密封(便于短暂运输保存),然后使用匀浆机对凡纳滨对虾虾头进行匀浆(10 000 r/min),上述操作于4 h内处理完毕。将浆液pH值调为7.5后在水浴锅中进行振荡(转速120 r/min,温度50 ℃),开启自溶反应,上述反应2 h后沸水浴中灭酶(100 ℃)10 min。上述酶解液离心后得到上清液,使用0.45 μm规格的水性滤膜抽滤后得到滤液,后转入超滤膜中(截留分子质量为3 000 Da)过滤,收集透过液经冷冻干燥后即为多肽冻干粉,依据GB 5009.235—2016《食品中氨基酸态氮的测定》中的酸度计法对样品中的多肽含量进行测定,测定结果为(91.22±0.23)%(质量分数)。
1.3.2 实验动物选用及分组
5~6周龄雄性昆明小鼠40只,体质量(20±2) g,2只一组随机分笼,自由采食和饮水。实验用随机数法分为NC(正常空白)组、TP(阳性对照牛磺酸)组和SP(虾头活性多肽)低(SPL)、中(SPM)、高(SPH)剂量组,SP低、中、高剂量分别为200 mg/(kg·d)、400 mg/(kg·d)和600 mg/(kg·d),NC组给予蒸馏水400 mg/(kg·d),TP组给予牛磺酸400 mg/(kg·d),实验时间为28 d。上述实验已通过重庆第二师范学院动物伦理委员会批准(批准号:2023030701B),研究方案等相关资料符合医学伦理原则和赫尔辛基宣言的各项要求,并严格遵守国家及国际动物实验研究伦理标准。
1.3.3 昆明小鼠负重游泳实验
参考姜丽冬等[10]相关方法,选取NC、TP和SP各剂量组实验小鼠(每组8只),进行负重游泳实验。实验小鼠灌胃30 min后,将其尾部负载自身体重5.00%(质量分数)铅皮后置入游泳箱中(箱规格50 cm×50 cm×40 cm,水深45 cm,水温25 ℃),观察各组小鼠游泳状态,逐一记录各小鼠从入水到沉入水面7 s后不再上浮的时间。
1.3.4 昆明小鼠组织样本的采集与制备
参考李欣[11]的方法,游泳实验后的昆明小鼠通过眼球取血后脱颈处死,血液经过离心(4 ℃,4 000 r/min)后低温保存备用(-20 ℃),取其肝脏组织以及腿部肌肉样本组织,低温保存备用(-80 ℃),用于后续生化指标及相关基因表达测定。
1.4 虾头活性多肽的抗氧化能力评价
1.4.1 DPPH自由基清除能力测定
参考刘菲霞等[12]的方法并略作修改,分别取3 mL质量浓度为(0.5、1、2、4、6、8、10 mg/mL)的虾头多肽样品溶液与等体积的摩尔浓度为0.2 mmol/L DPPH溶液混匀静置30 min后,在517 nm测其吸光度(Ai),同时将3 mL DPPH溶液与3 mL无水乙醇混合,3 mL多肽样品溶液与3 mL无水乙醇混合,使用相同方法测定2种混合液分别为A0和Aj,然后依据公式(1)计算DPPH自由基清除率以谷胱甘肽(glutathione,GSH)作阳性对照。
DPPH自由基清除率![]()
(1)
1.4.2 羟自由基清除能力测定
精确配制水杨酸-乙醇溶液(9 mmol/L)、FeSO4(9 mmol/L)和H2O2(8.8 mmol/L)。取2 mL质量浓度为(0.5、1、2、4、6、8、10 mg/mL)的虾头多肽样品溶液,分别加入上述的FeSO4和水杨酸-乙醇溶液各2 mL,最后加入2 mL的H2O2,混匀,在37 ℃下反应1 h,于510 nm处测定吸光度(AS)。用同体积的蒸馏水替换H2O2溶液,其余步骤同上测定吸光值,作对照组(Ab);用等体积蒸馏水替换酶解液样品,其余步骤同上测定吸光值,做空白组(A0)。通过公式(2)计算酶解液对羟自由基的清除率(以谷胱甘肽作阳性对照):
羟自由基清除率![]()
(2)
1.5 各项生化指标检测
将制备的血清用于检测CAT、SOD含量,肝脏组织液用于检测Ca2+Mg2+-ATPase和Na+K+-ATPase活性,上述指标按其试剂盒操作方法进行测定。
1.6 昆明小鼠组织的病理学观察
参照张世奇等[13]的研究方法,昆明小鼠肝脏组织采用HE染色法进行制片观测。
1.7 RNA提取和荧光定量分析
参考张世奇等[13]的研究方法,分别取50 mg无菌生理盐水洗净的小鼠肝脏组织和腿部肌肉(股四头肌)组织,使用TRIzol试剂提取各组织中的RNA(测其浓度及纯度),并将其转录成cDNA后使用荧光PCR仪进行PCR反应。PCR扩增条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,40 次循环。所测基因分别为核因子E2相关因子2(nuclear factor erythtoid 2 related factor 2, Nrf2)(肌肉组织)、血红素氧化酶1(heme oxygenase 1,HO-1)(肌肉组织)和细胞凋亡标志蛋白(cleaved caspase 3, C-caspase 3)(肝脏组织)。以内参基因β-actin为基准,通过公式 2-ΔΔCT计算各基因mRNA的相对表达量。上述各基因引物由Invitrogen公司设计并合成,引物序列见表1。
表1 引物序列
Table 1 Primers sequence

基因引物序列上游引物(5′-3′)下游引物(5′-3′)引物长度/bpBeta-actinGGCTGTATTCCCCTCCATCGCCAGTTGGTAACAATGCCATGT154Nrf2TAGATGACCATGAGTCGCTTGCGCCAAACTTGCTCCATGTCC153HO-1GATAGAGCGCAACAAGCAGAACAGTGAGGCCCATACCAGAAG111C-caspase3CTGACTGGAAAGCCGAAACTCCGACCCGTCCTTTGAATTTCT189
1.8 数据分析
实验数据使用SPSS 19.0进行统计学分析,试验结果以“平均值±标准差”表示。多组间采用One way ANOVA进行Duncan 氏法比较,两两比较采用LSD检验,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 DPPH自由基清除能力测定结果
研究表明,抗氧化肽主要通过3种机制发挥抗氧化作用:直接清除自由基、螯合促氧化金属离子以及增强抗氧化防御能力,从而抑制生物体内的氧化应激[14]。由图1可知,在质量浓度为0.5 mg/mL时,GSH的DPPH自由基清除率已达86.23%,随着浓度的逐渐上升,GSH的DPPH自由基清除率逐渐缓慢增加,最终在质量浓度为6.0 mg/mL时,其DPPH自由基清除率达到最高95.63%;与GSH相比,在质量浓度为0.50 mg/mL时,SP的DPPH自由基清除率仅为11.52%,随着其质量浓度的逐渐上升,其DPPH自由基清除率急剧上升,在质量浓度为8.00 mg/mL时,其DPPH自由基清除率达到最高83.04%,最为接近对照品GSH。结果表明SP对DPPH自由基清除能力虽然不如对照品GSH,但也表现出良好的清除作用,具有一定的抗氧化活性,其抗氧化活性与浓度呈线性关系,尤其在质量浓度为8.0 mg/mL时,具有良好的DPPH自由基清除能力,推测可能是由于SP的特殊分子结构中可能存在一些能够捕捉自由基的特定基团,从而减少自由基对细胞的损伤[15]。
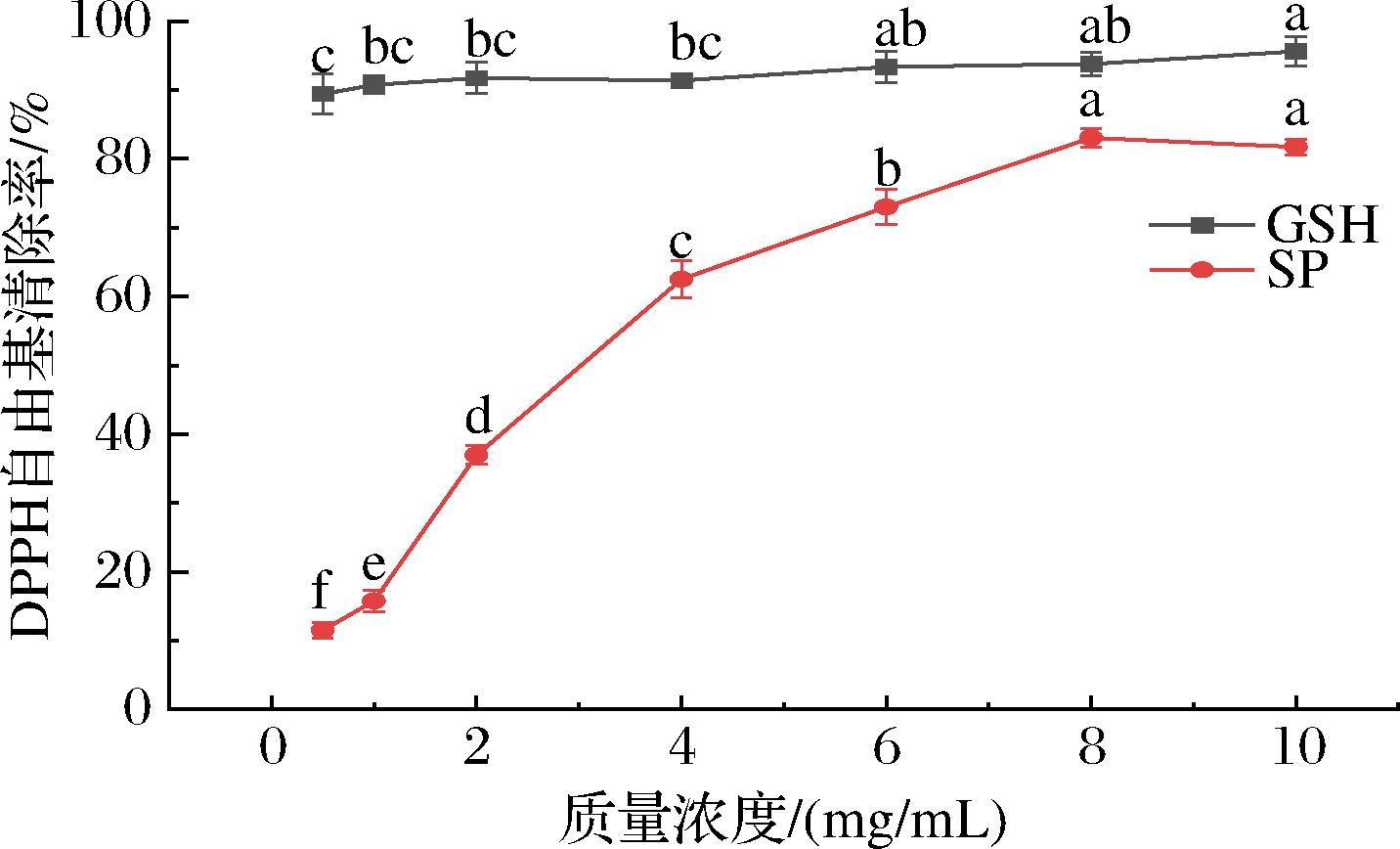
图1 SP清除DPPH自由基能力结果
Fig.1 DPPH radical scavenging ability of SP
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 羟自由基清除能力测定结果
由图2可知,在质量浓度为0.50 mg/mL时,GSH的羟自由基清除率已达91.39%,随着浓度的逐渐上升,GSH的DPPH自由基清除率逐渐缓慢增加,最终在质量浓度为6.00 mg/mL时,其羟自由基清除率为96.89%,已接近最高值;与GSH相比,在质量浓度为0.50 mg/mL时,SP的羟自由基清除率37.47%,随着其质量浓度的逐渐上升,其羟自由基清除率急剧上升,在质量浓度为6.00 mg/mL时,其羟自由基清除率达到最高94.50%,最为接近对照品GSH。结果表明,在质量浓度为6.0 mg/mL时,SP具有良好的羟自由基清除能力,其清除能力与等同质量浓度的GSH较为接近。
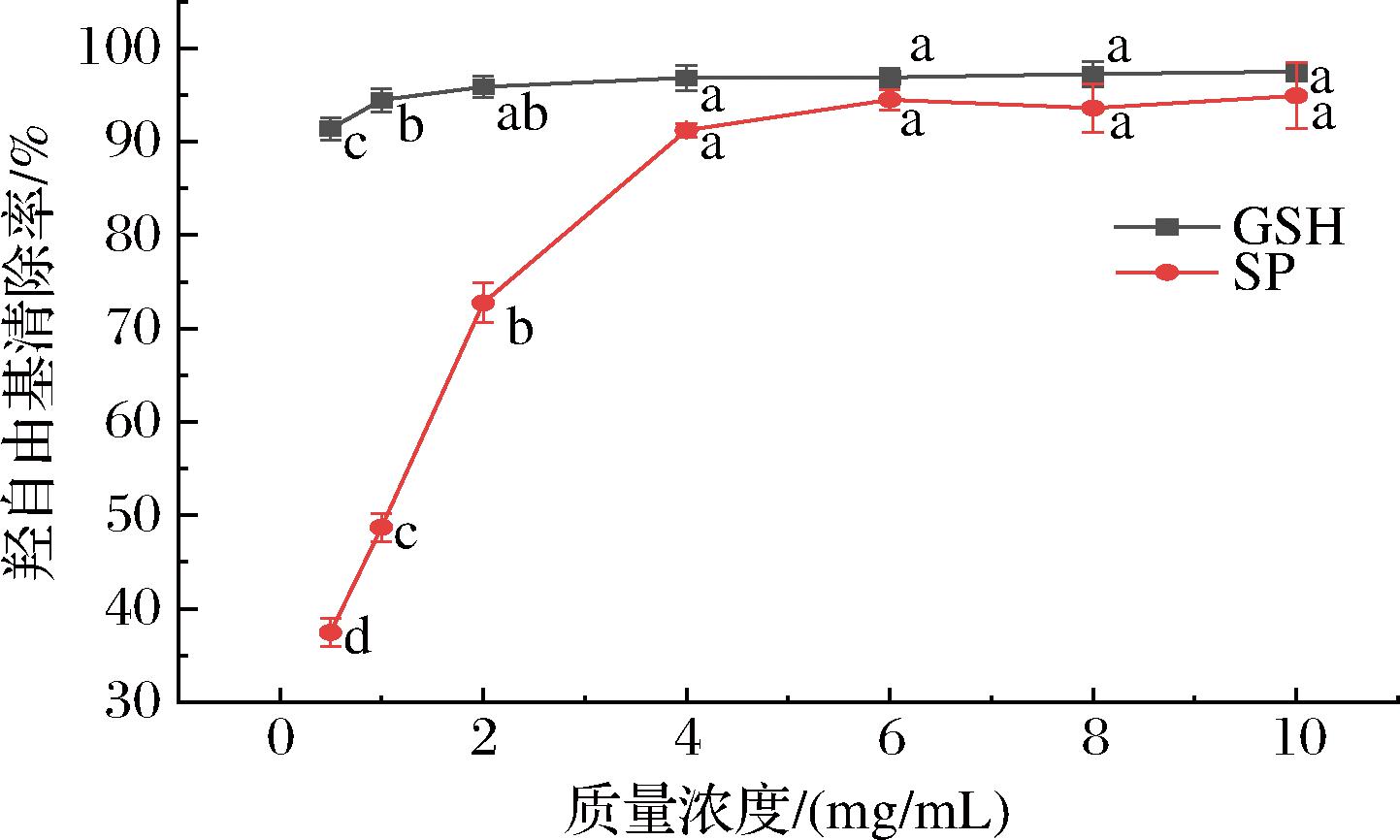
图2 虾头活性多肽清除羟自由基能力结果
Fig.2 Hydroxyl radicals scavenging capacity of SP
2.3 SP对昆明小鼠游泳时间的影响
由图3可知,与NC组相比,SP低、中、高剂量组小鼠负重游泳时间依次显著延长了48.76%、78.48%、92.42%(P<0.05),TP组显著延长了2.70倍(P<0.05)。结果表明,SP各剂量组中SPH组效果最为显著,仅次于TP组,表明SP具有良好的抗氧化活性。
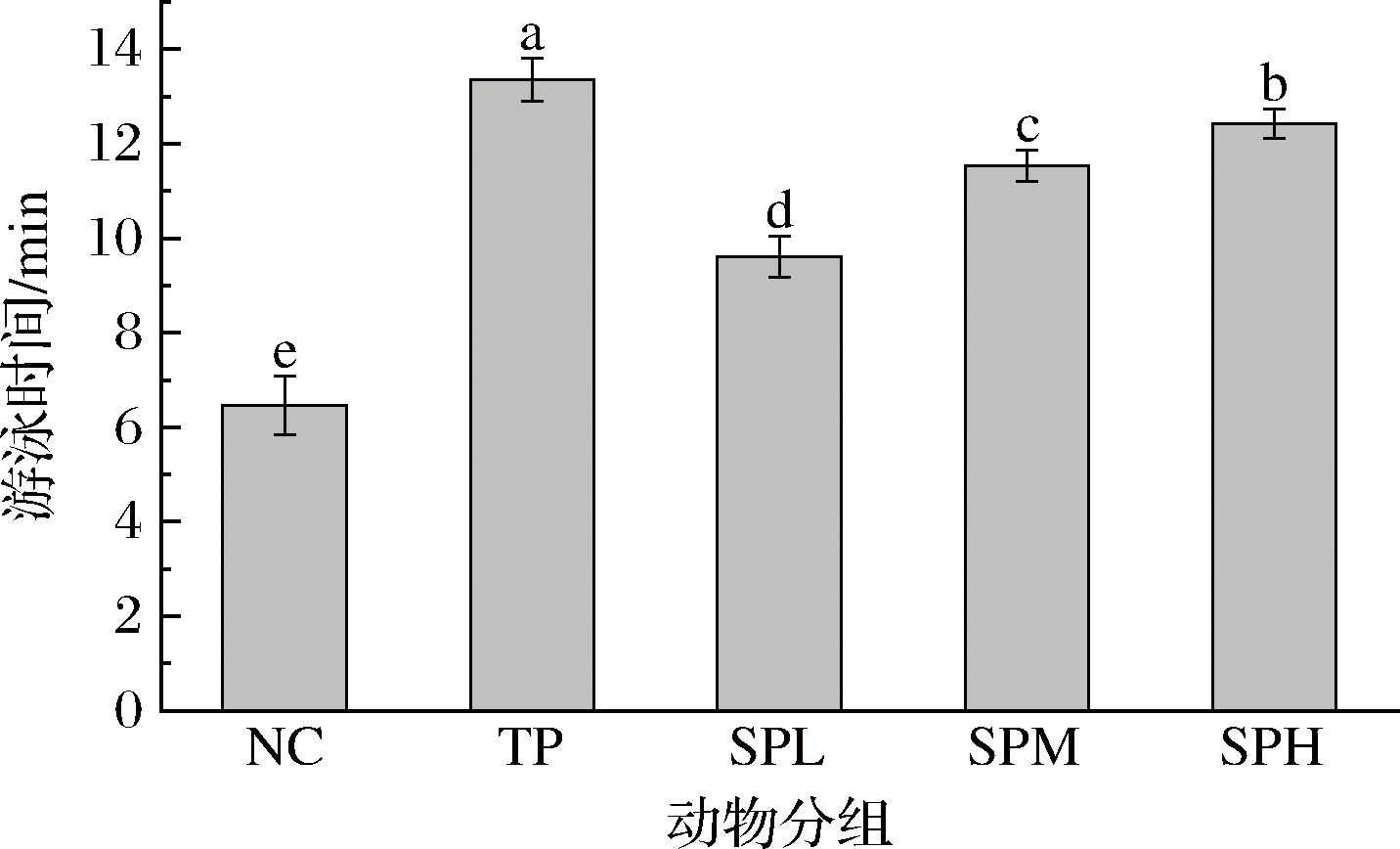
图3 SP对昆明小鼠游泳时间的影响
Fig.3 Effect of SP on the swimming time of KM mice
注:不同字母表示组间存在显著性差异(P<0.05)(图3~图7同)。
2.4 SP对昆明小鼠CAT活性的影响
由图4可知,NC组CAT活性处于正常范围,表明其体内抗氧化系统处于健康状态。与NC组相比,TP组小鼠的CAT活性显著高于正常组(P<0.05),表明400 mg/(kg·d)剂量的牛磺酸能够有效提高CAT的活性;SPL组对CAT活性的提升相较于NC组,其活性略有升高,但差异未达到显著水平。SPM和SPH剂量组均可显著提高CAT的活性,与正常组相比具有差异显著性(P<0.05),其中以中剂量组的增强效果最优,与NC组相比增加了30.02%,接近TP组的增强效果(30.98%)。上述结果表明,SP对昆明小鼠的CAT活性具有一定的影响,低剂量的SP可能尚未达到足以显著改变酶活性的阈值,随着多肽剂量的增加,其对CAT活性的促进作用逐渐增强。相关报道表明,从猴头菌中可提取出一种活性多肽,此肽可显著提高CAT、SOD和GSH-Px的活性,对H2O2诱导的HepG2细胞具有抗氧化作用[16]。
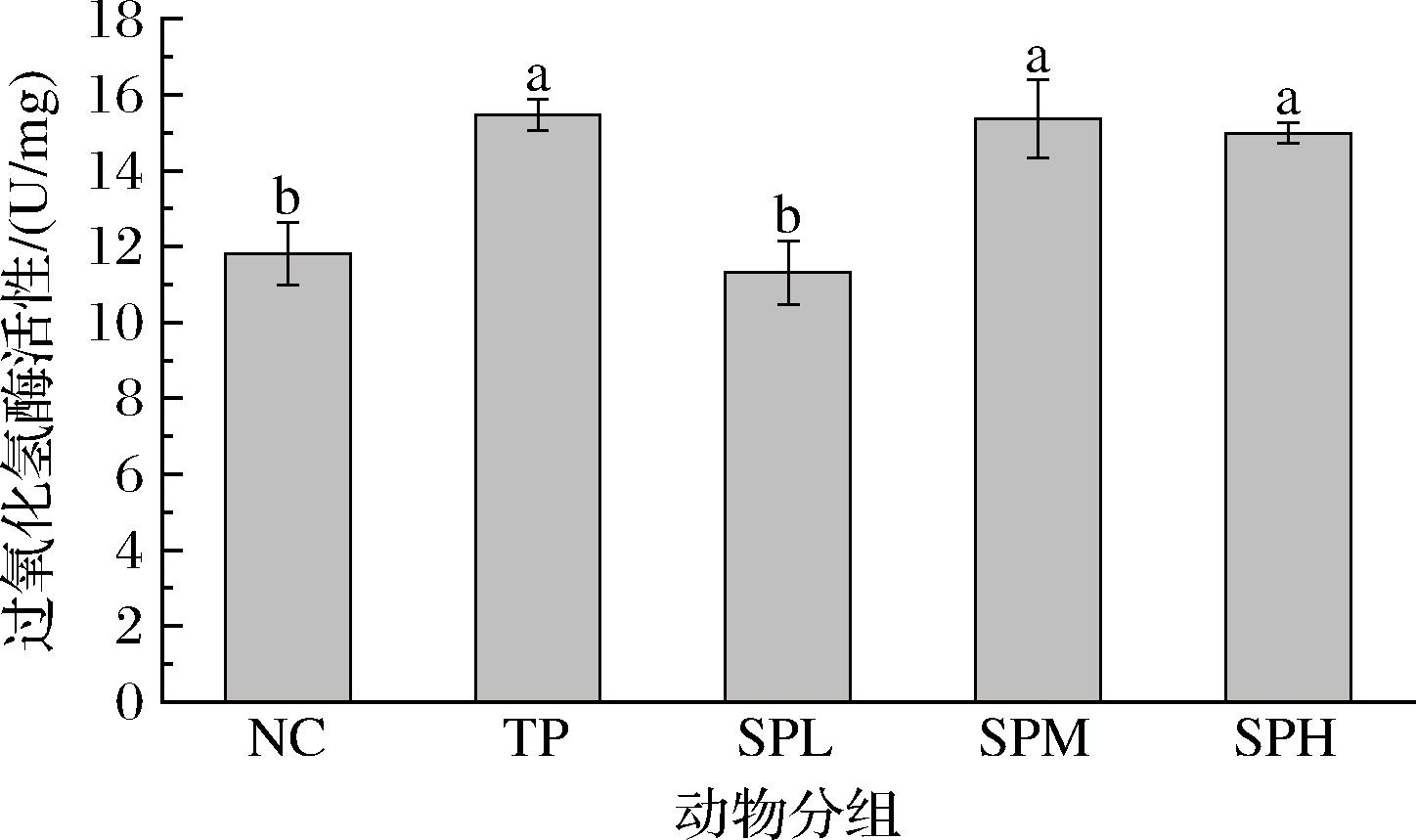
图4 SP对昆明小鼠CAT活性的影响
Fig.4 Effect of SP on CAT activity of KM mice
2.5 SP对昆明小鼠SOD活性的影响
由图5可知,与NC组相比,TP组小鼠的SOD活性显著提高(P<0.05),验证了阳性处理方法的有效性,并为本实验提供了最佳的SOD活性参照。而在剂量组中,随着SP剂量的增加,SOD活性也呈现出逐渐升高的趋势,SPL组小鼠的SOD活性有所上升,但上升幅度相对较小,表明低剂量多肽对小鼠抗氧化系统有一定的促进作用,但效果不如TP组显著;SPM组小鼠的SOD活性进一步上升,逐渐接近TP组水平(51.33%),表明中剂量多肽对小鼠抗氧化系统有较好的促进作用;SPH组小鼠的SOD活性达到最高,与NC组相比增加了65.54%,超过了TP组的水平,此现象表明高剂量多肽对小鼠抗氧化系统的促进作用最为显著。相关研究表明,无论动物源或植物源的多肽,均能够显著增加SOD活性,具有显著的抗氧化能力,如牡蛎肽可逆转乙醇对小鼠肝脏的损伤,显著提高SOD活性,通过增强体内抗氧化能力和抑制炎症反应等途径保护受损的肝脏[17-18]。同时也有研究重组技术将穿膜肽(一类能够穿越细胞膜的短肽)与SOD蛋白融合,从而使其能够清除活性氧、减少炎症因子表达和抑制核因子κB(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来缓解由辐射、缺血、炎症和化疗引起的多种组织的严重氧化损伤[19]。
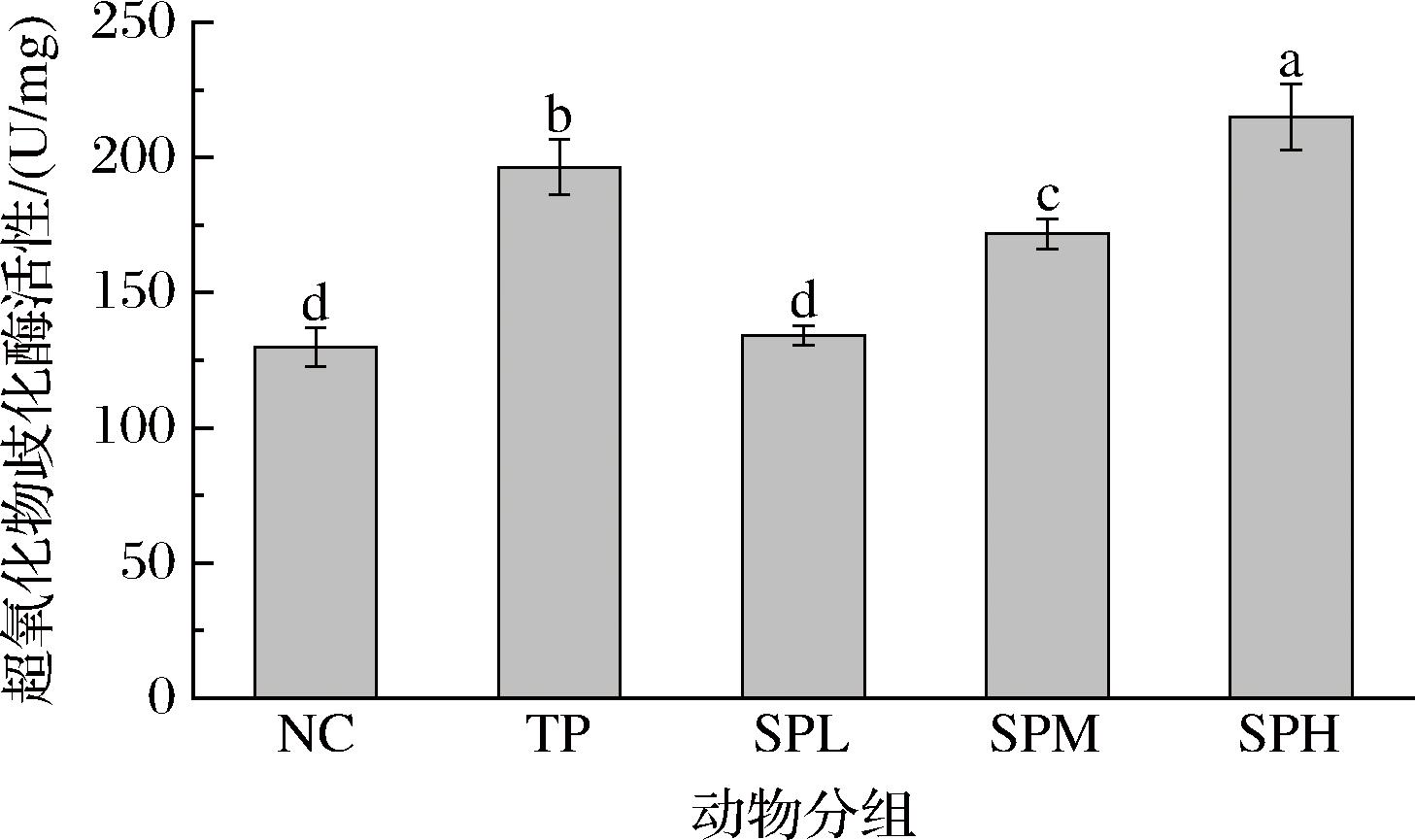
图5 SP对昆明小鼠SOD活性的影响
Fig.5 Effect of SP on SOD activity of KM mice
2.6 SP对昆明小鼠Ca2+Mg2+-ATPase活性的影响
Ca2+Mg2+-ATPase位于机体组织的细胞膜上,与细胞的分泌增殖和肌肉的收缩(心肌及其他肌肉)关系密切,其基本功能是将Ca2+主动转运到细胞外,维持胞内低钙水平[20]。相关报道表明力竭运动可以引起线粒体Ca2+含量的增加,最终导致肌纤维损伤[21]。由图6可知,NC组小鼠肝脏 Ca2+Mg2+-ATPase 活性处于正常生理水平,表明其肝脏细胞代谢与离子平衡维持正常。与NC组相比,TP组小鼠肝脏Ca2+Mg2+-ATPase活性显著提高(P<0.05);在剂量组中,与NC组相比,SPL组小鼠肝脏Ca2+Mg2+-ATPase活性变化不明显,表明低剂量多肽对小鼠肝脏该酶活性影响较小,SPM组的效果优于SPL组,表明一定程度的剂量增加能够产生更积极的影响,SPH组小鼠肝脏Ca2+Mg2+-ATPase活性达到最高,甚至超过了TP组水平,表明高剂量的多肽[600 mg/(kg·d)]对小鼠肝脏该酶活性的促进作用最为显著,这进一步验证了剂量与活性提升之间的正相关性。
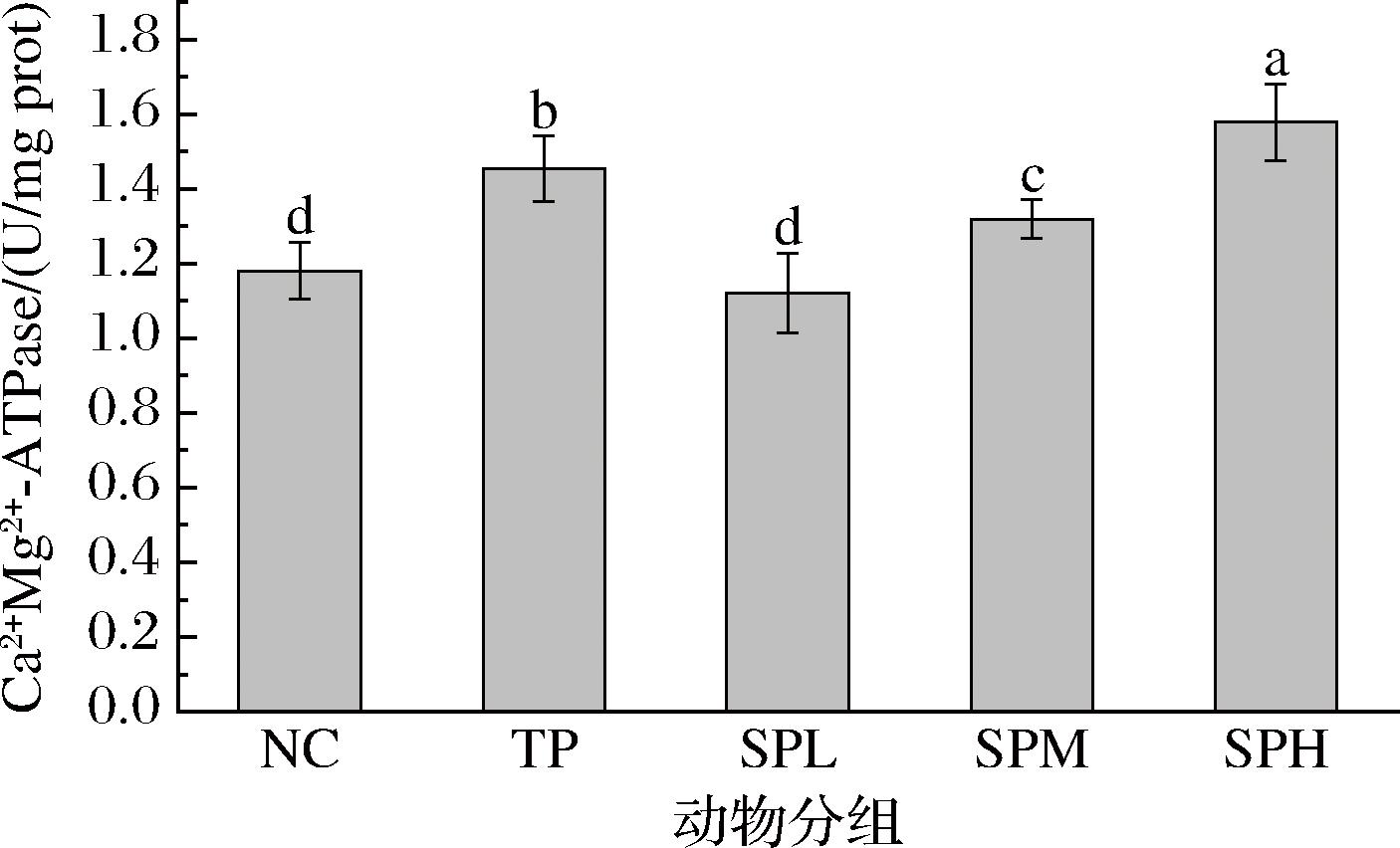
图6 SP对昆明小鼠Ca2+Mg2+-ATPase活性的影响
Fig.6 Effect of SP on Ca2+Mg2+-ATPase activity of KM mice
2.7 SP对昆明小鼠Na+K+-ATPase活性的影响
Na+K+-ATPase又称钠泵,广泛存在于组织细胞以及细胞膜上的一种蛋白酶,能够催化ATP水解,提供能量驱动Na+和K+对向输送,从而使细胞内外分别积蓄高浓度的K+和Na+,从而维持重要的生理意义[20]。由图7可知,与NC组相比,SPL组小鼠肝脏Na+K+-ATPase活性有所提升,但提升幅度较小,表明低剂量多肽对小鼠肝脏该酶活性影响有限;SPM组小鼠肝脏Na+K+-ATPase活性较NC组显著提高,且优于SPL组,表明SPL组对小鼠肝脏该酶活性有较好的促进作用;SPH组小鼠肝脏Na+K+-ATPase活性达到较高水平,仅次于TP组,相比NC组增加了53.69%,表明高剂量的SP对小鼠肝脏该酶活性的促进作用显著。实验结果表明,SP对昆明小鼠肝脏Na+K+-ATPase活性具有显著的促进作用,在一定浓度范围内能够发挥显著的促进作用,且随着浓度的增加,效果逐渐增强。
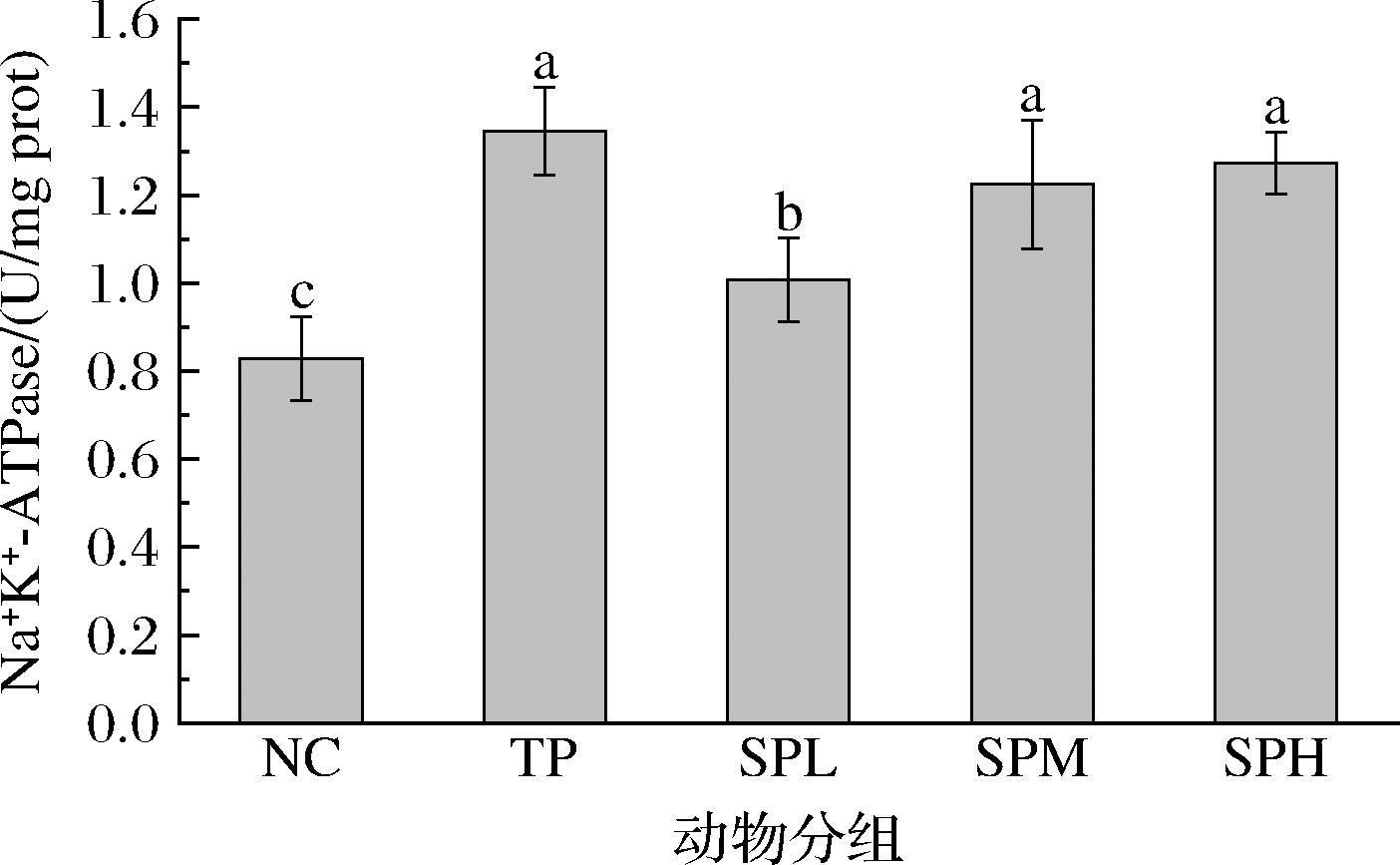
图7 SP对昆明小鼠Na+K+-ATPase活性的影响
Fig.7 Effect of SP on Na+K+-ATPase activity of KM mice
2.8 SP对昆明小鼠肝脏切片组织的影响
由图8可知,NC组小鼠的肝脏组织呈现出正常的细胞结构和排列,肝小叶结构完整,肝细胞形态规则,无明显的病理改变。TP组的肝脏组织形态与正常组相似,表明阳性对照条件下对小鼠肝脏组织无不良影响。SPL、SPM和SPH各剂量组肝脏组织仍保持良好的结构完整性,肝细胞形态正常,肝小叶和肝窦形态正常,无空泡或疏松现象,未观察到明显的病理变化,表明即使在较高剂量下,SP也未对小鼠肝脏造成明显损害。结合前期彭元怀等[9]的研究结果,使用相同方法制备的SP(不同批次)灌胃小鼠(6~8周龄)28 d,各剂量组肝脏组织形态均显示正常,相似的结果进一步证实了短期持续适量摄入多肽的安全性,即使在较高剂量下,也不会对小鼠肝脏的正常功能和代谢造成负担。此外,相关研究还表明多肽类物质可对氧化损伤的肝细胞起到修复作用,如SUN等[22]从南极磷虾中提取出一种高费舍尔比寡肽,用于治疗酒精诱导的急性肝损伤小鼠,其结果表明该寡肽可显著提高GSH-Px水平和降低MDA水平,有效减轻肝脏炎症,具有作为治疗酒精性肝损伤的新营养补充剂的潜力。
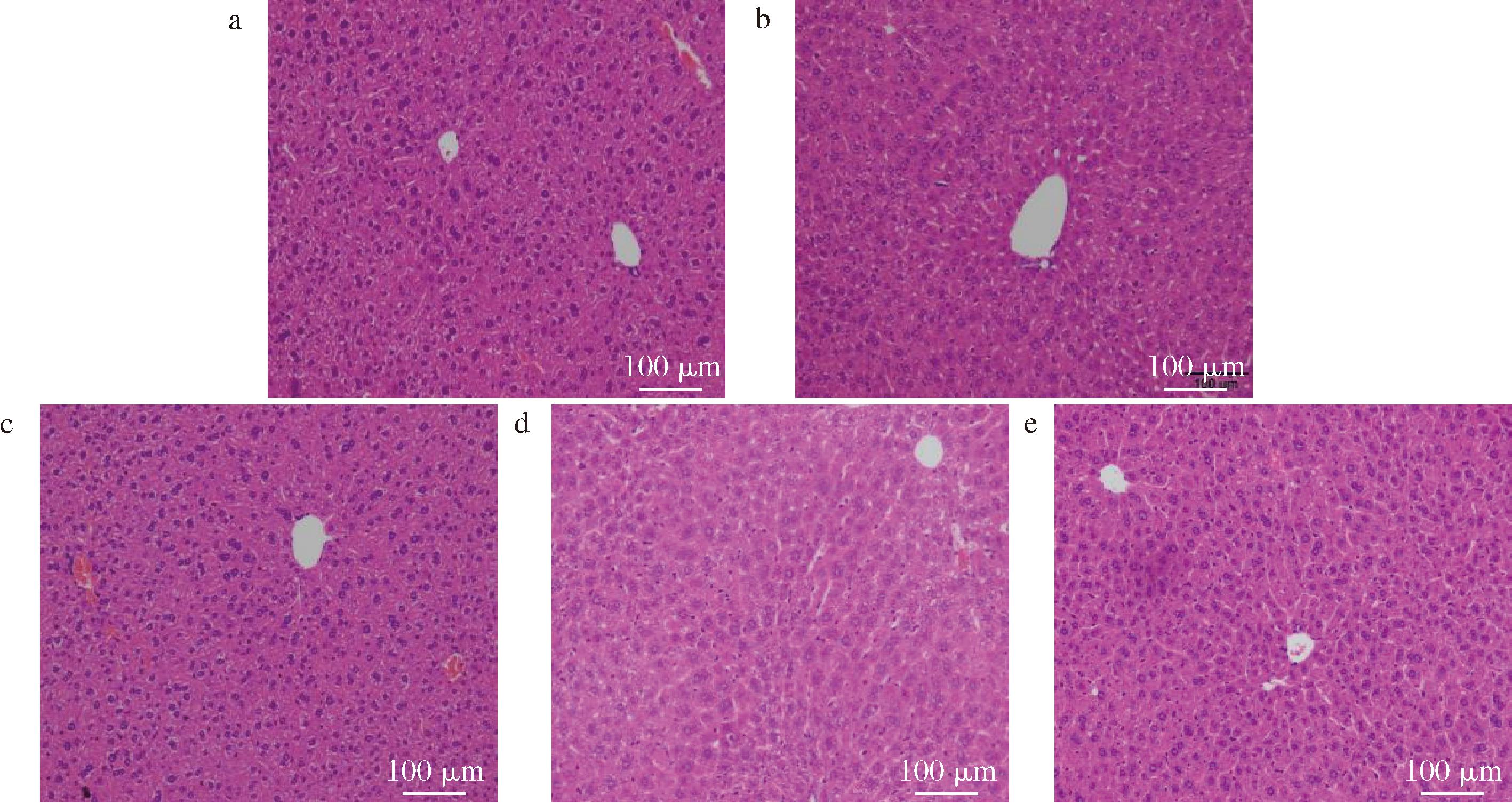
a-NC;b-TP;c-SPL;d-SPM;e-SPH
图8 SP对昆明小鼠肝脏组织形态学的影响
Fig.8 Effect of SP on liver histomorphology of KM mice
2.9 SP对昆明小鼠抗氧化相关基因mRNA表达的影响
Nrf2/HO-1信号通路作为机体氧化应激反应中的核心调控路径之一,通过调控炎症因子和自噬过程,显著增强机体的抗氧化防御能力[23-24]。本研究通过对比分析发现(图9),与NC组相比,SPL、SPM和SPH各剂量组小鼠肌肉中的Nrf2和HO-1 mRNA表达均呈现剂量依赖性的显著上调(P<0.05),这一结果清晰地表明多肽能够有效激活Nrf2/HO-1抗氧化信号通路,进而提升小鼠的抗氧化效能。尤为值得注意的是,高剂量组对HO-1 mRNA表达的上调幅度甚至超越了阳性对照组,预示着高剂量多肽在激活抗氧化通路方面可能展现出更为卓越的效果。此外,本研究还观察到SP能显著抑制小鼠肝脏中C-caspase 3 mRNA的表达,且抑制程度随剂量增加而增强,这进一步证实了SP在抑制细胞凋亡方面的积极作用。这一发现与先前的研究报道相呼应,如张睿玉等[25]发现灰树花多肽可通过调节NF-κB/Nrf2信号通路保护RAW264.7细胞免受氧化损伤,以及黄晓巍等[26]研究报道中还发现鹿茸多肽可通过调节Kelch样环氧氯丙胺相关蛋白1(Kelch-like epichlorohydrin-associated protein 1,Keap1)/Nrf2/HO-1信号通路改善轻度认知功能障碍大鼠的学习记忆能力,且鹿茸多肽使辐射诱导大鼠腹部脊髓神经细胞凋亡后C-caspase 3表达下降。上述研究佐证了本研究的实验结果,表明SP可通过激活Nrf2/HO-1信号通路,减轻力竭游泳小鼠的氧化应激症状,达到缓解其疲劳和提升运动耐力的效果。
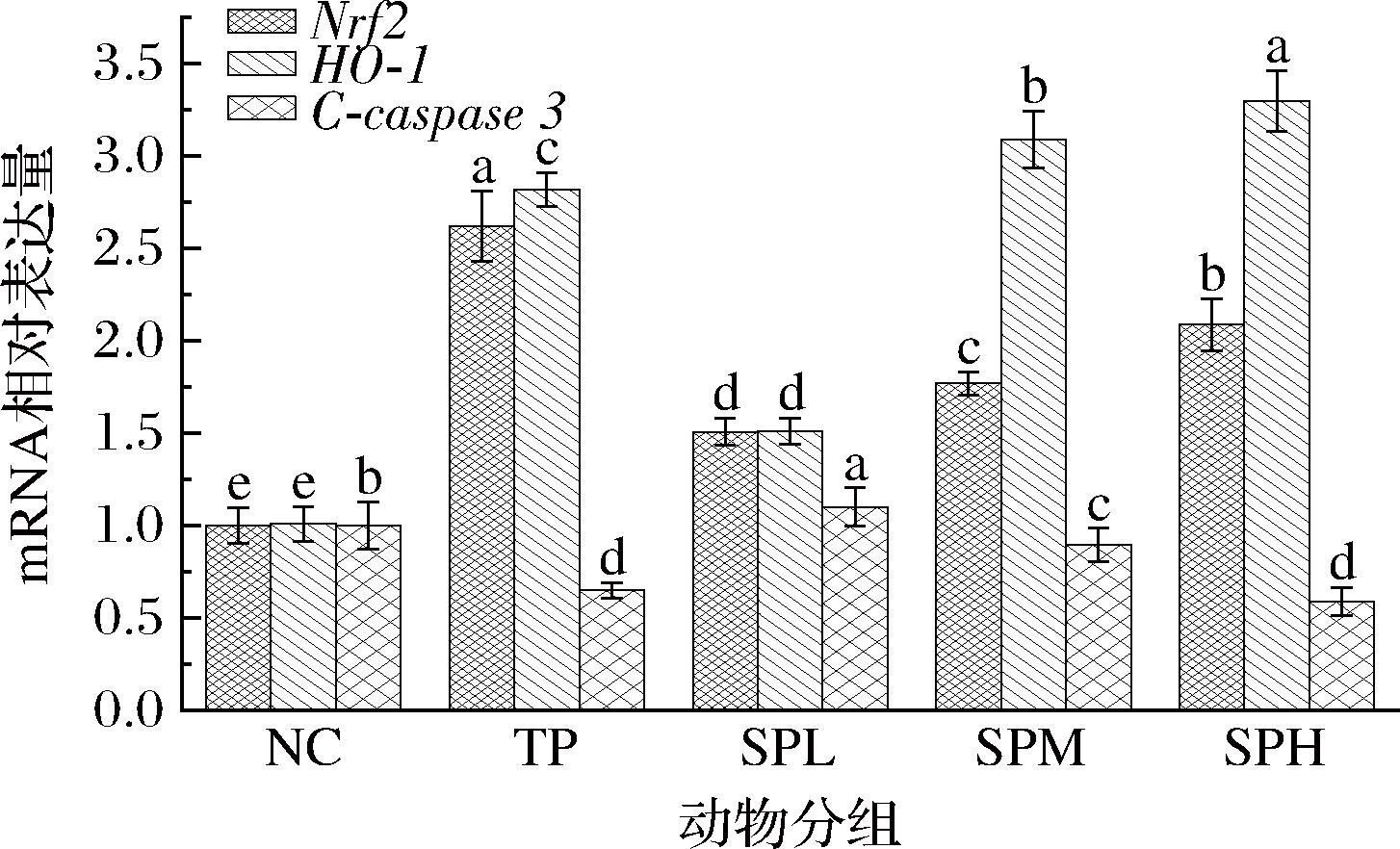
图9 SP对昆明小鼠抗氧化相关基因mRNA表达的影响
Fig.9 Effect of SP on mRNA expression of antioxidant-related genes of KM mice
注:所测基因Nrf2为核因子E2相关因子2、HO-1为血红素氧化酶1、C-caspase 3为细胞凋亡标志蛋白。
上述实验结果表明,SP能显著提升小鼠体内CAT、SOD、Ca2+Mg2+-ATPase和Na+K+-ATPase等关键酶的活性,其中CAT和SOD作为自由基清除酶,提升其活性可高效的清除过氧化氢和超氧阴离子等有害自由基,从而减轻细胞损伤[27];Ca2+Mg2+-ATPase和Na+K+-ATPase等离子泵类酶则能够维持细胞内外离子平衡,并且与肌肉收缩以及能量代谢具有密切联系,其中Ca2+Mg2+-ATPase酶活性的下降可导致细胞内钙超载激惹出一系列代谢紊乱,引起肌细胞损伤,最终导致骨骼肌的损伤[28-30]。实验中SP对上述酶的提升、激活作用,则表明SP能够参与到调控小鼠的神经传导和肌肉收缩等生理过程,减轻小鼠在游泳力竭时的细胞损伤,提高其抗疲劳的能力。相关研究表明,Nrf2作为抗氧化应激反应的核心转录因子,能够诱导多种抗氧化酶和物质的表达,可显著增强细胞的抗氧化能力[31],具有广泛的抗氧化、抗炎和抗凋亡作用的HO-1是Nrf2的下游靶基因[32],在本研究中可知,SP显著上调Nrf2和HO-1的mRNA表达,表明SP能够通过激活Nrf2/HO-1信号通路,提升小鼠的抗氧化应激防御能力,从而减轻力竭游泳小鼠因氧化应激所致的细胞损伤和炎症反应,并通过抑制C-caspase 3的表达,保护细胞免受凋亡损伤,维持细胞的正常生理功能,最终有效缓解疲劳。综上所述,SP能够显著上调Nrf2和HO-1的表达,通过激活该抗氧化应激反应通路,增强小鼠机体的抗氧化能力,减轻由氧化应激引起的炎症反应和细胞凋亡,从而维护机体的稳态和正常生理功能,最终对力竭游泳小鼠氧化应激所致的疲劳起到缓解作用。此外,SP的抗疲劳作用也可能涉及能量代谢调节以及微循环改善等其他机制,有待于后续深入研究。
3 结论
本研究通过体外抗氧化能力评价实验和动物实验较为系统地探讨了SP对力竭游泳小鼠氧化应激所致疲劳的缓解作用。研究发现SP具有显著的抗氧化活性,能够显著延长小鼠游泳的力竭时间,并提升CAT、SOD、Ca2+Mg2+-ATPase和Na+K+-ATPase等关键酶的活性。同时,通过检测小鼠肌肉组织中与抗氧化相关的基因mRNA表达发现,SP能够显著上调Nrf2和HO-1的mRNA表达,并抑制C-caspase 3的mRNA表达,表明SP可能通过激活Nrf2/HO-1信号通路并抑制C-caspase 3的mRNA表达来实现其抗氧化应激作用,最终达到抗疲劳的效果。此外,小鼠肝脏切片组织的检测结果表明短期持续适量的摄入SP对小鼠肝脏无不良影响,不会加重其肝脏代谢的负担。
[1] 王思炀.我国去年对虾产量增长6.4%, 广东位居第一[EB/OL].[2024-06-21]2024-0621.https://www.163.com/dy/article/J577CBGD055284 JB.html.
[2] HOSNEY A, ULLAH S, ![]() K.A review of the chemical extraction of chitosan from shrimp wastes and prediction of factors affecting chitosan yield by using an artificial neural network[J].Marine Drugs, 2022, 20(11):675.
K.A review of the chemical extraction of chitosan from shrimp wastes and prediction of factors affecting chitosan yield by using an artificial neural network[J].Marine Drugs, 2022, 20(11):675.
[3] MA Y Y, ZHANG D D, LIU M Q, et al.Identification of antioxidant peptides derived from Tilapia (Oreochromis niloticus) skin and their mechanism of action by molecular docking[J].Foods, 2022, 11(17):2576.
[4] LYU R Z, DONG Y F, BAO Z J, et al.Advances in the activity evaluation and cellular regulation pathways of food-derived antioxidant peptides[J].Trends in Food Science &Technology, 2022, 122:171-186.
[5] PAN X X, XU J, JIA X M.Research progress evaluating the function and mechanism of anti-tumor peptides[J].Cancer Management and Research, 2020, 12:397-409.
[6] LEIVA-PORTILLA D, MART NEZ R, BERNAL C.Valorization of shrimp (Heterocarpus reedi) processing waste via enzymatic hydrolysis:Protein extractions, hydrolysates and antioxidant peptide fractions[J].Biocatalysis and Agricultural Biotechnology, 2023, 48:102625.
NEZ R, BERNAL C.Valorization of shrimp (Heterocarpus reedi) processing waste via enzymatic hydrolysis:Protein extractions, hydrolysates and antioxidant peptide fractions[J].Biocatalysis and Agricultural Biotechnology, 2023, 48:102625.
[7] MECHRI S, JABALLI I, BEN TAHEUR F, et al.Anti-biofilm, antioxidant and cytotoxic potential of f5, a peptide derived from waste generated during the processing of the white shrimp, Metapenaeus monoceros (Fabricius, 1798)[J].Waste and Biomass Valorization, 2022, 13(7):3233-3244.
[8] WANG P X, ZENG H L, LIN S L, et al.Anti-fatigue activities of hairtail (Trichiurus lepturus) hydrolysate in an endurance swimming mice model-ScienceDirect[J].Journal of Functional Foods, 2020, 74:104207.
[9] 彭元怀, 王睿, 王凤妮, 等.基于Keap1/Nrf2/ARE信号通路研究虾头自溶活性多肽对小鼠抗疲劳的作用及其机制[J].食品工业科技, 46(5):364-370.PENG Y H, WANG R, WANG F N, et al.Investigation the Effects and Mechanisms of Autolytic Active Peptides from Shrimp Head on Anti-fatigue in Mice Based on the Keap1/Nrf2/ARE Signaling Pathway[J].Science and Technology of Food Industry, 2025, 46(5):364-370.
[10] 姜丽冬, 金鑫, 朴春红, 等.林蛙油生物活性肽的制备工艺及其抗疲劳研究[J].吉林农业大学学报, 2016, 38(4):482-488.JIANG L D, JIN X, PIAO C H, et al.Preparation technology and antifatigue effects of oviductus ranae bioactive peptide[J].Journal of Jilin Agricultural University, 2016, 38(4):482-488.
[11] 李欣.鹿茸菇多糖对小鼠抗疲劳能力的影响[J].食品研究与开发, 2022, 43(16):44-50.LI X.Anti-fatiuge effects of Lyophyllum decastes polysaccharides in mice[J].Food Research and Development, 2022, 43(16):44-50.
[12] 刘菲霞, 李红娟, 徐强, 等.滑菇子实体多糖提取条件优化及抗氧化活性研究[J].山东农业科学, 2013, 45(1):117-121.LIU F X, LI H J, XU Q, et al.Condition optimization for extracting pholiota nameko fruiting body polysaccharide and study on its antioxidant activity[J].Shandong Agricultural Sciences, 2013, 45(1):117-121.
[13] 张世奇, 王睿, 李成良, 等.辣木叶多糖对STZ诱导糖尿病小鼠的降糖效果及其机制[J].食品工业科技, 2024, 45(19):357-365.ZHANG S Q, WANG R, LI C L, et al.hypoglycemic effect of moringa oleifera leaf polysaccharide on STZ-induced diabetic mice and its mechanism[J].Science and Technology of Food Industry, 2024, 45(19):357-365.
[14] ZHOU Y F, XU Y X, TIAN T G, et al.Antihypertensive and antioxidant effects of food-derived bioactive peptides in spontaneously hypertensive rats[J].Food Science &Nutrition, 2024, 12(10):8200-8210.
[15] 张皓哲, 高春红, 李天铎, 等.胶原和明胶清除羟基自由基机理探究[J].齐鲁工业大学学报, 2022, 36(3):32-38.ZHANG H Z, GAO C H, LI T D, et al.Study on the mechanism of collagen and gelatin scavenging hydroxyl radical[J].Journal of Qilu University of Technology, 2022, 36(3):32-38.
[16] XU Z L, HU Q H, XIE M H, et al.Protective effects of peptide KSPLY derived from Hericium erinaceus on H2O2-induced oxidative damage in HepG2 cells[J].Food Science and Human Wellness, 2023, 12(5):1893-1904.
[17] WANG W Q, LIU Z C, LIU Y J, et al.Plant polypeptides:A review on extraction, isolation, bioactivities and prospects[J].International Journal of Biological Macromolecules, 2022, 207:169-178.
[18] WANG X Q, YU H A, XING R E, et al.Hepatoprotective effect of oyster peptide on alcohol-induced liver disease in mice[J].International Journal of Molecular Sciences, 2022, 23(15):8081.
[19] WANG X L, JIANG R W.Therapeutic potential of superoxide dismutase fused with cell-penetrating peptides in oxidative stress-related diseases[J].Mini Reviews in Medicinal Chemistry, 2022, 22(17):2287-2298.
[20] 习雪峰, 王单一, 熊正英, 等.云芝多糖对运动训练大鼠脑组织抗氧化能力和ATPase活性的影响[J].食品科学, 2012, 33(5):256-259.XI X F, WANG D Y, XIONG Z Y, et al.Effect of krestin polysaccharide on antioxidant capability and atpase activity in brain tissues of rats with high intensity exercise[J].Food science, 2012, 33(5):256-259.
[21] DENT J R, STOCKS B, CAMPELJ D G, et al.Transient changes to metabolic homeostasis initiate mitochondrial adaptation to endurance exercise[J].Seminars in Cell &Developmental Biology, 2023, 143:3-16.
[22] SUN Y, SHEN H R, FAN C Z, et al.Typical structural characteristics and hepatoprotective effects of novel high fischer ratio oligopeptides from antarctic krill on acute alcoholic liver injury[J].Food &Function, 2024, 15(18):9298-9314.
[23] KIM C, KIM N, BAE J S.Anti-Inflammatory and Anti-oxidant functions of cornuside by regulating Nf-κb, Stat-1, and Nrf2-HO-1 pathways[J].The American Journal of Chinese Medicine, 2022, 50(5):1349-1360.
[24] ZHANG C Y, HU X C, ZHANG G Z, et al.Role of Nrf2 and HO-1 in intervertebral disc degeneration[J].Connective Tissue Research, 2022, 63(6):559-576.
[25] 张睿玉.灰树花多肽的制备及其抗氧化活性研究[D].晋中:山西农业大学, 2022:55-57.ZHANG R S.Study on the preparation and antioxidant activity of polypeptide from Grifola frondosa[D].Jinzhong:Shanxi Agricultural University, 2022:55-57.
[26] 黄晓巍, 刘玥欣, 王晋冀, 等.鹿茸多肽对轻度认知功能障碍大鼠学习记忆能力的改善作用及其调节Keap1/Nrf2/HO-1信号通路的机制[J].吉林大学学报(医学版), 2021, 47(5):1215-1220.HUANG X W, LIU Y X, WANG J J, et al.Improvement effects of pilose antler polypeptide on learning and memory abilities in rats with mild cognitive impairment and their mechanisms of regulating Keap1/Nrf2/HO-1 signaling pathway[J].Journal of Jilin University (Medicine Edition), 2021, 47(5):1215-1220.
[27] CHANDIMALI N, BAK S G, PARK E H, et al.Free radicals and their impact on health and antioxidant defenses:A review[J].Cell Death Discovery, 2025,11(1):19.
[28] 杨福愉.生物膜结构研究的一些进展[J].生物化学与生物物理进展, 2003, 30(4):495-502.YANG F Y.Recent advances in the study of membrane structure[J].Progress in Biochemistry and Biophysics, 2003, 30(4):495-502.
[29] 徐雷, 杨磊, 杜柳涛, 等.静态负荷对大鼠离体骨骼肌能量代谢的影响[J].中国工业医学杂志, 2005, 18(1):14-15;18.XU L, YANG L, DU L T, et al.Effect of static load on energy metabolism of rat’s isolated skeletal muscles[J].Chinese Journal of Industrial Medicine, 2005, 18(1):14-15; 18.
[30] 孙鑫, 杨芳, 邓洋洋, 等.补肾, 健脾, 活血方法对骨质疏松症小鼠骨及骨骼肌中Ca2+-Mg2+-ATP酶含量影响[J].中国中医基础医学杂志, 2015,21(4):416-417.SUN X, YANG F, DENG Y Y, et al.Effect of Bushen Jianpi Huoxue Method to the Ca2+-Mg2+-ATP, enzyme content of bone and skeletal muscle in osteoporosis mice[J].Journal of Basic Chinese Medicine, 2015,21(4):416-417.
[31] ITOH K, WAKABAYASHI N, KATOH Y, et al.Keap1 represses nuclear activation of antioxidant responsive elements by Nrf2 through binding to the amino-terminal Neh2 domain[J].Genes &Development, 1999, 13(1):76-86.
[32] OTTERBEIN L E, BACH F H, ALAM J,et al.Carbon monoxide has anti-inflammatory effects involving the mitogen-activated protein kinase pathway[J].Nature Medicine, 2000, 6(4):422-428.