新疆日照时间长且昼夜温差大,适合核桃生长,其种植的‘温185’纸皮核桃以其壳薄、大果形和高油分含量而著称,常被用作榨油。榨油工艺分为热榨和冷榨,热榨因其具有出油率高、油香浓厚和成本低等特点,受到消费者的欢迎,是主流榨油方式之一[1]。前期研究表明热榨核桃蛋白高度变性,营养价值变低,常被用做肥料或燃料,若能开发热榨核桃饼粕类相关产品将对提高核桃榨油热榨工艺的经济效益产生积极的影响[2-3]。
郭兴峰等[4]研究了热榨和冷榨核桃饼粕中蛋白的功能特性,发现热榨后粕中的蛋白特性会比冷榨的差一些,但是并未探索深层次的原因。李梁宵[2]研究了我国4个品种核桃蛋白的结构和功能特性,研究表明热榨核桃粕蛋白相对冷榨对核桃蛋白分子质量影响不大,热榨巯基和二硫键总体均增多,蛋白结构变松散,疏水基团暴露,功能特性变差,但是未对电位,扫描电镜等进行检测,也未系统研究具体温度变化对核桃粕蛋白的影响。王振国等[5]以ζ-电位、粒度作为参数,利用荧光和红外光谱分析研究了不同压榨温度对大豆分离蛋白与原花青素复合物性能及结构的影响。付嘉阳[6]以亚临界流体萃取法、热榨浸出法及冷榨浸出法得到的棉子饼粕为材料提取了棉籽蛋白,发现亚临界流体萃取粕蛋白整体的功能性质优于其他2种蛋白,热榨浸出法对棉籽蛋白结构影响较大,进而降低了其功能性质。
众多学者虽不同程度的研究了热榨饼粕蛋白的结构,但未深入系统性研究温度对其结构的影响及与功能特性的相关性。本研究立足于探究热榨温度对核桃粕蛋白结构及其功能特性的影响,以期了解蛋白在热榨过程中变性机理,从而为优化榨油条件,在生产过程中控制蛋白变性,在保证榨油率的基础上最大化保存核桃粕中的营养物质,为开发利用热榨核桃粕及生产性能优良的热榨蛋白产品提供理论依据。
1 材料与方法
1.1 材料与试剂
新疆阿克苏地区温宿县种植的温185纸皮核桃(J.regia ‘Wen185’)。
石油醚(沸程60~90 ℃),天津市致远化学试剂有限公司;溴甲酚绿指示剂、甲基红指示剂,上海山浦化工有限公司;考马斯亮蓝G250,天津市风船化学试剂科技有限公司;牛血清白蛋白,北京博奥拓达科技有限公司;8-苯胺基萘-1-磺酸(8-aniline-naphthalene-1-sulfonic acid,ANS)、5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobide (2-nitrobenzoic acid),DTNB],麦克林;三羟甲基氨基甲烷(Tris base,Tris),索莱宝。
1.2 仪器与设备
X5S商用智能榨油机,游侠商用电器公司;K1100全自动凯氏定氮仪,济南海能仪器股份有限公司;WATERS E2695高效液相色谱仪,美国沃特世公司;Regulus 8100扫描电镜,日本日立公司;Frontier中红外光谱仪,美国珀金埃尔默公司;Lumina荧光分光光度计,赛默飞世尔科技公司;Synergy H1多功能酶标仪,美国伯腾仪器有限公司;FD-B12N-80Z真空冷冻干燥机,云南泽北科技有限公司。
1.3 实验方法
1.3.1 核桃脱脂粉制备
将核桃除去外壳和种皮后,称取5组,每组60 g的核桃仁,使用螺旋榨油机分别在40、70、100、130、160 ℃榨取核桃饼粕。将核桃饼粕样品置于烧杯中,按体积比1∶2加入石油醚,密封后于室温下浸泡24 h,过滤后弃去滤液,滤渣重复浸泡3次,取滤渣沉淀,在通风橱内放置至石油醚挥发,得到核桃饼粕脱脂粉,4 ℃ 贮存备用。
1.3.2 核桃蛋白制备
参考张继文等[7]的方法提取核桃蛋白,先称取部分核桃饼粕脱脂粉倒入容器中,然后按照1∶20(g∶mL)的配比添加去离子水,并调整pH值到9.07后将其放入恒温的水浴锅中,并在40 ℃下进行2 h的搅拌。接下来,过滤取滤液,并通过1 mol/L HCl的溶液调整pH值到4.62,然后静止30 min,最后通过4 000 r/min的离心机处理15 min,去滤液,将沉淀用1 mol/L NaOH溶液将pH值调节至7,在-80 ℃预冷12 h,立刻放于真空冷冻干燥机中,真空度0 MPa,冷阱温度-78 ℃,干燥12 h后,置于冰箱,4 ℃贮存。核桃蛋白提取率的计算如公式(1)所示:
核桃蛋白提取率![]()
(1)
1.3.3 扫描电子显微镜测定
采用导电胶粘结法测定,在试样台上放上一条导电胶粘剂带,取少量干燥后的核桃蛋白粉末均匀分布在导电胶上,吹去粘结不牢固的颗粒,然后用离子溅射仪喷金,上机检测。
1.3.4 核桃蛋白的二级结构测定
每1 mg核桃蛋白样品与100 mg KBr混合碾磨压片,在数显红外烘烤灯下烘烤30 min除去样品中水分。采用红外光谱仪对核桃蛋白的二级结构进行测定,测量范围400~4 000 cm-1,累积量300 s,测得的数据使用Peakfit v 4.12软件对酰胺Ⅰ带分峰去卷积二阶求导,计算拟合峰面积占比得到核桃蛋白中二级结构含量。
1.3.5 核桃蛋白的三级结构测定
取pH 7的磷酸盐缓冲液将核桃蛋白样品配制成0.1 mg/mL的溶液。用荧光分光光度计测定光谱,激发波长290 nm,扫描范围300~400 nm,狭缝宽5 nm,反应时间0.1 s。
1.3.6 核桃蛋白非共价作用力测定
参考李梁宵[2]的方法测定蛋白质中的主要非共价键(离子键、氢键和疏水相互作用)。配制0.05 mol/L NaCl溶液、0.6 mol/L NaCl溶液、6 mol/L NaCl+1.5 mol/L尿素溶液和0.6 mol/L NaCl+8 mol/L尿素溶液,分别记作RA、RB、RS、RD溶液。各取0.1 g蛋白样品分别溶于10 mL的4种试剂中。磁力搅拌30 min 后,8 000 r/min离心10 min,取上清液。以牛血清蛋白为标准品,采用考马斯亮蓝法在595 nm处测定样品吸光度,计算上清液可溶性蛋白含量。计算如公式(2)~公式(4)所示:
离子键的含量=RB中蛋白质含量-RA中蛋白质含量
(2)
氢键的含量=RC中蛋白质含量-RB中蛋白质含量
(3)
疏水相互作用=RD中蛋白质含量-RC中蛋白质含量
(4)
1.3.7 表面疏水性的测定
参考李梁宵[2]的实验步骤来测定样品的表面疏水性,首先使用0.01 mol/L的磷酸盐缓冲液将样品溶解,然后制备并稀释成不同质量浓度的蛋白质溶液,分别为0.05、0.1、0.2、0.3、0.4 mg/mL。取2 mL的待测蛋白质溶液,并加入40 μL的0.008 mol/L的ANS溶液,混合均匀后静置10 min后可进行测试。设置荧光分光光度计的激发波长为390 nm,发射波长为470 nm,狭缝宽度为5 nm,以此来测量样品的荧光强度,本实验采用ANS作为荧光探针对核桃蛋白质的表面疏水性进行测定,绘制蛋白质浓度与荧光强度关系的图表,曲线起始部分的斜率代表了蛋白质的表面疏水性。
1.3.8 游离巯基和二硫键含量测定
参照邓欣伦[3]的方法测定巯基和二硫键的含量。
游离巯基(SHF)的测定:取0.1 g样品,加入10 mL缓冲液A(配方为1.489 g二钠EDTA、10.418 g Tris、6.756 g甘氨酸和480 g尿素,pH=8.0)。该混合液在磁力搅拌下反应30 min后,以8 000 r/min的速度离心10 min。取1 mL上清液,加入40 μL的Ellman’s试剂(质量浓度为4 mg/mL,配方同上),混匀后在室温下反应5 min。最后,在412 nm处测定吸光度。
总巯基(SHT)的测定:取0.1 g样品,加入10 mL缓冲液B(由10.418 g Tris、6.756 g甘氨酸、1.489 g二钠EDTA、480 g尿素、15 mg/mL β-巯基乙醇及5 mol/L氯化胍组成,pH=8.0)。在磁力搅拌下反应30 min,随后加入5 mL的12%三氯乙酸(trichloroacetic acid,TCA),洗涤2次。将沉淀溶解在15 mL的Tris-Gly缓冲液中,取1 mL上清液,再加入40 μL Ellman’s试剂,迅速混匀。反应在室温下进行5 min后,于412 nm处测定吸光度。
SHF、SHT和二硫键含量的计算如公式(5)~公式(6)所示:
(5)
(6)
式中,A412是指在412 nm处的吸光度;C为蛋白质的质量浓度,mg/mL;D为样品稀释倍数,73.53=106/13 600(13 600指的是Ellman’s试剂的摩尔消光系数)。
1.3.9 吸水性和吸油性测定
吸水性(water absorption capacity,WAC)和吸油性(oil absorption capacity,OAC)的测定的方法为:将0.5 g核桃饼粕蛋白样品放入10 mL离心管中,进行称重。若检测吸水性,向离心管加入5 mL去离子水;若检测吸油性,则加入2.5 mL大豆油。混合均匀并静置30 min后,将其放入离心管中,并以5 000 r/min的速度离心20 min。之后,倒掉上层清液,并称量记录离心管连同沉淀物的总质量。重复测定3次取平均值,并记录结果。吸水性和吸油性的计算如公式(7)所示:
吸水性、吸油性/(g/g)
(7)
1.3.10 溶解性测定
溶解性的测定参照李梁宵[2]的方法。将100 mg的脱脂核桃饼粕和蛋白质样品分别与10 mg去离子水混合,室温下使用磁力搅拌器搅拌30 min。接着,以8 000 r/min的速度离心20 min,收集得到上清液。随后,将上清液与考马斯亮蓝染色液混合,以测定其中的蛋白质含量。溶解度的计算如公式(8)所示。重复测定3次取平均值,并记录结果。
溶解度![]()
(8)
1.3.11 乳化性及乳化稳定性测定
乳化性(emulsifying activity,EA)的测定方法为:称取0.4 g核桃饼粕脱脂粉样品和蛋白样品,分别加入10 mL去离子水,用高速分散机10 000 r/min均质1 min,再加入10 mL大豆油,混合物以10 000 r/min下打散1 min。最后,将乳化液以2 500 r/min离心5 min,记录乳化层高度。乳化稳定性(emulsion stability,ES)的测定是将离心后的样品在80 ℃水浴30 min 后进行再次离心,记录离心前后离心管中乳化层的高度。根据公式(9)~公式(10)计算乳化性和乳化稳定性。重复测定3次取平均值,并记录结果。
乳化性![]()
(9)
乳化稳定性![]()
(10)
1.4 数据处理
每个实验重复3次,数据以“平均值±标准差”的形式呈现。使用SPSS统计分析软件分析数据的显著性。数据图表则通过Origin 2023软件生成。
2 结果与分析
2.1 榨油温度对出油率和蛋白得率的影响
榨油温度对核桃出油率及蛋白得率的影响如表1所示。随着榨油温度的升高,出油率逐渐提高,但当温度高于100 ℃后,出油率上升的速率明显降低,考虑到榨油经济效益,榨油温度应不低于100 ℃。此外,蛋白得率随温度的升高逐渐升高后降低,蛋白提取率先上升,与蛋白高温挤压后,油脂减少,单位体积粕内蛋白含量增加有关,但后面逐渐降低是由于蛋白变性逐渐碳化,无法通过蛋白碱溶酸沉的特性从核桃饼粕中提取蛋白出来,所以提取率有所降低。
表1 榨油温度对出油率及蛋白得率的影响
Table 1 The impact of oil extraction temperature on oil yield and protein yield.

榨油温度/℃出油率/%蛋白得率/%4032.236±1.014d29.295±1.048c7046.519±0.688c31.749±0.546b10057.381±1.101b35.518±0.521a13061.786±1.522a36.860±1.099a16063.462±1.519a36.581±0.499a
注:同列数据肩标相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)(表3同)。
2.2 核桃蛋白的微结构分析
不同榨油温度生产的核桃粕蛋白微结构放大5 000倍图如图1所示。据报道核桃最适冷榨温度为43.43~53.23 ℃,可将40 ℃榨油近似看成冷榨[8]。冷榨核桃蛋白(图1-a)呈现出紧密饱满的圆球状颗粒结构,随着榨油温度的上升核桃蛋白呈现堆叠紧密的片状结构,该现象表明热榨会导致核桃饼粕蛋白微结构发生明显形变。由于蛋白质的特殊性质,它们在经过高温和挤压的作用后,会发生分子链展开、团聚、交联的过程,因此蛋白质在高温压榨后出现了片状组织化的形态结构。

a-40 ℃核桃蛋白;b-70 ℃核桃蛋白;c-100 ℃核桃蛋白;d-130 ℃核桃蛋白;e-160 ℃核桃蛋白
图1 核桃蛋白的扫描电镜图
Fig.1 Scanning electron microscopy of walnut protein
2.3 核桃蛋白的二级结构分析
图2是榨油温度对核桃蛋白红外光谱的影响。在红外光谱中,化学键的伸缩和弯曲振动通常在4 000至400 cm-1的波数范围内吸收能量。观察图2可以发现,在3 500至3 000 cm-1的区间内,核桃蛋白质的光谱均呈现出一个较宽的峰值,这暗示着它可能包括了一定量的淀粉物质,峰的出现也与O—H和N—H基团存在状态及相互作用有关[9]。随着温度的升高,在3 356.28 cm-1波数处观察到的吸收峰值下降,表明淀粉的结构受到了一定程度的破坏[10]。通过红外光谱分析发现,当波数在2 990~2 850 cm-1 附近时,蛋白质侧链中的CH2拉伸一般会产生峰。此外,蛋白质的酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带的波数分别为1 700~1 600 cm-1、1 580~1 500 cm-1和1 400~1 200 cm-1[11]。其中,红外光谱中的酰胺Ⅰ带(80%为C![]() O伸缩振动,1 650 cm-1附近)常被用来研究蛋白质的二级结构。
O伸缩振动,1 650 cm-1附近)常被用来研究蛋白质的二级结构。
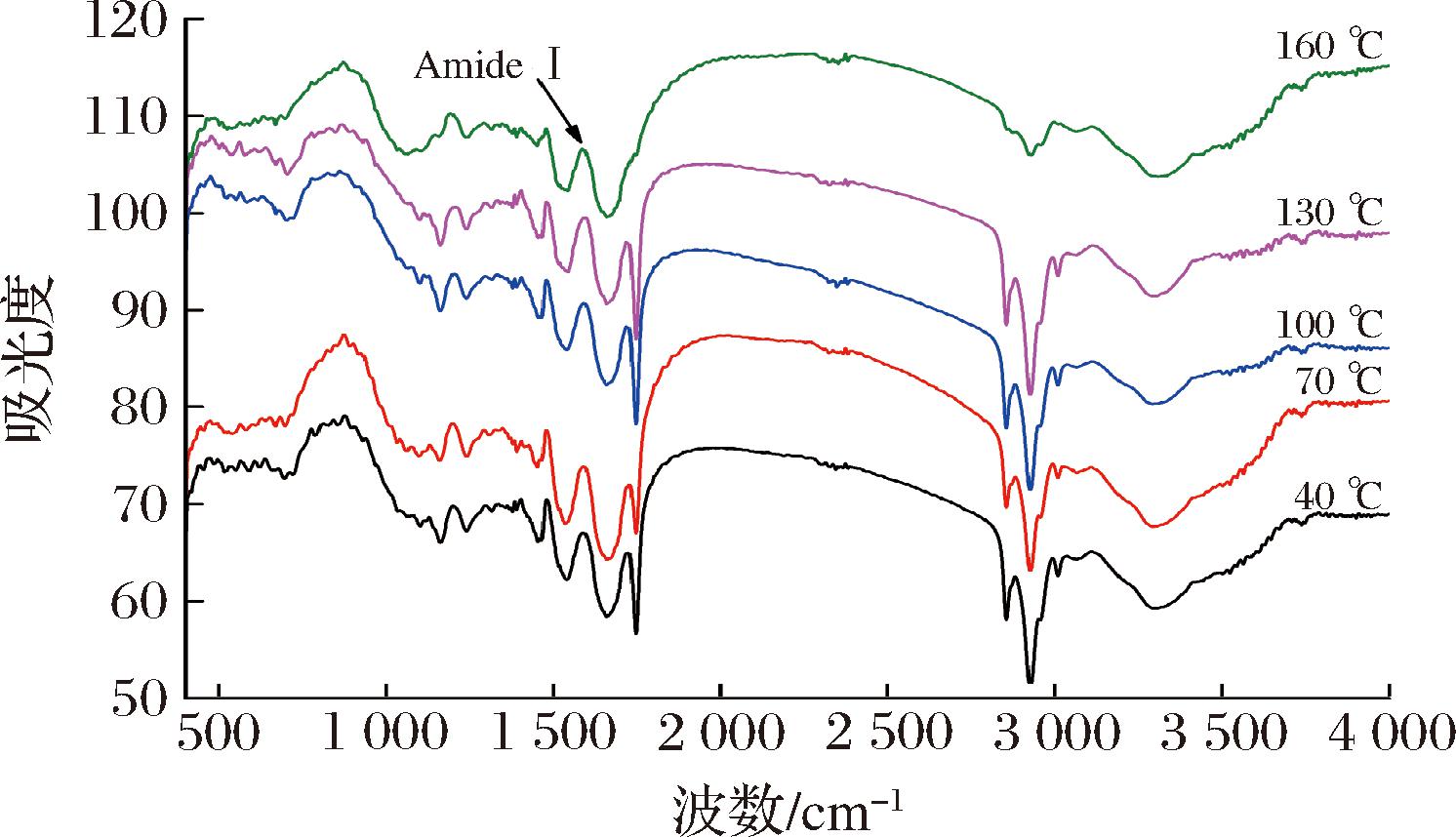
图2 核桃蛋白的红外光谱图
Fig.2 Infrared spectrum of walnut protein
红外光谱中酰胺I带拟合结果如图3所示。蛋白质水溶液中,红外光谱波数在1 650~1 657 cm-1被指认为α-螺旋、1 612~1 690 cm-1为β-折叠(反平行β片层:1 612~1 640 cm-1和1 670~1 690 cm-1;平行β片层:1 626~1 640 cm-1)、1 655~1 675和1 680~1 696 cm-1为β-转角、1 640~1 651 cm-1为无规则卷曲[12]。
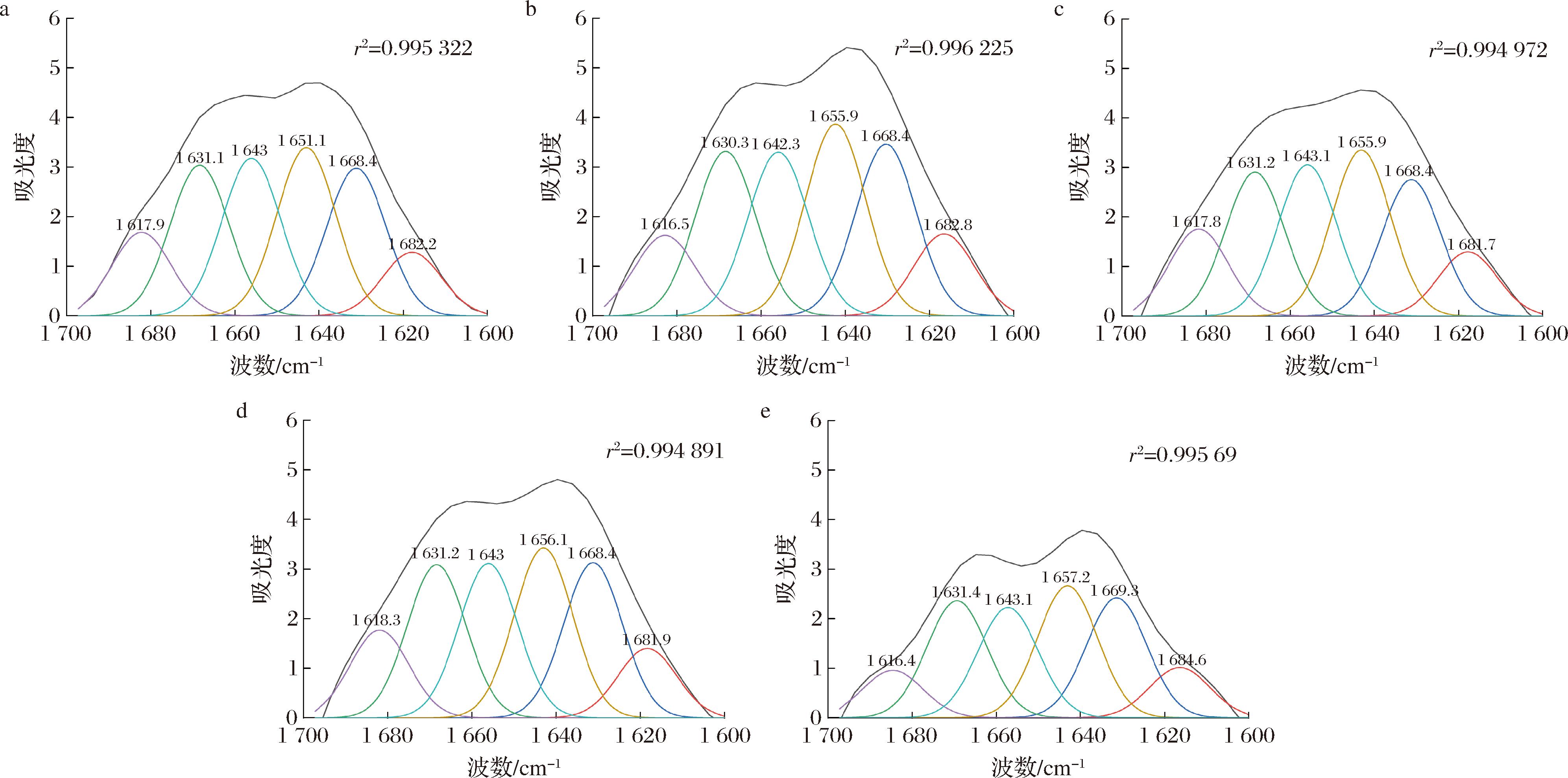
a-40 ℃榨油;b-70 ℃榨油;c-100 ℃榨油;d-130 ℃榨油;e-160 ℃榨油
图3 核桃蛋白酰胺I带曲线拟合谱图
Fig.3 Curve fitting spectrum of walnut protein amide I band
榨油温度对核桃蛋白二级结构的影响如表2所示。β-折叠含量较高,而α-螺旋含量最低,这反映了植物蛋白的典型结构特征。在天然蛋白质的二级结构中,α-螺旋和β-折叠是主要组成部分,存在较多的氢键,蛋白质更稳定有序具有一定的刚性。当温度由40 ℃升至70 ℃时,α-螺旋和β-转角含量明显降低,而β-折叠和无规则卷曲含量有所升高,说明温度升高会在一定程度上破蛋白空间结构,蛋白内部氢键断裂,结构展开,使得α-螺旋和β-转角降低。蛋白加热过程中,α-螺旋结构会转变为β-折叠结构,所以β-折叠含量会升高。升温过程中蛋白的变性总体上都会降低有序结构数量,使结构变得松散及混乱,从而呈现出无规则卷曲升高的现象。在100 ℃时,α-螺旋和β-转角升高,β-折叠降低,这显示蛋白质结构中的部分β-折叠转化成了α-螺旋和β-转角结构,表明此时蛋白的结构更加紧密[13]。100 ℃的作用温度可能是核桃粕蛋白内部作用力变化的拐点。当温度升高至160 ℃时,β-折叠含量和β-转角含量明显降低,而α-螺旋含量变化不大,这与HOSSAIN等[14]的研究结果相似。蛋白质分子间的化学键断裂和原始构象的展开导致β-折叠含量减少,这不仅提高了蛋白质的消化率,还引起了蛋白质的变性和随后的聚集现象[15]。
表2 榨油温度对核桃蛋白质二级结构的影响
Table 2 The effect of oil extraction temperature on the secondary structure of walnut protein
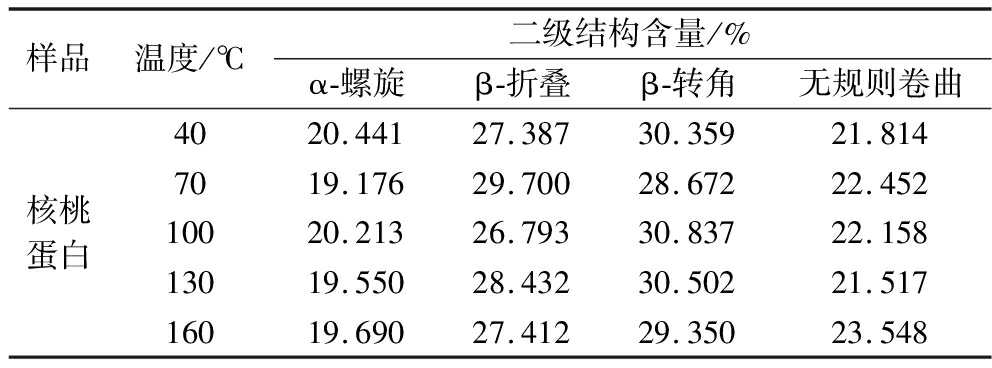
样品温度/℃二级结构含量/%α-螺旋β-折叠β-转角无规则卷曲核桃蛋白4020.44127.38730.35921.8147019.17629.70028.67222.45210020.21326.79330.83722.15813019.55028.43230.50221.51716019.69027.41229.35023.548
冷榨和热榨核桃蛋白二级结相比,冷榨核桃蛋白α-螺旋和β-折叠含量之和相对较高,表明冷榨核桃蛋白结构更稳定。
2.4 核桃蛋白的三级结构分析
蛋白质中的3种芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)的侧链生色基团在荧光波长295 nm下受激发光影响,蛋白质分子自身产生荧光,即内源荧光,能反映三级结构变化[16]。因此通常采用蛋白质的内源荧光光谱中荧光峰位变化,来推测蛋白质构象的变化,其中,通过色氨酸荧光光谱,可以研究蛋白质的三级结构变化特点和蛋白质之间的相互作用[13]。核桃蛋白的荧光光谱如图4所示。40 ℃核桃蛋白荧光发射峰的λm为337.01 nm,160 ℃核桃蛋白荧光发射峰的λm为338.69 nm,λm值均超过330 nm,这显示加热前后蛋白质中的色氨酸残基都位于极性环境中[13]。随着榨油温度的升高,制取的核桃蛋白样品的最大吸收峰红移1.68 nm。红移现象暗示了蛋白质的三级或四级结构发生了改变,导致内部的色氨酸残基从非极性环境转移出来。色氨酸通常具有疏水相互作用,红移程度越大,说明蛋白质疏水相互作用增强。荧光强度的波动也可以说明蛋白质结构在三级结构上发生的变化。如图4所示,荧光峰随着温度的升高不断增宽,这表明随着温度的升高,蛋白质的折叠结构展开的程度越大[17]。
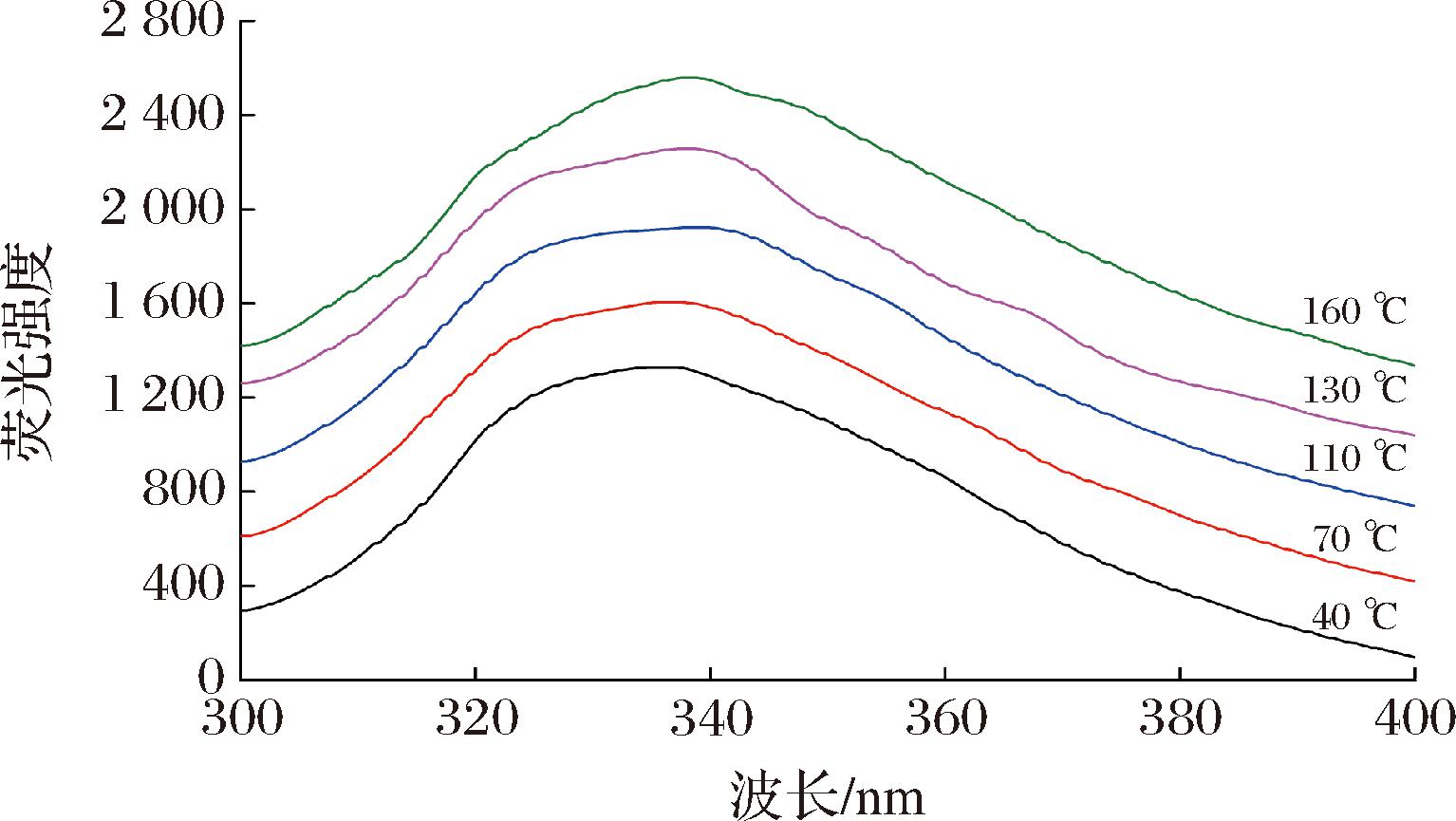
图4 核桃蛋白的荧光光谱
Fig.4 Fluorescence spectra of walnut protein
2.5 核桃蛋白非共价作用力分析
蛋白质中离子键、氢键和疏水相互作用的比例如图5所示,疏水相互作用明显高于氢键和离子键,表明维持组织化蛋白空间结构的主要作用力是疏水相互作用。随着榨油温度升高,核桃蛋白中的离子键、氢键含量降低,疏水相互作用含量不断增加。说明升高温度,蛋白质内部的非共价作用力发生了改变。其中的氢键对蛋白二级结构具有重要的影响,蛋白质内部氢键的断裂,使其α-螺旋和β-折叠的稳定性降低。同时蛋白质的折叠状态逐渐展开,分子内部的疏水侧链通过分子的伸展被暴露出来,使得相邻分子中间发生疏水相互作用,并使疏水相互作用成为主导驱动力[18]。特别是在160 ℃时,疏水相互作用的含量更加丰富,有助于蛋白质的组织化。
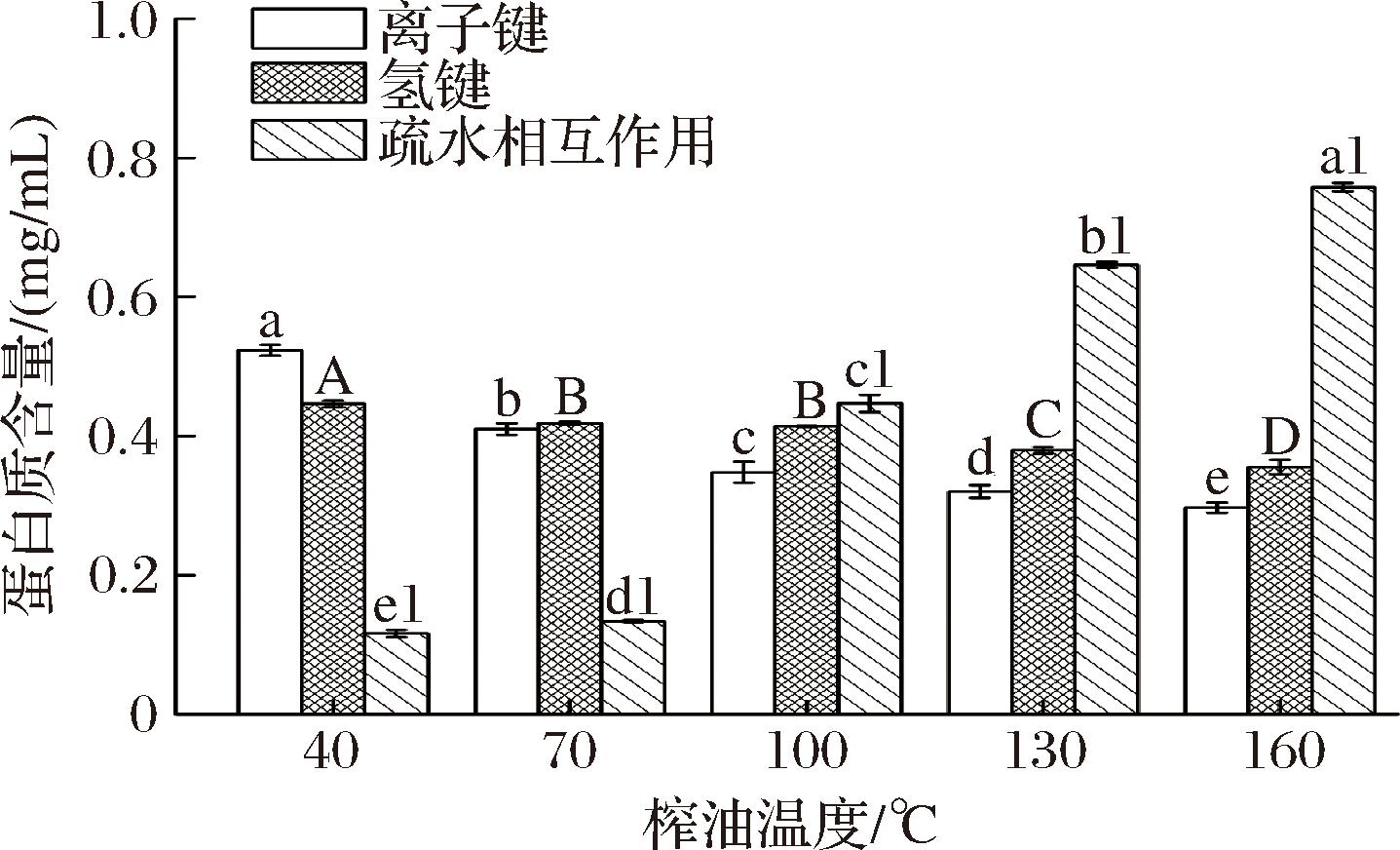
图5 核桃蛋白非共价键相互作用结果
Fig.5 Results of non-covalent bond interactions in walnut protein
注:小写字母表示离子键含量的显著性差异(P<0.05),大写字母表示氢键的显著性差异(P<0.05),小写字母+数字表示疏水相互作用的显著性差异(P<0.05)。
2.6 核桃蛋白表面疏水性分析
图6是榨油温度对核桃蛋白表面疏水性的影响。由图可知,随着温度的升高核桃蛋白的表面疏水性逐渐增大,这是由于高温条件下蛋白质变性程度大,分子链伸展,暴露出来的疏水基团之间在疏水相互作用下能够形成不可溶聚集体,表面疏水性可能源于非极性疏水基团聚集排斥开的水分子之间的相互作用。疏水基团暴露形成聚合包埋,导致蛋白质的表面疏水性逐渐增加。
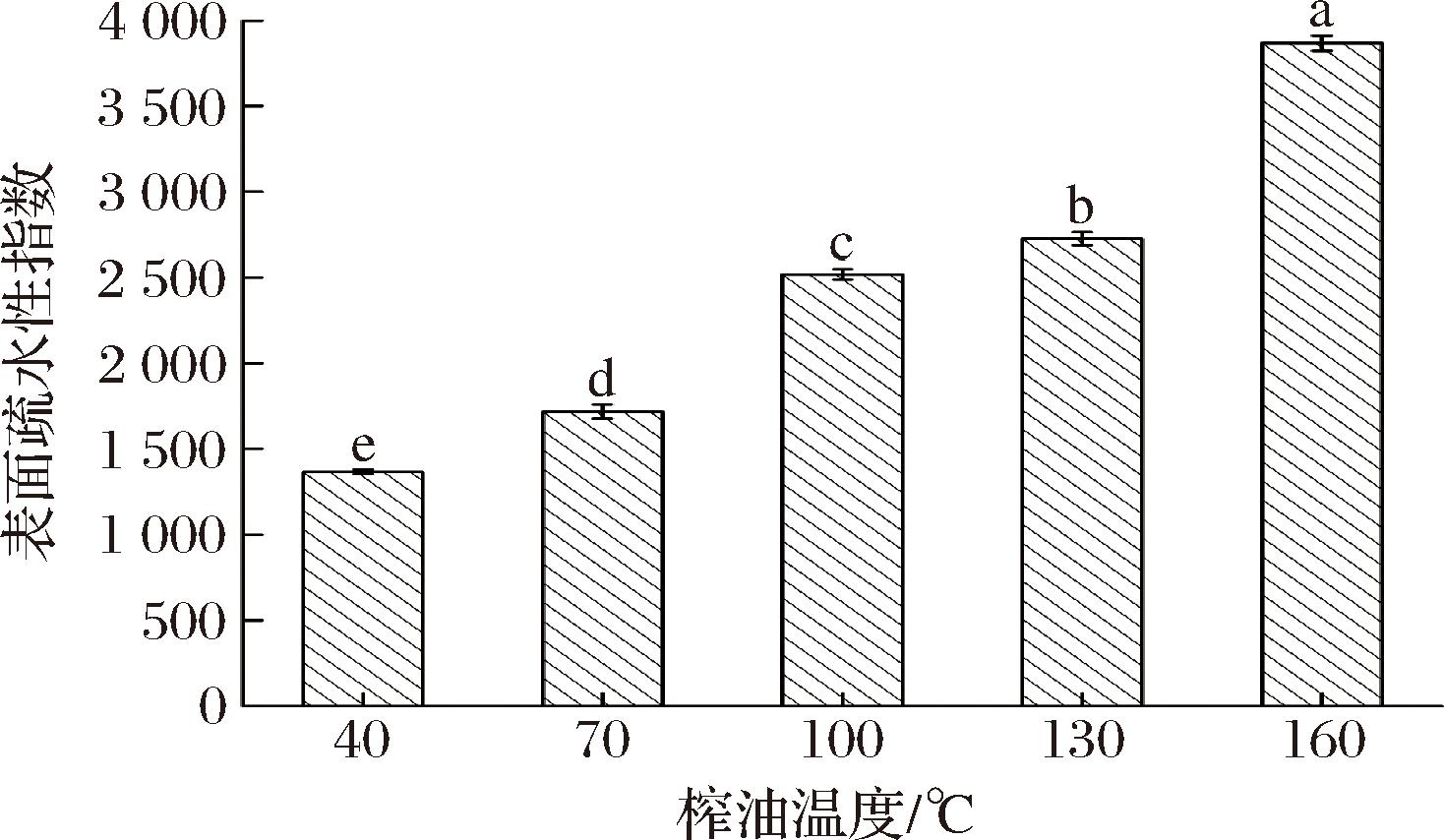
图6 榨油温度对核桃蛋白表面疏水性的影响
Fig.6 Effect of pressing temperature on surface hydrophobicity of walnut protein
注:小写字母表示游离巯基含量的显著性差异(P<0.05)。
2.7 游离巯基和二硫键含量分析
图7展示了榨油温度对核桃蛋白游离巯基和二硫键含量的影响。二硫键是蛋白质分子内部常见的共价键,当蛋白质发生变性时,二硫键会转变为游离巯基,因此通过观察游离巯基的含量,可以分析蛋白质的变性情况。由图7可知,随着温度的升高,游离巯基的含量从40 ℃时的5.88 μmol/g上升到160 ℃时的13.24 μmol/g。这表明,分子内部的二硫键在一定程度上发生了断裂,转变为游离巯基,进而导致蛋白质不断发生变性。此外,榨油温度越高,蛋白质的结构越容易展开,内部的巯基也随之暴露出来。因此,温度越高,巯基的含量也会相应增加。值得注意的是,巯基具有增强蛋白溶解性的作用,因此其含量的增加可能会提高蛋白的溶解性。另一方面,二硫键的含量并未随着榨油温度的升高逐渐降低,这可能是由于在高温条件下,巯基发生氧化反应形成了新的二硫键,从而导致其含量有所增加。
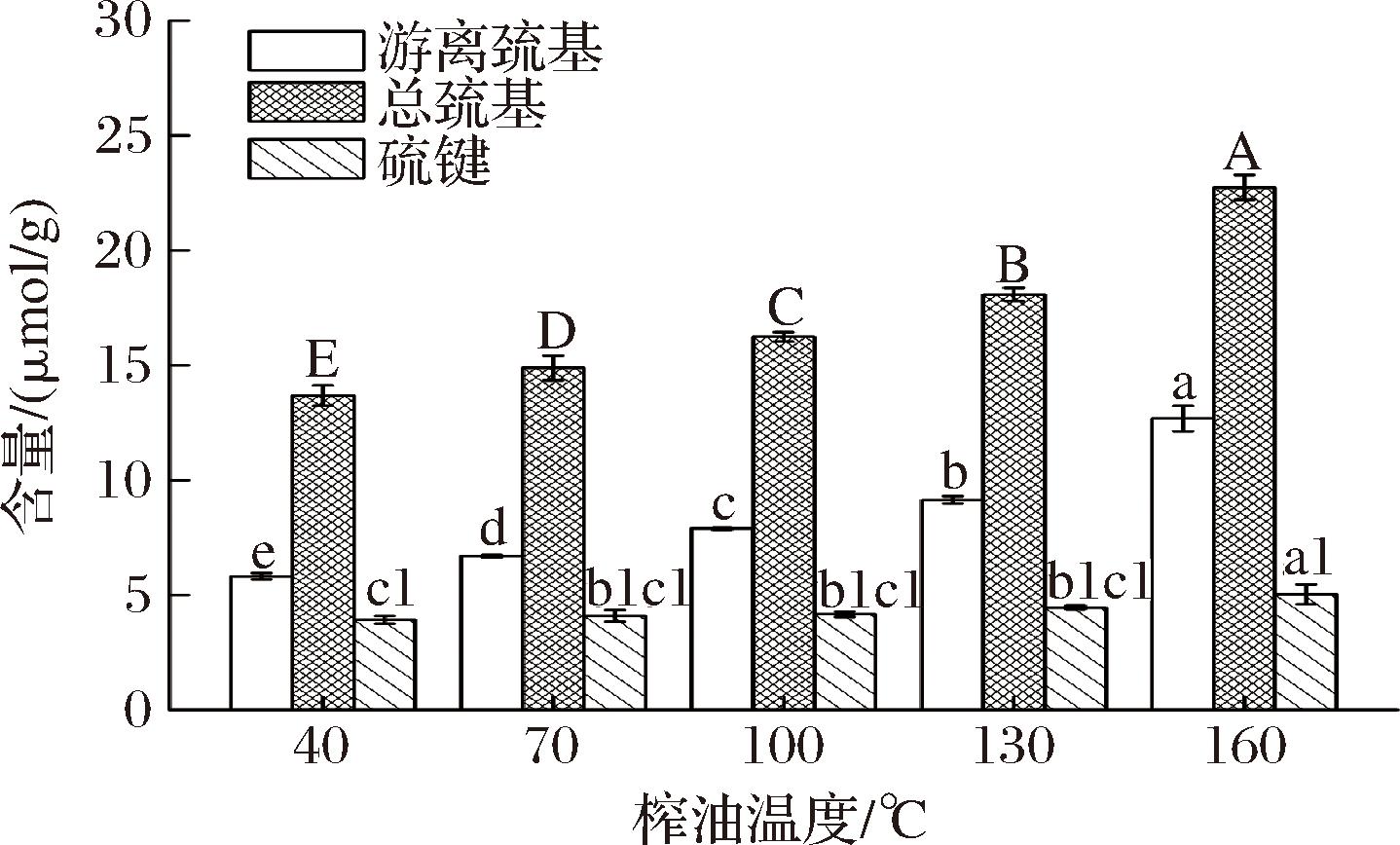
图7 榨油温度对核桃蛋白游离巯基和二硫键含量的影响
Fig.7 The effect of oil extraction temperature on the content of free sulfhydryl and disulfide bonds in walnut protein
注:小写字母表示游离巯基含量的显著性差异(P<0.05),大写字母表示总巯基的显著性差异(P<0.05),小写字母+数字表示二硫键的显著性差异(P<0.05)。
2.8 核桃蛋白功能特性分析
核桃蛋白的吸水性、吸油性、溶解度、乳化性及乳化稳定性如表3所示。
表3 榨油温度对核桃蛋白的功能特性影响
Table 3 Effect of pressing temperature on functional properties of walnut protein
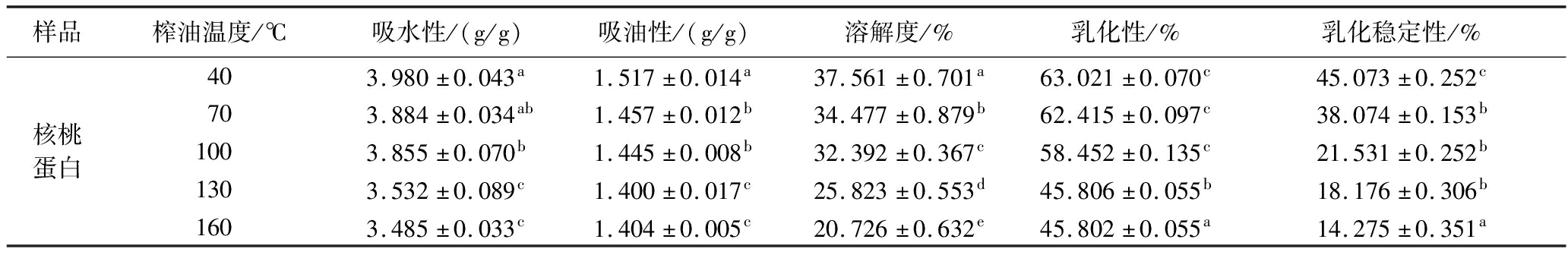
样品榨油温度/℃吸水性/(g/g)吸油性/(g/g)溶解度/%乳化性/%乳化稳定性/%核桃蛋白403.980±0.043a1.517±0.014a37.561±0.701a63.021±0.070c45.073±0.252c703.884±0.034ab1.457±0.012b34.477±0.879b62.415±0.097c38.074±0.153b1003.855±0.070b1.445±0.008b32.392±0.367c58.452±0.135c21.531±0.252b1303.532±0.089c1.400±0.017c25.823±0.553d45.806±0.055b18.176±0.306b1603.485±0.033c1.404±0.005c20.726±0.632e45.802±0.055a14.275±0.351a
蛋白的吸水性受蛋白纯度、结构和氨基酸组成等影响,吸油性与蛋白非极性侧链束缚脂肪烃链有关。随着榨油温度的上升,蛋白的吸水性逐渐减弱,该现象可能与高温下蛋白内部氢键断裂,折叠状态打开,蛋白表面疏水基团暴露,蛋白在水溶液中皱缩抱团,离子基团被包裹在蛋白内部后水合作用减弱,从而吸水性降低。吸油性的降低可能与蛋白皱缩后非极性侧链被包裹吸附油脂的能力降低有关,需要进一步地验证。
核桃蛋白的溶解度受其表面疏水基团的影响[2]。由之前红外光谱、分子间非共价作用力和疏水性实验结果可知,高温会导致蛋白二级结构发生变化,蛋白质去折叠,内部疏水基团显露,增强了疏水性并促进了蛋白在水溶液中皱缩成团,进而降低溶解性。此外,虽然加热还可导致蛋白质巯基增多,理论上溶解度会增加,但其对最终结果影响不大,蛋白整体溶解性随榨油温度升高逐渐降低。蛋白溶解度降低,意味着相同质量的蛋白质配制的蛋白水溶液的浓度降低,蛋白溶液浓度降低进而导致其乳化性和乳化稳定性降低。
3 结论
本研究以“温185”纸皮核桃为对象,分析了榨油温度对核桃蛋白的结构、非共价键和功能特性的影响,得出以下主要结论:
随着榨油温度的升高,核桃蛋白的微结构由圆球状颗粒转变为紧密堆叠的片状结构,且红外最大吸收峰发生红移,表明蛋白二级结构发生变化,且在100 ℃时变化最大。具体而言,氢键和离子键减少,疏水相互作用增强,导致α-螺旋和β-折叠含量分别下降0.75%和0.03%,无规则卷曲比例上升1.73%。内部疏水基团暴露使蛋白在水溶液中皱缩,降低了亲水性和溶解度,进而影响吸水性和吸油性。此外,蛋白皱缩使得蛋白的离子基团被包裹在蛋白内部后水合作用减弱,非极性侧链被包裹在蛋白内部吸油性降低。该研究为理解核桃蛋白功能特性变化机制及开发核桃饼粕产品提供了理论基础,后续研究将探讨不同蛋白种类与结构变化之间的相关性机制。
[1] 陈鹏, 庄永亮, 耿树香, 等.两种压榨条件下深纹核桃油挥发性物质成分研究[J/OL].中国油脂, 2023.https://doi.org/10.19902/j.cnki.zgyz.1003-7969.230387.CHEN P, ZHUANG Y L, GENG S X, et al.Study on volatile matters of walnut oil from Juglans sigillata under two pressing conditions[J/OL].China Oils and Fats, 2023.https://doi.org/10.19902/j.cnki.zgyz.1003-7969.230387.
[2] 李梁宵.我国四个品种核桃蛋白结构和功能特性的研究[D].北京:北京林业大学, 2019.LI L X.Structural and functional properties of walnut protein obtained from Chinese four varieties[D].Beijing:Beijing Forestry University, 2019.
[3] 邓欣伦.核桃蛋白—多糖界面相互作用及其对乳浊液性质影响的研究[D].广州:华南理工大学, 2016.DENG X L.Walnut protein-polysaccharide interactions at the oil/water interface:Effect on the properties of emulsion[D].Guangzhou:South China University of Technology, 2016.
[4] 郭兴峰, 陈计峦, 林燕, 等.热榨和冷榨核桃饼粕中蛋白质提取及其性质研究[J].农业工程学报, 2012, 28(18):287-292.GUO X F, CHEN J L, LIN Y, et al.Extraction and characterization of protein from cold pressed and traditional pressed degreased walnut dregs[J].Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(18):287-292.
[5] 王振国, 高育哲, 时家峰, 等.挤压温度对大豆分离蛋白与原花青素复合物结构和功能特性的影响[J].农业工程学报, 2022, 38(21):279-286.WANG Z G, GAO Y Z, SHI J F, et al.Effects of extrusion temperature on the functional and structural properties of soybean protein isolate and proanthocyanidin complex[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(21):279-286.
[6] 付嘉阳.改性方式对棉籽蛋白结构与功能性质的影响[D].西北农林科技大学, 2020.FU J Y.The effect of modification on structure properties and functional properties of cottonseed protein[D].Northwest A&F University, 2020.
[7] 张继文, 王丽梅, 马琳, 等.响应面分析法优化核桃蛋白提取工艺[J].武汉工业学院学报, 2013, 32(1):11-14.ZHANG J W, WANG L M, MA L, et al.Optimization of extracting protein from walnut cake by response surface methodology[J].Journal of Wuhan Polytechnic University, 2013, 32(1):11-14.
[8] 李芃荃, 谭雪松, 张清, 等.核桃冷榨适宜温度的试验研究[J].科技和产业, 2021, 21(1):203-208;268.LI P Q, TAN X S, ZHANG Q, et al.Experimental study on suitable press temperature of walnut[J].Science, Technology and Industry, 2021, 21(1):203-208;268.
[9] MOZAFARPOUR R, KOOCHEKI A, MILANI E, et al.Extruded soy protein as a novel emulsifier:Structure, interfacial activity and emulsifying property[J].Food Hydrocolloids, 2019, 93:361-373.
[10] AWAIS M, ASHRAF J, WANG L L, et al.Effect of controlled hydrothermal treatments on mung bean starch structure and its relationship with digestibility[J].Foods, 2020, 9(5):664.
[11] DU M X, XIE J H, GONG B, et al.Extraction, physicochemical characteristics and functional properties of Mung bean protein[J].Food Hydrocolloids, 2018, 76:131-140.
[12] 刘锞琳, 何悦珊, 王钊, 等.傅里叶红外光谱法与拉曼光谱法测定蛋白质二级结构研究进展[J].食品与发酵工业, 2023, 49 (10):293-298.LIU K L, HE Y S, WANG Z, et al.Progress in determination of protein secondary structure by Fourier infrared spectroscopy and Raman spectroscopy[J].Food and Fermentation Industries, 2023, 49(10):293-298.
[13] 张俊杰, 郑嘉琛, 谢宜桐, 等.高水分挤压温度对绿豆蛋白结构的影响[J].食品工业科技, 2022, 43(20):130-136.ZHANG J J, ZHENG J C, XIE Y T, et al.Effect of extrusion temperature on the structure of high-moisture extruded mung bean protein[J].Science and Technology of Food Industry, 2022, 43(20):130-136.
[14] HOSSAIN BRISHTI F, CHAY S Y, MUHAMMAD K, et al.Structural and rheological changes of texturized mung bean protein induced by feed moisture during extrusion[J].Food Chemistry, 2021, 344:128643.
[15] PERREAULT V, HÉNAUX L, BAZINET L, et al.Pretreatment of flaxseed protein isolate by high hydrostatic pressure:Impacts on protein structure, enzymatic hydrolysis and final hydrolysate antioxidant capacities[J].Food Chemistry, 2017, 221:1805-1812.
[16] WANG K Q, SUN D W, PU H B, et al.Principles and applications of spectroscopic techniques for evaluating food protein conformational changes:A review[J].Trends in Food Science &Technology, 2017, 67:207-219.
[17] GHOBADI S, ASHRAFI-KOOSHK M R, MAHDIUNI H, et al.Enhancement of intrinsic fluorescence of human carbonic anhydrase II upon topiramate binding:Some evidence for drug-induced molecular contraction of the protein[J].International Journal of Biological Macromolecules, 2018, 108:240-249.
[18] LIU H M, GAO L L, REN Y X, et al.Chemical interactions and protein conformation changes during silver carp (Hypophthalmichthys molitrix) surimi gel formation[J].International Journal of Food Properties, 2014, 17(8):1702-1713.