莼菜(Brasenia schreberi),又名水葵,俗称露葵、马蹄草、水荷叶或湖菜,属睡莲科,为多年生宿根草本水生植物,主要生长在湖泊、沼泽、池塘等淡水湿地环境中。在东亚、西印度群岛、澳大利亚、北美和中美洲等热带和温带地区广泛分布,国内则以苏南太湖、杭州西湖、湖北利川和重庆石柱等地为主[1]。莼菜嫩叶富含胶质蛋白、碳水化合物、脂肪、维生素和矿物质等,被认为是最有价值的蔬菜之一,具有药食两用的保健作用[2]。WAN等[3]发现包裹莼菜叶的黏液提取物通过调节小鼠的肠道菌群对溃疡性结肠炎有一定预防作用;VAHEKENI等[4]发现水提法提取的莼菜多糖有抗锥虫活性。目前,由于保鲜技术的限制,国内对莼菜的食用主要以鲜食为主或经杀菌工艺加工成饮品,整体产业的精深加工程度不足。
多糖是由十余种单糖缩合脱水而成的天然高分子聚合物,关于其生物活性研究是领域热点。在莼菜所含的各种营养成分中,以多糖所占比例为最高。FENG等[5]用超滤法从莼菜体外胶质中分离出3种多糖组分,发现其均对α-葡萄糖苷酶和α-淀粉酶有一定的抑制作用;WANG等[6]采用热水提取法获得莼菜多糖,发现其在体内外均表现出优异的抗氧化活性。此外,莼菜多糖还具有抗虫[4]、抗癌[7]和抑藻[8]等功能活性。
热水提取法是目前最为方便且应用最广泛的多糖提取方式,具有无毒无害、操作简单成本低等优点。然而,天然活性多糖主要存在于各种植物的细胞壁中,热水提取法只能提取一部分水溶性多糖,大量的细胞内多糖和细胞壁结合多糖不能被溶出[9]。研究表明,使用一定浓度的碱溶液可以破坏细胞壁中纤维素和半纤维素之间的氢键,使与细胞壁结合的多糖或细胞内多糖被溶出,以提高多糖的产量[10]。LIN等[11]研究发现碱提木枣多糖表现出较好的体外抗氧化活性;CHEN等[12]将水提黑小麦多糖的残渣使用碱溶液进一步提取剩余多糖,相比之下碱提黑小麦多糖表现出更好的α-淀粉酶抑制能力和抗氧化能力。此外,在多糖粗提物中会存在无机盐、蛋白质、色素和小分子物质等杂质,对多糖的纯度、结构和生物活性等都会有一定的影响,甚至在研究其活性作用时不能确定是否为多糖发挥的作用,因此需要进一步除杂处理(如脱蛋白、脱色)[13]。三氯乙酸(trichloroacetic acid method,TCA)法、Sevage法和等电点法等都是常见的脱蛋白方法,但可能导致多糖结构变化和损失率增加,进而影响多糖的生物活性[14]。大孔树脂法、H2O2法、活性炭法等是常见的脱色方法,能改善多糖的色泽,提高纯度,但也可能导致多糖结构发生变化[15]。因此,在多糖粗纯化过程中,需综合考虑多糖的纯度、结构和生物活性,选择合适的脱蛋白和脱色方法来优化多糖品质。但是,关于这方面的相关研究较少,尤其在莼菜多糖方面未有报道。
本文以产自重庆石柱地区的莼菜为原料,首先采用传统的热水提取法分离提取多糖,进一步采用碱提法提取水提残渣中的多糖,最大化利用莼菜原料。同时,重点考察莼菜粗多糖经脱蛋白和脱色处理后的结构和抗氧化活性变化,以期为莼菜多糖的开发和综合利用提供参考。
1 材料与方法
1.1 材料与试剂
莼菜,重庆市石柱县水火土食品产业有限公司提供;D101大孔树脂,上海麦克林生化科技股份有限公司;正丁醇,上海吉至生化科技有限公司;TCA、活性炭、30%过氧化氢,成都市科隆化学品有限公司;三氯乙酸,上海阿拉丁生化科技股份有限公司;ABTS,上海毕得医药科技股份有限公司;DPPH,上海亿言生物科技有限公司;总抗氧化能力试剂盒,上海碧云天生物技术股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
4500Y高速多功能粉碎机,永康市铂欧五金制品有限公司;Multifuge×3R高速冷冻离心机、Nicoletis-50傅里叶红外光谱仪,赛默飞世尔科技(中国)有限公司;JYq2-11 N超声波细胞粉碎机、SCIENTZ-10 ND冷冻干燥机,宁波新芝生物科技股份有限公司;XD-52AA旋转蒸发器,上海贤德实验仪器有限公司;Synergy HTX多功能酶标仪,美国伯腾有限公司;UV-6100紫外可见分光光度计,上海元析仪器有限公司;DGG-9140A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;HH-4智能数显恒温水浴锅,金坛区白塔安瑞实验仪器厂;Phenom Pro10102扫描电镜,荷兰Phenom World公司。
1.3 实验方法
1.3.1 莼菜多糖提取
莼菜经清水淋洗,用滤布将周围胶质挤出,将剩余的莼菜叶于60 ℃下烘干,冷却后经高速粉碎机粉碎,收集莼菜叶粉(the powder of Brasenia schreberi,P-BS)并密封保存。参考张琨霖等[16]的方法,并稍作修改。根据预实验结果,按照料液比1∶40(g∶mL)将莼菜叶粉与去离子水混合,于70 ℃提取2 h,8 000 r/min离心15 min,收集粗多糖上清液备用。进一步收集离心后的水提残渣,按照料液比1∶40(g∶mL)将其与0.1 mol/L的NaOH溶液混合,提取(70 ℃,2 h)并离心(8 000 r/min,15 min)收集上清液,并将其pH调至7.0。将2次所得提取液分别于55 ℃下减压浓缩至原体积的1/4后加入4倍体积无水乙醇,于4 ℃ 下醇沉24 h,离心后(8 000 r/min,15 min)收集沉淀,透析48 h,冷冻干燥即得莼菜叶水提粗多糖(water-extracted Brasenia schreberi polysaccharide,WBSP)和碱提粗多糖(alkaline-extracted Brasenia schreberi polysaccharide,ABSP)。
1.3.2 多糖含量的测定
采用苯酚硫酸法[17]测定多糖含量。以无水葡萄糖为标准品作线性回归,测定其在490 nm处的吸光度,得标准曲线回归方程为Y=7.852 5X+0.013 1,R2=0.993 9;Y为吸光度,X为葡萄糖含量(mg/mL),并按公式(1)计算多糖得率:
(1)
式中:Y, 多糖得率,%;C,待测液中多糖质量浓度,mg/mL;V,待测液体积,mL;N,稀释倍数;M,莼菜粉的质量,g。
1.3.3 蛋白质含量的测定
采用考马斯亮蓝法[18]测定蛋白质含量。以牛血清蛋白为标准品,得到标准曲线回归方程Y=0.757 3X+0.358 6,R2=0.998 9;Y为吸光度,X为蛋白质质量浓度(μg/mL)。
1.3.4 脱蛋白工艺研究
分别配制成1 mg/mL的WBSP和ABSP粗多糖样液,各取50 mL于锥形瓶中,采用3种不同的方法(Sevage法、三氯乙酸法和等电点法)进行脱蛋白比较,并分别按公式(2)和公式(3)计算脱蛋白率和多糖保留率:
脱蛋白率![]()
(2)
式中:脱蛋白率,%;c1,脱蛋白前溶液的蛋白质质量浓度,μg/mL;c2,脱蛋白后溶液的蛋白质质量浓度,μg/mL。
多糖保留率![]()
(3)
式中:多糖保留率,%;m1,脱蛋白前溶液的多糖质量浓度,mg/mL;m2,脱蛋白后溶液的多糖质量浓度,mg/mL。
1.3.4.1 Sevage法
参考WU等[19]的方法并稍作修改。加入12.5 mL的Sevage 试剂[V(氯仿)∶V(正丁醇)=4∶1]于粗多糖溶液中,180 r/min摇60 min,6 000 r/min离心15 min,弃去下层有机相和中间层状胶状变性蛋白质层,取上清液,多次脱蛋白至无明显沉淀生成并收集上清液备用,测定上清液的蛋白浓度和多糖含量,并计算脱蛋白率和多糖保留率。
1.3.4.2 TCA法
参考ZENG等[20]的方法并稍作修改。以1∶1的体积比加入150 g/L TCA溶液,将其混合均匀后,放置4 ℃静置过夜,6 000 r/min离心15 min,收集上清液备用,测定上清液的蛋白浓度和多糖含量,并计算脱蛋白率和多糖保留率。
1.3.4.3 等电点法
参考LIU等[21]的方法并稍作修改。用2 mol/L的盐酸分别调节pH至 1.0、2.0、3.0、4.0、5.0,将溶液静置12 h,6 000 r/min离心15 min,收集上清液备用,测定上清液的蛋白浓度和多糖含量,并计算脱蛋白率和多糖保留率。
1.3.5 ABSP的脱色研究
水提法获得的WBSP溶液近乎无色,不需要进行脱色处理。本研究取最优脱蛋白方法处理后的ABSP溶液,配制成1 mg/mL进行不同脱色方法间的比较,并按公式(4)计算脱色率和多糖保留率:
脱色率![]()
(4)
式中:脱色率,%;d1和d2分别为脱色前和脱色后ABSP溶液在波长450 nm处的吸光度。
1.3.5.1 活性炭法
活性炭经去离子水多次洗涤后,110 ℃烘干24 h。在ABSP溶液中加入20 g/L的活性炭,在50 ℃的水浴条件下恒温脱色90 min,趁热过滤。
1.3.5.2 过氧化氢法
参考金路等[22]的方法并稍作修改。在ABSP溶液中加入60 g/L的过氧化氢溶液,在50 ℃的水浴条件下恒温脱色90 min,趁热过滤。
1.3.5.3 大孔树脂法
参考HU等[23]的方法对D101号型大孔树脂进行预处理。用蒸馏水充分润洗树脂,以去除表面杂质,然后加入95%乙醇溶液浸泡12 h[料液比为1∶4(g∶mL)]浸泡。弃去乙醇并用蒸馏水洗涤至无醇味。进一步以1 mol/mL HCl溶液浸泡2 h,用蒸馏水洗涤至中性后,再用1 mol/mL NaOH溶液浸泡2 h,用蒸馏水洗涤至中性后干燥(60 ℃),保存于4 ℃冰箱备用。
准确称取预处理后的树脂置于具塞锥形瓶中,按液料比5∶1(mL∶g) 加入ABSP多糖溶液,在50 ℃的水浴条件下恒温脱色90 min,趁热过滤。
1.3.6 莼菜多糖的结构表征
1.3.6.1 紫外-可见光吸收光谱(ultraviolet-visible absorption spectroscopy,UV-vis)分析
配制质量浓度为0.1 mg/mL的多糖溶液,用紫外分光光度计于200~600 nm进行光谱扫描。
1.3.6.2 傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
称取少量经过不同方法处理后的莼菜多糖样品置于研钵中,与干燥的KBr粉末研磨和压片。使用傅里叶变换红外光谱仪进行测试,在4 000~400 cm-1波数进行扫描。
1.3.6.3 刚果红试验
参考李瑶等[24]的方法并稍作修改,将1 mL多糖溶液(1 mg/mL)加入1 mL 80 μmol/L刚果红,依次加入0、0.1、0.2、0.3、0.4、0.5 mol/L NaOH,室温避光反应30 min,去离子水为空白对照,利用酶标仪测定其在400~600 nm的最大吸收波长。
1.3.6.4 扫描电镜(scanning electron microscope,SEM)分析
取干燥的莼菜多糖样品粉末少许,通过导电胶将其固定在载样台上,真空喷金,然后置于场发射扫描电子显微镜下,捕捉样品表面立体形态,在20 kV的高真空加速电压和放大倍数为500倍下观察多糖的表面形态。
1.3.7 体外抗氧化活性测定
1.3.7.1 DPPH自由基清除能力
参考汪涛等[25]的方法并稍作修改。依据预实验结果,将WBSP的质量浓度稀释为50、100、200、300、400 μg/mL,将ABSP的质量浓度稀释为5、10、20、30、40 μg/mL,将0.5 mL不同浓度的多糖样液与2 mL 的0.1 mmol/L DPPH-50%乙醇溶液混匀,室温避光放置30 min,在517 nm处测定吸光度,以维生素C作为阳性对照,并按公式(5)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(5)
式中:A0,超纯水代替多糖溶液的DPPH溶液的吸光度;A1,多糖溶液与DPPH溶液混合的吸光度;A2,用50%乙醇代替DPPH溶液的样品的吸光度。
1.3.7.2 ABTS阳离子自由基清除能力
参考周元龙等[26]的方法并稍作修改。配制7 mmol/L的ABTS溶液和2.45 mmol/L K2S2O8溶液,等体积混合摇匀ABTS溶液和K2S2O8溶液,避光反应16 h,得ABTS溶液。使用时采用纯水稀释ABTS溶液至其在734 nm波长处的吸光度达到0.70±0.02,得ABTS测定液。取2 mL ABTS溶液于试管中,加入1 mL不同质量浓度的多糖溶液(WBSP:50、100、200、300、400 μg/mL,ABSP:4、8、12、16、20 μg/mL),振荡充分后避光反应6 min,在734 nm处测定吸光度,以维生素C作为阳性对照,并按公式(6)计算ABTS阳离子自由基清除率:
ABTS阳离子自由基清除率![]()
(6)
式中:A0,超纯水代替多糖溶液的ABTS溶液的吸光度;Ai,多糖溶液与ABTS溶液混合的吸光度;Aj,多糖溶液与纯水混合的吸光度。
1.3.7.3 总还原能力的测定
参考师丽仁等[27]的方法并稍作修改。配制不同质量浓度的多糖溶液(WBSP:400、500、600、700、800 μg/mL,ABSP:5、10、20、30、40 μg/mL),取2 mL多糖溶液与2 mL磷酸盐缓冲溶液(0.2 mol/L, pH 6.6)和2 mL铁氰化钾溶液(10 g/L)混合均匀,置于50 ℃ 水浴中反应20 min,加入100 g/L的三氯乙酸2 mL,混匀后以3 000 r/min离心10 min,取上清液2 mL,加入1 g/L三氯化铁溶液0.4 mL和2 mL的蒸馏水,摇匀后在700 nm处测定吸光值,平行测定3次取平均值,用维生素C溶液作阳性对照。
1.3.7.4 总抗氧化能力的测定
准确吸取10 μL不同质量浓度的多糖待测液(WBSP:400、500、600、700、800 μg/mL,ABSP:5、10、20、30、40 μg/mL),按照总抗氧化能力测定试剂盒(ABTS法)说明书进行各组试剂的配制,试剂配制完成后,室温静置10 min,蒸馏水为空白对照品,在734 nm处对吸光度值进行测定,总抗氧化能力直接用标准品Trolox的摩尔浓度来表示。
1.4 数据处理
运用GraphPad Prism 10和Origin 2021对数据进行绘图和处理。所有实验重复3次, 结果表示为“平均值±标准差”。采用SPSS 26.0对实验结果进行显著性分析,P<0.05为差异显著。
2 结果与分析
2.1 多糖得率比较
经水提法获得的WBSP的得率为5.39%,而进一步采用碱提法获得的ABSP的得率达到17.80%,远高于WBSP的得率,这可能是因为热水只能让植物细胞壁发生轻微破坏,促进更多水溶性多糖的溶出。而采用碱溶液可以进一步破坏细胞壁的结构、增强碱溶性多糖的溶出,导致ABSP的得率相对较高[10]。
2.2 不同脱蛋白方法的比较
结合图1可以看出,WBSP和ABSP的脱蛋白效果均为TCA法>Sevage法>等电点法,可能是TCA为酸性化合物,能使蛋白质变性从而改变蛋白质构象,暴露出较多的疏水基团,使TCA分子进入内部[14]。由图1-a可知,对于WBSP而言,3种方法处理后的脱蛋白率均较低,可能是因为WBSP本身含有的蛋白质较少。而多糖保留率均为Sevage法>等电点法>TCA法,这主要是因为Sevage法较温和,其原理是有机溶剂会与蛋白质产生相互作用,破坏蛋白质的双层结构,导致其在水溶液中的稳定性和溶解度平衡被打破,并发生沉淀,从而对多糖的结构影响较小[28]。而TCA 法形成的不溶性聚合物吸附了部分多糖从而造成损失,也可能导致部分多糖发生了降解,使其结构发生一定的变化[29]。综合脱蛋白率和多糖保留率,后续实验将采用Sevage法对粗多糖溶液进行脱蛋白处理,并将2种脱蛋白处理后的多糖分别命名为WBSP-S和ABSP-S。
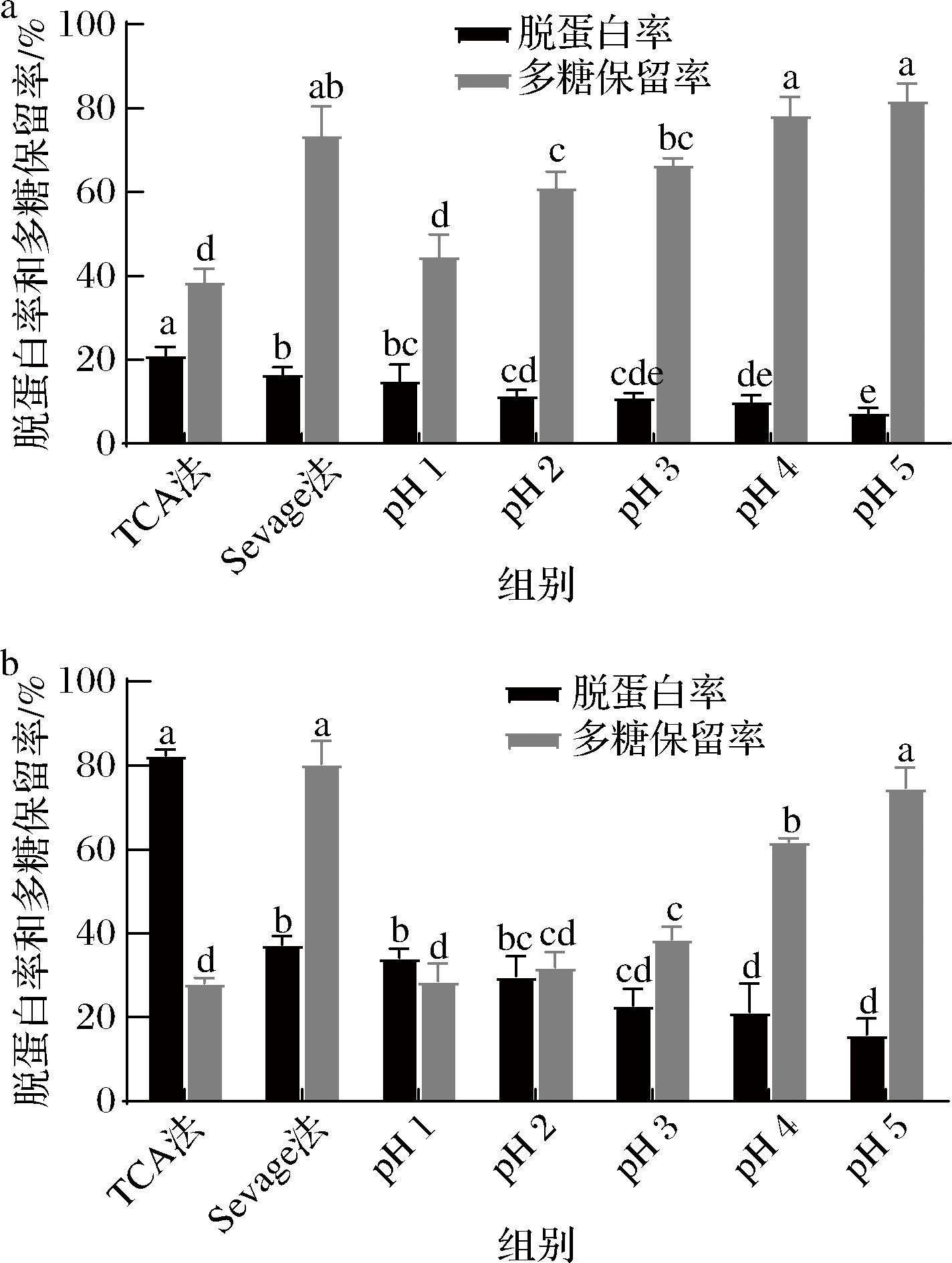
a-不同方法对WBSP的影响;b-不同方法对ABSP的影响
图1 不同脱蛋白方法对莼菜多糖的影响
Fig.1 Effect of different deproteinization methods on Brasenia schreberi polysaccharides
注:不同字母表示各比较组内的统计学差异显著(P<0.05)(下同)。
2.3 不同脱色方法对ABSP的影响
由图2可知,3种脱色方法其脱色效果依次为H2O2>大孔树脂>活性炭。H2O2作为一种强氧化剂,能将有色物质快速分解,且处理样品量大,能起到较好的脱色效果[30]。大孔树脂具有吸附速度快、再生处理方便、使用周期长、绿色环保等特点,具有一定的脱色效果[15]。而活性炭处理后的多糖溶液,其黑色残渣经多次离心后仍难以除去,脱色效果较差。对于多糖保留率而言,三者并无明显差别,大孔树脂脱色后的保留率略高于活性炭和过氧化氢脱色处理,其作为一种多孔性高分子材料,吸附条件温和且对多糖结构影响较小[31]。因此后续的体外抗氧化活性比较只针对过氧化氢和大孔树脂处理后的ABSP展开讨论,并将经H2O2脱色处理后的命名为ABSP-S-H,经大孔树脂脱色处理后的命名为ABSP-S-D。
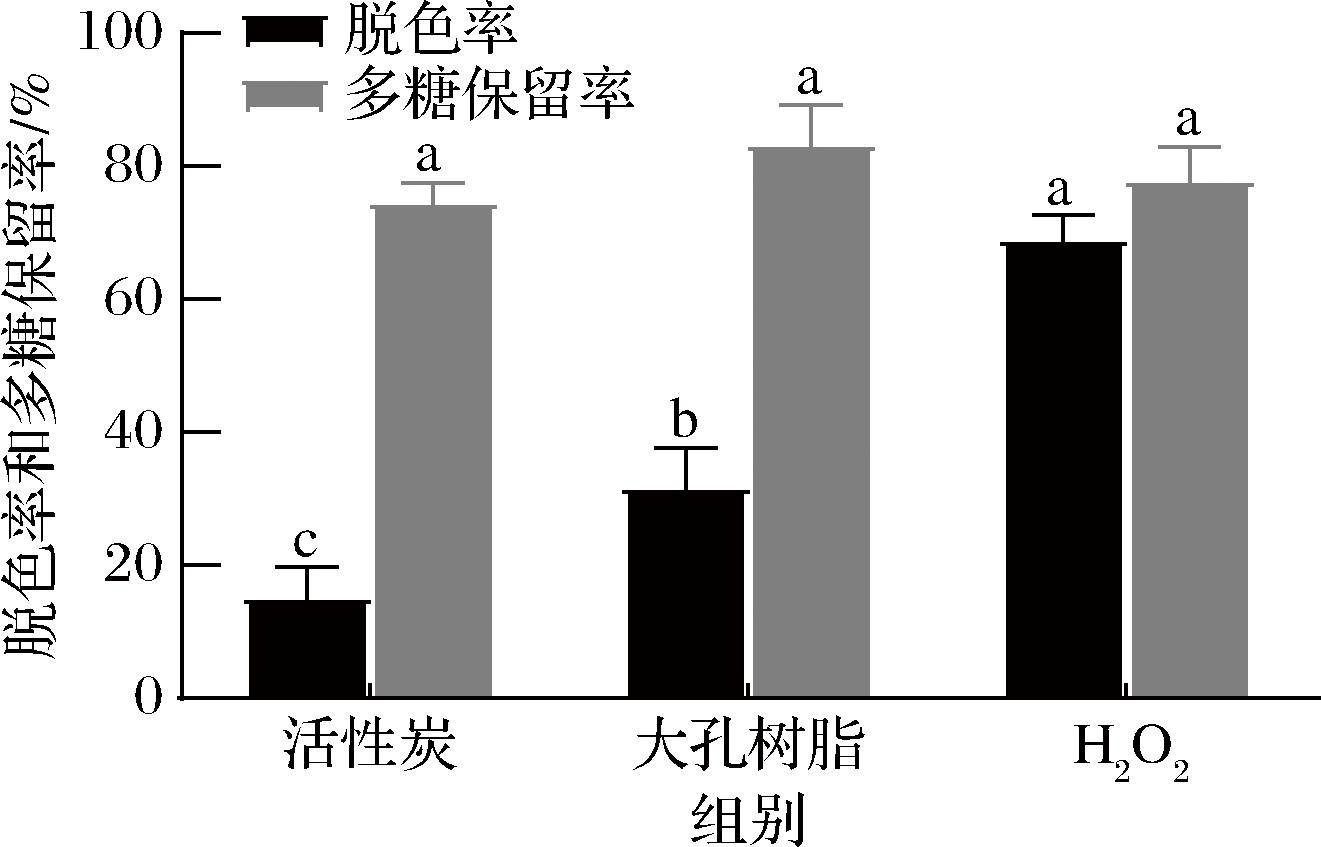
图2 不同脱色方法对ABSP脱色率和多糖保留率的影响
Fig.2 Effects of decolorization methods on decolorization rate and polysaccharide retention rate of Brasenia schreberi polysaccharides
2.4 结构表征
2.4.1 UV-vis分析
如图3所示,对莼菜多糖溶液进行UV-vis扫描,可以看到ABSP和WBSP均在280 nm附近有较强的吸收峰,说明存在一定含量的蛋白质和核酸。但经3种脱蛋白方法处理后,其吸收峰均有所降低,表明只存在较少的蛋白质和核酸。此结果也与之前测定的蛋白质含量结果一致。
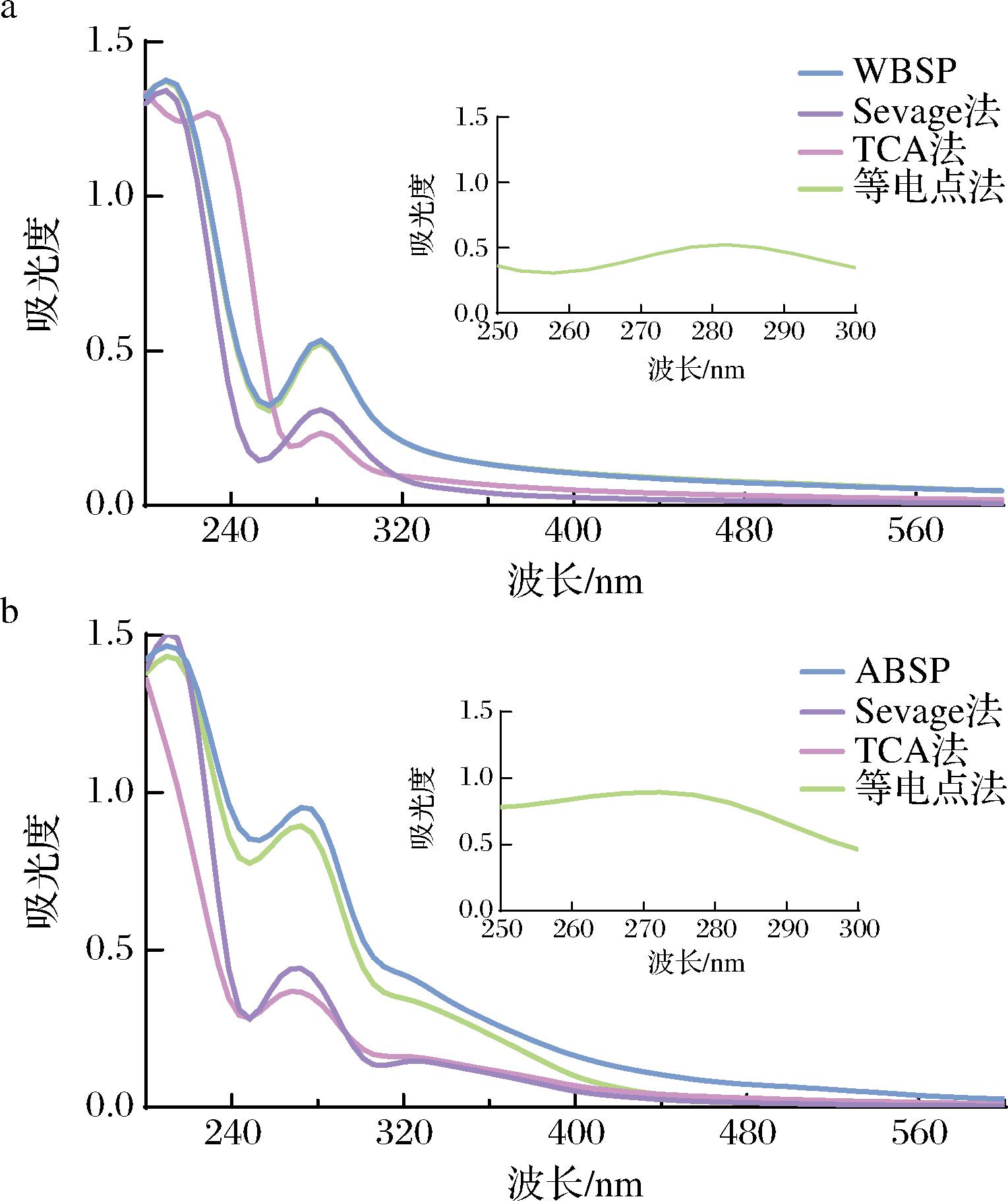
a-不同方法脱蛋白后WBSP的UV-vis谱图;b-不同方法脱蛋白后ABSP的UV-vis谱图
图3 不同方法脱蛋白前后莼菜多糖的UV-vis谱图
Fig.3 Uv-vis spectra of Brasenia schreberi polysaccharides before and after deproteinization by different methods
2.4.2 FTIR分析
不同处理后的莼菜多糖的FTIR谱图如图4所示。WBSP和WBSP-S在3 354.9 cm-1处的吸收峰为分子内/分子间氢键引起的O—H 伸缩振动;2 926.9 cm-1处的吸收峰来自—CH、—CH2、—CH3基团中C—H的伸缩振动;1 720.3 cm-1处的吸收峰可能为O—H的弯曲振动或C![]() O不对称伸缩振动;1 373.5 cm-1处为C—H的弯曲振动;1 247.3、1 023.1 cm-1处的吸收峰为吡喃糖中的C—O—C键不对称拉伸振动[32];在900~800 cm-1的小峰意味着α-构型和β-构型的存在,还可能存在D-葡萄糖残基;759.7 cm-1 处的吸收峰表明可能存在α-吡喃糖环,有α-糖苷键的存在[33]。对于ABSP、ABSP-S、ABSP-S-H和ABSP-S-D,也有类似的键型振动。结果表明,2种方法提取所得莼菜多糖的特征峰趋势基本一致,只是在吸收峰强度上略有不同,脱蛋白及脱色处理对其特征峰型影响不大,典型特征峰均没有消失。对比WBSP和ABSP,WBSP-S和ABSP-S的特征吸收峰均有一定程度的增强,表明脱蛋白处理后的莼菜多糖纯度较高,其对应的特定化学键的相对吸收强度较大。而经脱色处理后的ABSP-S-H和ABSP-S-D在相比之下,其峰型没有明显的变化,说明脱色处理对ABSP的化学键没有较大的影响。
O不对称伸缩振动;1 373.5 cm-1处为C—H的弯曲振动;1 247.3、1 023.1 cm-1处的吸收峰为吡喃糖中的C—O—C键不对称拉伸振动[32];在900~800 cm-1的小峰意味着α-构型和β-构型的存在,还可能存在D-葡萄糖残基;759.7 cm-1 处的吸收峰表明可能存在α-吡喃糖环,有α-糖苷键的存在[33]。对于ABSP、ABSP-S、ABSP-S-H和ABSP-S-D,也有类似的键型振动。结果表明,2种方法提取所得莼菜多糖的特征峰趋势基本一致,只是在吸收峰强度上略有不同,脱蛋白及脱色处理对其特征峰型影响不大,典型特征峰均没有消失。对比WBSP和ABSP,WBSP-S和ABSP-S的特征吸收峰均有一定程度的增强,表明脱蛋白处理后的莼菜多糖纯度较高,其对应的特定化学键的相对吸收强度较大。而经脱色处理后的ABSP-S-H和ABSP-S-D在相比之下,其峰型没有明显的变化,说明脱色处理对ABSP的化学键没有较大的影响。
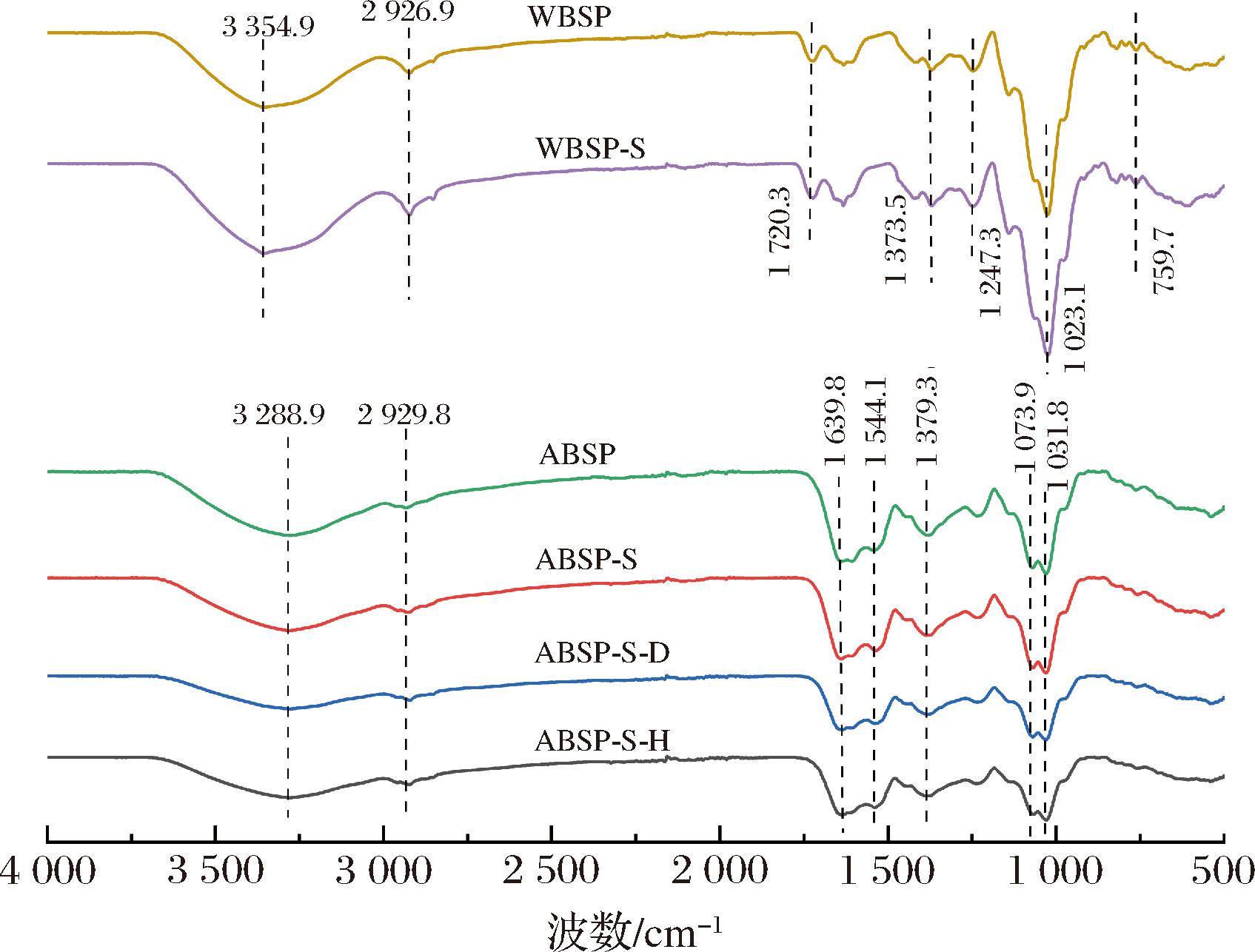
图4 不同处理前后莼菜多糖的FTIR谱图
Fig.4 FTIR spectra of Brasenia schreberi polysaccharides before and after different treatments
2.4.3 刚果红实验
刚果红是一种酸性染料,能够与具有三螺旋结构的多糖结合可以形成稳定的螺旋状复合物[34]。由图5可知,刚果红的λmax为500 nm,刚果红-WBSP复合物和刚果红-WBSP-S复合物的λmax均为510 nm,发生了红移,表明两者都存在三螺旋结构。并且λmax随NaOH浓度的增加减小,表明其三螺旋结构被破坏。而ABSP、ABSP-S和ABSP-S-D的λmax均为400 nm,不随NaOH的浓度变化而发生变化,表明其不能与刚果红产生络合物,三者均不存在三螺旋结构,可能是ABSP在碱法提取过程中就发生了解旋,使其结构发生改变。
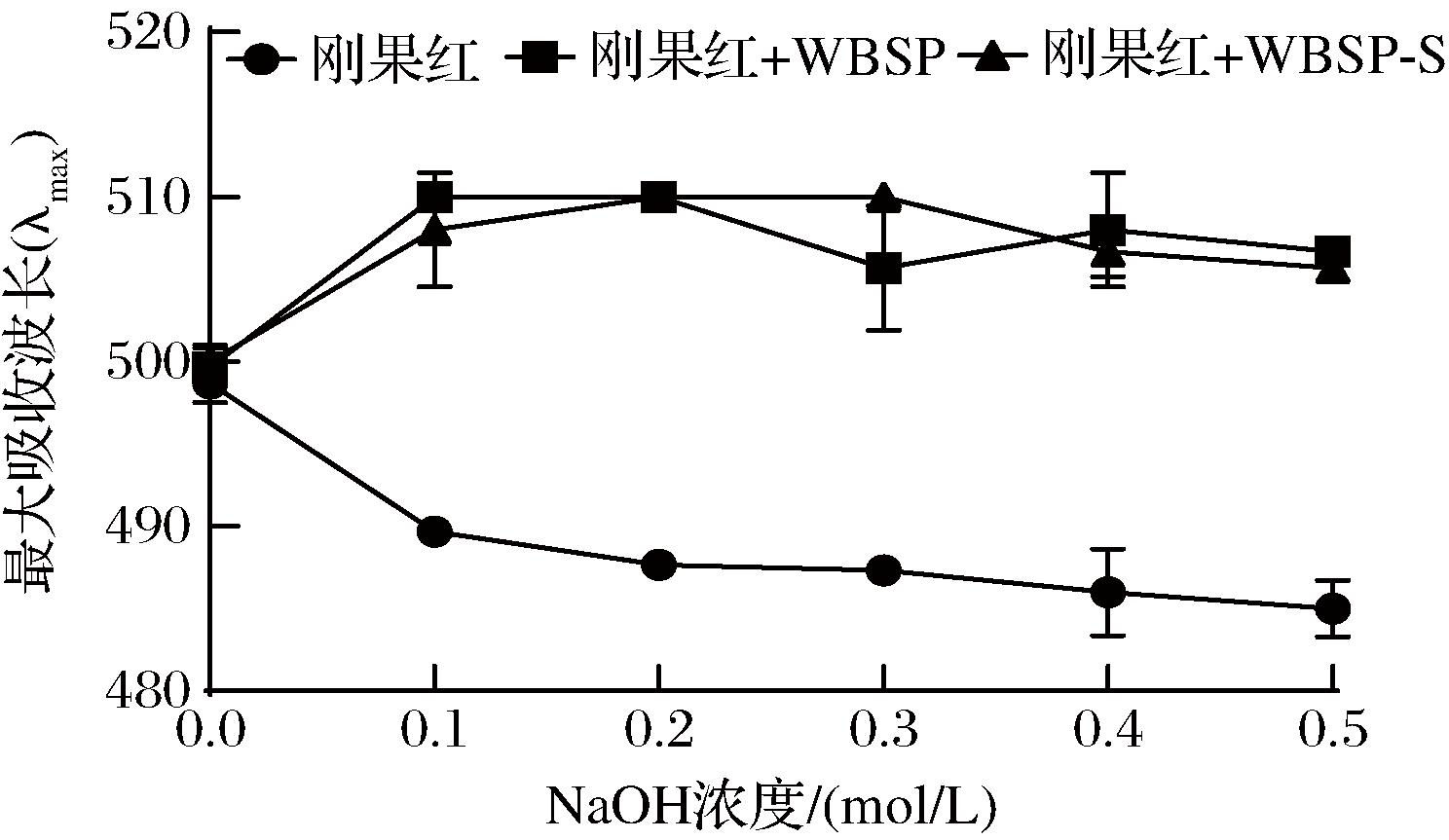
图5 不同NaOH浓度下WBSP与刚果红络合物的最大吸收波长
Fig.5 Maximum absorption wavelength of WBSP and Congo red complex at different concentrations of NaOH
2.4.4 SEM分析
图6为P-BS以及经不同处理后莼菜多糖的扫描电镜图。由图可知,WBSP和ABSP的形态有明显的区别。P-BS表面粗糙,有大小不一、致密的球状物聚集存在。WBSP呈现出不规则的致密光滑的纤维状结构,而ABSP呈现出不规则致密的片状结构,且两者经脱蛋白后的结构孔隙更多,可能是脱蛋白处理导致多糖的微观结构受损。ABSP经H2O2脱色处理后,其片状结构的破碎程度更深、更密集,而对于ABSP-S-D,其破碎程度无明显变化。这些差异可能也受到提取方法和处理方式的影响,还可能与分子内氢键的排列有关[35]。此外,不同提取方法所得多糖的相对分子质量、单糖组成及官能团等也可能造成多糖结构的差异。

图6 不同处理前后莼菜多糖的扫描电镜图
Fig.6 SEM images of Brasenia schreberi polysaccharides before and after different treatments
2.5 莼菜多糖的体外抗氧化研究
2.5.1 DPPH自由基清除活性
由图7可知,经不同处理后莼菜多糖的DPPH自由基清除率均呈浓度依赖性,且经Sevage法脱蛋白处理后多糖清除率均轻微增大。可能是因为Sevage试剂能使蛋白质的双层结构被有机溶剂破坏,打破了其在水溶液中的溶解度平衡和稳定性,将游离蛋白变性成为不溶性物质,从而对多糖的结构影响较小,经离心分离去除后使多糖的纯度提高,使其清除率增大[28]。经计算得WBSP-S对DPPH自由基的半抑制浓度(IC50)为426.66 μg/mL,ABSP-S对DPPH自由基的IC50为25.84 μg/mL。且ABSP-S质量浓度为40 μg/mL时,其DPPH自由基清除率为69.30%,表明ABSP-S对DPPH自由基具有相对较强的清除活性。由图7可知,在WBSP的浓度为ABSP 浓度10倍的情况下,其DPPH自由基清除率依然低于ABSP,说明ABSP的抗氧化活性远优于WBSP。结合上述结构表征的结果,虽然ABSP不存在三螺旋结构,但能通过其他方式如形成更紧密的分子间相互作用来增强抗氧化效果。且其含有的还原性基团(如醛基、烯键等)能够提供氢原子或电子,从而破坏自由基反应链,表现出更优的抗氧化活性[36]。由图7-b可知,ABSP-S-H和ABSP-S-D的DPPH自由基清除率均有一定程度的下降,且ABSP-S-H的清除率下降最显著。可能是因为H2O2在氧化色素的同时对多糖的微观结构产生了一定的破坏作用(图6),进而氧化了部分多糖和改变多糖的聚合结构,使ABSP-S-H对DPPH自由基的清除能力减弱[37]。但ABSP-S-D在质量浓度为40 μg/mL时的DPPH自由基清除率仍达到47.33%,IC50为42.35 μg/mL,仍具有较好的抗氧化活性。
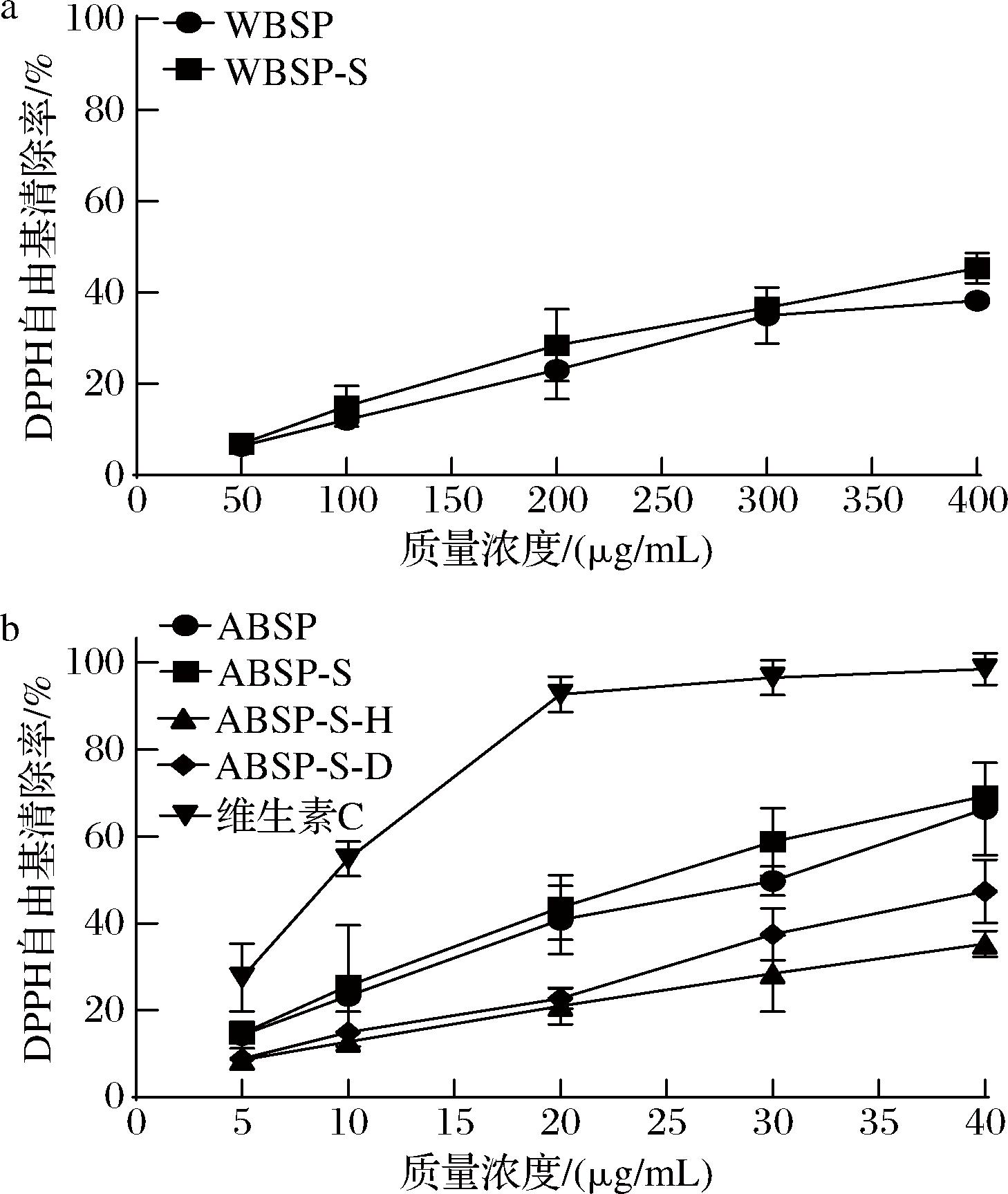
a-不同处理的WBSP的DPPH自由基清除率比较;b-不同处理的ABSP的DPPH自由基清除率比较
图7 不同处理后莼菜多糖的DPPH自由基清除率比较
Fig.7 Comparison of DPPH radical clearance rate of Brasenia schreberi polysaccharides after different treatments
2.5.2 ABTS阳离子自由基清除活性
从图8可以看出,莼菜多糖的ABTS阳离子自由基清除率随多糖质量浓度的增加而逐渐增大,且经Sevage处理后均略有增大,但WBSP的清除率仍然小于ABSP。WBSP-S对ABTS阳离子自由基的IC50为302.05 μg/mL,ABSP-S对ABTS阳离子自由基的IC50为9.63 μg/mL。且在ABSP的质量浓度为20 μg/mL时,其对ABTS阳离子自由基的清除率达到89.72%,与8 μg/mL的维生素C清除能力相当。可见ABSP-S对ABTS阳离子自由基有较强的清除能力。可能是由于ABSP不存在三螺旋结构,其活性基团易暴露在外,能提供更多的电子,表现出优异的自由基清除能力[38]。由图8-b可知,ABSP-S-H和ABSP-S-D的ABTS阳离子自由基清除率均有一定的下降,且ABSP-S-H的下降最显著,可能是因为H2O2在氧化色素的同时也氧化了部分多糖,使部分多糖失去活性。但ABSP-S-D在质量浓度为20 μg/mL时的ABTS阳离子自由基清除率仍达到63.49%,IC50为16.12 μg/mL,仍具有较好的抗氧化活性。
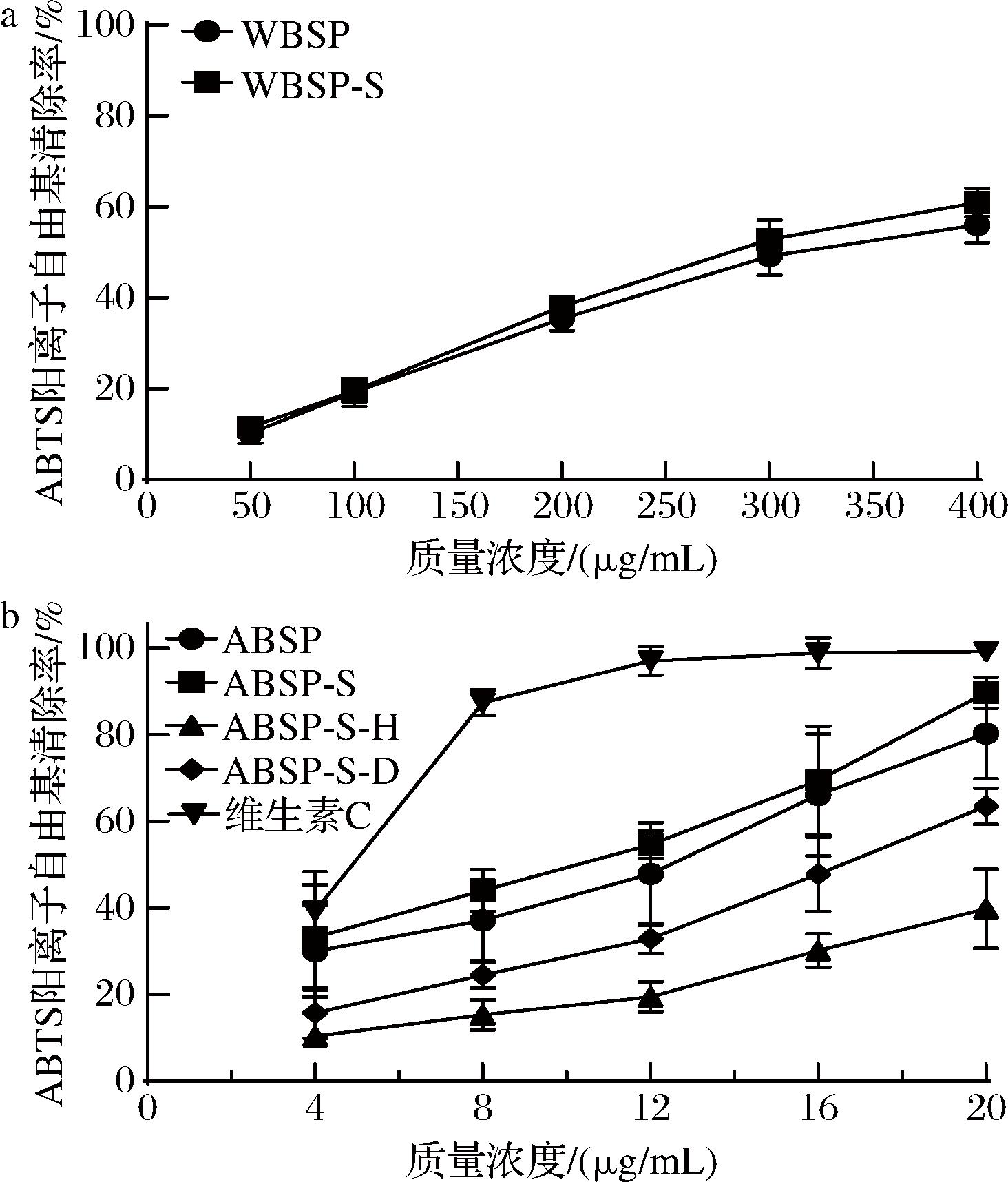
a-不同处理后WBSP的ABTS阳离子自由基清除率比较;b-不同处理后ABSP的ABTS阳离子自由基清除率比较
图8 不同处理后莼菜多糖的ABTS阳离子自由基清除率比较
Fig.8 Comparison of ABTS cationic radical clearance rate of Brasenia schreberi polysaccharides after different treatments
2.5.3 总还原能力
从图9可以看出,莼菜多糖的还原力随多糖浓度的增加,呈逐渐上升趋势,表明Fe3 +获得待测物质所提供的电子被还原为Fe2+,从而使反应体系的颜色发生改变,体系的吸光度增大[39]。经Sevage法脱蛋白处理后2种多糖的总还原力均略有增大,但WBSP的仍然小于ABSP。可能是由于ABSP的空间结构能使其活性基团更易暴露在外,提供更多的电子,因而有较强的还原力。由图9-b可知,ABSP-S-H和ABSP-S-D的总还原力均有一定程度的下降,且ABSP-S-H的下降最显著,这与上述自由基清除活性的变化趋势一致。
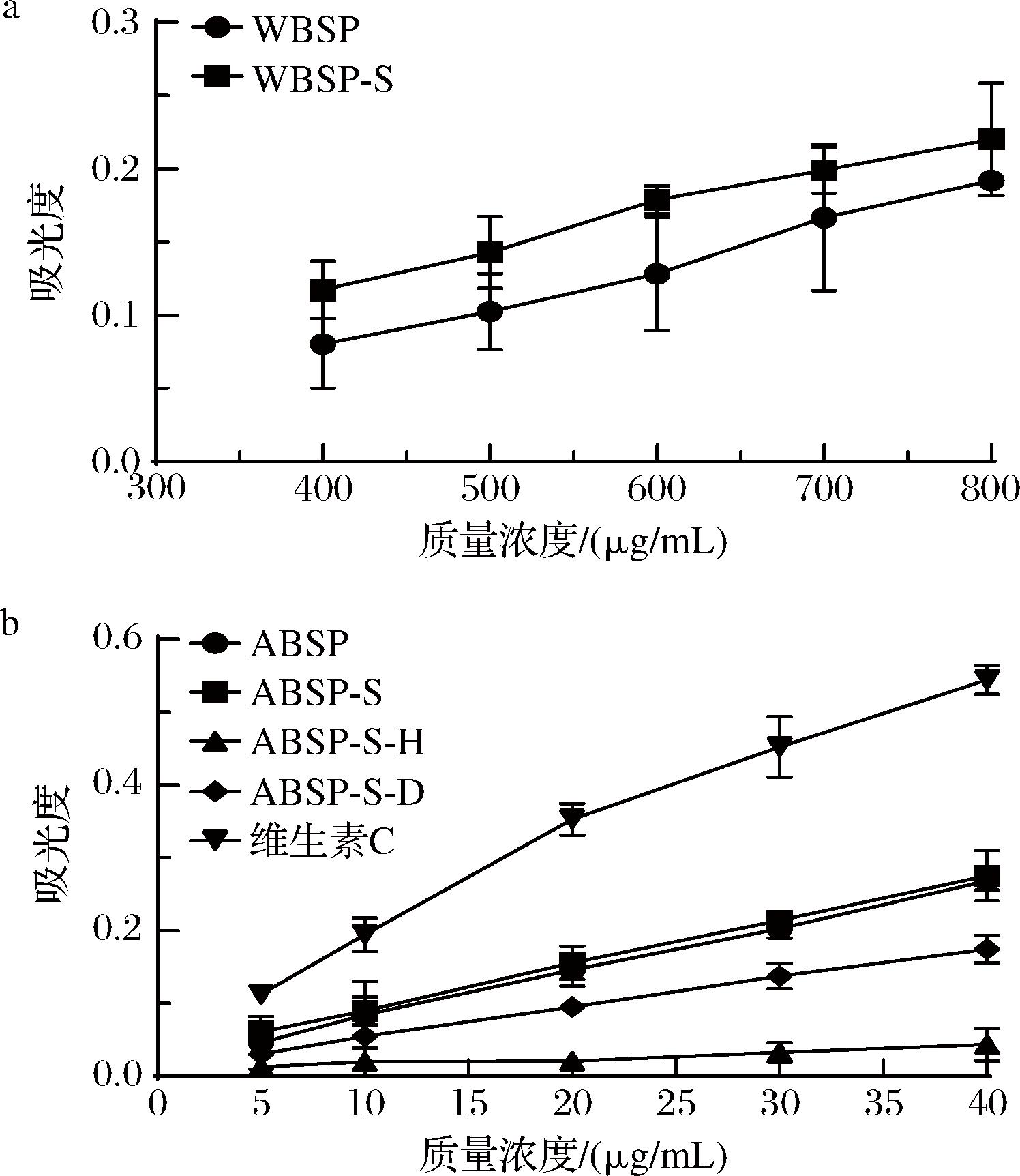
a-不同处理后WBSP的总还原力比较;b-不同处理后ABSP的总还原力比较
图9 不同处理后莼菜多糖的总还原力比较
Fig.9 Comparison of total reducing power of Brasenia schreberi polysaccharides after different treatments
2.5.4 总抗氧化能力
从图10可以看出,莼菜多糖的总抗氧化能力随多糖浓度的增加呈逐渐上升的趋势,且经Sevage法脱蛋白处理后的多糖均略有增大,整体上WBSP的总抗氧化能力仍然小于ABSP。由图10-b可知,ABSP-S-H和ABSP-S-D的总抗氧化能力均有一定的下降,且ABSP-S-H的下降最显著。可能是因为H2O2在氧化色素的同时也氧化了部分多糖,使这部分多糖失去活性,导致ABSP-S-H的总抗氧化能力降低。
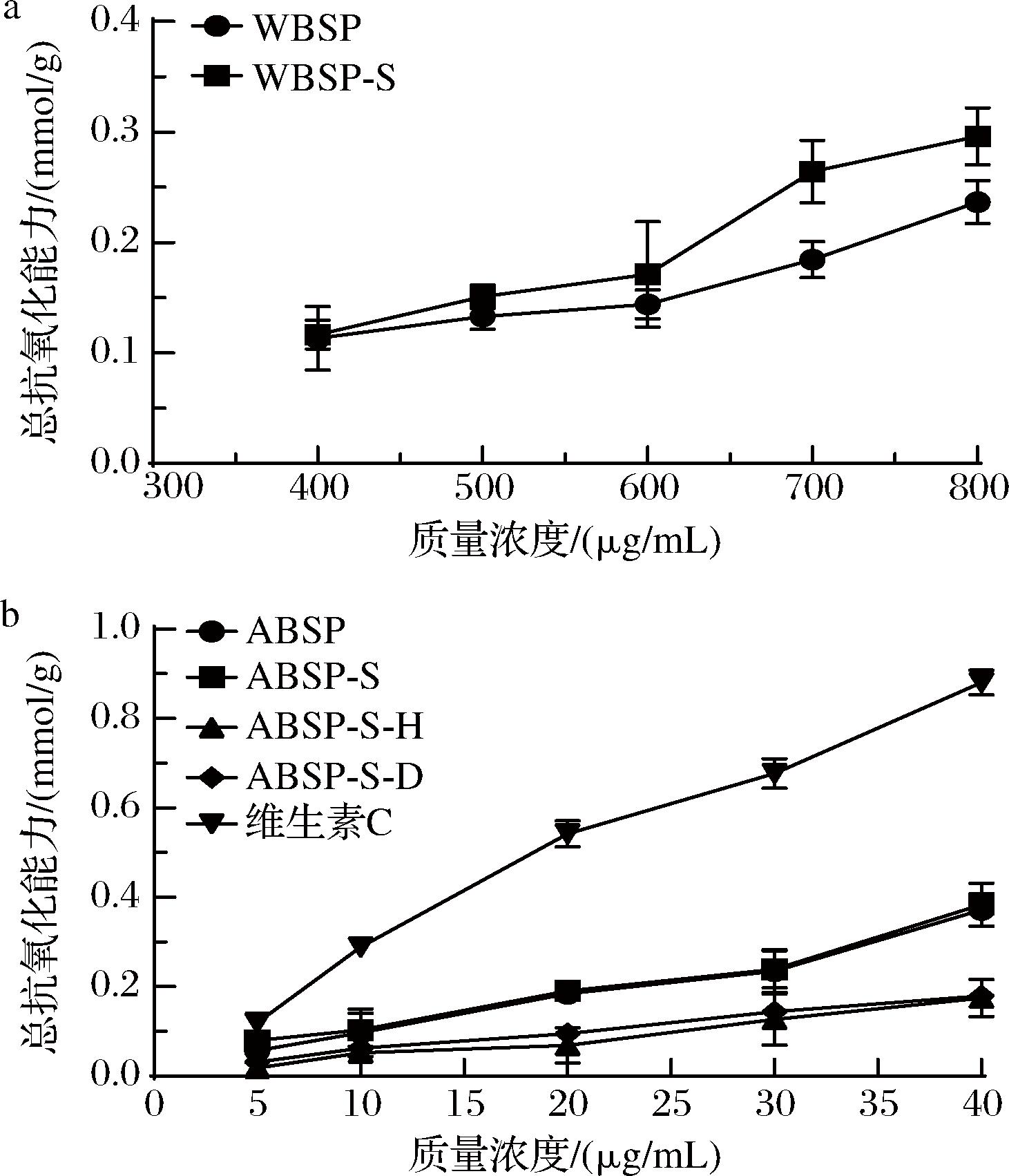
a-不同处理后WBSP的总抗氧化能力比较;b-不同处理后ABSP的总抗氧化能力比较
图10 不同处理后莼菜多糖的总抗氧化能力比较
Fig.10 Comparison of total antioxidant capacity of Brasenia schreberi polysaccharides after different treatments
3 结论
本研究以莼菜为原料采用热水法提取得到WBSP,然后利用碱法提取水提残渣获得ABSP,比较2种多糖脱蛋白前后及ABSP脱色前后的结构和抗氧化活性。2种提取方法所得的莼菜多糖在结构上存在一定差异,WBSP存在三螺旋结构;WBSP的结构呈纤维状,ABSP呈片状。脱蛋白及脱色处理对多糖红外结构的影响较小。总体上,ABSP的抗氧化活性优于WBSP,脱蛋白后抗氧化活性有所提升,但脱色处理后抗氧化活性有一定程度的降低。经Sevage法脱蛋白后的ABSP-S抗氧化能力最好,对DPPH自由基和ABTS阳离子自由基的清除率分别为69.30%(40 μg/mL)和89.72%(20 μg/mL),IC50分别为25.84、9.63 μg/mL。经大孔树脂脱色处理后ABSP-S-D的抗氧化活性仍保持得较好,对DPPH自由基和ABTS阳离子自由基的清除率分别为47.3%(40 μg/mL)和63.49%(20 μg/mL),IC50分别为42.35、16.12 μg/mL。本文主要分析了提取和初步纯化过中莼菜多糖的结构和抗氧化活性变化,后续需进一步探究多糖结构和体内抗氧化活性的构效关系,阐明其抗氧化活性机制。
[1] 陈顺清, 谢淋, 龙琼, 等.天然有机莼菜培育技术研究进展[J].贵州农机化, 2020 (1):18-22.CHEN S Q, XIE L, LONG Q, et al.Research progress on cultivation technology of natural organic Brasenia schreberi[J].Guizhou Agricultural Mechaniation, 2020 (1):18-22.
[2] YANG Y, LI J W, WANG N, et al.The complete chloroplast genome sequence of Brasenia schreberi (Cabombaceae)[J].Mitochondrial DNA Part B, 2019, 4(2):3842-3843.
[3] WAN J W, YU X J, LIU J, et al.A special polysaccharide hydrogel coated on Brasenia schreberi:Preventive effects against ulcerative colitis via modulation of gut microbiota[J].Food &Function, 2023, 14(8):3564-3575.
[4] VAHEKENI N, BRILLATZ T, RAHMATY M, et al.Antiprotozoal activity of plants used in the management of sleeping sickness in Angola and Bioactivity-guided fractionation of Brasenia schreberi J.F.Gmel and Nymphaea lotus L.active against T.b.rhodesiense[J].Molecules, 2024, 29(7):1611.
[5] FENG S M, LUAN D, NING K, et al.Ultrafiltration isolation, hypoglycemic activity analysis and structural characterization of polysaccharides from Brasenia schreberi[J].International Journal of Biological Macromolecules, 2019, 135:141-151.
[6] WANG Y J, ZOU Y, FANG Q, et al.Polysaccharides from Brasenia schreberi with great antioxidant ability and the potential application in yogurt[J].Molecules, 2023, 29(1):150.
[7] FENG S M, NING K, LUAN D, et al.Chemical composition and antioxidant capacities analysis of different parts of Brasenia schreberi[J].Journal of Food Processing and Preservation, 2019, 43(8):e14014.
[8] LEE M K, PARK H J, KWON S H, et al.Tellimoside, a flavonol glycoside from Brasenia schreberi, inhibits the growth of Cyanobacterium (Microcystis aeruginosa LB 2385)[J].Journal of the Korean Society for Applied Biological Chemistry, 2013, 56(1):117-121.
[9] HUANG Y Z, CHEN H, ZHANG K F, et al.Extraction, purification, structural characterization, and gut microbiota relationship of polysaccharides:A review[J].International Journal of Biological Macromolecules, 2022, 213:967-986.
[10] ULLAH S, KHALIL A A, SHAUKAT F, et al.Sources, extraction and biomedical properties of polysaccharides[J].Foods, 2019, 8(8):304.
[11] LIN X M, JI X L, WANG M, et al.An alkali-extracted polysaccharide from Zizyphus jujuba cv.Muzao:Structural characterizations and antioxidant activities[J].International Journal of Biological Macromolecules, 2019, 136:607-615.
[12] CHEN H, CHEN Z Y, FU Y F, et al.Structure, antioxidant, and hypoglycemic activities of arabinoxylans extracted by multiple methods from Triticale[J].Antioxidants, 2019, 8(12):584.
[13] HUANG G L, CHEN F, YANG W J, et al.Preparation, deproteinization and comparison of bioactive polysaccharides[J].Trends in Food Science &Technology, 2021, 109:564-568.
[14] MOHAMMED J K, ALI MAHDI A, AHMED M I, et al.Preparation, deproteinization, characterization, and antioxidant activity of polysaccharide from Medemia argun fruit[J].International Journal of Biological Macromolecules, 2020, 155:919-926.
[15] TAO L, ZHANG J W, LAN W F, et al.Polysaccharide decolorization:Methods, principles of action, structural and functional characterization, and limitations of current research[J].Trends in Food Science &Technology, 2023, 138:284-296.
[16] 张琨霖, 王贺琪, 郭庆彬, 等.桑黄子实体多糖的提取工艺优化、结构解析及免疫活性分析[J].食品工业科技, 2023, 44(20):93-100.ZHANG K L, WANG H Q, GUO Q B, et al.Optimization of extraction process, structure analysis and immunological properties of polysaccharides from the fruiting body of Phellinus igniarius[J].Science and Technology of Food Industry, 2023, 44(20):93-100.
[17] HADIDI M, AMOLI P I, JELYANI A Z, et al.Polysaccharides from pineapple core as a canning by-product:Extraction optimization, chemical structure, antioxidant and functional properties[J].International Journal of Biological Macromolecules, 2020, 163:2357-2364.
[18] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[19] WU X Y, LI R C, ZHAO Y J, et al.Separation of polysaccharides from Spirulina platensis by HSCCC with ethanol-ammonium sulfate ATPS and their antioxidant activities[J].Carbohydrate Polymers, 2017, 173:465-472.
[20] ZENG X T, LI P Y, CHEN X, et al.Effects of deproteinization methods on primary structure and antioxidant activity of Ganoderma lucidum polysaccharides[J].International Journal of Biological Macromolecules, 2019, 126:867-876.
[21] LIU Y, HUANG G L, HU J C.Extraction, characterisation and antioxidant activity of polysaccharides from Chinese watermelon[J].International Journal of Biological Macromolecules, 2018, 111:1304-1307.
[22] 金路, 严鹏, 李红玉.栉孔扇贝多糖的提取及脱色[J].食品与发酵工业, 2015, 41(2):233-236.JIN L, YAN P, LI H Y.The optimization of polysaccharide extraction process from Chlamys farreri and its decolorization[J].Food and Fermentation Industries, 2015, 41(2):233-236.
[23] HU Z Y, YU R Y, SUN J F, et al.Static decolorization of polysaccharides from the leaves of Rhododendron dauricum:Process optimization, characterization and antioxidant activities[J].Process Biochemistry, 2022, 121:113-125.
[24] 李瑶, 熊彩明, 张佳乐, 等.磷酸化裙带菜多糖的制备及结构表征和生物活性分析[J].食品科学, 2024, 45(7):35-42.LI Y, XIONG C M, ZHANG J L, et al.Preparation, structural characterization and biological activity of phosphorylated polysaccharide from Undaria pinnatifida suringar[J].Food Science, 2024, 45(7):35-42.
[25] 汪涛, 周新群, 孙君社, 等.低共熔溶剂提取黄精多糖工艺优化及抗氧化活性研究[J].食品科学技术学报, 2020, 38(6):111-120.WANG T, ZHOU X Q, SUN J S, et al.Study on optimal process and antioxidant activity of Polygonatum sibiricum polysaccharides extracted by deep eutectic solvents[J].Journal of Food Science and Technology, 2020, 38(6):111-120.
[26] 周元龙, 宋年年, 易宇欣, 等.不同提取方法对罗布麻多糖理化性质及抗氧化活性的影响[J].食品工业科技, 2024, 45(19):40-48.ZHOU Y L, SONG N N, YI Y X, et al.Effects of different extraction methods on physicochemical properties and antioxidant activity of Apocynum venetum polysaccharides[J].Science and Technology of Food Industry, 2024, 45(19):40-48.
[27] 师仁丽, 刘欣宜, 张彩玉, 等.金丝小枣全枣、枣皮、枣肉黄酮提取物的抗氧化活性和免疫活性[J].食品研究与开发, 2024, 45(7):103-108.SHI R L, LIU X Y, ZHANG C Y, et al.Antioxidant and immune activity of total flavonoids extracts from the whole, skin and flesh of Ziziphus jujuba[J].Food Research and Development, 2024, 45(7):103-108.
[28] 周鸿立, 杨晓虹.玉米须多糖中蛋白质脱除的Sevag与酶法联用工艺优化[J].食品科学, 2011, 32(8):129-132.ZHOU H L, YANG X H.Removal of proteins from corn silk polysaccharide by a combined enzymatic-sevag method[J].Food Science, 2011, 32(8):129-132.
[29] CHEN L, HUANG G L, HU J C.Preparation, deproteinization, characterisation, and antioxidant activity of polysaccharide from cu-cumber (Cucumis saticus L.)[J].International Journal of Biological Macromolecules, 2018, 108:408-411.
[30] 秦宇, 华宗, 张敏, 等.响应面法优化日本蛇菰多糖脱色、脱蛋白工艺[J].食品工业科技, 2023, 44(10):177-184.QIN Y, HUA Z, ZHANG M, et al.Optimization of decolorization and deproteinization of Balanophora japonica makino polysaccharide by response surface methodology[J].Science and Technology of Food Industry, 2023, 44(10):177-184.
[31] 冉靓, 张桂玲, 李素莲,等.黔产多汁乳菇多糖脱色工艺及抗氧化活性研究[J].食品工业, 2019, 40(1):108-111.RAN L.ZHANG G L, LI S L, et al.Decolorization process and antioxidant activity of polysaccharide from Lactarius volemus in Guizhou[J].The Food Industry, 2019, 40(1):108-111.
[32] HU H B, LIANG H P, WU Y.Isolation, purification and structural characterization of polysaccharide from Acanthopanax brachypus[J].Carbohydrate Polymers, 2015, 127:94-100.
[33] ZHANG X, CAI Z Y, MAO H Y, et al.Isolation and structure elucidation of polysaccharides from fruiting bodies of mushroom Coriolus versicolor and evaluation of their immunomodulatory effects[J].International Journal of Biological Macromolecules, 2021, 166:1387-1395.
[34] 常相娜, 陈雪峰, 龚频, 等.融水香菇多糖结构表征及体外抗氧化、降糖活性[J].中国食品添加剂, 2022, 33(4):1-9.CHANG X N, CHEN X F, GONG P, et al.Structural characterization, in vitro anti-oxidative effect and hypoglycemic activity of lentinan from Rongshui county[J].China Food Additives, 2022, 33(4):1-9.
[35] 薛紫曦, 王胜男, 杨慧, 等.大豆种皮多糖对蛋白乳液凝胶特性及微观结构的影响[J].食品科学技术学报, 2024, 42(4):164-172.XUE Z X, WANG S N, YANG H, et al.Effect of soybean hull polysaccharide on properties and microstructure of protein emulsion gel[J].Journal of Food Science and Technology, 2024, 42(4):164-172.
[36] 王文韬.绿豆多糖分离纯化、结构表征、功能特性及体外抗氧化活性研究[D].保定:河北农业大学, 2022.WANG W T.Isolation, purification, structure characterization, functional characteristics and in vitro antioxidant activity of polysaccharides from mung bean[D].Baoding:Hebei Agricultural University, 2022.
[37] 任恒.地黄多糖脱色工艺及其生物活性研究[D].郑州:河南工业大学, 2023.REN H.Study on decolorization process and biological activity of Rehmannia glutinosa polysaccharide[D].Zhengzhou:Henan University of Technology, 2023.
[38] LIU Y, HU C F, FENG X, et al.Isolation, characterization and antioxidant of polysaccharides from Stropharia rugosoannulata[J].International Journal of Biological Macromolecules, 2020, 155:883-889.
[39] YUAN Q X, XIE Y F, WANG W, et al.Extraction optimization, characterization and antioxidant activity in vitro of polysaccharides from mulberry (Morus alba L.) leaves[J].Carbohydrate Polymers, 2015, 128:52-62.