溃疡性结肠炎(ulcerative colitis, UC)是一种慢性炎症性疾病,主要影响人类的结肠和直肠,同时也对动物的肠道健康造成影响,其症状包括体重减轻、便血、腹泻、食欲不振等,严重者因脱水而死亡[1-2]。UC的发病机制尚未完全阐明,涉及环境、遗传、免疫系统和肠道菌群之间的复杂作用[3]。饮食是导致UC发作的环境因素之一,它可通过直接作用于宿主或通过调节肠道菌群的组成或功能间接作用于UC的发病或病程[4]。有研究表明饮食引起的微生物群变化可能会将健康的肠道微生物群转变为一种疾病诱因,从而引发或维持炎症性肠病患者的炎症[5]。饮食疗法是近年来兴起的干预措施之一,与药物治疗相比,饮食疗法的疗效显著且副作用小。
麸皮是谷物加工过程中的副产物,富含膳食纤维、维生素、矿物质、酚类等物质,但其在实际应用方面具有高不溶性膳食纤维、口感差等局限性[6]。利用微生物发酵技术对麸皮进行处理,可提高其整体利用率。研究表明,膳食补充发酵麸皮(fermented wheat bran,FWB)可以有效改善肠道微生态环境,促进营养物质的吸收与代谢,增强机体免疫力[7-8]。LIN等[9]发现发酵麸皮通过提高乳酸菌的相对丰度、增加乳酸浓度、降低肠道pH来改善动物的肠道健康。同时,发酵麸皮对UC具有保护作用。WANG等[10]发现发酵麸皮膳食纤维改善了葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎症状,上调了有益细菌的丰度,提高了乙酸、丙酸和丁酸的水平,并恢复了DSS诱导的小鼠肠道菌群失调。AGISTA等[11]研究表明补充发酵麸皮后小鼠肠道中的短链脂肪酸水平增加,并且发酵后的麸皮中具有抗氧化和抗炎作用的化合物(麦角硫因、精氨酸、支链氨基酸和腺苷)的含量增加,增加的短链脂肪酸水平和多种生物活性化合物含量可能有助于发酵麸皮缓解结肠炎。
本研究利用微生物发酵技术提高麸皮的整体利用率,将普通饲料中的麸皮替换为发酵麸皮,研究发酵麸皮对DSS诱导小鼠UC的保护作用,从肠道菌群角度分析可能的机制,旨在为发酵麸皮在实际应用中提供更多的理论依据。
1 材料与方法
1.1 材料与试剂
DSS,MP biomedical公司;4%(质量分数)多聚甲醛固定液,武汉塞维尔生物科技有限公司;肝素钠采血管,河北鑫乐医疗器械科技股份有限公司;Mouse 白细胞介素(interleukin,IL)-1β ELISA试剂盒、Mouse IL-6 ELISA试剂盒、Mouse 肿瘤坏死因子(tumor necrosis factor,TNF) ELISA试剂盒、Mouse IL-10 ELISA试剂盒,北京四正柏生物科技有限公司。
1.2 主要仪器与设备
METTLER XS204电子天平,Mettler Toledo公司;EPPENDORF 5424台式离心机,Eppendorf AG公司;Multiskan MK3酶标仪,Thermo Fisher Scientific 公司。
1.3 实验动物与菌株
实验动物:SPF级雌性BALB/c小鼠,12周龄,斯贝福(北京)生物技术有限公司,生产许可证(SCXK(京)2019-0010)。小鼠饲养在24~26 ℃,湿度50%~60%,12/12 h光/暗循环的环境中。本实验的所有程序均由国家粮食和物资储备局科学研究院实验动物福利伦理审查委员会(ASAG202307-01)审批。
实验菌剂:酿酒酵母菌剂(≥109 CFU/g)、鼠李糖乳杆菌菌剂(≥1010 CFU/g),本实验室保存。
1.4 实验方法
1.4.1 发酵麸皮饲料的制备
发酵麸皮的制备:无菌麸皮(121 ℃、30 min高压灭菌)、水(40%质量分数)、酿酒酵母菌剂(1 g/kg)、鼠李糖乳杆菌菌剂(0.5 g/kg)混合均匀后置于30 ℃培养箱中发酵60 h。
CON定制饲料购于斯贝福(北京)生物技术有限公司。
CON+FWB定制饲料:将CON定制饲料中的麸皮替换为发酵麸皮。
1.4.2 动物分组及模型的构建
小鼠适应性喂养7 d后,随机分为4组(n=5):CON组、DSS组、FWB组和DSS+FWB组。动物实验设计如图1所示,CON组自由饮用无菌水、全程饲喂CON定制饲料,DSS组在饮用水中添加3%(质量分数)DSS[10]、全程饲喂CON定制饲料,FWB组自由饮用无菌水、全程饲喂CON+FWB定制饲料,DSS+FWB组在饮用水中添加3%DSS、全程饲喂CON+FWB定制饲料。饲喂14 d结束后,对小鼠进行疾病活动指数(disease activity index,DAI)评分,3项指标评分的平均数即为小鼠的DAI评分,评分标准如表1所示[12];并取小鼠粪便、眼球血、结肠组织用于后续相关指标检测。
表1 DAI评分标准
Table 1 DAI scoring standards

评分体重下降率/%粪便形态便血0无正常无11%~5%松软但成型-25%~10%松散肉眼可见血迹310%~20%水样便大量便血4>20%严重腹泻肛门处严重出血
注:-表示介于两者之间。
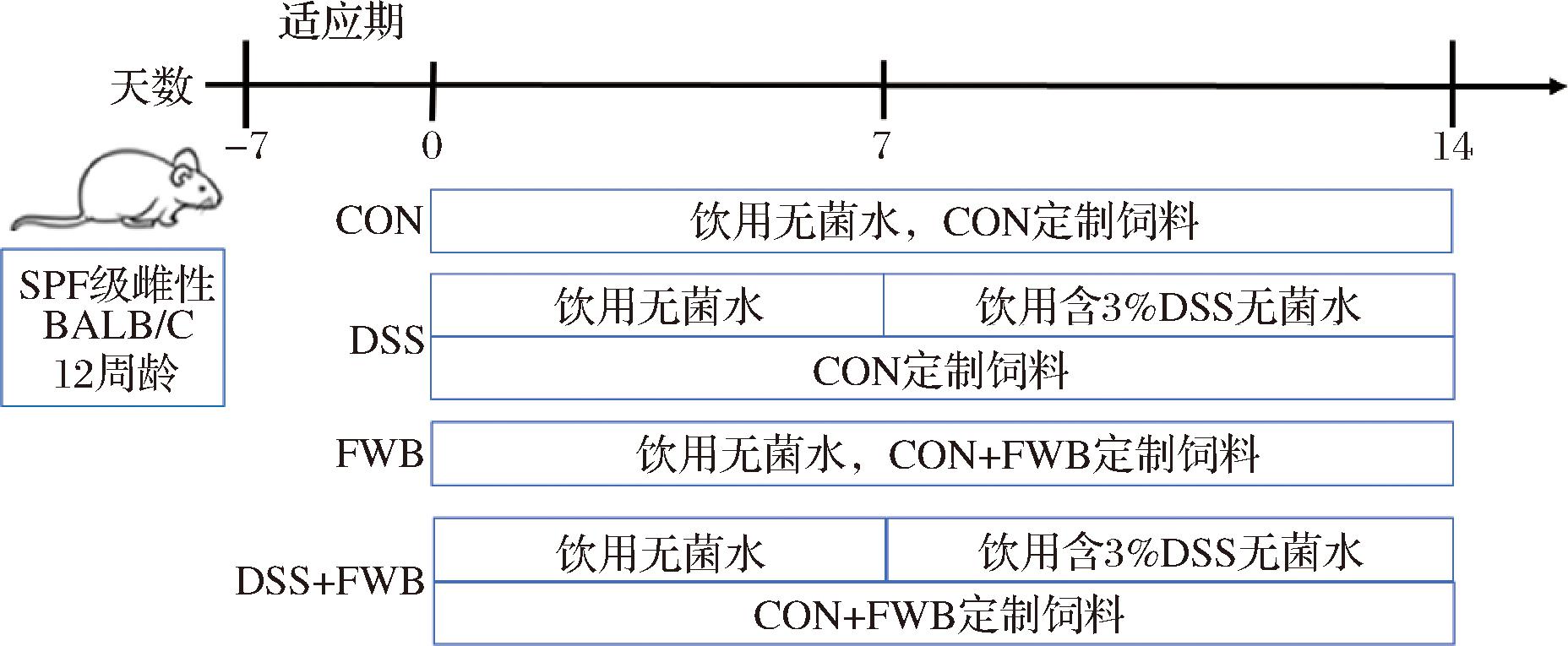
图1 动物实验方案
Fig.1 Animal experimental design
1.4.3 生长性能测定
在实验开始和结束时对实验小鼠进行称重,实验开始时体重记为初始体重(initial body weight,IBW),实验结束时体重记为终末体重(final body weight,FBW),计算平均日增重(average daily gain,ADG)和平均日采食量(average daily feed intake,ADFI)。
1.4.4 结肠组织病理学观察
取小鼠结肠组织固定于4%(质量分数)多聚甲醛固定液中,送武汉塞维尔生物科技有限公司进行后续的包埋、苏木精伊红(hematoxylin and eosin,H&E)染色[13]。
1.4.5 血浆指标检测
在实验结束时,采集小鼠眼球处血液于含抗凝剂的采血管中,4 ℃、4 000 r/min离心10 min后取上清液,根据ELISA试剂盒说明书测定小鼠血浆中炎症因子IL-1β、IL-6、TNF-α、IL-10的含量,于反应终止后立即在酶标仪450 nm波长下测定各孔的吸光度[14]。
1.4.6 粪便肠道菌群的分析
小鼠粪便由上海美吉生物医药科技公司采用高通量测序技术对粪便微生物16S rRNA基因测序。使用DNA提取试剂盒提取粪便总DNA,利用1%(质量分数)琼脂糖凝胶电泳检测所抽提的DNA浓度和纯度;使用上游引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和下游引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对V3~V4区域进行PCR扩增,扩增程序为95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共27个循环,72 ℃延伸10 min,4 ℃保存,2%(质量分数)琼脂糖凝胶电泳检测PCR产物,用AxyPrep DNA凝胶回收试剂盒(axygen Bioscience)切胶回收PCR产物,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(promega公司)进行检测定量。使用Illumina公司的TruSeqTM DNA Sample Prep Kit DNA文库构建试剂盒进行DNA文库构建,最后使用Illumina-MiSeq平台测序,所得数据在美吉云平台(https://cloud.majorbio.com/)上进行数据处理与分析。
1.5 数据统计学分析
实验数据用“平均值±标准差”表示。数据经Excel初步整理后,采用SPSS软件(版本26.0)进行统计分析,单因素方差分析(ANOVA)进行统计学检验,GraphPad Prism 9.0作图。
2 结果与分析
2.1 发酵麸皮对溃疡性结肠炎小鼠生长性能的影响
由表2可知,各组小鼠的初始体重差异不显著(P>0.05),符合实验要求。实验结束时,与CON组相比,DSS组小鼠体重(P<0.01)和平均日增重(P<0.01)明显减轻;与DSS组相比,DSS+FWB组小鼠体重(P<0.05)和平均日增重(P<0.01)显著增加。由此可见,饲料中添加发酵麸皮增加了小鼠的终末体重和平均日增重,有效地缓解了由UC引起的体重下降。
表2 发酵麸皮对溃疡性结肠炎小鼠生长性能的影响(n=5)
Table 2 Effect of fermented wheat bran on growth performance of mice with ulcerative colitis (n=5)
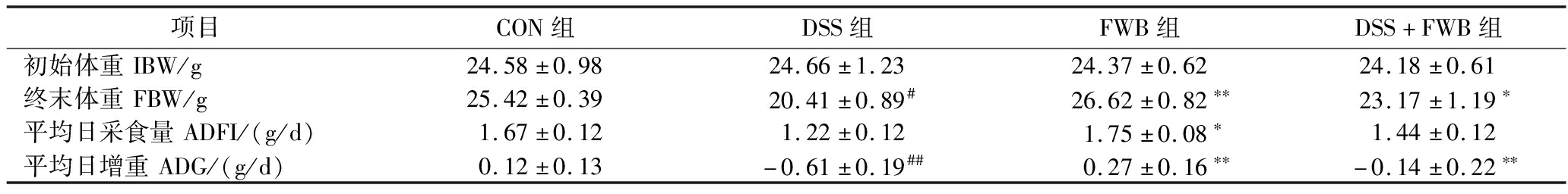
项目CON组DSS组FWB组DSS+FWB组初始体重IBW/g24.58±0.9824.66±1.2324.37±0.6224.18±0.61终末体重FBW/g25.42±0.3920.41±0.89#26.62±0.82∗∗23.17±1.19∗平均日采食量ADFI/(g/d)1.67±0.121.22±0.121.75±0.08∗1.44±0.12平均日增重ADG/(g/d)0.12±0.13-0.61±0.19##0.27±0.16∗∗-0.14±0.22∗∗
注:与CON组相比#P<0.05,## P<0.01;与DSS组相比*P<0.05,** P<0.01。
2.2 发酵麸皮对溃疡性结肠炎小鼠DAI评分和结肠的影响
UC小鼠会造成结肠长度缩短、便血、结肠组织病变等影响。由图2-a可知,DSS组的DAI评分显著高于CON组(P<0.01),表明UC模型建立成功;DSS+FWB组的DAI评分显著低于DSS组(P<0.01),说明发酵麸皮可以减轻UC的疾病症状。图2-b~图2-c所示,CON组和DSS组小鼠的结肠长度存在明显差异(P<0.01);与DSS组相比,DSS+FWB组的结肠长度明显增加(P<0.01)。结果表明,发酵麸皮能够改善UC小鼠结肠长度缩短的现象。
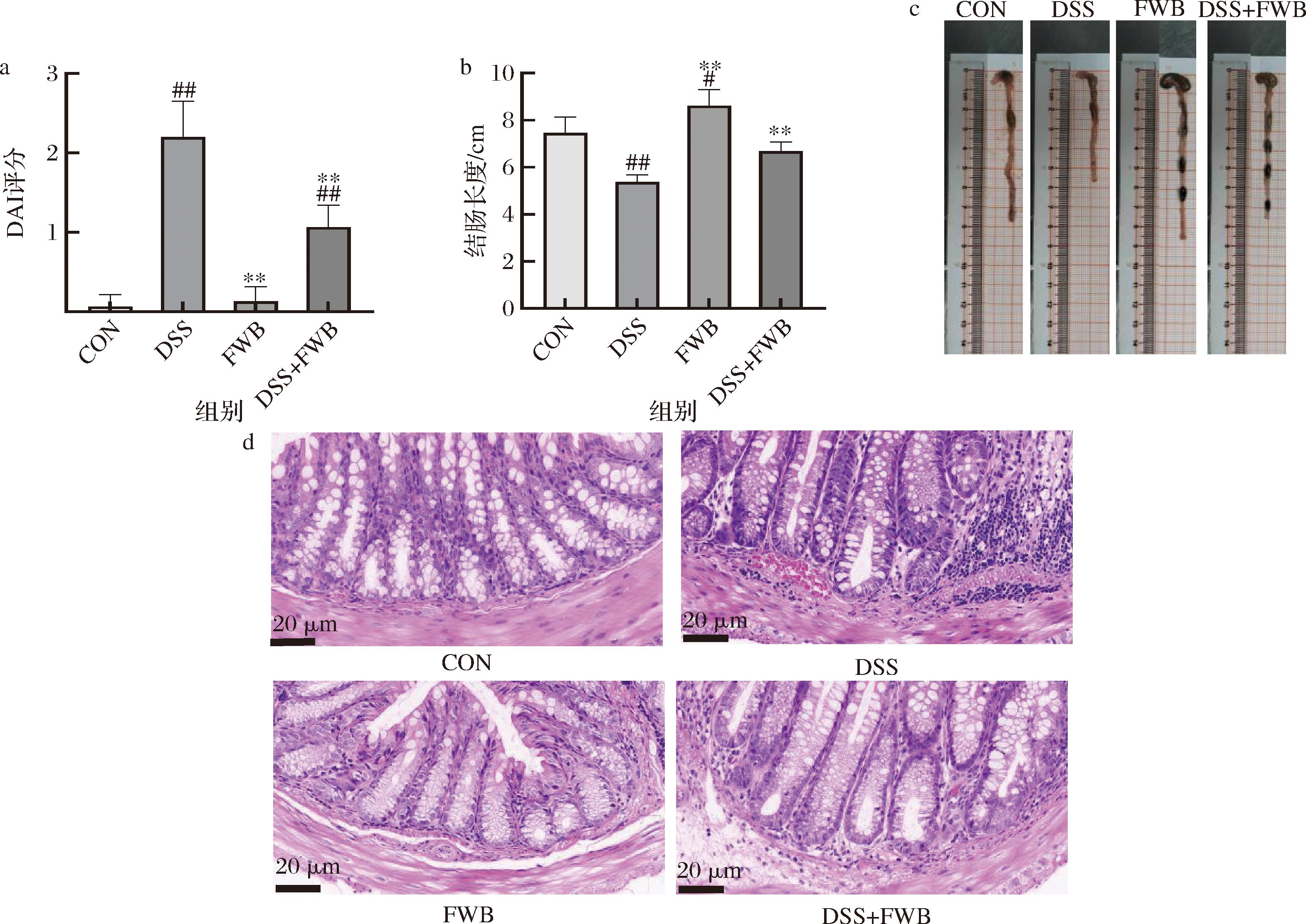
a-DAI评分(n=5);b-发酵麸皮对溃疡性结肠炎小鼠结肠长度的影响(n=5);c-结肠图片;d-FWB对UC小鼠结肠病理损伤的影响
图2 发酵麸皮对溃疡性结肠炎小鼠DAI评分和结肠的影响
Fig.2 Effects of fermented wheat bran on DAI score and colon in mice with ulcerative colitis
注:与CON组相比#P<0.05,## P<0.01;与DSS组相比*P<0.05,** P<0.01(下同)。
为了进一步评估发酵麸皮对结肠的影响,采用H&E染色对小鼠的结肠组织结构进行观察,结果如图1-b所示,CON组小鼠结肠组织形态良好,隐窝结构完整,含有大量的杯状细胞且排列完整,无炎症细胞浸润,而DSS组隐窝结构被破坏,杯状细胞数量明显减少,炎症细胞出现浸润现象,DSS+FWB组与DSS组相比,可见隐窝结构,杯状细胞数量恢复,炎症细胞浸润现象减少。以上结果说明,发酵麸皮可以减轻UC小鼠的结肠组织损伤。
2.3 发酵麸皮对溃疡性结肠炎小鼠炎症因子的影响
为了观察发酵麸皮对机体炎症反应的影响,检测了各组小鼠中血浆IL-1β、IL-6、TNF-α和IL-10的含量,结果如图3所示。经DSS诱导后,小鼠血浆IL-1β、TNF-α含量显著上升(P<0.01),而饲喂发酵麸皮的小鼠血浆IL-1β、TNF-α含量与DSS组相比,均有一定程度的下降且差异显著(P<0.01),而各组之间IL-10的含量均没有显著性差异(P>0.05)。结果表明,发酵麸皮对小鼠血浆促炎因子IL-1β、TNF-α的含量有显著的降低作用,对抗炎因子IL-10的含量没有显著作用。因此,发酵麸皮可以通过降低促炎因子的水平缓解UC。
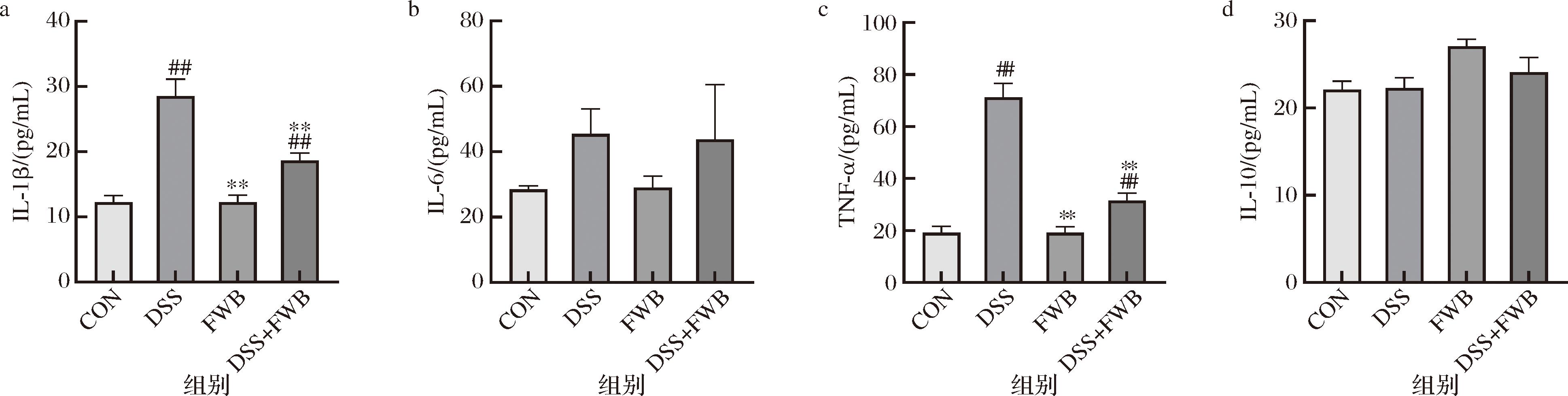
a-IL-1β;b-IL-6;c-TNF-α;d-IL-10
图3 发酵麸皮对溃疡性结肠炎小鼠血浆炎症因子的影响(n=3)
Fig.3 Effects of fermented wheat bran on plasma inflammatory factors in mice with ulcerative colitis (n=3)
2.4 发酵麸皮对溃疡性结肠炎小鼠肠道菌群的影响
从4组小鼠粪便样本中各随机选择5个进行了16S rRNA高通量测序分析,分析了4组小鼠肠道菌群的组成及改变来探索发酵麸皮发挥保护UC作用的可能机制。
2.4.1 肠道菌群多样性分析
Ace和Chao1指数能够反映微生物群落的丰富度,Shannon和Simpson指数反映微生物群落的多样性。如图4所示,与CON组相比,DSS组的Ace、Chao1和Shannon指数均显著降低(P<0.05),Simpson指数显著增加(P<0.05)。DSS+FWB组的Ace、Chao1和Shannon指数较DSS组有所升高,Simpson指数较DSS组有所降低,但均无显著性差异(P>0.05)。结果表明,发酵麸皮在一定程度上可以改善UC小鼠肠道菌群的多样性。主坐标分析(principal co-ordinates analysis,PCoA)如图4-e所示,DSS造模后小鼠肠道菌群群落构成与CON组形成明显差异,DSS组与DSS+FWB组的肠道微生物群落有分离但不明显,说明发酵麸皮在一定程度上调节了小鼠肠道菌群的群落组成。韦恩图(图4-f)显示4组共有的分类操作单元(operation taxonomic units,OTU)数目是189,CON组与DSS组共有的OTU数目为8,CON组与FWB组共有的OTU数目为324,DSS组与DSS+FWB组共有的OTU数目为46。
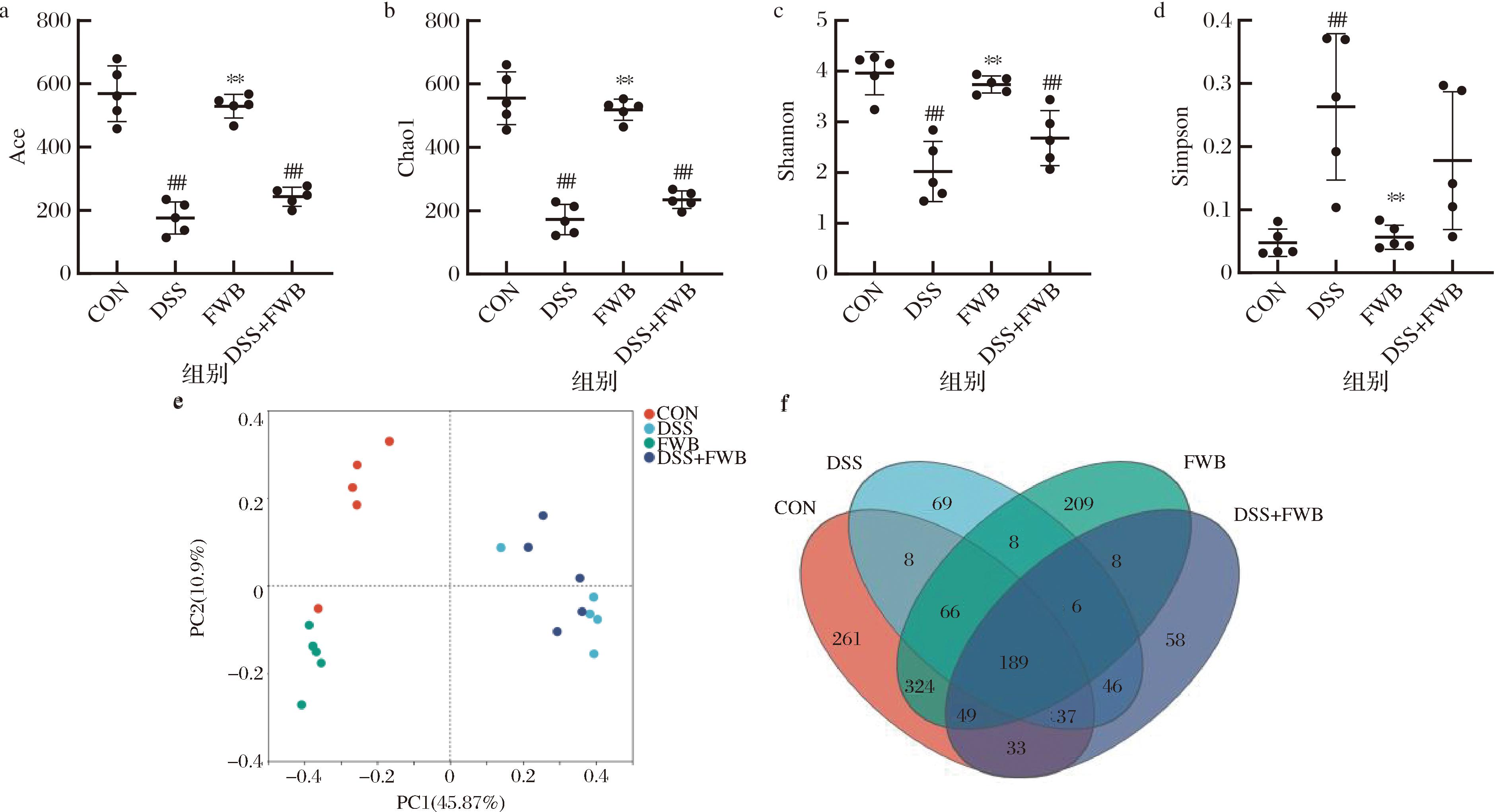
a-Ace;b-Chao1;c-Shannon;d-Simpson;e-主坐标分析;f-韦恩图
图4 发酵麸皮对溃疡性结肠炎小鼠肠道菌群α多样性和β多样性的影响(n=5)
Fig.4 Effects of fermented wheat bran on α diversity and β diversity of gut microbiota in mice with ulcerative colitis (n=5)
2.4.2 肠道菌群的组成
各组肠道微生物在门和属水平上的相对丰度如图5-a、图5-b所示。在门水平上,与CON组相比,DSS组小鼠的脱硫杆菌门(Desulfobacterota)和变形菌门(Proteobacteria)相对丰度增加,拟杆菌门(Bacteroidota)相对丰度降低。与DSS组相比,DSS+FWB组小鼠的Desulfobacterota和Proteobacteria相对丰度降低,Bacteroidota相对丰度增加。在属水平上,与CON组相比,DSS组小鼠的肠道菌群中norank_f__Desulfovibrionaceae和埃希氏-志贺氏菌属(Escherichia-Shigella)的相对丰度增加,norank_f__Muribaculaceae的相对丰度降低。与DSS组相比,DSS+FWB组小鼠的肠道菌群中的norank_f__Muribaculaceae和拟杆菌属(Bacteroides)相对丰度增加,norank_f__Desulfovibrionaceae和Escherichia-Shigella的相对丰度降低。

a-门水平微生物群落柱状图;b-属水平微生物群落柱状图;c-肠道优势微生物在属水平上的分布直方图;d-微生物群与炎症细胞因子之间的相关矩阵
图5 发酵麸皮对溃疡性结肠炎小鼠肠道微生物组成的影响(n=5)
Fig.5 Effects of fermented wheat bran on intestinal microbial composition in mice with ulcerative colitis(n=5)
注:***表示P<0.001。
采用线性判别分析(linear discriminant analysis effect size, LEfSe)进一步确定各组小鼠肠道中具有显著性差异的菌群,如图5-c所示。CON组中有28种优势微生物,FWB组有26种,DSS组和DSS+FWB组分别有24种和15种优势微生物。然后在属水平上分析了肠道菌群与炎症因子(IL-1β、IL-6、TNF-α、IL-10)的相关性。结果如图5-d所示,Escherichia-Shigella、norank_f__Desulfovibrionaceae、罗姆布茨菌属(Romboutsia)、苏黎世杆菌属(Turicibacter)与炎症细胞因子呈正相关,norank_f__Muribaculaceae、Candidatus_Saccharimonas与炎症细胞因子呈负相关。以上结果表明,发酵麸皮通过增加肠道内有益细菌和减少有害细菌来缓解DSS诱导的UC,这可能与其发挥保护UC作用有关。
3 结论与讨论
近年来,饮食在治疗和预防UC方面起着越来越重要的作用,饮食可以作为治疗UC的重要辅助方法。谷物是人们日常饮食中的重要组成部分,有研究证实摄入谷物与降低某些疾病的风险有关,例如UC和结肠癌[15]。麸皮作为小麦加工过程中产生的副产物,对治疗UC有积极的作用。因此,研究发酵麸皮对UC的保护作用,对于UC的预防治疗和饮食管理有重要意义。
本研究采用3%(质量分数)DSS诱导建立UC小鼠模型,DSS组中的小鼠体重下降、便血明显、结肠明显缩短、结肠组织H&E染色结果显示杯状细胞数量减少、有炎症细胞浸润,表明造模成功。在饮食中添加发酵麸皮,可以有效缓解UC的症状。
炎症细胞因子(IL-1β、IL-6、TNF-α、IL-10等)在结肠炎发病机制中起着重要的作用,它们是由免疫细胞在对肠腔内容物的响应中产生的,当这些物质穿透受损的肠道屏障时,可以激活免疫细胞(如巨噬细胞和树突细胞),导致炎性细胞因子的释放[16-17]。为了观察发酵麸皮对机体炎症反应的影响,本研究测定各组小鼠血浆IL-1β、IL-6、TNF-α、IL-10的含量。IL-1β主要由单核细胞和巨噬细胞产生,具有促进炎症的作用,并通过促进其他炎症介质的释放来放大炎症过程[18]。它还能通过激活信号通路和转录因子,导致肌球蛋白轻链激酶基因激活和microRNA的转录后调节,从而增加肠道紧密连接的通透性[19]。ISLAM等[20]研究表明IL-1β诱导的肠道紧密连接通透性增加是肠道炎症的重要促成因素,而膳食补充发酵米糠显著增强了紧密连接蛋白(TJ蛋白)基因的表达,发酵米糠保护上皮TJ屏障的完整性涉及抑制促炎细胞因子的激活。TNF-α是一种主要由活化的巨噬细胞和T细胞产生的炎症细胞因子,能够促进炎症细胞的聚集、活化和增值,从而加剧UC[21]。FAGHFOORI等[22]发现通过增加肠道中短链脂肪酸(如丁酸)的产生,直接抑制TNF-α的产生和/或释放,从而有助于增加肠道的抗炎活性。IL-10是一种具有免疫抑制和免疫刺激双重作用的抗炎细胞因子,还能抑制炎症细胞因子的合成与释放,如IL-1、IL-6、TNF-α[23]。有研究表明,IL-10的水平在不同患者之间存在差异,中重度临床疾病患者会表现出更高的IL-10水平[24-25]。CHANG等[26]研究表明,在UC小鼠中脆弱拟杆菌能增强IL-10的表达,并抑制了TNF-α和IL-6的表达。由此推测DSS给药后不影响IL-10的水平与小鼠之间的个体差异、患病程度等因素有关。本研究发现,发酵麸皮可能增加肠道中短链脂肪酸的含量、增强紧密连接蛋白的表达,降低促炎因子IL-1β和TNF-α的水平来缓解机体的炎症反应。
UC会造成肠道微生物的紊乱[27]。肠道微生物可能通过黏附和入侵进入肠道黏膜屏障,激活肠道上皮细胞和免疫细胞,产生促炎因子从而导致组织炎症和损伤,诱发炎性肠病[28]。例如,某些肠道微生物产生的代谢产物或病原体相关分子模式可以激活肠道内的免疫细胞,如树突状细胞和巨噬细胞,这些细胞在受到刺激后可以分泌包括IL-1β在内的多种炎症因子[29]。因此可以通过失调菌群的恢复来改善肠道稳态失衡,从而抑制肠道的炎症反应[30]。发酵麸皮富含多种物质,有着益生元特性,有助于增加肠道有益菌的数量和多样性,从而改善肠道健康。本研究发现,发酵麸皮在一定程度上可以改善UC小鼠肠道菌群的多样性。有研究表明UC患者肠道菌群的丰富度和多样性明显低于健康对照组,多样性的降低可能与结肠炎的严重程度有关,与本研究结果一致[31]。既往研究认为在UC患者中可以观察对宿主健康有益的菌群数量减少,与此同时一些潜在的致病菌和条件致病菌数量增加[31]。本研究结果表明,DSS组小鼠肠道微生物结构发生改变,Desulfobacterota和Proteobacteria菌门丰度增加。Desulfobacterota通过还原硫酸盐生成硫化氢,而硫化氢在高浓度下可能对肠道上皮细胞产生毒性,加剧胃肠道疾病[32]。Proteobacteria包括大肠杆菌(Escherichia coil)、沙门氏菌(Salmonella)等许多致病菌,Proteobacteria菌门丰度的增加,被认为是肠道菌群失调的一个标志,其能促进促炎细胞因子的过量产生并与UC的发病机制相关[33-34]。发酵麸皮抑制了Desulfobacterota和Proteobacteria的增加。属水平的结果分析表明,DSS组Escherichia-Shigella丰度增加,norank_f__Muribaculaceae、Bacteroides丰度下降,DSS+FWB组较DSS组的Escherichia-Shigella丰度降低,norank_f__Muribaculaceae、Bacteroides丰度明显增加。Escherichia-Shigella是一类适应肠道环境的有害细菌,可以通过黏附和侵入肠道上皮细胞,导致炎症反应的加剧,它还可以释放一些毒素和代谢产物,损伤宿主细胞膜和上皮屏障,进一步加剧肠道黏膜的损伤[35]。norank_f__Muribaculaceae、Bacteroides是肠道中常见的益生菌,有助于抑制有害菌的生长,能够通过产生抗菌物质和调节免疫系统等多种途径来维持肠道稳态[36-37]。本研究表明,Escherichia-Shigella、norank_f__Desulfovibrionaceae等有害菌与炎症细胞因子呈正相关,有益菌(norank_f__Muribaculaceae、Candidatus_Saccharimonas)与炎症细胞因子呈负相关。炎症细胞因子与UC小鼠肠道菌群失衡密切相关,UC小鼠肠道中的大多数致病菌与促炎因子呈正相关,与抗炎因子呈负相关,而有益菌则相反,本研究结果与其一致[38]。这一结果说明DSS诱导的UC小鼠中的肠道菌群的变化参与炎症细胞因子表达调控,二者的共同作用促进了UC的发生和治疗。
综上所述,发酵麸皮可以缓解由UC引起的体重下降、结肠缩短、结肠组织损伤等症状,其作用机制与提高肠道微生物的丰富度、调节肠道菌群相关。同时,发酵麸皮可作为粮食加工副产物的高值化产品,其中含有多种天然成分(膳食纤维、多酚、甘露糖等),可以抑制炎症因子表达、调节肠道菌群,具有更好的安全性和耐受性,同时还能作为一种新型饲料添加剂,为养殖行业防止炎症性疾病提供新方法。本研究探究了发酵麸皮对UC的保护作用,下一步可探究其中的单一有效成分对UC的保护作用,有助于进一步阐明发酵麸皮缓解UC的机制机理。
[1] 吴莲云.壳寡糖对动物实验性炎性肠病防治作用的研究[D].湛江:广东海洋大学, 2020.WU L Y, Study on the prevention and treatment of chitooligosaccharide on animal experimental inflammatory bowel disease[D].Zhanjiang:Guangdong Ocean University, 2020.
[2] WANG X Y, SAUD S M, ZHANG X W, et al.Protective effect of Shaoyao Decoction against colorectal cancer via the Keap1-Nrf2-ARE signaling pathway[J].Journal of Ethnopharmacology, 2019,241:111981.
[3] JARMAKIEWICZ-CZAJA S, ![]() M, SOKAL A, et al.Genetic and epigenetic etiology of inflammatory bowel disease:An update[J].Genes, 2022, 13(12):2388.
M, SOKAL A, et al.Genetic and epigenetic etiology of inflammatory bowel disease:An update[J].Genes, 2022, 13(12):2388.
[4] KESHTELI A H, MADSEN K L, DIELEMAN L A.Diet in the pathogenesis and management of ulcerative colitis:A review of randomized controlled dietary interventions[J].Nutrients, 2019, 11(7):1498.
[5] BROWN K, DECOFFE D, MOLCAN E, et al.Diet-induced dysbiosis of the intestinal microbiota and the effects on immunity and disease[J].Nutrients, 2012, 4(8):1095-1119.
[6] LI L, WANG Z, LI L M, et al.Effects of fermented wheat bran on flour, dough, and steamed bread characteristics[J].Journal of Chemistry, 2018, 2018:1597308.
[7] 张瑞雪, 李沿, 任晨刚, 等.小麦麸皮在饲料及食品加工领域应用研究现状[J].粮食与食品工业, 2023, 30(6):1-5.ZHANG R X,LI Y,REN C G,et al.Current research status of wheat bran application in feed and food processing fields[J].Cereal &Food Industry,2023,30(6):1-5.
[8] 夏超笃, 艾琴, 向娜娜, 等.发酵麸皮的功能及在动物饲料中的应用[J].中国畜牧杂志, 2017, 53(12):17-21.XIA C D,AI Q,XIANG N N,et al.The function of fermented wheat bran and its application in animal feed[J].Chinese Journal of Animal Science,2017,53(12):17-21.
[9] LIN W C, LEE T T.Effects of Laetiporus sulphureus-fermented wheat bran on growth performance, intestinal microbiota and digesta characteristics in broiler chickens[J].Animals, 2020, 10(9):1457.
[10] WANG H, LI M L, JIAO F R, et al.Soluble dietary fibers from solid-state fermentation of wheat bran by the fungus Cordyceps cicadae and their effects on colitis mice[J].Food &Function, 2024, 15(2):516-529.
[11] AGISTA A Z, CHIEN Y S, KOSEKI T, et al.Investigation of Rhizopus oligosporus metabolites in fermented wheat bran and its bio function in alleviating colitis in mice model[J].Metabolites, 2024, 14(7):359.
[12] CHEN B H, WU Y H, WU H, et al.Establishment of food allergy model in dextran sulfate sodium induced colitis mice[J].Foods, 2023, 12(5):1007.
[13] 王俊通.产共轭亚油酸乳酸菌对DSS诱导小鼠结肠炎的改善作用[D].无锡:江南大学, 2016.WANG J T.Ameliorating effects of CLA-producing lactic acid bacteria on DSS-induced colitis in mice[D].Wuxi:Jiangnan University, 2016.
[14] 杨凯蒂.抗生素疗程对早产儿肠道菌群与免疫功能的影响及新生儿早发型败血症生物标志物筛选研究[D].重庆:重庆医科大学, 2021.YANG K D.Effects of empirical antibiotic use duration on gut microbiota and immune function of premature infants and the screening for biomarkers in neonates with early-onset sepsis[D].Chongqing:Chongqing Medical University, 2021.
[15] 陈博睿, 付永霞, 王晗, 等.谷物及其成分影响炎症性肠病的研究进展[J].中国食品学报, 2022, 22(12):389-398.CHEN B R,FU Y X,WANG H,et al.Research progress on the effect of cereals and their components on inflammatory bowel disease[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(12):389-398.
[16] NIU M M, GUO H X, CAI J W, et al.Exopolysaccharide from Bifidobacterium breve alleviate dextran sulfate sodium-induced colitis in mice via inhibiting oxidative stress and regulating intestinal flora[J].Food Bioscience, 2023, 56:103020.
[17] MURATA Y, ISHIGURO Y, ITOH J, et al.The role of proinflammatory and immunoregulatory cytokines in the pathogenesis of ulcerative colitis[J].Journal of Gastroenterology, 1995, 30(Suppl 8):56-60.
[18] 吴娜, 李多, 高会斌, 等.ATG16L1、Gal-9、IL-1β、IL-33在溃疡性结肠炎静息期和发病期的表达差异及临床意义[J].河北医科大学学报, 2019, 40(9):1013-1016.WU N,LI D,GAO H B,et al.The difference of expression of ATG16L1, Gal-9, IL-1β, IL-33 in its resting and onset stage of ulcerative colitis and clinical significance[J].Journal of Hebei Medical University, 2019, 40(9):1013-1016.
[19] KAMINSKY L W, AL-SADI R, MA T Y.IL-1β and the intestinal epithelial tight junction barrier[J].Frontiers in Immunology, 2021, 12:767456.
[20] ISLAM J, KOSEKI T, WATANABE K, et al.Dietary supplementation of fermented rice bran effectively alleviates dextran sodium sulfate-induced colitis in mice[J].Nutrients, 2017, 9(7):747.
[21] PUGLIESE D, FELICE C, PAPA A, et al.Anti TNF-α therapy for ulcerative colitis:Current status and prospects for the future[J].Expert Review of Clinical Immunology, 2017, 13(3):223-233.
[22] FAGHFOORI Z, NAVAI L, SHAKERHOSSEINI R, et al.Effects of an oral supplementation of germinated barley foodstuff on serum tumour necrosis factor-α, interleukin-6 and-8 in patients with ulcerative colitis[J].Annals of Clinical Biochemistry:International Journal of Laboratory Medicine, 2011, 48(Pt3):233-237.
[23] LI M C, HE S H.IL-10 and its related cytokines for treatment of inflammatory bowel disease[J].World Journal of Gastroenterology, 2004, 10(5):620-625.
[24] MARLOW G J, VAN GENT D, FERGUSON L R.Why interleukin-10 supplementation does not work in Crohn’s disease patients[J].World Journal of Gastroenterology, 2013,19(25):3931-3941.
[25] RODR GUEZ-PERLV
GUEZ-PERLV REZ M L, GARC
REZ M L, GARC A-S
A-S NCHEZ V, VILLAR-PASTOR C M, et al.Role of serum cytokine pro
NCHEZ V, VILLAR-PASTOR C M, et al.Role of serum cytokine pro le in ulcerative colitis assessment[J].Inflammatory Bowel Diseases, 2012, 18(10):1864-1871.
le in ulcerative colitis assessment[J].Inflammatory Bowel Diseases, 2012, 18(10):1864-1871.
[26] CHANG Y C, CHING Y H, CHIU C C, et al.TLR2 and interleukin-10 are involved in Bacteroides fragilis-mediated prevention of DSS-induced colitis in gnotobiotic mice[J].PLoS One, 2017, 12(7):e0180025.
[27] FENG C J, PENG C T, ZHANG W Q, et al.Postbiotic administration ameliorates colitis and inflammation in rats possibly through gut microbiota modulation[J].Journal of Agricultural and Food Chemistry, 2024(16):72.
[28] KNOX N C, FORBES J D, PETERSON C L, et al.The gut microbiome in inflammatory bowel disease:Lessons learned from other immune-mediated inflammatory diseases[J].The American Journal of Gastroenterology, 2019, 114(7):1051-1070.
[29] FAN Y, FEDERSEN O.Gut microbiota in human metabolic health and disease[J].Nature Reviews Microbiology, 2020, 19(1):55-71.
[30] AMOROSO C, PERILLO F, STRATI F, et al.The role of gut microbiota biomodulators on mucosal immunity and intestinal inflammation[J].Cells, 2020, 9(5):1234.
[31] ZHU S Y, HAN M Z, LIU S M, et al.Composition and diverse differences of intestinal microbiota in ulcerative colitis patients[J].Frontiers in Cellular and Infection Microbiology, 2022, 12:953962.
[32] BLACHIER F, ANDRIAMIHAJA M, LARRAUFIE P, et al.Production of hydrogen sulfide by the intestinal microbiota and epithelial cells and consequences for the colonic and rectal mucosa[J].American Journal of Physiology.Gastrointestinal and Liver Physiology, 2021, 320(2):G125-G135.
[33] SHIN N R, WHON T W, BAE J W.Proteobacteria:Microbial signature of dysbiosis in gut microbiota[J].Trends in Biotechnology, 2015, 33(9):496-503.
[34] QU Y F, LI X Y, XU F Y, et al.Kaempferol alleviates murine experimental colitis by restoring gut microbiota and inhibiting the LPS-TLR4-NF-κB axis[J].Frontiers in Immunology, 2021,12:679897.
[35] HAIDAR-AHMAD N, MANIGAT F O, SILUÉ N, et al.A tale about Shigella:Evolution, plasmid, and virulence[J].Microorganisms, 2023, 11(7):1709.
[36] HIRAISHI K, ZHAO F Y, KURAHARA L H, et al.Lactulose modulates the structure of gut microbiota and alleviates colitis-associated tumorigenesis[J].Nutrients, 2022, 14(3):649.
[37] YU W, KANG C, ZHANG Y J, et al.The San-Qi-Xue-Shang-Ning formula protects against ulcerative colitis by restoring the homeostasis of gut immunity and microbiota[J].Journal of Ethnopharmacology, 2023, 305:116125.
[38] GU W C, ZHANG L K, HAN T, et al.Dynamic changes in gut microbiome of ulcerative colitis:Initial study from animal model[J].Journal of Inflammation Research, 2022, 15:2631-2647.