腌腊食品已存在上千年的历史,自古以来人们着迷于腌腊食品独特的风味。腊肉凭借着悠久的历史文化底蕴和浓郁独特的风味成为了中国传统腌制肉品的杰出代表,是世界饮食文化遗产的重要组成部分。我国传统优质腊肉制品主要产自高海拔地区,包括金华火腿、宣威火腿、诺邓火腿、城口老腊肉等地理标志食品产地均在1 500 m海拔以上,其中城口老腊肉作为西南地区传统腊肉的典型代表之一,特殊的地理条件和环境特点,独特的制作方式,使得城口老腊肉有着与众不同的风味和口感。现代食品科学认为,传统火腿、腊肉、香肠等肉制品均属于自然发酵产品,与当地的微生物群系结构密切相关。比如西班牙香肠成熟过程中优势菌属有假单胞菌、链球菌和不动杆菌等细菌[1];意大利萨拉米香肠的核心菌群由嗜酸乳杆菌、食肉明串珠菌、沙克乳酸杆菌等组成[2]。我国的宣威火腿真菌群系主要有假灰绿曲霉、状曲霉、Candida glucosophila等[3];金华火腿的优势微生物有曲霉、酵母菌、葡萄球菌等[4];诺邓火腿的优势菌群是葡萄球菌、嗜冷杆菌、假单胞菌等[5]。显然,因地域差异使得微生物的种类各不相同从而形成了各地特色的腌腊肉制品,而城口老腊肉风味与微生物的关系尚未得到深入研究。
目前中国传统食品发酵用微生物名单(第二版)共收录了56属124种微生物菌种,其中适用于肉制品加工的仅有清酒乳杆菌、肉葡萄球菌和木糖葡萄球菌[6],这与我国丰富的传统腌腊肉制品不相称,急需要展开广泛研究,明确更多地方传统肉制品的功能性微生物种类。近来研究显示在金华火腿表面接种纳地青霉菌发现接种组的表层肌肉色泽和硬度以及咀嚼性比对照组和抑霉组较高[7-8];在如皋火腿表面涂布产黄青霉菌进行发酵,发现成熟的火腿香气浓郁,口感鲜嫩[9];在香肠中添加腐生葡萄球菌和汉逊氏德巴酵母菌可在不同程度上抑制杂菌生长,促进酯类等风味物质产生[10]。城口老腊肉是西南地区难得的国家地理标志食品,形成其特色风味的微生物基础值得深入研究,以丰富我国的微生物资源库。
本研究通过高通量测序对陈年城口老腊肉表面优势菌株分析,并分离培养腊肉表面及炕房空气中微生物,初步确定波兰青霉菌(Penicillium polonicum)、罗伯氏德巴利酵母菌(Debaryomyces robertsiae)和木糖葡萄球菌(Staphylococcus xylosus)为优势菌株。经人工添加优势菌剂进行实地发酵及异地模拟发酵,使用电子鼻、电子舌对其风味进行检测,结果表明P.polonicum是城口老腊肉的关键功能微生物,现将结果报道如下。
1 材料与方法
1.1 材料与试剂
本研究所需重庆老腊肉材料取自重庆市城口县当地农户,由城口县巴渝味食品有限公司李文成同志提供,取样时间为2022年4月,样品为炕房悬挂2年腊肉。空气样本采集于农户炕房内,采样时间为2023年2月。
Tween 80,天津希恩思生化科技有限公司;胰蛋白胨、酵母浸出粉,上海生工生物工程股份有限公司;PrepManTM Ultra 样品制备试剂,美国赛默飞世尔科技公司;DNA Marker IV,北京天根生化科技有限公司;T3 Super PCR Mix,北京擎科生物科技有限公司。
1.2 仪器与设备
1300系列生物安全柜、Veriti PCR仪,美国赛默飞世尔科技公司;无菌均质器,宁波新芝生物科技股份有限公司;FKC-1浮游空气尘菌采样器,浙江孚夏医疗科技有限公司;德国AIRSENSE PEN3电子鼻,德国AIRSENSE公司;INSENT SA-402B电子舌,日本INSENT公司;全自动细菌生化鉴定仪,法国生物梅里埃公司;DHG-9140A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;SPX生化培养箱,宁波东南仪器有限公司。
1.3 实验方法
1.3.1 城品老腊肉表面微生物结构
将腊肉平均分为5个部分,在生物安全柜中用无菌手术刀刮取表面,每个部分刮取面积共50 cm2。将表面剥离物转入无菌均质袋,按10 mL/g 加入无菌生理盐水(含体积分数为1% Tween 80),使用无菌均质器均质5 min(功率12次/s)。样品送至北京诺禾致源科技股份有限公司进行细菌、真菌组学分析。
1.3.2 细菌、真菌的分离鉴定
将表面剥离物均质后作梯度稀释,涂布PDA和MRS培养基,100 μL/平板。用浮游空气尘菌采样器采集器,内置PDA或MRS平板,每点位定时1 min(约100 L空气),每个房间采4个点位。真菌于28 ℃ 培养3 d,细菌于37 ℃ 培养2 d,挑取单菌落再纯化2~3代。纯化的细菌用全自动生化鉴定仪进行鉴定,真菌利用通用引物ITS1/ITS4进行PCR扩增,扩增产物由北京六合华大基因科技有限公司测序。
1.3.3 人工接种发酵试验
仔细分析城口老腊肉表面的微生物群系、腊肉与空气样品中培养出的微生物种类、数量,初步确定潜在的功能微生物。液体培养后稀释为1012孢子/mL和1010 CFU/mL的菌悬液,于4 ℃备用。
实地发酵实验按城口(海拔1 500 m)的方法用后腿肉制作腊肉(1 kg/刀肉),先用50°玉米酒、2.8%(质量分数)盐腌制6 d,自然风干2 d。随机分成5组(6刀肉/组),在表面涂抹不同组合的菌剂(表1),于15~20 ℃熏制26 d,分别于第14、21、26天取样作风味分析。
表1 发酵剂的组成
Table 1 The component of fermentation agents
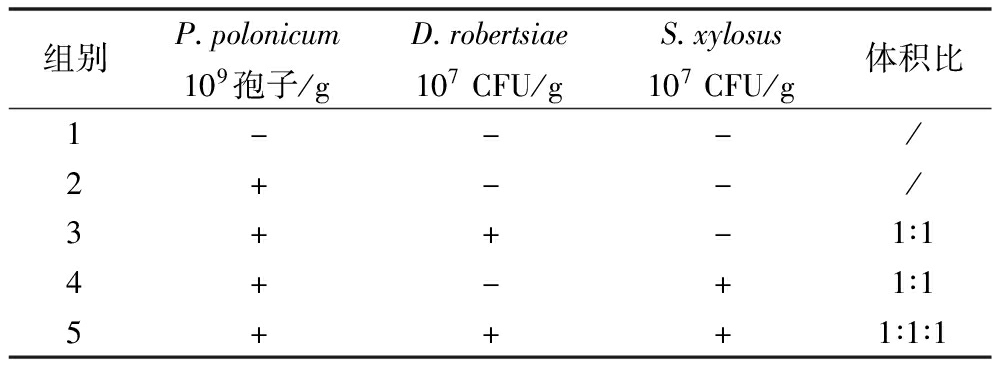
组别P.polonicumD.robertsiaeS.xylosus109孢子/g107CFU/g107CFU/g体积比1---/2+--/3++-1∶14+-+1∶15+++1∶1∶1
注:+表示添加,-表示未添加,/表示无数据。
异地模拟发酵试验在海拔200 m的北碚进行。购买新鲜猪肉,对表面进行紫外照射消毒,分割为100 g/块,按4%(质量分数)加盐腌制,转入灭菌的广口瓶(300 g),于50 ℃烘箱烘干2 d。在肉块表面涂抹菌剂,置于15 ℃培养箱静置21 d,每组3瓶。
1.3.4 腊肉的风味、滋味分析
腊肉样品每组肥瘦质量比为1∶1,用绞肉机打成肉泥。将5 g腊肉样品转移至集气瓶中,40 ℃水浴30 min,用AIRSENSE-PEN 3电子鼻测定挥发性物质。取30 g腊肉样品于均质袋中,加入270 mL去离子水。用均质器(功率12 次/s)处理5 min,40 ℃超声30 min,使中心温度达到40 ℃,再均质处理5 min。收集100 mL滤液用INSENT SA-402B电子舌检测滋味成分。
1.4 数据分析
数据结果使用Excel 2021和Origin 2024处理并绘制物种丰度图、主成分分析(principal component analysis,PCA)和雷达图,使用R包pheatmap (V 1.0.12)应用Euclidean距离算法和Sigle聚类方式进行聚类热图绘制,MEGA-X软件绘制系统发育树(phylogeny tree),MegAlign软件进行多序列比对。
2 结果与分析
2.1 表面菌群结构
城口老腊肉中共鉴定出127个细菌属,排名前10的属包括葡萄球菌属(Staphylococcus)、假单胞菌属(Pseudomonas)、乳杆菌属(Lactobacillus)、麦特康菌属(Mitochondria)、芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、拟杆菌属(Bacteroides)、罗氏菌属(Roseburia)、双歧杆菌属(Bifidobacterium)、大肠埃氏菌属-志贺氏菌属(Escherichia-Shigella),其中Staphylococcus和Pseudomonas占比为41%和3.8%以上(图1-a)。
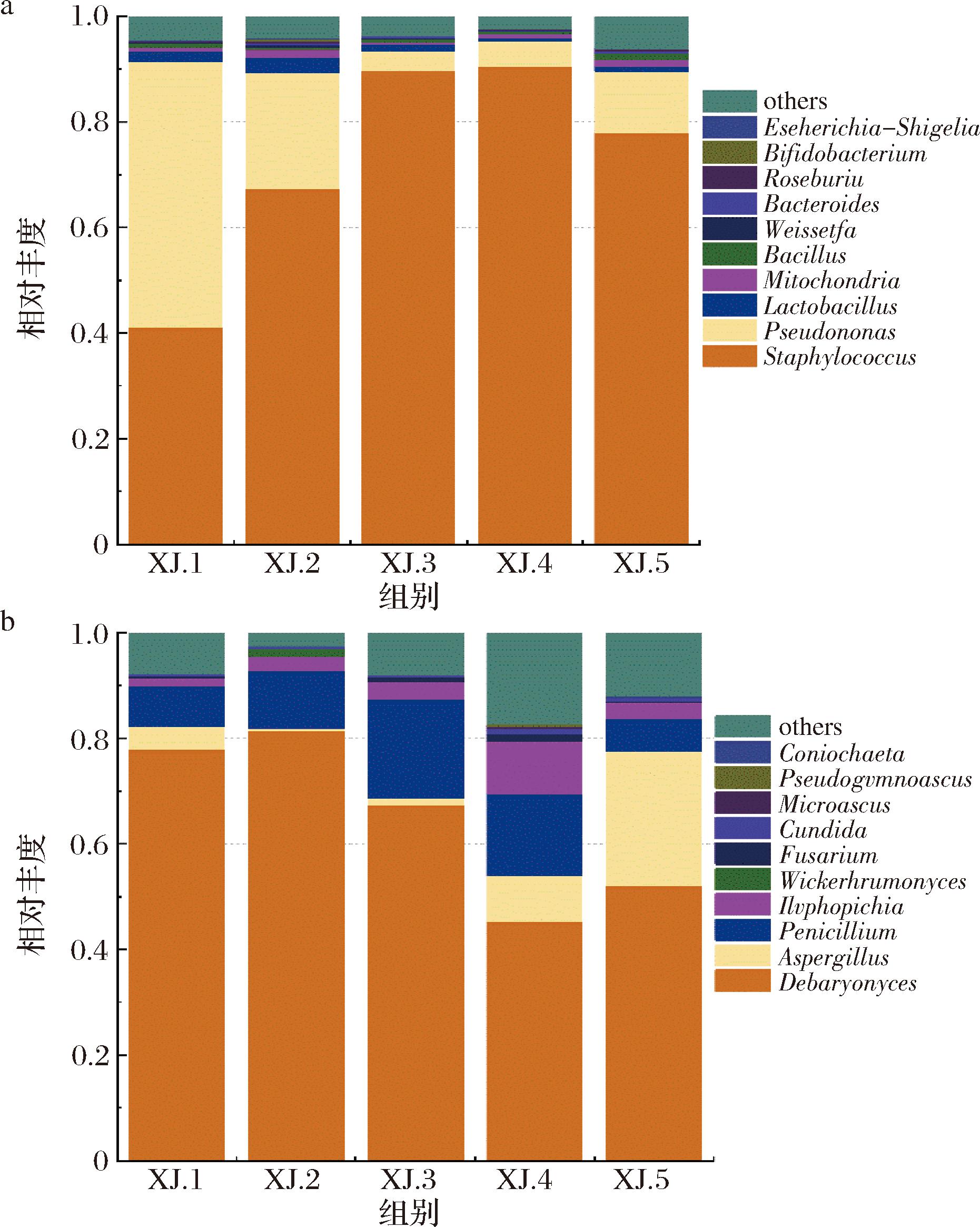
a-细菌属水平物种分布柱状图;b-真菌属水平物种分布柱状图
图1 城口老腊肉表面微生物柱状分布图
Fig.1 Histograms of bacterium and fungus distribution of Chengkou bacon
共鉴定出43个真菌属,前10个属包括德巴利酵母属(Debaryomyces)、曲霉属(Aspergillus)、青霉属(Penicillium)、丝孢毕赤酵母属(Hyphopichia)、威克汉姆酵母属(Wickerhamomyces)、镰刀菌属(Fusarium)、假丝酵母菌属(Candida)、微球菌属(Microascus)、假裸囊菌属(Pseudogymnoascus)、子囊菌属(Coniochaeta),其中Debaryomyces 和Penicillium的占比为45%和4.3%以上(图1-b)。
2.2 腊肉表面与炕房空气中微生物
腊肉表面剥离物在PDA培养基的菌落经3代纯化后提取基因组DNA、扩增ITS序列,与NCBI数据库进行同源性序列比较分析,选择同源性大于99%的菌株,利用MEGAX软件构建系统发育树,确定各菌株分类地位,部分菌株的系统发育树见图2,GenBank账号为PP967850.1、PP967851.1。共鉴定出26株青霉菌(13株P.polonicum、5株P.crustosum、5株P.rubens 和3株Penicillium sp),另有15株曲霉(6株A.jensenii、4株A.puulaauensis、5株A.versicolor),12株德巴利酵母菌(3株D.hansenii、9株D.robertsiae)和1株Kodamaea ohmeri。11株细菌经全自动细菌生化鉴定仪鉴定为6株木糖葡萄球菌、1株马葡萄球菌和4株腐生葡萄球菌,部分菌落形态如图3所示。

a-P.polonicum CK2023-1株;b-D.robertsiae CK2023-2株
图2 基于ITS序列的系统发育树
Fig.2 Phylogenetic tree of P.polonicum and D.robertsiae based on ITS sequences
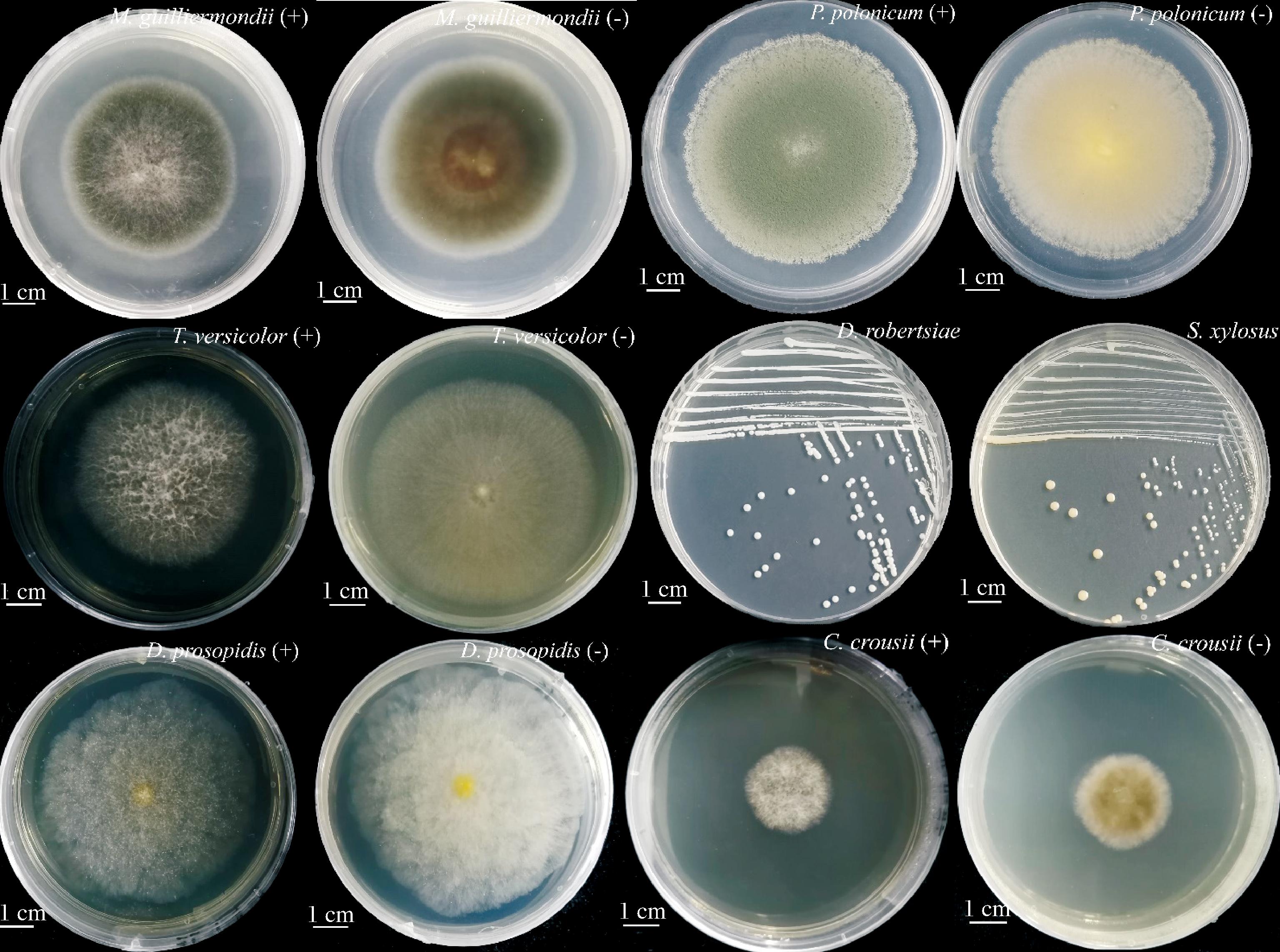
图3 城口老腊肉表面微生物的菌落形态
Fig.3 Colony morphology of microbes isolated from Chengkou Bacon
炕房内空气样品共分离到80株青霉菌(40株P.polonicum、10株P.crustosum、6株P.oxalicum、3株P.viridicatum等),4株D.robertsiae;共分离到葡萄球菌41株,包括29株S.xylosus和12株S.saprophyticus。
将腊肉表面与空气中分离真菌的ITS用MegAlign软件进行多序列比对,结果P.polonicum的相似率为100%,代表株命名为CK2023-1;D.robertsiae的相似度99.8%以上,代表株为CK2023-2。宏基因组分析城口腊肉表面的优势微生物主要有葡萄球菌、酵母菌、曲霉菌和青霉,经分离培养鉴定主要是S.xylosus(6/11),P.polonicum(13/26),A.jensenii (6/15),D.robertsiae(9/12);对空气样品分离鉴定主要是S.xylosus(29/41),D.robertsiae(4/4),P.polonicum(40/80)。这些数据相互吻合,而且城口本地人公认“长青毛的腊肉比长白毛的腊肉好”,因此我们推测P.polonicum、D.robertsiae和S.xylosus是关键功能微生物。
2.3 实地发酵气味变化分析
基于上述研究结果,人工接菌实验分4组:P.polonicum组、P.polonicum/D.robertsiae组、P.polonicum/S.xylosus组、P.polonicum/D.robertsiae/S.xylosus组。经电子鼻检测城口腊肉的主要挥发性物质是氮氧化合物(W5S)和硫化物(W1W),其次是甲基类、醇类、醛酮类和有机硫化物(W1S、W2S、W2W),氮类、苯类芳香化合物,烷烃类化合物(长链、短链)和氢化物占比很低。W3C、W3S、W6S和 W5C传感器的水平均较稳定,而氮氧化合物和硫化物的含量在发酵后期明显下降(图4-a)。经聚类分析各组挥发性物质总体上体现发酵14、21、26 d 3个时间段的特征,14 d与21 d样品在95%置信值下聚为一群,而与26 d样品相区别(P.polonicum/D.robertsiae/S.xylosus组除外)。P.polonicum、P.polonicum/D.robertsiae 2组在第14天和第26天的挥发性物质组成与对照组一致,但第21天检测到P.polonicum组的短链烷烃芳香成分和氨类明显低于对照组、P.polonicum/D.robertsiae组除甲基类外其他组分均与对照组存在差异。在95%置信值下,P.polonicum/S.xylosus组第26天数据可与对照组聚为一群。同时接种3种菌的肉制品3个时间点的风味物质组成聚类位置较为凌乱(图4-a)。综合以上数据说明大量添加P.polonicum不影响腊肉挥发性物质,而增加D.robertsiae和S.xylosusr会影响腊肉的风味。
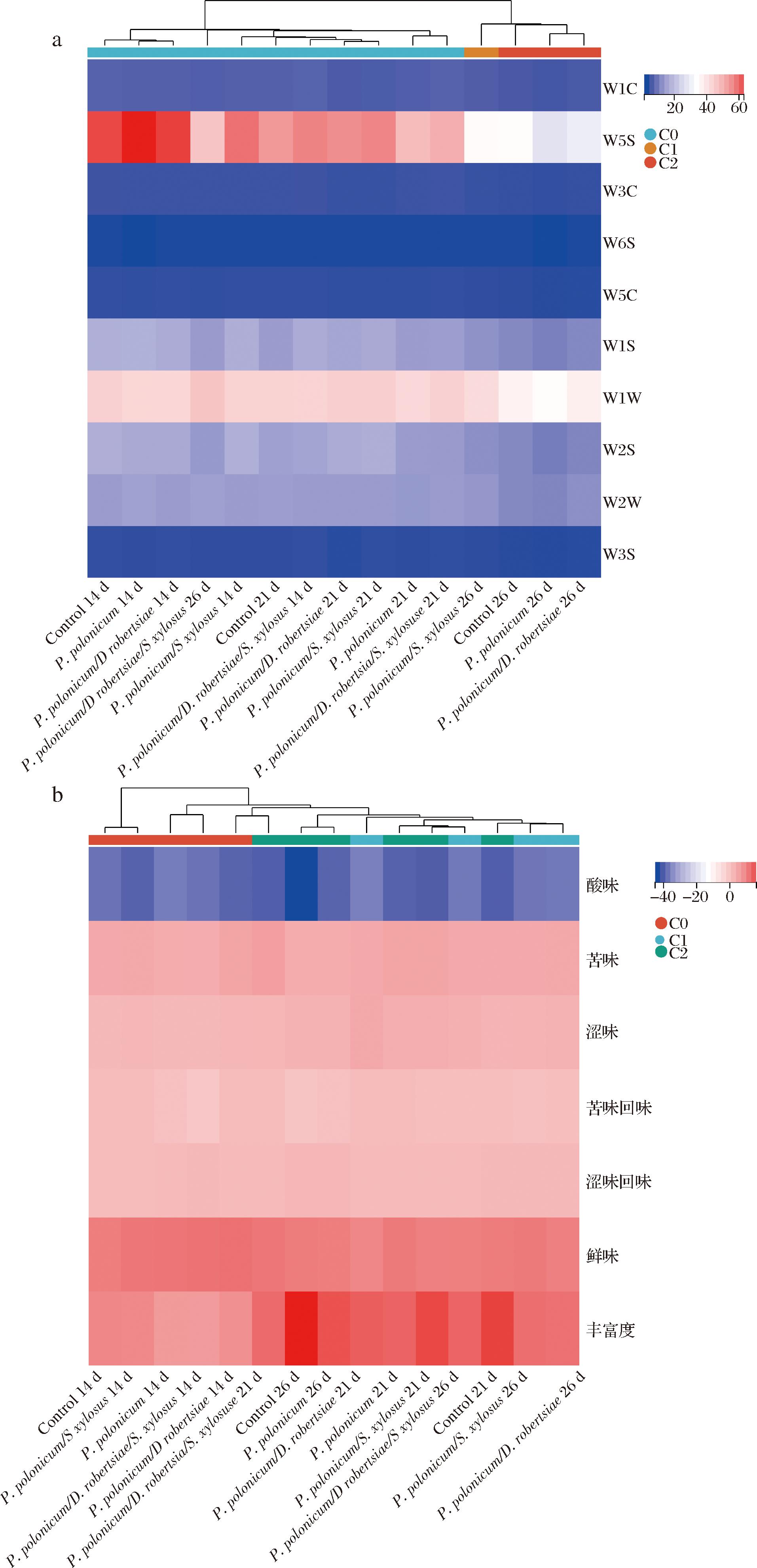
a-电子鼻;b-电子舌
图4 不同发酵组风味物质的聚类热图
Fig.4 Heat maps of flavour compounds measured with electronic nose and electronic tongue
2.4 实地发酵有效味觉变化分析
电子舌检测5组腊肉,总体上酸味、丰富度、鲜味和涩味的响应值较大(图4-b)。结果显示26 d的P.polonicum组与对照组聚为一类,而P.polonicum/D.robertsiae/S.xylosus组14 d和26 d滋味才能到达其他组别的14 d和21 d效果。与对照组相比,P.polonicum组、P.polonicum/D.robertsiae组在苦味、涩味、苦味回味和鲜味无差异,P.polonicum/S.xylosus组、P.polonicum/D.robertsiae/S.xylosus组的所有指标均存在差异(图4-b)。由此可以看出,增加腊肉表面波兰青霉菌CK2023-1的量不影响城口老腊肉的滋味。
2.5 异地模拟发酵风味变化分析
为了排除城口当地微生物群落及其他环境因素对人工接种实验的影响,在学校实验室人工培养箱中进行以波兰青霉菌CK2023-1为中心的单独发酵以及与罗伯氏德巴利酵母菌按照1∶1组合的混合发酵试验,同时设置了未添加任何菌剂的组(阴性对照)。在15 ℃放置21 d后,肉未发生腐败,表面青霉生长良好。经电子鼻、电子舌检测,添加波兰青霉菌CK2023-1发酵的腊肉在气味上与阳性对照组(来自城口本地的老腊肉)完全一致(图5-a),且在滋味的丰富度、涩味和涩味回味方面也表现出相似性,而罗伯氏德巴利酵母菌与阳性对照风味差异较大(图5-b)。这说明波兰青霉菌CK 2023-1在城口老腊肉的发酵过程中起着关键性的作用,能够在脱离城口当地环境的情况下复制出城口老腊肉的传统风味。
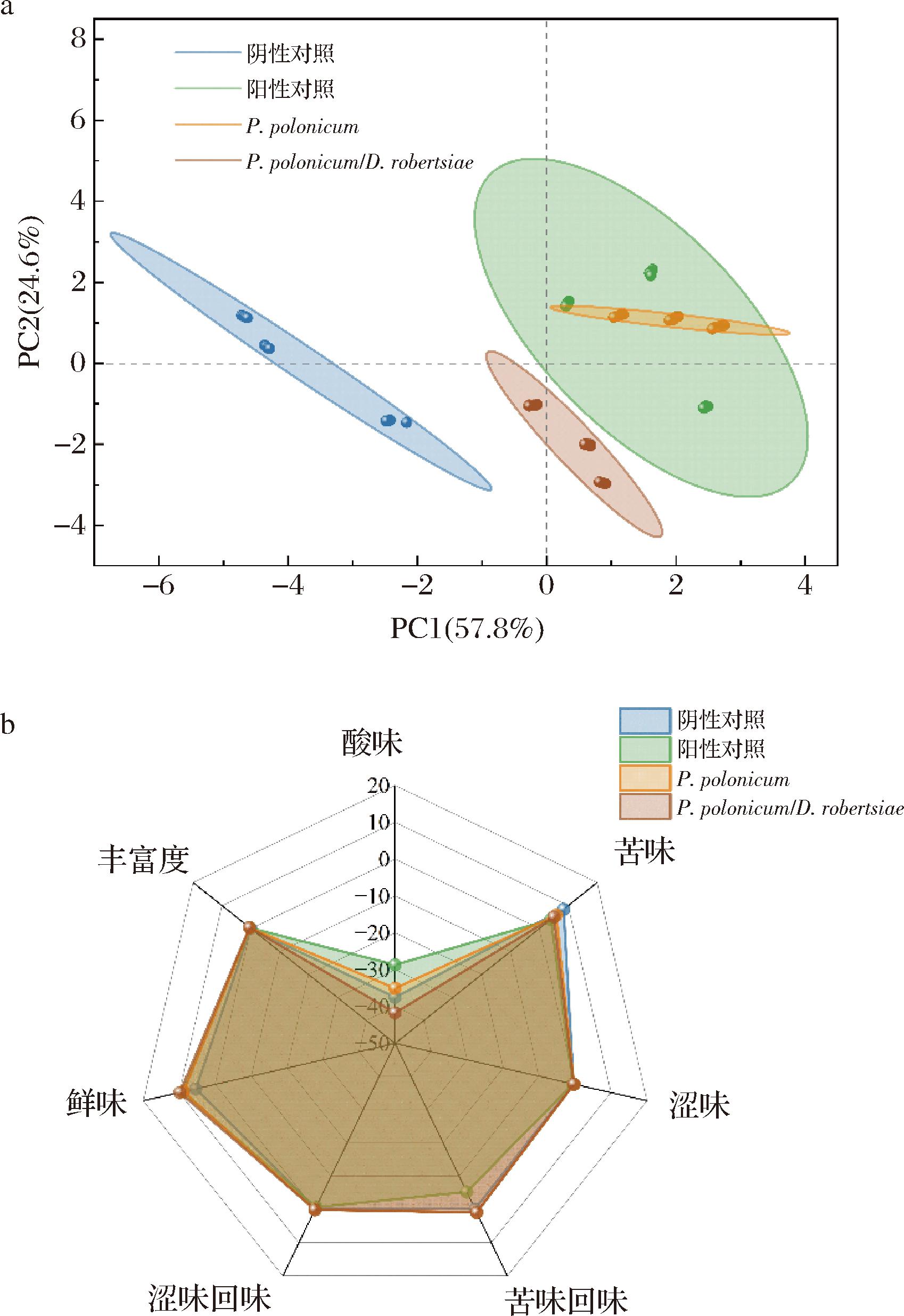
a-PCA图;b-雷达图
图5 波兰青霉发酵腊肉的风味物质分析PCA图与雷达图
Fig.5 PCA plot and radar chart analysis of flavour compounds from P.polonicum fermentation
3 讨论
与乳制品、酒、醋等发酵食品不同,传统腌腊肉制品是在开放空间经长时间悬挂而成的,其品质受环境微生物影响较大。贺稚非等分析了现代工艺制作金华火腿过程中微生物群落的变化,显示优势微生物结构发生动态变化,并且金华火腿的风味与该地区微生物群落有一定的关系[11]。我国制作优质火腿、腊肉的地方都地处海拔1 500 m以上的山区,有植被高、空气清新、昼夜温差大等共同生态特点,但表面优势微生物结构不尽相同,比如金华火腿成熟后的优势微生物是曲霉菌属、酵母菌属、葡萄球菌属和科贝特氏菌属,而成熟的宣威火腿优势群是葡萄球菌、微球菌和霉菌,成熟阶段的诺邓火腿的优势属则是葡萄球菌属、沙雷氏菌属和罗尔斯通菌属[4-5,12],说明不同地区的独特微生物群系造就了地域特色风味的发酵肉制品。本研究使用 Illumina NovaSeq高通量测序技术从基因组水平分析陈年城口老腊肉表面的微生物群落结构,证实了城口老腊肉表面确实存在一定丰度的微生物,属于微生物参与发酵的肉制品,通过探讨城口老腊肉表面微生物群落组成,结果显示陈年城口老腊肉表面优势属是葡萄球菌属(Staphylococcus)、假单胞菌属(Pseudomonas)、德巴利酵母属(Debaryomyces)和青霉属(Penicillium),这与川味腊肉货架期间主要微生物[13]、川渝地区烟熏腊肉与风干腊肉的微生物结构一致[14]。结合分离表面剥离物和炕房空气样品优势微生物,确定P.polonicum、D.robertsiae和S.xylosus为发酵菌株,通过人工接种优势菌剂试验发现波兰青霉菌是城口老腊肉核心功能菌株,不仅可以缩短发酵周期而且能够实现异地发酵重现城口老腊肉风味。
青霉菌曾为人类医药事业发展作出重大贡献,近年发现它在发酵肉制品中也发挥举足轻重的作用。陈杰等[7-8]曾在金华火腿表面接种纳地青霉菌菌剂发现接种组比对照组和抑霉组的表层肌肉色泽、硬度和咀嚼性高,接种组火腿整体品质比其他各组优越;在如皋火腿表面涂布接种产黄青霉菌进行发酵发现成熟的火腿香气浓郁,口感鲜嫩[9];西班牙salchichón干发酵香肠表面喷洒卡门培尔青霉菌,发现可以加速蛋白质和脂肪的水解引起游离氨基酸、游离脂肪酸和挥发性化合物的浓度,明显改善了香肠的气味和风味[15];萨拉米香肠制作中添加萨拉米青霉菌,被证明是干腌香肠肠衣上快速生长的霉菌,非常适合调味过程,具有高脂解和蛋白水解酶活性,赋予肉制品典型的感官特征[16]。本研究首次报道波兰青霉菌是城口老腊肉的核心功能菌,这也与当地农户的经验相吻合,他们认为长绿毛的是好腊肉,而长白毛的就容易发臭。波兰青霉菌曾被鉴定为柑橘、当归、洋葱等的病原性真菌[17-20],近年也有报道它是马齿苋、黄草乌和海洋植物的内生性真菌,产生抗菌、抗癌的次生代谢产物,能抑制青枯菌、金黄色葡萄球菌的生长,也能在体外抑制肝癌细胞MHCC97H、乳腺癌细胞BT549、肺癌细胞H1299等肿瘤细胞的生长[21-23]。赖春玲[24]用波兰青霉发酵赣南脐橙果皮,发现橙皮提取物的抑菌、抗氧化、抗糖化及对α-葡萄糖苷酶抑制作用均增强,这暗示波兰青霉有比较多样的生物学活性。本研究把重庆市城口的波兰青霉菌代表种命名为CK2023-1,今后将按程序申请进入我国传统食品微生物名单,也将从基因组、代谢组、表观遗传等方面展开研究,全面认识城口老腊肉特色风味的生物学基础,以及与波兰青霉相关的作物病害的关系。
4 结论
P.polonicum、D.robertsiae和S.xylosus是重庆城口老腊肉的优势微生物,其中P.polonicum CK2023-1在其特色风味形成过程中发挥了关键作用。
[1] JU REZ-CASTEL
REZ-CASTEL N C, GARC
N C, GARC A-CANO I, ESCOBAR-ZEPEDA A, et al.Evaluation of the bacterial diversity of Spanish-type chorizo during the ripening process using high-throughput sequencing and physicochemical characterization[J].Meat Science, 2019, 150:7-13.
A-CANO I, ESCOBAR-ZEPEDA A, et al.Evaluation of the bacterial diversity of Spanish-type chorizo during the ripening process using high-throughput sequencing and physicochemical characterization[J].Meat Science, 2019, 150:7-13.
[2] BELLEGGIA L, ![]() V, FERROCINO I, et al.Is there any still undisclosed biodiversity in Ciauscolo salami? A new glance into the microbiota of an artisan production as revealed by high-throughput sequencing[J].Meat Science, 2020, 165:108128.
V, FERROCINO I, et al.Is there any still undisclosed biodiversity in Ciauscolo salami? A new glance into the microbiota of an artisan production as revealed by high-throughput sequencing[J].Meat Science, 2020, 165:108128.
[3] 邹颖玲, 刘姝韵, 王桂瑛, 等.基于PCR-DGGE技术分析宣威火腿中真菌群落结构[J].食品与发酵工业, 2020, 46(6):269-274. ZOU Y L, LIU S Y, WANG G Y, et al.Analysis of fungal community structure in Xuanwei ham by PCR-DGGE[J].Food and Fermentation Industries, 2020,46(6):269-274.
[4] DENG J Y, XU H, LI X M, et al.Correlation of characteristic flavor and microbial community in Jinhua ham during the post-ripening stage[J].LWT, 2022, 171:114067.
[5] 王馨蕊, 史巧, 刘毕琴, 等.诺邓火腿加工过程中细菌群落的动态变化[J].食品工业科技, 2021, 42(2):83-89;98.WANG X R, SHI Q, LIU B Q, et al.Bacterial dynamics during the processing of Nuodeng dry-cured ham[J].Science and Technology of Food Industry, 2021,42(2):83-89;98.
[6] 姚粟, 王鹏辉, 白飞荣, 等.中国传统发酵食品用微生物菌种名单研究(第二版)[J].食品与发酵工业, 2022, 48(1):272-307.YAO S, WANG P H, BAI F R, et al.Research on the inventory of microbial food cultures in Chinese traditional fermented foods(2nd edition)[J].Food and Fermentation Industries, 2022,48(1):272-307.
[7] 陈杰.金华火腿成熟过程中霉菌菌相构成、安全性及与其品质关系的研究[D].杭州:浙江工商大学, 2007.CHENG J, Studies on the moulds population during ripening and their effects on the safety and quality of Jinhua ham[D], Hangzhou:Zhejiang Gongshang University, 2007.
[8] 陈杰, 孟岳成.金华火腿成熟过程中霉菌生长与其品质关系[J].食品与发酵工业, 2009, 35(8):138-142.CHEN J, MENG Y C.Studies on the relationship between moulds and quality of Jinhua ham during ripening[J].Food and Fermentation Industries, 2009, 35(8):138-142.
[9] 蒋云升, 潘明, 汪志君, 等.如皋火腿用霉菌性表面涂膜发酵剂的应用研究[J].食品与发酵工业, 2007, 33(7):81-84.JIANG Y S, PAN M, WANG Z J, et al.The study of application of fermentation on the surface of Rugao ham[J].Food and Fermentation Industries, 2007, 33(7):81-84.
[10] 杨小莹, 肖珊, 庞煜, 等.不同发酵剂对发酵香肠品质的影响[J].食品与发酵工业, 2023, 49(18):242-249.YANG X Y, XIAO S, PANG Y, et al.Different starters on the quality of fermented sausage[J].Food and Fermentation Industries, 2023,49(18):242-249.
[11] 贺稚非, 甄宗圆, 李洪军, 等.金华火腿发酵过程中微生物区系研究[J].食品科学, 2008, 29(1):190-195.HE Z F, ZHEN Z Y, LI H J, et al.Microorganisms flora study on Jinhua ham fermentation[J].Food Science, 2008,29(1):190-195.
[12] 李平兰, 沈清武, 吕燕妮, 等.宣威火腿成熟产品中主要微生物菌相构成分析[J].中国微生态学杂志, 2003, 15(5):262-263.LI P L, SHEN Q W, LYU Y N, et al.Analysis of main of microorganisms in Xuanwei ham[J].Chinese Journal of Microecology, 2003, 15(5):262-263.
[13] 全拓, 邓大川, 李洪军, 等.川味腊肉货架期间主要微生物的研究[J].西南大学学报(自然科学版), 2017, 39(2):14-21.QUAN T, DENG D C, LI H J, et al.Study on the main microorganisms of traditional Sichuan bacon during its shelf life[J].Journal of Southwest University (Natural Science Edition), 2017, 39(2):14-21.
[14] YANG L, LI H J, WU H, et al.Quality relationship between smoked and air-dried bacon of Sichuan-Chongqing in China:Free amino acids, volatile compounds, and microbial diversity[J].Food Research International, 2023, 164:112274.
[15] BRUNA J M, HIERRO E M, DE LA HOZ L, et al.Changes in selected biochemical and sensory parameters as affected by the superficial inoculation of Penicillium camemberti on dry fermented sausages[J].International Journal of Food Microbiology, 2003, 85(1-2):111-125.
[16] MAGIST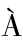 D, FERRARA M, DEL NOBILE M A, et al.Penicillium salamii strain ITEM 15302:A new promising fungal starter for salami production[J].International Journal of Food Microbiology, 2016, 231:33-41.
D, FERRARA M, DEL NOBILE M A, et al.Penicillium salamii strain ITEM 15302:A new promising fungal starter for salami production[J].International Journal of Food Microbiology, 2016, 231:33-41.
[17] 朱从一.柑橘采后青霉属病原菌生物学特性及其系统发育[D].武汉:华中农业大学, 2011.ZHU C Y.The biological characteristics and molecular phylogenetic analyses of Penicillium spp.that causing the mold fruit of citrus[D].Wuhan:Huazhong Agricultural University, 2011.
[18] 陈娟, 高微微, 唐丹, 等.赭曲霉毒素A污染的7种根类药材中污染真菌的分析[J].中国中药杂志, 2010, 35(20):2647-2651.CHEN J, GAO W W, TANG D, et al.Investigation of fungal populations in seven ochratoxin A contaminated root herbs[J].China Journal of Chinese Materia Medica, 2010,35(20):2647-2651.
[19] 杨董云, 吕丙钰, 薛华丽, 等.新鲜当归采后青霉病病原菌分离鉴定、生物学特性及毒素积累[J].甘肃农业大学学报, 2022, 57(2):74-81.YANG D Y, LYU B Y, XUE H L, et al.Isolation and identification, biological characteristics and mycotoxin accumulation of blue mould pathogen in harvested Angelica sinensis[J].Journal of Gansu Agricultural University, 2022, 57(2):74-81.
[20] 苏建红.甘肃省洋葱贮藏期真菌性病害研究[D].兰州:甘肃农业大学, 2015.SU J H.The research of onion fungal disease during storage period in Gansu Province[D].Lanzhou:Gansu Agricultural University, 2015.
[21] 张倩.马齿苋内生菌抗青枯病的研究[D].广州:华南农业大学, 2019.ZHANG Q.Study on the endophytes in Portulaca oleracea L.against bacterial wilt[D].Guangzhou:South China Agricultural University, 2019.
[22] 蔡学芸.基于OSMAC策略下黄草乌内生真菌波兰青霉TY12次生代谢产物分析和活性研究[D].昆明:云南大学, 2021.CAI X Y.Secondary metabolites analysis and their bioactivities of the endophytes fungus Penicillium polonicum TY12 associated with Aconitum vilmorinianum Kom based on OSMAC strategy[D].Kunming:Yunnan University, 2021.
[23] GUO X C, ZHANG Y H, GAO W B, et al.Absolute configurations and chitinase inhibitions of quinazoline-containing diketopiperazines from the marine-derived fungus Penicillium polonicum[J].Marine Drugs, 2020, 18(9):479.
[24] 赖春玲.波兰青霉菌发酵赣南脐橙果皮中活性物质研究[D].赣州:赣南师范大学, 2023.LAI C L.Study on the bioactive compounds in Gannan navel orange peel fermentated by Penicillium polonicum[D].Ganzhou:Gannan Normal University, 2023.