阪崎肠杆菌(Cronobacter sakazakii)属革兰氏阴性菌,是一种在自然界中广泛存在的食源性条件致病菌,主要污染婴儿配方奶粉[1]。C.sakazakii易导致早产和免疫力低下的新生儿患败血症、脑膜炎和坏死性小肠结肠炎等疾病,致死率高达80%[2]。与此同时,C.sakazakii具有较强的极端环境耐受性,表现为耐干燥、耐酸碱、耐氧化、耐高渗透胁迫以及耐紫外线辐射等。尤其是与其他食源性致病菌[大肠杆菌(Escherichia coli)和沙门氏菌]相比,C.sakazakii对干燥和渗透压的耐受性更高[3]。其在干燥处理2.5年后仍能恢复细胞活性[4],导致传统的消杀策略对C.sakazakii效果不佳。因此开发针对C.sakazakii的新型杀菌方法具有重要意义,而其中较有前景的方式之一为抗菌肽(antimicrobial peptides,AMPs)。
AMPs是一类天然存在的结构和功能多样化的肽,能够靶向多种病原体(包括革兰氏阴性细菌、革兰氏阳性细菌、真菌和病毒等)[5],具有抗菌等多重作用[6]。其中昆虫死亡素(thanatin,Tn)是近年报道的一种具有单个二硫键的β-发夹阳离子肽,其分离自刺甲虫(Podisus maculiventris),含21个氨基酸(GSKKPVPIIYCNRRTGKCQRM)[7]。Tn制备方法包括自然提取、化学合成和微生物合成。昆虫体内Tn含量低,且提取时间长、工艺繁琐。化学合成法需要的固相肽技术生产成本高,昂贵且耗时[8]。而通过微生物异源合成Tn具有潜力。TIAN等[9]将具有广泛抑菌作用的蛙源抗菌肽Magainin的核心序列与Tn的核心序列相连,并在E.coli BL21(DE3)中成功表达。重组蛋白对金黄色葡萄球菌、E.coli DH5α和枯草芽孢杆菌具有抑制作用。另一种表达宿主为巴斯德毕赤酵母(Pichia pastoris),其具有多种潜在优势,例如安全性更高、致病性更低以及具有高密度发酵能力和成熟的翻译后修饰能力[10]。PIPIYA等[11]基于组成型载体pGAPZα A,在YPD培养基中实现了重组Tn的高效分泌表达,达到20 mg/L,是目前报道的最高水平。本论文以P.pastoris为表达宿主,通过优化Tn密码子,利用不同启动子(pPICZα A和pGAPZα A)表达Tn,探究了Tn对C.sakazakii BAA-894生长的抑制作用。
据报道,Tn对E.coli、肺炎克雷伯菌、鲍曼不动杆菌等有效,且对革兰氏阴性细菌的抗菌率超过了对革兰氏阳性菌和真菌[12-13],目前认为杀菌机制可能与脂多糖(lipopolysaccharide,LPS)有关,但尚无研究证实。LPS是革兰氏阴性菌细胞外膜的主要致病性大分子,可影响细胞外膜的通透性及稳定性[14]。C.sakazakii BAA-894具有完整的LPS结构,包含类脂A、核心多糖和O-抗原[15]。为证实LPS结构对Tn杀菌效率的影响,本文选取LPS核心多糖链缺失的C.sakazakii BAA-894ΔwaaC[16],并比较其与C.sakazakii BAA-894对Tn敏感性差异。本文可为开发C.sakazakii新型抗菌剂提供参考,也为深入探究Tn杀菌机制奠定基础。
1 材料与方法
1.1 培养基与试剂
LB培养基(1 L):酵母粉5 g、蛋白胨10 g、氯化钠10 g;
YPD培养基(1 L):酵母粉10 g、蛋白胨20 g、葡萄糖20 g;
以上固体培养基通过添加1.8%(质量分数)琼脂粉配制。
BMGY(buffered glycerol-complex medium)发酵培养基(1 L):酵母粉10 g、蛋白胨20 g、甘油10 g、100 mL 磷酸钾缓冲液(pH 6.0)、无氨基酵母氮源(yeast nitrogen base,YNB)13.4 g、生物素400 μg。
BMMY(buffered methanol-complex medium)发酵培养基(1 L):酵母粉10 g、蛋白胨20 g、甲醇10 g、100 mL磷酸钾缓冲液(pH 6.0)、YNB 13.4 g、生物素400 μg。
试剂:酵母粉、蛋白胨,英国Oxoid公司;氯化钠、氯化钾、磷酸二氢钾、磷酸氢二钾、葡萄糖、甘油、D-山梨醇、分析级乙腈、分析级甲醇等,国药集团化学试剂有限公司;三氟乙酸(trifluoroacetic acid,TFA),上海麦克林生化科技有限公司;GoldView核酸染料、博来霉素、YNB,北京索莱宝生物工程有限公司;质粒小提试剂盒,北京天根生化科技公司;His标签蛋白纯化试剂盒,上海碧云天生物技术股份有限公司;PCR产物纯化试剂盒,南京诺唯赞生物科技股份有限公司。
1.2 菌株、质粒及引物
菌株:E.coli JM109用于质粒的构建,P.pastoris GS115作为实验生产菌株,C.sakazakii BAA-894和C.sakazakii BAA-894ΔwaaC用于抗菌活性检测。
质粒:pGAPZα A载体质粒,pPICZα A载体质粒。
本文所用的基因和PCR涉及的引物列于表1中。
表1 文中所涉及的基因和引物
Table 1 Genes and primers used in this study

基因与引物序列(5′-3′)来源基因thanGGTTCCAAGAAGCCAGTTCCAATCATCTACTGCAACAGACGTACCGGTAAGTGCCAGAGAATGTGA[11]than-1GGCAGCAAAAAACCGGTGCCGATTATTTATTGCAACCGCCGCACCGGCAAATGCCAGCGCATGTGA本研究GAPT-FTTATTTATTGCAACCGCCGCACCGGCAAATGCCAGCGCATGTGAGAATTCACGTGGATGGGCC本研究GAPT-RGCGGCGGTTGCAATAAATAATCGGCACCGGTTTTTTGCTGCCAGCTTCAGCCTCTCTTTTCTCG本研究AOXT-FTTATTTATTGCAACCGCCGCACCGGCAAATGCCAGCGCATGTGAGTTTGTAGCCTTAGACATGACTGTT本研究引物AOXT-RGCGGCGGTTGCAATAAATAATCGGCACCGGTTTTTTGCTGCCAGCTTCAGCCTCTCTTTTCTCGAGAGATA本研究AOXT-HFCAGCGCATGCACCACCACCACCACCACTGAGTTTGTAGCCTTAGACATGACTGTT本研究AOXT-HRGCTACAAACTCAGTGGTGGTGGTGGTGGTGCATGCGCTGGCATTTGCCG本研究Y-FAAAAAACCGGTGCCGATT本研究Y-RGGTCGGTCCAGAACTCGA本研究
1.3 实验方法
1.3.1 质粒构建
查询目的基因的序列,在SnapGene软件进行质粒和引物设计,以pGAPZα A和pPICZα A为模板PCR线性化扩增质粒骨架(图1)。操作根据2×Hieff Canace®高保真酶预混液说明书进行。PCR反应体系为50 μL,其中高保真酶25 μL,上下引物各5 μL,模板100 ng,最后用ddH2O将反应体系补齐至50 μL。反应结束后,取7 μL产物进行琼脂糖电泳,胶回收后取200 ng化学转化到E.coli JM109中连接成环,验证成功后使用质粒小提试剂盒提取质粒备用。
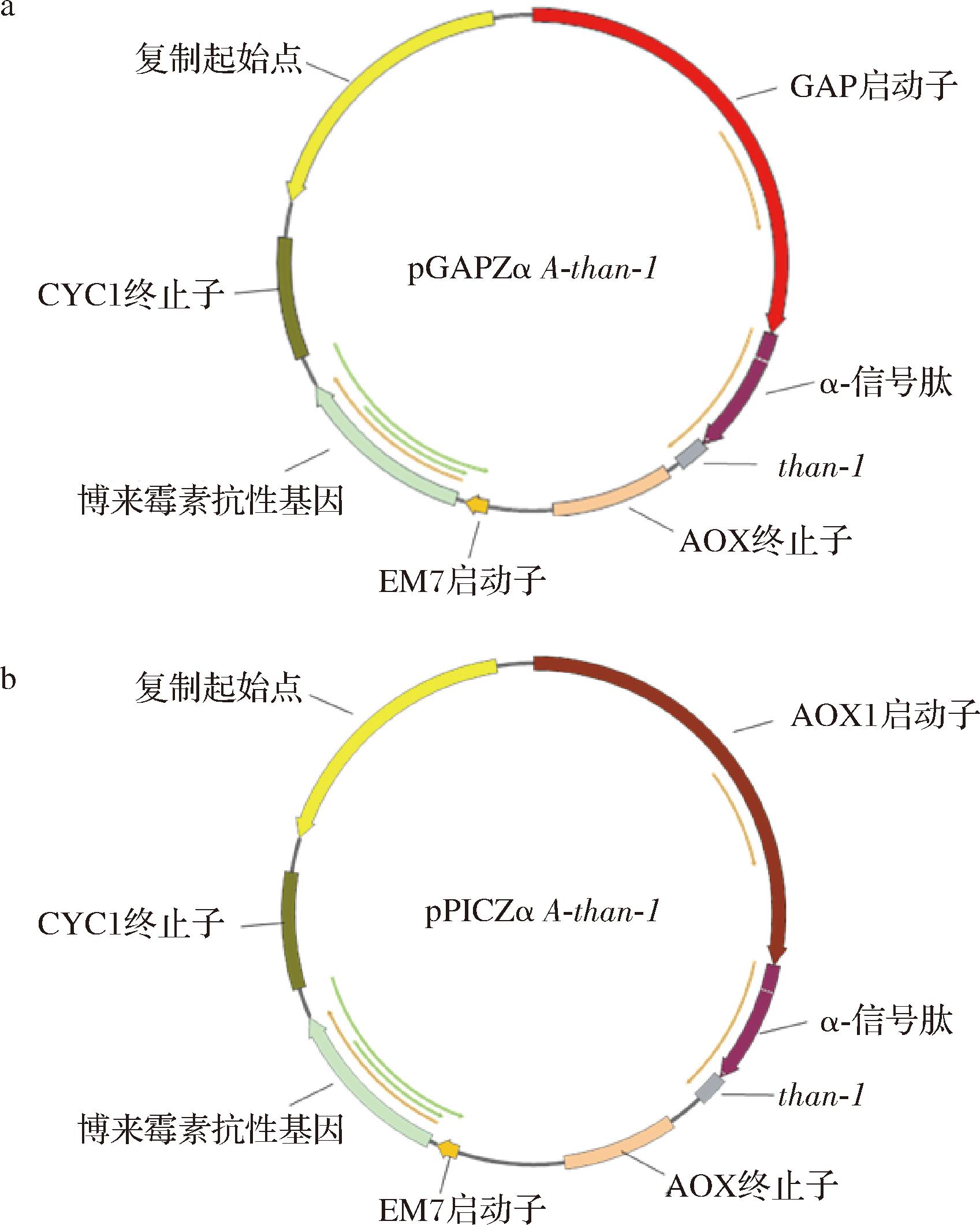
a-pGAPZα A-than-1;b-pPICZα A-than-1
图1 pGAPZα A-than-1和pPICZα A-than-1质粒构建
Fig.1 Construction of pGAPZα A-than-1 and pPICZα A-than-1 plasmids
1.3.2 P.pastoris转化子构建
pGAPZα A质粒用AvrⅡ进行限制性酶切,pPICZα A质粒则用SacⅠ进行酶切。将100 ng酶切后的质粒和P.pastoris感受态细胞轻轻混匀置于预冷的电极杯中,在冰上静置30 min。电穿孔后立即将细胞悬浮在预冷的0.5 mL山梨醇(1 mol/L)和0.5 mL YPD培养基的溶液中,振荡孵育2 h后,离心涂布于博来霉素抗性平板中,筛选阳性转化子。
1.3.3 P.pastoris摇瓶发酵
将菌株在YPD平板上划线活化,挑取单菌落接种于YPD试管中摇床培养过夜。
含有pGAPZα A质粒的转化子,以1%(体积分数)种子培养液接种于50 mL BMGY培养基,30 ℃和220 r/min培养。每24 h添加0.5 mL甘油以维持生长。在不同时间点取样分析。
含有pPICZα A质粒的转化子,以1%种子培养液接种于50 mL BMGY培养基,30 ℃和220 r/min培养24 h。离心收获细胞,在50 mL BMMY培养基中重悬,每12 h定期添加诱导剂甲醇0.25 mL,以保持其终浓度为0.5φ%。在选定的时间点取样以供分析。
1.3.4 Tn高效液相色谱分析
实验中采用的检测条件:Agilent 1260高效液相色谱仪、C18柱(250 mm×4.6 mm,5 μm)、UV检测器,吸收波长为220 nm,柱温35 ℃。A相为含0.1% TFA的乙腈溶液,B相为含0.1%TFA的H2O溶液。线性梯度进行洗脱:0~25 min,10%~35%A,90%~65%B;25~25.1 min,35%~100%A,65%~0%B;30 min,Stop。流速为0.8 mL/min,进样体积为20 μL,检测时长为30 min。
1.3.5 Tn亲和层析
根据His标签蛋白纯化试剂盒说明书进行操作。先用非变性裂解液平衡BeyoGoldTM His-tag Purification Resin(耐还原螯合型)凝胶2次,将离心好的上清样品加入其中。4 ℃在水平摇床上缓慢摇动1 h,确保带有His标签的Tn与凝胶充分结合。凝胶装柱后,用非变性洗涤液清洗凝胶5次,最后用非变性洗脱液洗脱蛋白6~10次,将每次的洗脱液分别收集到不同的离心管中。收集的洗脱液即为纯化的Tn。
1.3.6 Tn体外抗菌活性分析
取-80 ℃冻存的2种指示菌株C.sakazakii BAA-894和C.sakazakii BAA-894ΔwaaC,划线于LB琼脂培养基,30 ℃过夜培养至单菌落长出。挑取单菌落接种于LB液体培养基中,30 ℃和220 r/min培养过夜。菌液接种于LB新鲜液体培养基中使OD600值为0.01。96孔板各孔均加入100 μL新鲜LB培养基,取100 μL纯化后160 mg/L的Tn自第1孔倍比稀释后加入10 μL菌悬液,只加液体培养基为阴性对照,只加液体培养基和菌液为阳性对照。每孔3个重复,封盖振荡,放置30 ℃摇床中培养12 h。培养结束后,使用BioTek Synergy 2酶标仪测定OD600值,能够代表菌浓度,反映其生长状况。抑菌率计算如公式(1)所示:
抑菌率![]()
(1)
2 结果与分析
2.1 Tn生产菌株的构建
Tn序列为GSKKPVPIIYCNRRTGKCQRM。因此只需设计包含目的基因的引物,进行密码子偏好性优化得than-1,再通过PCR得到重组质粒pGAPZα A-than-1和pPICZα A-than-1。电转入P.pastoris后抗性筛选,转化子经PCR、DNA电泳和基因测序验证,获得成功转化的菌株GS115/pGAPZα A-than-1和GS115/pPICZα A-than-1。电泳结果如图2所示,表明菌株构建成功。
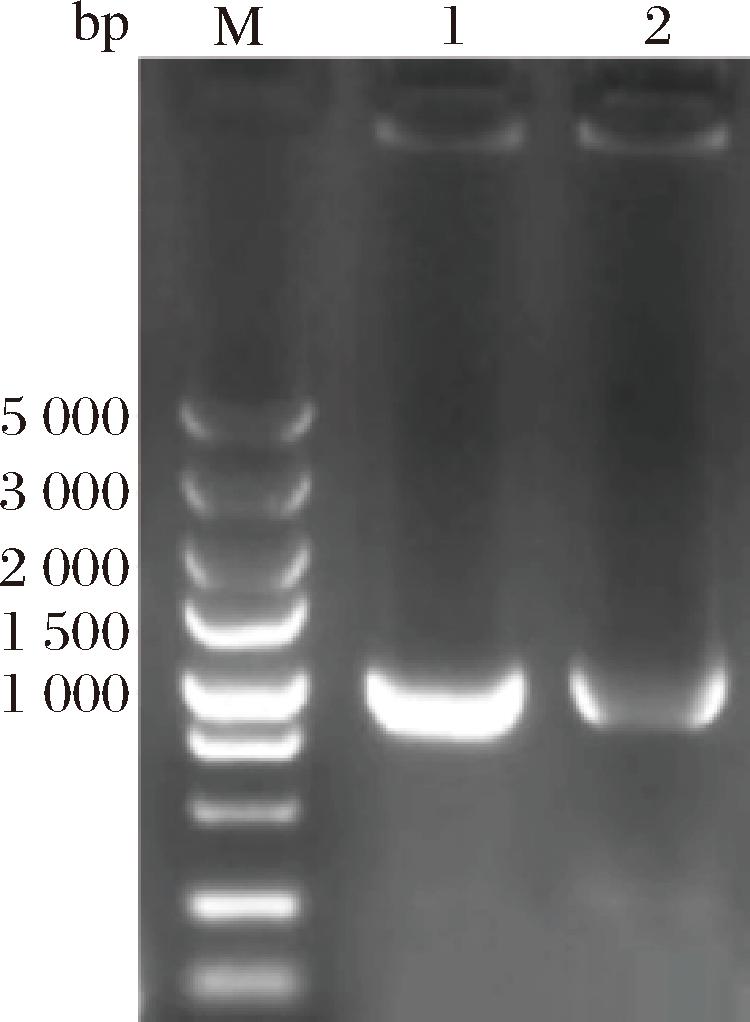
M-Marker;1-GS115/pGAPZα A-than-1;2-GS115/pPICZα A-than-1。
图2 转化子的PCR验证
Fig.2 Verification of expression strain by PCR
2.2 不同启动子对菌株生长及Tn合成的影响
为验证Tn的表达对菌株生长的影响,图3-a比较了GS115/pGAPZα A-than-1、GS115/pPICZα A-than-1与GS115生长曲线。在BMGY培养基中,GS115与GS115/pGAPZα A-than-1生长速度差别不大。两者均在120 h达到最大生物量,其中GS115最大OD600值为28.40,GS115/pGAPZα A-than-1最大OD600值为28.00。在BMMY培养基中,GS115和GS115/pPICZα A-than-1生长速度无显著差异。GS115在132 h达到最大OD600值为21.90,GS115/pPICZα A-than-1在120 h的最大OD600值为22.60。表明Tn对P.pastoris生长几乎无影响。
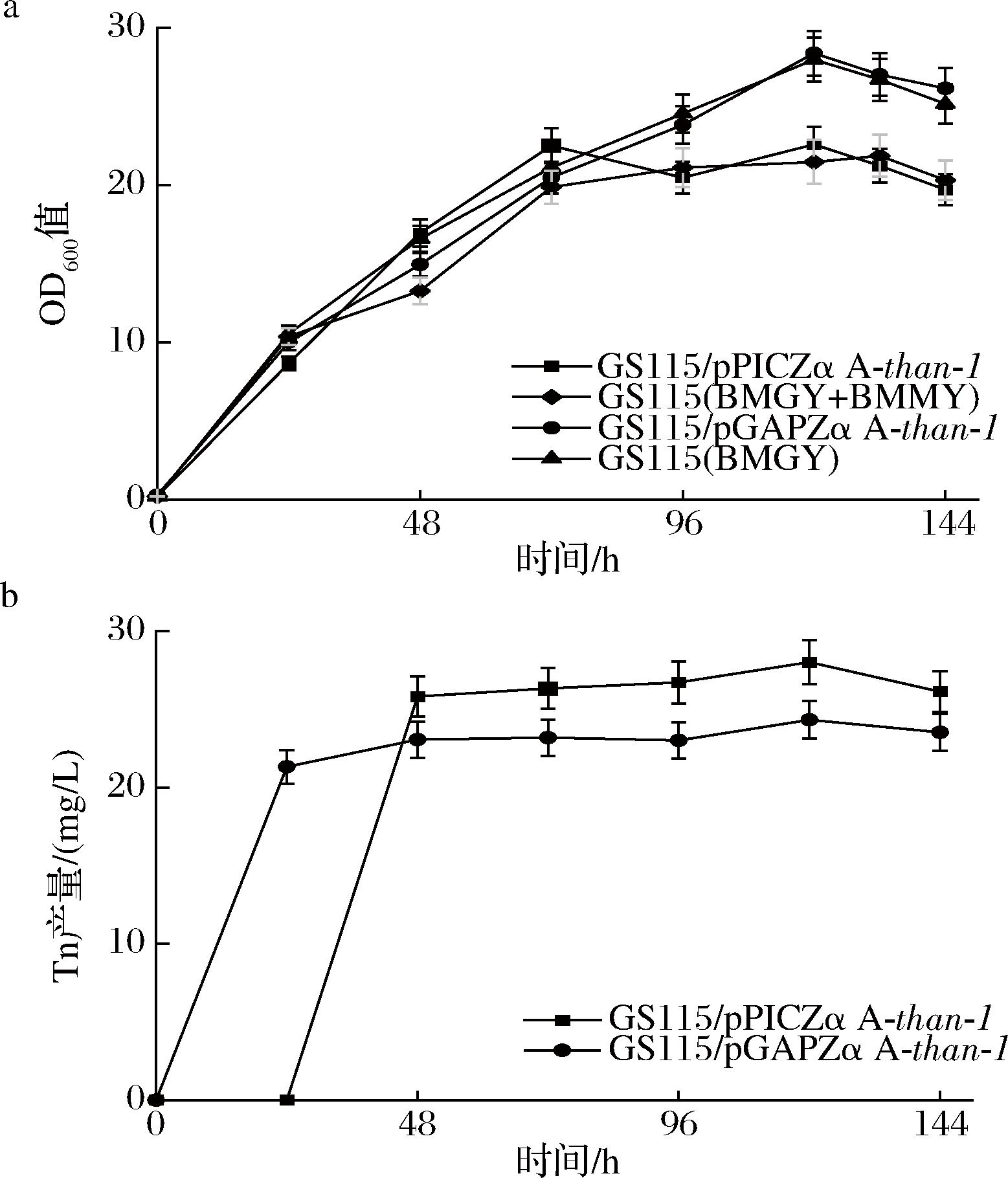
a-生长曲线;b-Tn产量
图3 不同菌株的生长曲线及Tn产量
Fig.3 The growth curve and Tn yield of different hosts
然后比较不同菌株间Tn合成量差异。由图3-b可知,GS115/pGAPZα A-than-1和GS115/pPICZα A-than-1既有相似之处又具有差异。两者均在发酵120 h后Tn产量达到峰值,GS115/pPICZα A-than-1的最高产量为28.03 mg/L,而GS115/pGAPZα A-than-1的产量为24.34 mg/L,较前者低3.69 mg/L。因此这2种菌株具备Tn生产潜力,且高于报道最高水平[11]。
2.3 Tn的抗菌活性
为检测Tn对C.sakazakii的抗菌活性,将纯化后的Tn与C.sakazakii孵育培养12 h,测定C.sakazakii的OD600值,计算抑菌率。如图4所示,Tn对2种指示菌均具有抑菌作用。当Tn初始质量浓度为40 mg/L时,对BAA-894的抑菌率达到89.14%;Tn质量浓度达80 mg/L时,抑菌率达到98.49%。显示Tn可有效抑制C.sakazakii生长。本研究抑菌模型中C.sakazakii细胞密度远高于乳品加工车间,具有较好的代表性。
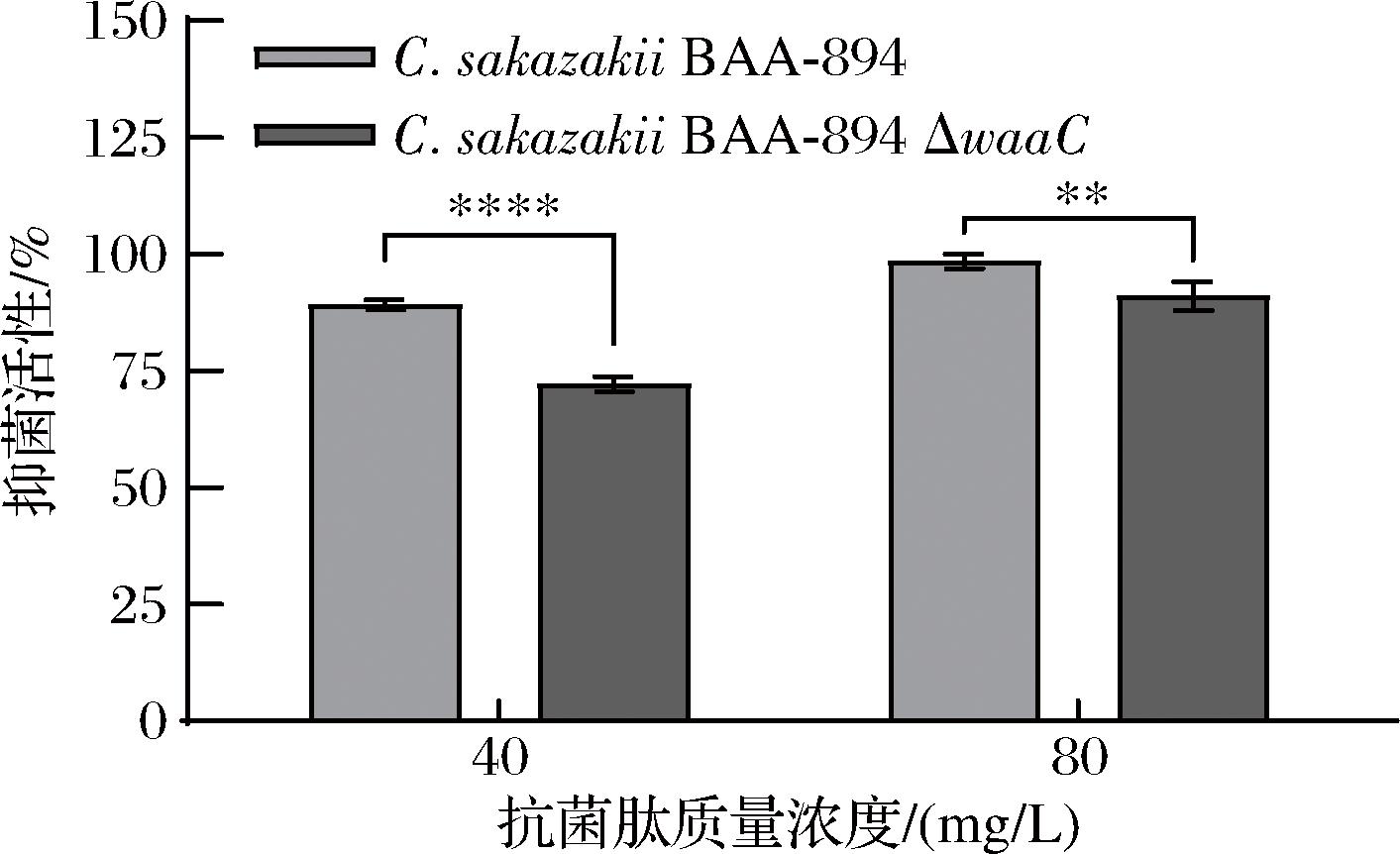
图4 不同浓度Tn对C.sakazakii BAA-894和C.sakazakii BAA-894ΔwaaC抑菌活性
Fig.4 The antibacterial activity of different Tn concentrations against C.sakazakii BAA-894 and ΔwaaC
注:**表示P<0.01;****表示P<0.000 1。
值得注意的是,当指示菌株变成ΔwaaC后,40 mg/L Tn抑菌率为72.15%,较指示菌株为BAA-894时降低了16.99%;Tn为80 mg/L时,抑菌率为91.01%,较BAA-894降低了7.48%,二者存在显著性差异。抗菌肽Tn对C.sakazakii BAA-894杀菌作用大于其LPS突变菌株ΔwaaC,这很可能与Tn的杀菌靶标有关。据报道Tn杀菌过程的关键是改变细胞外膜结构,LPS是革兰氏阴性菌细胞壁分布数以百万计的大分子,覆盖着细胞外壁85%以上表面积,因此LPS的结构改变将影响细胞外壁的理化性质,导致Tn与细胞外壁的结合效率发生改变。
LPS的结构模型如图5所示,BAA-894的LPS结构拥有完整的核心多糖,包括内核心糖与外核心糖两部分[15]。内核心糖与类脂A相连,而外核心糖直接与O-抗原部分相连,核心多糖链上有带负电荷的磷酸基团。而ΔwaaC由于庚糖基转移酶Ⅰ(WaaC)缺失,无法将第一个庚糖转移到Kdo2-lipid A上[17],因此丢掉了绝大部分亲水性的糖链,使荷电性大大降低,这势必影响了Tn与LPS分子相互结合[18]。因为Tn是阳离子肽,与C.sakazakii BAA-894的LPS多糖链磷酸基团(带负电荷)相互作用[19],发挥抗菌作用。而ΔwaaC中这一过程极可能被削弱,因此表现出较低的抑菌率。这是关于LPS结构突变影响Tn杀菌率的首次研究报道,该作用机制有待进一步研究。
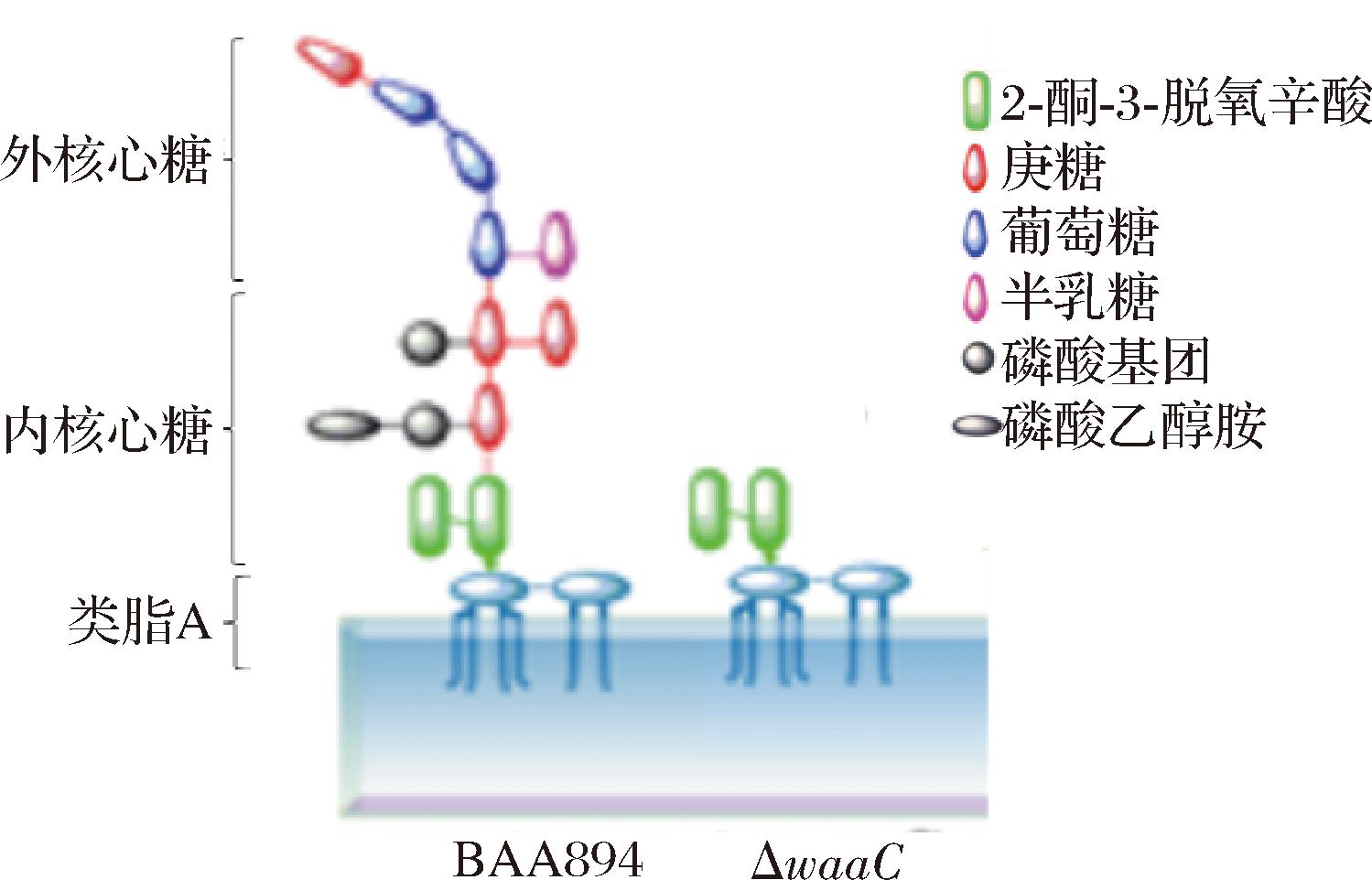
图5 C.sakazakii BAA-894及其突变体ΔwaaC的LPS结构模型
Fig.5 A model of LPS structure of C.sakazakii BAA-894 and its mutant ΔwaaC
据报道,25 000 mg/L的乳酸链球菌素nisin对阪崎肠杆菌没有显著抑菌活性[20],本研究预实验也得到了印证(数据未显示)。相较之下,80 mg/L的Tn即可实现高效抑制,表明Tn对C.sakazakii具有较强杀菌作用。未来研究需进一步解析Tn与更多LPS突变体的结合效率和杀菌效率,并评估其在食品应用中的稳定性与安全性。
3 结论
本研究针对P.pastoris GS115菌株,使用2种强启动子pGAPZα A和pPICZα A,表达了具有活性的Tn。结果显示,在相同培养条件下,GS115/pPICZα A-than-1、GS115/pGAPZα A-than-1生长不受影响。发酵120 h后,GS115/pPICZα A-than-1发酵上清液中Tn最大含量为28.03 mg/L,而GS115/pGAPZα A-than-1的最高水平为24.34 mg/L。
经His-tag亲和层析浓缩后,80 mg/L Tn对C.sakazakii BAA894生长抑制率达到98.49%,而相同浓度下对BAA894ΔwaaC生长抑制率为91.01%,较BAA894降低了7.48%,证实Tn的作用靶标与脂多糖的核心多糖和O-抗原有关。
[1] MULLANE N R, MURRAY J, DRUDY D, et al.Detection of Enterobacter sakazakii in dried infant milk formula by cationic-magnetic-bead capture[J].Applied and Environmental Microbiology, 2006, 72(9):6325-6330.
[2] NAZAROWEC-WHITE M, FARBER J M.Enterobacter sakazakii:A review[J].International Journal of Food Microbiology, 1997, 34(2):103-113.
[3] CHEN S S, CHEN S, WANG J L, et al.Characterization of a gene cluster containing four genes relevant to biosynthesis of inner core of lipopolysaccharide in Cronobacter sakazakii[J].Biotechnology and Applied Biochemistry, 2022, 69(3):1080-1093.
[4] FOLCH J, LEES M, SLOANE STANLEY G H.A simple method for the isolation and purification of total lipides from animal tissues[J].Journal of Biological Chemistry, 1957, 226(1):497-509.
[5] MAHLAPUU M, HÅKANSSON J, RINGSTAD L, et al.Antimicrobial peptides:An emerging category of therapeutic agents[J].Frontiers in Cellular and Infection Microbiology, 2016, 6:194.
[6] HANEY E F, STRAUS S K, HANCOCK R E W.Reassessing the host defense peptide landscape[J].Frontiers in Chemistry, 2019, 7:43.
[7] FEHLBAUM P, BULET P, CHERNYSH S, et al.Structure-activity analysis of thanatin, a 21-residue inducible insect defense peptide with sequence homology to frog skin antimicrobial peptides[J].Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(3):1221-1225.
[8] WU Z Y, LI Y R, ZHANG L, et al.Microbial production of small peptide:Pathway engineering and synthetic biology[J].Microbial Biotechnology, 2021, 14(6):2257-2278.
[9] TIAN L, ZHANG D, SU P, et al.Design, recombinant expression, and antibacterial activity of a novel hybrid Magainin-thanatin antimicrobial peptide[J].Preparative Biochemistry &Biotechnology, 2019, 49(5):427-434.
[10] UNVER Y, DAGCI I.Komagataella phaffii (Pichia pastoris) as a powerful yeast expression system for biologics production[J].Frontiers in Bioscience, 2024, 16(2):19.
[11] PIPIYA S O, KUDZHAEV A M, MIRZOEVA N Z, et al.Bioengineering the antimicrobial activity of yeast by recombinant thanatin production[J].Antibiotics, 2023, 12(12):1719.
[12] WU G Q, LI X F, FAN X B, et al.The activity of antimicrobial peptide S-thanatin is independent on multidrug-resistant spectrum of bacteria[J].Peptides, 2011, 32(6):1139-1145.
[13] LIU S, WANG W J, DENG L L, et al.Control of sour rot in citrus fruit by three insect antimicrobial peptides[J].Postharvest Biology and Technology, 2019, 149:200-208.
[14] CHEN L, COLEMAN W G Jr.Cloning and characterization of the Escherichia coli K-12 rfa-2 (rfaC) gene, a gene required for lipopolysaccharide inner core synthesis[J].Journal of Bacteriology, 1993, 175(9):2534-2540.
[15] RAETZ C R H, WHITFIELD C.Lipopolysaccharide endotoxins[J].Annual Review of Biochemistry, 2002, 71:635-700.
[16] WANG L, HU X, TAO G, et al.Outer membrane defect and stronger biofilm formation caused by inactivation of a gene encoding for heptosyltransferase Ⅰ in Cronobacter sakazakii ATCC BAA-894[J].Journal of Applied Microbiology, 2012, 112(5):985-997.
[17] KADRMAS J L, RAETZ C R.Enzymatic synthesis of lipopolysaccharide in Escherichia coli.:Purification and properties of heptosyltransferase Ⅰ[J].The Journal of Biological Chemistry, 1998, 273(5):2799-2807.
[18] SINHA S, BHATTACHARJYA S.NMR structure and localization of the host defense peptide ThanatinM21F in zwitterionic dodecylphosphocholine micelle:Implications in antimicrobial and hemolytic activity[J].The Journal of Membrane Biology, 2022, 255(2-3):151-160.
[19] SINHA S, ZHENG L Z, MU Y G, et al.Structure and interactions of a host defense antimicrobial peptide thanatin in lipopolysaccharide micelles reveal mechanism of bacterial cell agglutination[J].Scientific Reports, 2017, 7:17795.
[20] LEE S Y, JIN H H.Inhibitory activity of natural antimicrobial compounds alone or in combination with nisin against Enterobacter sakazakii[J].Letters in Applied Microbiology, 2008, 47(4):315-321.