八宝豆豉是中国著名调味食品之一,其制作历史悠久,早在公元19世纪初,山东沂州府的垛庄民间就流传着制作豆豉的技艺。20世纪80年代后,临沂惟一斋酱园收集了各地制作豆豉的名师技艺和配方,并在实践中不断加以研究改进,终于研制成独具一格的具有临沂特色风味的豆豉产品[1-2]。八宝豆豉由8种原料(黑豆、茄子、鲜姜、杏仁、花椒、紫苏叶、香油和白酒)经前发酵(制曲)和后发酵而成,8种原料搭配精妙,不仅能产生令人愉悦的风味,还产生了多种生物活性物质,包括蛋白质、维生素、谷氨酸、赖氨酸、天门冬氨酸等营养成分[3],食用后可起到温中健脾、益气补肾、滋补润燥、舒筋活络的保健功能[4],故称之为“八宝”。因其具备营养丰富、醇厚清香、食用方便等特点,八宝豆豉成为了享誉中外的地方名吃。
作为一种典型的细菌发酵食品,八宝豆豉在制曲后需要经过2~3年基于细菌菌群的协同发酵,才能降解生物大分子以产生独特的风味和活性物质。然而,在豆豉后发酵风味形成过程中食盐添加量直接关系到发酵是否成功,影响着产品的最终品质[5]。食盐常常被应用在食品发酵中,它与食物的发酵速率以及滋味和风味密切相关[6]。KIM等[7]在研究食用盐添加量与蚕豆酱发酵品质关系时,发现盐度越低苦味越高。除此之外,在传统郫县豆瓣酱研究中,LI等[8]发现低盐制备豆瓣酱在发酵结束时检测到的菌落总数最高并伴随着明显的酸味。食用盐可能是驱动产品发酵过程中微生物动力学的主要环境因素,可以提供渗透压抑制食源性腐败微生物的生长,适当地摄入食用盐有益于维持人体血液酸碱平衡[9]。同时,盐含量关系到豆豉保鲜防腐、酸化、调味、色泽和结构等特性[10]。然而,过高的盐分摄入会引发高血压、心脑血管疾病等[11-12],因而减少食用盐摄入量已被重点列入安全饮食指导方针中[13],世界卫生组织(World Health Organization,WHO)明确建议成年人每日食盐摄入量应少于5 g[14]。另外,从行业发展的角度考虑,八宝豆豉制作过程中的高盐环境不仅抑制腐败细菌的生长,还会抑制自然环境中其他有益微生物的生长代谢,因而自然发酵的八宝豆豉需要较长的生产周期,这也极大地限制了豆豉产业的发展。因此,对传统八宝豆豉进行减盐工艺优化已迫在眉睫。
减盐工艺是腌制类发酵食品面临的主要难题,关系到产品的理化特性、质构特性、贮藏特性和风味特征等的改变[5]。发酵过程中盐度降低可能会影响食品的色泽、鲜味,严重时会导致食物发酵失败,甚至出现食品安全问题[15]。因而,如何在不影响八宝豆豉风味品质的情况下降低食用盐含量,并保证其食品安全性[16]是目前八宝豆豉发酵工艺研究的重中之重。为了更安全合理地优化八宝豆豉的减盐工艺,本研究分析了不同盐度下八宝豆豉发酵过程中细菌微生物多样性,通过感官评价获知不同盐度下八宝豆豉的基本风味变化,并通过高通量测序技术精准获知不同盐度处理不同发酵时期八宝豆豉样品中细菌微生物群落动态变化情况,并结合多种统计学方法分析减盐处理方式与各指标间的内在联系,为进一步探究腐败微生物与盐含量的关系提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
样品制作所需的黑豆、茄子、鲜生姜、鲜花椒、紫苏叶、杏仁、芝麻油、食盐、白酒(65%酒精度)均购买于当地大润发超市。
实验中所用到的试剂主要为:琼脂糖(分析纯),索莱宝生物科技有限公司;氢氧化钠(分析纯),北京陆桥技术股份有限公司;E.Z.N.A.®Stool DNA Kit试剂盒,美国SDB公司;QuantiFluorTM-ST蓝色荧光定量系统,Promega公司;AxyPrepDNA凝胶回收试剂盒,AXYGEN公司;Tris-HCl洗脱液,索莱宝生物科技有限公司;TruSeqTM DNA Sample Prep Kit,美国Illumina公司。
1.2 仪器与设备
WTB5003电子分析天平,杭州万特衡器有限公司;LDZX-50KBS精立式高压蒸汽灭菌锅,上海申安医疗器械厂;500 mL发酵罐,长胜器械制造厂;GeneAmp 9700 PCR仪,赛默飞科技公司;恒湿恒温发酵箱,上海析牛莱伯仪器有限公司;HWS-24电热恒温水浴锅,上海一恒科学仪器公司;GL-88B涡旋仪,其林贝尔仪器制造有限公司;灭菌超净工作台,郑州安晟科学仪器有限公司;超纯水工作系统,上海芷昂仪器有限公司;T6-1650E紫外分光光度计,北京普析仪器公司;Pico-21台式离心机,Thermo Fisher公司;DYY-60C电泳仪,北京六一仪器厂;FR-1000凝胶成像仪,上海复日科技有限公司;QuantiFluorTM-ST蓝色荧光定量系统,Promega公司;®FlavorSpec顶空-气相色谱-离子迁移谱(headspace-gas-chromatogram phyion-mobility spectrometry,HS-GC-IMS),山东海能科学仪器有限公司。
1.3 实验方法
1.3.1 样品制作及取样
八宝豆豉实验样品的制作包含了辅料(茄子、生姜、鲜花椒、紫苏叶、杏仁)的腌制、主料(黑豆)的制曲和混料3个主要步骤。首先,在盐度均低于商业八宝豆豉(30%~33%,质量分数)的情况下,制备了3种不同氯化钠添加量(A:100 g/L、B:150 g/L、C:200 g/L)处理的茄子、生姜等辅料,密封保存,共腌渍14 d备用。以市售高盐样品为对照组(D)。黑豆清洗干净后入锅煮制,待豆子变软后盛出,沥干水分之后,趁余温未散去时立即使用干净的笼布包裹。将所有煮好的黑豆制曲发酵7 d左右。再与盐渍完成的3批不同盐度茄子等辅料分别混合,加入等量的香油以及高度白酒,混匀放置在发酵罐中,发酵3个月。
使用超净工作台收集3种不同盐度的八宝豆豉(A、B、C)样品。设置采样时间分别为后发酵的第0、15、30、45、60、75、90天。每次采集40 g样品,并将样本放入50 mL无菌冻存管中。为了消除偶然因素和保证实验的合理性,取样时,将罐子中的样品充分混合均匀后再取样,以此作为各个发酵阶段的代表性样品。最后,将所有的豆豉样品贴好标签后,保存在-80 ℃冰箱中作为实验的待测样,样本名称如表1所示。
表1 不同盐度八宝豆豉样本名称
Table 1 Sample names of Ba-bao douchi with different salinities

盐度发酵时间第0天第15天第30天第45天第60天第75天第90天A(100g/L)A0A1A2A3A4A5A6B(150g/L)B0B1B2B3B4B5B6C(200g/L)C0C1C2C3C4C5C6
1.3.2 感官评定
采集发酵90 d的不同盐浓度八宝豆豉样本,以发酵90 d的临沂市“惟一斋”酱园的八宝豆豉作为对照组,由10名受过集中训练的临沂大学学生(5男5女)组成的感官评定小组进行评定,采用盲评计分的方式对八宝豆豉的滋味(30分)、风味(20分)、色度(20分)、组织状态(30分)进行评分(满分为100分)。
1.3.3 微生物多样性分析
采用液氮研磨法对2 g八宝豆豉样本仔细研磨后,称取微量样品,并用试剂盒提取样本中细菌总DNA。琼脂糖凝胶电泳检测DNA定量。PCR扩增选用正向引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和反向引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)对样品基因组序列V3~V4可变区进行扩增。PCR试验采用Pro Taq,20 μL反应体系:2×Pro Taq 10 μL;Forward Primer(5 μmol/L) 0.8 μL;Reverse Primer(5 μmol/L) 0.8 μL;Template DNA 10 μL;补双蒸水(ddH2O)至20 μL。PCR反应参数:95 ℃、3 min;94 ℃、20 s,55 ℃、20 s,72 ℃、30 s,30个循环;72 ℃、5 min,全部样本均重复3次。PCR扩增产物使用QuantiFluorTM-ST蓝色荧光定量系统进行检测定量,采用质量分数为2%的琼脂糖凝胶电泳检测DNA完整性,确定PCR产物目的条带大小正确,浓度合适,3 μL上样检测。
1.3.4 风味物质分析
采用HS-GC-IMS测定了不同处理组八宝豆豉发酵90 d挥发性有机物的变化。取1 g样品称重,置于20 mL顶空瓶中。样品在60 ℃下孵育15 min。进样量300 μL,孵育速度500 r/min,注射针温度85 ℃。色谱条件:柱型CPC-PAL (15 m×0.53 mm, 1.0 μm),柱温60 ℃。色谱运行时间为30 min,进样温度为80 ℃。IMS条件:迁移管长度为53 mm,迁移管温度为45 ℃,迁移管内电场强度为500 V/cm。流速为150 mL/min。漂移气体为高纯氮气。
1.4 数据处理
根据overlap关系将得到的PE reads拼接,对所有序列进行质量监控,按照97%的相似性进行操作分类单元(operational taxonomic units,OTU)聚类分析和物种分类学分析。基于以上分析所得结果再对各水平群落结构统计。OTU聚类算法所用软件Uparse 11(http://www.drive5.com/uparse/),统计软件Usearch 11(http://www.drive5.com/usearch/);BLAST比对注释分类;采用R语言(V 4.3.3)绘制韦恩图、稀释曲线、香农指数曲线、层级聚类图、相关性分析、热图分析和偏最小二乘法路径模型(partial least squaves path modeling,PLS-PM)分析;采用Origin Pro(V 2024)绘制柱形图。
2 结果与分析
2.1 感官评定分析
在同一发酵时间下(90 d),低盐组(A、B、C)与市售高盐组(D)的八宝豆豉感官评价结果如图1所示。对于八宝豆豉制品,4种感官的重要程度依次为组织状态、滋味、风味、色度。不同含盐度八宝豆豉的组织状态呈现出B>A>C>D的趋势,这是由于含盐量高低可以直接影响八宝豆豉的发酵周期,高含盐量抑制多种微生物生长繁殖,导致生物大分子降解不均匀,组织状态呈现出质地硬、不软烂的特点。与此同时八宝豆豉的滋味受食盐和微生物代谢产物的协同影响,不同含盐量八宝豆豉的滋味呈现出B>C>A>D的趋势。对于八宝豆豉的风味和色度,分别C组和D组的得分最高。综上,低盐发酵组A、B、C均呈现出较好的感官品质,为了明晰其微生物安全性,后续对其微生物多样性进行进一步解析。
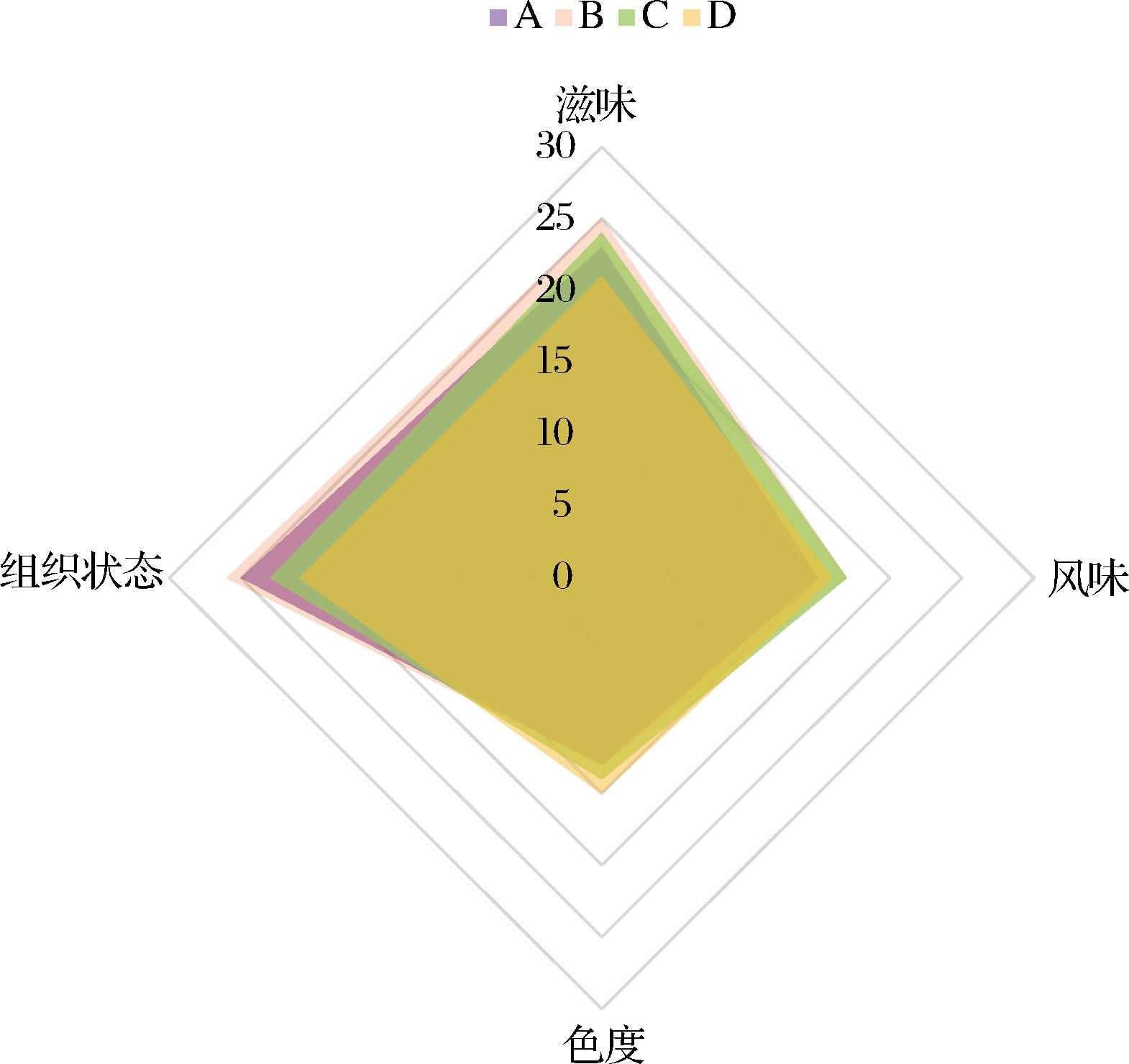
图1 减盐发酵和高盐发酵八宝豆豉的感官评定雷达图
Fig.1 Sensory evaluation radar map of Ba-bao douchi in reduced salt fermentation and high salt fermentation
2.2 不同盐度在不同发酵过程下OTU种类分析
对于不同发酵阶段八宝豆豉减盐发酵样品进行测序后,共获得了840 777条有效序列。序列长度分布在401~440 bp。为了解减盐后八宝豆豉样本中的微生物群落信息,对样本相似水平在97%以上所有OTU有效序列进行Venn分析(图2)。结果显示,八宝豆豉不同发酵阶段的减盐组(A、B和C)共有OTU有50种,A组独有OTU有26种、B组独有OTU有7种、C组独有OTU有6种。A组7个不同发酵时期的物种数量依次为58、50、30、38、41、38、30个(图2-B),B组7个时期分别为43、50、27、39、33、44、34个(图2-C),C组7个时期分别为39、37、41、37、37、33、39个(图2-D)。在3个不同盐度的发酵过程中有50个物种是共有的。综上,在八宝豆豉发酵过程中盐度越低,其微生物群落的复杂性和特殊性越高,当盐度为100 g/L时,八宝豆豉的微生物多样性最高,其次为盐度150、200 g/L。
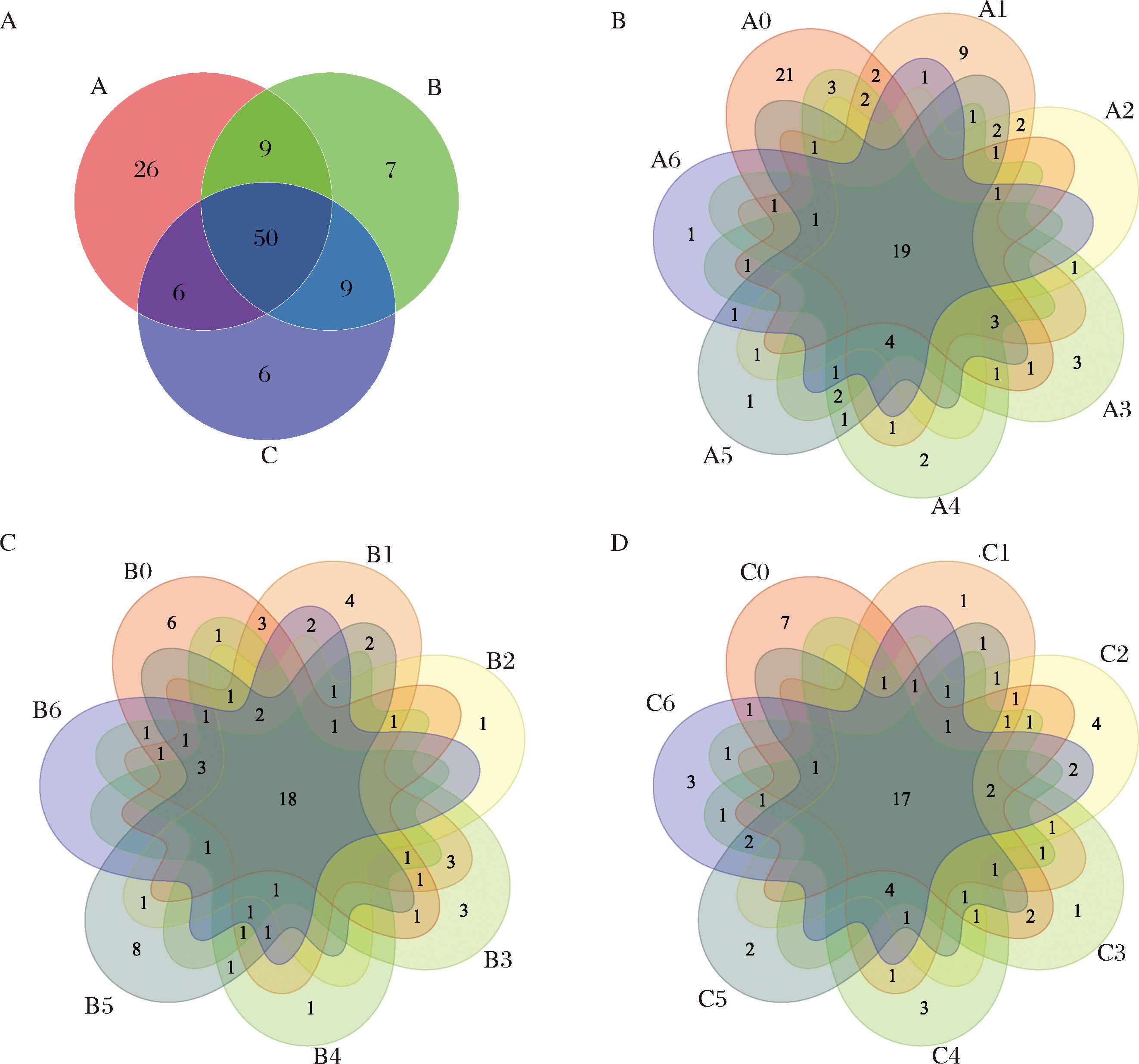
A-减盐样本组间物种数目;B-A组样本物种数目;C-B组样本物种数目;D-C组样本物种数目
图2 不同盐度发酵过程中八宝豆豉样本OTU数目韦恩图分析
Fig.2 Venn plot of the number of OTU in the Ba-bao douchi with different salt concentrations
2.3 不同盐度对八宝豆豉发酵过程中微生物菌群α多样性的影响
为了判断本次测序数据量是否足够,从样本中随机抽取一定数量的序列,统计这些序列对应样本的α多样性指数,以抽取的数据量为横坐标,以α多样性指数值为纵坐标绘制曲线,若曲线达到平缓说明数据量准确[17]。同时,也可以根据OTU水平的Sobs指数、Simpson指数、Shannon指数和Coverage指数是否达到平缓判断样品的测序量能否代表整个样本细菌多样性的信息。由图3可知,不同发酵时期不同的减盐八宝豆豉样本随着测序量的不断扩大,OTU数目没有发生明显的变化,稀释曲线趋近于平缓,说明本次测序几乎覆盖样本中全部细菌,测序量可以代表整个样本细菌多样性的信息。

A-Sobs指数;B-Simpson指数;C-Shannon指数;D-Coverage指数
图3 不同发酵时间下减盐发酵八宝豆豉样品的稀释性曲线
Fig.3 Dilution curves of Ba-bao douchi fermented with reduced salt fermentation in different fermentation time
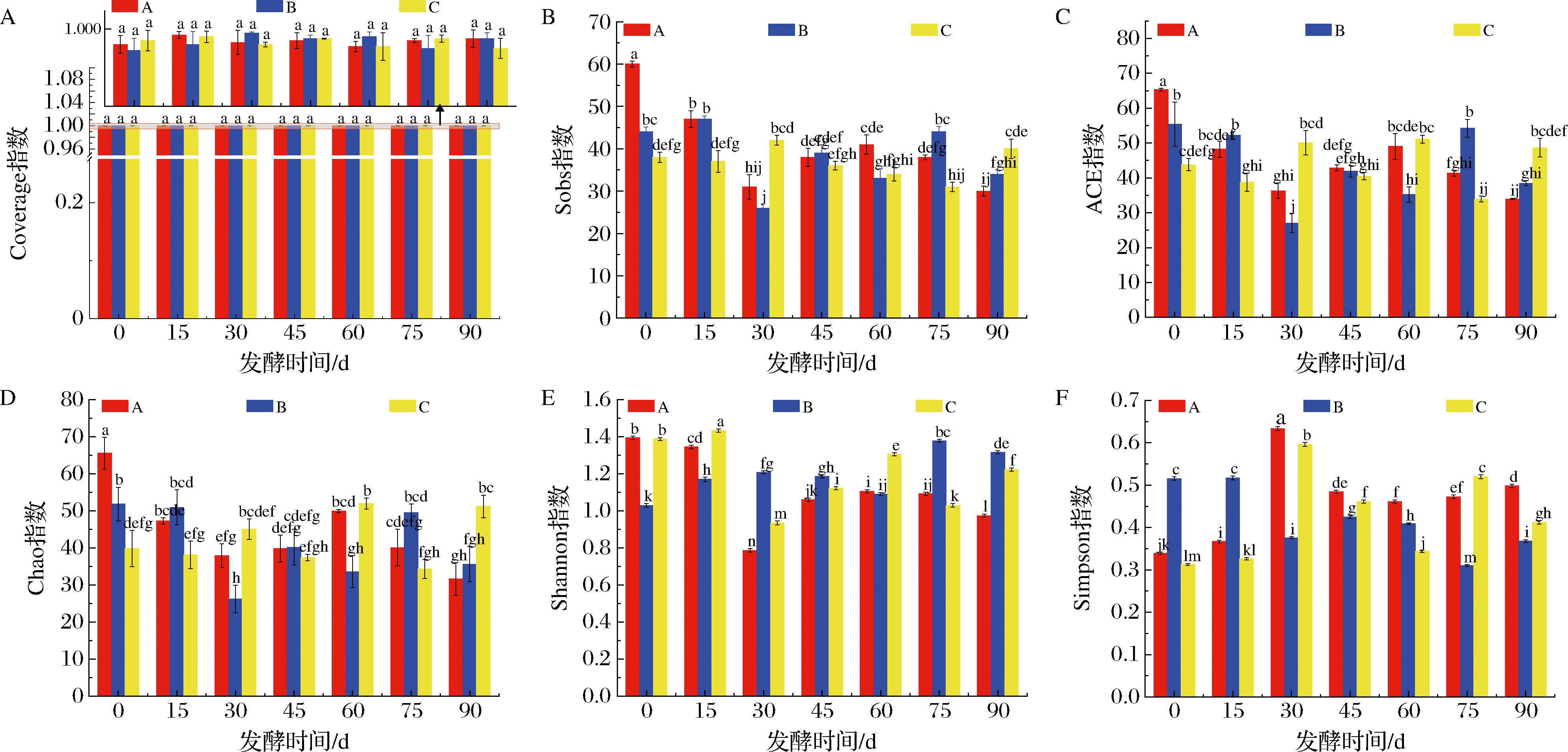
A-Coverage指数;B-Sobs指数C-ACE指数;D-Chao指数;E-Shannon指数;F-Simpson指数
图4 不同发酵时间下减盐发酵八宝豆豉中微生物菌群的α多样性指数变化
Fig.4 Change of α diversity indexes of microbial community in Ba-bao douchi fermented with reduced salt fermentation at different fermentation time
注:不同小写字母表示差异显著(P<0.05)(下同)。
α多样性指数是分析八宝豆豉样本中微生物群落的丰富度和多样性的重要指标,度量标准主要有Coverage指数、Sobs指数、ACE指数、Chao指数、Shannon指数和Simpson指数。由图4-A可知,每个八宝豆豉样本的Coverage指数均接近1,表明高通量测序结果的覆盖程度较高,测得的微生物菌群结果真实,样品序列检测结果稳定。Sobs指数可以通过数值大小(OTU数)直观地观测样本的微生物丰富度,结果显示,100 g/L低盐发酵组(A)在发酵初始阶段具有最高的OTU种类数,随着发酵时间的延长,在发酵75 d后,150 g/L低盐发酵组(B)的微生物菌群丰富度达到最高,经过90 d发酵后,200 g/L低盐发酵组(C)的丰富度达到最高(图4-B)。Chao指数和ACE指数是用来描述群落丰富度的,这2个指数越大,代表对应群落的丰富度就越高[18]。由图4-C和图4-D可知,样品A组的群落丰富度大小为A0>A4>A1>A3>A5>A6>A2。样品B组的群落丰富度大小为B0>B5>B1>B3>B6>B4>B2。A组样品和B组样品的Chao指数和ACE指数在A0和B0时期的丰富度最高。在A2和B2时期群落的丰富度最低。A组样品和B组样品的Chao指数和ACE指数呈现先下降后上升再下降的趋势,说明盐度为100和150 g/L时,八宝豆豉中的细菌群落丰富度是先减少后增加然后再减少。C组样品的群落丰富度大小为C4>C6>C2>C0>C3>C1>C5。C组样品在整个发酵过程中呈现出的群落丰富度是先上升后下降再次上升后下降的趋势,细菌菌落丰度在C4时期达到物种丰度最大时期。Shannon指数和Simpson指数通常被用来描述物种群落多样性,一般来讲,Shannon指数越高代表被测样本群落有着较高的多样性[19]。相反,在分析Simpson指数时,数值越低代表群落多样性越低[20]。如图4-E和图4-F所示,样品A的群落多样性呈现为A0>A1>A4>A5>A3>A6>A2。样品A在初期群落多样性最高,之后呈现出下降的趋势。样品B的群落多样性呈现为B5>B6>B2>B3>B1>B4>B0。B组样本在发酵75 d时群落多样性指数最高。样品C的群落多样性呈现为C1>C0>C4>C6>C3>C5>C2。样品C在发酵第15天时,群落多样性最高而后逐渐降低趋于稳定。同时,Simpson指数呈现与之相反的变化,说明了八宝豆豉在不同发酵时期群落的多样性变化不同。综上,相同的发酵条件下,在不同盐度八宝豆豉样本中,发酵前期细菌的多样性最高,而后出现下降趋势直至后期逐渐趋于一种稳定的状态。
2.4 不同盐度对八宝豆豉发酵过程中微生物群落组成的影响
盐度高低直接影响了发酵制品中微生物的群落组成,并最终影响产品的感官特质和发酵周期。因此,本研究对八宝豆豉不同盐度添加下发酵过程中的微生物种类进行图谱分析,基于门水平不同盐度八宝豆豉各发酵时期相对丰度(相对丰度>0.1%)如图5所示,检测到不同发酵时期的菌门为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝菌门(Cyanobacteria)、拟杆菌门(Bacteroidota)和放线菌门(Actinobacteriota)。100 g/L盐度组和200 g/L盐度组在发酵初期(A0和C0)具有相似的优势微生物菌门(变形菌门和蓝菌门),除此之外,其他发酵组别的优势微生物菌门为变形菌门和厚壁菌门。在盐度较低的情况下,变形菌门的相对丰度一直处于比较高的状态。由此可见,在八宝豆豉发酵中,变形菌门和厚壁菌门对八宝豆豉的代谢产物生成起到了关键作用。
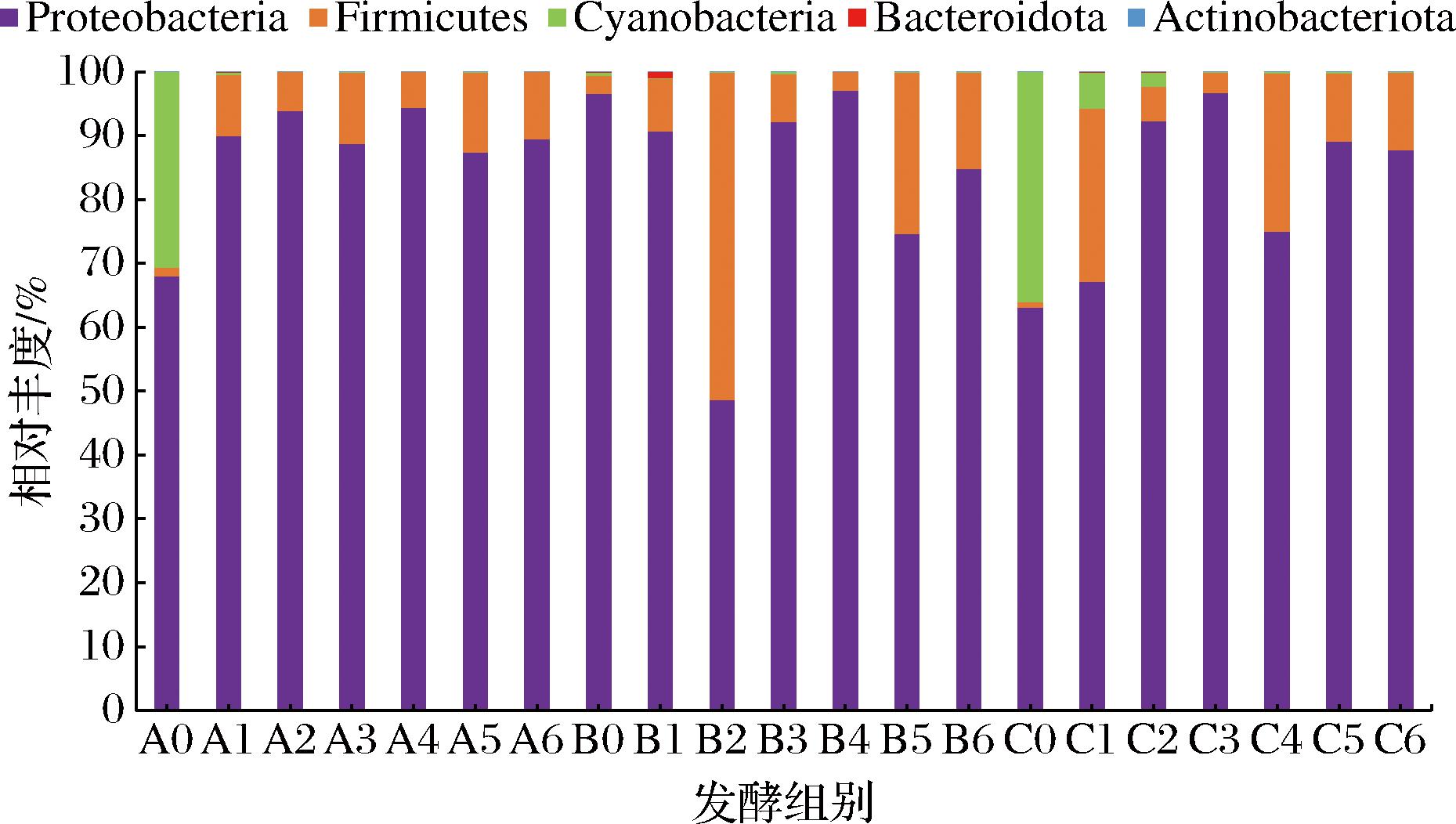
图5 基于门水平不同盐度八宝豆豉发酵过程中细菌群落组成
Fig.5 Bacterial community composition during the fermentation process of Ba-bao douchi with different salinities at the phylum level
基于属水平的不同盐度八宝豆豉各发酵时期的相对丰度(相对丰度>0.1%)如图6所示,A组样本(100 g/L盐度)中,相对丰度最高的细菌菌属分别为肠杆菌属(Enterobacter)、克罗诺杆菌属(Cronobacter)、芽孢杆菌属(Bacillus)、肠球菌属(Enterococcus)和魏斯氏菌属(Weissella)。B组样本(150 g/L盐度)中,相对丰度最高的细菌菌属分别为肠杆菌属、克罗诺杆菌属、芽孢杆菌属、肠球菌属(Enterococcus)、克雷伯氏菌属(Klebsiella)和嗜麦芽属(Stenotrophomonas)。八宝豆豉C组样本(200 g/L盐度)中,相对丰度最高的细菌菌属分别为肠杆菌属、芽孢杆菌属、克罗诺杆菌属、肠球菌属和克雷伯氏菌属。其中肠杆菌属和克罗诺杆菌属于致病菌属[21],当盐度较低时(100 g/L),其相对丰度达到89%以上,在八宝豆豉的全发酵过程均为主导微生物,对于豆豉发酵的质量和安全会产生不良影响。随着盐度增加至150 g/L,肠杆菌属和克罗诺杆菌相对丰度减少,芽孢杆菌属相对丰度增加,这可能是由于生态位重叠的肠杆菌属与芽孢杆菌属之间存在着相互竞争的关系[22]。肠杆菌属与芽孢杆菌属同在八宝豆豉发酵微环境中,芽孢杆菌属在厚壁菌门中最常见,而肠杆菌属在变形菌门中最常见[23],因此,上述结果与门水平微生物菌门变化结果一致。与此同时,肠球菌属和乳杆菌属(Lactobacillus)等有益微生物菌属的相对含量增加。肠球菌属与乳杆菌属等乳酸菌能够抑制发酵过程中存在的有害微生物生长,同时能够产生游离氨基酸,赋予食品醇厚滋味[24-25]。当盐度为200 g/L时,肠杆菌属和芽孢杆菌属相对丰度增加。芽孢杆菌属在发酵第15天后急剧增加,随后逐渐变成八宝豆豉的优势菌属。其中芽孢杆菌可以在发酵过程中产生大量蛋白酶,与魏斯氏菌属同属于有益菌[26]。

图6 基于属水平不同盐度八宝豆豉发酵过程中细菌群落组成
Fig.6 Bacterial community composition during the fermentation process of Ba-bao douchi with different salinities at the genus level
总体来看,在八宝豆豉发酵过程中,盐浓度改变会引起细菌微生物群落的菌属和丰度的改变,肠杆菌属、克罗诺杆菌和芽孢杆菌属等菌属在减盐八宝豆豉发酵过程中属于主导微生物。
2.5 减盐发酵八宝豆豉中盐度对微生物代谢作用的影响
不同盐度八宝豆豉发酵过程中微生物菌属的聚类热图见图7-A和图7-B,其中,肠杆菌属、克罗诺杆菌属和芽孢杆菌属为八宝豆豉发酵过程中的主导菌属。肠球菌属和乳杆菌属在盐度为150 g/L发酵60 d后,相对丰度显著增加,肠球菌属在盐度为150和200 g/L的八宝豆豉后发酵环境中具有一定的适应性,乳杆菌属只存在于150 g/L盐度组,这可能是由于100 g/L盐度情况下其他菌属抑制乳杆菌属的生长,在200 g/L盐度的情况下盐度抑制乳酸菌属的生长繁殖。进一步根据Pearson相关性分析构建了八宝豆豉中微生物菌属与感官指标间的相关性热图,由图7-C可知,微生物菌属和感官指标之间的相关性系数被分为2个聚类(Cluster)。其中Cluster1由G2、G13、G10、G21、G17、G19、G24、G23、G25、G29、G8、G18、G30和组织状态组成,Cluster2由G6、G15、G7、G11、G1、G20、G32、G12、G14、G4、G5、G9、G35、G22、G3、G16、G26、色度、盐度、风味、滋味组成。
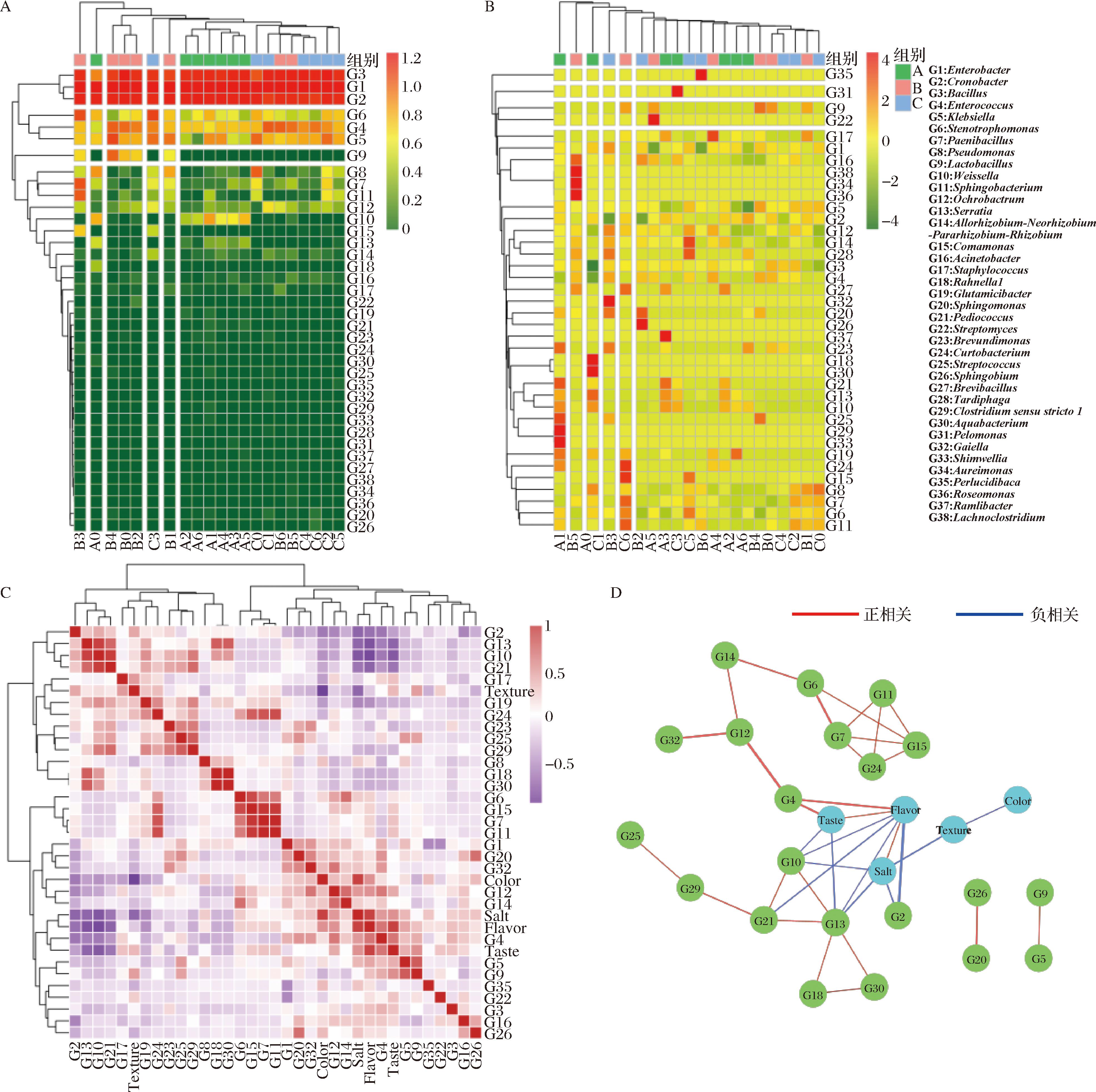
A-不同盐度八宝豆豉发酵过程中微生物菌属的聚类热图;B-不同盐度八宝豆豉发酵过程中微生物菌属行归一化聚类热图;C-八宝豆豉微生物菌属与感官指标间的相关性热图;D-八宝豆豉微生物菌属与感官指标间的相关性网络图
图7 减盐发酵八宝豆豉中盐度对微生物代谢作用的影响
Fig.7 The effect of salinity on microbial metabolism in reduced salt fermentation of Ba-Bao douchi
注:Texture:组织状态;Color:色度;Flavor:风味;Taste:滋味;Salt:盐度。
在八宝豆豉制作过程中发现,减盐处理的八宝豆豉发酵过程中会伴随一些菌丝体和苦味的出现,盐度越低的八宝豆豉中这种异味和菌丝体往往越明显,鲜味明显降低,这也导致大部分的消费者接受度下降。一般来说,食品中的香气成分主要与原料、微生物代谢、酶促反应和非酶促反应条件相关[27-28],筛选微生物菌种人工发酵可以控制豆豉中生物胺的含量,从而间接地提高产品的营养成分[29-30],对保证发酵豆制品的安全性至关重要,使用相关性网络图可有效筛选八宝豆豉风味滋味形成的优势有益菌和有害微生物。以|r|>0.6和P<0.05对相关性热图进行数据过滤并绘制相关性网络图(图7-D),发现盐度不同直接影响组织状态(r=-0.70),并促进风味的形成(r=0.87)。风味和滋味之间有明显的正协同效应,都受到肠球菌属(G4)的直接影响(r=0.63和r=0.62)。G2、G10、G13和G21等菌属抑制八宝豆豉风味的形成,盐度增加可以明显抑制G2、G10和G13的生长繁殖,因而,可以控制盐度的添加以调控影响风味形成的微生物菌属的代谢作用,进一步促进八宝豆豉风味形成。为了确定经过不同处理后八宝豆豉中的主要风味物质,本研究利用HS-GC-IMS测定八宝豆豉中的挥发性风味物质(图8)。
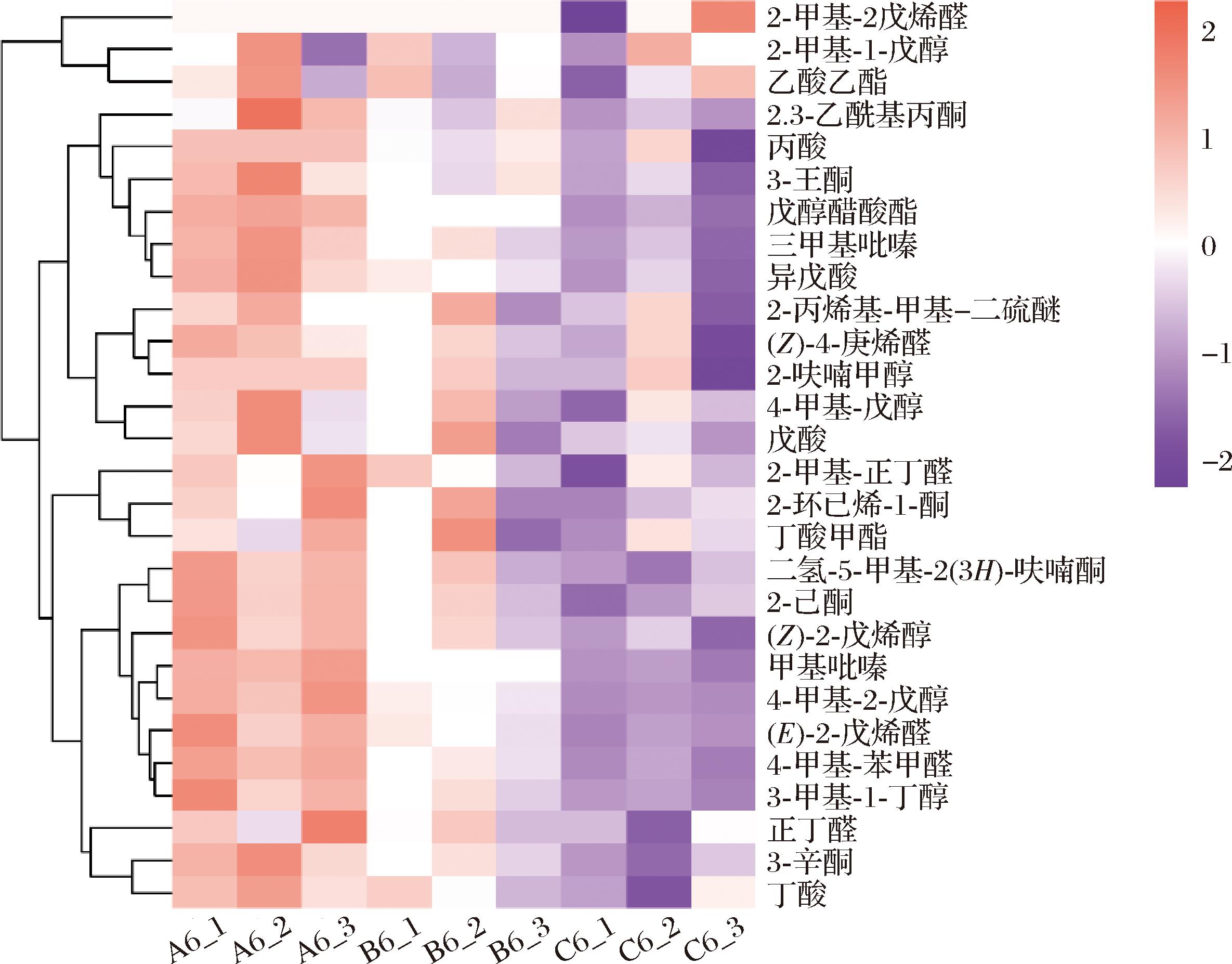
图8 基于HS-GC-IMS分析不同低盐处理方式对八宝豆豉风味物质的影响
Fig.8 Effect of different low salt treatment on flavor substances of Ba-bao douchi based on HS-GC-IMS
共有28种挥发性风味物质被检测到并存在于市售八宝豆豉中,包括3-壬酮、4-甲基-苯甲醛、3-辛酮、二氢-5-甲基-2(3H)-呋喃酮、2-环己烯-1-酮、2-丙烯基-甲基-二硫醚、三甲基吡嗪、(Z)-4-庚烯醛、4-甲基-戊醇、2-甲基-1-戊醇、乙酸乙酯、2-甲基-2戊烯醛、2-己酮、(Z)-2-戊烯醇、3-甲基-1-丁醇、2-呋喃甲醇、戊酸、戊醇醋酸酯、甲基吡嗪、丁酸、异戊酸、4-甲基-2-戊醇、(E)-2-戊烯醛、2-甲基-正丁醛、丁酸甲酯、正丁醛、丙酸和2,3-乙酰基丙酮。盐度降低可显著促进挥发性风味物质的生成,并且150 g/L盐度处理组中具有较高含量的2-环己烯-1-酮、2-丙烯基-甲基-二硫醚、(Z)-4-庚烯醛、4-甲基-戊醇、2-呋喃甲醇、戊酸和丁酸甲酯等物质。
PLS-PM分析可以用于观测多个变量之间的直接、间接、正面、负面的关系,是将主成分分析、相关性分析及多元回归分析进行迭代分析的方法,可以建立因果模型[31]。八宝豆豉处理方式(发酵时间及盐度变化)与感官指标及微生物指标(菌门及菌属)间基于PLS-PM模型呈现结果见图9,该模型拟合优度(goodness of fit,GOF)为0.65,代表构建该模型的内部模型和外部模型对整个模型的平均预测能力是优良的。R2是确定内源性潜变量系数,该值可表征潜变量和观测变量(发酵时间和盐度)之间的解释能力,其中菌属、菌门和感官特性的R2分别为0.40、0.81和0.88,表明其解释程度较好。分析各线型后发现,盐度对感官特性有显著正向直接影响,发酵时间对微生物菌门有负向间接影响。
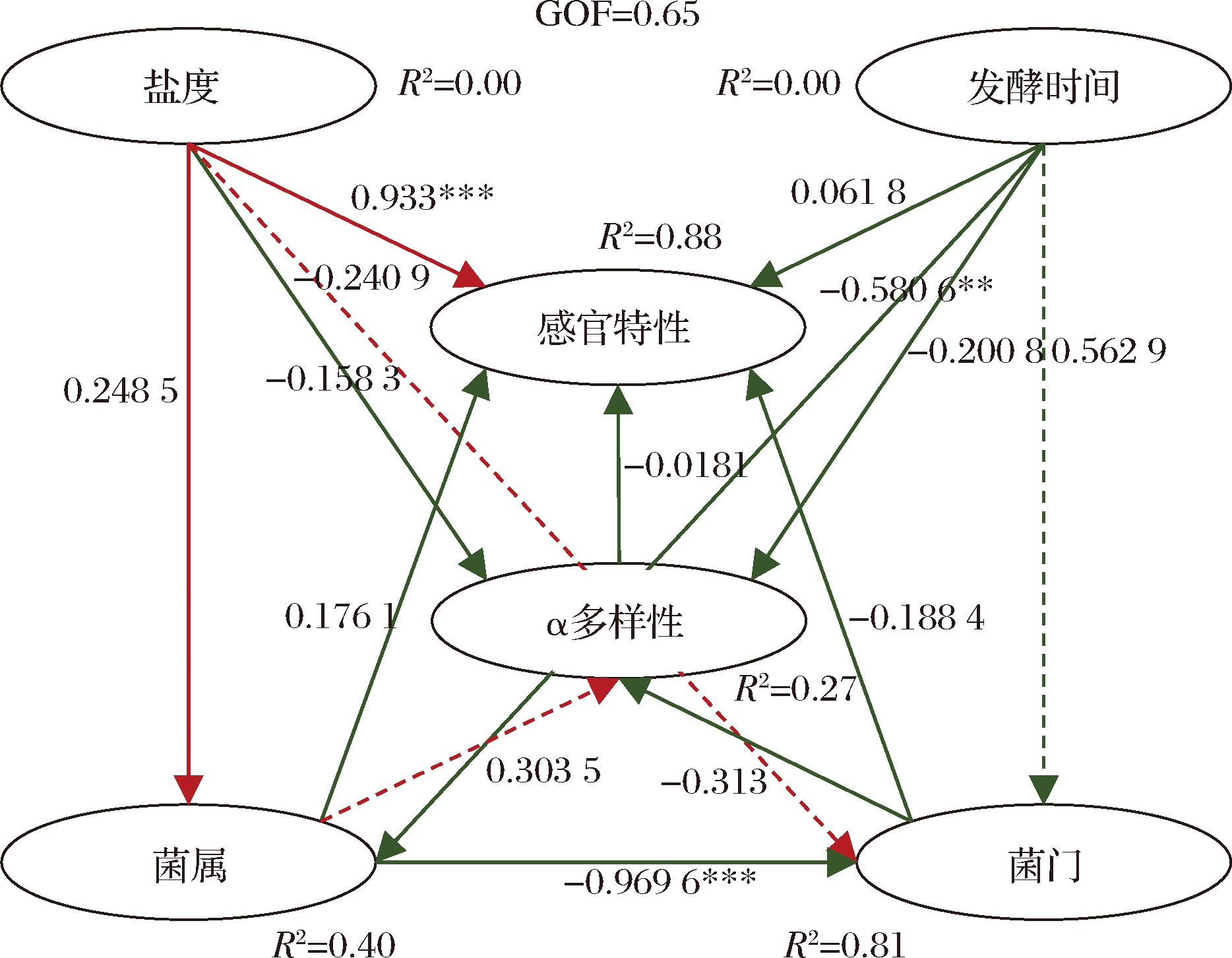
图9 八宝豆豉处理方式与感官指标及微生物指标间基于PLS-PM的路径分析图
Fig.9 Path analysis diagram of the relationship between the treatment of Ba-bao douchi and sensory indexes and microbial indexes based on PLS-PM
注:**表示P<0.01;***表示P<0.001;虚线表示间接影响;实线表示直接效果;红线表示正面影响;绿线表示负面影响。
3 结论
盐度是影响八宝豆豉发酵品质的重要因素之一。适度低盐处理(150 g/L)的八宝豆豉,可有效控制肠杆菌属和克罗诺杆菌等致病菌属的生长,促进肠球菌属和乳杆菌属等乳酸菌的生长。150 g/L盐度处理八宝豆豉具有较高含量的2-环己烯-1-酮、2-丙烯基-甲基-二硫醚、(Z)-4-庚烯醛、4-甲基-戊醇、2-呋喃甲醇、戊酸和丁酸甲酯等挥发性风味物质。然而盐度与组织状态呈现明显的负相关,盐度增加,微生物多样性降低,导致豆豉发酵不彻底或时间不够,因而八宝豆豉组织状态较硬。盐度与风味形成的微生物菌属(克罗诺杆菌、肠杆菌属、魏斯氏菌属)之间生长关系紧密,发酵中需平衡盐度与风味的关系,风味和滋味之间有明显的正协同效应,肠球菌在促进八宝豆豉风味和滋味的形成中起到重要作用。传统高盐发酵豆豉有望向健康、减盐的趋势发展,未来可通过人工培养微生物优势菌种,探索减盐发酵优化工艺。
[1] 郭兰奎.“惟一斋”八宝豆豉[J].中国工商, 1994(4):47.GUO L K.“Unique Zhai” Babao Douchi[J].China Industry and Commerce, 1994(4):47.
[2] 唐汝友,黄秀山,刘振本,等.特制八宝豆豉原料配方加工技术[J].安徽农业科学, 2006, 34(6):1211;1214.TANG R Y, HUANG X S, LIU Z B, et al.Processing technology of raw material formula for special eight-treasure Douchi[J].Journal of Anhui Agricultural Sciences, 2006, 34(6):1211; 1214.
[3] JUNG A R, AHN S H, PARK I S, et al.Douchi (fermented Glycine max Merr.) alleviates atopic dermatitis-like skin lesions in NC/Nga mice by regulation of PKC and IL-4[J].BMC Complementary and Alternative Medicine, 2016, 16(1):416.
[4] ZHANG Y Z, LIN X N, JI Y Q, et al.Characterization and correlation of dominant bacteria and volatile compounds in post-fermentation process of Ba-Bao Douchi[J].Food Research International, 2022, 160:111688.
[5] 芮李彤,李海静,张婷婷,等.食盐对肉制品品质形成的作用及减盐技术研究进展[J].肉类研究, 2022, 36(7):61-67.RUI L T, LI H J, ZHANG T T, et al.Progress in research on the effect of sodium on meat product quality and sodium reduction technologies[J].Meat Research, 2022, 36(7):61-67.
[6] CHEN Q, WANG Y Q, WU Y Y, et al.Investigation of fermentation-induced changes in the volatile compounds of Trachinotus ovatus (Meixiangyu) based on molecular sensory and interpretable machine-learning techniques:Comparison of different fermentation stages[J].Food Research International, 2021, 150:110739.
[7] KIM S S, KWAK H S, KIM M J.The effect of various salinity levels on metabolomic profiles, antioxidant capacities and sensory attributes of doenjang, a fermented soybean paste[J].Food Chemistry, 2020, 328:127176.
[8] LI W L, LIU Y S, YE Y X, et al.Chemical profiling and metabolic mechanism of Pixian doubanjiang, a famous condiment in Chinese cuisine[J].LWT, 2021, 145:111274.
[9] 于海燕,刘新广,李永,等.调味品减盐增鲜的研究进展[J].食品科学, 2023, 44(5):375-382.YU H Y, LIU X G, LI Y, et al.Progress in reducing salt and enhancing umami in condiments[J].Food Science, 2023, 44(5):375-382.
[10] 孙文佳.食盐替代物与乳酸链球菌素在低钠盐郫县豆瓣发酵中的应用研究[D].成都:西华大学,2021.SUN W J.Study on the application of salt substitute and Lactostreptococcus in the fermentation of low sodium Pixian bean[D].Chengdu:Xihua University,2021.
[11] ZHANG T, WANG J, FENG J Q, et al.Ultrasonic pretreatment improves the gelation properties of low-salt Penaeus vannamei (Litopenaeus vannamei) surimi[J].Ultrasonics Sonochemistry, 2022, 86:106031.
[12] GRAUDAL N A, HUBECK-GRAUDAL T, JÜRGENS G.Effects of low-sodium diet vs.high-sodium diet on blood pressure, renin, aldosterone, catecholamines, cholesterol, and triglyceride (Cochrane Review)[J].American Journal of Hypertension, 2012, 25(1):1-15.
[13] 钟宝,彭诚, Youn-Soo Cha.高脂高盐饮食对大鼠醛固酮分泌和高血压的影响[J].营养学报,2021,43(4):384-388.ZHONG B, PENG C, CHA Y S.Effects of high-fat and high-salt diet on aldosterone secretion and hypertension in rats[J].Acta Nutrimenta Sinica,2021,43(4):384-388.
[14] HWANG J, KIM J C, MOON H, et al.Determination of sodium contents in traditional fermented foods in Korea[J].Journal of Food Composition and Analysis, 2017, 56:110-114.
[15] OLAIMAT A N, AL-NABULSI A A, OSAILI T M, et al.Survival and inhibition of Staphylococcus aureus in commercial and hydrated tahini using acetic and citric acids[J].Food Control, 2017, 77:179-186.
[16] 李宁,白莉.中美欧食源性细菌耐药性监测系统比较研究及启示[J].食品科学技术学报, 2023, 41(1):1-9;21.LI N, BAI L.Comparative study on foodborne bacterial antimicrobial resistance surveillance system in China, America and Europe and its implication[J].Journal of Food Science and Technology, 2023, 41(1):1-9;21.
[17] WANG Y R, SHE M N, LIU K L, et al.Evaluation of the bacterial diversity of Inner Mongolian acidic gruel using Illumina MiSeq and PCR-DGGE[J].Current Microbiology, 2020, 77(3):434-442.
[18] HE B, LI H R, HU Z H, et al.Difference in microbial community and taste compounds between Mucor-type and Aspergillus-type Douchi during koji-making[J].Food Research International, 2019, 121:136-143.
[19] 凌荔,方尚玲,牟飞燕,等.基于高通量测序技术分析南方清香型白酒大曲的微生物多样性[J].酿酒科技, 2023(1):51-60.LING L, FANG S L, MOU F Y, et al.Analysis of microbial diversity of Qingxiang daqu based on high-throughput sequencing[J].Liquor-Making Science &Technology, 2023(1):51-60.
[20] 李薇,罗沈斌,邱泽瑞,等.永川毛霉型豆豉传统发酵过程中微生物群落结构及动态演替规律[J].食品与发酵工业, 2020, 46(23):60-67.LI W, LUO S B, QIU Z R, et al.Microbial community structure and dynamic succession in traditional fermentation of Mucor-type Yongchuan Douchi[J].Food and Fermentation Industries, 2020, 46(23):60-67.
[21] 宋仪洋,吴梦洁,董庆利,等.食源性致病菌感染体内外肠道模型研究进展[J].食品与发酵工业, 2024,50(15):340-349.SONG Y Y, WU M J, DONG Q L,et al.In vivo and in vitro intestinal models involved in foodborne pathogens[J].Food and Fermentation Industries, 2024,50(15):340-349.
[22] 李德志, 石强, 臧润国, 等.物种或种群生态位宽度与生态位重叠的计测模型[J].林业科学, 2006, 42(7):95-103.LI D Z, SHI Q, ZANG R G, et al.Models for niche breadth and niche overlap of species or populations[J].Scientia Silvae Sinicae, 2006, 42(7):95-103.
[23] YOUSSEF H H, HAMZA M A, FAYEZ M, et al.Plant-based culture media:Efficiently support culturing rhizobacteria and correctly mirror their in situ diversity[J].Journal of Advanced Research, 2016, 7(2):305-316.
[24] G NZLE M G.Lactic metabolism revisited:Metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2:106-117.
NZLE M G.Lactic metabolism revisited:Metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2:106-117.
[25] IWANIAK A, MINKIEWICZ P, DAREWICZ M, et al.Food protein-originating peptides as tastants-Physiological, technological, sensory, and bioinformatic approaches[J].Food Research International, 2016, 89(Pt 1):27-38.
[26] 严鑫,艾连中,夏永军,等.融合魏斯氏菌安全性、益生潜力及功能特性研究进展[J].工业微生物, 2022, 52(6):37-48.YAN X, AI L Z, XIA Y J, et al.Research progress of safety, probiotic potential and functional properties of Weissella confusa[J].Industrial Microbiology, 2022, 52(6):37-48.
[27] HUANG Z K, FENG Y Z, ZENG J, et al.Six categories of amino acid derivatives with potential taste contributions:A review of studies on soy sauce[J].Critical Reviews in Food Science and Nutrition, 2024, 64(22):7981-7992.
[28] ZOU S C, WU J C, SHAHID M Q, et al.Identification of key taste components in loquat using widely targeted metabolomics[J].Food Chemistry, 2020, 323:126822.
[29] CHEN Y T, LUO W S, FU M Q, et al.Effects of selected Bacillus strains on the biogenic amines, bioactive ingredients and antioxidant capacity of Shuidouchi[J].International Journal of Food Microbiology, 2023, 388:110084.
[30] ZHU L, HE S Y, LU Y, et al.Metabolomics mechanism of traditional soy sauce associated with fermentation time[J].Food Science and Human Wellness, 2022, 11(2):297-304.
[31] REN J H, LIU X L, YANG W P, et al.Rhizosphere soil properties, microbial community, and enzyme activities:Short-term responses to partial substitution of chemical fertilizer with organic manure[J].Journal of Environmental Management, 2021,299:113650.