鼠李糖乳酪杆菌是第一种被授予专利的乳杆菌属乳酸菌,已有30余年的研究历史,是目前研究最深入和应用领域最广泛的益生菌之一,其中代表菌株包括LGG等[1]。鼠李糖乳酪杆菌具有良好的产酸、肠道增殖、耐酸与耐胆盐[2],黏附肠道上皮细胞等能力,是食品与饲料领域重要的发酵剂与肠道益生菌菌株之一[3-5];在医药健康领域,相关研究表明鼠李糖乳酪杆菌制剂对胃肠道感染、艰难梭菌等引起的相关腹泻、肠易激综合征、炎症性肠疾病、呼吸道感染、过敏、心血管疾病、非酒精性脂肪性肝病、囊泡性纤维症[6]、血糖控制[7]等都具有一定药效,具有一定研究价值。
酵母浸出物是乳酸菌生产的关键培养基原料之一,对乳酸菌生物量、活菌数、冻干存活率等具有重要影响[8-10],因此不同特性的酵母浸出物筛选与优化是乳酸菌企业工艺优化与生产效率提高的重要研究内容。谷胱甘肽型酵母浸出物含有丰富还原型谷胱甘肽,与常规酵母浸出物相比具有典型的营养差异性,兼具抗氧化和作为培养基有机氮源的功能,在乳酸菌生产中可能具有一定特殊应用潜力和优势功能,目前还原型谷胱甘肽在乳酸菌生产中常被作为冻干保护剂组分之一,但在乳酸菌及相关发酵中的应用鲜有报道。本研究拟探索谷胱甘肽型酵母浸出物应用于鼠李糖乳酪杆菌培养的可行性,分析对鼠李糖乳酪杆菌生长、代谢、稳定性等的影响,为其在乳酸菌发酵生产中的应用提供一定理论参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
鼠李糖乳酪杆菌,由安琪酵母股份有限公司蛋白质营养与调味技术中心保存。
1.1.2 试剂
MgSO4、KH2PO4、MnSO4、柠檬酸氢二铵、Tween 80、葡萄糖、琼脂粉,国药集团化学试剂有限公司;邻硝基苯-β-D-半乳糖苷(2-nitrophenyl β-D-galactopyranoside,OPNG),魏氏化学试剂股份有限公司;酵母浸粉FM808(即不含谷胱甘肽型酵母浸出物)、酵母浸粉FM603(即谷胱甘肽型酵母浸出物,谷胱甘肽含量为10%,其中还原型谷胱甘肽占95%),安琪酵母股份有限公司。
1.2 仪器与设备
SW-CJ-1C型双人单面超净工作台,苏州净化设备有限公司;FiveEasy Plus FP20型pH计,梅特勒-托利多国际贸易(上海)有限公司;HWS-350型生化培养箱,上海比朗仪器有限公司;Sp-750型分光光度计,上海光谱仪器有限公司;GI54DWS型灭菌锅,致微(厦门)仪器有限公司;CX43型生物显微镜/MII Image View4.11.19051拍照系统,奥林巴斯株式会社;BIOTECH-3 JG-6型离位灭菌玻璃多联发酵罐,上海保兴生物设备有限公司;真空冷冻干燥机 LABCONCO FreeZone 12 L,美国LABCONCO公司;冷冻离心机Sigma3-15,德国SIGMA公司。
1.3 实验方法
1.3.1 培养基的配制
MRS液体培养基(g/L):葡萄糖20、蛋白胨10、牛肉膏10、酵母浸粉5、乙酸钠5、K2HPO4 2、柠檬酸氢二铵 2、硫酸镁 0.58、硫酸锰 0.25、Tween 80 1 mL,调节pH 6.5。
谷胱甘肽型酵母浸出物对鼠李糖乳酪杆菌影响的研究培养基(g/L):葡萄糖30、有机氮源20、Tween 80 1 mL、硫酸镁 0.1、硫酸锰 0.05、K2HPO4 2、柠檬酸氢二铵 2,调节pH 6.5,其中不同实验组的有机氮源如表1所示。
表1 培养基中的有机氮源组成 单位:g/L
Table 1 The composition of nitrogen source in the culture medium

组别Y-GSH-0Y-GSH-20Y-GSH-14Y-GSH-12Y-GSH-10Y-GSH-8Y-GSH-6Y-GSH-4含谷胱甘肽酵母浸出物FM603020141210864酵母浸出物FM8082006810121416
1.3.2 菌株的活化与培养
菌种的活化:用接种环从保菌管中蘸取1环,在MRS固体培养基上划线,平板置于37 ℃培养过夜,挑取单菌落,接入15 mL MRS液体培养基中,37 ℃培养12 h。按2%(体积比)接种到新鲜的MRS培养基中,培养12 h得到活化的种子液。
鼠李糖乳酪杆菌的扩大培养:将活化好的种子液按5%的接种量,转接至装有1.3.1节各组别培养基的5 L发酵罐(装液量4 L),添加NaOH控制pH 6.2,搅拌转速100 r/min,37 ℃培养至稳定期,结束培养。
1.3.3 培养基中谷胱甘肽的分析
5,5-二硫双酚-2-硝基苯甲酸[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]在pH值为8时与谷胱甘肽的巯基基团反应,从1 mol巯基化合物中得到1 mol黄色阴离子,谷胱甘肽浓度可以通过在412 nm的分光光度计中测量吸光度计算。
谷胱甘肽标准曲线:称取0.030 7 g谷胱甘肽标准品,加10 mL 0.1 mol/L盐酸,溶解混匀,现配现用。分别配制以下反应体系:0.1 mL 0.1 mol/盐酸+4.9 mL DTNB;0.2 mL 0.1 mol/L盐酸+4.8 mL DTNB;0.3 mL 0.1 mol/L盐酸+4.7 mL DTNB;0.5 mL 0.1 mol/L盐酸+4.5 mL DTNB;1.0 mL 0.1 mol/L盐酸+4.0 mL DTNB。涡旋混匀,室温静置10 min后于412 nm处测量吸光度值,根据吸光度与谷胱甘肽浓度绘制标准曲线。
取9.0 mL培养基(根据实际情况进行调整),加1.0 mL 1.0 mol/L HCl,并旋转以悬浮样品,在30~60 min的消化期内定期搅拌,8 000 r/min离心5 min。取0.1 mL上清液,加4.9 mL DTNB试剂混匀,室温静置10 min后于412 nm处测量吸光度,并计算培养基中谷胱甘肽浓度。
还原型谷胱甘肽检测:采用高效液相色谱法,参照GB/T 35882—2018《富营养素酵母》进行测定。
1.3.4 鼠李糖乳酪杆菌的菌体形态分析
鼠李糖乳酪杆菌扩大培养结束后取1 mL培养液于1.5 mL离心管中,12 000 r/min离心1 min,弃上清液,收集菌体,菌体用生理盐水进行悬浮洗涤2~3次,取适量菌悬液于载玻片固定、染色后用显微镜油镜观察,利用拍照系统进行拍照记录并测量菌体长度[11]。生物量、活菌数及存活率的测定方法如下。
生物量的测定(OD600值):用紫外分光光度计在波长600 nm下测定发酵液的吸光度值,若吸光度值大于0.8,将发酵液进行稀释,使稀释后的菌液的吸光值为0.2~0.8。
活菌数的测定:采用平板计数法。
存活率的测定:发酵结束后分别取样测定各实验组发酵液活菌数(记为C0),并取样200 mL于经灭菌的三角瓶中,存放于4 ℃,于24 h和 48 h时测定发酵液活菌数,存活率计算如公式(1)所示:
(1)
式中:St,存放时间为t小时的存活率,%;C0,发酵结束时发酵液活菌数,CFU/mL;Ct,存放t小时发酵液活菌数,CFU/mL;其中S0计为100%。
1.3.5 鼠李糖乳酪杆菌菌体氨基酸组成分析
鼠李糖乳酪杆菌扩大培养结束后取3 L发酵液,5 000 r/min离心15 min,弃上清液,菌体用生理盐水进行洗涤3次,收集菌体并进行冻干,冻干后的菌体参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,采用氨基酸分析仪测定盐酸水解后的游离氨基酸,即为鼠李糖乳酪杆菌菌体氨基酸组成。
1.3.6 细胞膜通透性分析
经不同培养基培养的菌体细胞用0.01 mol/L的PBS(pH 7.4)离心洗涤2次后重悬于相同缓冲液并调节细胞浓度为OD600=1.0,添加OPNG至终浓度为1.5 mmol/L,37 ℃孵育30 min后,细胞悬液经分光光度计测定OD420值[12]。
1.3.7 代谢组学分析
经不同培养基培养的菌体细胞用生理盐水离心洗涤2次,收集菌体,于液氮快速冷冻。样本提取、检测、代谢物定量分析、数据分析由武汉迈维代谢生物科技股份有限公司完成。
1.4 数据统计与分析
所有实验均重复3次,实验结果表示为“平均值±标准差”,实验数据采用Origin 2013绘图,采用Minitab 21统计软件进行差异性分析,P<0.05表示有显著性差异。
2 结果与分析
2.1 谷胱甘肽型酵母浸出物对鼠李糖乳酪杆菌生物量的影响
生物量与活菌数是乳酸菌等益生菌生产制备中重要指标,培养条件、培养基及原料的差异对其均具有重要影响。由图1-a可知,全部为非谷胱甘肽型酵母浸出物的生物量(OD600值)最高为9.47,全部为谷胱甘肽型酵母浸出物的生物量(OD600值)最低为7.35,两者存在显著性差异(P<0.05)。谷胱甘肽型酵母浸出物与非谷胱甘肽型酵母浸出物搭配使用,随着谷胱甘肽型酵母浸出物添加量增加,生物量呈下降趋势。
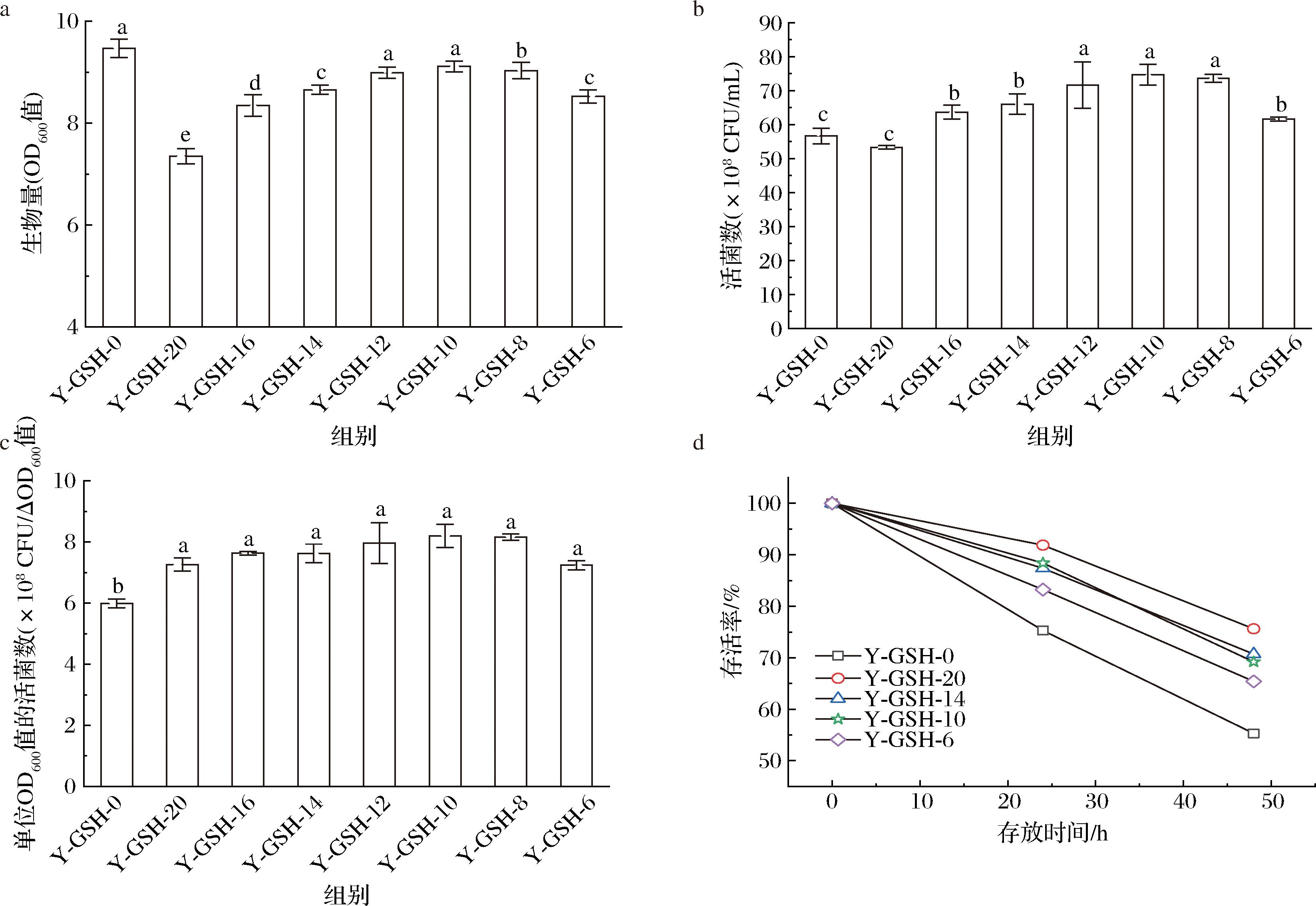
a-生物量(OD600值);b-发酵液活菌数;c-单位OD600值的活菌数;d-存活率
图1 谷胱甘肽型酵母浸出物对鼠李糖乳酪杆菌生长与稳定性的影响
Fig.1 Effect of glutathione-enriched yeast extract on the growth and stability of Lacticaseibacillus rhamnosus
注:不同小写字母表示差异显著(P<0.05)(下同)。
活菌数检测结果(图1-b)表明,10 g/L谷胱甘肽型酵母浸出物与10 g/L非谷胱甘肽酵母浸出物搭配使用,活菌数最高可达7.67×109 CFU/mL,显著高于全部使用非谷胱甘肽型酵母浸出物(5.67×109 CFU/mL)和全部使用谷胱甘肽型酵母浸出物(5.33×109 CFU/mL),此结果与李盼盼等[13]的生物量越高活菌数越高的研究结果存在一定差异,分析单位生物量(OD600值)活菌数,结果如图1-c所示,全部使用或部分使用谷胱甘肽型酵母浸出物的单位OD600值活菌数均显著高于非谷胱甘肽型酵母浸出物的实验组,该结果表明非谷胱甘肽型酵母浸出物与谷胱甘肽型酵母浸出物对鼠李糖乳酪杆菌的生物量和活菌数影响不同。非谷胱甘肽型酵母浸出物含氮量高有利于鼠李糖乳酪杆菌生物量提升,而谷胱甘肽型酵母浸出物有利于维持高的活菌数,ZHANG等[14]在对鼠李糖乳酪杆菌的抗性研究中也发现培养基适当降低氮源有助于菌体稳定性的提升。
乳酸菌发酵中,活菌数受生物量和菌体稳定性等多种因素的影响,谷胱甘肽型酵母浸出物不利于生物量提升,而有助于活菌数提高,其可能与菌体稳定性的改变有关。如图1-d所示,鼠李糖乳酪杆菌发酵液分别存放24 h和48 h后,使用非谷胱甘肽型酵母浸出物培养存活率分别为75.29%和55.41%,死亡率显著高于含谷胱甘肽型酵母浸出物实验组,此结果表明谷胱甘肽型酵母浸出物对提高发酵液中鼠李糖乳酪杆菌的稳定性具有显著作用。已有报道表明,乳酸菌的稳定性与菌体代谢状态、外界环境等多个因素相关[15],本研究将重点从菌体自身变化,分析谷胱甘肽型酵母浸出物影响鼠李糖乳酪杆菌稳定性的方式。
2.2 谷胱甘肽型酵母浸出物对鼠李糖乳酪杆菌形态的影响
袁峥等[16]和ZHANG等[17]的研究表明,乳酸菌的稳定性、存活率等与菌体长度有密切关系[16-17],菌体偏短其冻干存活率和稳定性更高。本研究对不同培养基培养的鼠李糖乳酪杆菌镜检并测量长度,结果如图2所示,不同方式培养的菌体长度存在显著性差异,完全使用非谷胱甘肽型酵母浸出物鼠李糖乳酪杆菌菌体平均长度最长为4.54 μm,使用一定量谷胱甘肽型酵母浸出物菌体长度最短可至3.04 μm,且更均一,这可能是2.1节中谷胱甘肽型酵母浸出物培养菌体稳定性更好,活菌数更高的原因之一。
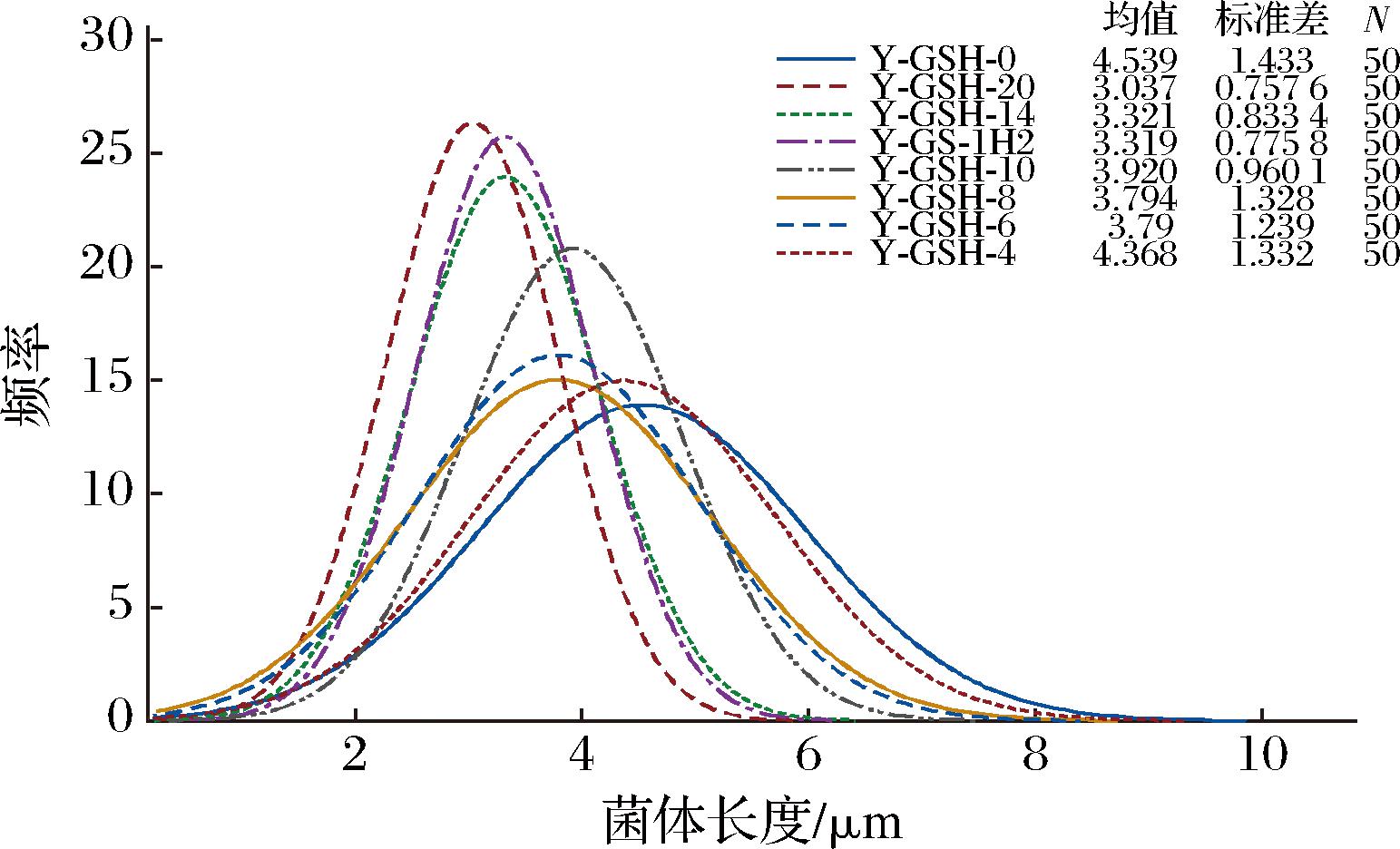
图2 鼠李糖乳酪杆菌菌体长度正态分布图
Fig.2 Normal distribution of length of Lacticaseibacillus rhamnosus
2.3 谷胱甘肽型酵母浸出物对鼠李糖菌体组成的影响
酵母浸出物作为乳酸菌培养的关键原料之一,其营养特异性的差异对微生物的营养吸收、菌体组成也会产生一定影响[18]。不同条件培养的鼠李糖乳酪杆菌氨基酸组成如表2所示,天冬氨酸、丝氨酸、谷氨酸、支链氨基酸、脯氨酸含量及占比存在显著性改变,其中不含谷胱甘肽型酵母浸出物培养的菌体天冬氨酸、丝氨酸含量较高,含谷胱甘肽型酵母浸出物培养的菌体谷氨酸、缬氨酸、异亮氨酸、亮氨酸含量显著上升,据MIYOSHI等[19]的研究结果表明,支链氨基酸合成过程中会竞争性消耗丙酮酸,降低甲酸等的产量,缓和胁迫压力,维持胞内pH(pHi)的相对平衡,改善乳酸菌的活力,维持稳定性。此研究结果说明,谷胱甘肽型酵母浸出物提高鼠李糖乳酪杆菌支链氨基酸可能是改善菌体稳定性的另一途径[19-21]。
表2 谷胱甘肽型酵母浸出物对鼠李糖乳酪杆菌菌体氨基酸组成的影响 单位:g/100 g
Table 2 Amino acid composition of Lacticaseibacillus rhamnosus cultured by different yeast extracts

氨基酸Y-GSH-0Y-GSH-20Y-GSH-14Y-GSH-12Y-GSH-10Y-GSH-8Y-GSH-6Y-GSH-4天冬氨酸6.12±0.13a5.28±0.14c5.08±0.23c5.25±0.09c5.33±0.12c5.72±0.12b5.69±0.23b5.49±0.09b苏氨酸2.28±0.15a2.31±0.03a2.40±0.12a2.42±0.10a2.15±0.13a2.37±0.19a2.45±0.07a2.37±0.02a丝氨酸1.75±0.06a1.44±0.11b1.49±0.07b1.39±0.05b1.41±0.01b1.29±0.01c1.42±0.03b1.42±0.12b谷氨酸6.35±0.23c6.88±0.20a7.27±0.15a7.25±0.09a6.89±0.12b6.67±0.4b7.02±0.17a6.66±0.22b甘氨酸2.38±0.13a2.38±0.03a2.40±0.12a2.41±0.09a2.40±0.11a2.34±0.11a2.38±0.12a2.33±0.11a丙氨酸5.01±0.23a4.42±0.27a4.68±0.31a4.51±0.16a4.71±0.26a4.72±0.17a4.85±0.19a4.78±0.12a胱氨酸0.34±0.03a0.32±0.03a0.33±0.13a0.37±0.15a0.29±0.02a0.32±0.09a0.35±0.06a0.35±0.08a缬氨酸2.04±0.07c2.32±0.05b2.32±0.03b2.56±0.1a2.24±0.04b2.33±0.06b2.34±0.04b2.33±0.05b蛋氨酸0.26±0.03a0.21±0.04a0.28±0.06a0.26±0.03a0.24±0.07a0.20±0.03a0.27±0.04a0.20±0.02b异亮氨酸1.44±0.09b2.16±0.15a1.93±0.09a2.14±0.16a2.09±0.07a2.00±0.07a2.13±0.23a1.68±0.13b亮氨酸2.56±0.11c2.99±0.12b3.01±0.12b3.20±0.16a2.76±0.03b3.04±0.17a2.82±0.10b3.45±0.18a酪氨酸1.36±0.03a1.22±0.06b1.28±0.04a1.29±0.05a1.26±0.08a1.36±0.09a1.37±0.05a1.27±0.08a苯丙氨酸1.30±0.07a1.26±0.03b1.39±0.06a1.31±0.03a1.36±0.09a1.34±0.05a1.34±0.03a1.28±0.02a赖氨酸4.55±0.19a4.47±0.18a4.42±0.11a4.51±0.19a4.35±0.16a4.43±0.21a4.53±0.22a4.56±0.08a组氨酸0.83±0.04a0.81±0.04a0.77±0.04a0.78±0.03a0.71±0.02b0.76±0.03a0.68±0.04b0.72±0.03b精氨酸1.73±0.05a1.55±0.02c1.81±0.03a1.61±0.04b1.62±0.06b1.68±0.03b1.73±0.03a1.62±0.04b脯氨酸0.60±0.04c0.99±0.04a1.04±0.11a0.78±0.02a0.80±0.01a0.72±0.03b0.074±0.03b0.94±0.05a
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4 基于代谢组学的谷胱甘肽型酵母浸出物影响鼠李糖乳酪杆菌稳定性的作用方式分析
还原型谷胱甘肽常作为抗氧化剂应用于乳酸菌生产[22],如表3所示,含谷胱甘肽酵母浸出物的培养基在灭菌后,还原型谷胱甘肽却全部被转化为氧化型谷胱甘肽,因此谷胱甘肽型酵母浸出物可能并不依赖于抗氧化作用来提高鼠李糖乳酪杆菌的稳定性。如表3所示,氧化型谷胱甘肽虽不具有抗氧化功能,但在培养过程中发生了大量消耗,说明鼠李糖乳酪杆菌可能通过对谷胱甘肽型酵母浸出物中的谷胱甘肽等功能肽及其他关键营养组分的利用,调控代谢途径,影响了菌体稳定性和活菌数。
表3 培养前后培养基中谷胱甘肽的变化 单位:g/L
Table 3 Glutathione in the culture medium before and after fermentation
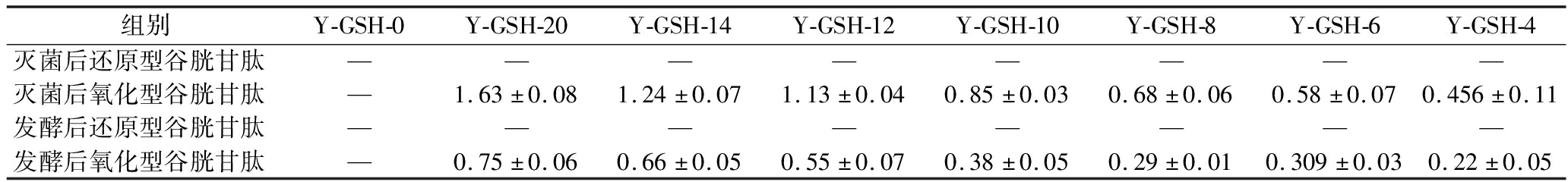
组别Y-GSH-0Y-GSH-20Y-GSH-14Y-GSH-12Y-GSH-10Y-GSH-8Y-GSH-6Y-GSH-4灭菌后还原型谷胱甘肽————————灭菌后氧化型谷胱甘肽—1.63±0.081.24±0.071.13±0.040.85±0.030.68±0.060.58±0.070.456±0.11发酵后还原型谷胱甘肽————————发酵后氧化型谷胱甘肽—0.75±0.060.66±0.050.55±0.070.38±0.050.29±0.010.309±0.030.22±0.05
注:“—”表示未检出。
代谢组学分析结果如图3所示,含谷胱甘肽型酵母浸出物培养基培养的鼠李糖乳酪杆菌磷脂类代谢通路显著上调,包括磷脂酰乙醇胺、磷脂酸、丝氨酸(丝氨酸是磷脂酰丝氨酸的前体)等。如图4所示,不同分子质量磷脂酰乙醇胺含量最高增加7.45倍,磷脂酸增加6.17倍。磷脂是细胞膜骨架结构重要组成成分,影响细胞膜稳定性、流动性与通透性等,谷胱甘肽型酵母浸出物可能正是通过促进磷脂的合成,改变了细胞膜组成与状态,提高了菌体的稳定性。张猛等[23]在对干酪乳酪杆菌的研究中发现其可以通过增加脂肪酸磷脂的合成来维持细胞膜的流动性,有效提高乳酸菌的抗逆性和稳定性,GUO等[24]发现副干酪乳酪杆菌在乙醇胁迫环境下通过上调磷脂代谢相关基因可提高其抗逆性和稳定性。
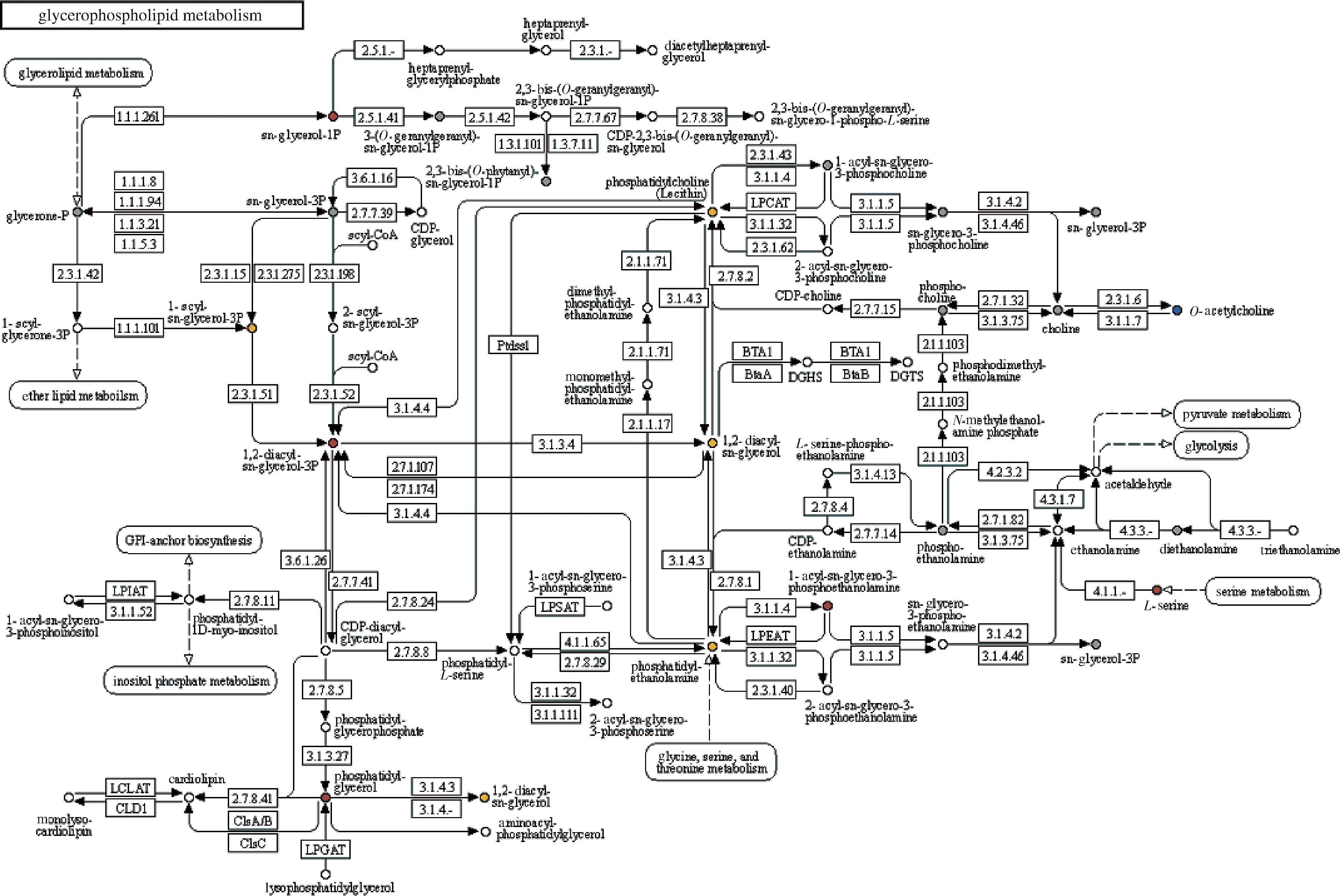
图3 差异代谢物通路图
Fig.3 Pathway of differential metabolites
注:红色圆圈表示代谢物含量显著上调,蓝色圆圈表示代谢物含量显著下调,灰色圆圈表示该代谢物被检测到但未发生显著变化,黄色圆圈表示同时包含上调、下调代谢物;glycerolipid metabolism:甘油酯代谢;glycerone-P:甘油-1-磷酸;1-acglycerone-3P:1-酰基甘油-3磷酸;ether lipid metabolism:乙醚脂质代谢;GPI-anchor biosynthesis;1-Acyl-sn-glycero-3-phosphoinositol:1,2-二月桂酰-sn-甘油酸-3-磷酸乙醇胺;phosphatidyl-1D-myo-inositol:磷脂酰-1D-肌醇;inositol phosphate metabolism:肌醇磷酸代谢;cardiolipin:心磷脂;sn-glycerol-1P:sn-甘油-1磷酸;heptaprenyl glycerylphosphate:七萜烯基甘油磷酸;diacetylheptaprenyl glycerol:二乙酰七萜烯基甘油;3-(O-geranylgeranyl)-sn-glycerol-1P:3-(O-降冰片烯基)-sn-甘油-1磷酸;2,3-bis-(O-geranylgeranyl)-sn-glycerol-1P:2,3-双(O-降冰片烯基)-sn-甘油-1磷酸;CDP-2,3-bis-(O-geranylgeranyl)-sn-glycerol:CDP-2,3-双(降冰片烯基)-sn-甘油;2,3-bis-(O-geranylgeranyl)-sn-glycero-1-phospho-L-serine:2,3-双(降冰片烯基)-sn-甘油-1-磷酸-L-丝氨酸;sn-glycerol-3P:sn-甘油-3磷酸;CDP-glycerol:CDP-甘油;acyl-CoA:酰基辅酶A;2-acyl-sn-glycerol-3P:2-酰基-sn-甘油-3磷酸;1,2-diacyl-sn-glycerol-3P:1,2-二酰基-sn-甘油-3磷酸;CDP-diacyl-glycerol:CDP-二酰基甘油;phosphatidyl-glycerophosphate:磷脂酰甘油磷酸;phosphatidyl-glycerol:磷脂酰甘油;1,2-diacyl-sn-glycerol:1,2-二酰基-sn-甘油;aminoacyl phosphatidylglycerol:氨酰磷脂酰甘油;lysophosphatidylglycerol:溶血磷脂酰甘油;phosphatidylcholine (lecithin):磷脂酰胆碱(卵磷脂);1-acyl-sn-glycerol-3-phosphatidylcholine:1-酰基-sn-甘油-3-磷酸胆碱;sn-glycero-3-phosphocholine:sn-甘油-3-磷酸胆碱;sn-glycerol-3P:sn-甘油-3磷酸;dimethyl-phosphatidyl-ethanolamine:二甲基磷脂酰乙醇胺;monomethyl phosphatidyl ethanolamine:单甲基磷脂酰乙醇胺;phosphatidyl-ethanolamine:磷脂酰乙醇胺;1,2-diacyl-sn-glycerol:1,2-二酰基-sn-甘油;L-serine-phospho-ethanolamine:L-丝氨酸磷酸乙醇胺;N-methyl ethanolamine phosphate:N-甲基乙醇胺磷酸;pyruvate metabolism:丙酮酸代谢;glycolysis:糖酵解;acetaldehyde:乙醛;CDP-ethanolamine:CDP-乙醇胺;phosphoethanolamine:磷酸乙醇胺;ethanolamine:乙醇胺;diethanolamine:二乙醇胺;triethanolamine:三乙醇胺;1-acyl-sn-glycero-phosphoserine:1-酰基-sn-甘油-3-磷酸丝氨酸;2-acyl-sn-glycero-3-phosphoserine:2-酰基-sn-甘油-3-磷酸丝氨酸;1-acyl-sn-glycero-3-phosphoethanolamine:1-酰基-sn-甘油-3-磷酸乙醇胺;sn-glycero-3-phosphoethanolamine:sn-甘油-3-磷酸乙醇胺;2-acyl-sn-glycero-3-phosphoethanolamine:2-酰基-sn-甘油-3-磷酸乙醇胺;sn-glycerol-3P:sn-甘油-3磷酸。
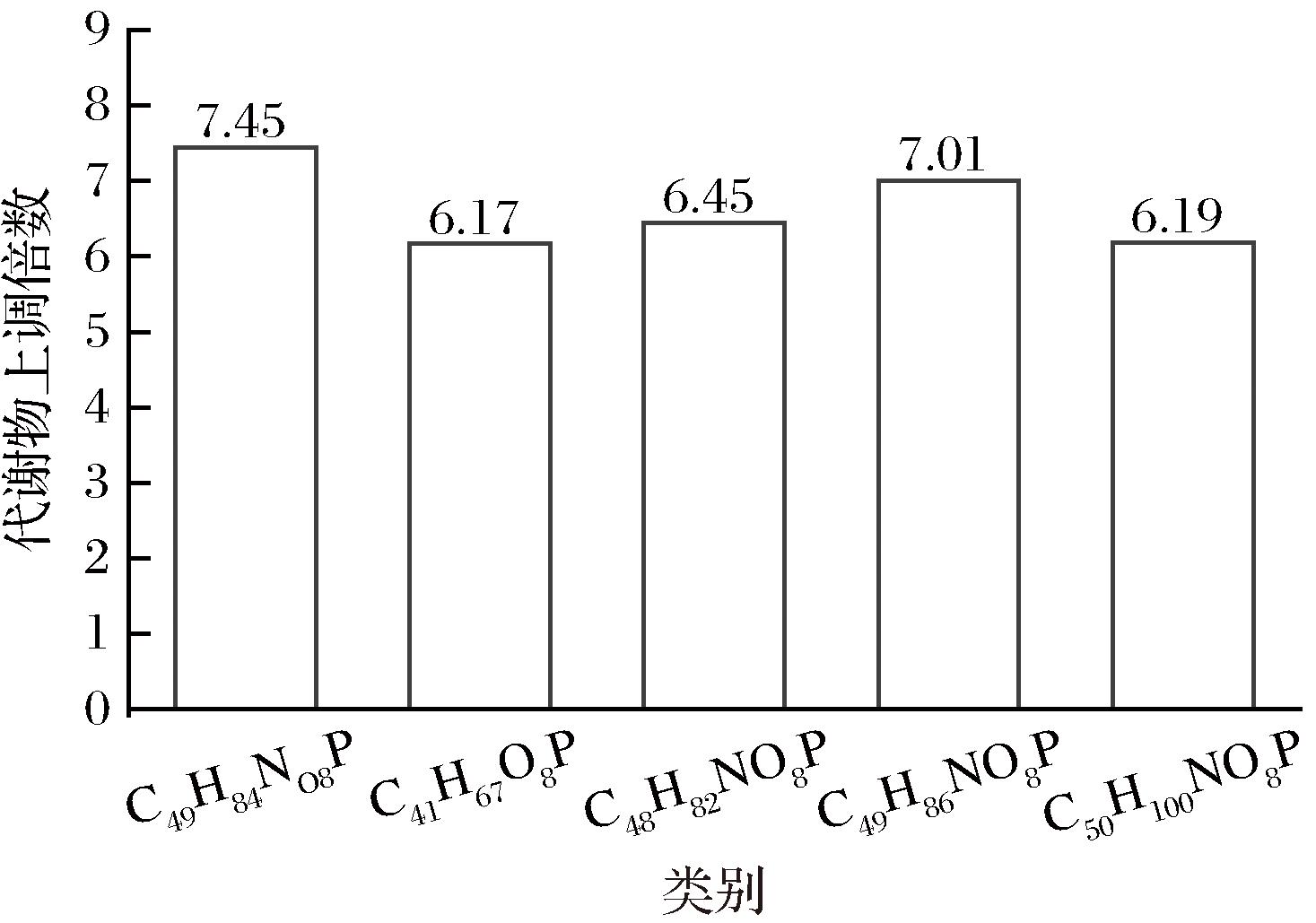
图4 差异代谢物变化
Fig.4 Changes of differential metabolites
进一步测定不同有机氮源培养的鼠李糖乳酪杆菌细胞膜通透性,如图5所示,使用谷胱甘肽型酵母浸出物培养的鼠李糖乳酪杆菌的细胞膜通透性显著性低于不含谷胱甘肽酵母浸出物培养的菌体。该结果一定程度上佐证了谷胱甘肽型酵母浸出物可能通过调控甘油磷脂的代谢影响细胞膜组成、降低细胞膜通透性等的方式,改善了菌体稳定。田喜梅[25]在植物乳植杆菌研究中发现,随着细胞膜通透性增大,菌体活力与稳定性表现出一定程度降低,与本研究结果具有相似性。
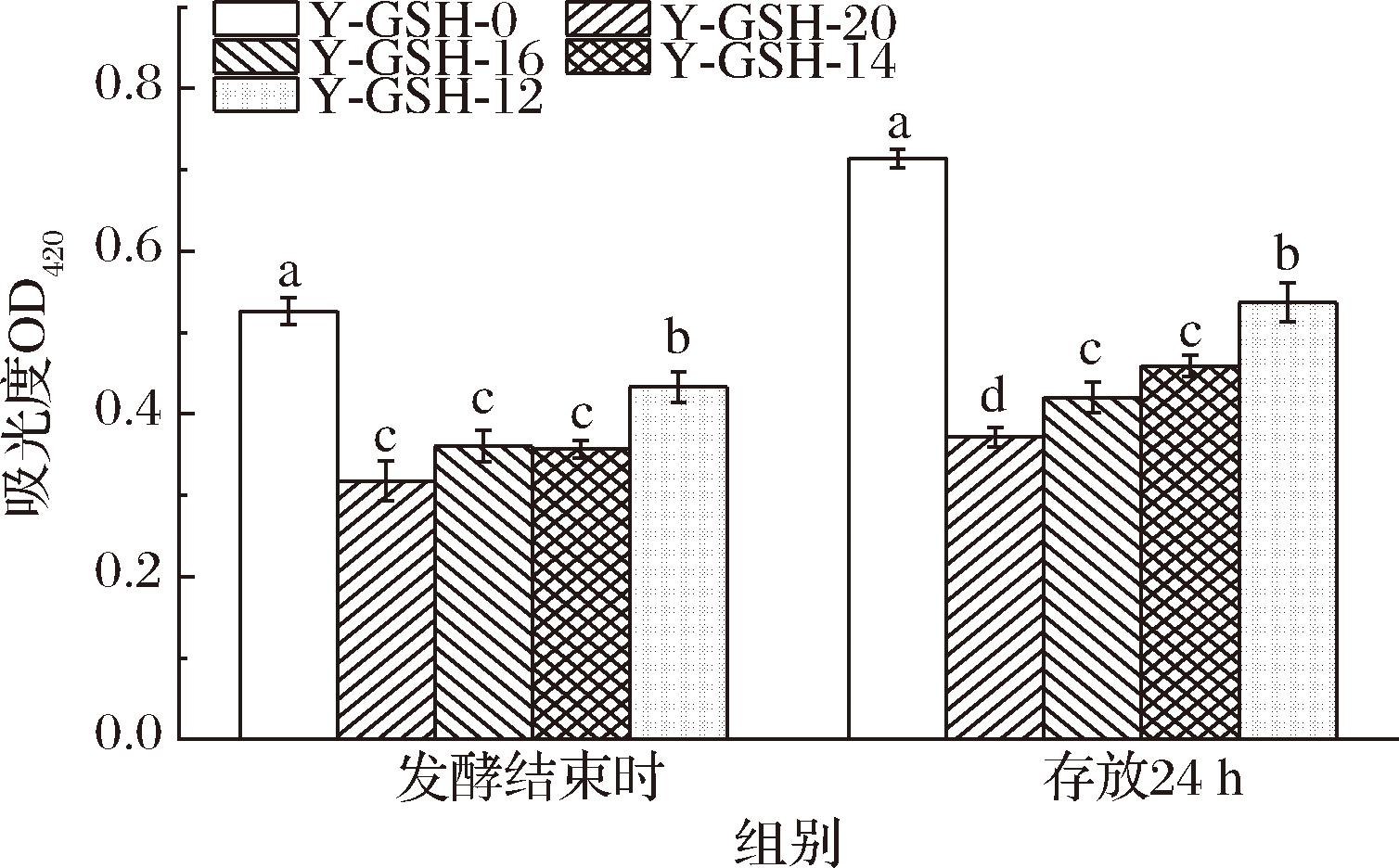
图5 谷胱甘肽酵母浸出物对细胞膜通透性的影响
Fig.5 Effect of glutathione-enriched yeast extract on cell membrane permeability
3 结论
谷胱甘肽型酵母浸出物是一种与其他酵母浸出物有显著营养差异的有机氮源,可缩短鼠李糖乳酪杆菌菌体长度,提高活菌数与菌体稳定性。
谷胱甘肽型酵母浸出物对鼠李糖乳酪杆菌活菌数、稳定性的提升,不依赖于其还原型谷胱甘肽的抗氧化作用,可能主要通过谷胱甘肽等功能肽及其他关键营养的供给,上调鼠李糖乳酪杆菌磷脂合成代谢来影响鼠李糖乳酪杆菌细胞膜组成及通透性等方式发挥作用。
本研究为谷胱甘肽型酵母浸出物应用于鼠李糖乳酪杆菌与其他乳酸菌的发酵生产及提升乳酸菌活菌数和稳定性,提供了理论和数据支撑。后续还将进一步开展代谢组学深度研究,进一步明晰其作用机理。
[1] CAPURSO L.Thirty years of Lactobacillus rhamnosus GG:A review[J].Journal of Clinical Gastroenterology, 2019, 53(Suppl 1):S1-S41.
[2] 王昊乾, 张静雯, 杨雄洲, 等.抗氧化肽在真空冷冻干燥过程中对乳双歧杆菌Probio-M8的保护作用[J].中国食品学报, 2023, 23(10):32-40.WANG H Q, ZHANG J W, YANG X Z, et al.Protective effect of antioxidant peptides on Bifidobacterium animalis subsp.lactis probio-M8 during vacuum freeze-drying[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(10):32-40.
[3] 谢子怡, 戴志勇, 谢秋涛, 等.鼠李糖乳酪杆菌发酵果蔬的研究进展[J].食品与发酵工业, 2025,51(3):376-384.XIE Z Y, DAI Z Y, XIE Q T, et al.Research progress on fruits and vegetables fermented by Lacticaseibacillus rhamnosus[J].Food and Fermentation Industries, 2025,51(3):376-384.
[4] 刘帅, 郑健, 姜鑫, 等.鼠李糖乳杆菌对全株玉米青贮品质及瘤胃降解率的影响[J].中国畜牧杂志, 2019, 55(7):111-116.LIU S, ZHENG J, JIANG X, et al.Effects of Lactobacillus Rhamnosus on silage quality and rumen degradation rate of whole plant corn[J].Chinese Journal of Animal Science, 2019, 55(7):111-116.
[5] 苏帅, 孙会, 于航宇, 等.鼠李糖乳杆菌的生物学功能[J].动物营养学报, 2019, 31(1):97-101.SU S, SUN H, YU H Y, et al.Biological Function of Lactobacillus rhamnosus[J].Chinese Journal of Animal Nutrition, 2019, 31(1):97-101.
[6] TUOMOLA E, CRITTENDEN R, PLAYNE M, et al.Quality assurance criteria for probiotic bacteria[J].The American Journal of Clinical Nutrition, 2001, 73(2):393s-398s.
[7] 余萍.鼠李糖乳酪杆菌RH0121冻干工艺优化及降血糖作用的研究[J].中国微生态学杂志, 2023, 35(6):681-688.YU P.Optimization of lyophilized powder of Lacticaseibacillus rhamnosus RH0121 and its hypoglycemic effect[J].Chinese Journal of Microecology, 2023, 35(6):681-688.
[8] 任磊, 杨玲, 霍世和, 等.培养基中的酵母营养物对罗伊氏粘液乳杆菌L840冻干存活率的影响[J].中国微生态学杂志, 2022, 34(10):1135-1138.REN L, YANG L, HUO S H, et al.Effects of yeast nutrients in culture medium on survival rate of Limosilactobacillus reuteri L840 during lyophilization[J].Chinese Journal of Microecology, 2022, 34(10):1135-1138.
[9] 许喜林, 赵思博, 郑柳青, 等.鼠李糖乳杆菌LR-ZB1107-01的培养基优化及益生特性评价[J].华南理工大学学报(自然科学版), 2022, 50(8):21-29.XU X L, ZHAO S B, ZHENG L Q, et al.Culture medium optimization and probiotic characteristics evaluation of Lactobacillus rhamnosus LR-ZB1107-01[J].Journal of South China University of Technology (Natural Science Edition), 2022, 50(8):21-29.
[10] HSIEH S C, LIU J M, PUA X H, et al.Optimization of Lactobacillus acidophilus cultivation using taro waste and evaluation of its biological activity[J].Applied Microbiology and Biotechnology, 2016, 100(6):2629-2639.
[11] 熊昌武, 朱亚军, 张彦, 等.小麦蛋白水解物对嗜酸乳杆菌(Lactobacillus acidophilus)生长的影响研究[J].中国酿造, 2024, 43(7):171-176.XIONG C W, ZHU Y J, ZHANG Y, et al.Effect of wheat protein hydrolysate on the growth of Lactobacillus acidophilus[J].China Brewing, 2024, 43(7):171-176.
[12] ZHU X, DONG N, WANG Z Y, et al.Design of imperfectly amphipathic α-helical antimicrobial peptides with enhanced cell selectivity[J].Acta Biomaterialia, 2014, 10(1):244-257.
[13] 李盼盼, 张庆芳, 刘春莹, 等.鼠李糖乳杆菌LP216高密度发酵培养基优化[J].中国酿造, 2022, 41(4):87-92.LI P P, ZHANG Q F, LIU C Y, et al.Optimization of high-density fermentation medium of Lactobacillus rhamnosus LP216[J].China Brewing, 2022, 41(4):87-92.
[14] ZHANG C C, GUI Y, CHEN X, et al.Transcriptional homogenization of Lactobacillus rhamnosus hsryfm 1301 under heat stress and oxidative stress[J].Applied Microbiology and Biotechnology, 2020, 104(6):2611-2621.
[15] 苗维娜, 赵亮.冷冻干燥影响乳酸菌发酵活力机制的研究进展[J].食品工业科技, 2022, 43(21):36-44.MIAO W N, ZHAO L.Research progress on the mechanism of freeze-drying affecting the fermentation activity of lactic acid bacteria[J].Science and Technology of Food Industry, 2022, 43(21):36-44.
[16] 袁峥, 赵瑞香, 牛生洋, 等.酸胁迫下嗜酸乳杆菌菌体形态的扫描电镜观察[J].食品工业科技, 2012, 33(24):199-201.YUAN Z, ZHAO R X, NIU S Y, et al.Observation of the mycelia morphology of Lactobacillus acidophilus with scanning electron microscope under acid stress[J].Science and Technology of Food Industry, 2012, 33(24):199-201.
[17] ZHANG T, GUO Y X, FAN X K, et al.Protection mechanism of metal ion pre-stress on Lactobacillus acidophilus CICC 6074 under acid tolerance[J].Journal of Agricultural and Food Chemistry, 2023, 71(36):13304-13315.
[18] SIATERLIS A, DEEPIKA G, CHARALAMPOPOULOS D.Effect of culture medium and cryoprotectants on the growth and survival of probiotic Lactobacilli during freeze drying[J].Letters in Applied Microbiology, 2009, 48(3):295-301.
[19] MIYOSHI A, ROCHAT T, GRATADOUX J J, et al.Oxidative stress in Lactococcus lactis[J].Genetics and Molecular Research, 2003, 2(4):348-359.
[20] SANTIAGO B, MACGILVRAY M, FAUSTOFERRI R C, et al.The branched-chain amino acid aminotransferase encoded by ilvE is involved in acid tolerance in Streptococcus mutans[J].Journal of Bacteriology, 2012, 194(8):2010-2019.
[21] LEN A C L, HARTY D W S, JACQUES N A.Proteome analysis of Streptococcus mutans metabolic phenotype during acid tolerance[J].Microbiology, 2004, 150(Pt 5):1353-1366.
[22] 傅瑞燕, 陈坚, 李寅.谷胱甘肽在乳酸乳球菌抵抗氧胁迫中的保护作用[J].微生物学报, 2006, 46(3):379-384.FU R Y, CHEN J, LI Y.Glutathione plays an anti-oxidant role in Lactococcus lactis[J].Acta Microbiologica Sinica, 2006,46(3):379-384.
[23] 张猛, 贾星, 张和平, 等.干酪乳杆菌Zhang在逆境条件下基因表达的差异分析[J].中国食品学报, 2021, 21(6):62-69.ZHANG M, JIA X, ZHANG H P, et al.Analysis of differential gene expression of Lactobacillus casei Zhang under adverse circumstances[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(6):62-69.
[24] GUO J F, LI X, LI B K, et al.Transcriptome analysis of Lactobacillus paracasei SMN-LBK under ethanol stress[J].Journal of Dairy Science, 2020, 103(9):7813-7825.
[25] 田喜梅.植物乳杆菌ZDY 2013的耐酸机制研究及其谷氨酸脱氢酶基因的克隆表达[D].南昌:南昌大学, 2016.TIAN X M.A study of acid tolerance of Lactobacillus plantarum ZDY 2013 and expression of glutamate dehydrogenase gene[D].Nanchang:Nanchang University, 2016.