中国传统食醋至今已有3 000多年的历史,大多在开放的环境条件下,以高粱、糯米等谷物为主要原料,采用固态发酵的方式酿造而成[1],以四川麸醋、山西老陈醋、镇江香醋、福建永春老醋最为出名[2]。四川麸醋以麸皮为主要原料,药曲作为糖化剂,采用糖化、酒化、酸化同时进行的生料固态多菌种混合发酵工艺[3],使得发酵过程中形成了特有的微生物区系。
芽孢杆菌是四川麸醋发酵过程中的优势微生物[4],然而目前关于四川麸醋发酵过程中芽孢杆菌多样性的报道较少。作为传统食醋发酵过程中的功能菌,它能通过自身代谢直接或间接产生多种挥发性风味物质。乙偶姻是芽孢杆菌常见代谢产物之一[5],其本身具有愉悦的奶油香味[6],且是四甲基吡嗪的重要前体物质[7-8]。史改玲等[9]从山西老陈醋中分离得到甲基营养型芽孢杆菌CP-1576,其乙偶姻产量为1 150 mg/L。食醋发酵环境条件的动态变化影响着微生物的生长和代谢[10],筛选环境耐受能力强的芽孢杆菌强化发酵将有助于食醋品质的提升。本研究通过宏基因组测序技术和传统分离培养法分析四川麸醋发酵过程中芽孢杆菌的多样性,同时研究不同芽孢杆菌产乙偶姻能力及在不同发酵环境条件下的生长情况,为进一步应用芽孢杆菌于四川麸醋发酵,提高其风味品质提供理论依据和菌种资源。
1 材料与方法
1.1 材料与试剂
醋醅样品,采自四川某麸醋厂(中国四川阆中)。醋醅样品的采集参考LIU等[11]的方法,选取3个发酵池(21#、29#、30#),分别在第1、5、7、9、11、13、15、17、19、21、25天采集样品(除第1天样品翻醅后约1 h采集,其他时间样品翻醅前约0.5~1 h采集)。将同一天从同一发酵池采集的样品混合,将约400 g醋醅装于无菌采样袋中密封后,用冰袋运至四川农业大学食品微生物实验室,分别于-80 ℃和4 ℃保存。
无水乙醇、乳酸、乙酸,成都市科隆化学品有限公司;肌酸、α-萘酚,上海泰坦科技股份有限公司;乙偶姻,广州佳途科技股份有限公司;MRS肉汤培养基、MRS琼脂培养基,青岛海博生物技术有限公司;Fast DNA SPIN试剂盒,美国MP Biomedicals公司;NEXTFLEXTM 快速DNA测序试剂盒,美国Bio Scientific公司;细菌基因组DNA抽提试剂盒,天根生化科技(北京)有限公司。
1.2 仪器与设备
HWS24电热恒温水浴锅,上海一恒科技有限公司;C1000 Thermal Cycler PCR仪、Gel Doc XR+凝胶成像系统,美国Bio-Rad公司;UV-3100PC紫外分光光度计,上海美谱达仪器有限公司;3001酶标仪,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 醋醅微生物基因组DNA提取
分别称取不同发酵时间的醋醅样品5 g,置于装有50 mL生理盐水的锥形瓶中,用灭过菌的4层纱布过滤,收集滤液,以300 r/min离心5 min,收集上清液;10 000 r/min高速离心5 min,收集沉淀,用无菌生理盐水洗涤3次。根据Fast DNA SPIN试剂盒的说明书,提取不同发酵时间醋醅样品的总基因组DNA。
1.3.2 基因文库构建、测序及功能注释
参考刘丹彤[12]的方法使用Covaris超声波处理器将DNA随机剪切成约400 bp的片段,采用NEXTFLEXTM快速DNA测序试剂盒构建PE文库,并基于Illumina NovaSep 6000平台进行宏基因组测序。参考LI等[13]的方法,对原始序列数据进行质量控制。使用Fastp软件截断适配体序列的3′端和5′端,保留高质量的配对端和单端读数,从而获得高质量的质控数据(clean data)。使用Megahit v1.1.2和MetaGene软件分别进行序列拼接和基因预测,使用CD-HIT v4.7软件通过聚类构建细菌非冗余基因集,利用SOAPaligner v2.21软件将每个样品的质控数据与非冗余基因集进行比对,统计基因在对应样品中的丰度。使用Diamond v0.8.35软件将非冗余基因集与NR数据库比对,进行Best-hit物种注释,使用物种对应的基因丰度总和计算各物种的丰度。保留芽孢杆菌科水平下的物种,选择丰度占比≥1%的物种,利用R软件包v3.3.1进行统计和作图。
1.3.3 芽孢杆菌的分离与鉴定
1.3.3.1 芽孢杆菌的分离
分别取不同发酵时间的醋醅5 g,置于装有45 mL MRS肉汤培养基的250 mL锥形瓶中,在转速120 r/min的37 ℃振荡培养箱培养30 min后,将振荡培养液稀释至合适梯度,取稀释液0.1 mL均匀涂布至MRS固体培养基,37 ℃培养48 h。挑取菌落表面粗糙、边缘不规则,菌落形态不同的单菌落,通过3次划线得到纯化菌株。
1.3.3.2 芽孢杆菌的分子生物学鉴定
按照细菌基因组DNA抽提试剂盒提取芽孢杆菌的DNA,并以此DNA为模板,使用引物(27F:5′-AGA GTT TGA TCC TGG CTC AG-3′;1492R:5′-GGT TAC CTT GTT ACG ACT T-3′)扩增芽孢杆菌16S rDNA区间。PCR扩增反应体系为:Premix TaqTM(TaKaRa TaqTM Version 2.0) 25 μL,模板DNA 1 μL,27F和1492R各1 μL,无菌超纯水22 μL。PCR扩增反应条件为:95 ℃预变性10 min,然后经30个循环(95 ℃变性45 s,50 ℃退火45 s,72 ℃延伸1 min),最后72 ℃延伸10 min,4 ℃保存。经1%琼脂糖凝胶,电压110 V,30 min电泳分离,UV凝胶成像系统检测与成像。将16S rRNA PCR扩增产物送至生工生物工程(上海)股份有限公司完成测序,测序结果与NCBI数据库进行BLAST比对,使用MEGA11.0绘制系统发育树[14]。
1.3.4 产乙偶姻芽孢杆菌的筛选
参考邱婷[15]的方法,使用无菌MRS肉汤将活化后的芽孢杆菌菌液OD600值调整至0.70~0.75,涡旋混匀后以2%的接种量接入5 mL MRS肉汤培养基,置于37 ℃培养48 h。采用肌酸比色法测定乙偶姻含量,具体步骤如下:精准配制质量浓度分别为25、50、75、100、125、175、225 mg/L的一系列乙偶姻标准溶液。分别取标准液100 μL,加入2.4 mL去离子水、0.5 mL肌酸溶液(5 g/L)、0.5 mL α-萘酚溶液(50 g/L)和0.5 mL氢氧化钠溶液(100 g/L),混匀,于30 ℃水浴1 h后,在520 nm处测定溶液吸光度值。以乙偶姻浓度为横坐标,520 nm处吸光度值为纵坐标绘制标准曲线。取稀释后样品100 μL,根据标准曲线测定方法得到样品吸光度值,利用标准曲线计算乙偶姻含量。
1.3.5 不同发酵环境条件下芽孢杆菌的生长情况
1.3.5.1 不同温度条件下芽孢杆菌的生长情况
参考李晓梅[16]的方法,使用无菌MRS肉汤将活化后的芽孢杆菌菌液OD600值调整至0.70~0.75,涡旋混匀后以2%的接种量接入5 mL MRS肉汤培养基中,分别置于30、35、37、40、45、50 ℃培养箱静置培养48 h,测定其OD600值,比较其接种前后生长情况。
1.3.5.2 不同乙醇体积分数下芽孢杆菌生长情况
参考李晓梅[16]的方法,使用无菌MRS肉汤将活化后的芽孢杆菌菌液OD600值调整至0.70~0.75,涡旋混匀后以2%的接种量分别接入乙醇体积分数为1%、2%、3%、4%、5%的5 mL MRS肉汤培养基中,置于37 ℃培养箱静置培养48 h,测定其OD600值,比较其接种前后生长情况。
1.3.5.3 不同pH条件下芽孢杆菌生长情况
参考李晓梅[16]的方法,使用无菌MRS肉汤将活化后的芽孢杆菌菌液OD600值调整至0.70~0.75,涡旋混匀后以2%的接种量分别接入使用乳酸和乙酸调节pH值为5.0、4.5、4.0、3.5、3.0的5 mL MRS肉汤培养基中,置于37 ℃培养箱静置48 h,测定其OD600值,比较其接种前后生长情况。
1.4 数据处理
所有分析都进行3次独立重复,平均值和标准差使用Microsoft Excel 2021进行计算,使用GraphPad Prism 10软件绘图,使用IBM SPSS Statistics 27软件进行单因素方差分析分析(ANOVA),P<0.05为显著差异。
2 结果与分析
2.1 醋醅中芽孢杆菌群落多样性
在种水平上对不同发酵时间醋醅样品中芽孢杆菌多样性进行了分析(图1)。在整个醋醅发酵过程中,凝结芽孢杆菌(Heyndrickxia coagulans)占据绝对优势,其相对丰度占芽孢杆菌的13.16%~61.17%。其中,在发酵第9天H.coagulans的相对丰度最小(13.16%),在发酵第19天凝结芽孢杆菌的相对丰度最高(61.17%)。随着发酵时间的延长,凝结芽孢杆菌的相对丰度呈现波动式变化。未分类的魏茨曼属(unclassified Weizmannia)是醋醅发酵过程中相对丰度第二的物种,其相对丰度为1.86%~8.68%,在整个发酵过程中也呈现不规则波动趋势。热噬淀粉芽孢杆菌(Caldibacillus thermoamylovorans)是醋醅发酵过程中相对丰度第三的物种,其相对丰度为4.73%~6.43%,在整个发酵过程中呈现相对稳定趋势。耐热芽孢杆菌(Heyndrickxia sporothermodurans)、同温层芽孢杆菌(Bacillus stratosphericus)、蔬菜芽孢杆菌(Heyndrickxia oleronia)、外村尚芽孢杆菌(Caldibacillus hisashii)和淤泥大洋芽孢杆菌(Oceanobacillus caeni)在整个醋醅发酵过程中占有一定的比例。此外,发酵过程中还有相对丰度较少的盐枝芽孢杆菌(Virgibacillus dakarensis)、任清芽孢杆菌(Bacillus renqingensis)和枯草芽孢杆菌(Bacillus subtilis)等物种存在。这一结果与镇江香醋芽孢杆菌的群落结构有所区别,LIU等[17]发现解淀粉芽孢杆菌、蜡样芽孢杆菌、巨大芽孢杆菌、吉氏芽孢杆菌、热噬淀粉芽孢杆菌等是镇江香醋发酵过程中的优势芽孢杆菌。

图1 不同发酵时间醋醅芽孢杆菌组成
Fig.1 Bacillaceae composition in Cupei at different fermentation time
2.2 芽孢杆菌的分离与鉴定
从不同发酵时间的醋醅样品中共分离到42株疑似芽孢杆菌,在MRS固体培养基上37 ℃培养48 h,可观察到圆形或椭圆形、白色、凸起、表面粗糙或光滑的菌落。分别以上述42株分离株的DNA为模板,扩增其16S rRNA区域,扩增产物经测序后与NCBI数据库中的序列进行BLAST比对。42株分离株均为芽孢杆菌(表1),分属2个属、9个种,包括6株H.coagulans、6株贝莱芽孢杆菌(Bacillus velezensis)、7株地衣芽孢杆菌(Bacillus licheniformis)、2株暹罗芽胞杆菌(Bacillus siamensis)、7株B.subtilis、5株解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、1株酸居芽孢杆菌(Heyndrickxia acidicola)、4株H.oleronia以及3株H.sporothermodurans。这一结果与山西老陈醋有所区别,贾瑞娟等[18]从山西老陈醋醋醅中分离得到54株芽孢杆菌,其中B. amyloliquefaciens、B.subtilis和B.licheniformis占比最高,分别为31.36%,26.26%和20.59%。为进一步明确分离株的进化关系,对42株芽孢杆菌进行了系统发育树构建(图2),可聚为三类,第一类主要为H.sporothermodurans、H.acidicola、H.oleronia、H. coagulans,第二类主要为B.licheniformis,第三类主要为B.subtilis、B.amyloliquefaciens、B.siamensis、B.velezensis。
表1 芽孢杆菌分离株的分类信息
Table 1 Taxonomical information of Bacillaceae isolates
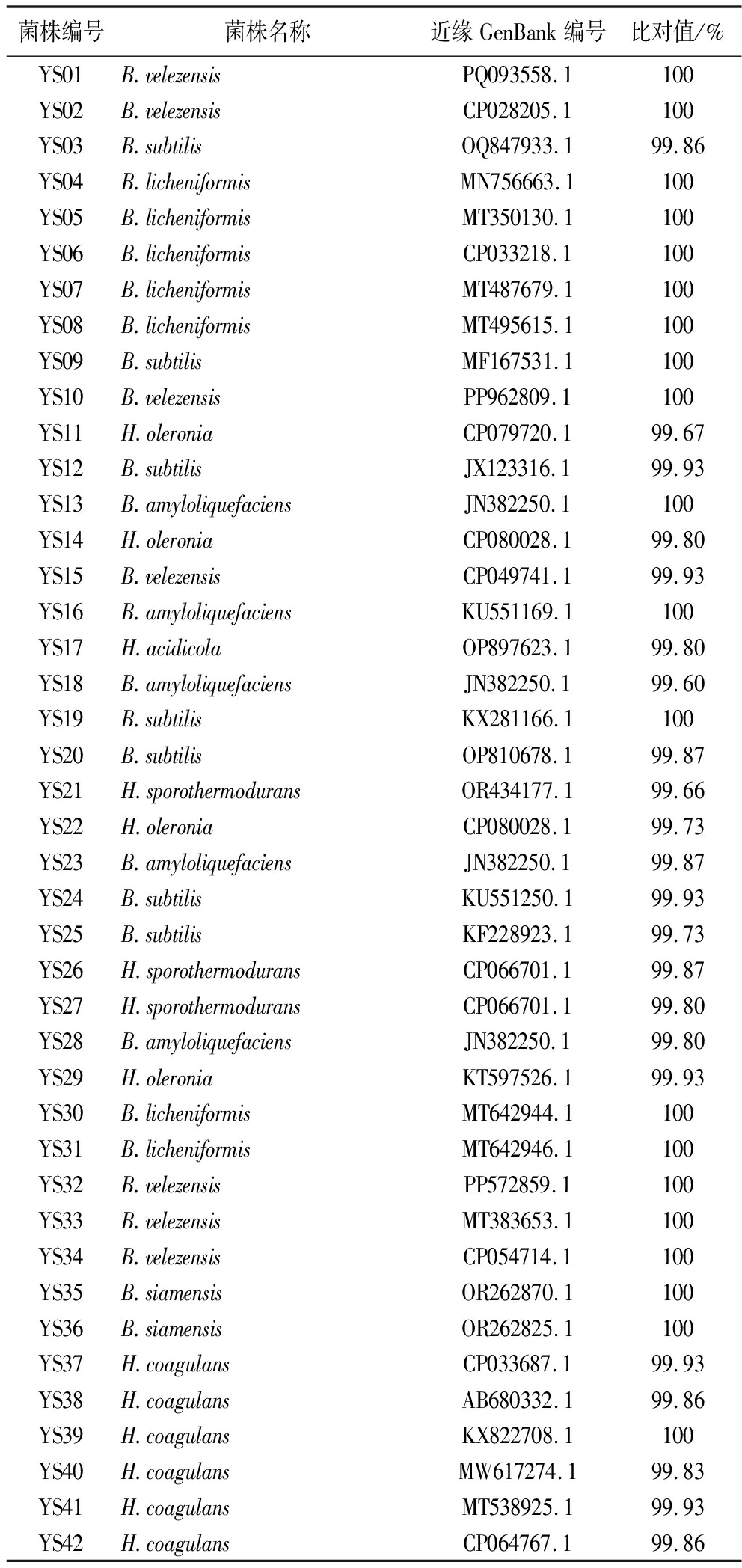
菌株编号菌株名称近缘GenBank编号比对值/%YS01B.velezensisPQ093558.1100YS02B.velezensisCP028205.1100YS03B.subtilisOQ847933.199.86YS04B.licheniformisMN756663.1100YS05B.licheniformisMT350130.1100YS06B.licheniformisCP033218.1100YS07B.licheniformisMT487679.1100YS08B.licheniformisMT495615.1100YS09B.subtilisMF167531.1100YS10B.velezensisPP962809.1100YS11H.oleroniaCP079720.199.67YS12B.subtilisJX123316.199.93YS13B.amyloliquefaciensJN382250.1100YS14H.oleroniaCP080028.199.80YS15B.velezensisCP049741.199.93YS16B.amyloliquefaciensKU551169.1100YS17H.acidicolaOP897623.199.80YS18B.amyloliquefaciensJN382250.199.60YS19B.subtilisKX281166.1100YS20B.subtilisOP810678.199.87YS21H.sporothermoduransOR434177.199.66YS22H.oleroniaCP080028.199.73YS23B.amyloliquefaciensJN382250.199.87YS24B.subtilisKU551250.199.93YS25B.subtilisKF228923.199.73YS26H.sporothermoduransCP066701.199.87YS27H.sporothermoduransCP066701.199.80YS28B.amyloliquefaciensJN382250.199.80YS29H.oleroniaKT597526.199.93YS30B.licheniformisMT642944.1100YS31B.licheniformisMT642946.1100YS32B.velezensisPP572859.1100YS33B.velezensisMT383653.1100YS34B.velezensisCP054714.1100YS35B.siamensisOR262870.1100YS36B.siamensisOR262825.1100YS37H.coagulansCP033687.199.93YS38H.coagulansAB680332.199.86YS39H.coagulansKX822708.1100YS40H.coagulansMW617274.199.83YS41H.coagulansMT538925.199.93YS42H.coagulansCP064767.199.86
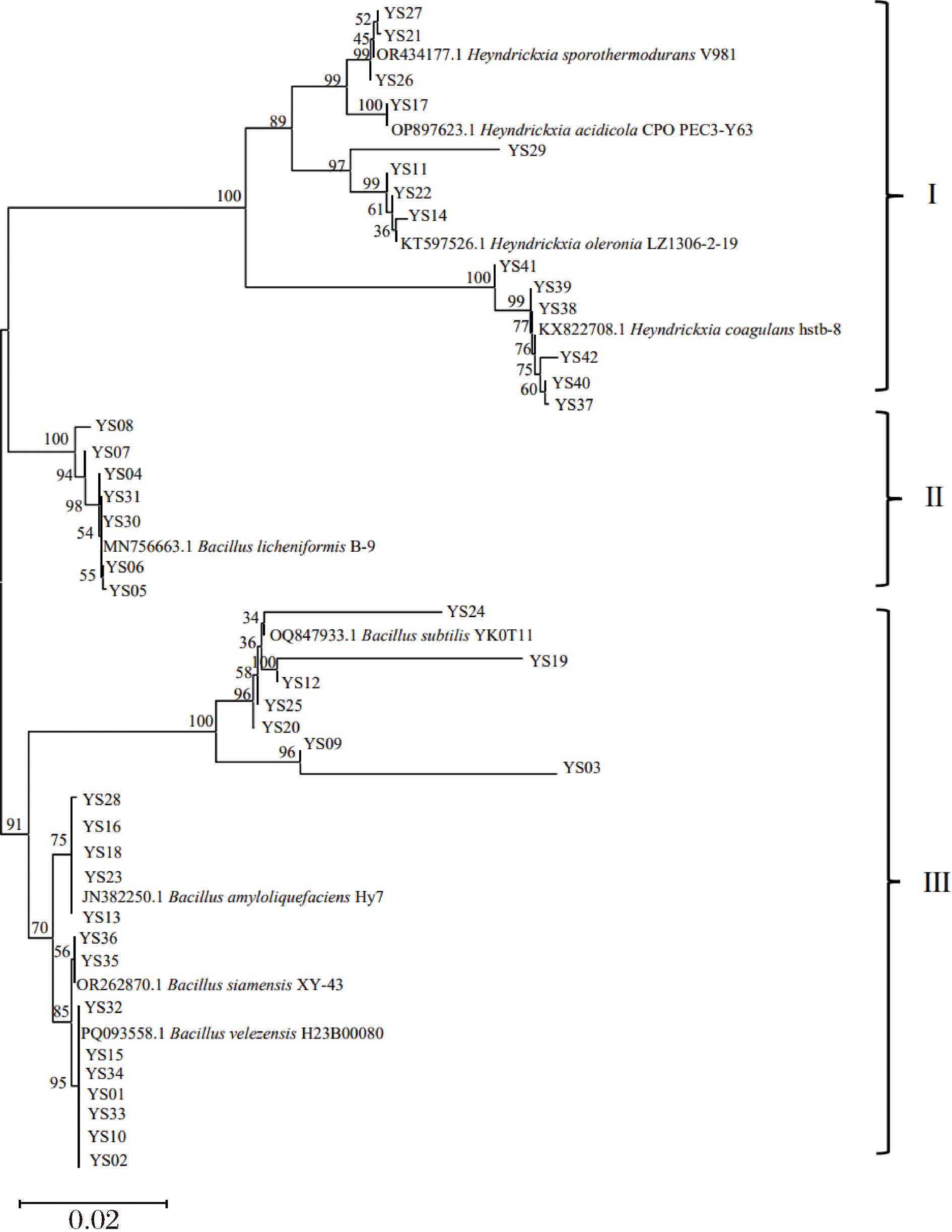
图2 以42株芽孢杆菌菌株16S rRNA基因序列构建的系统发育树
Fig.2 Phylogenetic tree constructed with 16S rRNA gene sequences of 42 Bacillaceae strains
2.3 产乙偶姻芽孢杆菌的筛选
对分离得到的42株芽孢杆菌的产乙偶姻能力进行了测定(图3),并观察到了不同菌株之间的差异。分离得到的芽孢杆菌乙偶姻产量为(43.42±8.22)~(1 260.36±74.57) mg/L。这一结果与李晓梅[16]的报道接近,其筛选的36株芽孢杆菌产乙偶姻产量为320~1 460 mg/L。共有9株芽孢杆菌乙偶姻产量高于1 000 mg/L,其中B.velezensis YS10的产乙偶姻能力最强,为(1 260.36±74.57) mg/L。发酵过程中丰度最高的H.coagulans中,YS37产乙偶姻产量为(246.83±19.04) mg/L。乙偶姻是四川麸醋中重要的挥发性风味物质[19],能显著改善醋的风味,并且已被我国列入食品添加剂名单中,在食品、制药等行业中被广泛应用[20]。考虑到各菌株在发酵过程中的相对丰度,和产乙偶姻能力,选择H.coagulans YS37以及9株乙偶姻产量较高的菌株进行后续不同发酵环境条件下生长情况的研究。
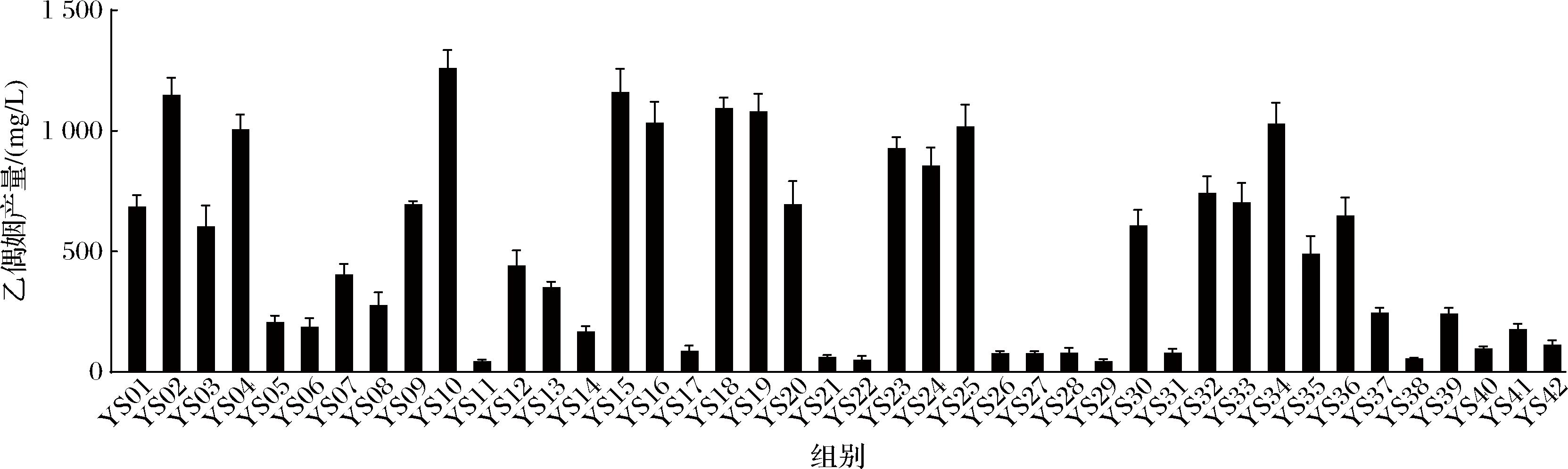
图3 42株芽孢杆菌乙偶姻产量
Fig.3 Acetoin production of 42 Bacillaceae strains
2.4 不同发酵环境条件下芽孢杆菌的生长情况
2.4.1 不同温度条件下的生长情况
芽孢杆菌最适生长温度大多为30~37 ℃,温度过高会阻碍菌株生长代谢,温度过低菌株生长缓慢。在醋醅发酵过程中,温度可达到45 ℃。因此耐高温的芽孢杆菌在醋醅发酵过程中具有一定优势。
探究了10株芽孢杆菌在不同温度条件下的生长情况,结果如图4所示。随着温度的升高,各菌株生物量呈现先增加再降低的趋势。大多数芽孢杆菌在37 ℃和40 ℃条件下生长较好。当温度为45 ℃和50 ℃时,YS37生物量显著高于其他菌株(P<0.05)。这一结果与乔羽等[21]的研究结果类似,其筛选的6株芽孢杆菌在50 ℃条件下生长均被抑制。
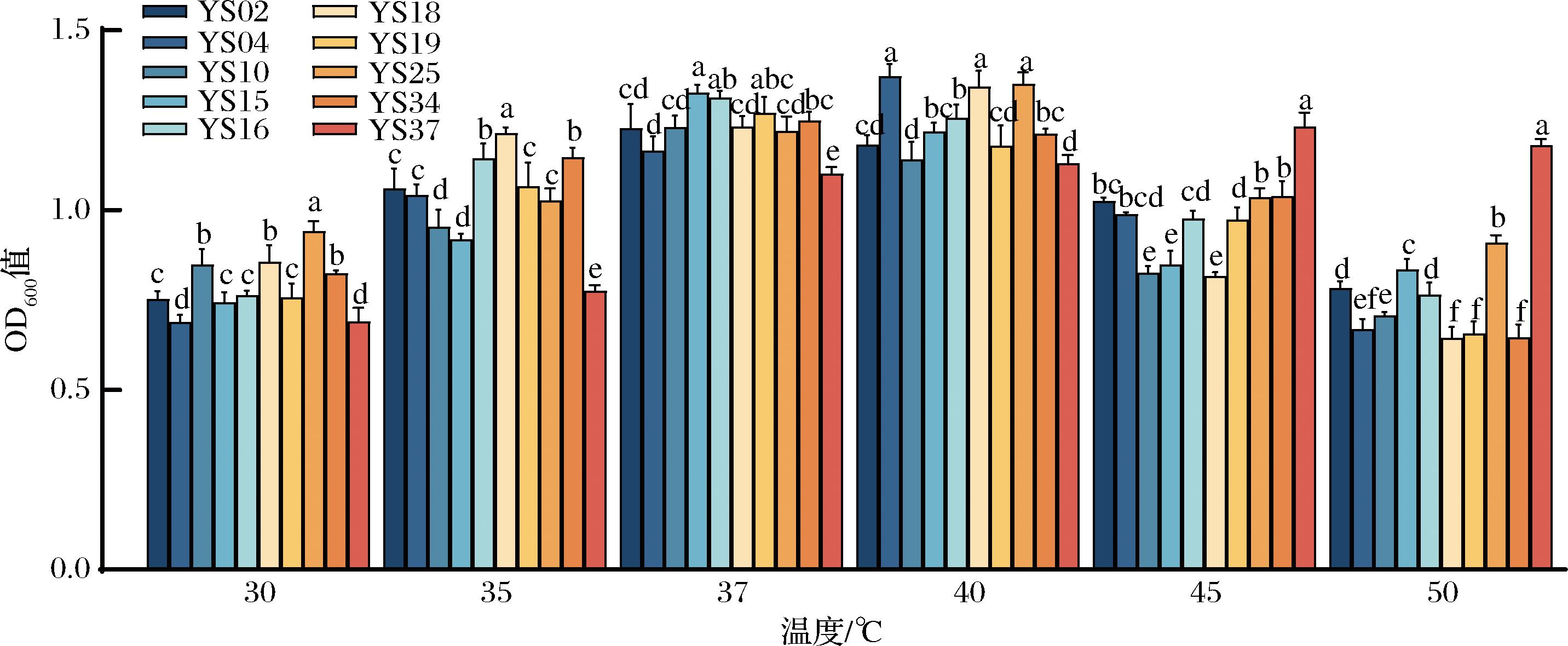
图4 芽孢杆菌不同温度下的生长情况
Fig.4 Growth of Bacillaceae under different temperature
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4.2 不同乙醇含量条件下的生长情况
在醋醅发酵过程中,酵母菌能在厌氧条件下利用糖类物质产生乙醇。当醋醅中乙醇含量较高时会在一定程度上抑制其他微生物的生长。因此在高乙醇含量下生长较好的芽孢杆菌能够更好适应醋醅发酵环境。
探究了10株芽孢杆菌在不同乙醇含量下的生长情况,结果如图5所示。随着乙醇体积分数的增加,各菌株的生物量呈现下降趋势。在1%、2%、3%、4%乙醇条件下,各菌株生长均良好。在5%乙醇条件下,各菌株生长均受到抑制。其中YS15、YS18、YS37在5%乙醇条件下生物量显著高于其他菌株(P<0.05)。这一结果与武雨薇等[22]的研究结果类似,其筛选的5株芽孢杆菌在乙醇≥5%的条件下生长被抑制。
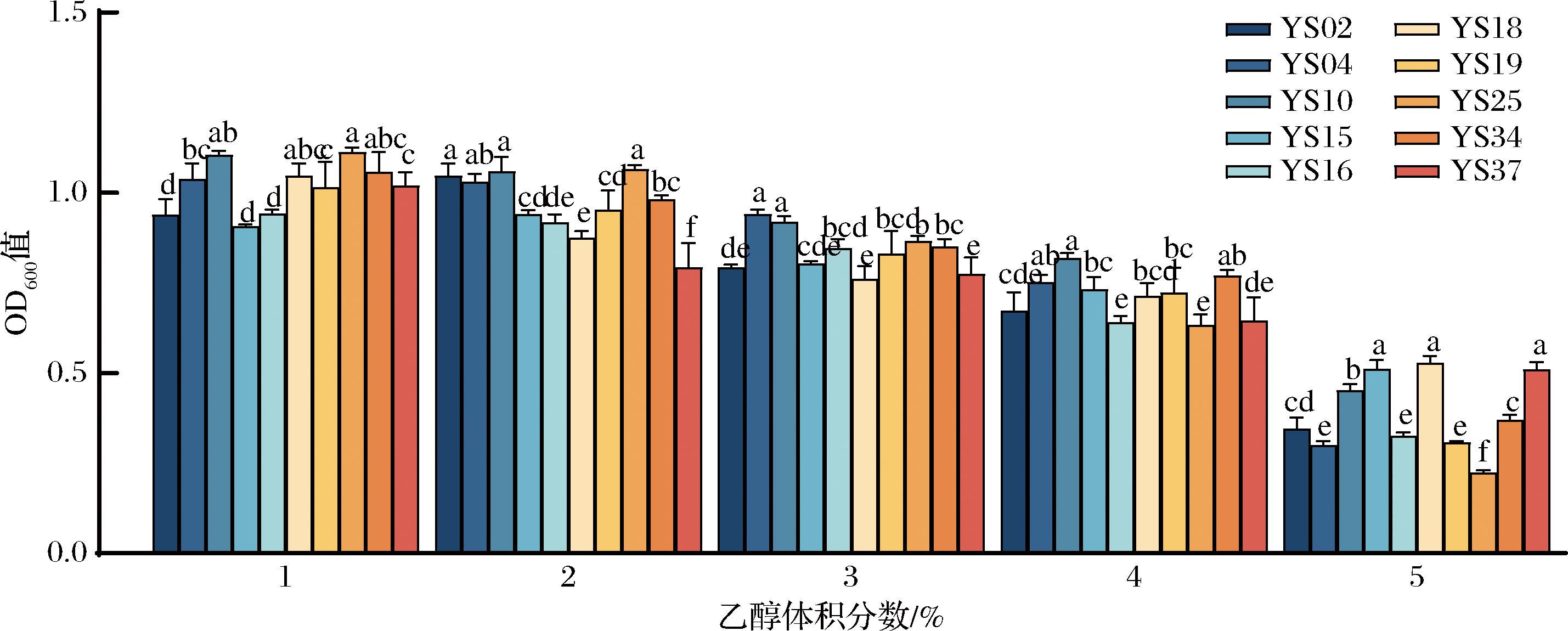
图5 芽孢杆菌不同乙醇含量下的生长情况
Fig.5 Growth of Bacillaceae under different ethanol contents
2.4.3 不同pH条件下的生长情况
随着发酵时间的延长,醋醅中的酸度会不断增加,从而抑制微生物的生长代谢。探究了10株芽孢杆菌在不同pH条件下的生长情况,结果如图6所示。随着酸度的增加,各菌株的生物量呈现下降趋势。pH值为5.0时,各菌株生长良好,YS02和YS37生物量显著高于其他菌株(P<0.05)。pH≤4.5时,所有菌株生长均受到抑制。pH值为4.5时,YS10和YS37生物量显著高于其他菌株(P<0.05)。pH值为4.0、3.5、3.0时,YS37生物量显著高于其他菌株(P<0.05)。这一结果与乔羽等[23]的研究结果类似,其筛选的6株芽孢杆菌在pH值为3.5时生长均受到抑制。
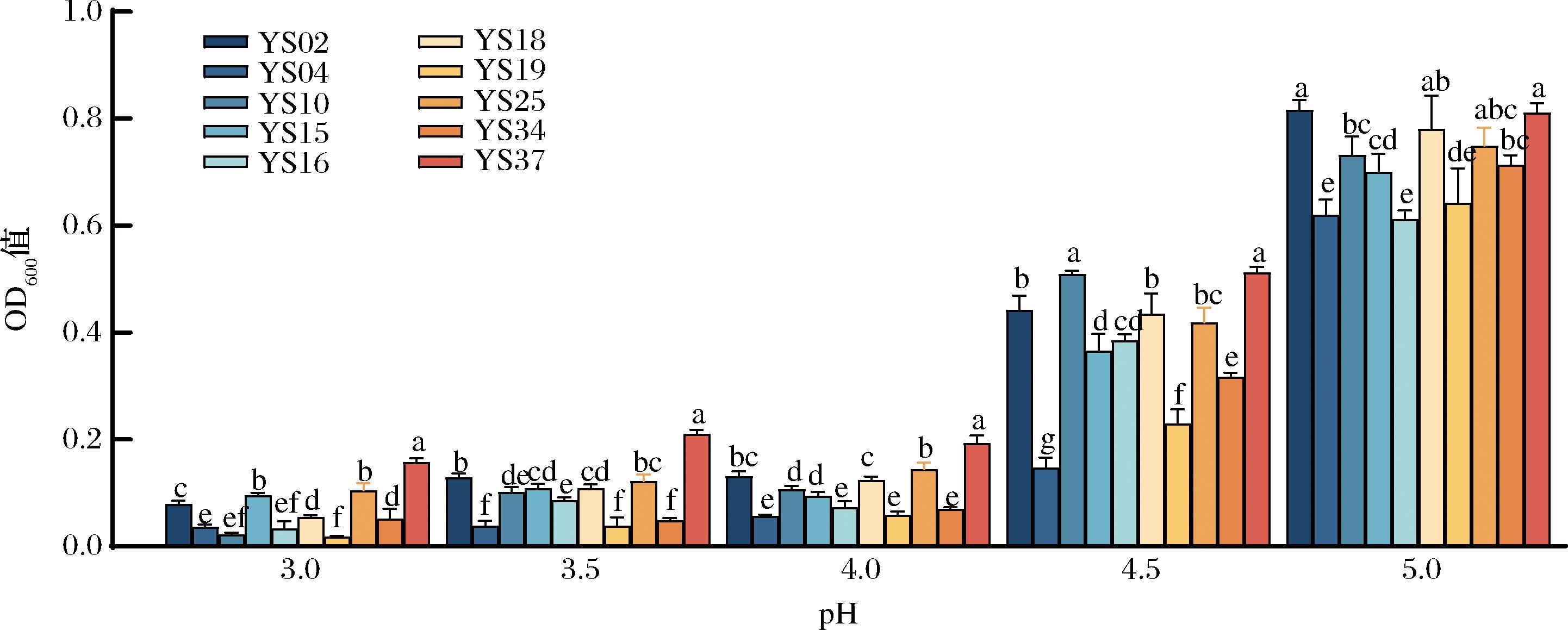
图6 芽孢杆菌不同pH条件下的生长情况
Fig.6 Growth of Bacillaceae under different pH
3 结论
宏基因组测序分析表明,在四川麸醋发酵过程中占主导地位的芽孢杆菌是凝结芽孢杆菌。此外,未分类的魏茨曼属、热噬淀粉芽孢杆菌等是也发酵过程中的优势物种。传统分离培养法共得到42株芽孢杆菌,共2个属,9个种,其中地衣芽孢杆菌、凝结芽孢杆菌和贝莱斯芽孢杆菌占比最高。贝莱斯芽孢杆菌YS10乙偶姻产量最高,为(1 260.36±74.57) mg/L。结合宏基因组测序结果和产乙偶姻能力,共选择10株芽孢杆菌,比较了其在不同发酵环境条件下的生长特性。凝结芽孢杆菌YS37在50 ℃条件下生长较好,贝莱斯芽孢杆菌YS15、解淀粉芽孢杆菌YS18及凝结芽孢杆菌YS37在5%乙醇条件下生长较好,所有菌株在pH≤4.0时生长受到明显抑制。本研究丰富了芽孢杆菌菌种资源,未来可将筛选得到的优良芽孢杆菌强化应用到实际生产中,并研究其对微生物群落及食醋风味的影响。
[1] HAN D, YANG Y S, GUO Z T, et al.Metagenomics profiling of the microbial community and functional differences in solid-state fermentation vinegar starter (seed Pei) from different Chinese regions[J].Frontiers in Microbiology, 2024, 15:1389737.
[2] HU Y, ZHENG C Y, CHEN H Y, et al.Characteristics and discrimination of the commercial Chinese four famous vinegars based on flavor compositions[J].Foods, 2023, 12(9):1865.
[3] LIU A P, WANG R, LI J L, et al.Multiple rounds of Aspergillus niger biofortification confer relatively stable quality with minor changes of microbial community during industrial-scale Baoning vinegar production[J].Food Research International, 2021, 150:110768.
[4] LIU A P, OU Y X, SHU H J, et al.Exploring the role of Sichuan Baoning vinegar microbiota and the association with volatile flavor compounds at different fermentation depths[J].Frontiers in Microbiology, 2023, 14:1135912.
[5] 李林梅, 刘柠, 马长义, 等.枯草芽胞杆菌NRCB002发酵液的促生效应及高产乙偶姻发酵条件优化[J].南京农业大学学报, 2024,47(6):1105-1112.LI L M, LIU N, MA C Y, et al.Growth promoting effects of fermentation broth and optimization of high-yield acetoin fermentation conditions of Bacillus subtilis NRCB002[J].Journal of Nanjing Agricultural University, 2024,47(6):1105-1112.
[6] 林源.酿酒酵母乙偶姻、高级醇的协同代谢调控研究[D].济南:齐鲁工业大学, 2024.LIN Y.Synergistic metabolic regulation of acetoin and higher alcohols in Saccharomyces cerevisiae[D].Jinan:Qilu University of Technology, 2024.
[7] 郎繁繁, 夏瑶瑶, 申瑾, 等.不同酿造工艺对山西老陈醋乙偶姻及川芎嗪含量的影响[J].中国酿造, 2024, 43(6):128-132.LANG F F, XIA Y Y, SHEN J, et al.Effects of different brewing techniques on the contents of acetoin and ligustrazine in Shanxi aged vinegar[J].China Brewing, 2024, 43(6):128-132.
[8] 陈媛媛, 陈德茗, 李子健, 等.产乙偶姻菌株的分离鉴定及其对固态混菌发酵产物的影响[J].中国酿造, 2024, 43(3):84-89.CHEN Y Y, CHEN D M, LI Z J, et al.Isolation and identification of acetoin-producing strain and its effect on solid-state multi-microbial fermentation products[J].China Brewing, 2024, 43(3):84-89.
[9] 史改玲, 许女, 贾瑞娟, 等.山西老陈醋源优良芽孢杆菌菌株的鉴定及筛选[J].中国酿造, 2018, 37(5):22-27.SHI G L, XU N, JIA R J, et al.Identification and screening of superior Bacillus strains from Shanxi aged vinegar[J].China Brewing, 2018, 37(5):22-27.
[10] LIU A P, PAN W S, LI S, et al.Seasonal dynamics of microbiota and physicochemical indices in the industrial-scale fermentation of Sichuan Baoning vinegar[J].Food Chemistry:X, 2022, 16:100452.
[11] LIU A P, PENG Y, AO X L, et al.Effects of Aspergillus niger biofortification on the microbial community and quality of Baoning vinegar[J].LWT, 2020, 131:109728.
[12] 刘丹彤.基于宏基因组测序揭示山西老陈醋菌群功能[D].晋中:山西农业大学, 2021.LIU D T.Metagenomic analysis of the function of Shanxi aged vinegar microflora[D].Jinzhong:Shanxi Agricultural University, 2021.
[13] LI N, FU J J, ZHANG G R, et al.Investigating the mechanism of the flavor formation in Sichuan Sun vinegar based on flavor-orientation and metagenomics[J].Current Research in Food Science, 2023, 6:100460.
[14] 沈晓熳, 杨炽光, 翁晨虹, 等.枯草芽孢杆菌RN8的抗菌活性成分分离及其作用机制[J].中国生物工程杂志, 2024, 44(7):12-28.SHEN X M, YANG C G, WENG C H, et al.Isolation of antibacterial active components from Bacillus subtilis RN8 and their mechanism of action[J].China Biotechnology, 2024, 44(7):12-28.
[15] 邱婷.产乙偶姻微生物群落的合成及其在传统食醋酿造过程的应用[D].无锡:江南大学, 2019.QIU T.Synthesis of acetoin-producing microbial community and its application in traditional vinegar brewing process[D].Wuxi:Jiangnan University, 2019.
[16] 李晓梅.山西老陈醋源优良芽孢杆菌的筛选、互作及原位强化研究[D].晋中:山西农业大学, 2020.LI X M, Screening of excellent Bacillus from Shanxi aged vinegar and study of interaction and enhancement with other excellent strains in alcohol fermentation[D].Jinzhong:Shanxi Agricultural University, 2020.
[17] LIU J X, YU Y J, YE X T, et al.Exploring the ecological interactions of Bacillus and their contribution to characteristic aroma components in Zhenjiang aromatic vinegar[J].Food Bioscience, 2023, 54:102900.
[18] 贾瑞娟, 陈旭峰, 胡开燕, 等.山西老陈醋优良芽孢菌与醋酸菌、乳酸菌的相互作用[J].中国食品学报, 2021, 21(9):57-70.JIA R J, CHEN X F, HU K Y, et al.Interaction of excellent Bacillus, acetic acid bacteria and lactic acid bacteria isolated from Cupei of Shanxi aged vinegar[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):57-70.
[19] 潘婉舒.季节变化对保宁醋发酵过程中细菌菌群及风味物质的影响[D].雅安:四川农业大学, 2019.PAN W S.Effects of seasonal variation on bacteria flora and flavor substances in the fermentation of Baoning vinegar[D].Ya’an:Sichuan Agricultural University, 2019.
[20] 张玲玲, 罗惠波, 黄丹, 等.一株高产乙偶姻芽孢杆菌菌株筛选及发酵条件优化[J].现代食品科技, 2021, 37(5):71-81.ZHANG L L, LUO H B, HUANG D, et al.Screening of a Bacillus strain with high acetoin-producing ability and optimization of its fermentation conditions[J].Modern Food Science and Technology, 2021, 37(5):71-81.
[21] 乔羽, 于迪, 范振宇, 等.山西老陈醋发酵过程中高产蛋白酶芽孢杆菌的筛选与鉴定[J].食品与发酵科技, 2017, 53(6):11-16;33.QIAO Y, YU D, FAN Z Y, et al.Screening and identification of high yield protease-producing Bacillus in fermentation process of Shanxi mature vinegar[J].Food and Fermentation Science &Technology, 2017, 53(6):11-16;33.
[22] 武雨薇, 帖余, 唐之兴, 等.四川麸醋醅中功能芽孢杆菌的分离鉴定及发酵性能评价[J].食品工业科技, 2025,46(2):122-131.WU Y W, TIE Y, TANG Z X, et al.Isolation and identification of functional Bacillus strain from Cupei of Sichuan bran vinegar and evaluation of its fermentation characteristics[J].Science and Technology of Food Industry, 2025,46(2):122-131.
[23] 乔羽, 于迪, 邢晓莹, 等.山西老陈醋发酵阶段高产淀粉酶芽孢杆菌的筛选与鉴定[J].中国酿造, 2018, 37(1):30-34.QIAO Y, YU D, XING X Y, et al.Screening and identification of high yield amylase-producing Bacillus in fermentation stage of Shanxi mature vinegar[J].China Brewing, 2018, 37(1):30-34.