燕麦是世界第六大谷物,富含优质膳食纤维、维生素和不饱和脂肪酸[1-2]。燕麦中含丰富的蛋白质及人体必需的氨基酸,特别是赖氨酸含量较高,是小麦、稻米的2倍以上。通常燕麦中蛋白质含量为12%~20%,赖氨酸含量为72%~75%,膳食纤维约占3.1%[3],可溶性和不可溶性膳食纤维的比例接近1.1∶1[4-5]。β-葡聚糖是燕麦中主要的可溶性膳食纤维,存在于燕麦胚乳和糊粉层细胞壁的一种非淀粉多糖,可降低低密度脂蛋白胆固醇水平、抗增殖特性和预防心脑血管疾病[6-7]。目前,以燕麦为基础的食品仅限于燕麦片、面粉和谷物早餐,其他类别产品尚未被充分开发[8]。
根据联合国粮食及农业组织/世界卫生组织的报道,益生菌是通过定殖在人体内,改变宿主某一部位菌群组成的一类对宿主有益的活性微生物[9]。乳制品是益生菌常见的发酵载体,发酵酸奶及乳饮料产品种类繁多。然而,乳糖不耐症和乳蛋白过敏限制了乳制品的发展。谷物也是乳酸菌和双歧杆菌等微生物生产发酵食品的合适底物[10],研究表明,以燕麦为基础的非乳制品适合益生菌菌株的生长。乳酸菌中植物乳植杆菌是一个重要的菌株,具有调节肠道菌群和提高免疫系统的作用,植物乳植杆菌已广泛应用于酸奶、果汁、奶酪等发酵产品[11-12]。本课题组前期的实验发现,分离于婴儿粪便的植物乳植杆菌ZJ316(GeneBank No.CP004082,简称ZJ316)可做为发酵泡菜和低温火腿的发酵剂且稳定性较高。因此,本研究旨在筛选具有高活性的乳酸菌菌株,探讨ZJ316等乳酸菌在燕麦中应用的可行性,以燕麦为原料研发发酵饮料,并对饮料的挥发性成分、益生菌存活力、后酸化和贮存期稳定性进行分析。开发长保质期高活性的燕麦发酵饮料可拓展燕麦等谷物原料的应用,有助于为燕麦发酵产品的开发提供理论依据和实践指导。
1 材料与方法
1.1 材料与试剂
全燕麦粉[蛋白质(12.35±0.15)%、脂肪(6.89±0.12)%、碳水化合物(58.27±1.26)%、膳食纤维(12.89±0.56)%],中国桂林西麦股份有限公司;鼠李糖乳酪杆菌GG(Lactobacillus rhamnosus GG,LGG)分离于内蒙古伊利有限公司发酵乳;干酪乳酪杆菌Shirota(Lacticaseibacillus casei Shirota,LcS)分离于养乐多产品;植物乳植杆菌ZJ316分离于健康婴儿粪便,该菌株的完整核苷酸序列已提交至GenBank,登录号为:CP004082;副干酪乳酪杆菌ZB25(ZB25)、嗜酸乳杆菌ZB18(ZB18)、罗伊氏粘液乳杆菌ZB86(ZB86),浙江省食品微生物技术研究重点实验室。
3-羟基丁酸乙酯,Supelco公司;正戊烷、正己烷、己醛、4-甲基庚烷、辛烷、丙酮、2,4-二甲基-1-庚烯、乙醇、戊醛、2,3-丁二酮、十一烷、三氯甲烷、2,3-戊二酮、己醛、2-羟基-2-丁二酮、庚醛、2,4-二甲基-3-羰基戊酸甲酯、2-庚烯、1-己醇、非醛、2-辛烯、1-己醇、非醛、2-辛烯、2-辛烯、2,3-二叔丁基苯、乙酸、2-乙基-4-甲基-1-戊烯醇、2-乙基-4-甲基-1-戊烯醇、2-辛烯醇、2-辛烯醇、2-辛烯醇、2-辛烯醇、2-辛烯醇、2-辛烯醇、2-辛烯醇、2,3-二叔丁基苯、苯甲醛、2-庚烯-1-醇、3,5-辛基二烯-2-酮、1-辛醇、2-辛烯-1-醇、对甲基苯甲醛、2-癸烯、1-壬醇、2-甲基己酸、3-乙基-2,4-戊二烯-1-醇、2,4-癸二烯、2-三烯酮、己酸、1-十二烷基醇、2-五烯酮、辛酸、壬酸,西格玛有限公司。
1.2 仪器与设备
58108冷冻高速离心机,德国Eppendorf有限公司;HP 7890B气相色谱-质谱仪,德国安捷伦公司;GB204电子分析天平,瑞士Mettler Toledo公司;MSN780高压蒸汽灭菌锅,日本三洋公司;BCG401生物安全柜,美国Baker公司;BF115恒温培养箱,德国Binder有限公司,Olympus IX83显微镜,日本奥林巴斯公司。
1.3 实验方法
1.3.1 高活性乳酸菌的筛选
制备pH值为6.0的MRS无碳源基础培养基(g/L):色氨酸15、牛肉粉10、酵母膏5、大豆蛋白胨5、磷酸氢二钾0.0237、柠檬酸二铵2、醋酸钠5、硫酸镁0.86、吐温80 1。6株乳酸菌(LGG、LcS、ZJ316、ZB18、ZB25、ZB86)经传代纯化后,分别取2 mL接种于200 mL的MRS-葡萄糖、MRS-蔗糖、MRS-乳糖、MRS-果糖、MRS-半乳糖培养基中(MRS基础培养基中添加30 g/L不同糖)。菌悬液分别在25 ℃下培养8周,每周取样平板菌落计数法测定乳酸菌存活率。
1.3.2 燕麦发酵样品制备
将全燕麦粉(150 g/L)充分振荡混匀3次,加入3%(质量分数)果糖,75 ℃加热1 h,95 ℃灭菌10 min,冷却至30 ℃,ZJ316和LGG(10 g/L接种量)接种至燕麦溶液中,接种后的燕麦混合物在25 ℃下发酵8周后,加入益生元、稳定剂和柠檬酸,30 MPa均质2次,燕麦发酵饮料的配方为(质量分数):燕麦粉10%、菊粉2%、果胶0.1%、k-卡拉胶0.1%、柠檬酸0.1%,制备出燕麦发酵饮料,并在25 ℃下贮藏,每周测定pH及细菌总数。
1.3.3 发酵燕麦饮品挥发性成分分析
将20 mL燕麦样品加入到50 mL的琥珀色玻璃小瓶中,用聚四氟乙烯(Polytetrafluoroethylene,PTFE)硅胶隔膜盖上盖子,然后加入20 μL的3-羟基丁酸乙酯作为内标(1 mg/L甲醇)。将混合物在35 ℃的水浴中加热15 min并搅拌,采用顶空固相微萃取法提取挥发性风味化合物,探头插入顶空瓶中提取40 min后,在250 ℃下解吸5 min。采用GC-MS仪对提取液的主要挥发性成分进行分析。采用质量选择检测器,选用熔融石英毛细管柱,载气为氦气,流速为1.0 mL/min。根据挥发性化合物的峰面积与3-羟基丁酸乙酯内标的峰面积测定挥发性成含量[13]。
1.3.4 燕麦发酵饮料的理化性质
植物乳植杆菌ZJ316的燕麦发酵饮料在25 ℃条件下保存4个月,每2周取样测定黏度、酸度、益生菌存活率及感官评价,采用平板计数法测定细菌计数。滴定酸度用0.1 mol/L NaOH溶液将100 g样品的pH值调节到8.0。按照公式(1)计算酸度:
酸度![]()
(1)
式中:Vi,用于调节样品pH值至8.3的NaOH溶液体积;V0,用于调节水pH值至8.3的0.1 moL/L NaOH溶液体积;mS,样品质量(g)[14]。
黏度测量使用Brookfield黏度计,感官评价按照国际标准进行培训(https://www.iso.org/standard/45352.html),培训20名审核员,使受训者能够理解测试程序,对样本进行数字编码,随机分发,可接受性基于颜色、质地、风味和口感等方面,由评估人员以0~10分进行评分,感官测试在配备独立隔间的感官实验室中进行。
1.4 数据处理
燕麦发酵饮料中的挥发性化合物主成分分析采用瑞典SIMCA-P 11.0软件,统计分析使用SPSS version 23,采用单因素方差分析和最小显著差异法检验分析组间差异[15]。
2 结果与分析
2.1 高活性优良乳酸菌的筛选
6株乳酸菌在不同碳源MRS培养基中菌株活力如图1所示。除ZJ316外,其他菌株在MRS-葡萄糖培养基中5周后无活菌检出。MRS-果糖、MRS-乳糖培养基中,培养8周后,ZJ316和LGG仍具有较高的存活能力,MRS-果糖培养基中,2个菌株的活菌数随着发酵时间的延长均呈下降趋势,ZJ316菌株的活菌数下降3.0 lg CFU/mL,LGG菌株的活菌数下降5.0 lg CFU/mL。在MRS-乳糖培养基中培养8周后,ZJ316和LGG的活菌数下降了约6 lg CFU/mL。MRS-半乳糖和MRS-蔗糖培养基中,ZJ316和LcS的存活率高于其他菌株。MRS-半乳糖中培养8周后,ZJ316的活菌数为3.86 lg CFU/mL,LcS的活菌数为1.06 lg CFU/mL,MRS-蔗糖培养基中ZJ316的活菌数下降5.0 lg CFU/mL,菌株LcS的活菌数下降6.2 lg CFU/mL。在贮藏过程中,ZJ316菌株在不同MRS碳水化合物中均表现出较高的生存能力,特别是在MRS-果糖中,培养8周后,其活菌数仍可达到105 CFU/mL。
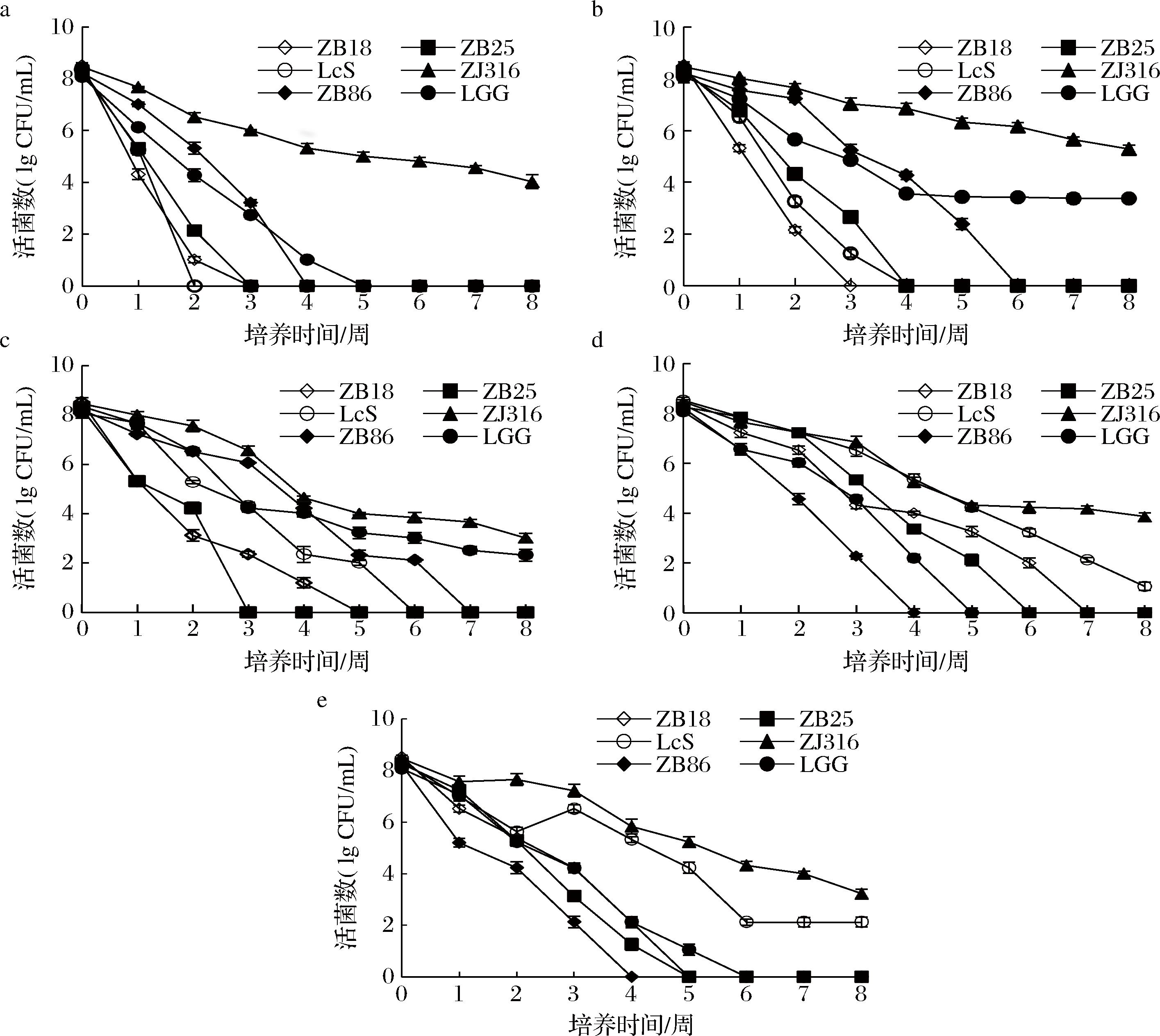
a-MRS-葡萄糖;b-MRS-果糖;c-MRS-乳糖;d-MRS-半乳糖;e-MRS-蔗糖
图1 不同碳源MRS培养基中乳酸菌的活力
Fig.1 The survivability of lactic acid bacteria strains in MRS culture with different carbon sources
葡萄糖、果糖、乳糖、半乳糖和蔗糖是乳酸菌生长所必需的碳源,乳酸菌利用不同种类的糖代谢产生乳酸,乳酸菌的代谢途径与糖的种类有关具有特异性影响菌株的活力。乳酸菌的糖代谢途径具有特异性,与糖的类型有关,主要有3种途径即磷酸烯醇丙酮酸-磷酸转移酶系统、ABC转运系统(ABC transporter)及透性酶系统,乳酸菌的糖代谢机制可影响菌株的生长活力[16-17]。本文通过筛选在燕麦体系中适宜发酵的益生菌并确定菌株生长代谢最适的碳源。实验表明,植物乳植杆菌ZJ316菌株是一种潜在的高活性菌株,果糖是此菌株的最适碳源。
2.2 燕麦发酵饮料的稳定性
研究表明LGG具有高活性和抗逆性,作为对照菌株[18],以果糖为碳源,菊粉为益生元制备燕麦饮料,室温下贮藏,分析乳酸菌在燕麦发酵饮料的稳定性,细胞活力和pH变化如图2所示。ZJ316燕麦饮料贮藏8周后,pH值保持在4.5,活菌数为2.5×107 CFU/mL。LGG燕麦饮料贮藏期间,活菌数从8 lg CFU/mL急剧下降到3 lg CFU/mL,pH值从4.75下降到3.62。
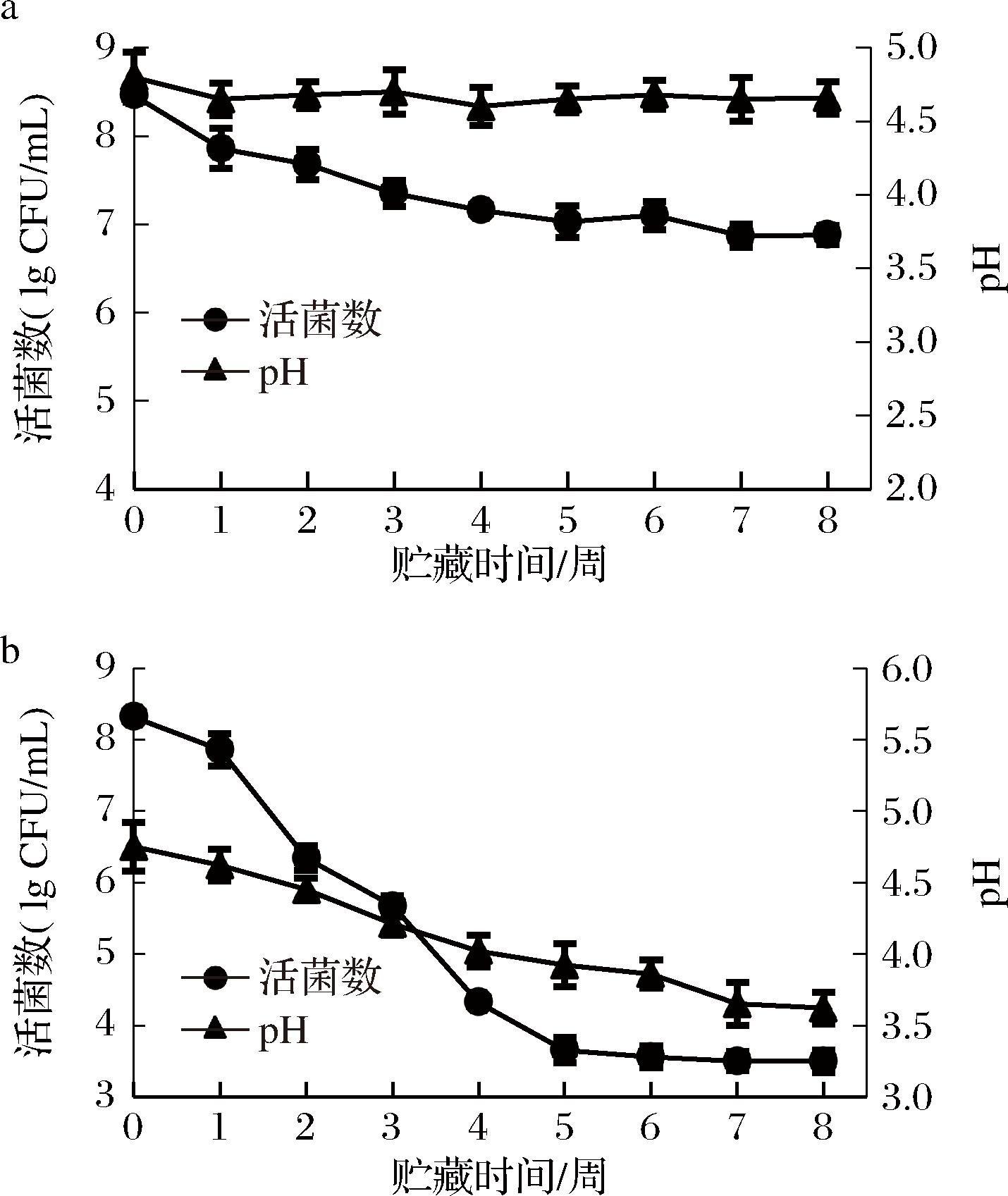
a-ZJ316;b-LGG
图2 乳酸菌燕麦饮料稳定性
Fig.2 The stability of lactic acid bacteria oat beverage
菌株ZJ316在燕麦共生饮料中表现出较高的稳定性,可能与果糖有关,其在果糖中缓慢代谢弱酸化并维持活力稳定。乳酸菌的果糖代谢途径通常为2种:a)果糖在果糖激酶的作用下,最终生成3-磷酸甘油醛进入糖酵解;b)果糖在己酮糖激酶作用下转化为D-1-磷酸果糖,催化生成3-磷酸甘油醛,再进入糖酵解[19]。研究表明,不同环境下的菌株耐受性及存活率与糖代谢途径相关,罗伊氏粘液乳杆菌ATCC55730的代谢过程中存在糖酵解和磷酸酮酶2种途径,添加果糖作为受体可以提高菌株的生长性能[20]。
2.3 燕麦发酵饮料挥发性风味成分
采用GC-MS分析植物乳植杆菌ZJ316发酵燕麦饮料在不同发酵时间的挥发性成分。50种挥发性化合物及其平均相对峰面积如附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.042292)所示,包括5种酸类、14种醇类、12种醛类、9种酮类、6种烷烃类、1种呋喃类、烯烃类、苯类和酯类。发酵前期,乙酸、辛酸、己醛、乙醇、2-氨基呋喃、2-甲基-2-丙醇、2,4-庚二烯醛的挥发性化合物含量呈下降趋势,随着发酵时间的延长,己醛和2-氨基呋喃的含量显著降低,这些化合物主要影响ZJ316接种后发酵燕麦的初始阶段。而壬醇、辛烯醛、2,3-丁二酮等挥发性物质在发酵前期未检出,发酵4周后含量显著增加,2,3-丁二酮的含量在发酵8周后达到最高值。研究表明,燕麦发酵过程中,己醛是常见的不良风味物质,其产生与脂肪氧化酶的氧化有关。2-氨基呋喃,产生刺激性气味可能是由于燕麦中亚油酸含量高和脂氧合酶活力高[21],壬醇具有令人愉悦的香气,如花香、果味、乳香等,辛醛被认为是大豆蛋白的关键风味化合物[22]。
主成分分析是一种使用最广泛的数据降维算法有利于数据的可视化。主成分分析燕麦发酵样品中挥发性化合物随发酵时间延长的变化如图3所示。主成分分析图解释了总方差的62.51%,其中36.68%来自第一主成分(PC1),25.83%来自第二主成分(PC2)。发酵初期(0、2、4周)位于正轴,发酵后期(6、8周)位于负轴。除壬醇外,大多数酸类、醇类均位于PC1轴阳性,且在发酵初期浓度变化明显。位于PC1负轴的丙酮酸代谢物2,4-二甲基-3-戊酸羰基甲酯和2,3-丁二酮浓度随着发酵时间的延长增加,这些化合物是乳酸菌发酵产物中的关键香气成分[23]。结果表明,燕麦发酵饮料在不同发酵时间挥发性成分存在差异。随着发酵时间的延长,植物乳植杆菌ZJ316燕麦饮料可产生2,3-丁二酮、辛烯醛等富含香气的挥发性物质,并降低2-氨基呋喃、己醛等刺激性物质的含量。
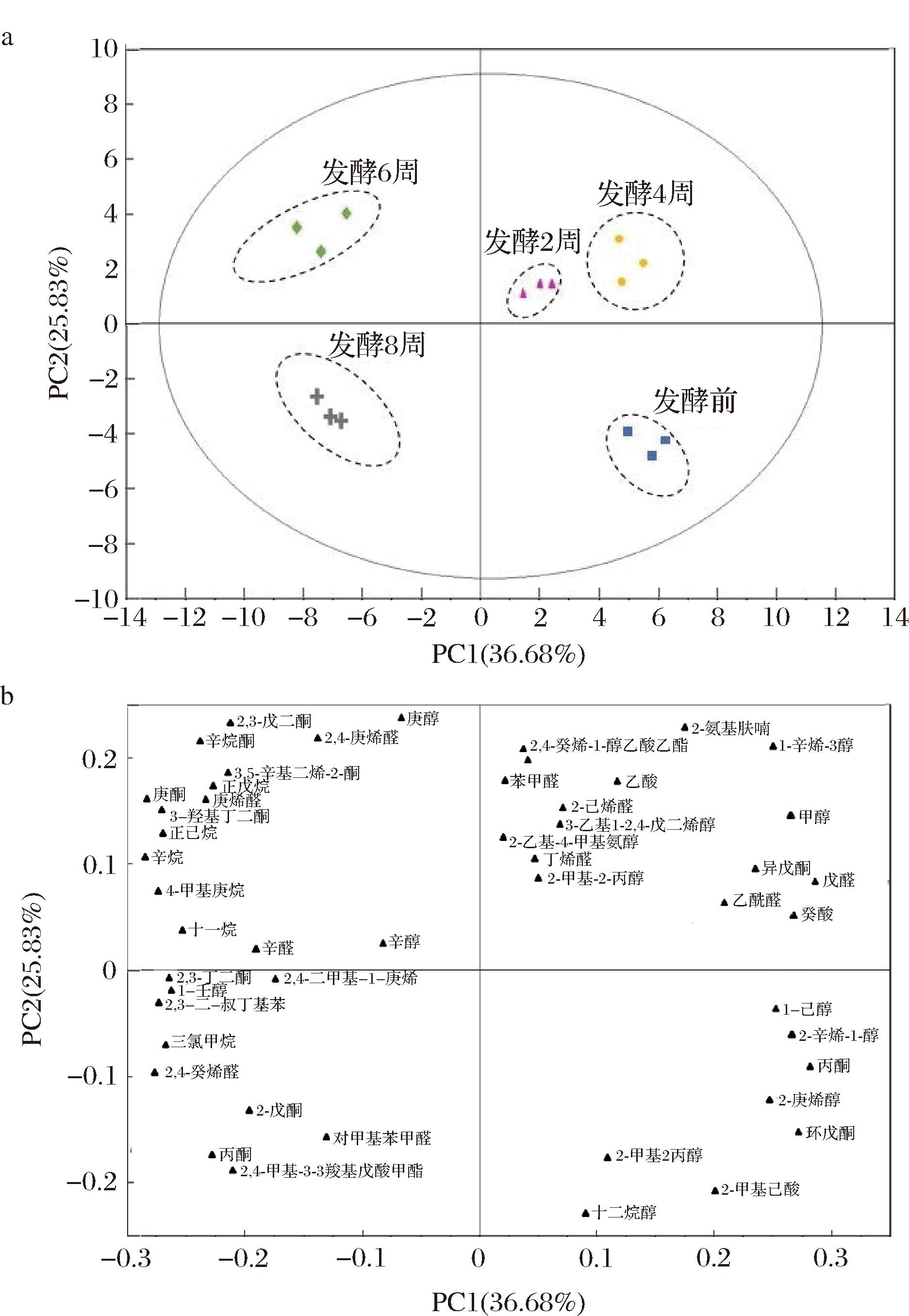
a-评分图;b-负荷图
图3 燕麦发酵饮料挥发性成分的主成分分析图
Fig.3 The principal component analysis diagram of volatile components of oat fermented beverage
2.4 燕麦发酵饮料贮藏期的感官分析及理化特性
滴定酸度可反映食品的腐败程度。燕麦饮料在贮存期间的益生菌活力和酸度如图4所示。保存4个月后,ZJ316的活菌为6.87 lg CFU/mL,滴定酸度为65~75 oT,属于可接受范围。饮料的黏度变化小于5 mPa·s可认为对饮料的质构影响不明显,贮藏4周后,黏度达到最高值为68.56 mPa·s。感官评价关系到消费者对新产品的接受程度和满意度。如图5所示,燕麦发酵饮料贮藏前,质地细腻、香气适中,无异味,可接受度评分为9.0分,贮藏4个月后,外观评分小幅下降,香味评分提高,质地无分层、无异味,可接受度评分仍有8.2分,表明燕麦饮料在贮存过程中仍有良好的感官性状。
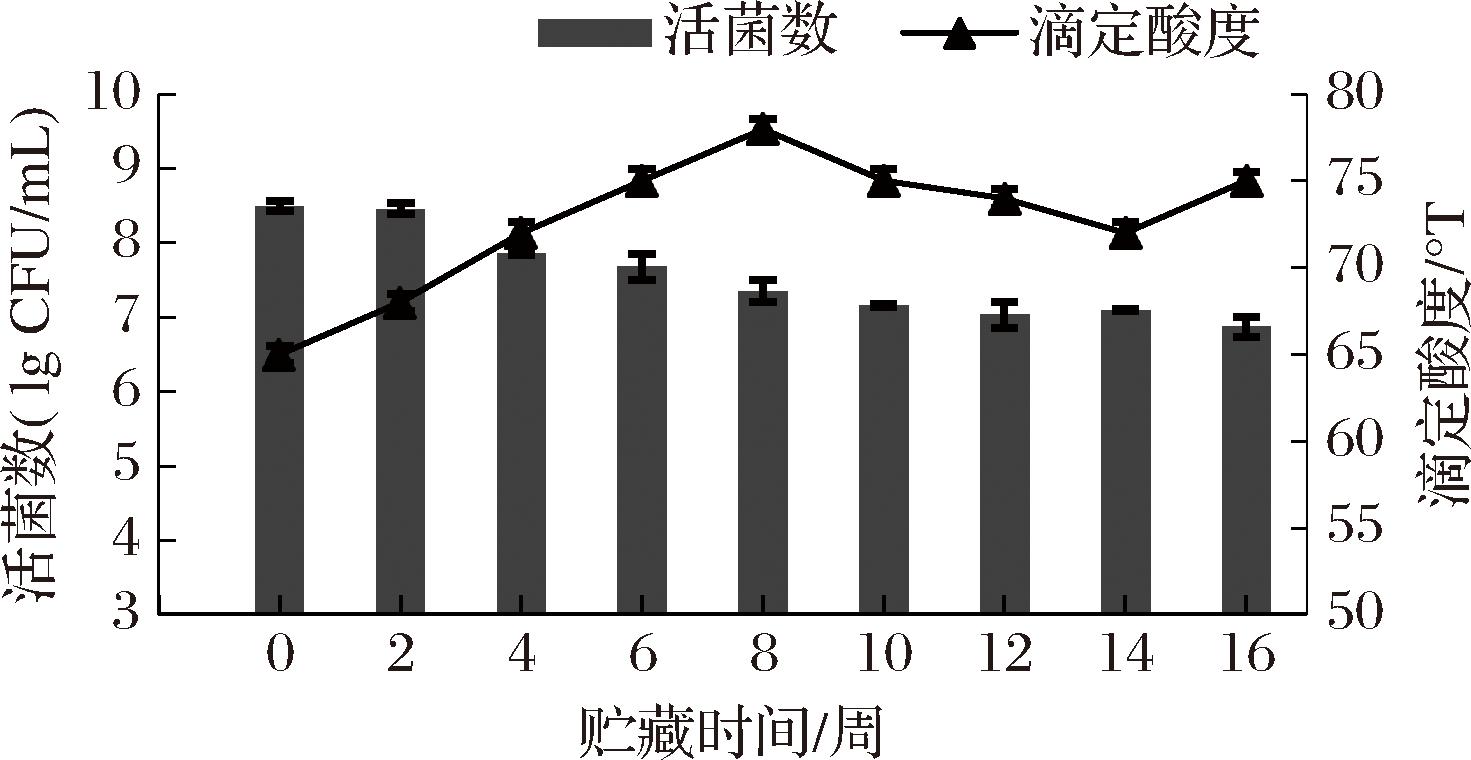
图4 燕麦发酵饮料贮藏期内的稳定性
Fig.4 Stability of oat fermented beverage during storage
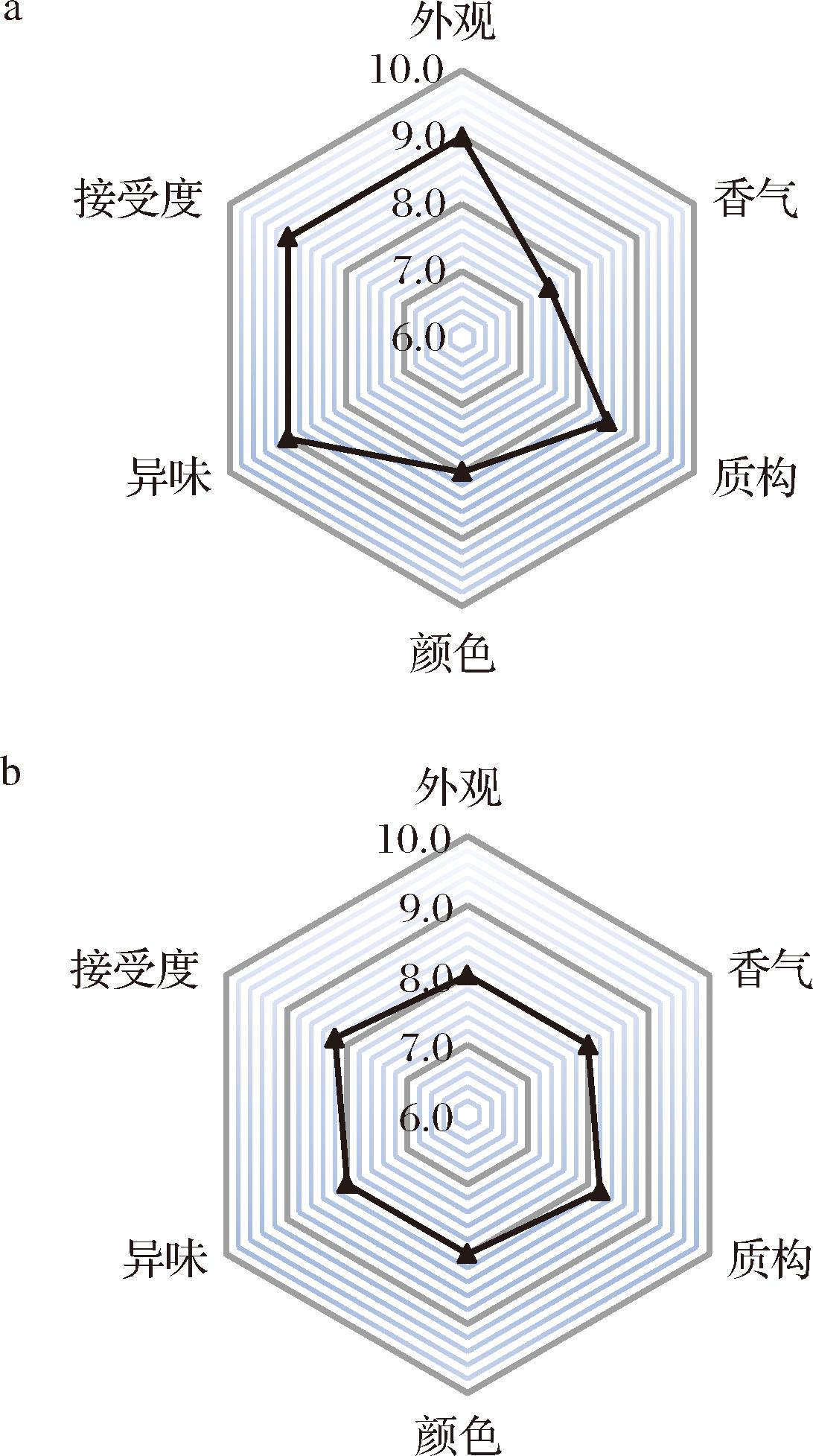
a-贮藏前燕麦发酵饮料;b-贮藏4个月后燕麦发酵饮料
图5 燕麦发酵饮料的感官评价
Fig.5 Sensory evaluation of oat fermented beverage
燕麦发酵饮料作为一种植物基发酵产品,具有广阔的发展前景。研究发现以植物乳植杆菌-60为发酵剂,可开发出低脂肪、高膳食纤维的燕麦饮料[24]。植物乳植杆菌B28、Lp90和CCM 7039也可用于燕麦发酵饮料[25],然而,目前市面上的燕麦发酵饮品大多数为灭菌型且货架期较短,保持益生菌的活力下延长保质期仍是一个持续的挑战。通常通过筛选弱后酸化的菌株、高压处理,改善产品后酸化的情况,接种前在胁迫条件下(高NaCl和低pH组合)对植物乳植杆菌WCFS1进行预培养可以显著减少后酸化[26]。本文研究中发现调节ZJ316糖代谢可提高贮藏期内的菌株活力,实验结果与CHEN等[14]研究一致,罗伊氏粘液乳杆菌WHH1689不能代谢乳糖,但在果糖饮用酸奶中应用具有较高的存活率。
3 结论
本文分析6株乳酸菌在不同碳源培养基中的生长代谢情况,筛选得到一株植物乳植杆菌ZJ316可在室温条件下燕麦共生饮料中存活超2个月,并保持较好的质构性状。挥发性成分的主成分分析发现ZJ316发酵的燕麦发酵过程中能产生有益的挥发性成分,降低了刺激性气味的含量。燕麦发酵饮料在室温条件下货架期超4个月且产品感官性状良好,可作为发酵燕麦饮料的发酵菌株,ZJ316发酵燕麦产品可成为潜在乳制品的良好替代品。
[1] HAN S F, GAO H, SONG R J, et al.Oat fiber modulates hepatic circadian clock via promoting gut microbiota-derived short chain fatty acids[J].Journal of Agricultural and Food Chemistry, 2021, 69(51):15624-15635.
[2] FULLER S, BECK E, SALMAN H, et al.New horizons for the study of dietary fiber and health:A review[J].Plant Foods for Human Nutrition, 2016, 71(1):1-12.
[3] BEVILACQUA A, CASANOVA F P, PETRUZZI L, et al.Using physical approaches for the attenuation of lactic acid bacteria in an organic rice beverage[J].Food Microbiology, 2016, 53(Pt B):1-8.
[4] NORTHROP G, D′COSTA A S, TOSH S M, et al.Viscosity development from oat bran β-glucans through in vitro digestion is lowered in the presence of phenolic compounds[J].Food &Function, 2022, 13(7):3894-3904.
[5] CHOROMANSKA A, KULBACKA J, REMBIALKOWSKA N, et al.Anticancer properties of low molecular weight oat beta-glucan—An in vitro study[J].International Journal of Biological Macromolecules, 2015, 80:23-28.
[6] VIJAYA KUMAR B, VIJAYENDRA S V N, REDDY O V S.Trends in dairy and non-dairy probiotic products-a review[J].Journal of Food Science and Technology, 2015, 52(10):6112-6124.
[7] MS WOLEVER T, RAHN M, DIOUM E, et al.An oat β-glucan beverage reduces LDL cholesterol and cardiovascular disease risk in men and women with borderline high cholesterol:A double-blind, randomized, controlled clinical trial[J].The Journal of Nutrition, 2021, 151(9):2655-2666.
[8] LONDONO D M, SMULDERS M J M, VISSER R G F, et al.Effect of kilning and milling on the dough-making properties of oat flour[J].LWT-Food Science and Technology, 2015, 63(2):960-965.
[9] MANIGANDAN T, MANGAIYARKARASI S P, HEMALATHA R, et al.Probiotics, prebiotics and synbiotics-a review[J].Biomedical & Pharmacology Journal, 2012, 5(2):295-304.
[10] ARGYRI A A, ZOUMPOPOULOU G, KARATZAS K G, et al.Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J].Food Microbiology, 2013, 33(2):282-291.
[11] YANG W S, HAO X Y, ZHANG X X, et al.Identification of antioxidant peptides from cheddar cheese made with Lactobacillus helveticus[J].LWT, 2021, 141:110866.
[12] MUHIALDIN B J, MEOR HUSSIN A S, KADUM H, et al.Metabolomic changes and biological activities during the lacto-fermentation of jackfruit juice using Lactobacillus casei ATCC334[J].LWT, 2021, 141:110940.
[13] AKAN S.“Symbiotic” or “synbiotic”?Response to “Quality and microbial properties of symbiotic bread produced by straight dough and frozen part-baking methods”[J].Journal of Texture Studies, 2021, 52(1):137-138.
[14] CHEN S, CHEN L, CHEN L, et al.Potential probiotic characterization of Lactobacillus reuteri from traditional Chinese highland barley wine and application for room-temperature-storage drinkable yogurt[J].Journal of Dairy Science, 2018, 101(7):5780-5788.
[15] CHEN X F, LU Y L, ZHAO A Q, et al.Quantitative analyses for several nutrients and volatile components during fermentation of soybean by Bacillus subtilis natto[J].Food Chemistry, 2022, 374:131725.
[16] ZHANG C, ZHANG Y X, LIU G R, et al.Effects of soybean protein isolates and peptides on the growth and metabolism of Lactobacillus rhamnosus[J].Journal of Functional Foods, 2021, 77:104335.
[17] WANG J C, ZHAO W, GUO S, et al.Different growth behaviors and metabolomic profiles in yogurts induced by multistrain probiotics of Lactobacillus casei Zhang and Bifidobacterium lactis V9 under different fermentation temperatures[J].Journal of Dairy Science, 2021, 104(10):10528-10539.
[18] GOYAL N, RISHI P, SHUKLA G.Lactobacillus rhamnosus GG antagonizes Giardia intestinalis induced oxidative stress and intestinal disaccharidases:An experimental study[J].World Journal of Microbiology and Biotechnology, 2013, 29(6):1049-1057.
[19] ENDO A.Fructophilic lactic acid bacteria inhabit fructose-rich niches in nature[J].Microbial Ecology in Health and Disease, 2012, 23(1):6-9.
[20] ÅRSKÖLD E, LOHMEIER-VOGEL E, CAO R, et al.Phosphoketolase pathway dominates in Lactobacillus reuteri ATCC 55730 containing dual pathways for glycolysis[J].Journal of Bacteriology, 2008, 190(1):206-212.
[21] PARK M S, PARK J H, OH D H.Quality and volatile-flavor compound characteristics of Hypsizigus marmoreus[J].Korean Journal of Food Preservation, 2011, 18(4):552-558.
[22] FRANCO-LUESMA E, FERREIRA V.Quantitative analysis of free and bonded forms of volatile sulfur compouds in wine.Basic methodologies and evidences showing the existence of reversible cation-complexed forms[J].Journal of Chromatography A, 2014, 1359:8-15.
[23] SALMER N I, LOEZA-SERRANO S, PÉREZ-VEGA S, et al.Headspace gas chromatography (HS-GC) analysis of imperative flavor compounds in Lactobacilli-fermented barley and malt substrates[J].Food Science and Biotechnology, 2015, 24(4):1363-1371.
N I, LOEZA-SERRANO S, PÉREZ-VEGA S, et al.Headspace gas chromatography (HS-GC) analysis of imperative flavor compounds in Lactobacilli-fermented barley and malt substrates[J].Food Science and Biotechnology, 2015, 24(4):1363-1371.
[24] WANG C N, LIANG S X, WANG H, et al.Physiochemical properties and probiotic survivability of symbiotic oat-based beverage[J].Food Science and Biotechnology, 2018, 27(3):735-743.
[25] MAGALA M, KOHAJDOV Z,
Z, ![]() J, et al.Application of lactic acid bacteria for production of fermented beverages based on rice flour[J].Czech Journal of Food Sciences, 2015, 33(5):458-463.
J, et al.Application of lactic acid bacteria for production of fermented beverages based on rice flour[J].Czech Journal of Food Sciences, 2015, 33(5):458-463.
[26] ANTUNES A E C, CAZETTO T F, BOLINI H M A.Viability of probiotic micro-organisms during storage, postacidification and sensory analysis of fat-free yogurts with added whey protein concentrate[J].International Journal of Dairy Technology, 2005, 58(3):169-173.