薤白作为百合科葱属植物小根蒜(Allium macrostemon Bunge),主要分布在东北、河北、江苏和湖北等地[1]。2002年,中国卫生部将其列入药食同源植物名录[2]。现代研究表明,薤白中主要含有甾体皂苷、精油、多糖、脂肪酸等多种生物活性成分,具有降脂、抗氧化、抑菌、抗肿瘤、保护心肌细胞等作用[3],被用于治疗高血脂、心绞痛、冠心病等疾病[4]。目前,分离精油常用的方法是水蒸气蒸馏法(hydrodistillation,HD)。然而,HD技术通常存在能耗高、热敏成分降解等缺点,导致精油提取率和质量下降[5]。随着微波提取和酶提取等绿色提取技术不断发展,并逐步应用于精油提取。与传统的HD相比,微波辅助法能提高精油的提取率和质量。无溶剂微波法(solvent-free microwave extraction,SFME)只利用新鲜原料中的水分,不需额外添加溶剂,是一种绿色、高效的植物精油提取方法[6-7]。细胞壁是从植物中获得精油和其他活性物质的一个重大屏障[8]。酶解处理是分解植物细胞壁和促进内容成分释放的有效方法。混合酶在提取精油方面的效率明显高于单一酶[9]。酶预处理与SFME相结合是一种创新精油提取方法,该方法不仅提取效率高,也符合当代绿色技术的原则。酶预处理结合微波辅助提取法在植物精油提取中已广泛应用。例如,WEI等[6]采用此方法对香叶天兰葵精油进行提取,PU等[10]利用此方法对石菖蒲精油进行提取。目前,关于东北野生鲜薤白精油的相关活性研究报道较少。对东北野生鲜薤白通过酶预处理结合SFME提取精油的研究未见报道。本研究采用酶-无溶剂微波法(enzymatic pretreatment combined with solvent-free microwave extraction,EP-SFME)提取东北野生鲜薤白植物精油,采用GC-MS、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)和体外抑菌实验对提取获得的精油提取率、组成成分和抑菌活性进行分析。为EP-SFME提取东北野生鲜薤白精油的开发利用提供了数据支持。
1 材料与方法
1.1 材料与试剂
东北野生鲜薤白于2023年2月采自辽宁省沈阳市康平县,经毛子军教授(东北林业大学森林植物生态学教育部重点实验室)认证,新鲜薤白保存在4 ℃冰箱中,以确保使用前新鲜。
纤维素酶(10 000 U/g)和果胶酶(50 000 U/g)购自上海源叶生物技术有限公司。单核增生李斯特菌、大肠杆菌、铜绿假单胞菌、枯草芽孢杆菌和金黄色葡萄球菌,由包怡红教授(东北林业大学食品工程系教授)捐赠。
1.2 仪器与设备
HP7890A-5975型气相色谱-质谱联用仪,美国安捷伦科技有限公司;FA 2004电子分析天平,上海恒平科学仪器有限公司;Infinite 200 PRO 酶标仪,长沙泰肯生物技术有限公司;FLC-3生物洁净工作台,哈尔滨市东联公司;HDM型电热套,巩义市予华仪器有限责任公司;YXQ-50SII立式压力蒸汽灭菌器,上海博讯实业有限公司;DHP-9082微生物培养箱,上海一恒科学仪器有限公司;DHG-9070A电热恒温鼓风干燥箱,上海申贤恒温设备厂;JSHD-10 mL精油提取器,天津天科玻璃仪器制造有限公司;HK-068小型高速磨粉机,广州市旭朗机械设备有限公司;P70F23P-G5 (S0) 微波萃取装置,广东格兰仕生活电器商业有限公司。
1.3 实验方法
1.3.1 EP- SFME精油提取
整个EP-SFME过程包括酶促预处理和无溶剂微波萃取2个连续步骤。酶预处理时,将100 g东北野生鲜薤白和混合酶加入1 L圆底烧瓶中,在50 ℃恒温水浴中孵育一段时间。预处理后,将烧瓶放入微波提取装置中,在一定的微波照射功率下进行微波照射处理一段时间。精油的提取是通过持续冷凝装置来实现的。最后,通过石油醚萃取和无水硫酸钠干燥后获得精油,并在4 ℃下保存。在EP-SFME过程中,以精油提取率为响应值,分别对混合酶的比例、酶添加量、酶解时间、微波功率和时间进行优化。所有实验均重复进行3次。不同提取方法的精油提取率计算如公式(1)所示:
(1)
式中:Y为精油提取率,%;m为精油的质量,g;M为提取原料的干重,g。
1.3.2 正交试验
在单因素试验的基础上,以精油得率为评价指标,选择混合酶比例、酶解时间、微波功率和微波时间4个因素,进行L9(34)正交试验,确定最佳提取工艺条件,各因素及水平如表1所示。
表1 鲜薤白精油提取正交因素水平表
Table 1 Extraction of volatile oil from fresh Allium macrostemon Bunge by orthogonal factor level
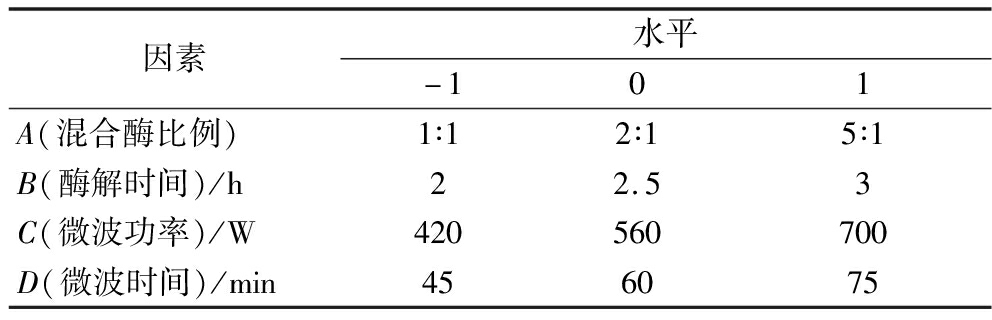
因素水平-101A(混合酶比例)1∶12∶15∶1B(酶解时间)/h22.53C(微波功率)/W420560700D(微波时间)/min456075
1.3.3 SFME和HD精油提取
为了进行比较,分别进行SFME和HD提取东北野生鲜薤白精油。SFME不需要酶预处理,其他提取条件与EP-SFME的最佳条件相同。HD将100 g东北野生鲜薤白与1 L水混合在圆底烧瓶中,回流提取4 h,后续过程与EP-SFME相同。
1.3.4 表征及成分分析
1.3.4.1 FTIR分析
参考WEI等[11]的方法,采用FTIR法检测不同提取方法中精油官能团的变化。将精油均匀地涂在1个压制的溴化钾圆盘上,然后在4 000~400 cm-1进行分析。
1.3.4.2 GC-MS分析
参考WEI等[11]的方法,采用GC-MS分析法测定并分析精油的化学成分。用正己烷稀释精油后,注入1 μL的样品进行GC-MS检测。利用NIST14质谱库对精油各组成成分的色谱峰进行分析和鉴定。
1.3.5 抑菌活性
1.3.5.1 微生物培养
为评价东北野生鲜薤白精油的抑菌活性,本研究采用2株革兰氏阴性菌(大肠杆菌和铜绿假单胞菌)和3株革兰氏阳性杆菌(枯草芽孢杆菌、金黄色葡萄球菌和单核增生李斯特菌)。将所选菌株活化,接种到含有LB肉汤培养基的锥形瓶中。然后将锥形瓶置于37 ℃恒温振荡培养箱中,培养24 h。
1.3.5.2 测定最低抑制浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC)
采用微量二倍稀释法测定精油的MIC和MBC[12]。将100 mg/mL薤白精油用0.5%(质量分数)吐温80溶剂稀释至100、50、25、12.5、6.25、3.13、1.56、0.78、0.39、0.20、0.10 mg/mL,将不同浓度的薤白精油溶液分别吸出100 μL装入96孔板中。再放入100 μL浓度大约为1.5×108 CFU/mL的菌液,然后在37 ℃培养24 h,采用盐酸环丙沙星为阳性对照组、0.5%吐温80代替样品为空白对照组、LB肉汤培养基代替菌液为阴性对照组。
MIC被定义为在体外经过一段特定的孵育期后,抑制微生物生长的药物的最低浓度[13]。MBC代表了根除99.90%(降低3个数量级)的最低药物浓度[13]。根据MIC试验结果,在平板上培养0.1 mL培养基,无微生物生长,获得MBC。遵循试验结果,根据公式(2)计算精油对细菌的抑制率。根据不同浓度的精油与抑制率的相关性,构建抑菌图,确定IC50值(半数抑制浓度)。以3个重复的“平均值±标准差”计算。
(2)
式中:I为抑制率,%;A0为阴性对照组的吸光值;A1为空白对照组的吸光值;A2为样品或阳性对照组的吸光值。
1.3.5.3 抑菌圈直径的测定
通过倒入20 mL的LB肉汤培养基溶液来制备培养板。将0.1 mL的菌悬液(106~107 CFU/mL)均匀的接种在平板上,干燥20 min后将无菌滤纸盘(直径6 mm)均匀放置于平板上,加入20 μL 100 mg/mL精油,0.5%吐温80作为空白对照,盐酸环丙沙星(0.5 mg/mL)作为试验细菌的阳性对照。然后,将培养皿置于37 ℃的振荡培养箱中,孵育12 h。通过测定对试验微生物的抑菌圈直径来评价其抑菌活性。
1.3.6 精油抑菌机制
1.3.6.1 对细胞壁损伤的影响
参考李玉珍等[14]的方法,将活化的大肠杆菌接种于LB肉汤液体培养基中,在120 r/min、37 ℃恒温培养12 h,取出30 mL,在4 000 r/min离心10 min收集细菌。用磷酸盐缓冲液(phosphate buffer saline,PBS)(0.03 mmol/L,pH 7.2)稀释细菌溶液,在630 nm处,测定OD值为0.1~0.3。在96孔细胞培养板中,每组加入100 μL细菌溶液,分为3组:A组为50 μL PBS缓冲液(阴性对照),B组为50 μL TritionX-100(300 mg/L,阳性对照),C组为50 μL精油样品含量,含量为1/2 MIC、MIC和2 MIC(MIC=3.13 mg/mL),混合细菌溶液,在37 ℃培养120 min,在630 nm下每30 min间隔测定1次OD值。
1.3.6.2 对细胞膜电导率的影响
参考乔彩红等[15]的方法,将0.25 g未经处理的大肠杆菌准确地称到含有10 mL不同浓度精油(0、MIC、2 MIC)的离心管中(二甲基亚砜稀释),对照组加入等体积的无菌蒸馏水,在25 ℃培养,细胞外溶液的电导率计在0、30、60、90、120、150和180 min连续测量电导率。
1.3.6.3 对细胞核酸和蛋白质泄漏的影响
参考乔彩红等[15]的方法,收集10 mL大肠杆菌悬浮液(浓度为106 CFU/mL),将样品精油添加到菌悬液中(最终浓度分别为0、MIC、2 MIC),对照组加入等体积的无菌蒸馏水,在25 ℃、120 r/min培养箱中培养4 h,每1 h取1 mL的细菌悬浮液,在8 000 r/min离心10 min,收集上清液在260 nm和280 nm下测定OD值,未经精油处理的作为对照组。所有实验均平均进行3次实验。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 酶添加量的影响
添加足够的酶可以有效破坏植物细胞壁结构,促进精油充分释放[16]。不同混合酶添加量(20、30、40、50、60 g/L)对精油提取率的影响如图1-a所示。随着混合酶添加量的增加,精油的提取率也相应增加。当混合酶添加量大于50 g/L时,精油提取率增加不显著。因此,50 g/L的酶添加量是最佳选择。
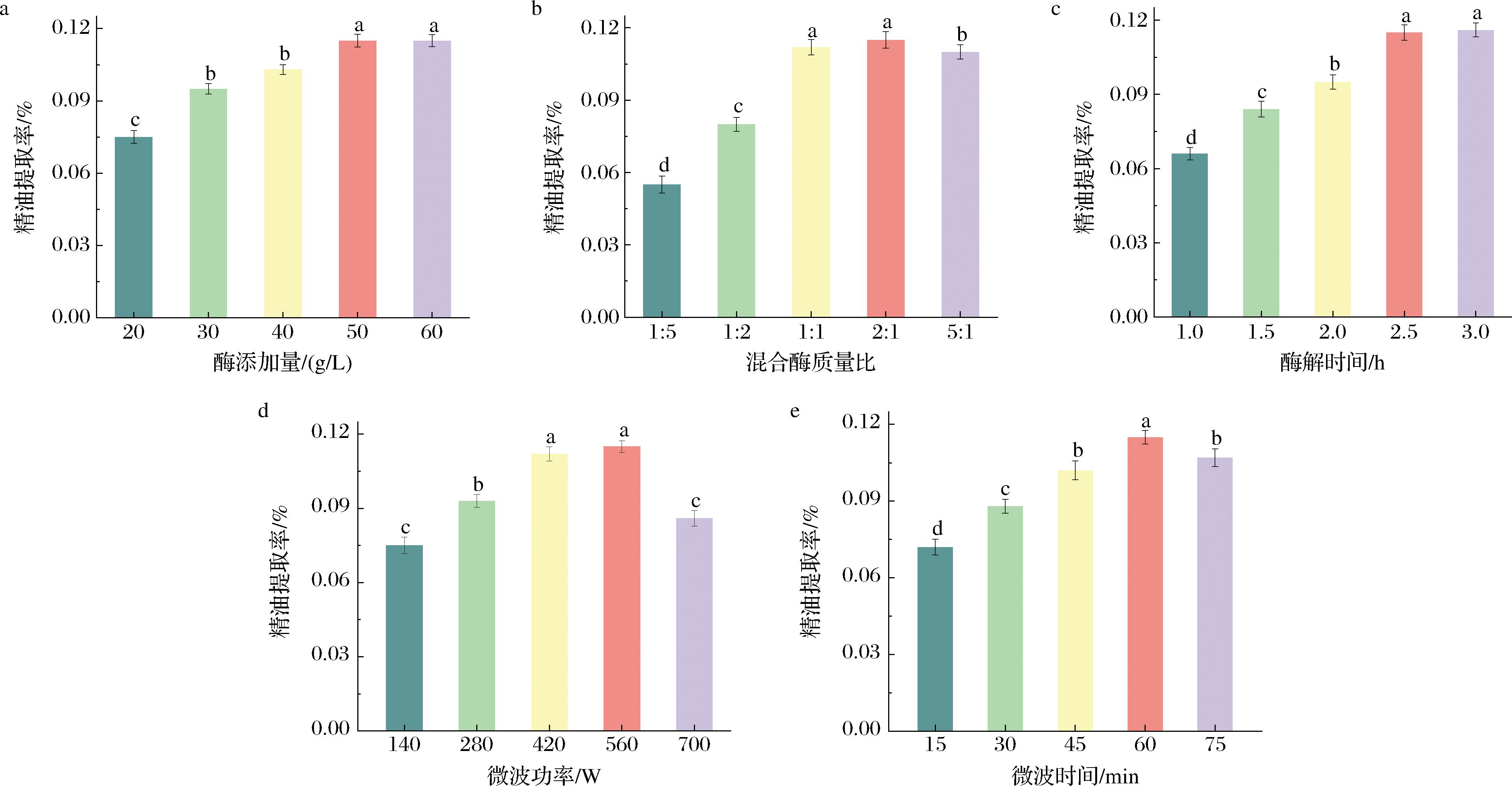
a-酶添加量;b-混合酶质量比;c-酶解时间;d-微波功率;e-微波时间
图1 单因素试验结果
Fig.1 Results of single factor experiment
注:不同字母表示有显著性差异(P<0.05)(下同)。
2.1.2 混合酶比例的影响
由于纤维素和果胶是植物细胞壁的主要组成,所以通过添加纤维素酶和果胶酶可以加快薤白细胞壁的破坏,从而促进精油的释放[17]。混合酶的比例对酶的预处理影响通常比较显著,进而影响精油的提取率。不同混合酶比例对精油提取率的影响如图1-b所示,当混合酶质量比为2∶1(果胶酶∶纤维素酶)时,精油提取率最高。
2.1.3 酶解时间的影响
酶解时间是保证酶能够充分释放其潜力的关键因素。酶解时间(0~3 h)对精油提取率的影响如图1-c所示。随着酶解时间(0~2.5 h)的延长,精油的提取率逐渐上升。当酶解时间为2.5 h时,精油的提取率达到最高点。当酶解时间超过2.5 h时,精油提取率没有显著增加。这一现象表明,酶解在2.5 h内基本完成。因此,酶解时间选择为2.5 h。
2.1.4 微波功率的影响
研究表明,高微波辐照功率可导致植物温度的快速升高,从而促进了植物精油在短时间内有效分离[18]。然而,较高的微波辐照功率不仅对精油的质量产生负面影响,而且造成精油回收困难[19]。因此,适当的微波辐照功率对保证精油的提取率和质量具有重要意义。图1-d为不同微波功率(140、280、420、560、700 W)对鲜薤白精油提取率的影响。随着微波功率的增加,精油提取率不断增加。但最高的微波功率并不是精油提取的最佳条件,560 W时的精油提取率高于700 W的精油提取率。因此,微波功率设置为560 W。
2.1.5 微波时间的影响
研究表明,微波辐照可促进植物精油的分离。但是,过长时间的微波辐照不仅对精油的质量产生负面影响,而且也使精油的回收变得困难[20]。因此,适当的微波辐照时间对保证精油的提取率和质量都具有重要意义。本研究对不同微波时间(15、30、45、60、75 min)下的精油提取率进行了研究,结果如图1-e所示。随着微波时间的延长,精油的提取率持续增加。然而,最长的微波时间并不是本研究中提取精油的最佳条件。在一定时间内,精油被充分提取,随着时间的延长,精油得率持平并伴随着一定的损失[20],所以精油得率下降。因此,将微波时间设置为60 min。
2.2 正交试验结果
根据单因素试验结果可知,相对较优的参数为:混合酶质量比2∶1、酶解时间2.5 h、微波功率560 W和微波时间60 min,以此为基础设计正交试验,结果如表2所示,各因素对精油提取率影响的大小依次为:酶解时间>微波功率>混合酶比例>微波时间。由K值得出薤白精油提取的最优工艺条件为A2B3C2D2,即混合酶质量比2∶1,酶解时间3 h,微波功率560 W,微波时间60 min。并进行3次验证实验,薤白精油的平均提取率为(0.112±0.005)%,与正交试验中最大提取率结果相近,说明该工艺的重现性较好。
表2 鲜薤白精油提取正交试验结果
Table 2 Orthogonal test results of volatile oil extraction from fresh Allium macrostemon Bunge
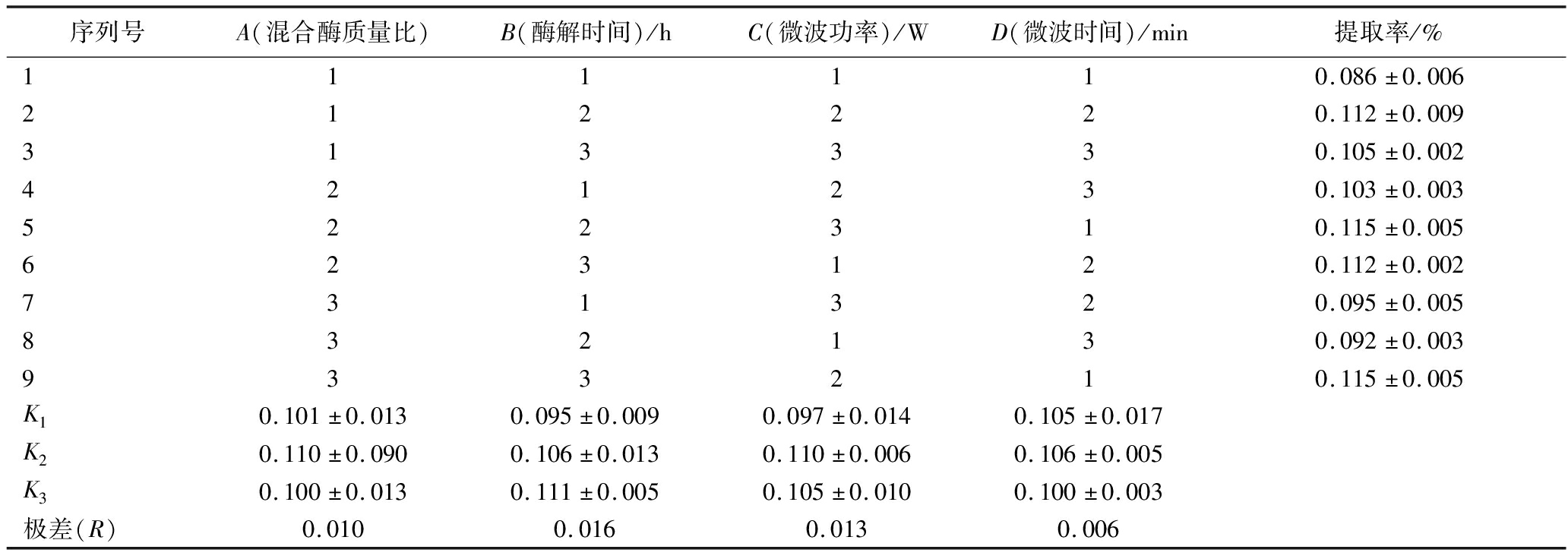
序列号A(混合酶质量比)B(酶解时间)/hC(微波功率)/WD(微波时间)/min提取率/%111110.086±0.006212220.112±0.009313330.105±0.002421230.103±0.003522310.115±0.005623120.112±0.002731320.095±0.005832130.092±0.003933210.115±0.005K10.101±0.0130.095±0.0090.097±0.0140.105±0.017K20.110±0.0900.106±0.0130.110±0.0060.106±0.005K30.100±0.0130.111±0.0050.105±0.0100.100±0.003极差(R)0.0100.0160.0130.006
2.3 三种方法提取精油的提取率结果
根据上述提取方法,分别采取HD、SFME、EP-SFME法对东北野生鲜薤白进行精油的提取,提取结果如表3所示,EP-SFME提取的东北野生鲜薤白精油提取率比HD和SFME分别高出0.047%和0.020%。HD是采用对流方式加热原料,即由外向内,这与精油的传质方向相反。SFME是利用微波辐射直接加热植物细胞,产生高温和压力直接作用于植物细胞,导致植物细胞的破裂和挥发油的释放。EP-SFME在SFME的基础上加入酶解预处理,可以更有效地破坏植物细胞壁,进一步促进内容组分的释放[21]。因此,EP-SFME具有更高的精油提取率。
表3 鲜薤白精油提取率
Table 3 Rate of volatile oil extraction from fresh Allium macrostemon Bunge
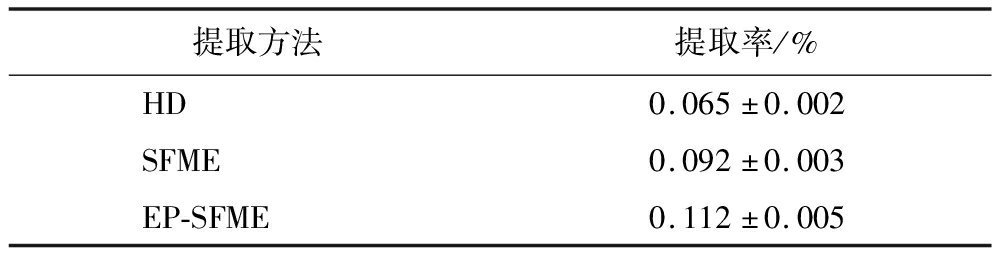
提取方法提取率/%HD0.065±0.002SFME0.092±0.003EP-SFME0.112±0.005
2.4 FTIR分析
图2显示了用不同提取方法得到精油的FTIR光谱。在3 672 cm-1处的峰值是羟基(O—H)的拉伸振动峰。在2 918和2 850 cm-1处的峰是烷基的C—H不对称伸缩振动峰。在1 697 cm-1处的峰值是碳基(C![]() O)的伸缩振动峰。在1 441和1 291 cm-1附近的峰归属于双二甲基的吸收带。在1 224和1 063 cm-1处的峰值与C—O—C的拉伸振动相关。在1 000~1 300 cm-1处的峰值是硫醚(C—S)的吸收峰。在934 cm-1处的峰值是由于醚键(C—O)的不对称伸缩振动产生。在700 cm-1处的峰值是由于硫醚(C—S)的拉伸振动造成的。
O)的伸缩振动峰。在1 441和1 291 cm-1附近的峰归属于双二甲基的吸收带。在1 224和1 063 cm-1处的峰值与C—O—C的拉伸振动相关。在1 000~1 300 cm-1处的峰值是硫醚(C—S)的吸收峰。在934 cm-1处的峰值是由于醚键(C—O)的不对称伸缩振动产生。在700 cm-1处的峰值是由于硫醚(C—S)的拉伸振动造成的。
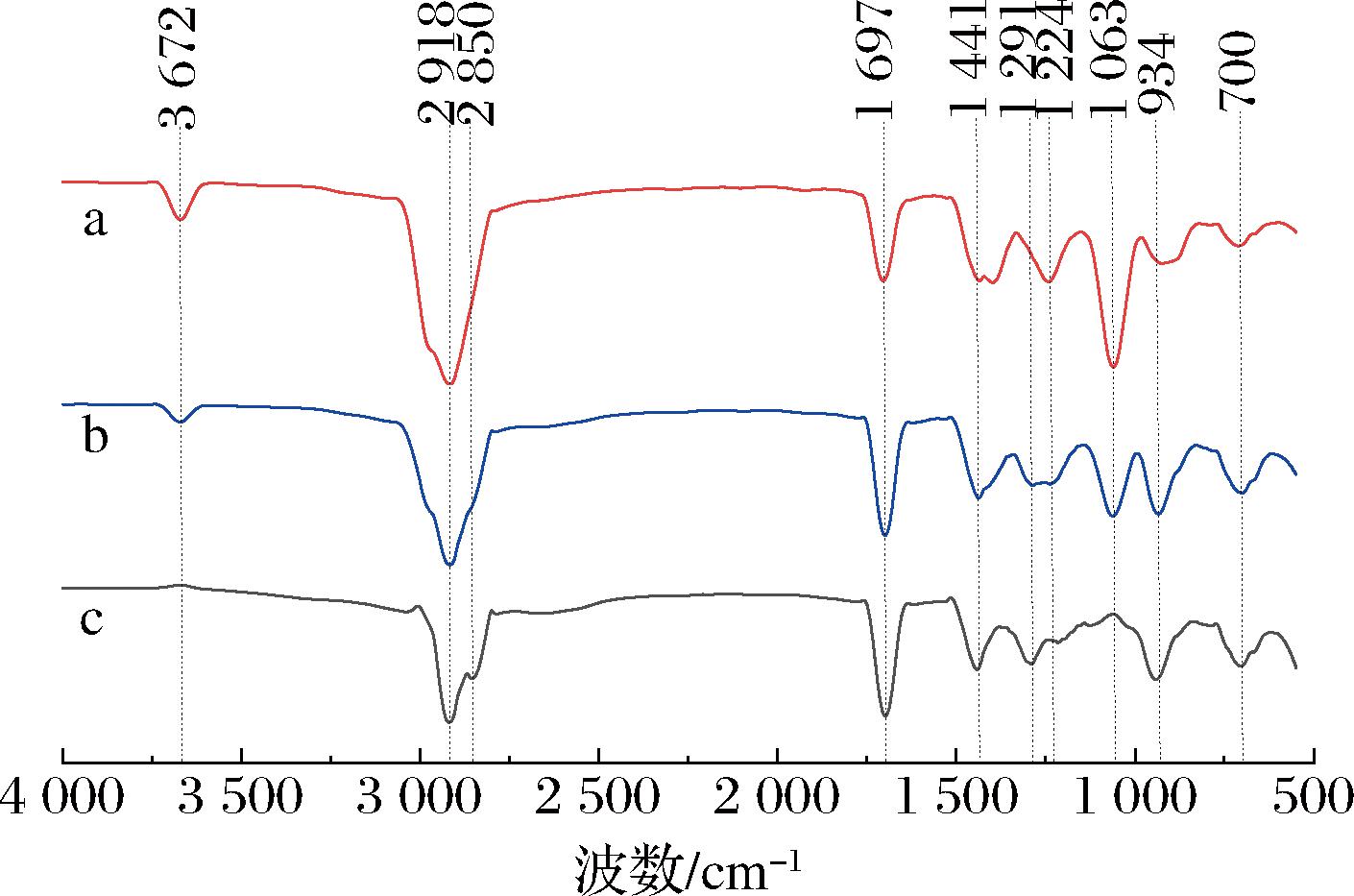
a-EP-SFME提取的精油;b-SFME提取的精油;c-HD提取的精油
图2 HD、SFME和EP-SFME提取鲜薤白精油的FTIR光谱曲线
Fig.2 FTIR spectral curves of fresh Allium macrostemon Bunge volatile oil extracted by HD, SFME, and EP-SFME
FTIR结果表明,EP-SFME提取的精油中羟基、醚键和硫醚键吸收峰的强度均高于HD和SFME所提取的精油。这表明,EP-SFME获得的精油含有更多的硫基化合物和含氧化合物,这也被GC-MS分析结果所证实。
2.5 GC-MS分析结果
采用GC-MS对精油的组成成分进行了检测分析,结果见图3-a和表4。在EP-SFME、SFME和HD提取的精油中共鉴定出83种组分,鉴定的组分分别占总组分的98.35%、99.52%和99.63%。

a-EP-SFME、SFME和HD提取精油总离子流图;b-EP-SFME、SFME和HD提取精油总化合物相对含量对比图(化合物序号见表4);c- SFME与HD相比精油的主要成分增减量;d-EP-SFME与HD相比精油的主要成分增减量
图3 EP-SFME、SFME和HD提取鲜薤白精油的挥发成分相对含量对比图
Fig.3 Comparison charts of the relative content contrast of fresh Allium macrostemon Bunge volatile oil by EP-SFME, SFME, and HD
表4 鲜薤白精油主要成分分析
Table 4 Analysis of the main components of volatile oil from fresh Allium macrostemon Bunge
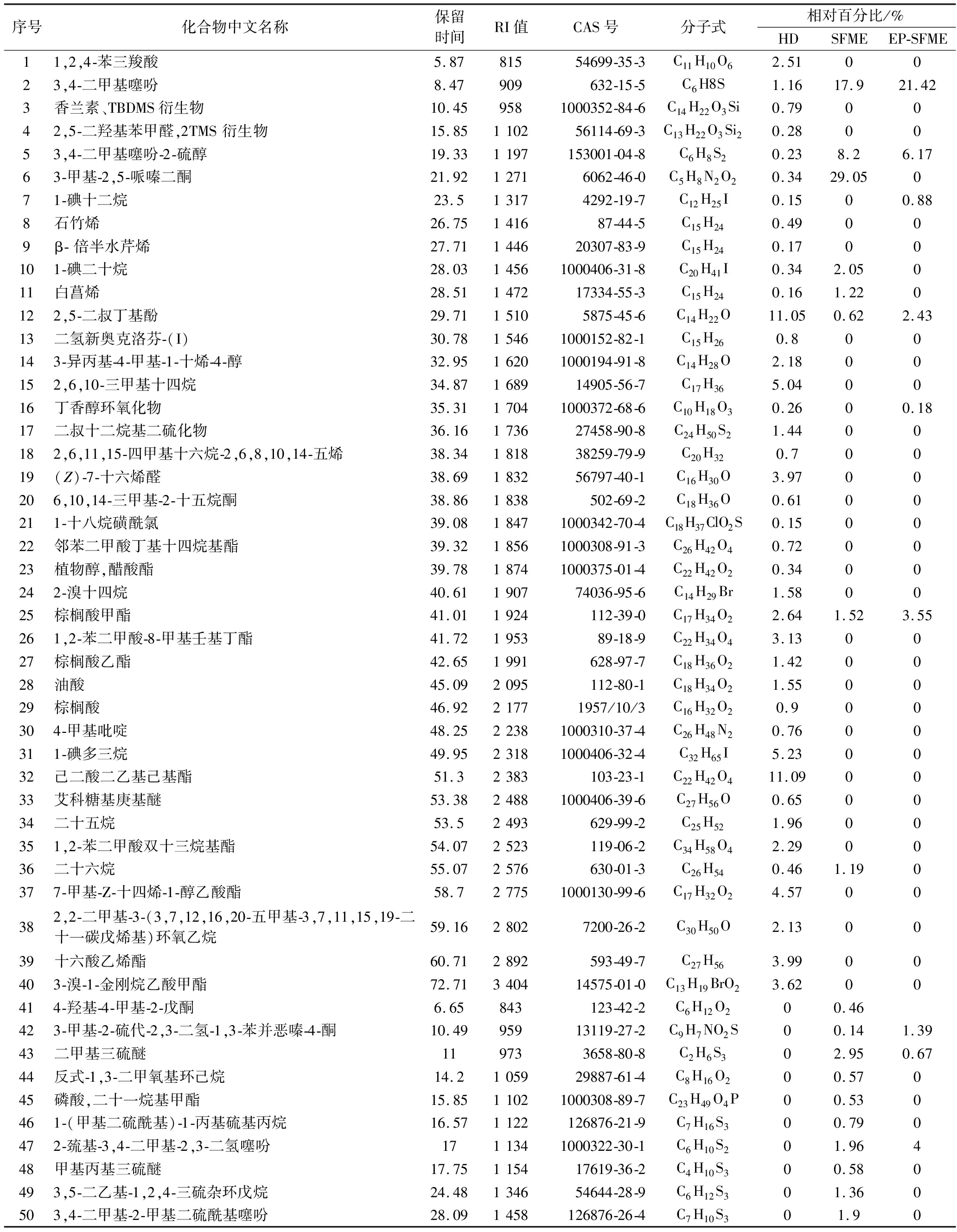
序号化合物中文名称保留时间RI值CAS号分子式相对百分比/%HDSFMEEP-SFME11,2,4-苯三羧酸5.8781554699-35-3C11H10O62.510023,4-二甲基噻吩8.47909632-15-5C6H8S1.1617.921.423香兰素、TBDMS衍生物10.459581000352-84-6C14H22O3Si0.790042,5-二羟基苯甲醛,2TMS衍生物15.85110256114-69-3C13H22O3Si20.280053,4-二甲基噻吩-2-硫醇19.331197153001-04-8C6H8S20.238.26.1763-甲基-2,5-哌嗪二酮21.9212716062-46-0C5H8N2O20.3429.05071-碘十二烷23.513174292-19-7C12H25I0.1500.888石竹烯26.75141687-44-5C15H240.49009β-倍半水芹烯27.71144620307-83-9C15H240.1700101-碘二十烷28.0314561000406-31-8C20H41I0.342.05011白菖烯28.51147217334-55-3C15H240.161.220122,5-二叔丁基酚29.7115105875-45-6C14H22O11.050.622.4313二氢新奥克洛芬-(I)30.7815461000152-82-1C15H260.800143-异丙基-4-甲基-1-十烯-4-醇32.9516201000194-91-8C14H28O2.1800152,6,10-三甲基十四烷34.87168914905-56-7C17H365.040016丁香醇环氧化物35.3117041000372-68-6C10H18O30.2600.1817二叔十二烷基二硫化物36.16173627458-90-8C24H50S21.4400182,6,11,15-四甲基十六烷-2,6,8,10,14-五烯38.34181838259-79-9C20H320.70019(Z)-7-十六烯醛38.69183256797-40-1C16H30O3.9700206,10,14-三甲基-2-十五烷酮38.861838502-69-2C18H36O0.6100211-十八烷磺酰氯39.0818471000342-70-4C18H37ClO2S0.150022邻苯二甲酸丁基十四烷基酯39.3218561000308-91-3C26H42O40.720023植物醇,醋酸酯39.7818741000375-01-4C22H42O20.3400242-溴十四烷40.61190774036-95-6C14H29Br1.580025棕榈酸甲酯41.011924112-39-0C17H34O22.641.523.55261,2-苯二甲酸-8-甲基壬基丁酯41.72195389-18-9C22H34O43.130027棕榈酸乙酯42.651991628-97-7C18H36O21.420028油酸45.092095112-80-1C18H34O21.550029棕榈酸46.9221771957/10/3C16H32O20.900304-甲基吡啶48.2522381000310-37-4C26H48N20.7600311-碘多三烷49.9523181000406-32-4C32H65I5.230032己二酸二乙基己基酯51.32383103-23-1C22H42O411.090033艾科糖基庚基醚53.3824881000406-39-6C27H56O0.650034二十五烷53.52493629-99-2C25H521.9600351,2-苯二甲酸双十三烷基酯54.072523119-06-2C34H58O42.290036二十六烷55.072576630-01-3C26H540.461.190377-甲基-Z-十四烯-1-醇乙酸酯58.727751000130-99-6C17H32O24.5700382,2-二甲基-3-(3,7,12,16,20-五甲基-3,7,11,15,19-二十一碳戊烯基)环氧乙烷59.1628027200-26-2C30H50O2.130039十六酸乙烯酯60.712892593-49-7C27H563.9900403-溴-1-金刚烷乙酸甲酯72.71340414575-01-0C13H19BrO23.6200414-羟基-4-甲基-2-戊酮6.65843123-42-2C6H12O200.46423-甲基-2-硫代-2,3-二氢-1,3-苯并恶嗪-4-酮10.4995913119-27-2C9H7NO2S00.141.3943二甲基三硫醚119733658-80-8C2H6S302.950.6744反式-1,3-二甲氧基环己烷14.2105929887-61-4C8H16O200.57045磷酸,二十一烷基甲酯15.8511021000308-89-7C23H49O4P00.530461-(甲基二硫酰基)-1-丙基硫基丙烷16.571122126876-21-9C7H16S300.790472-巯基-3,4-二甲基-2,3-二氢噻吩1711341000322-30-1C6H10S201.96448甲基丙基三硫醚17.75115417619-36-2C4H10S300.580493,5-二乙基-1,2,4-三硫杂环戊烷24.48134654644-28-9C6H12S301.360503,4-二甲基-2-甲基二硫酰基噻吩28.091458126876-26-4C7H10S301.90
续表4
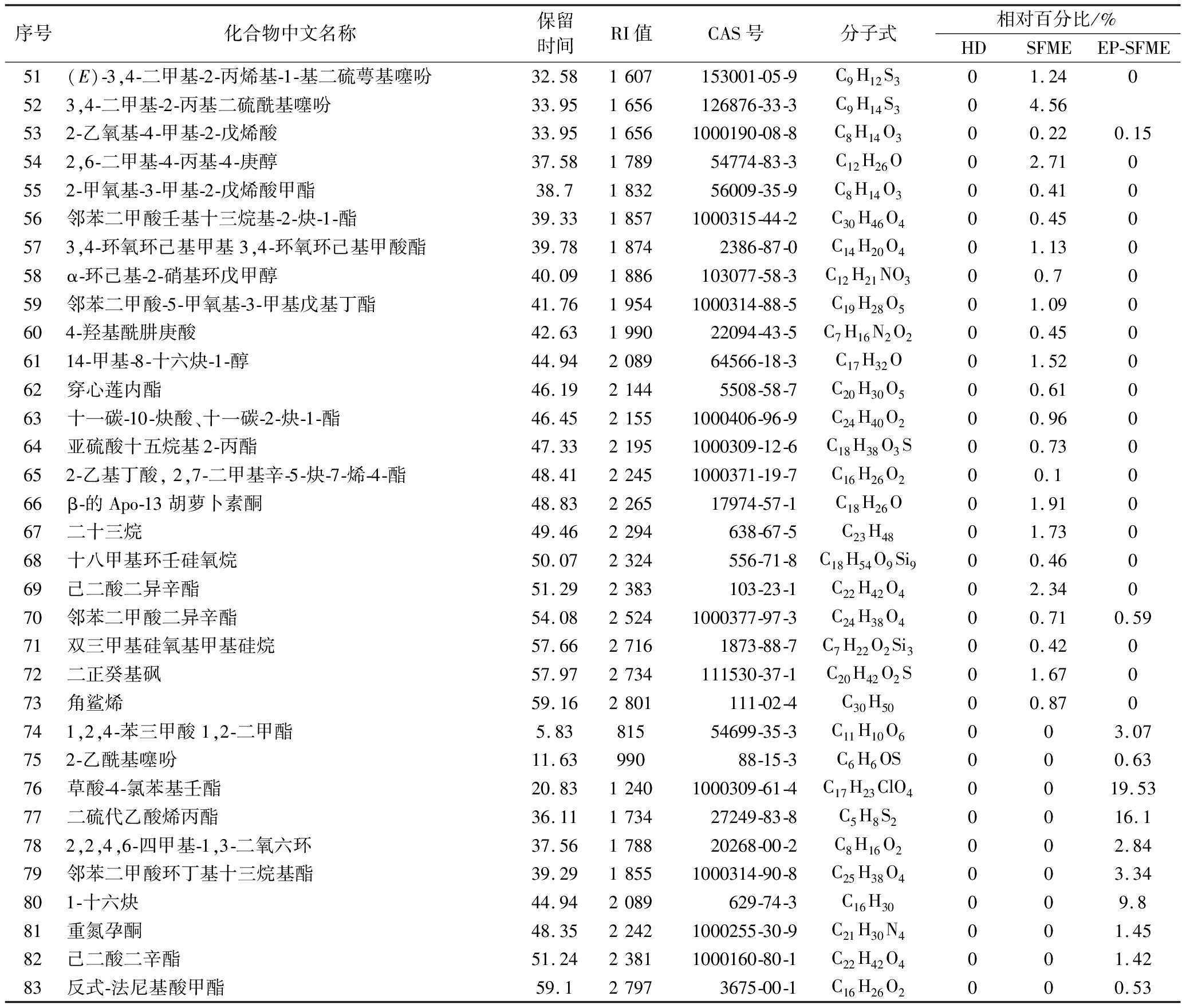
序号化合物中文名称保留时间RI值CAS号分子式相对百分比/%HDSFMEEP-SFME51(E)-3,4-二甲基-2-丙烯基-1-基二硫萼基噻吩32.581607153001-05-9C9H12S301.240523,4-二甲基-2-丙基二硫酰基噻吩33.951656126876-33-3C9H14S304.56532-乙氧基-4-甲基-2-戊烯酸33.9516561000190-08-8C8H14O300.220.15542,6-二甲基-4-丙基-4-庚醇37.58178954774-83-3C12H26O02.710552-甲氧基-3-甲基-2-戊烯酸甲酯38.7183256009-35-9C8H14O300.41056邻苯二甲酸壬基十三烷基-2-炔-1-酯39.3318571000315-44-2C30H46O400.450573,4-环氧环己基甲基3,4-环氧环己基甲酸酯39.7818742386-87-0C14H20O401.13058α-环己基-2-硝基环戊甲醇40.091886103077-58-3C12H21NO300.7059邻苯二甲酸-5-甲氧基-3-甲基戊基丁酯41.7619541000314-88-5C19H28O501.090604-羟基酰肼庚酸42.63199022094-43-5C7H16N2O200.4506114-甲基-8-十六炔-1-醇44.94208964566-18-3C17H32O01.52062穿心莲内酯46.1921445508-58-7C20H30O500.61063十一碳-10-炔酸、十一碳-2-炔-1-酯46.4521551000406-96-9C24H40O200.96064亚硫酸十五烷基2-丙酯47.3321951000309-12-6C18H38O3S00.730652-乙基丁酸,2,7-二甲基辛-5-炔-7-烯-4-酯48.4122451000371-19-7C16H26O200.1066β-的Apo-13胡萝卜素酮48.83226517974-57-1C18H26O01.91067二十三烷49.462294638-67-5C23H4801.73068十八甲基环壬硅氧烷50.072324556-71-8C18H54O9Si900.46069己二酸二异辛酯51.292383103-23-1C22H42O402.34070邻苯二甲酸二异辛酯54.0825241000377-97-3C24H38O400.710.5971双三甲基硅氧基甲基硅烷57.6627161873-88-7C7H22O2Si300.42072二正癸基砜57.972734111530-37-1C20H42O2S01.67073角鲨烯59.162801111-02-4C30H5000.870741,2,4-苯三甲酸1,2-二甲酯5.8381554699-35-3C11H10O6003.07752-乙酰基噻吩11.6399088-15-3C6H6OS000.6376草酸-4-氯苯基壬酯20.8312401000309-61-4C17H23ClO40019.5377二硫代乙酸烯丙酯36.11173427249-83-8C5H8S20016.1782,2,4,6-四甲基-1,3-二氧六环37.56178820268-00-2C8H16O2002.8479邻苯二甲酸环丁基十三烷基酯39.2918551000314-90-8C25H38O4003.34801-十六炔44.942089629-74-3C16H30009.881重氮孕酮48.3522421000255-30-9C21H30N4001.4582己二酸二辛酯51.2423811000160-80-1C22H42O4001.4283反式-法尼基酸甲酯59.127973675-00-1C16H26O2000.53
如表4所示,HD提取的精油主要成分为己二酸二乙基己基酯(11.09%)、2, 5-二叔丁基酚(11.05%)、3-溴-1-金刚烷乙酸甲酯(3.62%)、1, 2, 4-苯三羧酸(2.51%)、1, 2-苯二甲酸双十三烷基酯(2.29%)、油酸(1.55%)、二叔十二烷基二硫化物(1.44%)、3, 4-二甲基噻吩(1.16%)等。SFME提取的挥发油主要成分为2, 5-哌嗪二酮-3-甲基-(29.05%)、3, 4-二甲基噻吩(17.90%)、3, 4-二甲基噻吩-2-硫醇(8.20%)、3, 4-二甲基-2-丙基二硫酰基噻吩(4.56%)、二甲基三硫醚(2.95%)、2-巯基-3, 4-二甲基-2, 3-二氢噻吩(1.96%)、β-Apo-13胡萝卜素酮(1.91%)、3, 4-二甲基-2-甲基二硫酰基噻吩(1.90%)等。EP-SFME提取的挥发油主要成分为3, 4-二甲基噻吩(21.42%)、草酸-4-氯苯基壬酯(19.53%)、二硫代乙酸烯丙酯(16.10%)、1-十六炔(9.80%)、3, 4-二甲基噻吩-2-硫醇(6.17%)、2-巯基-3, 4-二甲基-2, 3-二氢噻吩(4.00%)、棕榈酸甲酯(3.55%)、1, 2, 4-苯三甲酸 1, 2-二甲酯(3.07%)等。
本研究发现,不同提取方法得到的精油组分存在显著差异,如图3-b所示。SFME和EP-SFME得到的精油与HD得到的精油成分差异(D值)如图3-c、图3-d所示。SFME精油的成分增量超过2%的组分包括:2, 5-哌嗪二酮-3-甲基-(+28.71%)、3, 4-二甲基噻吩(+16.74%)、3, 4-二甲基噻吩-2-硫醇(+7.97%)、3, 4-二甲基-2-丙基二硫酰基噻吩(+4.56%)、二甲基三硫醚(+2.95%)、2, 6-二甲基-4-丙基-4-庚醇(+2.71%)、己二酸二异辛酯(+2.34%)等。EP-SFME精油的成分增量超过2%的组分包括:3,4-二甲基噻吩(+20.26%)、草酸-4-氯苯基壬酯(+19.53%)、二硫代乙酸烯丙酯(+16.1%)、1-十六炔(+9.8%)、3, 4-二甲基噻吩-2-硫醇(+5.94%)、2-巯基-3, 4-二甲基-2, 3-二氢噻吩(+4.00%)、邻苯二甲酸环丁基十三烷基酯(+3.34%)、1, 2, 4-苯三甲酸-1, 2-二甲酯(+3.07%)、1, 3-二恶烷-2, 2, 4, 6-四甲基(反式)(+2.84%)等。可以看出,EP-SFME法提取的精油中含硫化合物(49.59%)和含氧化合物(35.72%)更为丰富。根据文献[1-5]数据,东北野生鲜薤白植物精油的主要成分为含硫化合物,包括二甲基三硫、甲基烯丙基三硫和二甲基四硫[1-2],且具有良好的抑菌活性[22]和抗氧化活性[23]。EP-SFME提取的精油含硫化合物含量的增加即意味着其具有更高的生物活性。因此,EP-SFME显著提高了精油的质量。
2.6 抑菌活性分析
使用EP-SFME、SFME和HD所获得精油对枯草芽孢杆菌、金黄色葡萄球菌、单核增生李斯特菌、大肠杆菌、铜绿假单胞菌等5种代表性菌的抑菌活性进行评价。表5中列出了3个抑菌指标,包括MIC、MBC和抑菌圈直径(inhibitory zone diameter,IZD)。根据IC50值(图4-a),EP-SFME、SFME和HD获得的精油对大肠杆菌具有较好的抑制活性,而对单核增生李斯特菌的抑制作用较弱。其中,EP-SFME所获得的精油对大肠杆菌的抑制效果最好,IZD最大[(2.86±0.12) cm],MIC(3.13 mg/mL)和MBC(6.25 mg/mL)最低。图4-b为1.5 mg/mL质量浓度下精油抑菌活性的五轴图。EP-SFME所获得精油的抑菌面积分别是HD和SFME的2.0倍和1.5倍。由图4-c可知,EP-SFME所获得精油的抑菌圈直径显著增加了50%,这都表明EP-SFME提取的精油对细菌生长的抑制作用强于HD和SFME。这与EP-SFME所获得精油含有更多的硫基化合物和含氧化合物有关,进一步说明EP-SFME是能够提高东北野生鲜薤白精油质量的有效方法。
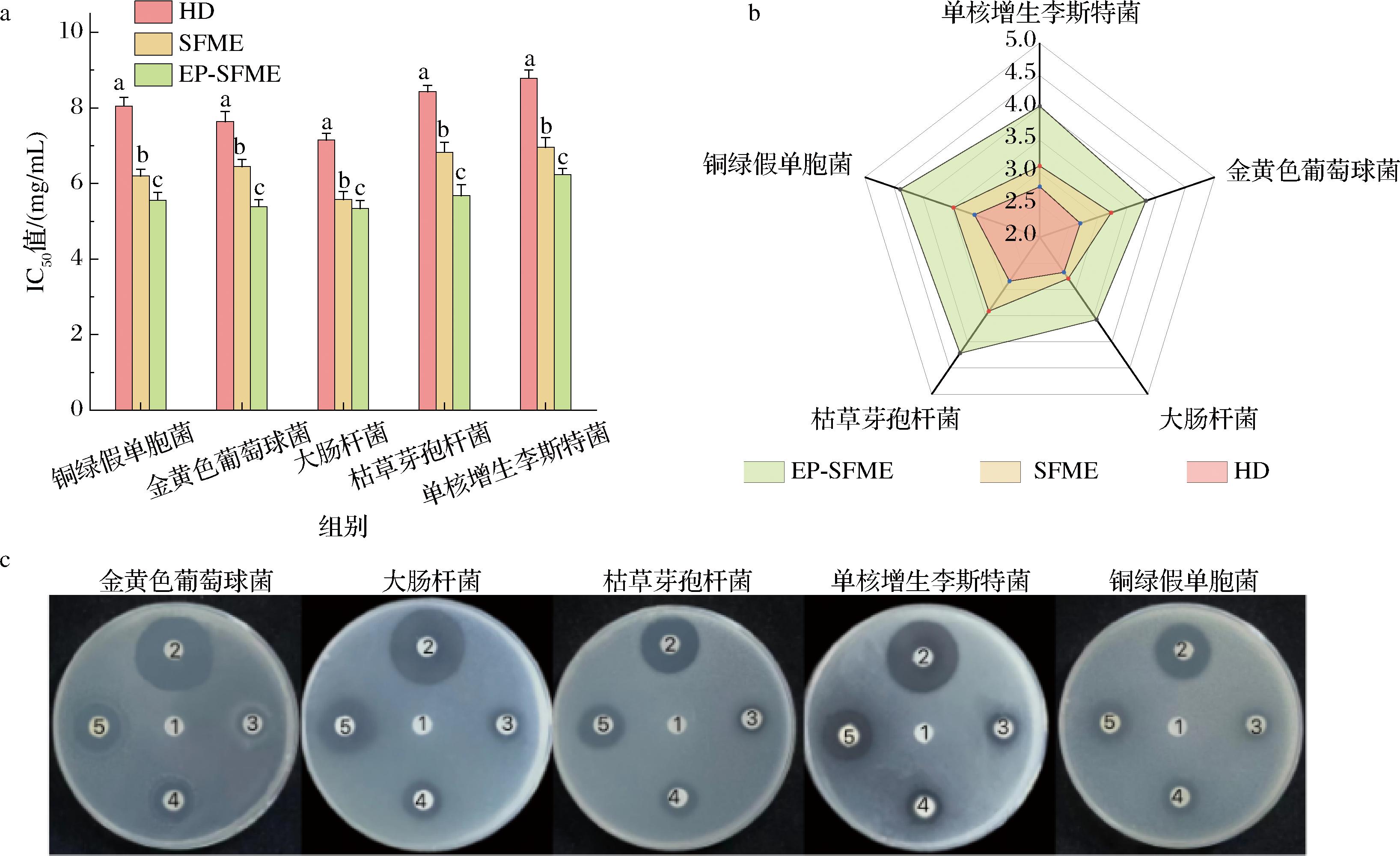
a-HD、SFME和EP-SFME提取的精油对5种细菌的IC50值;b-HD、SFME和EP-SFME提取的精油在1.5 mg/mL质量浓度下抑菌五轴图;c-HD、SFME和EP-SFME提取的精油对5种细菌的抑菌圈[1-吐温80(0.5%);2-盐酸环丙沙星(0.5 mg/mL);3-HD提取的精油;4-SFME提取的精油;5-EP-SFME提取的精油]
图4 HD、SFME和EP-SFME提取的鲜薤白精油对5种细菌的抑制程度数据图
Fig.4 Data diagram of the degree of inhibition of five kinds of bacteria by the fresh Allium macrostemon Bunge volatile oil extracted by HD, SFME, and EP-SFME
表5 EP-SFME、SFME和HD提取的鲜薤白精油的抑菌活性
Table 5 Antimicrobial activity of volatile oils extracted from fresh Allium macrostemon Bunge by EP-SFME, SFME, and HD
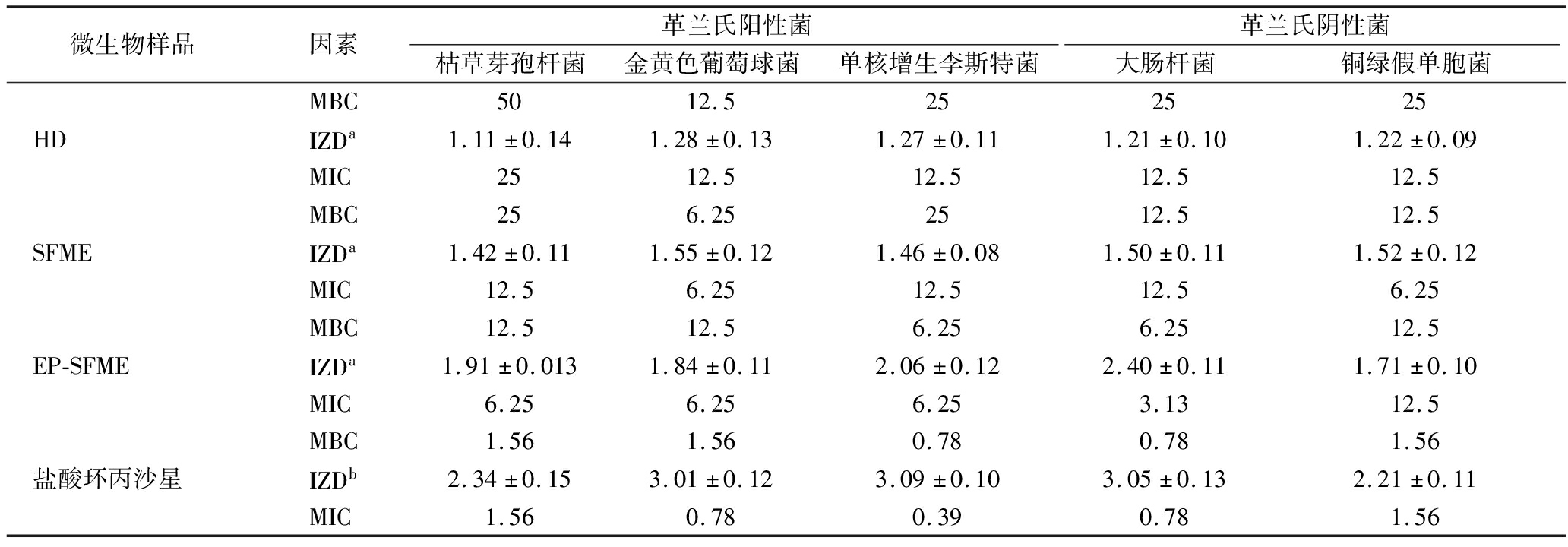
微生物样品因素革兰氏阳性菌革兰氏阴性菌枯草芽孢杆菌金黄色葡萄球菌单核增生李斯特菌大肠杆菌铜绿假单胞菌HDMBC5012.5252525IZDa1.11±0.141.28±0.131.27±0.111.21±0.101.22±0.09MIC2512.512.512.512.5SFMEMBC256.252512.512.5IZDa1.42±0.111.55±0.121.46±0.081.50±0.111.52±0.12MIC12.56.2512.512.56.25EP-SFMEMBC12.512.56.256.2512.5IZDa1.91±0.0131.84±0.112.06±0.122.40±0.111.71±0.10MIC6.256.256.253.1312.5盐酸环丙沙星MBC1.561.560.780.781.56IZDb2.34±0.153.01±0.123.09±0.103.05±0.132.21±0.11MIC1.560.780.390.781.56
注:a:精油的抑菌圈直径(样品质量浓度,1.5 mg/mL);b:阳性对照盐酸环丙沙星抑菌圈直径(样品质量浓度,20 μg/mL)。
2.7 抑菌机理分析
大肠杆菌的细胞壁破裂情况可以用A630nm处的吸光值表示[24],吸光值越小,说明细胞裂损程度越大。如图5-a所示,菌悬液处理120 min时,组间差异显著,PBS空白对照组、1/2 MIC、MIC、2 MIC试验组和TrtionX-100阳性对照组的吸光值分别为0.166±0.005、0.120±0.004、0.119±0.004、0.116±0.006和0.106±0.003。PBS空白对照组在630 nm处的吸光值随处理时间的延长而增加,这说明大肠杆菌细胞的生长不受影响。而不同浓度精油(1/2 MIC、MIC和2 MIC)处理的大肠杆菌组的吸光值随处理时间延长和剂量的增加而显著降低,这说明大肠杆菌细胞壁破损程度与处理时间和精油浓度呈正相关。
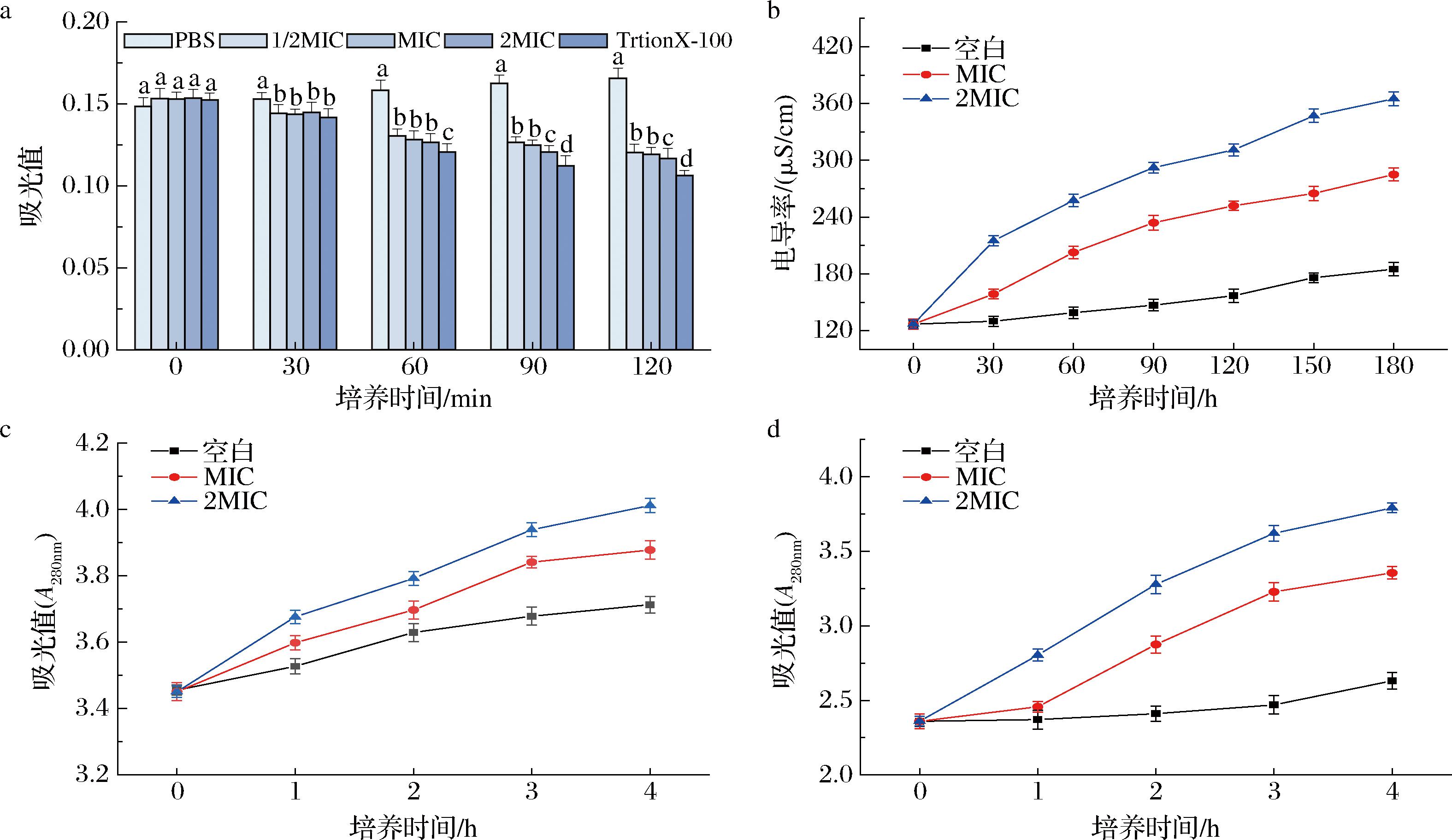
a-细胞壁损伤;b-细胞电导率;c-核酸泄漏;d-蛋白泄漏
图5 鲜薤白精油对大肠杆菌关于细胞壁损伤、细胞膜电导率、核酸泄漏和蛋白泄漏的影响
Fig.5 Effects volatile oil from fresh Allium macrostemon Bunge on cell wall damage, cell membrane conductivity, nucleic acid leakage, and protein leakage in E.coli
电导率值可以用来表示细菌细胞膜的通透性[25],电导率值越大,说明细胞膜破损程度越大。如图5-b所示,对照组大肠杆菌溶液电导率没有明显变化,说明该组大肠杆菌细胞膜未受损。经浓度为MIC和2 MIC的精油处理后,大肠杆菌溶液的电导率迅速增加,由初始的(126±0.5) μS/cm分别增长为(285±1.53) μS/cm和(366±1.15) μS/cm,这表明精油对大肠杆菌细胞膜有显著的破坏作用,大量电解质从细胞中流出导致大肠杆菌溶液电导率增加。
大肠杆菌经过精油处理后,可以用A260nm和A280nm的吸光值来表达大肠杆菌核酸和蛋白的泄漏[24],吸光值越大,核酸和蛋白泄漏程度越严重。经浓度0、MIC、2MIC精油处理的大肠杆菌,吸光度值(核酸和蛋白的泄漏)变化分别如图5-c和图5-d所示。可以看出随时间延长,经浓度0、MIC、2MIC精油处理的大肠杆菌在260 nm处吸光值由初始的3.45±0.02分别增加至3.71±0.003、3.88±0.006、4.01±0.005;在280 nm处的吸光值由初始的2.36±0.01分别增加至2.63±0.06、3.36±0.01、3.79±0.01。这表明,大肠杆菌细胞核酸和蛋白泄漏与处理时间和精油浓度呈正相关,精油对大肠杆菌细胞膜产生严重破坏。
EP-SFME获得的精油通过破坏大肠杆菌细胞的膜完整性使细胞内容物流出,有效抑制了大肠杆菌的生长。在一定浓度范围内,大肠杆菌细胞损伤程度与精油处理时间和剂量呈正相关。
3 结论
本研究采用混合酶(果胶酶和纤维素酶)预处理结合EP-SFME方法提取东北野生鲜薤白精油,得到最佳精油提取条件为:酶添加量5.0%、混合酶比例2∶1、酶解时间3 h、微波功率560 W、微波时间60 min。在此条件下,EP-SFME精油提取率为(0.112±0.005)%,比HD和SFME所获精油提取率分别高出72.31%和21.74%。EP-SFME所获得的东北野生鲜薤白精油富含多种含硫和含氧化合物,这些化合物有效地增加了精油的抑菌生物活性。通过对大肠杆菌抑菌机理进行研究发现,EP-SFME所获得东北野生鲜薤白精油通过对大肠杆菌细胞膜和细胞壁的破坏,实现对大肠杆菌生长的抑制。本文为EP-SFME提取东北野生鲜薤白精油、以及精油开发和利用提供了数据支持。
[1] 国家药典委员会.中华人民共和国药典一部:2020年版[M].北京:中国医药科技出版社, 2020:392.Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China, 2020 edition[M].Beijing:China Medical Science and Technology Press, 2020:392.
[2] 王苗, 张荣榕, 马馨桐, 等.中药薤白药食同源功效探析[J].亚太传统医药, 2020, 16(6):195-201.WANG M, ZHANG R R, MA X T, et al.Analysis of Chinese herbal medicine Allium bulbus[J].Asia-Pacific Traditional Medicine, 2020, 16(6):195-201.
[3] 卢可, 方刚.基于网络药理学探讨薤白治疗肺癌的作用机制[J].湖南中医杂志, 2020, 36(6):142-147;158.LU K, FANG G.Mechanism of action of macrostem onion in treatment of lung cancer:An analysis based on network pharmacology[J].Hunan Journal of Traditional Chinese Medicine, 2020, 36 (6):142-147;158.
[4] 杨依然.薤化学成分与生物活性研究[D].长春:吉林大学, 2021.YANG Y R.Study on chemical constituents and biological activity of Allium chinense G.Don[D].Changchun:Jilin University, 2021.
[5] FIORINI D, SCORTICHINI S, BONACUCINA G, et al.Cannabidiol-enriched hemp essential oil obtained by an optimized microwave-assisted extraction using a central composite design[J].Industrial Crops and Products, 2020, 154:112688.
[6] WEI L, YANG H Y, LI H, et al.Comparison of chemical composition and activities of essential oils from fresh leaves of Pelargonium graveolens L’ Herit.extracted by hydrodistillation and enzymatic pretreatment combined with a solvent-free microwave extraction method[J].Industrial Crops and Products, 2022, 186:115204.
[7] WEI L, PU D W, MI S C, et al.Essential oil extraction and evaluation from the fresh Platycladus orientalis (L.) Franco seed peel waste by an environment-friendly method[J].Sustainable Chemistry and Pharmacy, 2022, 29:100771.
[8] DOS SANTOS REIS N, DE SANTANA N B, DE CARVALHO TAVARES I M, et al.Enzyme extraction by lab-scale hydrodistillation of ginger essential oil (Zingiber officinale Roscoe):Chromatographic and micromorphological analyses[J].Industrial Crops and Products, 2020, 146:112210.
[9] LI Z, WANG H, PAN X D, et al.Enzyme-deep eutectic solvent pre-treatment for extraction of essential oil from Mentha haplocalyx Briq.leaves:Kinetic, chemical composition and inhibitory enzyme activity[J].Industrial Crops and Products, 2022, 177:114429.
[10] PU D W, WEI L G, WEI L, et al.Extraction and in vitro active evaluation of essential oil of Acorus tatarinowii Schott rhizome rich in β-asarone using enzymatic pretreatment and solvent-free microwave-assisted method[J].Journal of Essential Oil Bearing Plants, 2023, 26(6):1563-1575.
[11] WEI L, YU X X, LI H, et al.Optimization of solvent-free microwave extraction of essential oil from the fresh peel of Citrus medica L.var.arcodactylis Swingle by response surface methodology, chemical composition and activity characterization[J].Scientia Horticulturae, 2023, 309:111663.
[12] WANG D X, SHI Z M, LIU C J, et al.E.globulus leaf EO exhibits anti-inflammatory effects by regulating GSDMD-mediated pyroptosis, thereby alleviating neurological impairment and neuroinflammation in experimental stroke mice[J].Journal of Ethnopharmacology, 2024, 319:117367.
[13] BEN ELHADJ ALI I, TAJINI F, BOULILA A, et al.Bioactive compounds from Tunisian Pelargonium graveolens (L’Hér.) essential oils and extracts:α-Amylase and acethylcholinesterase inhibitory and antioxidant, antibacterial and phytotoxic activities[J].Industrial Crops and Products, 2020, 158:112951.
[14] 李玉珍, 肖怀秋, 刘淼, 等.金抗肽SIF4对大肠杆菌基于细胞壁靶点的非细胞质膜损伤抑菌机理[J].食品与生物技术学报, 2023, 42(6):78-83.LI Y Z, XIAO H Q, LIU M, et al.Non-cytoplasmic membrane damage antimicrobial mechanism of metal antimicrobial peptide SIF4 against Escherichia coli based on cell wall target[J].Journal of Food Science and Biotechnology, 2023, 42(6):78-83.
[15] 乔彩红, 张忠.当归叶精油的抑菌活性及对大肠杆菌的抑制机理研究[J].食品与发酵科技, 2022, 58(5):14-18.QIAO C H, ZHANG Z.Antibacterial activity of essential oil from Angelica sinensis leaf and the mechanism against Escherichia coli[J].Food and Fermentation Science and Technology, 2022, 58(5):14-18.
[16] LIU Z Z, LI H L, CUI G Q, et al.Efficient extraction of essential oil from Cinnamomum burmannii leaves using enzymolysis pretreatment and followed by microwave-assisted method[J].LWT, 2021, 147:111497.
[17] HU B, WANG H Y, HE L F, et al.A method for extracting oil from cherry seed by ultrasonic-microwave assisted aqueous enzymatic process and evaluation of its quality[J].Journal of Chromatography A, 2019, 1587:50-60.
[18] WEI C L, WAN C Y, HUANG F H, et al.Extraction of Cinnamomum longepaniculatum deciduous leaves essential oil using solvent-free microwave extraction:Process optimization and quality evaluation[J].Oil Crop Science, 2023, 8(1):7-15.
[19] ZHANG Q, GAO W B, GUO Y, et al.Aqueous enzyme-ultrasonic pretreatment for efficient isolation of essential oil from Artemisia argyi and investigation on its chemical composition and biological activity[J].Industrial Crops and Products, 2020, 158:113031.
[20] HU B, LI Y, SONG J X, et al.Oil extraction from tiger nut (Cyperus esculentus L.) using the combination of microwave-ultrasonic assisted aqueous enzymatic method-design, optimization and quality evaluation[J].Journal of Chromatography A, 2020, 1627:461380.
[21] 孙宇, 王金麟, 贾树龙, 等.北五味子藤茎精油EP-SFME法提取工艺优化及精油主要成分和抗氧化活性测定[J].东北林业大学学报, 2023, 51(7):162-168.SUN Y, WANG J L, JIA S L, et al.Extraction process of essential oil from stem of Schisandrae chinensis fructus by EP-SFME method and its main components and antioxidant activity of essential oil[J].Journal of Northeast Forestry University, 2023, 51(7):162-168.
[22] 岳玉秀.小根蒜挥发油抑菌活性的研究[J].食品研究与开发, 2017, 38(14):17-20.YUE Y X.Study on bacteriostasis activity of the Allium macrostemon Bunge volatile oil[J].Food Research and Development, 2017, 38 (14):17-20.
[23] 彭颖, 黄晴, 李珂.发酵对小根蒜挥发性物质、有机硫化合物及其抗氧化活性的影响[J].食品工业科技, 2020, 41(22):43-49;56.PENG Y, HUANG Q, LI K.Effects of fermentation on volatile compounds, organic sulfur compounds and antioxidant activity of Allium macrostemon Bunge[J].Science and Technology of Food Industry, 2020, 41(22):43-49;56.
[24] CHAUDHARI A K, SINGH V K, DAS S, et al.Improvement of in vitro and in situ antifungal, AFB1 inhibitory and antioxidant activity of Origanum majorana L.essential oil through nanoemulsion and recommending as novel food preservative[J].Food and Chemical Toxicology, 2020, 143:111536.
[25] AL-MIJALLI S H, EL HACHLAFI N, ABDALLAH E M, et al.Exploring the antibacterial mechanisms of chemically characterized essential oils from leaves and buds of Syzygium aromaticum (L.) Merr.et Perry against Staphylococcus aureus and Pseudomonas aeruginosa[J].Industrial Crops and Products, 2023, 205:117561.